维生素K2是一种重要的脂溶性凝血维生素,在支持线粒体功能和促进骨骼发育等生理功能方面具有重要作用[1]。随着近年来对维生素K2的深入研究,发现其在某些疾病的预防和治疗方面具有突出生理功效,例如诱导细胞周期停滞实现对癌细胞增殖的抑制[2],恢复线粒体功能障碍来预防帕金森病[3],降低Ⅱ型糖尿病的患病风险[4]。虽然人体可以合成一定量的维生素K2,但从食物中获取足够的维生素K2对于确保其生理功能仍然很重要。然而,维生素K2水溶解性差,对光、热和氧气敏感,易降解,此外,直接口服的维生素K2生物利用率低,严重限制了其在食品及保健产品领域的应用。基于脂质基质的包埋技术是目前改善脂溶性物质的溶解性和稳定性的重要技术手段,包括乳液、微胶囊、脂质体等方法,其中脂质体在提高活性物质的生物可接受率方面具有显著效果。但是,目前关于直接应用于维生素K2的包埋研究较少,将维生素K2封装在脂质体中有利于改善其溶解特性和消化特性,对维生素K2营养补剂产品的开发和市场扩展具有重大意义。
脂质体是一层或多层磷脂双分子层构成的囊泡,可同时携带水溶性和脂溶性物质,掩盖营养素的不良风味。此外,脂质体还有靶向递送、良好的生物相容性、增加药物稳定性和提高药物吸收率等优异性能,被广泛应用于营养素的包埋,如ω-3脂肪酸、β-胡萝卜素等[5-6]。目前主要研究采用薄膜分散法、冻融法、逆向蒸发法和超声法等[7]制备由单个或多个双层结构组成的脂质体。这些方法制备的脂质体可能存在有机溶剂或洗涤剂残留的风险,并且难以实现工业化应用。此外,上述方法制备的脂质体还存在大小分布不均的问题,而过大的粒径会降低脂质体的稳定性和生物可接受率。与此相比,乙醇注入法通过将磷脂的乙醇溶液快速分散至水溶液中形成脂质体,具有简便高效等优势,适应大规模生产。同时,利用高压微射流、高压均质等新型流体处理技术,可以精准有效控制颗粒的大小和分布,实现更均匀的分散,并且具有安全高效等优势,可广泛应用于脂质体制备[8]。
本研究拟采用乙醇注入法结合高压微射流技术制备维生素K2脂质体,通过粒径、zeta电位、包封率和微观结构等参数,研究大豆磷脂与维生素K2油的质量比对维生素K2脂质体性质的影响。进一步分析维生素K2脂质体的体外消化行为,确保其应用于功能性食品领域的有效性,为开发维生素K2高生物可及性的功能性食品提供理论依据和技术支撑。
1 材料与方法
1.1 实验原料
维生素K2油,金达威集团股份有限公司;大豆磷脂,上海爱康精细化工有限公司;黏膜蛋白、胃蛋白酶等其他化学试剂(均为分析纯),上海阿拉丁生化科技股份有限公司。
1.2 仪器与设备
M-110P微射流,河北廊坊通用机械有限公司;T6紫外可见分光分度计,北京Microfluidics公司;Z-sizer Nano ZSP纳米粒度仪,英国马尔文公司;Agilent 7890B高效液相色谱仪,美国安捷伦公司;HT7800透射电子显微镜,日本日立公司;Metrohm 907自动电位滴定仪,瑞士万通公司;TCS SP8共聚焦激光扫描显微镜,德国徕卡公司。
1.3 实验方法
1.3.1 维生素K2脂质体样品制备
参考CHEN等[9]的方法并稍作修改,称取维生素K2油加入乙醇中,按比例加入大豆磷脂,搅拌至完全溶解,在水浴条件下将混合溶液缓慢注入到超纯水中,并在水浴条件下持续搅拌形成乳化液。乳化液经高压微射流处理,再经减压蒸发除去乙醇,最后用超纯水定容得到维生素K2脂质体。
1.3.2 粒径、zeta电位分析
将脂质体样品同pH的蒸馏水稀释40倍后于室温下稳定25 min,使用纳米粒度仪测定其平均粒径、多分散系数(polydispersity index,PDI)和zeta电位。
1.3.3 微观结构
采用负染色法对脂质体进行染色后,利用透射电镜对不同大豆磷脂和维生素K2油质量比的样品进行形态结构的观察。用尼罗红染剂对消化前的脂质体进行染色,通过共聚焦显微镜对消化过程中的脂质体形态变化进行观察。
1.3.4 包封率
取1 mL样品与4 mL异丙醇混合在离心管中,涡旋5 min并机械振荡15 min后,采用高效液相色谱法测定样品中维生素K2的总含量。
取1 mL脂质体样品与4 mL正己烷混合于离心管中,涡旋3 min后机械振荡15 min,在5 000 r/min条件下离心20 min。取上清液经N2吹干后用异丙醇定容至5 mL,测定样品中游离的维生素K2含量,记为Cfree。脂质体包封率(encapsulation efficiency,EE)的计算如公式(1)所示:
(1)
式中:mtotal,脂质体溶液中维生素K2的总含量,μg;mfree,脂质体溶液中游离的维生素K2含量,μg。
色谱条件为:C18色谱柱(150 mm×4.6 mm,5 μm);流动相:甲醇∶四氢呋喃=90∶10;流速1.0 mL/min;柱温35 ℃;进样量10 μL;检测波长248 nm。
1.3.5 理化稳定性测试
pH稳定性:取6份脂质体样品于离心管中,用盐酸或NaOH调节pH值至1.5、3、5、7、9、11,室温静置2 h后测平均粒径与zeta电位。
离子稳定性:取6份脂质体样品于离心管中,加入等体积NaCl溶液调节离子浓度至0、0.1、0.2、0.3、0.4、0.5 mol/L,室温静置2 h后测平均粒径与zeta电位。
热稳定性:将脂质体样品置于95 ℃加热,模拟食品热杀菌环境,在0、20、30、40、50、60 min时取样测平均粒径与包封率,探究其在食品热加工过程中的稳定性。
1.3.6 体外消化行为分析
参考CHEN等[10]的方法,采用三步模拟消化模型进行模拟体外消化实验,观察脂质体的结构变化并测定游离脂肪酸的释放率和维生素K2的生物可接受率。
口腔消化:7.5 mL维生素K2脂质体与等体积含30 mg/mL黏膜蛋白盐溶液混合,调pH值至6.8后,于37 ℃、100 r/min振荡孵育10 min。胃消化:向口腔消化后混合液加15 mL含特定浓度胃蛋白酶、盐酸、NaCl的模拟胃液,调节pH值至2.5孵育2 h。肠消化:在胃消化后的混合液中加1.5 mL含特定浓度NaCl、CaCl2的模拟肠液,及溶于相应缓冲液的189 mg牛胆盐、60 mg脂肪酶与60 mg胰蛋白酶,调节pH值至7.0孵育2 h。各阶段分别取样测脂质体平均粒径、zeta电位与微观结构。
生物可接受率的测定:将模拟肠消化结束后的溶液迅速转入冰水浴中冷却。取适量消化液于15 000×g条件下离心30 min,收集中间澄清的胶束层,脂质体中维生素K2的生物可接受率的计算如公式(2)所示:
生物可接受率![]()
(2)
式中:mInitial,脂质体样品中维生素K2的含量,μg;mMicelle,胶束层中维生素K2的含量,μg。
游离脂肪酸(free fatty acids,FFA)的测定:进行肠消化时,将消化液置于pH-stat自动电位滴定仪中,模拟肠消化过程。根据消耗的NaOH溶液的体积计算游离脂肪酸的释放率。计算如公式(3)所示:
FFA释放率![]()
(3)
式中:CNaOH,NaOH的摩尔浓度,0.1 mol/L;VNaOH,中和游离脂肪酸消耗NaOH的总体积,L;MLipid,油相相对分子质量,924.10;mLipid,样品中脂质的总质量,0.075 g。
取0.075 g维生素K2油与7.5 mL PBS混合稀释,作为对照组,重复上述实验,观察其微观结构,测定其游离脂肪酸释放率和生物可接受率。
1.3.7 数据统计与分析
所有数据重复测定3次,结果采用“平均值±标准差”来表示,利用Origin进行绘图,通过SPSS软件对试验数据进行方差分析(P<0.05为差异显著)。
2 结果与分析
2.1 维生素K2脂质体的理化性质表征
2.1.1 脂质体的包封率
脂质体包封率是评估其在药物递送系统性能的关键指标,提高包封率可提升包埋药物的生物可接受率[11]。如图1所示,随着磷脂含量的增加,脂质体的包封率由(66.71±1.44)%提高到(98.13±1.01)%。这可能是由于磷脂数量不足时无法形成完整的脂质双分子层结构,导致药物泄露,包封率较低,而随着磷脂含量的增加可以形成更多的可用于包埋维生素K2的脂质双分子层,从而增大包封率。然而,随着磷脂含量进一步增加,维生素K2脂质体的包封率无显著的变化,表明该质量比下脂质体的封装结构已经达到饱和状态。
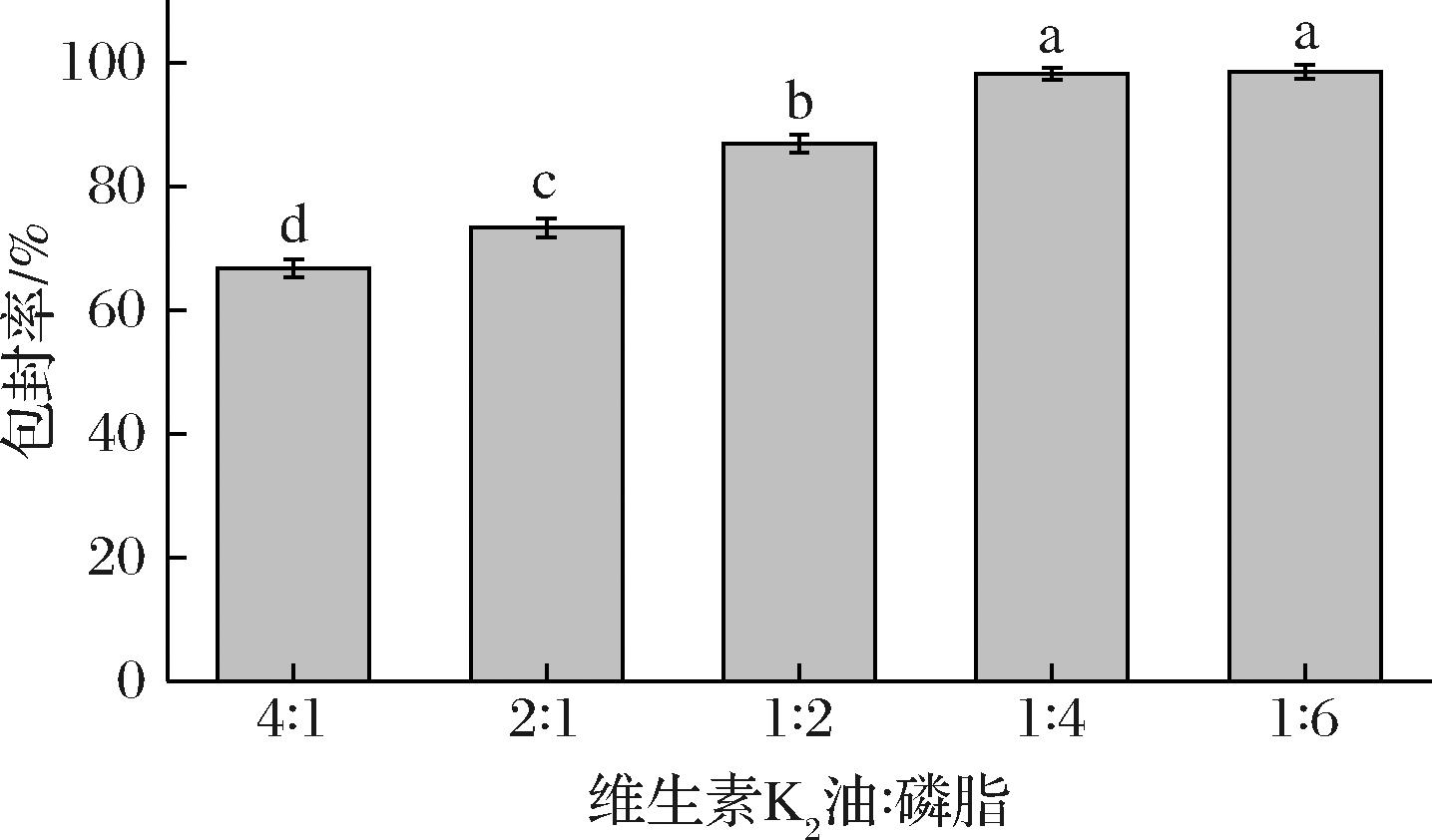
图1 不同磷脂与维生素K2油质量比脂质体的包封率
Fig.1 Encapsulation efficiencies of liposomes with different mass ratios of phospholipids to vitamin K2 oil
注:不同小写字母表示差异显著(P<0.05)。
2.1.2 脂质体的粒径和zeta电位
较小的平均粒径和较低的PDI表明脂质体具有更高的稳定性[12]。Zeta电位绝对值越高,表明颗粒间的静电斥力越大,分散体系更加稳定[13]。如表1所示,随着磷脂的比例提高,脂质体平均粒径减小,zeta电位绝对值增大,PDI无显著差异。提高磷脂含量可减小脂质体的平均粒径和分布宽度,增强稳定性,这可能是因为更多的磷脂分子可以形成更多的磷脂双分子层界面,减小单个颗粒的体积。但当磷脂与维生素质量比达到4∶1后,若继续增加磷脂含量,因结构已饱和,磷脂量变化难以改变其数量和尺寸,脂质体相关参数无显著变化(P>0.05)。
表1 不同磷脂与维生素K2油质量比脂质体的平均粒径、zeta电位
Table 1 Average particle size and zeta potential of liposomes with different mass ratios of phospholipids to vitamin K2 oil
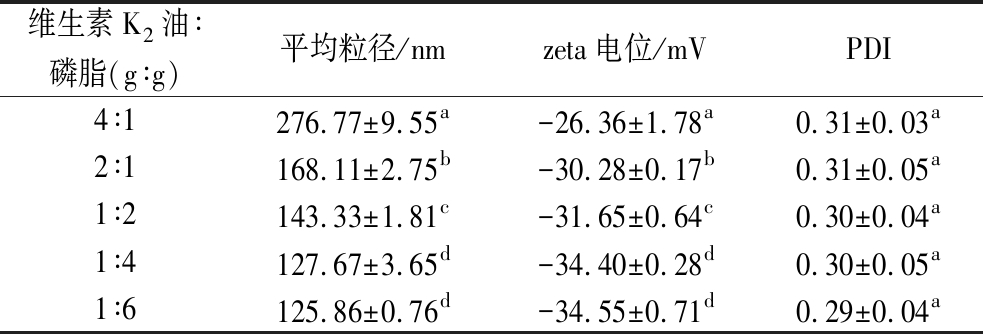
注:同列数据不同小写字母表示差异显著(P<0.05)。
维生素K2油∶磷脂(g∶g)平均粒径/nmzeta电位/mVPDI4∶1276.77±9.55a-26.36±1.78a0.31±0.03a2∶1168.11±2.75b-30.28±0.17b0.31±0.05a1∶2143.33±1.81c-31.65±0.64c0.30±0.04a1∶4127.67±3.65d-34.40±0.28d0.30±0.05a1∶6125.86±0.76d-34.55±0.71d0.29±0.04a
2.1.3 脂质体的微观结构
使用透射电子显微镜观察各样品的微观结构,如图2所示,各维生素K2脂质体样品均呈近圆形的囊泡结构,表面光滑且结构完整。随着磷脂比例提高,脂质体的尺寸逐渐减小,这与脂质体平均粒径的测定结果一致,维生素K2与磷脂质量比为4∶1的脂质体具有最大的囊泡结构和较厚的磷脂双分子层,其结构不稳定,维生素K2油易发生渗透泄露[14]。综合评估表明,维生素K2与磷脂比例为1∶4时,制备的脂质体包封率高、粒径和zeta电位稳定,既能保证性能又能避免磷脂浪费。故本研究采用此质量比,进一步探究维生素K2脂质体产品的稳定性和体外消化特性。

a-4∶1;b-2∶1;c-1∶2;d-1∶4;e-1∶6
图2 脂质体的透射电子显微镜图像
Fig.2 Transmission electron microscope image of liposomes
2.2 稳定性分析
脂质体结构可能受到环境影响而发生改变,导致稳定性降低[15],从而限制脂质体产品的应用,因此本文研究了不同维生素K2脂质体的pH、离子及加热稳定性,结果如图3所示。由图3-a可知维生素K2脂质体在pH值1.5~11的范围内粒径保持稳定,表明脂质体在强酸或强碱条件下具有良好的稳定性,这可能是因为脂质体表面的负电荷产生了较强的静电中和作用,在强酸强碱环境中具有较强的静电排斥作用,抑制了颗粒的聚集。
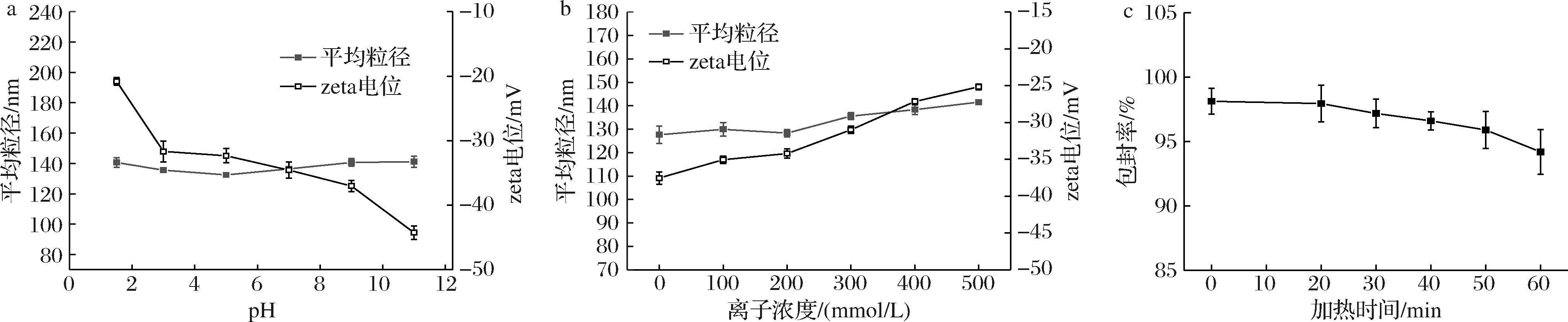
a-pH;b-离子浓度;c-加热时间
图3 维生素K2脂质体的粒径和zeta电位变化趋势图
Fig.3 Trend chart of particle size and zeta potential changes of vitamin K2 liposomes
维生素K2脂质体的平均粒径和zeta电位随NaCl浓度的变化趋势如图3-b所示。随着NaCl浓度的升高,脂质体的平均粒径和zeta电位的绝对值分别增大和减小。这是由于NaCl增加了溶液中的离子强度,导致脂质体表面电荷的屏蔽效应增强,静电斥力减弱,从而促进脂质体的聚集[16]。脂质体在500 mmol/L NaCl溶液中,平均粒径增幅小于10%,zeta电位<-25 mV,表明其在高盐离子浓液中仍具有良好的稳定性。
磷脂晶体在高温下会重新定向,从而引起包埋物的泄露[17]。如图3-c所示,在95 ℃条件下加热60 min,脂质体的包封率仍保持高于94%,表明脂质体具有良好的热稳定性。综上所述,所制备的维生素K2脂质体在pH 1.5~11、500 mmol/L NaCl溶液以及95 ℃加热20 min条件下均具有良好的稳定性。
2.3 体外消化行为分析
2.3.1 粒径和zeta电位变化行为分析
模拟体外消化结果表明(图4),维生素K2脂质体在口腔消化阶段的平均粒径无显著性变化(P>0.05)。在胃消化阶段,脂质体的平均粒径随消化时间的延长略有增大,其zeta电位绝对值呈现先下降后上升的趋势。这是因为当脂质体进入胃消化阶段时,pH值的剧烈变化会改变颗粒之间相互作用的强度和范围,从而使脂质体发生聚集[18]。在进入小肠消化阶段时,脂质体的平均粒径迅速增大至450 nm以上,其zeta电位绝对值也增大至超过30 mV。这是由于小肠消化液中的胆盐可以与磷脂分子相互作用,促进脂质体的聚集,从而导致粒径增大。同时,胆盐也可能吸附在脂质体表面,增加脂质体表面的负电荷密度,从而增加zeta电位的绝对值[19]。脂质体在胃消化阶段平均粒径仍保持200 nm以下,zeta电位小于-10 mV,证明脂质体在模拟胃液中具有一定的稳定性。
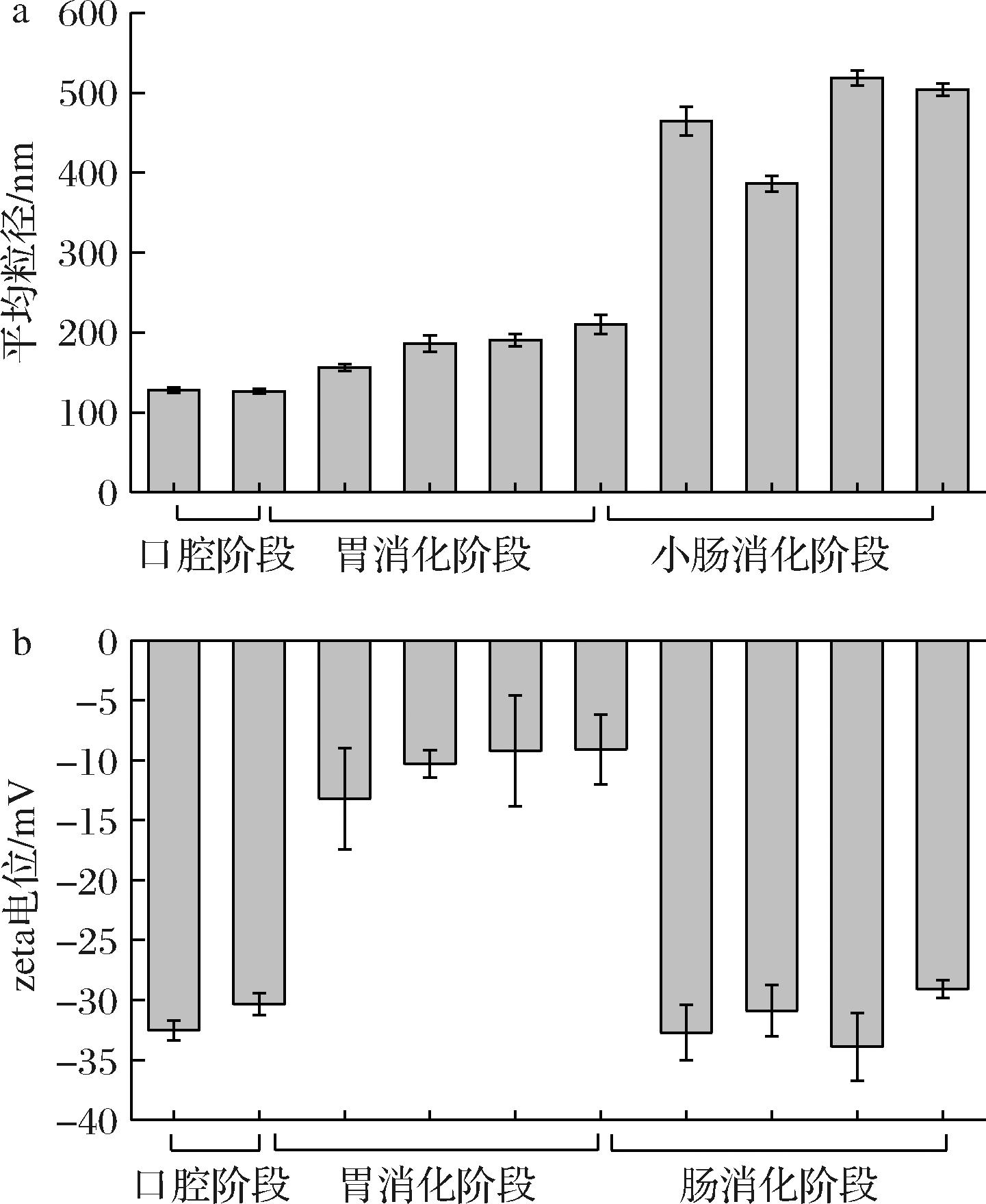
a-粒径图;b-zeta电位图
图4 维生素K2脂质体在体外模拟消化过程中的粒径图和zeta电位图
Fig.4 Particle size diagram and zeta potential diagram of vitamin K2 liposomes during in vitro simulated digestion
2.3.2 微观结构变化分析
如图5所示,维生素K2脂质体在整个消化过程中结构稳定、分散性良好,未发生明显的聚集与油脂泄露,表明其在消化过程中具有良好的结构稳定性,这可能是因为磷脂双分子层能有效阻隔胃酸的侵蚀,脂质体初始较高的负zeta电位在酸性条件下保留了一定的静电斥力,从而避免颗粒聚集。未包封的维生素K2油在消化过程中持续漂散在消化液表面,共聚焦激光显微镜图谱中也观察到油滴分布在消化液中,这表明脂溶性的维生素K2在消化过程中难以在消化液中均匀分布,会对其生物可接受率产生不利影响,进一步说明了脂质体作为维生素K2药物递送系统在消化过程中的优越性能。

a-表观图;b-微观结构图
图5 维生素K2油和维生素K2脂质体在消化过程中表观图及微观结构图
Fig.5 Apparent diagram and microstructural diagram of vitamin K2 oil and vitamin K2 liposomes during digestion
2.3.3 游离脂肪酸释放率和生物可接受率的考察
脂质体因为其粒径小的特性和磷脂双分子层的特殊结构,可以与胆盐和消化酶形成的胶束相结合,这种胶束化作用提高了受封装药物在消化道中的溶解度,从而增加其生物可接受率[20-21]。如图6所示,维生素K2脂质体的游离脂肪酸释放率达到了67.35%,生物可接受率为84.1%;而未包封的维生素K2的游离脂肪酸释放率仅有20.81%,生物可接受率为40.65%。这是因为维生素K2的水溶性差,在消化液中不易分散,降低了其与脂肪酶的接触面积,导致消化速率和生物可接受率低[22]。而脂质体在消化过程中可以更充分地与消化酶接触,脂质体的磷脂双分子层可以充当物理屏障,保护维生素K2不受胃酸的影响,从而提高其在消化过程中的稳定性[23]。综上,脂质体包封可以显著改善维生素K2的生物可接受率。
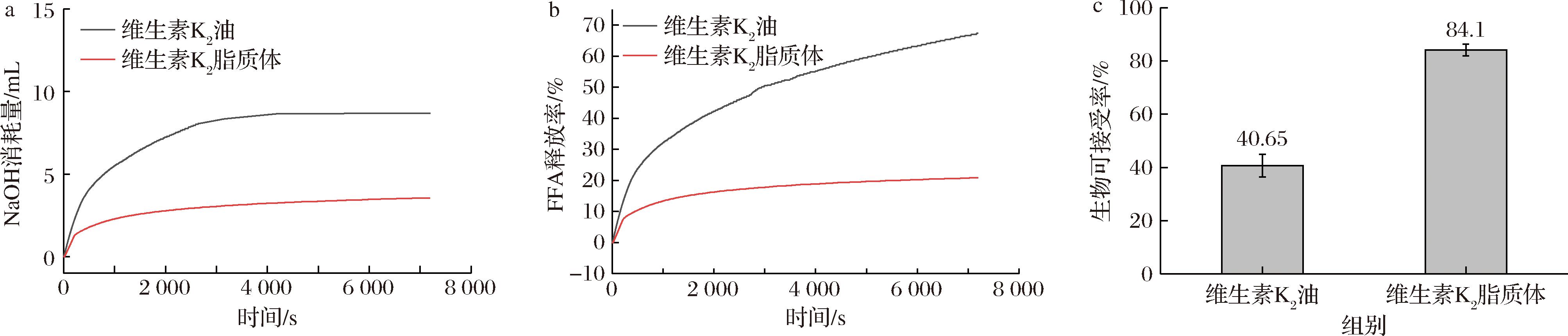
a-NaOH消耗量;b-FFA释放曲线;c-生物可接受率
图6 消化过程中的NaOH消耗量、FFA释放曲线和生物可接受率
Fig.6 NaOH consumption, FFA release curve, and bioacceptability during digestion
3 结论
本研究通过脂质体包埋有效改善了维生素K2的稳定性和生物可接受率,探究了磷脂比例对脂质体稳定性的调控规律,并考察了其环境稳定性和消化稳定性。研究表明,增加磷脂与维生素K2油的质量比可有效减小脂质体的平均粒径和PDI值,且显著提高包封率。当磷脂与维生素K2的比值为4∶1时,该体系在强酸强碱、高盐离子溶液及高温等严苛环境中均具有良好的稳定性。体外消化研究表明,脂质体包封显著改善了维生素K2的生物利用度,其游离脂肪酸释放率与生物可接受率分别提升至未包封组的3.2倍和2.1倍。证明了脂质体包封是实现维生素K2稳定负载的有效途径,为维生素K2高值利用产品的开发提供了技术支撑。
[1] YAN Q X, ZHANG T, O’CONNOR C, et al.The biological responses of vitamin K2:A comprehensive review[J].Food Science &Nutrition, 2023, 11(4):1634-1656.
[2] NARVAEZ C J, BAK M J, SALMAN N, et al.Vitamin K2 enhances the tumor suppressive effects of 1, 25(OH)2D3 in triple negative breast cancer cells[J].The Journal of Steroid Biochemistry and Molecular Biology, 2023, 231:106307.
[3] TANG H F, ZHENG Z M, WANG H, et al.Vitamin K2 modulates mitochondrial dysfunction induced by 6-hydroxydopamine in SH-SY5Y cells via mitochondrial quality-control loop[J].Nutrients, 2022, 14(7):1504.
[4] ZHANG Y T, LIU L, WEI C B, et al.Vitamin K2 supplementation improves impaired glycemic homeostasis and insulin sensitivity for type 2 diabetes through gut microbiome and fecal metabolites[J].BMC Medicine, 2023, 21(1):174.
[5] LIU G Y, HOU S L, TONG P H, et al.Liposomes:Preparation, characteristics, and application strategies in analytical chemistry[J].Critical Reviews in Analytical Chemistry, 2022, 52(2):392-412.
[6] NSAIRAT H, KHATER D, SAYED U, et al.Liposomes:Structure, composition, types, and clinical applications[J].Heliyon, 2022, 8(5):e09394.
[7] CHAI C, PARK J.Food liposomes:Structures, components, preparations, and applications[J].Food Chemistry, 2024, 432:137228.
[8] SHAH S, DHAWAN V, HOLM R, et al.Liposomes:Advancements and innovation in the manufacturing process[J].Advanced Drug Delivery Reviews, 2020, 154:102-122.
[9] CHEN H W, FANG W P.A novel method for the microencapsulation of curcumin by high-pressure processing for enhancing the stability and preservation[J].International Journal of Pharmaceutics, 2022, 613:121403.
[10] CHEN X, MCCLEMENTS D J, WANG J, et al.Coencapsulation of (-)-epigallocatechin-3-gallate and quercetin in particle-stabilized W/O/W emulsion gels:Controlled release and bioaccessibility[J].Journal of Agricultural and Food Chemistry, 2018, 66(14):3691-3699.
[11] HU Y, ZHANG L, WEN Q H, et al.Prebiotic saccharides polymerization improves the encapsulation efficiency, stability, bioaccessibility and gut microbiota modulation of urolithin a liposomes[J].International Journal of Biological Macromolecules, 2024, 273:133045.
[12] MOHAMMADI M, HAMISHEHKAR H, MCCLEMENTS D J, et al.Encapsulation of Spirulina protein hydrolysates in liposomes:Impact on antioxidant activity and gastrointestinal behavior[J].Food Chemistry, 2023, 400:133973.
[13] TAN X Y, LIU Y, WU X X, et al.Layer-by-layer self-assembled liposomes prepared using sodium alginate and chitosan:Insights into vesicle characteristics and physicochemical stability[J].Food Hydrocolloids, 2024, 149:109606.
[14] TAI K D, RAPPOLT M, MAO L K, et al.Stability and release performance of curcumin-loaded liposomes with varying content of hydrogenated phospholipids[J].Food Chemistry, 2020, 326:126973.
[15] PATEL A S, LAKSHMIBALASUBRAMANIAM S, NAYAK B, et al.Improved stability of phycobiliprotein within liposome stabilized by polyethylene glycol adsorbed cellulose nanocrystals[J].International Journal of Biological Macromolecules, 2020, 163:209-218.
[16] SUN Y, TANG W T, PU C F, et al.Improved stability of liposome-stabilized emulsions as a co-encapsulation delivery system for vitamin B2, vitamin E and β-carotene[J].Food &Function, 2022, 13(5):2966-2984.
[17] TAN C, FENG B, ZHANG X M, et al.Biopolymer-coated liposomes by electrostatic adsorption of chitosan (chitosomes) as novel delivery systems for carotenoids[J].Food Hydrocolloids, 2016, 52:774-784.
[18] VERGARA D, L PEZ O, BUSTAMANTE M, et al.An in vitro digestion study of encapsulated lactoferrin in rapeseed phospholipid-based liposomes[J].Food Chemistry, 2020, 321:126717.
PEZ O, BUSTAMANTE M, et al.An in vitro digestion study of encapsulated lactoferrin in rapeseed phospholipid-based liposomes[J].Food Chemistry, 2020, 321:126717.
[19] WANG Y, ZHOU Q, ZHENG J X, et al.Fabricating pectin and chitosan double layer coated liposomes to improve physicochemical stability of beta-carotene and alter its gastrointestinal fate[J].International Journal of Biological Macromolecules, 2023, 247:125780.
[20] ZHENG H J, WIJAYA W, ZHANG H W, et al.Improving the bioaccessibility and bioavailability of carnosic acid using a lecithin-based nanoemulsion:Complementary in vitro and in vivo studies[J].Food &Function, 2020, 11(9):8141-8149.
[21] CHEN Y P, LU Y, CHEN J M, et al.Enhanced bioavailability of the poorly water-soluble drug fenofibrate by using liposomes containing a bile salt[J].International Journal of Pharmaceutics, 2009, 376(1-2):153-160.
[22] BELTR N J D, SANDOVAL-CUELLAR C E, BAUER K, et al.In-vitro digestion of high-oleic palm oil nanoliposomes prepared with unpurified soy lecithin:Physical stability and nano-liposome digestibility[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2019, 578:123603.
N J D, SANDOVAL-CUELLAR C E, BAUER K, et al.In-vitro digestion of high-oleic palm oil nanoliposomes prepared with unpurified soy lecithin:Physical stability and nano-liposome digestibility[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2019, 578:123603.
[23] LIU W L, YE A Q, LIU C M, et al.Structure and integrity of liposomes prepared from milk-or soybean-derived phospholipids during in vitro digestion[J].Food Research International, 2012, 48(2):499-506.