动物脂肪作为营养物质之一,可赋予食品良好的风味,因其具有较强的可塑性,对食品的质地和口感存在重要影响,然而其饱和脂肪酸含量较高,过多摄入易引发肥胖、冠心病及动脉粥样硬化等慢性疾病[1-4]。采用植物油凝胶化组装技术构建类固体油凝胶,是开发动物脂肪替代品的有效方式。目前,国内外已有报道表明油凝胶几乎均采用GB 2760—2024《食品安全国家标准 食品添加剂使用标准》中禁止或限量使用的有机凝胶因子(生物蜡、单甘油酯、卵磷脂等)凝胶化油相,不符合当前大环境对全天然、绿色健康脂肪替代品的追求。另外,通过有机凝胶因子凝胶化油相构建的油凝胶质地较脆弱,热稳定性较差,脂质氧化较为严重[5-7]。因此,探索新型的植物油凝胶化方法,对绿色、健康脂肪替代品的开发意义重大。
气凝胶是一种低密度、高比表面积、高孔隙率的新型固体材料,具有优越的吸油能力,可有效替代有机凝胶因子的结晶网络,可用作全天然油凝胶的构建模板[8-9]。气凝胶的制备过程主要包括:亲水性聚合物在水中的分散;充分水化的聚合物体系的高速分散充气;充气水泡沫的快速预冻和冷冻;冷冻水泡沫的干燥脱水[10-11]。在气凝胶的构建基材中,植物多糖由于相对绿色安全,具有良好的胶凝能力和独特的结构强化作用,是目前关注较多的凝胶材料[12]。多糖基气凝胶的物理性质(如孔隙度、平均孔径和孔体积等)是影响其吸附性能的重要因素,主要受多糖类型、浓度、黏度以及水泡沫干燥方式等的影响。通常,具有表面活性的双亲多糖可吸附至气-水界面稳定水泡沫体系,而不具有表面活性的多糖常用来增加水溶液的黏度,防止泡沫体系的分层和聚集[13-14]。研究发现,羟丙基甲基纤维素是一种性能较好的双亲多糖,以其为基材构建的气凝胶体系具有较好的吸油能力,当以此气凝胶为替代材料,吸油后形成的油凝胶可以用于替代传统起酥油制备松饼,且不会对松饼的品质产生负面影响[15]。在另一项研究中,通过羟丙基甲基纤维素协同黄原胶构建的泡沫模板气凝胶同样呈现出较好的吸油能力,其吸油量可达气凝胶质量的60倍[16]。
甲基纤维素(methylcellulose,MC)是一种水溶性纤维素衍生物,通过醚化在纤维素中引入甲氧基而制成,具有良好的生物相容性、生物可降解性和增稠性能,在食品工业中具有广阔的应用前景[17-18]。另外,MC分子结构中同时含有亲水基和疏水基,这种双亲特性为其在气-水和油-水界面的有效吸附提供了可能。然而,目前尚未发现MC在气凝胶构建中的应用研究,尤其是作为气凝胶基材的潜力仍未得到充分探讨。基于此,本研究以MC为基材,通过高速分散充气联合冷冻干燥技术(即泡沫模板法)制备了气凝胶,重点探究了MC黏度和浓度对多糖水溶液和水泡沫性质的影响,并采用扫描电镜、红外光谱、X-射线衍射和热重分析等表征技术,系统分析了MC气凝胶的结构与性能特征,以期为扩大多糖基泡沫模板气凝胶在全天然类脂肪油凝胶开发中的应用提供理论参考。
1 材料与方法
1.1 材料与试剂
MC(黏度分别为450、40 000、100 000 mPa·s),麦克林生物科技有限公司;KBr,上海源叶生物科技有限公司;其余试剂均为分析纯。
1.2 仪器与设备
DV2T LV旋转黏度计,上海备得数码科技有限公司;TAXT plus C质构仪,上海瑞玢智能科技有限公司;Great 20傅里叶红外光谱仪,中科瑞捷(天津)科技有限公司;STA 449 F5 Jupiter同步热分析仪,耐驰科学仪器商贸有限公司;T18高速分散器,艾卡(广州)仪器设备有限公司;ZEISS扫描电子显微镜,蔡司集团;X射线衍射仪,布鲁克衍射荧光事业部;FD-551冷冻干燥机,青岛澳海源国际贸易有限公司。
1.3 实验方法
1.3.1 MC气凝胶的制备
准确称取一定量的MC粉末,与适量蒸馏水混合后置于70 ℃热水中加热搅拌5 min使其完全溶解,然后将其转移至4 ℃冰箱中水化过夜以制备不同黏度(450、40 000和100 000 mPa·s)和质量浓度(4、8、12、16和20 g/L)的MC水溶液。随后借助高速分散器以10 000 r/min转速对MC水溶液均质充气5 min得到水泡沫,将水泡沫倒入6孔板模具后放入-20 ℃低温冰箱中预冻12 h,然后再转入-80 ℃冰箱内冷冻12 h,借助真空冷冻干燥机进行干燥脱水72 h制得不同浓度和黏度的MC气凝胶。
1.3.2 MC水溶液的黏度测定
利用旋转黏度计测定不同浓度MC水溶液的黏度。选取LV-03转子,将其插入300 mL多糖水溶液中,待仪器运行稳定后,于室温下进行黏度测试。
1.3.3 气泡膨胀率的测定
借助量筒分别测定不同黏度和浓度MC水溶液和对应充气后的水泡沫的体积,按照公式(1)计算膨胀率[16]。
膨胀率![]()
(1)
式中:V0,不同黏度和浓度MC水溶液的体积;V1,不同黏度和浓度MC水泡沫的体积。
1.3.4 气泡稳定性、微观形态及尺寸大小分析
将不同黏度和浓度MC水泡沫置于20 mL透明玻璃瓶中,通过观察水泡沫在储存0、0.3、0.6、1.0、2.0、4.0、8.0、12.0、24.0、48.0和72.0 h后的气泡消失程度来评价不同泡沫体系的稳定性。采用光学显微镜在50×和150×的放大倍数下观察不同黏度和浓度MC水泡沫的微观形态,借助Image J软件在显微图片中计数测量得到气泡的尺寸。
1.3.5 气凝胶的物理性质分析
1.3.5.1 网络密度
对冻干的圆柱形MC气凝胶称重,质量记为m,然后通过数显游标卡尺测量其高度及直径,并计算其体积V,气凝胶的网络密度(g/cm3)即为其质量与体积的比值。
1.3.5.2 孔隙度、总孔隙体系和平均孔径
参考蒋秦波[19]的方法,按照公式(2)计算气凝胶的孔隙度,按照公式(3)计算总孔隙体积,按照公式(4)计算平均孔径。
(2)
总孔隙体积![]()
(3)
平均孔径![]()
(4)
式中:ε,气凝胶的孔隙度,%;VC,气凝胶的体积,cm3;mC,气凝胶的质量,g;ρ,MC的真密度,g/cm3; SBET,气凝胶的比表面积,m2/g。
1.3.5.3 硬度
采用配备P/35探头的质构仪分析MC气凝胶的硬度,设置测前速率和测试速率分别为5、2 mm/s,触发力5 g,应变50%。
1.3.6 气凝胶的微观结构观察
将气凝胶样品通过液氮脆断后,固定在载物台上,然后进行喷金处理,借助扫描电子显微镜观察气凝胶的内部微观结构,设置放大倍数为50×和150×。
1.3.7 气凝胶的红外光谱分析
将MC气凝胶与KBr粉末以1∶100的质量比混合后充分研磨。通过压片机压成厚度均匀的薄片,置于傅里叶红外光谱仪中,于4 000~400 cm-1的波数范围内采集气凝胶的红外光谱图。
1.3.8 气凝胶的X射线衍射分析
通过配备有Cu靶的X射线衍射仪对MC气凝胶的晶体特性进行分析,设置扫描角度5°~90°,扫描速度5°/min。
1.3.9 气凝胶的热稳定性分析
准确称量5 mg MC气凝胶于陶瓷坩埚中,利用同步热分析仪测定其在加热过程中的质量损失,以评价其热稳定性。设置N2流速20 mL/min,升温速率10 ℃/min,升温范围30~600 ℃。
1.3.10 数据处理
所有实验数据均表示为“平均值±标准差”,采用SPSS 25.0软件对数据结果进行方差分析,P<0.05被认为差异显著。
2 结果与分析
2.1 不同MC水溶液的黏度和膨胀率
多糖水溶液的黏度反映了多糖分子与水分子之间相互作用所产生的流动阻力,其大小可用于表征溶液中多糖的浓度、分子间作用力的强度,并可进一步用于研究多糖的分子结构、理化性质及其与其他物质的相互作用。表1呈现了不同浓度MC水溶液的黏度及其对应的膨胀率。随着MC黏度从450 mPa·s增加至100 000 mPa·s,相应水溶液黏度呈现先增加后减小的趋势,并在MC黏度为40 000 mPa·s时达到最大值。此外,对于同一黏度的MC,其多糖水溶液的黏度值随着MC浓度的增加而持续增大,这可能是由于MC的增稠效应引起的。另外,当MC黏度为450 mPa·s时,水溶液的膨胀率随其浓度增加而上升,这可能是因为该体系初始黏度较低,高速分散过程中不易形成气泡或形成的泡沫稳定性较差,易发生破裂,适当增大甲基纤维素浓度能够增加水溶液的黏度,进而提高体系的膨胀率。然而,对于黏度为40 000 mPa·s和100 000 mPa·s的MC水溶液,膨胀率均随着MC浓度的增加而降低,这是因为高黏度MC致使其水溶液即使在浓度较低时黏稠度仍较高,在充气过程中容易引起更多的能量损失,导致体系维持气-水界面的能力减弱,进而造成膨胀率即充气效率的降低[19]。
表1 不同MC水溶液的黏度和膨胀率
Table 1 Viscosity and expansion rate of MC aqueous solutions
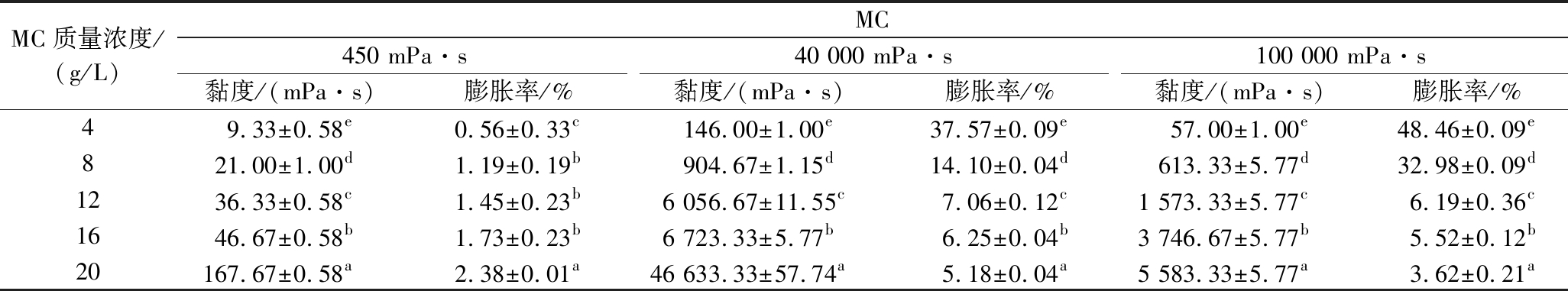
注:同列不同字母表示差异显著(P<0.05)(下同)。
MC质量浓度/(g/L)MC450 mPa·s40 000 mPa·s100 000 mPa·s黏度/(mPa·s)膨胀率/%黏度/(mPa·s)膨胀率/%黏度/(mPa·s)膨胀率/%49.33±0.58e0.56±0.33c146.00±1.00e37.57±0.09e57.00±1.00e48.46±0.09e821.00±1.00d1.19±0.19b904.67±1.15d14.10±0.04d613.33±5.77d32.98±0.09d1236.33±0.58c1.45±0.23b6 056.67±11.55c7.06±0.12c1 573.33±5.77c6.19±0.36c1646.67±0.58b1.73±0.23b6 723.33±5.77b6.25±0.04b3 746.67±5.77b5.52±0.12b20167.67±0.58a2.38±0.01a46 633.33±57.74a5.18±0.04a5 583.33±5.77a3.62±0.21a
2.2 不同MC水泡沫的稳定性
在泡沫模板气凝胶的制备过程中,水泡沫的稳定性对于气凝胶的物理性质具有重要影响。通常良好的泡沫稳定性使气泡在冻结过程中能够保持结构的完整性,不易发生破裂,进而有利于维持冻干后气凝胶的多孔网络结构。水泡沫的稳定性与多糖水溶液的种类、黏度和浓度密切相关。此外,气泡的尺寸大小及分布也会影响水泡沫的稳定性,一般尺寸较大的泡沫更容易发生破裂,进而降低体系的稳定性[20]。图1呈现了不同黏度和浓度MC水泡沫经室温储存不同时间后的外观变化。不同浓度450 mPa·s甲基纤维素水溶液的黏度较低,体系充气较为困难,所形成的水泡沫稳定性较差,气泡在存放期间迅速发生破裂,20 min后即可完全消失。相比之下,40 000 mPa·s和100 000 mPa·s MC水泡沫的稳定性得到明显改善,且随着MC浓度的增加,水泡沫体系的稳定性越来越好。其中,20 g/L浓度40 000 mPa·s MC水泡沫在室温存放4 h仍未出现明显的分层现象,直至8 h后才出现轻微的分层。然而,20 g/L浓度100 000 mPa·s MC水泡沫在存放1 h后即出现明显的分层,这可能是因为高黏度MC导致的过度增稠效果使其在充气过程中损失了更多能量。此外,由表1可知,100 000 mPa·s MC在水中的溶解度较差,导致水溶液体系黏度有所降低,这可能也是导致其水泡沫稳定性不如40 000 mPa·s MC水泡沫的原因之一。

a-450 mPa·s;b-40 000 mPa·s;c-100 000 mPa·s
图1 不同黏度和质量浓度MC水溶液形成的水泡沫随时间的变化图
Fig.1 Variation of water foam formed by MC aqueous solutions with different viscosity and concentration over time
2.3 MC水泡沫的微观形态及尺寸分布
多糖气凝胶的网络结构很大程度上受水泡沫尺寸及分布的影响。在气凝胶形成过程中,气体与液体接触后在介质中迅速扩散,最终会在凝胶内部形成复杂的孔隙结构[5]。气泡的尺寸及分布直接影响着气凝胶的孔隙结构。气泡数量越多,尺寸越小,气凝胶的机械强度就越高,负载和吸附能力也更优越[9]。图2呈现了不同浓度40 000 mPa·s MC气凝胶的气泡显微形态和尺寸大小分布。由图可知,40 000 mPa·s MC水泡沫的直径主要集中在20~200 μm之间。随着MC浓度从4 g/L增加至16 g/L,水泡沫体系的平均气泡尺寸逐渐减小,并在MC浓度为16 g/L时达到最小值(仅为81.05 μm)。此外,与其他组相比,16 g/L MC水泡沫体系的气泡尺寸分布更加均匀。然而,当MC浓度增加至20 g/L时,形成的高黏度水溶液大大阻碍了充气过程,无法将气体均匀分散到体系中,导致剪切力不足以有效地将大气泡破碎成小气泡,从而使体系的平均气泡尺寸略有增加,达到86.12 μm。
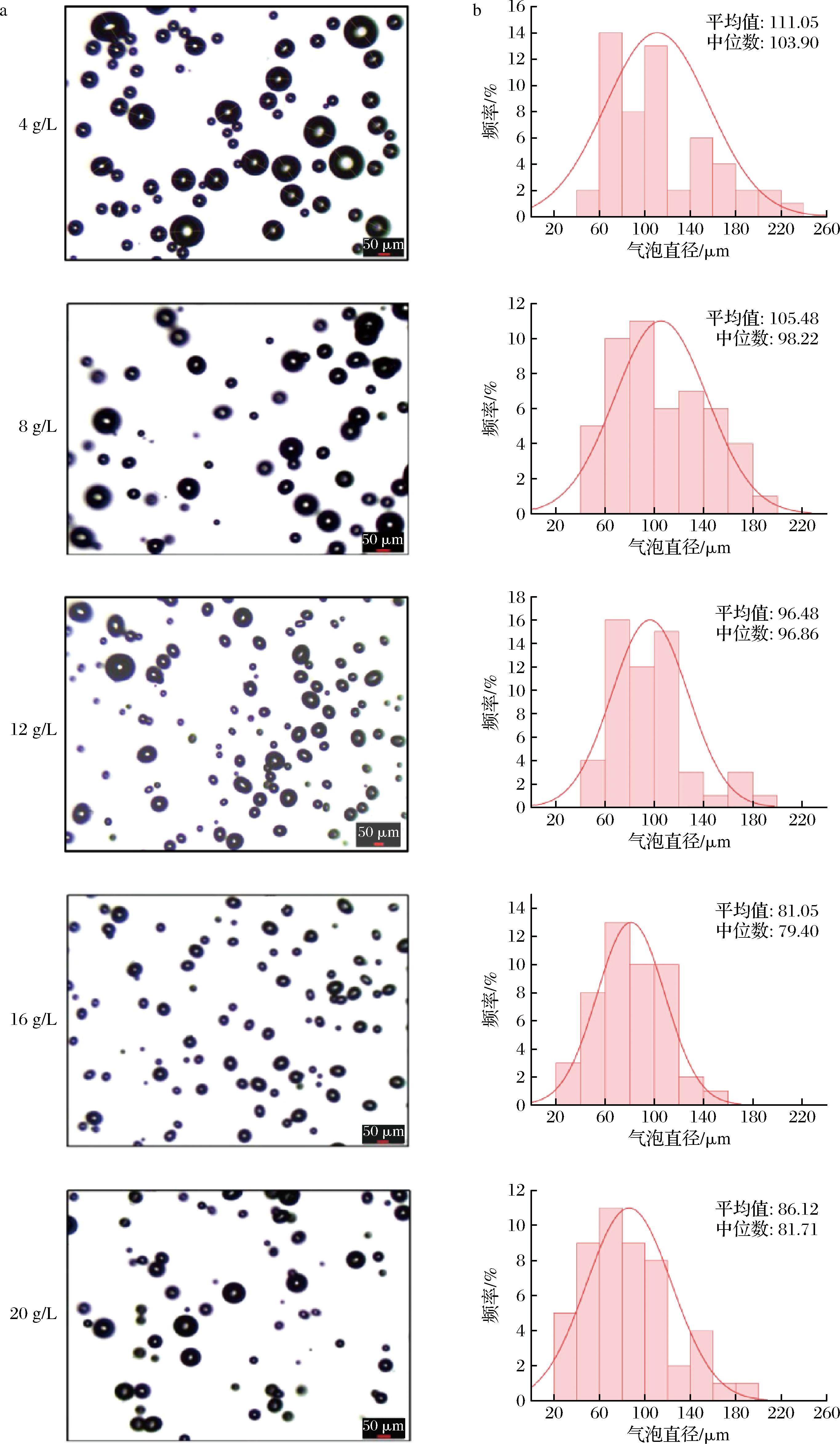
a-显微结构图;b-气泡尺寸分布
图2 不同质量浓度MC(40 000 mPa·s)水溶液形成的气泡显微结构图以及气泡尺寸大小分布
Fig.2 Microstructures and size distributions of bubbles generated by varying concentrations of MC (40 000 mPa·s) aqueous solutions
2.4 气凝胶的物理性质分析
气凝胶的网络密度对其性能具有重要影响,并与生物聚合物的干物质含量呈正相关。孔隙度、孔体积和平均孔径是气凝胶的孔结构参数,反映了气凝胶中的网孔结构信息。气凝胶的网络密度越低,通常表明其具有较高的孔隙度(一般超过90%),这种高孔隙度使气凝胶具有优异的吸附性能和轻质特点[5]。由表2可知,随着MC浓度的增加,气凝胶的网络密度和硬度逐渐增加,表明多糖水溶液浓度越高,所形成的气凝胶的网络结构也越强。SUN等[5]所构建的豌豆蛋白原纤维-卡拉胶泡沫模板气凝胶中也发现了类似的变化规律。然而,气凝胶的孔隙度随着甲基纤维素浓度的增加逐渐从98.69%降低至92.52%,说明气凝胶内部的开孔程度占整体体积的比例有所下降。此外,随着MC浓度的升高(4~16 g/L),气凝胶的孔体积和平均孔径均逐渐降低,但当浓度达到20 g/L时,气凝胶的孔体积和平均孔径有所增加。这是因为多糖水溶液浓度较低时,所形成的水泡沫直径较大,进而导致冻干后的气凝胶孔体积和平均孔径较大且结构较为疏松。随着MC浓度的增加,多糖水溶液中分子间相互作用逐渐增强,进而导致冻干后的气凝胶孔体积和平均孔径逐渐减小,体系结构变得更加密实。然而,当MC浓度升高至20 g/L时,由于多糖水溶液黏度较高,阻碍了水泡沫的形成并影响了气泡的尺寸大小及分布,进而使得冻干后的气凝胶孔体积和平均孔径有所增加。
表2 不同质量浓度MC(40 000 mPa·s)气凝胶的物理性质
Table 2 Physical properties of MC (40 000 mPa·s) aerogels with varying concentrations

MC质量浓度/(g/L)网络密度/(g/cm3)孔隙度/%硬度/g孔体积/(cm3/g)平均孔径/nm40.017 1±0.001 7c98.69±0.14a20.64±1.22e10.21±0.18a16.45±0.06a80.030 0±0.001 8c97.69±0.14a53.66±0.01d8.93±0.09b14.30±0.10c120.051 4±0.006 3b96.05±0.49b170.54±3.19c7.61±0.11c13.45±0.55c160.070 2±0.016 3b94.60±1.26b235.66±0.87b5.94±0.13d12.31±0.16d200.097 3±0.016 5a92.52±1.27c395.92±0.55a7.05±0.08cd15.31±0.64b
2.5 气凝胶的微观结构观察
图3展示了不同浓度MC(40 000 mPa·s)气凝胶的扫描电镜图像。由图可以看出,4 g/L MC气凝胶是由不同纤维丝相互缠绕交联在一起的,内部孔隙较少,8 g/L甲基纤维素气凝胶呈片层交联结构,内部出现少量孔隙。这是因为MC的分子结构呈长链状,当浓度较低时,能够在溶剂中充分伸展和分散,呈现单个分子链的丝状特征。随着浓度的升高,MC分子链上的羟基等官能团会通过氢键等相互作用彼此连接,促使分子链在空间上的排列方式发生改变,逐渐从分散的丝状结构转变为片层状聚集体,最终交联形成网孔结构[18]。当MC浓度达到16 g/L时,气凝胶内部孔隙数量增多,分布相对均匀且致密,呈现较为理想的三维网络结构,进而有利于其对液态油的吸附。
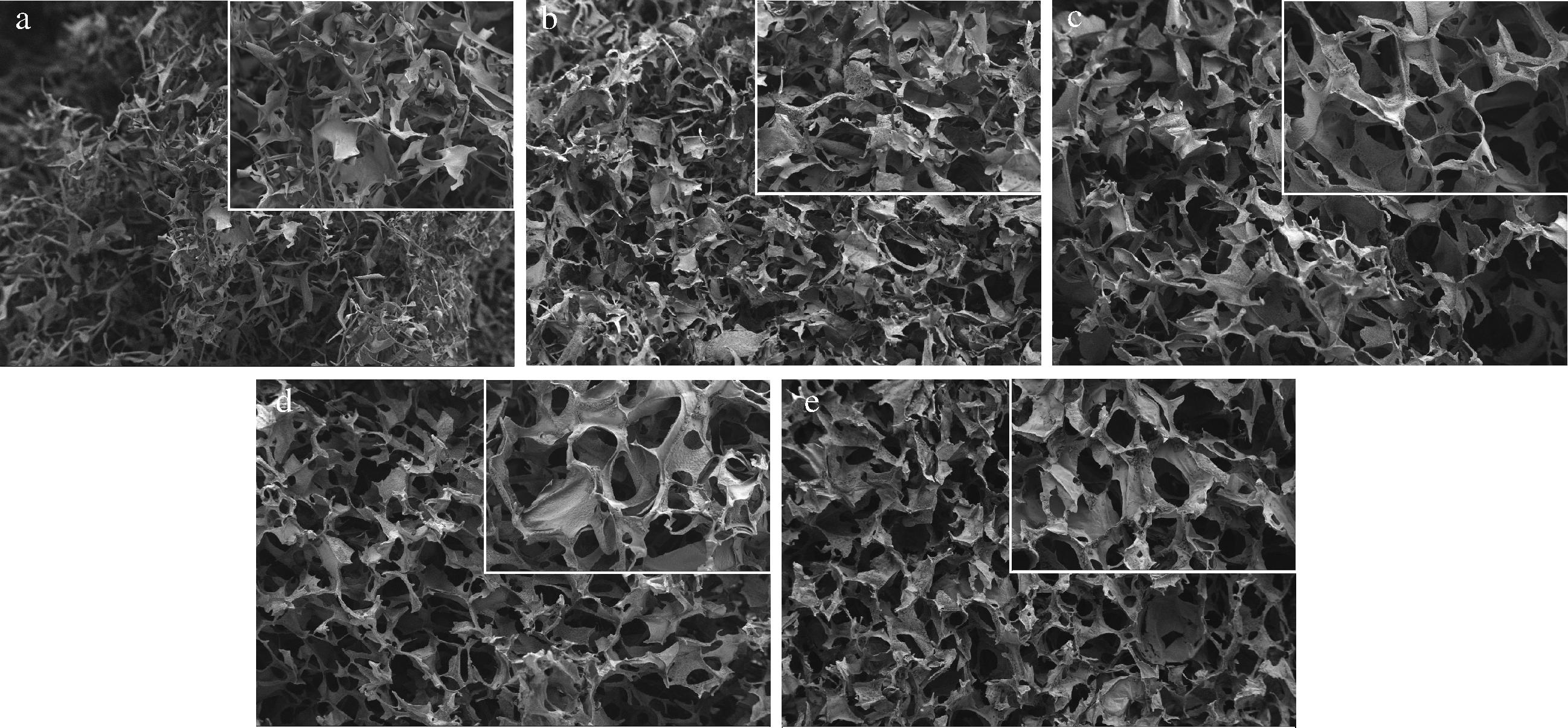
a-4 g/L;b-8 g/L;c-12 g/L;d-16 g/L;e-20 g/L
图3 不同质量浓度MC(40 000 mPa·s)气凝胶的扫描电镜图像(50×)
Fig.3 Scanning electron microscope images of aerogels containing varying concentrations of MC (40 000 mPa·s)(50×)
注:图中右上角均为放大图(150×)。
2.6 气凝胶的红外光谱分析
红外光谱是研究多糖分子间相互作用(氢键、范德华力、共价作用等)最主要的手段[19]。不同浓度MC气凝胶的红外光谱图如图4所示。从图中可以看出,除了MC的特征吸收峰外,所有样品均未出现新的吸收峰,表明不同浓度MC气凝胶中没有新官能团的形成,只是在峰强度上稍有差异[18]。此外,在不同浓度MC气凝胶中,3 446 cm-1处的吸收峰是由O—H伸缩振动引起的,表明MC中存在着大量的羟基官能团[5]。在2 831 cm-1处的吸收峰是由C—H拉伸振动引起的,此峰的峰强度可以反映MC中甲基基团的含量。此外,1 597 cm-1和1 356 cm-1处的吸收带主要归因于MC中芳香环的C![]() C伸缩振动和甲氧基(—OCH3)的伸缩振动,可用于分析MC中是否存在芳香环结构以及甲氧基的含量,而770 cm-1处的吸收峰对应于苯环的邻位二取代结构。另外,与高浓度MC气凝胶相比,4 g/L气凝胶在3 446 cm-1处的吸收峰强度相对较高,表明其含有更多的羟基官能团[18,21]。
C伸缩振动和甲氧基(—OCH3)的伸缩振动,可用于分析MC中是否存在芳香环结构以及甲氧基的含量,而770 cm-1处的吸收峰对应于苯环的邻位二取代结构。另外,与高浓度MC气凝胶相比,4 g/L气凝胶在3 446 cm-1处的吸收峰强度相对较高,表明其含有更多的羟基官能团[18,21]。
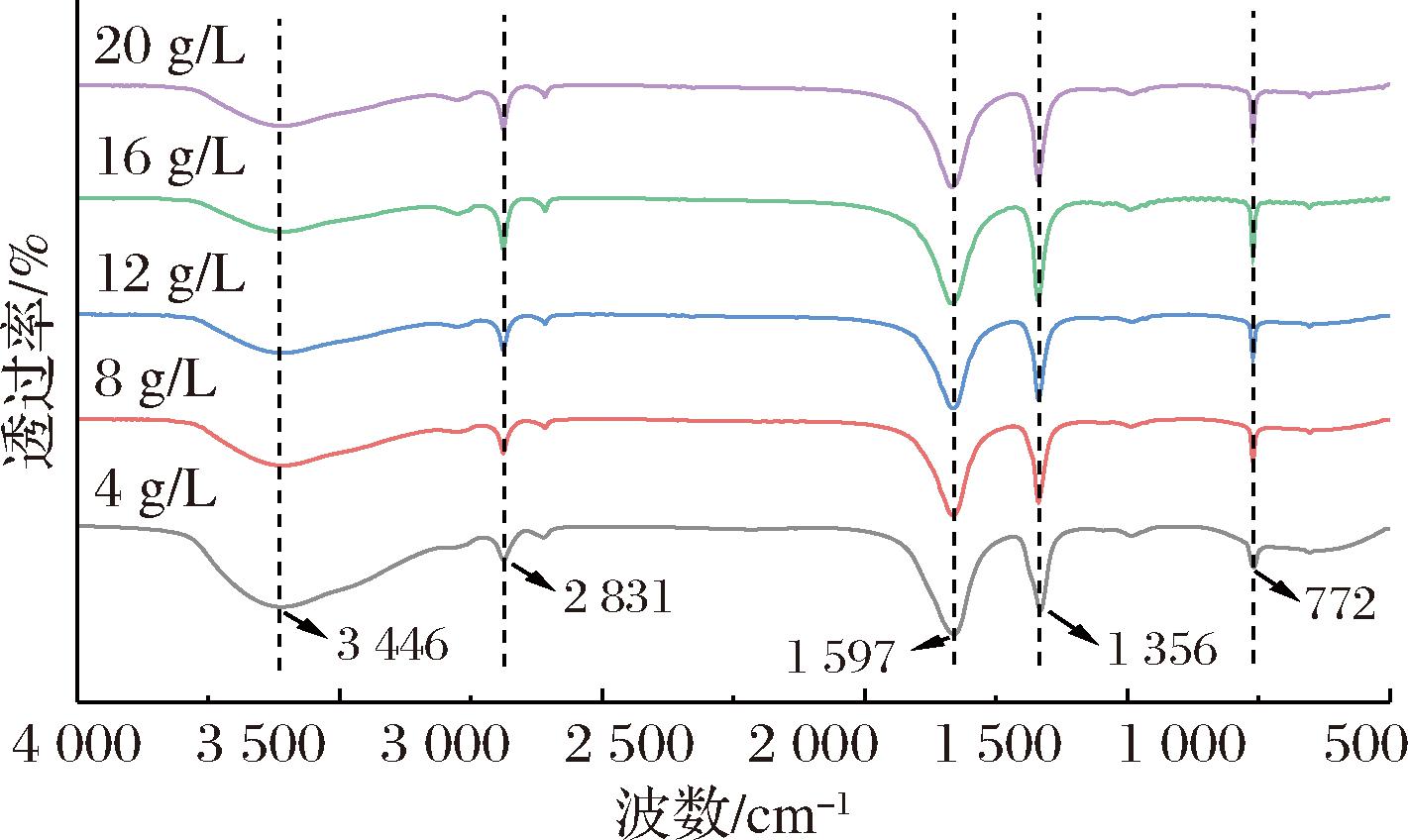
图4 不同质量浓度MC(40 000 mPa·s)气凝胶的红外光谱图
Fig.4 Infrared spectra of aerogels containing varying concentrations of MC (40 000 mPa·s)
2.7 气凝胶的X射线衍射图谱
X射线衍射分析是利用X射线在晶体物质中的衍射效应进行物质结构分析的技术,通过衍射角的位置可以进行化合物的定性分析,而谱线的强度随角度的变化关系可以进行晶粒的大小和形状的检测[22]。通常,在X射线衍射图谱中,晶体材料的特征峰较为尖锐且细长,而非晶体材料则呈现宽峰。不同浓度MC气凝胶的X射线衍射图谱见图5。不同浓度MC气凝胶的衍射峰位置没有发生明显改变,均在2θ为31.77°和45.54°处呈现出尖锐的特征性衍射峰,这可能与纤维素的结晶性质有关,说明不同浓度MC在形成气凝胶的过程中,纤维素的晶型并未受到明显影响。
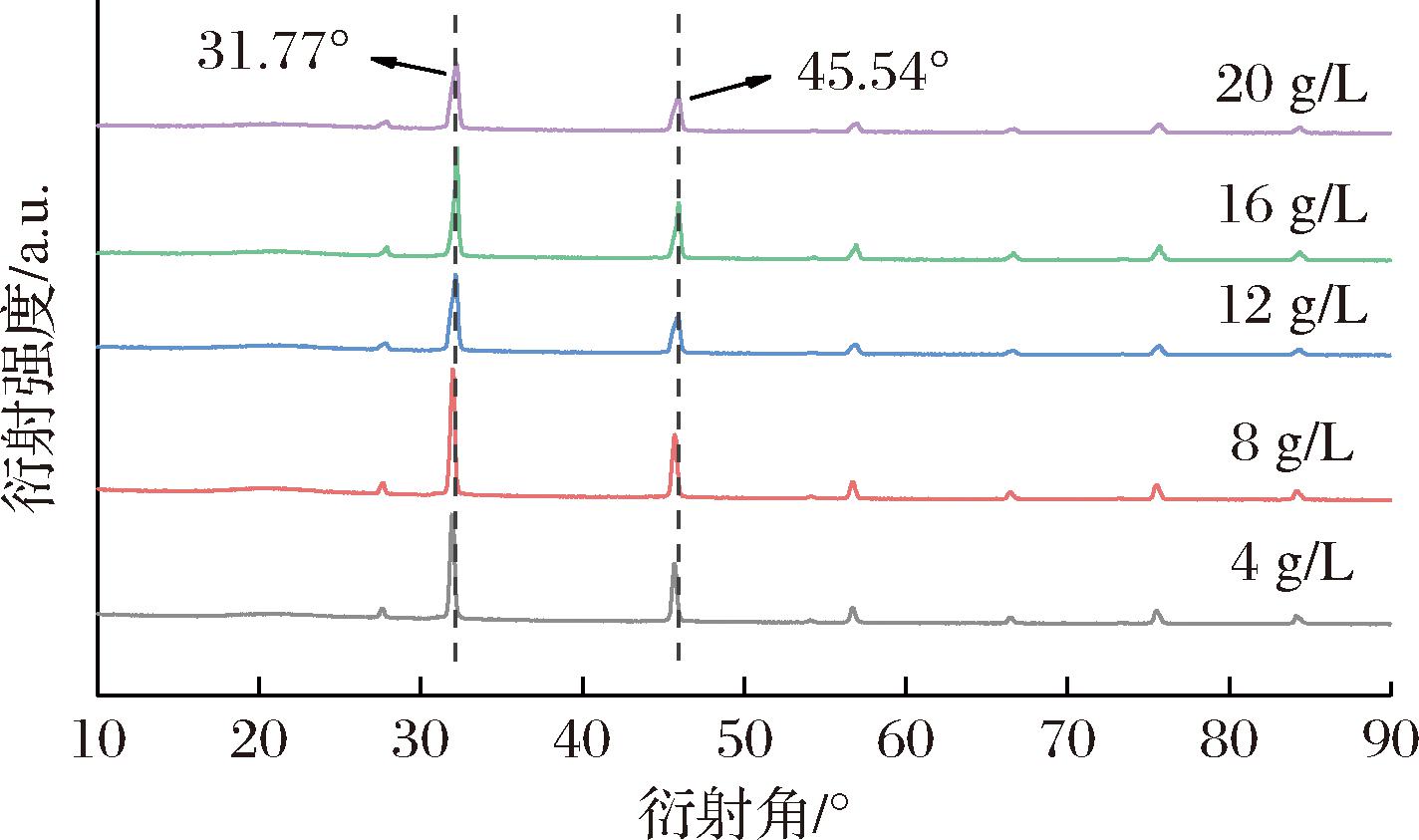
图5 不同质量浓度MC(40 000 mPa·s)气凝胶的X射线衍射图谱
Fig.5 X-ray diffraction spectra of aerogels containing varying concentrations of MC (40 000 mPa·s)
2.8 气凝胶的热稳定性分析
采用热重分析仪测定了不同浓度MC气凝胶在热降解过程中的稳定性,对应的热失重曲线和微熵热重曲线分别如图6和图7所示。
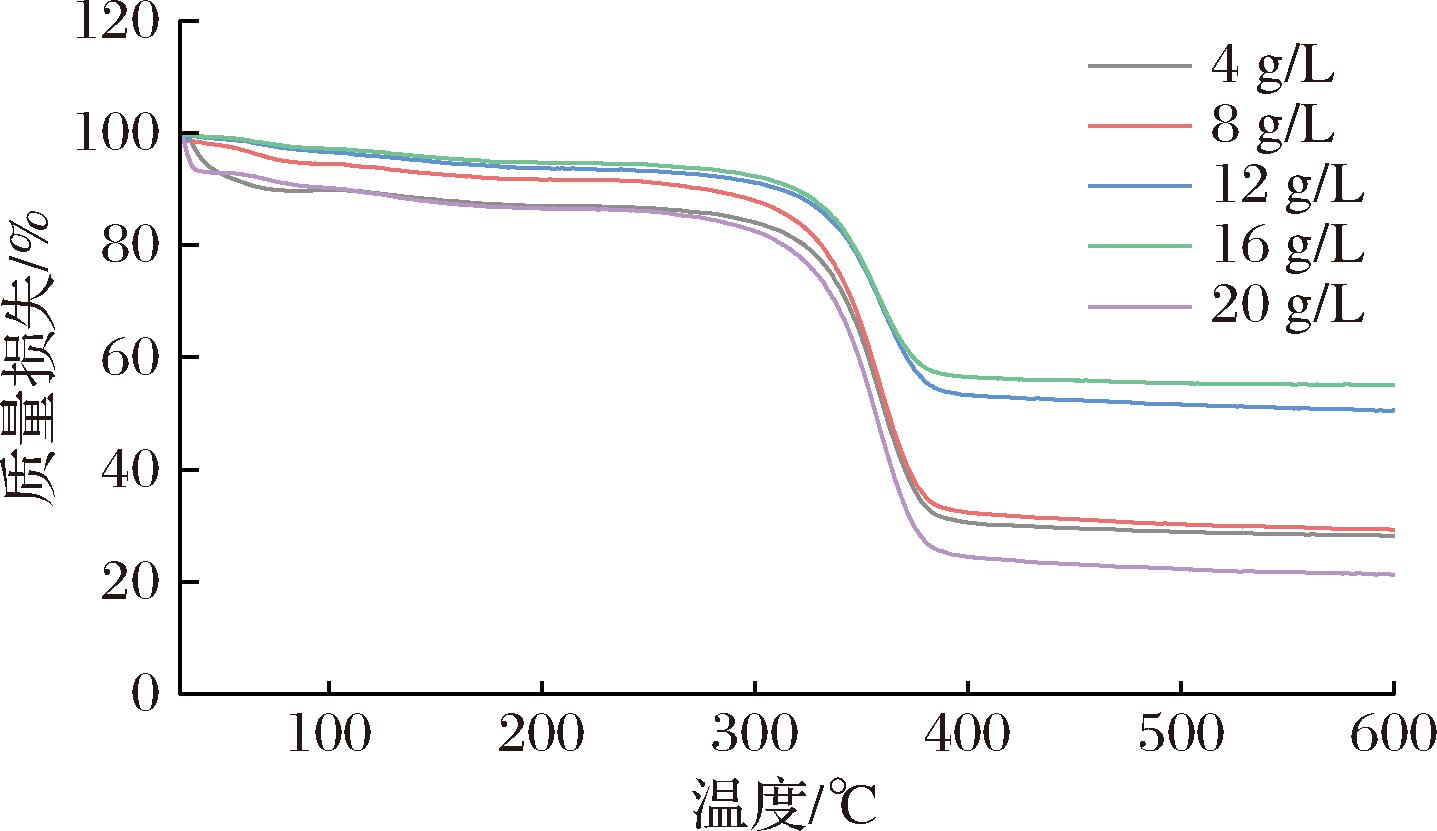
图6 不同质量浓度MC(40 000 mPa·s)气凝胶的热失重曲线
Fig.6 Thermogravimetric curves of aerogels containing varying concentrations of MC (40 000 mPa·s)
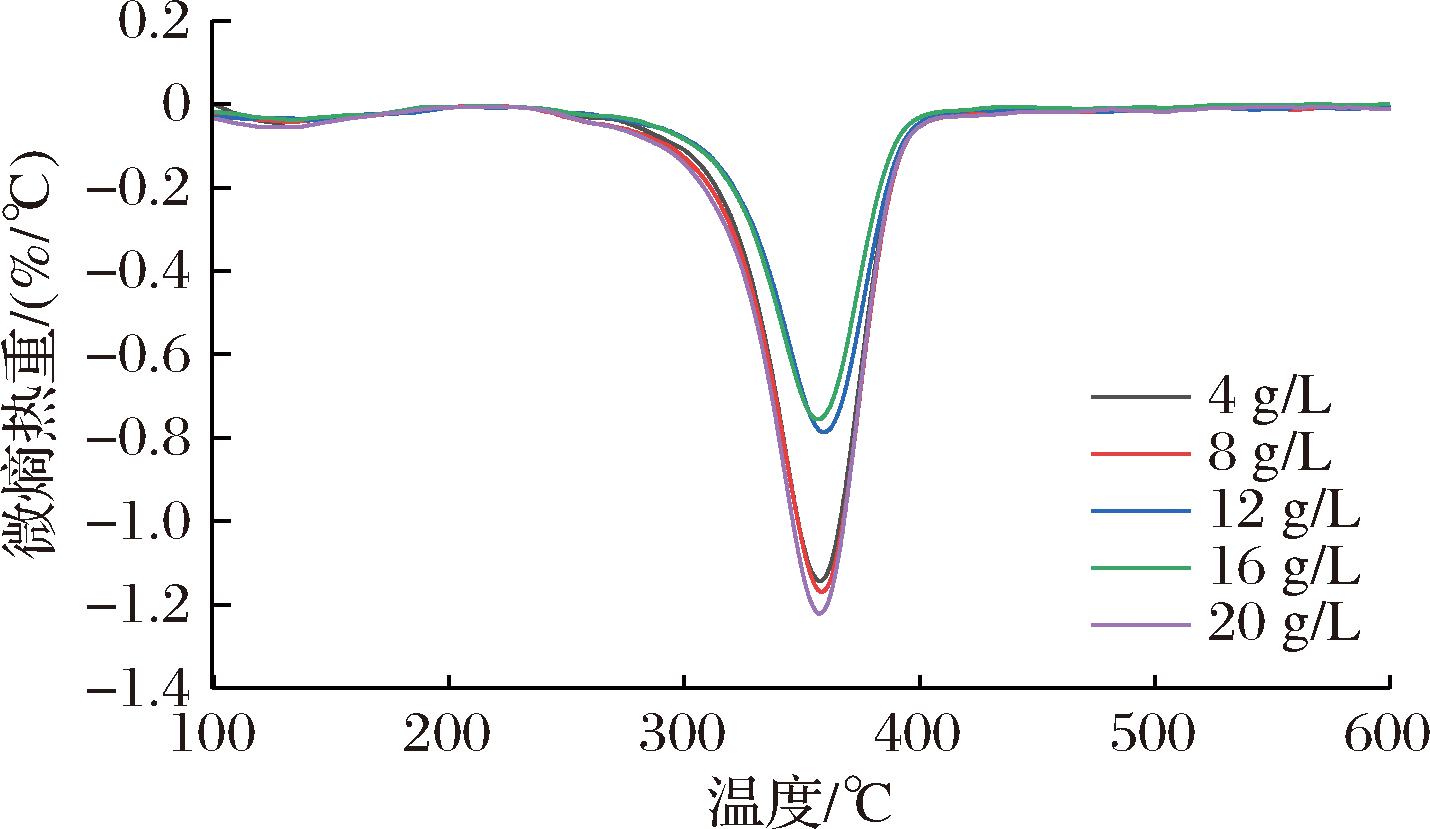
图7 不同质量浓度MC(40 000 mPa·s)气凝胶的微商热重曲线
Fig.7 Derivative thermogravimetric curves of aerogels containing varying concentrations of MC (40 000 mPa·s)
由图6可知,不同浓度MC气凝胶在30 ℃~600 ℃的加热范围内均经历了3个明显的质量损失阶段。第一阶段质量损失发生在30~150 ℃,气凝胶的质量损失为5.41%~9.49%,主要是由于气凝胶表面吸附的水分蒸发或其他挥发性物质的脱除而引起的[18]。第二阶段发生在190~400 ℃左右,此阶段气凝胶热降解迅速,质量损失达到40.06%~62.53%,主要是由于气凝胶中多糖糖苷键的裂解而引起的[22]。值得注意的是,与4、8 g/L和20 g/L的MC气凝胶相比,12 g/L和16 g/L(尤其是16 g/L)的MC气凝胶的热降解速率较低,表明12 g/L和16 g/L的MC气凝胶具有相对较好的气孔网络结构,能够更好地抵抗高温引起的糖链热降解效应。另外,这一阶段在微熵热重曲线(图7)中呈现一个较为明显的峰值,其对应的温度为各个浓度甲基纤维素气凝胶的热降解温度,并且4、8、20 g/L的MC气凝胶的峰值强度明显大于12、16 g/L的MC气凝胶,这进一步说明12、16 g/L的MC气凝胶具有相对较好的热稳定性。热失重曲线的第三阶段发生在400~600 ℃,这部分的质量损失主要由残渣碳化分解所致[18]。总之结合图6和图7可以看出,相比于其他质量浓度的甲基纤维素气凝胶,质量浓度为16 g/L的甲基纤维素气凝胶在加热过程中的质量损失较少且质量变化速率较慢,呈现出相对较好的热稳定性。
3 结论
本研究采用泡沫模板法构建了MC气凝胶,探究了MC黏度和浓度对多糖水溶液、水泡沫和气凝胶物理性质的影响。结果发现,不同黏度MC水溶液的黏度均随着其浓度的增加而增大,同时,低黏度(450 mPa·s)MC水溶液的膨胀率也随其浓度的增加而增大,而高黏度(40 000、100 000 mPa·s)MC水溶液的膨胀率则呈下降趋势。通过对比不同黏度和浓度MC水泡沫的稳定性,发现40 000 mPa·s MC水泡沫呈现较好的稳定性,室温储存4 h后仍未出现明显的分层现象。进一步,对不同浓度40 000 mPa·s MC气凝胶的物理性质、微观形貌、分子间相互作用、结晶特性和热稳定性进行分析,发现浓度为16 g/L的MC气凝胶的内部网孔结构更加均匀致密,孔隙分布较为均一,平均孔径较小,并呈现较好的热稳定性,整体性能较为理想,可视作是一种良好的生物基油凝胶构建泡沫模板。未来将进一步分析MC气凝胶的吸油性能,旨在拓展其在全天然油凝胶体系中的应用,并为绿色、安全的动物脂肪替代品的开发提供技术支持。
[1] 张雯雯, 李坤, 赵丽平, 等.基于紫胶蜡和单甘酯构建茶籽油凝胶的工艺及其性能研究[J].粮食与油脂, 2024, 37(11):69-75.ZHANG W W, LI K, ZHAO L P, et al.Study on the technology of camellia seed oil oleogel based on shellac wax and monoglyceride and its properties[J].Cereals &Oils, 2024, 37(11):69-75.
[2] 王崇昊, 陈焱, 酉琳娜, 等.油凝胶的制备、性质及其在食品中应用研究进展[J].中国粮油学报, 2024, 11(5):1-11.WANG C H, CHEN Y, YOU L N, et al.Progress in the study of the preparation and properties of oleogels and their application in foodstuffs[J].Journal of the Chinese Cereals and Oils, 2024, 11(5):1-11.
[3] 姚欣鹏, 曹传爱, 孔保华, 等.黄原胶浓度对猪血浆蛋白-黄原胶基油凝胶结构及功能性质的影响[J].食品工业科技, 2024, 45(17):95-104.YAO X P, CAO C A, KONG B H, et al.Effect of xanthan gum concentration on structure and functional properties of porcine plasma protein-xanthan gum oleogel[J].Science and Technology of Food Industry, 2024, 45(17):95-104.
[4] 鲍玉格, 王启明, 冉娅琳, 等.生物聚合物油凝胶制备及其在食品领域的应用[J].食品与发酵工业, 2025, 51(8):351-358.BAO Y G, WANG Q M, RAN Y L, et al.Preparation of biopolymer based oleogels and its application in food industry:A review[J].Food and Fermentation Industries, 2025, 51(8):351-358.
[5] SUN C, WEI Z H, XUE C H.Construction of foam-templated Antarctic krill oil oleogel based on pea protein fibril and ι-carrageenan[J].Carbohydrate Polymers, 2025, 347:122729.
[6] WU Y M, SUN S H, LI X, et al.Fabrication, characterization, and fat substitution application in chocolate spreads of methyl cellulose and xanthan gum foam-templated oleogels[J].International Journal of Biological Macromolecules, 2024, 283:137677.
[7] ZHAO W J, WEI Z H, XUE C H.Foam-templated oleogels constructed by whey protein isolate and xanthan gum:Multiple-effect delivery vehicle for Antarctic krill oil[J].International Journal of Biological Macromolecules, 2024, 256:128391.
[8] ZHENG S B, WEI F L, ZHENG Q W, et al.Fabrication of rice bran protein-sodium alginate-calcium double cross-linked foam template for oleogel preparation[J].Food Hydrocolloids, 2023, 143:108873.
[9] ZHAO W J, WEI Z H, XUE C H, et al.Development of food-grade oleogel via the aerogel-templated method:Oxidation stability, astaxanthin delivery and emulsifying application[J].Food Hydrocolloids, 2023, 134:108058.
[10] LI H, YANG Y L, MU M, et al.MXene-based polysaccharide aerogel with multifunctional enduring antimicrobial effects for infected wound healing[J].International Journal of Biological Macromolecules, 2024, 261:129238.
[11] YAN Q, LONG X Y, ZHANG P X, et al.Oxidized Bletilla rhizome polysaccharide-based aerogel with synergistic antibiosis and hemostasis for wound healing[J].Carbohydrate Polymers, 2022, 293:119696.
[12] LI J W, ZHAO S N, ZHU Q Y, et al.Characterization of chitosan-gelatin cryogel templates developed by chemical crosslinking and oxidation resistance of camellia oil cryogel-templated oleogels[J].Carbohydrate Polymers, 2023, 315:120971.
[13] 崔梦琦, 单冠程, 孙若涵, 等.大豆蛋白强化羧甲基纤维素钠复合油凝胶的性能[J].食品科学, 2024, 45(4):60-67.CUI M Q, SHAN G C, SUN R H, et al.Properties of composite oleogels based on soybean isolate protein reinforced with sodium carboxymethylcellulose[J].Food Science, 2024, 45(4):60-67.
[14] 王谡阳, 王飞杰, 马淑凤, 等.多糖基气凝胶食品包装的研究进展[J].食品科学, 2023, 44(19):340-349.WANG S Y, WANG F J, MA S F, et al.Research progress on polysaccharide-based aerogel food packaging[J].Food Science, 2023, 44(19):340-349.
[15] JIANG Q B, YU Z J, MENG Z.Double network oleogels co-stabilized by hydroxypropyl methylcellulose and monoglyceride crystals:Baking applications[J].International Journal of Biological Macromolecules, 2022, 209:180-187.
[16] JIANG Q B, LI P Y, JI M R, et al.Synergetic effects of water-soluble polysaccharides for intensifying performances of oleogels fabricated by oil-absorbing cryogels[J].Food Chemistry, 2022, 372:131357.
[17] 王淑敏. 甲基纤维素复配食源性多糖体系构建运载姜黄素及生物可及性研究[D].杭州:浙江工商大学, 2023.WANG S M.Construction of a system of methyl cellulose mixed with food derived polysaccharides for the delivery of curcumin and its bioavailability[D].Hangzhou:Zhejiang Gongshang University, 2023.
[18] 金地. 甲基纤维素基气凝胶的制备与性能研究[D].苏州:苏州大学, 2017.JIN D.Preparation and adsorption properties of aerogel based on methylcellulose[D].Suzhou:Soochow University, 2017.
[19] 蒋秦波. 基于多糖聚合物构建多相低饱和类脂肪凝胶的研究[D].无锡:江南大学, 2022.JIANG Q B.Research on the construction of multiphase low-saturated fatty gels based on polysaccharide polymers[D].Wuxi:Jiangnan University, 2022.
[20] 陈迟, 李珂, 苏新, 等.壳聚糖基气凝胶药物控释体系的构建与应用[J].上海纺织科技, 2024, 52(5):21-27.CHEN C, LI K, SU X, et al.Construction of chitosan-based aerogel drug controlled release system and its application[J].Shanghai Textile Science &Technology, 2024, 52(5):21-27.
[21] EELAGER M P, MASTI S P, CHOUGALE R B, et al.Noni (Morinda citrifolia) leaf extract incorporated methylcellulose active films:A sustainable strategy for browning inhibition in apple slice packaging[J].International Journal of Biological Macromolecules, 2024, 269:132270.
[22] FORGHANI S, ALMASI H.Halochromic aerogels with Ca2+-induced tailored porosity based on alginate/gellan integrated with Echium amoenum anthocyanins:Characterization and application for freshness monitoring of rainbow trout fillet[J].Food Hydrocolloids, 2025, 160:110826.