八角是我国重要的传统天然香料,从八角果实或枝叶蒸馏可得到初级加工产品茴香油。茴香油的主要成分为反式茴脑(trans-anethole),占87%~94%,经过氧化可转变成食品饮料行业广泛应用的香料茴香醛(p-anisaldehyde)。茴香醛具有山楂花香气,芳香持久,GB 2760—2024《食品安全国家标准 食品添加剂使用标准》将茴香醛列为允许使用的食品用合成香料。
工业上生产茴香醛的方法主要是以反式茴脑为原料,加入MnO2催化剂氧化而成。反应特异性不高,副产物较多,且排放的含锰废弃物污染环境[1]。欧美法律规定,用酶或微生物以自然界分离的天然物质转化生成的香料可归为“天然香料”[2-3],在食品行业天然香料比化学合成的香料更受消费者欢迎。以来自八角茴香油的反式茴脑为底物,经生物法合成的茴香醛不仅可满足消费者对天然香料的要求,也可解决化学法合成带来的副产物多、污染环境等问题。
目前发现可以合成茴香醛的微生物包括细菌和真菌,而涉及茴香醛合成的基因研究主要集中在细菌。韩国研究人员分离到一株以反式茴脑为唯一碳源生长的Pseudomonas putida JYR-1,从该菌株中分离出一个反式茴脑加氧酶(trans-anethole oxygenase,TAO)基因,并研究了重组酶的性质[4-5]。国内多个课题组也筛选分离得到了可产生茴香醛的细菌,如Pseudomonas sp.BT-13[6-7]、Burkholderia sp.WGB30[8],克隆、表达了假单胞菌的tao基因[9-10],但都未研究茴香醛的全细胞催化合成。除了假单胞菌的tao基因之外,目前只发现了2种细菌的tao基因,分别来自Paraburkholderia sp.MR185和Stenotrophomonas maltophilia[11-12]。合成茴香醛还可通过还原反应来实现,比如TAVANTI等[13]用羧酸还原酶将茴香酸还原成茴香醛,产量达到了2.6 g/L,但反应底物茴香酸是化学法合成的产品,这样得到的产物茴香醛不能归为“天然香料”,而且反应过程还需额外加入葡萄糖脱氢酶、聚磷酸激酶实现辅因子的再生。如果将目的酶分离纯化出来用于茴香醛的合成,将会面临酶纯化步骤繁琐、成本高、纯酶易失活等问题。利用自然界筛选的微生物将反式茴脑转化形成茴香醛的转化率较低,比如Pseudomonas sp.BT-13在含有1%反式茴脑的培养基中生长,得到的茴香醛摩尔转化率仅为7.7%[7]。将tao基因导入大肠杆菌中表达,利用全细胞催化生成茴香醛,可避免提取纯化过程繁琐、纯酶易失活等问题,同时降低成本,然而关于利用基因工程菌全细胞转化反式茴脑生成茴香醛的研究尚未见报道。
在前期研究Paraburkholderia sp.MR185反式茴脑加氧酶的工作中,笔者发现该酶在大肠杆菌中形成大量的包涵体,导致表达水平很低。XXA是近年来发现的小球藻Chlorella sorokiniana抗冻蛋白AXX的反向蛋白,对目的蛋白有非常突出的促溶效果[14-16]。本研究尝试将人工反向蛋白XXA与TAO以融合形式表达,得到具有TAO活性的重组大肠杆菌,并将重组菌作为全细胞催化剂,研究了转化反式茴脑生成茴香醛的条件,得到了比较高的摩尔转化率,为茴香醛生物合成的产业化提供理论依据。
1 材料与方法
1.1 材料与仪器
限制性内切酶、T4 DNA连接酶、FastPfu 快速高保真DNA聚合酶,北京全式金生物技术有限公司;E.coli DH5α及BL21(DE3)感受态细胞、SimplePAGE Bis-Tris预制胶、蛋白预染Marker、引物,生工生物工程(上海)有限公司;茴香醛(>99.0%,GC)、反式茴脑(>98.0%,GC),梯希爱(上海)化成工业发展有限公司;异丙基-β-D-硫代半乳糖苷(isopropyl-beta-D-thiogalactopyranoside,IPTG)、硫酸卡那霉素、2,4-二硝基苯肼(2,4-dinitrophenylhydrazine,DNPH)、2-硫代巴比妥酸,上海阿拉丁生化科技有限公司;铁锤超级裂菌液,常州伯仪生物科技有限公司;其他试剂均为国产分析纯;质粒pRPOCDN-tao[11]、pET-28a,由本实验室保存;xxa基因,委托武汉金开瑞生物工程公司合成。
LB(Luria-Bertani)培养基(g/L):胰蛋白胨 10,酵母粉 5,NaCl 10;
TB(terrific broth)培养基(g/L):酵母粉 24,胰蛋白胨 12,甘油 4 mL/L,KH2PO4 2.31,K2HPO4·3H2O 16.43;
SOB(super optimal broth)培养基(g/L):酵母粉 5,胰蛋白胨 20,KCl 0.186,NaCl 0.5,MgCl2·6H2O 2.03;
SB(super broth)培养基(g/L):胰蛋白胨 32,酵母粉 20,NaCl 5;
2YT(2 yeast extract tryptone)培养基(g/L):胰蛋白胨 16,酵母粉 10,NaCl 5。
以上培养基121 °C灭菌20 min。
Biometra TProfessional PCR仪,德国耶拿公司;Centrifuge5804R高速冷冻离心机,德国Eppendorf公司;TU1901紫外可见分光光度计,北京普析通用仪器有限公司;DYY-6D电泳仪,北京六一生物科技有限公司;ZWYR-2102C恒温培养振荡器,上海智城分析仪器有限公司。
1.2 实验方法
1.2.1 表达载体的构建
委托武汉金开瑞生物工程公司合成xxa基因,按照大肠杆菌密码子偏好进行优化,插入pET-28a的Nco I、EcoR I位点,得到pET28a-xxa。用EcoR I、Xho I切割质粒pET28a-xxa,切胶回收;设计引物P1、P2,在tao基因前加上一段linker(GSGGSG),引物P1、P2的5′端分别加上EcoR I、Xho I识别序列,从pRPOCDN-tao中扩增Paraburkholderia sp.MR185反式茴脑加氧酶基因tao。
P1:5′-ACCGgaattcGGTAGTGGTGGTAGTGGTAT-GACCGATCAGGTTGAAACCCATG-3′
P2:5′-AACCGctcgagAGATTTTTTACCTTTGGAGG-TGCCG-3′
用EcoR I、Xho I切割PCR产物,与同样双酶切的pET28a-xxa连接,转化E.coli DH5α感受态细胞,挑单菌落,提取质粒,双酶切,测序,将重组质粒命名为pET28a-xxa-tao(图1)。
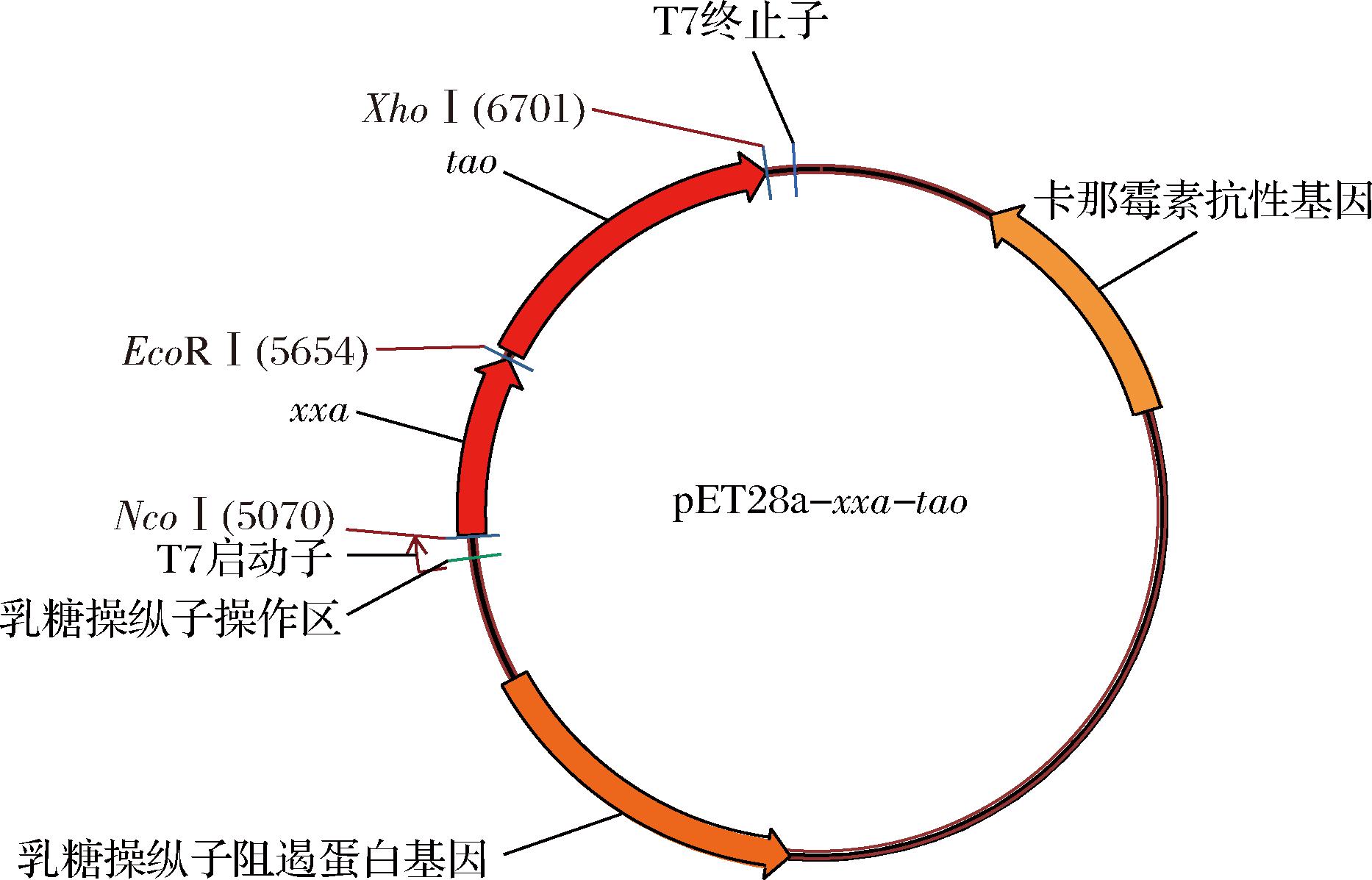
图1 pET28a-xxa-tao质粒图
Fig.1 Plasmid pET28a-xxa-tao
1.2.2 重组蛋白的诱导表达
将重组质粒pET28a-xxa-tao转化大肠杆菌BL21(DE3)感受态细胞,挑单菌落至20 mL含有卡那霉素50 μg/mL的LB液体培养基,37 ℃振荡过夜。按1%接种量将过夜培养菌液接种到新鲜LB培养基,37 ℃振荡至OD600值达到0.6,加入0.2 mmol/L IPTG溶液,20 ℃、200 r/min诱导表达20 h,离心,弃上清液,称量菌体湿重。按照1 g湿菌体加入9 mL TBS缓冲液(0.025 mol/L Tris-HCl,0.14 mol/L NaCl,0.003 mol/L KCl,pH 7.4)的比例,重悬菌体,加入TBS缓冲液1/9体积的铁锤裂菌液裂解10 min,10 000 r/min、4 ℃离心10 min。分别将上清液、沉淀进行SDS-PAGE分析。使用网络工具Protein-Sol(http://protein-sol.manchester.ac.uk)在线预测重组蛋白可溶性[17]。
1.2.3 重组菌株诱导表达条件优化
基础诱导条件按照1.2.2节方法进行。分别用不同的诱导培养基、诱导温度、诱导时菌液OD600值、IPTG浓度、种子液接种量诱导20 h后收集菌体,进行全细胞催化1 h,测定茴香醛的产量,计算酶活力。酶活力单位定义:每分钟产生1 μmol的茴香醛所需的酶量为1 U。优化条件时将最高酶活力设定为100%,其他处理条件的酶活力/最高酶活力×100为相对酶活力(%)。
1.2.4 全细胞催化初始反应条件
将IPTG诱导表达的菌液离心,收集菌体细胞,称量菌体湿重。用PBS(pH 7.5)洗涤后,用适量PBS(pH 7.5)重悬,得到20%的湿菌体,用于全细胞催化。反式茴脑按照1 g/L的终质量浓度加入全细胞悬液,于30 ℃、200 r/min振荡反应10 h。取全细胞催化反应液1 mL,12 000 r/min离心5 min,弃沉淀,取上清液,稀释到一定倍数,测定其中茴香醛含量。摩尔转化率计算如公式(1)所示:
摩尔转化率![]()
(1)
1.2.5 重组菌全细胞催化条件优化
在初始反应条件基础上,分别在不同菌体质量分数、底物浓度、催化反应温度、反应pH等条件下测定茴香醛的产量及转化率。
1.2.6 固定化细胞催化合成茴香醛
离心收集诱导后的菌体细胞,称重湿菌体。用PBS(pH 8.0)洗涤后,用PBS(pH 8.0)重悬,制备得到20%的湿菌体。参考邹树平等[18]的方法,将菌悬液分别采用卡拉胶、明胶、聚乙烯醇、海藻酸钠包埋法制备固定化细胞。将固定化细胞小球滤出,生理盐水洗净后用PBS(pH 8.0)重悬,加入反式茴脑至终质量浓度为2 g/L,于30 ℃、200 r/min振荡反应10 h,测定其中茴香醛浓度。
1.2.7 茴香醛的测定
茴香醛的定性检测采用DNPH显色法[11]。定量测定采用硫代巴比妥酸分光光度法[19]。将一系列不同浓度的茴香醛与硫代巴比妥酸在酸性条件反应后,在415 nm波长处测定OD值,制作标准曲线,得到的线性回归方程为:y=5.864 2x-0.078 7,R2=0.993 4。其中y为波长415 nm下的OD值,x为茴香醛的浓度(mmol/L)。
2 结果与分析
2.1 重组表达载体的构建
本研究构建的表达载体pET28a-xxa-tao如图1所示,将反式茴脑加氧酶基因tao与反向蛋白基因xxa融合成一个开放阅读框,置于pET-28a质粒T7启动子下游、T7终止子上游,使得融合基因xxa-tao在T7启动子驱动下表达。
2.2 重组蛋白的诱导表达
重组菌株表达蛋白的电泳分析如图2所示。重组大肠杆菌BL21(DE3)/pET28a-xxa-tao与未诱导样品相比,IPTG诱导后的菌体裂解液沉淀、上清液均出现明显的目的条带(泳道2、泳道3),与理论计算值60 kDa相符。虽然融合蛋白有很大一部分以可溶形式表达,但仍无法避免包涵体的形成。类似的现象也在其他细菌的TAO上发现,如HAN等[5]研究Pseudomonas putida JYR-1的TAO表达时,发现其加上组氨酸标签无法得到可溶性表达,在酶的N端加上促溶的谷胱甘肽巯基转移酶标签后才解决。值得注意的是,刘思琴等[9]Pseudomonas putida TAO用pET-22b成功表达出酶活性,WEN等[10]将Pseudomonas putida TAO野生型与突变型用pETDuet-1均可表达出酶活性,这2个研究均未加上任何促溶标签。而在最近的一个研究中,PURWANI等[12]尝试将Pseudomonas putida JYR-1的TAO用pBAD或pET系列载体降低诱导温度,无论是否与促溶标签小分子泛素样修饰蛋白融合,均无法表达出可溶性的重组蛋白。造成这些可溶性表达差异的原因仍不清楚。在本研究中,Paraburkholderia sp.MR185 TAO在大肠杆菌中也有易于形成不溶性蛋白的倾向。使用大肠杆菌蛋白溶解度预测工具Protein-Sol,输入该酶的氨基酸序列后溶解度预测值(Predicted scaled solubility)为0.333,低于实验数据集的群体平均值(PopAvrSol)0.45,表明容易形成包涵体;在TAO的N端加上助溶标签XXA后,融合酶的溶解度预测值为0.588,超过了0.45,溶解度明显增加。由此推测,该酶的氨基酸序列是导致形成包涵体的主要原因,选择合适的助溶标签,插入到TAO的N端,以融合蛋白的形式表达。融合蛋白在翻译时依次翻译出助溶标签、TAO,这样融合蛋白因为助溶标签的可溶性,以及助溶标签之间的不聚集特性倾向于相互独立。相互独立的融合蛋白因为没有聚集产生包涵体,其中的TAO就有了充分的时间用于自发的折叠,折叠由酶的氨基酸序列自发驱动,助溶标签为TAO提供了自发折叠的时间和空间。本研究选择小球藻Chlorella sorokiniana抗冻蛋白AXX的反向蛋白XXA作为助溶标签,XXA具有极强的可溶性以及分子间不易聚集的特性[14],对TAO的可溶性有明显的提升作用。此外,合适的外部因素(如培养温度)能降低蛋白的翻译速度,使目的蛋白有充分的时间进行折叠,降低包涵体的形成概率,因此需要摸索合适的诱导表达条件。
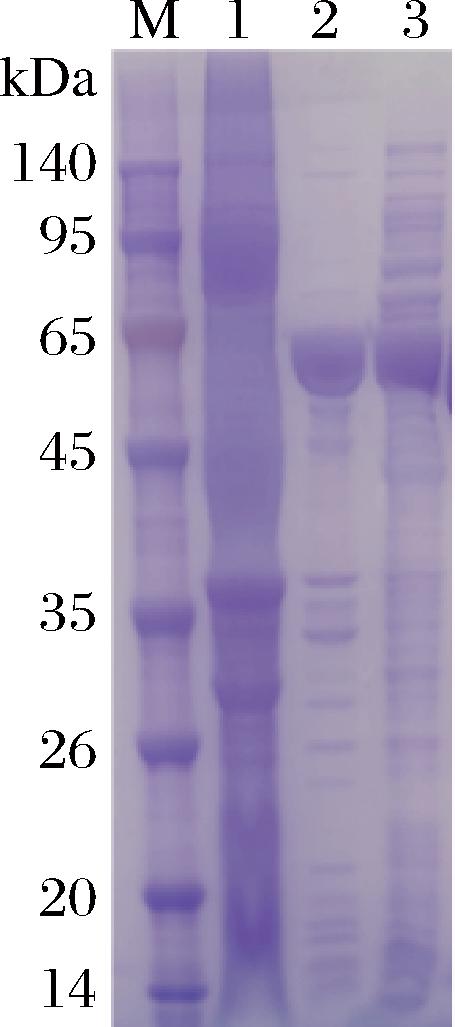
M-预染蛋白Marker;泳道1-未诱导菌体;泳道2-诱导菌体沉淀;泳道3-诱导菌体上清液。
图2 大肠杆菌BL21(DE3)中表达XXA-TAO的SDS-PAGE分析
Fig.2 SDS-PAGE analysis of expression of XXA-TAO in E.coli BL21(DE3)
将诱导后重组菌体与反式茴脑反应后,分别用DNPH、硫代巴比妥酸检测反应产物,结果如图3所示。诱导后重组菌体可将反式茴脑转化为茴香醛,与DNPH生成了红色沉淀,与硫代巴比妥酸生成了黄色的5-亚烃基硫代巴比妥酸,而未诱导的菌体没有这些显色反应,证明携带质粒pET28a-xxa-tao的大肠杆菌在IPTG诱导下成功表达出了Paraburkholderia sp.MR185 TAO。
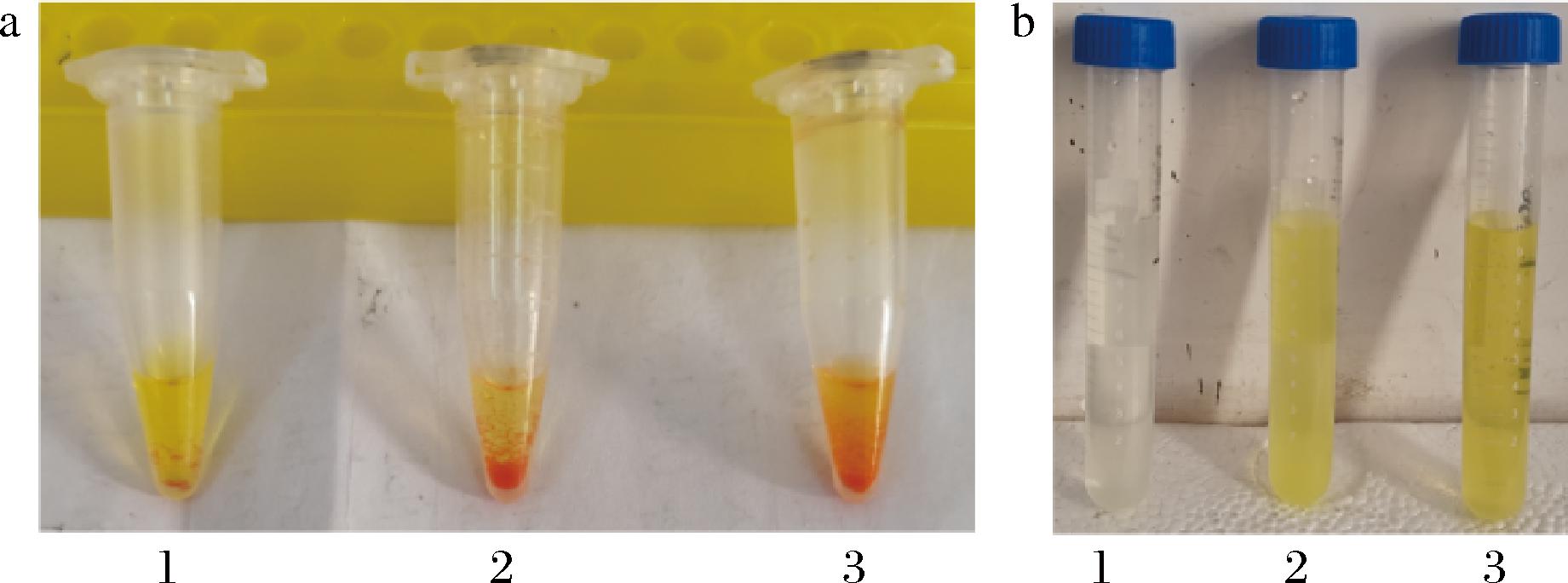
a-DNPH显色;b-硫代巴比妥酸显色
图3 重组大肠杆菌转化反式茴脑产物的显色反应
Fig.3 Color assay of transformation product of trans-anethole by recombinant E.coli
注:1号管为未诱导菌体转化反式茴脑产物,2号管为茴香醛,3号管为诱导菌体转化反式茴脑产物。
2.3 诱导表达条件优化
将菌体用不同培养基诱导表达,诱导后测定菌液OD600值、酶活力,结果如图4-a所示。在测试的几种培养基中,使用TB培养基得到的菌液OD600值和相对酶活力均为最高,OD600值达到了8.4,而LB诱导得到的菌体OD600值与相对酶活力最低。可能原因为TB培养基提供的营养成分比其他培养基更丰富,其中的甘油有利于菌体产生足够的还原力,促进氧化还原反应的进行[20]。
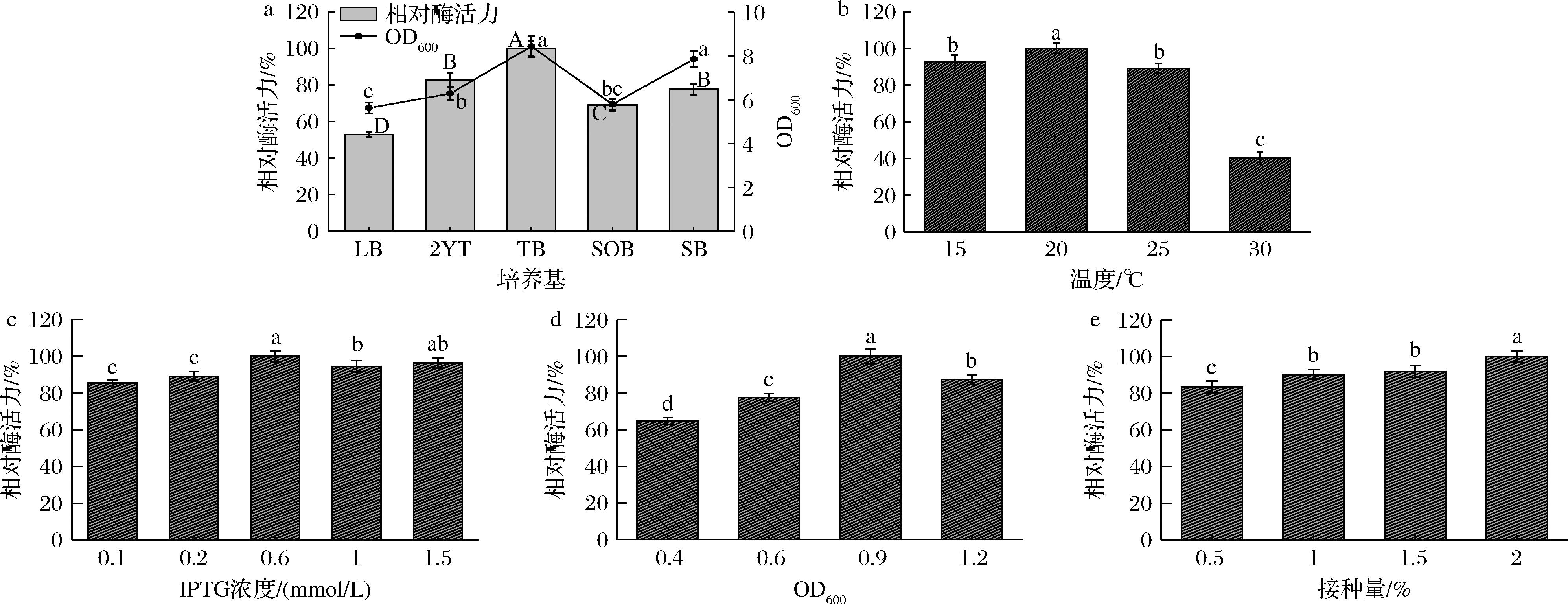
a-诱导培养基优化;b-诱导温度优化;c-IPTG浓度优化;d-诱导时菌体OD600值优化;e-接种量优化
图4 诱导条件对菌体酶活力的影响
Fig.4 Effect of induction conditions on TAO activity in E.coli cells
注:不同字母表示组间具有显著性差异(P<0.05)(下同)。
在诱导过程中,温度影响了细胞活性、蛋白的合成速率以及蛋白的正确折叠,pET载体携带的T7启动子能够高效率地合成外源蛋白,但在温度较高时往往导致错误的蛋白折叠,因此需要探索有利于目的蛋白可溶性表达的温度。在4个不同诱导温度(15、20、25、30 ℃)下诱导20 h,收集菌体,测定菌体的酶活力。如图4-b所示,最佳诱导温度为20 ℃,温度过高反而导致酶活力下降,表明过高的温度不利于重组酶的表达。
IPTG是pET系列表达载体的诱导剂,对T7启动子有高效的诱导作用,可能影响到菌体细胞活性及目的蛋白表达水平。为找到合适的IPTG添加量,在菌液中加入0.1、0.2、0.6、1.0、1.5 mmol/L 的IPTG,诱导20 h后,测定菌体的酶活力。如图4-c所示,0.6 mmol/L为最适IPTG浓度,其他浓度诱导的效果相差不大。
向不同生长状态(OD600=0.4、0.6、0.9、1.2)菌液中添加IPTG,诱导20 h,测定菌体的酶活力。如图4-d所示,OD600=0.9时诱导表达水平最高。
使用不同接种量(0.5%、1%、1.5%和2%)将种子液接入新鲜培养基后,待OD600=0.6加入IPTG诱导,测定菌体的酶活力。如图4-e所示,2%接种量得到的菌体酶活力最高。
综上,确定诱导表达条件为按2%接种量取过夜培养菌液接种到新鲜TB培养基,37 ℃振荡至OD600值达到0.9,加入0.6 mmol/L IPTG,20 ℃诱导表达后收集菌体,得到的菌体酶活力达到9.3 U/g,比初始诱导条件得到的菌体酶活力(2.8 U/g)提高了232.1%。
2.4 全细胞催化条件优化
2.4.1 菌体量
收集诱导后的菌体,在全细胞初始催化条件下得到的茴香醛产量为0.49 g/L。重组菌菌体具有转化反式茴脑生成茴香醛的活性,高浓度的菌体细胞带来更多含量的活性酶,可产生更多的产物。为找到合适的反应体系细胞浓度,用pH 7.5的PBS将菌体调整为不同质量分数(3%、5%、10%、15%、20%、30%)的菌悬液,加入底物反式茴脑终质量浓度为1 g/L,30 ℃、200 r/min振荡反应10 h。如图5-a所示,反应体系菌体质量分数为5%时,茴香醛产量和摩尔转化率均达到最高。当菌体质量分数继续升高,茴香醛产量和转化率急剧下降。这种现象在其他利用大肠杆菌全细胞催化反应的研究中也有报道[21],可能原因是大肠杆菌细胞密度过大,黏度过高,导致传质阻力变大,TAO催化反应时需要的O2供应受到严重影响。

a-菌体质量分数;b-反式茴脑浓度;c-温度;d-pH
图5 全细胞催化反应条件对茴香醛产量的影响
Fig.5 Effect of catalysis conditions on production of p-anisaldehyde by E.coli whole cells
2.4.2 底物浓度
在生物催化反应中,底物的浓度也会对产物合成带来较大影响。添加不同质量浓度(1、2、3、4、5 g/L)的反式茴脑进行催化反应,结果如图5-b所示,反式茴脑质量浓度从1 g/L升高到2 g/L,茴香醛产量从0.49 g/L升高到1.12 g/L,而摩尔转化率从53.3%上升到60.9%,当反式茴脑浓度继续增加,茴香醛产量增加幅度较小,而摩尔转化率迅速下降,可能原因是底物反式茴脑和产物茴香醛都对大肠杆菌有抑制作用。确定底物反式茴脑的最佳添加量为2 g/L。
2.4.3 催化反应温度
将菌体悬液与底物置于不同温度(25、30、35、40、45 ℃),其他条件按照初始条件进行催化反应。如图5-c所示,30 ℃的产量最高,25 ℃和35 ℃时的产量略低于30 ℃时,从40 ℃时产量开始明显下降,表明酶对热比较敏感。
2.4.4 催化反应pH
配制pH 6.5~8.0的磷酸缓冲液及pH 8.5~9.0的Tris-HCl缓冲液。将菌体悬液与底物置于不同的初始pH值(6.5、7.0、7.5、8.0、8.5、9.0)条件下,其他反应条件按照初始条件进行催化反应。结果如图5-d所示,pH 8.0条件下全细胞催化产生的茴香醛产量最高,为0.53 g/L,转化率达到57.6%。
根据上述优化结果,当全细胞催化反应的菌体质量分数为5%,底物质量浓度为2 g/L,温度为30 ℃,pH值为8.0时催化反应10 h,转化液中茴香醛的产量可达1.62 g/L,比未优化条件的产量提高了230.6%,摩尔转化率达到88.3%,比未优化条件的转化率提高了35.0%。
2.5 固定化细胞催化合成茴香醛
2.5.1 固定化材料
将菌体细胞使用不同固定化材料进行包埋,按照1.2.6节方法进行催化反应,测定转化液中茴香醛的浓度及转化率。以相同条件下游离的细胞生成茴香醛的转化率作为100%活力,算出不同载体包埋后的固定化细胞活力回收率。如图6-a所示,海藻酸钠包埋的细胞活力回收率最高,聚乙烯醇的回收率最低,可能与聚乙烯醇的细胞毒性有关。与其他3种包埋材料相比,海藻酸钠对微生物细胞毒性小、固定化细胞密度高,因此选定海藻酸钠作为固定化载体。

a-固定化载体的选择;b-包埋菌体质量分数的优化;c-固定化细胞热稳定性;d-固定化细胞操作稳定性
图6 固定化条件对茴香醛产量的影响
Fig.6 Effect of immobilization conditions on production of p-anisaldehyde
2.5.2 包埋菌体质量分数
用不同菌体质量分数的菌悬液制成固定化细胞,测定将反式茴脑转化为茴香醛的摩尔转化率。固定化小球包埋的菌体细胞数量越多,催化活性越高,但固定化小球机械强度随着细胞数的增多而下降,破损率上升,且过高的包埋率会产生空间位阻,导致催化活性下降。如图6-b所示,包埋菌体质量分数为5%时,制成的固定化细胞转化率最高。
2.5.3 固定化细胞热稳定性
用海藻酸钠包埋5%菌体的固定化细胞以及含有相同菌体量的游离细胞置于不同温度下转化反式茴脑,测定茴香醛产量及转化率。如图6-c所示,与游离细胞相比,虽然固定化细胞的转化率在25~35 ℃较低,但耐热性有所提高。45 ℃时游离细胞的转化率已经降到20%以下,而固定化细胞的转化率仍在40%以上。固定化细胞热稳定性有了明显的提高。
2.5.4 固定化细胞操作稳定性
分别将含相同菌体量的游离细胞、固定化细胞用于重复催化反应,如图6-d所示,最初游离细胞的茴香醛产量高于固定化细胞,但随着重复次数的增加,游离细胞的活性急剧下降,到第6次时已无催化活性。固定化细胞由于在包埋时损失了部分活性,因此第1轮反应的产量低于游离细胞,但从第2轮反应开始超过游离细胞。固定化细胞在前3次循环中的茴香醛产量均可达到1 g/L以上,且到了第9次仍可产生少量茴香醛,包埋载体对菌体细胞起到了保护作用,减缓了活性的损失,提高了菌体的重复使用次数。固定化细胞活性下降的原因可能是没有营养物质的补充,细胞无法长时间维持活性,逐渐死亡,酶分子也随之流失;此外,反式茴脑和茴香醛作为芳香化合物,对大肠杆菌有一定的抑制作用[22-23],虽有包埋载体的保护,也会导致细胞逐渐丧失活性。
综上所述,在优化条件后,本研究用游离细胞、固定化细胞得到的茴香醛产量分别达到1.62、1.26 g/L,摩尔转化率分别为88.3%、68.5%。
3 结论与讨论
茴香醛是食品饮料、日化行业中广泛应用的香料,目前还没有生产企业实现生物法合成。以往的研究从自然界分离了多个可将反式茴脑转变为茴香醛的菌株,但转化率、产量都很低,无法达到工业化生产的需求。本研究通过基因工程手段将tao基因导入大肠杆菌,并将其与一个助溶标签XXA融合表达,在重组菌中检测到了酶活性。优化了重组酶的诱导表达条件,菌体重组酶活力达到9.3 U/g,比初始诱导条件得到的菌体酶活力提高了232.1%。将诱导表达后得到的菌体用作全细胞催化剂,转化反式茴脑合成茴香醛,优化了全细胞催化反应条件,茴香醛产量达到1.62 g/L,转化率达到88.3%,比未优化条件下产量提高了230.6%,转化率提高了35.0%。将大肠杆菌制成固定化细胞,用固定化细胞进行多次重复转化,茴香醛产量最高为1.26 g/L,摩尔转化率为68.5%,固定化细胞在前3次循环中的茴香醛产量均可达到1 g/L以上。
已有相关文献报道均为利用野生型细菌转化反式茴脑生成茴香醛,比如粟桂娇等[7]在有机溶剂-水两相系统中用游离的Pseudomonas sp.BT-13转化反式茴脑,30 h后茴香醛产量达到0.69 g/L,摩尔转化率为7.7%,改用海藻酸钙固定化细胞,摩尔转化率提高到12.6%,产量达1.12 g/L;梁肖仍等[8]用Burkholderia sp.WGB30将反式茴脑转化为茴香醛,转化时间为60 h,茴香醛的摩尔转化率为5.08%,产量为0.23 g/L。本研究使用了游离的全细胞与固定化细胞,得到的茴香醛产量(1.62、1.26 g/L)与摩尔转化率(88.3%、68.5%)都高于这2个研究,且转化时间仅为10 h,效率更高。野生型细菌以反式茴脑作为唯一碳源用于菌体生长、合成细胞组分及产能代谢,有完整的代谢途径,在此过程中生成的茴香醛只是一个中间代谢产物,被细胞继续转化为其他产物,难以大量积累。本研究采用基因工程大肠杆菌转化反式茴脑,大肠杆菌缺乏反式茴脑的完整代谢途径,不能将其作为碳源用于生长代谢,只能在TAO催化下生成终产物茴香醛,产量明显提高。利用大肠杆菌生产其他种类芳香醛的产量已经达到10 g/L以上[10,24],相比之下,本研究得到的茴香醛产量仍偏低,主要原因可能是酶活力及对底物的耐受性均不高。后续可考虑通过蛋白质分子进化手段提高酶的活性与稳定性,进一步提高茴香醛产量与转化率,为八角资源的深加工提供新途径。
[1] XIONG J, YUAN X, ZONG M H, et al.Iron-incorporated metal-organic frameworks for oxidative cleavage of trans-anethole to p-anisaldehyde[J].Nanoscale, 2023, 15(48):19493-19498.
[2] MANINA A S, FORLANI F.Biotechnologies in perfume manufacturing:Metabolic engineering of terpenoid biosynthesis[J].International Journal of Molecular Sciences, 2023, 24(9):7874.
[3] DICKEY R M, GOPAL M R, NAIN P, et al.Recent developments in enzymatic and microbial biosynthesis of flavor and fragrance molecules[J].Journal of Biotechnology, 2024, 389:43-60.
[4] HAN D F, RYU J Y, KANALY R A, et al.Isolation of a gene responsible for the oxidation of trans-anethole to para-anisaldehyde by Pseudomonas putida JYR-1 and its expression in Escherichia coli[J].Applied and Environmental Microbiology, 2012, 78(15):5238-5246.
[5] HAN D F, SADOWSKY M J, CHONG Y, et al.Characterization of a self-sufficient trans-anethole oxygenase from Pseudomonas putida JYR-1[J].PLoS One, 2013, 8(9):e73350.
[6] 粟桂娇, 刘雄民, 朱萍, 等.反式茴脑生物降解菌株的筛选及其生物转化[J].化工进展, 2009, 28(1):141-144;172.SU G J, LIU X M, ZHU P, et al.Isolation of trans-anethole degrading bacterial strains and biotransformation of trans-anethole[J].Chemical Industry and Engineering Progress, 2009, 28(1):141-144;172.
[7] 粟桂娇, 刘雄民, 李伟光, 等.两相系统中生物转化茴脑生成茴香醛[J].精细化工, 2009, 26(2):136-141.SU G J, LIU X M, LI W G, et al.Biotransformation of anethole to anisaldehyde in aqueous-organic solvents biphasic systems[J].Fine Chemicals, 2009, 26(2):136-141.
[8] 梁肖仍, 宋张杨, 曾华贺, 等.一株转化茴脑生成茴香醛的菌株筛选与鉴定[J].食品与生物技术学报, 2011, 30(6):956-961.LIANG X R, SONG Z Y, ZENG H H, et al.Isolation and characterization of a strain for bioconversion of anethole to anialdehyde[J].Journal of Food Science and Biotechnology, 2011, 30(6):956-961.
[9] 刘思琴, 郑璞, 陈鹏程, 等.合成洋茉莉醛重组菌株的构建与产物鉴定[J].食品与发酵工业, 2018, 44(6):1-7.LIU S Q, ZHENG P, CHEN P C, et al.Construction of a recombinant strain for biosynthesis of heliotropin and its product identification[J].Food and Fermentation Industries, 2018, 44(6):1-7.
[10] WEN P, WU D, ZHENG P, et al.Highly efficient biosynthesis of heliotropin by engineered Escherichia coli coexpressing trans-anethole oxygenase and formate dehydrogenase[J].Journal of Agricultural and Food Chemistry, 2019, 67(51):14121-14128.
[11] LIN Q, LI J N, LING X R, et al.Cloning and expression of a novel trans-anethole oxygenase gene from Paraburkholderia sp.MR185[J].Journal of General and Applied Microbiology, 2022, 68(3):163-167.
[12] PURWANI N N, ROZEBOOM H J, WILLERS V P, et al.Discovery of a new class of bacterial heme-containing CC cleaving oxygenases[J].New Biotechnology, 2024, 83:82-90.
[13] TAVANTI M, HOSFORD J, LLOYD R C, et al.ATP regeneration by a single polyphosphate kinase powers multigram-scale aldehyde synthesis in vitro[J].Green Chemistry, 2021, 23(2):828-837.
[14] XIE X, WU P, HUANG X C, et al.Retro-protein XXA is a remarkable solubilizing fusion tag for inclusion bodies[J].Microbial Cell Factories, 2022, 21(1):51.
[15] YE X, LING X, WU M, et al.Improving soluble expression of SARS-CoV-2 spike priming protease TMPRSS2 with an artificial fusing protein[J].International Journal of Molecular Sciences, 2023, 24(13):10475.
[16] 敖龙, 朱玲玉, 庞欣, 等.人工蛋白XXA促进人源肿瘤抑素Tumstatin可溶性表达[J].食品与发酵工业, 2024, 50(12):1-8.AO L, ZHU L Y, PANG X, et al.Artificial protein XXA promotes soluble expression of human-derived Tumstatin[J].Food and Fermentation Industries, 2024, 50(12):1-8.
[17] HEBDITCH M, CARBALLO-AMADOR M A, CHARONIS S, et al.Protein-Sol:A web tool for predicting protein solubility from sequence[J].Bioinformatics, 2017, 33(19):3098-3100.
[18] 邹树平, 颜海蔚, 胡忠策, 等.固定化重组大肠杆菌细胞催化合成(R)-环氧氯丙烷[J].现代化工, 2013, 33(7):55-59.ZOU S P, YAN H W, HU Z C, et al.Synthesis of (R)-epichlorohydrin catalyzed by immobilized recombinant Escherichia coli cells[J].Mordern Chemical Industry, 2013, 33(7):55-59.
[19] 魏小平, 李建平, 蓝小月.分光光度法测定微量茴香醛的研究[J].食品科学, 2002, 23(1):101-103.WEI X P, LI J P, LAN X Y.Spectrophotometric determination of micro-amount of anisaldehyde by condensation reaction with tba[J].Food Science, 2002, 23(1):101-103.
[20] 李沂馨, 毛银, 刘伟, 等.生物基1,6-己二醇的全细胞催化及其过程强化[J].食品与发酵工业, 2025, 51(5):8-14.LI Y X, MAO Y, LIU W, et al.Whole-cell catalysis of biobased 1,6-hexanediol and its fermentation enhancement[J].Food and Fermentation Industries, 2025, 51(5):8-14.
[21] 付声亮, 邹诗瑶, 高娃, 等.重组大肠杆菌全细胞转化苹果酸合成丙酮酸[J].中国食品学报, 2024, 24(7):219-228.FU S L, ZOU S Y, GAO W, et al.Biosynthesis of pyruvate from malic acid by whole-cell biotransformation using recombinant Escherichia coli[J].Journal of Chinese Institute of Food Science and Technology, 2024, 24(7):219-228.
[22] AUEZOVA L, NAJJAR A, KFOURY M, et al.Antibacterial activity of free or encapsulated selected phenylpropanoids against Escherichia coli and Staphylococcus epidermidis[J].Journal of Applied Microbiology, 2020, 128(3):710-720.
[23] LIN Y, HUANG R, SUN X X, et al.The p-Anisaldehyde/β-cyclodextrin inclusion complexes as a sustained release agent:Characterization, storage stability, antibacterial and antioxidant activity[J].Food Control, 2022, 132:108561.
[24] TAZON A W, AWWAD F, MEDDEB-MOUELHI F, et al.Biotechnological advances in vanillin production:From natural Vanilla to metabolic engineering platforms[J].BioChem, 2024, 4(4):323-349.