辅酶Q10是一种内源性合成的类维生素物质,主要存在于人体线粒体中,作为电子载体在呼吸链中起着重要作用,同时也是人体内唯一可自身合成的脂溶性抗氧化剂,保护着蛋白质、DNA和脂质免受氧化[1-2]。研究表明,随着年龄的增长,机体合成辅酶Q10的能力逐渐下降,组织水平不断降低[3-4],且辅酶Q10缺乏症已被证明与多种疾病相关,如心血管疾病、糖尿病以及肾脏疾病等[4]。因此,辅酶Q10的外源性摄入对于一些特殊人群是必不可少的。辅酶Q10原料常以多晶体的形式存在[5],而人体胃肠道不能直接吸收该形式的辅酶Q10,其仅能以单个分子的形式被吸收[6]。从分子式上看,一个苯醌环和异戊二烯侧链的结构使辅酶Q10具有脂溶性,但高分子质量又限制了其溶解度,生物可接受率通常约为5%及以下[7]。因此,如何将辅酶Q10在体内去晶体化是解决其生物可接受率低的关键。
脂质纳米颗粒(lipid nanoparticle,LNP)已被开发用于解决活性成分的溶解性和渗透性,通过胃肠道将活性物质运输到血液中,从而实现更高的生物利用度。其中,固体纳米脂质颗粒(solid lipid nanoparticles,SLN)已被广泛用于封装、保护和递送亲脂性功能成分,例如,BAN等[8]利用SLN载体递送姜黄素使其在大鼠体内生物利用度提高了12倍。然而,由于SLN密集堆积的晶体网络,容纳空间小,导致负载度低,稳定性差[9]。对此,后开发出的纳米结构脂质载体(nanostructured lipid carriers,NLC)由固体和液体脂质共同构成疏水性核心,克服了SLN中的一些缺点。与SLN体系相对完美的晶格相比,液体脂质的掺入破坏了固体脂质的晶体网络,形成了更多用于负载物质的纳米空间,最大程度上减少了储藏过程中活性成分的排出[9]。与此同时,脂质晶体网络能够增强其对负载物的释放性能和自身稳定性,这些优点使得NLC成为制药和化妆品行业的常用载体[10]。另外,相较于纳米乳液(nanoemulsion,NE)液态脂质的内部,NLC的脂质相还能够保护包埋的药物,使其在特殊环境中免受降解,如在之前的一项研究中[11],辅酶Q10具有光不稳定性,经NE包埋的辅酶Q10在日光照射28 d后保留率为46%,而NLC的保留率可高达75%。
尽管辅酶Q10已在多种载体方面取得了进展,如固体分散体、乳液、脂质体、纳米粒子、自乳化载体等[12-13],但高负载下生物可接受率低的问题依旧未得到有效的解决。结合目前一些活性成分(active pharmaceutical ingredient,API),如布洛芬、阿司匹林、姜黄素等,通过晶体工程修饰晶体的大小、晶型或晶习以改变各自的熔点、溶解度及溶解效率等性质,进而提高生物可接受率[14]。因此,利用NLC的载体形式实现辅酶Q10的高负载,通过调整脂质相固液油脂比例改变晶体环境,控制辅酶Q10晶体生长,实现对其晶体的修饰,促进生物利用。本文以3种不同的棕榈油与中链甘油三酯(medium chain triglycerides,MCT)比例,制备了辅酶Q10纳米结构脂质载体,即辅酶Q10-NLCs,表征其理化性质,并探究脂质相晶体结构对稳定性和辅酶Q10递送的影响。
1 材料与方法
1.1 材料与试剂
辅酶Q10(>99%,分析纯),上海阿拉丁生物科技有限公司;单脂肪酸甘油酯,上海麦克林生化科技股份有限公司;黏蛋白(M2378)、胃蛋白酶(P7125)、脂肪酶(L3126)、胰酶(P1750),Sigma Aldrich公司;牛胆盐,北京索莱宝科技有限公司;棕榈油,山东荣威化工有限公司;MCT,青岛海智源生命科技有限公司;其他化学试剂均为分析纯。
1.2 仪器与设备
加热磁力搅拌器、ULTRA-TURRAX®分散机,艾卡(广州)仪器设备有限公司(德国IKA);M-110P微射流,美国MFIC公司;Zetasizer Nano ZS纳米粒度电位仪,英国马尔文仪器有限公司;Pyris Diamond差示扫描量热仪,美国珀金埃尔默(PE)股份有限公司;HT7800透射电子显微镜,日立高新技术(上海)国际贸易有限公司;1260高效液相色谱仪,安捷伦科技有限公司;SHA-B水浴恒温摇床,常州金坛良友仪器有限公司;827台式pH计、907 Titrando全自动电位滴定仪,瑞士万通中国有限公司;DM2700P偏光显微镜,德国徕卡(Leica)仪器有限公司。
1.3 试验方法
1.3.1 辅酶Q10-NLCs的制备
首先,以2∶1、1∶1、1∶2比例混合棕榈油和MCT,加热至油相溶解。然后,基于油脂量添加辅酶Q10,使其占脂质相总体的15%(质量分数),搅拌至辅酶Q10完全溶解。辅酶Q10-NLCs采用单脂肪酸甘油酯作表面活性剂,将单脂肪酸甘油酯(3%,质量分数)完全溶解在蒸馏水(87%,质量分数)中作为水相,并以上述3种负载辅酶Q10的脂质相作油相(10%,质量分数),将油相缓慢加入水相,同时使用高速分散机以10 000 r/min的速度分散3 min,再在恒温微射流中以60 MPa的压力循环处理3次,最后置于25 ℃环境中放置24 h,待进一步分析。3种辅酶Q10-NLCs按照固液油脂比例分别命名为:P2/M1、P1/M1、P1/M2。
1.3.2 微观结构
通过透射电子显微镜对辅酶Q10-NLCs的微观结构进行观察。将稀释100倍的NLCs置于带有薄膜的铜网格上,用2%(体积分数)磷钨酸染色2 min,然后使用透射电子显微镜对其进行图像采集。
1.3.3 粒径、多分散性指数及zeta电位
纳米粒度电位仪对辅酶Q10-NLCs进行基本理化性质的表征,即使用动态光散射功能测定平均粒径与多分散性指数(polydispersity index,PDI),使用电泳光散射测定zeta电位。在测量之前,使用超纯水对样品进行适当稀释,以达到适合测量的浓度。测定时,分析温度25 ℃,平衡时间120 s。
1.3.4 差示扫描量热法
采用差示扫描量热法(differential scanning calorimetry,DSC)分析辅酶Q10-NLCs的晶体结构和热力学性质。由于辅酶Q10-NLCs中脂质相比例低,且测定量少,为防止测定值低于仪器灵敏度,先采用超滤离心对NLCs进行前处理。然后,以空坩埚为空白对照,称取5.0~10.0 mg样品置于坩埚中密封测定。仪器参数设置如下:升温范围25~65 ℃,升温速率5 ℃/min,N2流速40 mL/min。
1.3.5 包封率
取1 mL辅酶Q10-NLCs在超速离心机中以4 ℃,15 000 r/min条件分离1 h。在4 ℃条件下,未包埋的辅酶Q10形成晶体下沉,去除上层脂质载体颗粒,在下层中加入5 mL无水乙醇,涡旋1 min后超声波破碎15 min,移入定量瓶,并使用无水乙醇定容稀释,等待测定。另外,使用无水乙醇直接对NLCs破乳萃取,测定其总含量。辅酶Q10封装效率(encapsulation efficiency,EE)的计算如公式(1)所示:
(1)
式中:C0,未包封的辅酶Q10含量,即下层沉淀中辅酶Q10的测定含量,mol/L;C1,NLCs中辅酶Q10的总含量,mol/L。
采用配有紫外检测器的高效液相色谱仪对辅酶Q10进行定量分析,测定方法在李喆等[15]的方法上做出更改。采用C18反向色谱柱,流动相:V(甲醇)∶V(乙醇)=50∶50,流速1 mL/min,紫外检测波长275 nm,进样体积20 μL。所有测定样品使用无水乙醇进行稀释,经0.22 μm孔径的尼龙膜过滤后上样洗脱测定。通过不同浓度下标准辅酶Q10的对应峰面积绘制标准曲线,辅酶Q10质量浓度范围为5~100 μg/mL。
1.3.6 储藏稳定性
3种辅酶Q10-NLCs经常温储藏28 d,观察其外观变化,并测定粒径、PDI以及zeta电位,比较储藏前后的变化,评估NLCs的稳定性,测定方法同1.3.3节。
1.3.7 体外消化特性
1.3.7.1 模拟体外消化
依据BRODKORB等[16]的方法,制备模拟口腔液(simulated oral fluid,SSF)、模拟胃液(simulated gastric fluid,SGF)和模拟肠液(simulated intestinal fluid,SIF),并对样品进行体外静态消化模拟。模拟体外消化过程中,消化液处于37 ℃,且所有溶液在使用前进行预热,避免温度波动。
口腔阶段:首先,将2 mL辅酶Q10-NLCs中加入3 mL水,稀释至5 mL。然后,按照体积比1∶1加入含有3.75 mg/mL黏蛋白的SSF,调节pH值至6.8。最后,置于恒温水浴摇床中在37 ℃,100 r/min的条件下孵育2 min。
胃阶段:口腔结束后,按照体积比1∶1加入含有胃蛋白酶的SGF,调节pH值至3.0,然后,在与口腔消化同样条件下孵育2 h。其中,胃蛋白酶的添加量以其在最终胃消化混合液中活力达到2 000 U/mL为标准。
小肠阶段:将从胃阶段获得的混合液体与含有胰蛋白酶、胰脂肪酶和10 mmol/L胆盐的SIF以体积比1∶1混合,调节pH值至7.0,在相同条件下孵育2 h。同时,使用自动滴定装置模拟肠道pH稳定的状态。其中,胰蛋白酶和胰脂肪酶的添加量分别以其在肠消化混合液中活力达到100 U/mL和2 000 U/mL为标准。
1.3.7.2 游离脂肪酸释放
在模拟肠道消化过程中,使用自动电位滴定仪测定游离脂肪酸(free fatty acids,FFA)的释放。在37 ℃条件下,自动电位滴定仪通过滴加0.1 mol/L NaOH溶液与释放出的脂肪酸中和,始终稳定消化液pH值在7.0左右。FFA由消耗NaOH的体积进行定量,假设1分子甘油三酯被脂肪酶水解成1个单酰基甘油和2个FFA。FFA的释放量根据公式(2)计算:
FFA释放量![]()
(2)
式中:CNaOH,NaOH的摩尔浓度,mol/L;VNaOH,中和游离脂肪酸消耗NaOH的总体积,L;MLipid,脂质的摩尔质量,g/mol;mLipid,样品中脂质的总质量,g。
1.3.7.3 生物可接受率
模拟体外消化结束后,取消化液在4 ℃,15 000 r/min下离心30 min,取中间胶束层。使用无水乙醇分别对未消化的NLCs和胶束层破乳和稀释,然后,对辅酶Q10进行定量分析,测定方法同1.3.4节。辅酶Q10的生物可接受率通过公式(3)进行计算:
生物可接受率![]()
(3)
式中:CInitial,模拟消化系统中辅酶Q10的初始含量,mol/L;CMicelle,胶束层中辅酶Q10的含量,mol/L。
1.3.8 数据统计与分析
所有实验重复3次,实验数据以“平均值±标准偏差”表示,并使用SPSS 24.0软件进行分析。采用独立样本t检验两个均值之间的差异;比较两个以上均值时,采用单因素方差分析(ANOVA),多重比较进行检验。差异在P<0.05时被认为具有统计学显著性。
2 结果与分析
2.1 理化性质分析
如图1-a所示,从外观上看,3种不同固液脂质比例的辅酶Q10-NLCs无明显差异,均表现为黄色均一的液体。采用透射电镜观察辅酶Q10-NLCs微观结构,如图1-b所示,NLCs的粒径均在100~300 nm,且随着固体脂质比例的下降,NLCs从不规则的多边形颗粒逐渐转变为完美的球形颗粒,这与SAUPE等[17]的发现一致,脂质相中晶体的结晶度影响着NLCs的大小和形状。
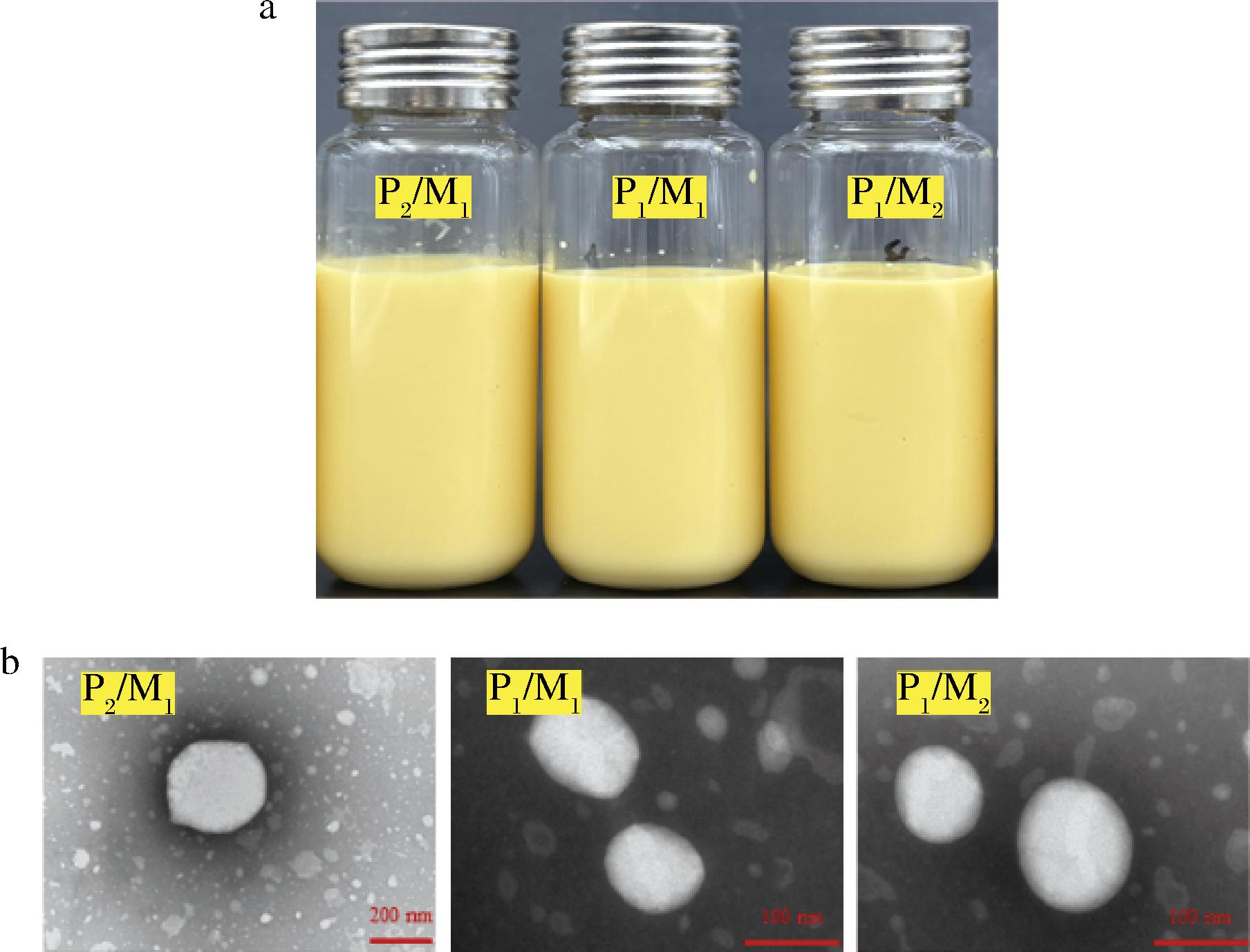
a-表观图;b-微观结构
图1 辅酶Q10纳米结构脂质载体的表观图和微观结构
Fig.1 Apparent image and microstructure of coenzyme Q10 nanostructured lipid carriers
平均粒径、PDI以及zeta电位是纳米分散体的关键特性,决定了其物理稳定性、释放速率以及化学稳定性等。如图2-a所示,随着固体脂质与液体脂质比例的下降,NLCs的平均粒径逐渐减小,依次为(237.3±3.2)、(205.9±2.6)、(186.9±1.6) nm,这与微观结构(图1-b)中观察到的结果相符;另外,PDI与平均粒径呈现同样的趋势,这意味着随着粒径的降低,NLCs的粒度分布尺寸范围也越窄。HU等[18]发现,液态脂质的加入可以降低脂质相的黏度和表面张力,进而导致载体颗粒的粒径和PDI减小。如图2-b所示,所有NLCs的电位均在-50~-30 mV,载体颗粒之间具有较强的静电排斥力,表明体系具有良好的物理稳定性[10]。同时,随着液态脂质含量的增加,NLCs的zeta电位逐渐下降,这说明脂质相的变化导致NLCs表面发生了变化,与SAKELLARI等[19]的研究结果一致。
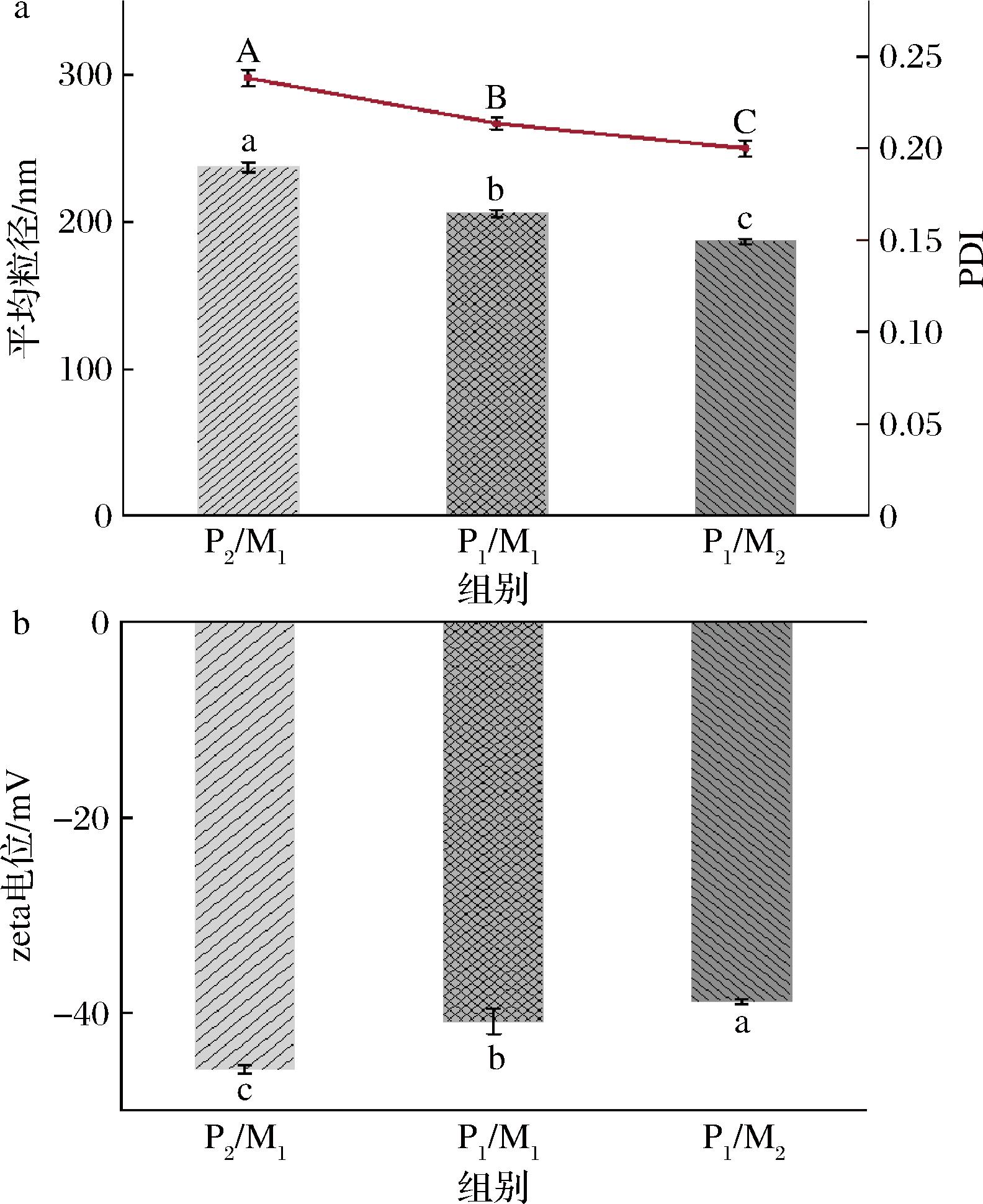
a-平均粒径和PDI;b-zeta电位
图2 辅酶Q10纳米结构脂质载体的平均粒径、PDI以及zeta电位
Fig.2 Average size, PDI, and zeta potential of coenzyme Q10 nanostructured lipid carriers
注:不同字母表示差异显著(P<0.05)(下同)。
2.2 DSC分析
为了表征辅酶Q10-NLCs的多态性和结晶度,对棕榈油、辅酶Q10原料以及几种NLCs进行了DSC分析。如图3所示,棕榈油和辅酶Q10的DSC曲线分别在53.5 ℃和51.1 ℃时出现明显的吸热峰,即这两个温度分别对应为各自的熔点。与原材料相比,NLCs中棕榈油和辅酶Q10的熔化温度均明显低于其熔点,这主要是由于包埋后晶体尺寸从微米级转变为纳米级,尺寸的减小和比表面积的增加导致熔化温度降低[20]。另外,MCT的掺入使棕榈油和辅酶Q10易形成熔点较低的亚稳态晶型[21],以及随着MCT的增加导致脂质载体颗粒尺寸的降低,进而造成两种晶体熔化温度呈现下降的趋势。在P2/M1和P1/M1中,辅酶Q10的熔化温度发生了显著性的下降,变化超过10 ℃,根据对其结构的研究[10],这可能是棕榈油晶体形成的纳米室,使辅酶Q10晶体进一步减小;然而,P1/M2中辅酶Q10未发生明显的吸热峰,这说明辅酶Q10溶解在脂质相中,可能是MCT比例的进一步增加,使冷却至室温后辅酶Q10处于过冷熔融态、无定形或分子分散状态[22]。
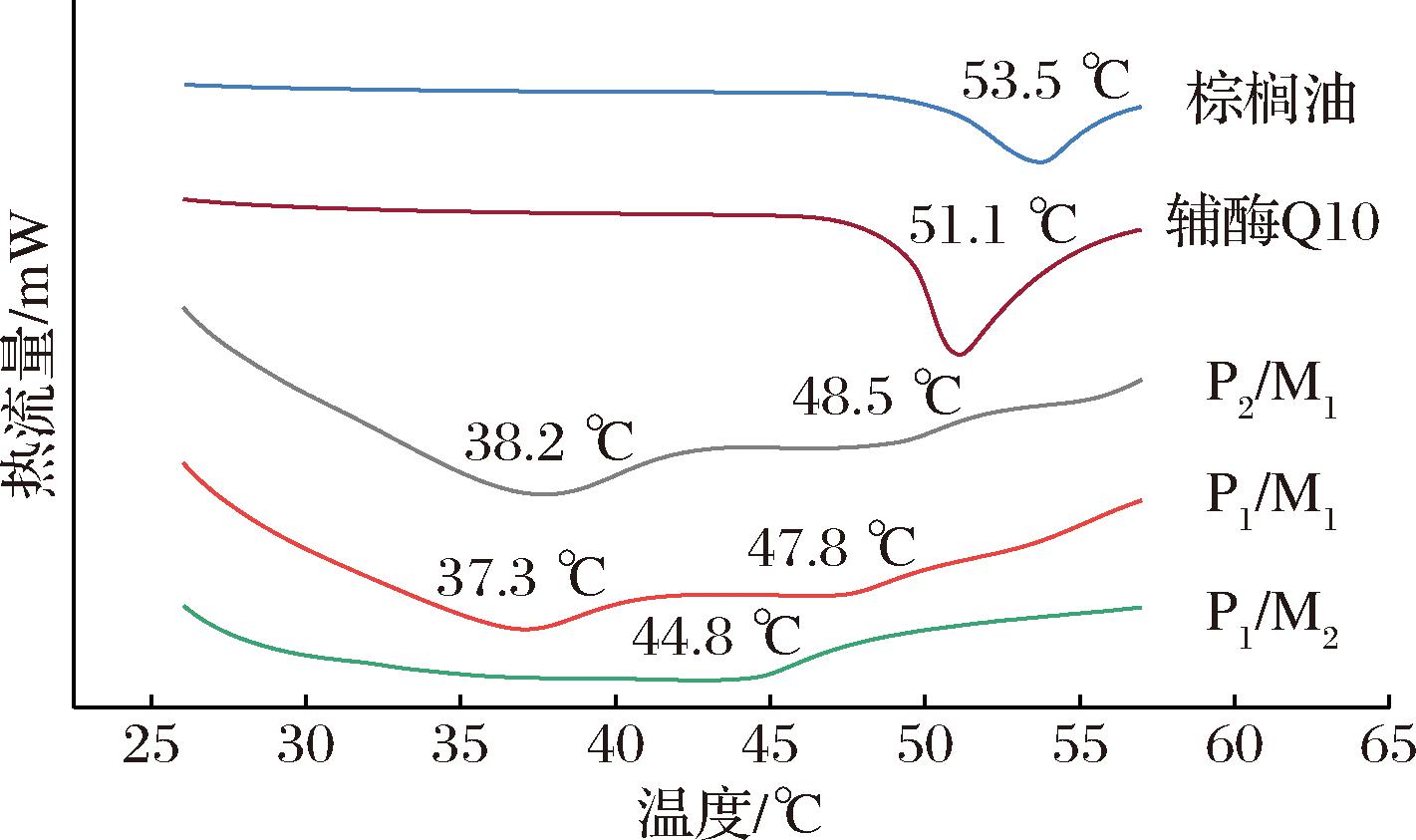
图3 棕榈油与辅酶Q10原料、纳米结构脂质载体的熔化曲线
Fig.3 Melting curves of palm oil and coenzyme Q10 raw materials, nanostructured lipid carriers
2.3 包封率分析
为研究脂质相变化对辅酶Q10-NLCs的负载能力的影响,对辅酶Q10包封效果进行测定。测定结果发现(图4),所有NLCs对辅酶Q10的包封率在95%以上,均表现出良好的负载能力,且NLCs的封装能力没有随脂质相的改变发生显著性变化,这得益于自身载体中晶体结构形成的纳米室,增加了负载空间[9],以及辅酶Q10的脂溶性使其与脂质相之间表现出高亲和力,减少了排斥作用。另外,大多数亲脂性药物在液态油中的溶解性优于固体脂质。JENNING等[23]的研究中,比较SLNs和NLCs的对脂溶性药物的包封效果时,NLCs显示出比SLNs更高的载药量和包封效率。
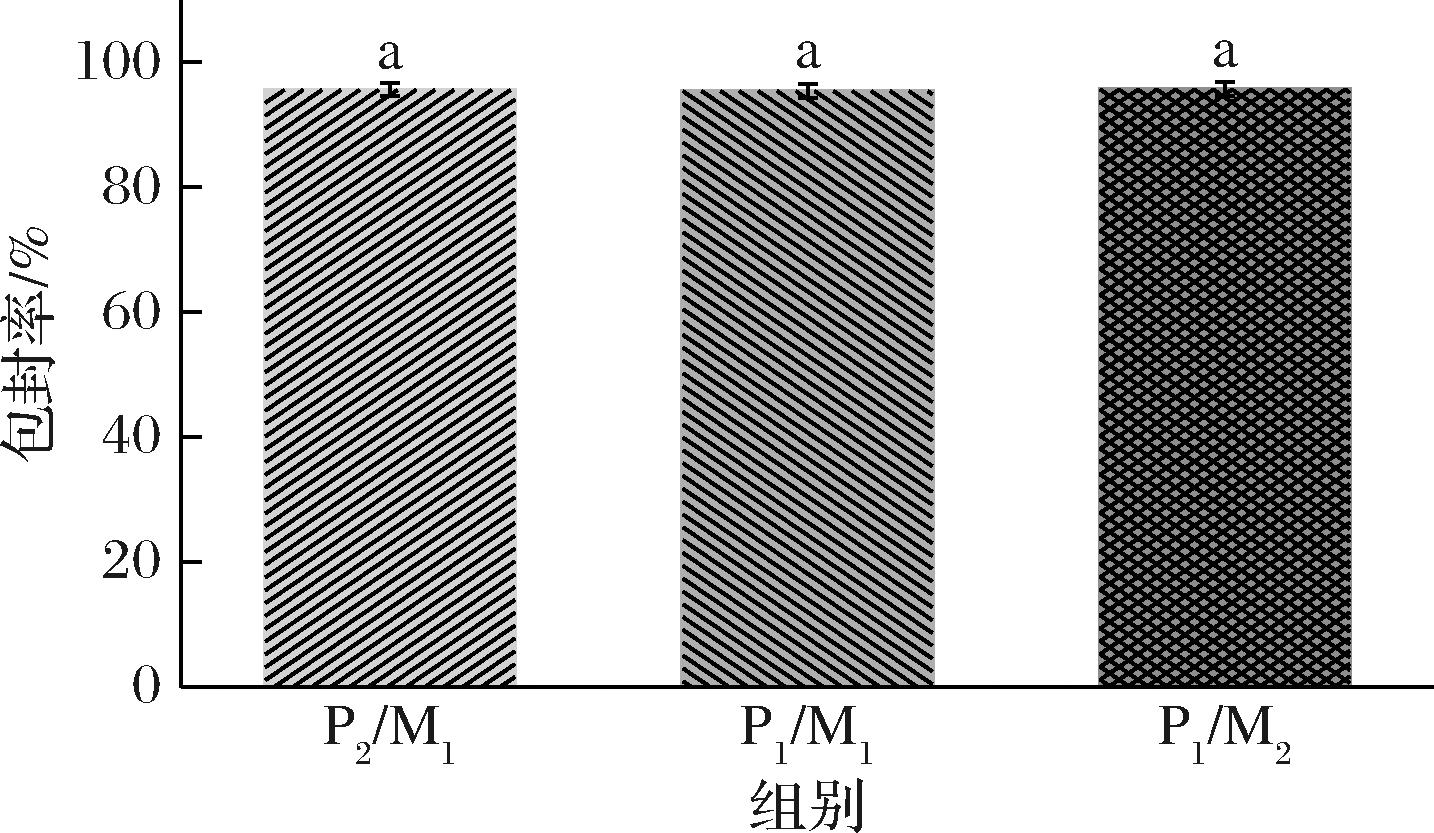
图4 辅酶Q10纳米结构脂质载体的包封率
Fig.4 Encapsulation efficiency of coenzyme Q10 nanostructured lipid carriers
2.4 储藏稳定性分析
通过将辅酶Q10-NLCs常温放置28 d后,测定粒径、PDI以及zeta电位来评估其储藏稳定性。如图5所示,储藏28 d后,P2/M1和P1/M2在外观上出现不同程度的颗粒聚集,且随着脂质相中固态脂质比例的上升,程度加深;经测定发现(表1),储藏后的平均粒径发生显著上升(P<0.05),而PDI略有上升,zeta电位绝对值略有下降,这些数值均发生不稳定的趋势变化。与之相反,P1/M2对应的脂质载体颗粒在外观及3种测定参数均表现出良好的物理稳定性。基于已有的研究发现[19],脂质相中固体脂质的比例较高,晶体数量越多,在储藏过程中易发生老化现象,导致严重的物理性质不稳定。
表1 辅酶Q10纳米结构脂质载体常温储藏28 d前后的平均粒径、PDI和zeta电位
Table 1 Average size, PDI, and zeta potential of coenzyme Q10 nanostructured lipid carriers before and after 28 days of storage at room temperature
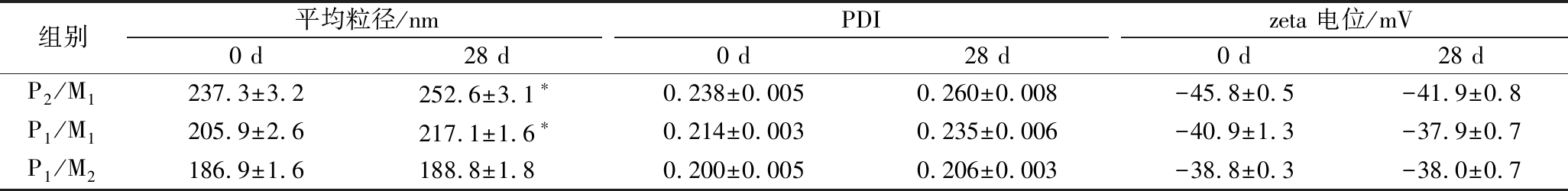
注:*代表两者具有显著性差异(P<0.05)。
组别平均粒径/nmPDIzeta 电位/mV0 d28 d0 d28 d0 d28 dP2/M1237.3±3.2252.6±3.1∗0.238±0.0050.260±0.008-45.8±0.5-41.9±0.8P1/M1205.9±2.6217.1±1.6∗0.214±0.0030.235±0.006-40.9±1.3-37.9±0.7P1/M2186.9±1.6188.8±1.80.200±0.0050.206±0.003-38.8±0.3-38.0±0.7

图5 辅酶Q10纳米结构脂质载体常温储藏28 d后的表观图
Fig.5 Apparent image of coenzyme Q10 nanostructured lipid carriers after 28 days of storage at room temperature
2.5 体外消化特性分析
目前,市面上常见的辅酶Q10产品为晶体-油悬浮液剂型,因此,将辅酶Q10-MCT悬浮液作为对照模拟体外消化,评估几种NLCs对辅酶Q10的递送潜力。如图6所示,在外观上除辅酶Q10-MCT悬浮液表面存在未消化的油脂,NLCs在消化结束后均表现为黄色均一的液体。经离心后,消化液发生了显著性变化,中间胶束层的颜色呈现不同的深度。“胶束”是脂质系统在吸收前的中间消化产物,由胆盐等包埋形成,通常默认该形式下的疏水性物质可被人体直接吸收[24],故辅酶Q10在胶束层的浓度大小决定着其生物可接受率。经测定(图7-a),辅酶Q10的生物可接受率具有显著性差异(P<0.05),依次为(10.4±1.9)%、(32.5±2.5)%、(46.4±2.0)%、(72.1±2.5)%,测定结果与颜色趋势成正比。其中,P1/M2中辅酶Q10生物可接受率达到(72.1±2.5)%,远高于辅酶Q10-MCT悬浮液和其他NLCs。

图6 辅酶Q10纳米结构脂质载体的体外消化外观图
Fig.6 Apparent image of in vitro digestion of coenzyme Q10 nanostructured lipid carriers

a-生物可接受率;b-FFA释放曲线
图7 辅酶Q10纳米结构脂质载体的生物可接受率和FFA释放曲线
Fig.7 Bioaccessibility and FFA release curves of coenzyme Q10 nanostructured lipid carriers
消化液离心后发现,辅酶Q10-MCT悬浮液对应消化液中存在大量辅酶Q10晶体沉于底部,这主要是由于辅酶Q10原料的多晶型及其低溶解度[25],在模拟体温37 ℃下仅有极少部分溶解在MCT中,导致辅酶Q10的生物可接受率低;另外,在酶解消化MCT脂质的过程中辅酶Q10转化为胶束形式,但油悬浮液比表面积小,消化速率低,最终仅有30%左右的脂肪酸得到释放(图7-b)。因此,对于市面上该类辅酶Q10产品,即使有较高的摄入量,晶体形式却严重限制了其生物可接受率。
在P2/M1和P1/M1中,大量辅酶Q10依旧被包埋在NLCs中随离心分离到上层消化液,且下层未发现晶体沉淀,造成该现象的原因可能是这两种NLCs的稳定性较差,在消化过程中对pH或离子不稳定发生聚集,以及脂质相中较高的结晶度,导致消化酶酶解困难,辅酶Q10胶束转化率差,结合对应的脂肪酸释放曲线(图7-b)也能看出,FFA的释放率随棕榈油占比的上升而下降;因此,对于结晶度适中的P1/M2,辅酶Q10以非晶态形式存在,并在模拟消化过程中缓慢释放辅酶Q10,协调胶束转化速率,最终在消化结束时获得最高的生物可接受率。
3 结论与讨论
本研究以改变脂质相实现对辅酶Q10晶体修饰,通过制备不同脂质相的辅酶Q10-NLCs,表征其理化性质和脂质相晶体结构,探究脂质相对载体稳定性和辅酶Q10递送的影响。结果表明,所有NLCs均表现出良好的包埋效率和负载能力,但固液油脂比例决定了脂质相的结晶度,进而影响了NLCs的稳定性。随着MCT液态油的掺入,脂质相结晶度下降,物理稳定性及消化稳定性显著增强。与此同时,脂质相的结晶度影响着辅酶Q10晶体形态和消化特性。其中,P1/M2在储藏稳定性、释放特性以及晶体修饰等方面表现较佳,在模拟体外消化过程中生物可接受率达到(72.1±2.5)%。因此,本研究为辅酶Q10的递送提供了新的数据支持,并为开发脂溶性活性成分高负载及高生物可接受率的功能产品提供了一定的思路。
[1] HARGREAVES I P.Coenzyme Q10 in mitochondrial and lysosomal disorders[J].Journal of Clinical Medicine, 2021, 10(9):1970.
[2] MANTLE D, HEATON R A, HARGREAVES I P.Coenzyme Q10, ageing and the nervous system:An overview[J].Antioxidants, 2021, 11(1):2.
[3] GASMI A, BJØRKLUND G, MUJAWDIYA P K, et al.Coenzyme Q(10) in aging and disease[J].Critical Reviews in Food Science and Nutrition, 2024, 64(12):3907-3919.
[4] NAVAS P, CASCAJO M V, ALC ZAR-FABRA M, et al.Secondary CoQ10 deficiency, bioenergetics unbalance in disease and aging[J].BioFactors, 2021, 47(4):551-569.
ZAR-FABRA M, et al.Secondary CoQ10 deficiency, bioenergetics unbalance in disease and aging[J].BioFactors, 2021, 47(4):551-569.
[5] JUDY W V.The single-dose absorption of different CoQ10 product types into the lymph compared to that transported to the blood[J].Integrative Medicine, 2022, 21(5):30-35.
[6] MANTLE D, LOPEZ-LLUCH G, HARGREAVES I P.Coenzyme Q10 metabolism:A review of unresolved issues[J].International Journal of Molecular Sciences, 2023, 24(3):2585.
[7] MANTLE D, DYBRING A.Bioavailability of coenzyme Q(10):An overview of the absorption process and subsequent metabolism[J].Antioxidants, 2020, 9(5):386.
[8] BAN C, JO M, PARK Y H, et al.Enhancing the oral bioavailability of curcumin using solid lipid nanoparticles[J].Food Chemistry, 2020, 302:125328.
[9] DAS S, NG W K, TAN R B H.Are nanostructured lipid carriers (NLCs) better than solid lipid nanoparticles (SLNs):Development, characterizations and comparative evaluations of clotrimazole-loaded SLNs and NLCs?[J].European Journal of Pharmaceutical Sciences, 2012, 47(1):139-151.
[10] VIEGAS C, PATR CIO A B, PRATA J M, et al.Solid lipid nanoparticles vs.nanostructured lipid carriers:A comparative review[J].Pharmaceutics, 2023, 15(6):1593.
CIO A B, PRATA J M, et al.Solid lipid nanoparticles vs.nanostructured lipid carriers:A comparative review[J].Pharmaceutics, 2023, 15(6):1593.
[11] JUNYAPRASERT V B, TEERANACHAIDEEKUL V, SOUTO E B, et al.Q10-loaded NLC versus nanoemulsions:Stability, rheology and in vitro skin permeation[J].International Journal of Pharmaceutics, 2009, 377(1-2):207-214.
[12] CHEN S, GAO Y X.Nano delivery vehicles of coenzyme Q10 based on biomacromolecule:A review[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(1).
[13] MACIEJEWSKA-STUPSKA K, CZARNECKA K, SZYMA SKI P.Bioavailability enhancement of coenzyme Q10:An update of novel approaches[J].Archiv der Pharmazie, 2024, 357(8):2300676.
SKI P.Bioavailability enhancement of coenzyme Q10:An update of novel approaches[J].Archiv der Pharmazie, 2024, 357(8):2300676.
[14] VARSHOSAZ J, GHASSAMI E, AHMADIPOUR S.Crystal engineering for enhanced solubility and bioavailability of poorly soluble drugs[J].Current Pharmaceutical Design, 2018, 24(21):2473-2496.
[15] 李喆, 邓英杰, 王秀敏, 等.HPLC法测定辅酶Q10脂质体包封率[J].药物分析杂志, 2006, 26(2):149-151.LI Z, DENG Y J, WANG X M, et al.HPLC determination of entrapment efficiency of coenzyme Q10 liposome[J].Chinese Journal of Pharmaceutical Analysis, 2006, 26(2):149-151.
[16] BRODKORB A, EGGER L, ALMINGER M, et al.INFOGEST static in vitro simulation of gastrointestinal food digestion[J].Nature Protocols, 2019, 14(4):991-1014.
[17] SAUPE A, GORDON K C, RADES T.Structural investigations on nanoemulsions, solid lipid nanoparticles and nanostructured lipid carriers by cryo-field emission scanning electron microscopy and Raman spectroscopy[J].International Journal of Pharmaceutics, 2006, 314(1):56-62.
[18] HU F Q, JIANG S P, DU Y Z, et al.Preparation and characterization of stearic acid nanostructured lipid carriers by solvent diffusion method in an aqueous system[J].Colloids and Surfaces B:Biointerfaces, 2005, 45(3-4):167-173.
[19] SAKELLARI G I, ZAFEIRI I, BATCHELOR H, et al.Formulation design, production and characterisation of solid lipid nanoparticles (SLN) and nanostructured lipid carriers (NLC) for the encapsulation of a model hydrophobic active[J].Food Hydrocolloids for Health, 2021, 1:100024.
[20] PEREZ M.Gibbs-Thomson effects in phase transformations[J].Scripta Materialia, 2005, 52(8):709-712.
[21] JENNING V, SCH FER-KORTING M, GOHLA S.Vitamin A-loaded solid lipid nanoparticles for topical use:Drug release properties[J].Journal of Controlled Release, 2000, 66(2-3):115-126.
FER-KORTING M, GOHLA S.Vitamin A-loaded solid lipid nanoparticles for topical use:Drug release properties[J].Journal of Controlled Release, 2000, 66(2-3):115-126.
[22] TEERANACHAIDEEKUL V, SOUTO E B, JUNYAPRASERT V B, et al.Cetyl palmitate-based NLC for topical delivery of Coenzyme Q10-Development, physicochemical characterization and in vitro release studies[J].European Journal of Pharmaceutics and Biopharmaceutics, 2007, 67(1):141-148.
[23] JENNING V, GOHLA S H.Encapsulation of retinoids in solid lipid nanoparticles (SLN)[J].Journal of Microencapsulation, 2001, 18(2):149-158.
[24] FAUBEL N, CILLA A, ALEGR A A, et al.Overview of in vitro digestion methods to evaluate bioaccessibility of lipophilic compounds in foods[J].Food Reviews International, 2023, 39(9):7126-7147.
A A, et al.Overview of in vitro digestion methods to evaluate bioaccessibility of lipophilic compounds in foods[J].Food Reviews International, 2023, 39(9):7126-7147.
[25] 段鹏杰, 罗濛, 姜同英, 等.辅酶Q10的溶解度测定及稳定性考察[J].中国药剂学杂志(网络版), 2008, 6(6):370-376.DUAN P J, LUO M, JIANG T Y, et al.Investigation of basic physico-chemical properties of coenzyme Q10[J].Chinese Journal of Pharmaceutics, 2008, 6(6):370-376.