紫薯,又名紫甘薯,除含有普通甘薯的营养成分外,还富含花青素、绿原酸等功能性成分[1],具有可观的经济价值。花青素和绿原酸作为紫薯中主要活性成分其含量随品种而异,大致范围分别为1.75~3.36 mg/g FW[2]、26.51~28.72 mg/g DW[3],研究报道它们均具有一定的降糖功效[4-6],但其性质极不稳定,在贮藏和加工过程中易受到温度、O2、pH等影响而发生变化[7-8],导致其生物利用度不高。随着人们对于天然活性物质的研究日益深入,微胶囊技术可使被包埋物质与外界环境隔绝开来,在特定条件下才被释放,极大程度上保护了活性物质,提高了其在食品中应用的稳定性[9]。目前对于紫薯活性成分探究比较单一,大都集中在花青素提取和纯化技术探讨,或将其制备成微胶囊,提高其稳定性等方面[10-13],而紫薯中其他活性成分,如绿原酸亦有抗氧化、降血糖的功效却被摒弃,这限制了紫薯中活性成分利用的最大化。
本实验以新鲜紫薯为原料对其活性成分进行粗提及共包埋,制备紫薯粗提物微胶囊(purple sweet potato crude extract microcapsules,PPEM),探讨微胶囊包埋对紫薯粗提物相关特性的影响,旨在提高紫薯活性成分的稳定性和生物活性,为紫薯中有效降糖活性物质以及类似植物化学物的开发利用提供一定参考。
1 材料与方法
1.1 试验试剂
新鲜紫薯,成都市郫县红光沃尔玛超市;麦芽糊精(maltodextrin,MD),山东西王糖业有限公司;无水CaCl2、KBr,国药集团化学试剂有限公司;阿拉伯胶(gum arabic,GA),杭州普罗星淀粉有限公司;柠檬酸-柠檬酸钠缓冲液(pH 3.0)、柠檬酸-柠檬酸钠缓冲液(pH 1.0)、醋酸-醋酸钠缓冲液(pH 4.5)、PBS(pH 6.8)、绿原酸标准品、α-葡萄糖苷酶(100 U/g)、α-淀粉酶(4 000 U/g)、对硝基苯基-α-D-吡喃葡萄糖苷(4-nitrophenyl α-D-glucopyranoside,PNPG),上海源叶生物科技有限公司;无水乙醇、DPPH、ABTS、KMnO4、DNS、FeSO4,均为分析纯,成都市科龙化工试剂厂。
1.2 试验设备
78HW-1恒温磁力搅拌器,金坛市恒丰仪器制造有限公司;TP-214电子分析天平,北京赛多利斯仪器有限公司;TG-17台式高速离心机,四川蜀科仪器有限公司;HBS-ScanX全波长酶标分析仪,南京德铁实验设备有限公司;SB-5200 dTN超声清洗机,宁波新芝生物科技股份有限公司;FDU-120真空冷冻干燥机,上海爱朗仪器有限公司装置;SHZ-D(Ⅲ)循环水式真空泵,巩义市子华仪器有限公司;Nicolet iS50傅里叶变换红外光谱仪(Fourier transform infrared spectroscopy,FTIR),上海力晶科学仪器有限公司;Sigma360扫描电子显微镜(scanning electron microscope,SEM),卡尔˙蔡司股份有限公司;Rigaku Ultima IV型X射线多晶衍射仪(X-ray diffraction,XRD),苏州科鲁斯特测控科技有限公司;1900岛津双光束紫外分光光度计、RF-6000多波长荧光分光光度计,日本岛津中国分公司。
1.3 实验方法
1.3.1 PPEM芯材的制备
紫薯去皮洗净切块→真空冷冻干燥→研磨过筛(80目)→加入提取剂后超声波提取→抽滤→滤液→78 ℃旋蒸浓缩至乙醇蒸发完毕→芯材浓缩液
参考李辰等[14]的方法并经过预实验确定提取工艺最佳参数为:提取剂为质量分数60%的酸化乙醇溶液(pH 1.0)、料液比1∶15(g∶mL)、超声波时间45 min、超声波温度50 ℃。
芯材浓缩液预冻后转移至冻干机中干燥48 h,取出研磨后过60目筛,即可得到紫薯粗提物粉末。
1.3.2 PPEM制备方法
参考冯志强等[15]、唐榕[16]的方法并稍作修改,经过预实验确定最佳工艺为:芯材与未溶解的复合壁材(MD∶GA=5.5∶4.5,质量比)以壁芯比(9.5∶100,质量比)的比例放入恒温为57 ℃磁力搅拌器中搅拌1 h,即可获得微胶囊溶液,预冻后转移至冻干机中干燥48 h,取出研磨后过60目筛,即可得到PPEM粉末。
1.3.3 PPEM包埋率的测定
参考宛美志[17]的方法测定PPEM中花青素和绿原酸的包埋率,以总包埋率为指标(根据前期实验结果采用自主赋权,花青素包埋率权重为0.6、绿原酸包埋率权重为0.4)。紫薯微胶囊中以及表面的花青素的含量测定参考pH示差法[18],绿原酸的含量测定参考郭蒙等[19]的方法。计算如公式(1)~公式(5)所示:
花青素包埋率![]()
(1)
式中:m1,微胶囊总花青素质量,mg;m2,微胶囊表面花青素质量,mg。
绿原酸包埋率![]()
(2)
式中:m3,微胶囊总绿原酸质量,mg;m4,微胶囊表面绿原酸质量,mg。
ΔA=(A530-A700)pH1.0-(A530-A700)pH4.5
(3)
花青素质量![]()
(4)
式中:V,样品溶液总体积,mL;F,稀释倍数;M,矢车菊-3-葡萄糖苷的相对分子质量,449.2 Da;ξ,矢车菊-3-葡萄糖苷的摩尔消光系数,29 600。
绿原酸质量/mg=cNV
(5)
式中:c,绿原酸质量浓度,mg/mL;N,稀释倍数;V,样品溶液总体积,mL。
1.3.4 PPEM的理化特性和表征
1.3.4.1 水分含量测定
采用GB/T 5009.3—2016《食品安全国家标准 食品中水分的测定》中的直接干燥法。
1.3.4.2 溶解度测定
根据邓微[20]的方稍作修改。在30 ℃的10 mL蒸馏水中加入0.1 g样品粉末并磁力搅拌30 min。将悬浮液在8 000 r/min下离心10 min,收集上清液并在105 ℃下干燥24 h。溶解度表示干燥后固体粉末质量与干燥前粉末质量的百分比。溶解度按公式(6)计算:
溶解度![]()
(6)
式中:m1,称量皿质量,g;m2,称量皿与不溶物总质量,g;X,样品含水率,%;m3,样品质量,g。
1.3.4.3 密度测定
堆积密度是指粉状或散粒状材料在堆积状态下,单位体积的质量[21]。微胶囊粉末的密度以堆密度表示,按公式(7)计算:
堆密度![]()
(7)
式中:m,样品质量,g;V,样品的堆积体积,cm3。
1.3.4.4 微观形貌
参考王影[22]的方法,用SEM表征PPEM微观形貌。取适量微胶囊分散在电镜导电胶上,喷金处理,然后在工作电压10 kV,分别放大倍数500、2 000倍下观察形态。
1.3.4.5 FTIR测定
参考陈湘粤[23]的方法,取少量MD、GA、紫薯粗提物、PPEM与KBr混合,研磨压片,置于FTIR室中进行扫描后获得FTIR数据。测试条件为:扫描范围4 000~500 cm-1,光谱分辨率1 cm-1,扫描次数64次。
1.3.4.6 XRD测定
参考张玉荣等[24]的方法并稍作修改,将MD、GA、PPEM平铺于样品板中,获得无裂纹的平坦表面。以Cu-Kα射线作为激发源,采用XRD测定样品的结晶度。参数设置:电压30 kV,电流20 mA,衍射角范围5~50°,扫描速度5°/min。
1.3.5 PPEM的贮藏稳定性
参考卢钏燚等[25]的方法并稍作修改,分别称取0.1 g紫薯粗提物、PPEM(每种样品共6袋)装入铝箔自封袋,室温避光条件下储存90 d,每隔15 d取出1袋,2种样品的花青素和绿原酸的保留率按照公式(7)、公式(8)分别计算,其中,花青素和绿原酸质量的计算见公式(4)和公式(5)。
花青素保留率![]()
(8)
式中:BH1,处理前产品中总花青素质量,mg;BH2,处理后产品中总花青素质量,mg。
绿原酸保留率![]()
(9)
式中:BL1,处理前产品中总绿原酸质量,mg;BL2,处理后产品中总绿原酸质量,mg。
1.3.6 PPEM的抗氧化活性研究
1.3.6.1 DPPH自由基清除能力
参考逄金鑫等[26]的方法并稍作修改。DPPH溶液现配现用,在试管中加入2 mL 0.1 mmol/L 的DPPH溶液和不同浓度的PPEM溶液,混匀,放置0.5 h后在517 nm处测吸光度A0;混合2 mL DPPH溶液和2 mL无水乙醇,静置0.5 h,测吸光度A1;另取一支试管,加入2 mL PPEM溶液和无水乙醇,静置0.5 h,测吸光度A2。以粗提物为对照,DPPH自由基清除能力按公式(10)计算:
DPPH自由基清除率![]()
(10)
1.3.6.2 ABTS阳离子自由基清除能力
参考张汉辉等[27]的方法并稍作修改。准确吸取ABTS工作液2 mL与25 μL不同质量浓度的PPEM溶液混合摇匀,室温下避光反应6 min,于734 nm下测其吸光度A1,同时用无水乙醇代替样品液作为对照测定吸光度为A0,用蒸馏水代替ABTS工作液作为本底样液,测得吸光度为A2。以粗提物为对照,ABTS阳离子自由基清除能力按公式(11)计算:
ABTS阳离子自由基清除率![]()
(11)
1.3.7 PPEM的体外降糖活性研究
1.3.7.1 PPEM对α-葡萄糖苷酶抑制率测定
参考蒋美龄等[28]的方法并稍作修改。用PNPG法测定PPEM的α-葡萄糖苷酶抑制活性。抑制率按公式(12)计算,α-葡萄糖苷酶抑制活性以半抑制浓度(half inhibitory concentration,IC50)值表示。
α-葡萄糖苷酶抑制率![]()
(12)
式中:A样品,含待测物、PNPG及酶的吸光度;A样品空白,含待测物、PBS及PNPG的吸光度;A对照,含PBS、PNPG及酶的吸光度;A对照空白,含PBS和PNPG的吸光度。
1.3.7.2 PPEM对α-淀粉酶抑制率的测定
参考周婷[29]的方法并稍作修改。采用DNS比色法测定样品的α-淀粉酶抑制活性。抑制率按公式(13)计算,α-淀粉酶抑制活性以IC50值表示。
α-淀粉酶抑制率![]()
(13)
式中:A样品,含PPEM、淀粉溶液及酶液的吸光度;A样品空白,含PPEM、PBS及淀粉溶液的吸光度;A对照,含PBS、淀粉溶液及酶液的吸光度;A对照空白,含PBS和淀粉溶液的吸光度。
1.3.7.3 PPEM对α-葡萄糖苷酶和α-淀粉酶的紫外光谱测定
参考张静等[30]的方法并稍作修改,将4 mL的0.1 U/mL α-葡萄糖苷酶溶液、7 U/mL α-淀粉酶溶液分别与400 μL不同质量浓度(0.6、0.4、0.2、0.1、0.08 mg/mL) 的PPEM溶液混匀进行反应,以粗提物溶液为对照。在200~800 nm范围内进行紫外吸收光谱扫描。
1.3.7.4 PPEM对α-葡萄糖苷酶和α-淀粉酶的荧光光谱测定
参考朋毛德吉[31]的方法并稍作修改,在4 mL的0.1 U/mL α-葡萄糖苷酶溶液、7 U/mLα-淀粉酶溶液分别与400 μL不同质量浓度(0.6、0.4、0.2、0.1、0.08、0 mg/mL)的PPEM溶液,以粗提物溶液为对照。根据浓度0的混合溶液分析研究,在电脑上设置发射波长290 nm,激发波长270 nm,在波长290~500 nm对其扫描。
1.3.8 数据统计与分析
每次测定重复3次取平均值,采用SPSS 26统计软件进行多样本均数比较的方差分析,各组间多重比较采用Duncan’s法,独立样本采用t检验,P<0.05差异有统计学意义。运用Origin 2021软件对数据进行处理绘图。相关性分析采用Pearson相关,P<0.05表示具有显著性。
2 结果与分析
2.1 PPEM的理化性质
含水率和溶解度是衡量微胶囊的重要物理性质,前者对微胶囊的稳定性起着重要作用,而高溶解度的微胶囊具有良好的食品加工特性[32]。从表1可知,粗提物粉末和PPEM产品的含水率分别为4.95%和4.08%,符合GB/T 29602—2013《固体饮料》中水分≤7%的规定,样品的含水率指标良好。较低含水率环境中微生物生长受到抑制,有利于产品贮藏稳定性[33]。其中PPEM的溶解性显著高于粗提物(P<0.05),为92.67%,说明PPEM粉末可以很好地在室温下用水溶解复原,这可能是因为MD和GA具有大量分枝结构,含有较短的链和更多的亲水基团,因此可以容易地与水分子结合,具有一定的助溶性[34]。粉末的堆积密度高,则粉末之间的空气少,活性成分被氧化降解的可能性降低,从而贮藏稳定性提高[35]。PPEM的堆密度显著高于粗提物(P<0.05),因此其贮藏稳定性更高。GA与MD混合形成的复合壁材有良好的成膜性和干燥性能[36],提高了壁材的致密性,使PPEM的总包埋率高达95.68%,该结果与XUE等[37]的报道相似。上述各指标说明壁材对芯材保护的效果良好。
表1 微胶囊的物理性质指标
Table 1 Physical property indicators of microcapsules
注:粗提物为原料无总包埋率指标,故用-表示;不同小写字母代表不同样品相同指标数据差异显著(P<0.05)。
样品含水率/%溶解度/%总包埋率/%堆密度/(g/cm3)粗提物4.95±0.33b84.59±0.78a-0.13±0.56aPPEM4.08±0.01a92.67±0.01b95.68±0.790.28±0.17b
2.2 PPEM的微观结构
样品表面越圆润和光滑,则包埋效率越高、贮藏稳定性也越好[38]。如图1所示,粗提物和PPEM均呈不规则片状结构,这是真空冷冻干燥制品的典型特征。但粗提物结构更疏松,孔洞和破裂多;PPEM整体表现更光滑,没有空洞和碎裂的情况,这与周凯旋[39]得到的结果类似,说明芯材已被壁材全部包裹,与测得PPEM的高包埋率结果一致。本实验制得的PPEM与赵慧芳等[40]及冯志强等[15]使用真空冷冻干燥制备的微胶囊形态类似。

a-紫薯粗提物(500×);b-紫薯粗提物(2 000×);c-PPEM(500×);d-PPEM(2 000×)
图1 不同样品的SEM图像
Fig.1 SEM images of different samples
2.3 PPEM的FTIR分析
FTIR可以显示出各物质的分子结构和具有特征性的化学键,以判断微胶囊是否形成[41]。由图2可知,GA的光谱在3 413 cm-1(O—H伸缩),2 930 cm-1(C—H伸缩),1 613 cm-1(C![]() O伸缩和N—H弯曲),1 141、1 070 cm-1(C—O伸缩),840 cm-1(O—H变形振动)处出现吸收带。在MD光谱中发现了接近1 450 cm-1(C—O伸缩),1 370 cm-1(—CH2伸缩),1 150 cm-1(O—H伸缩)和1 080 cm-1(C—O伸展)的谱带。这与KANG等[42]的结果相似。
O伸缩和N—H弯曲),1 141、1 070 cm-1(C—O伸缩),840 cm-1(O—H变形振动)处出现吸收带。在MD光谱中发现了接近1 450 cm-1(C—O伸缩),1 370 cm-1(—CH2伸缩),1 150 cm-1(O—H伸缩)和1 080 cm-1(C—O伸展)的谱带。这与KANG等[42]的结果相似。
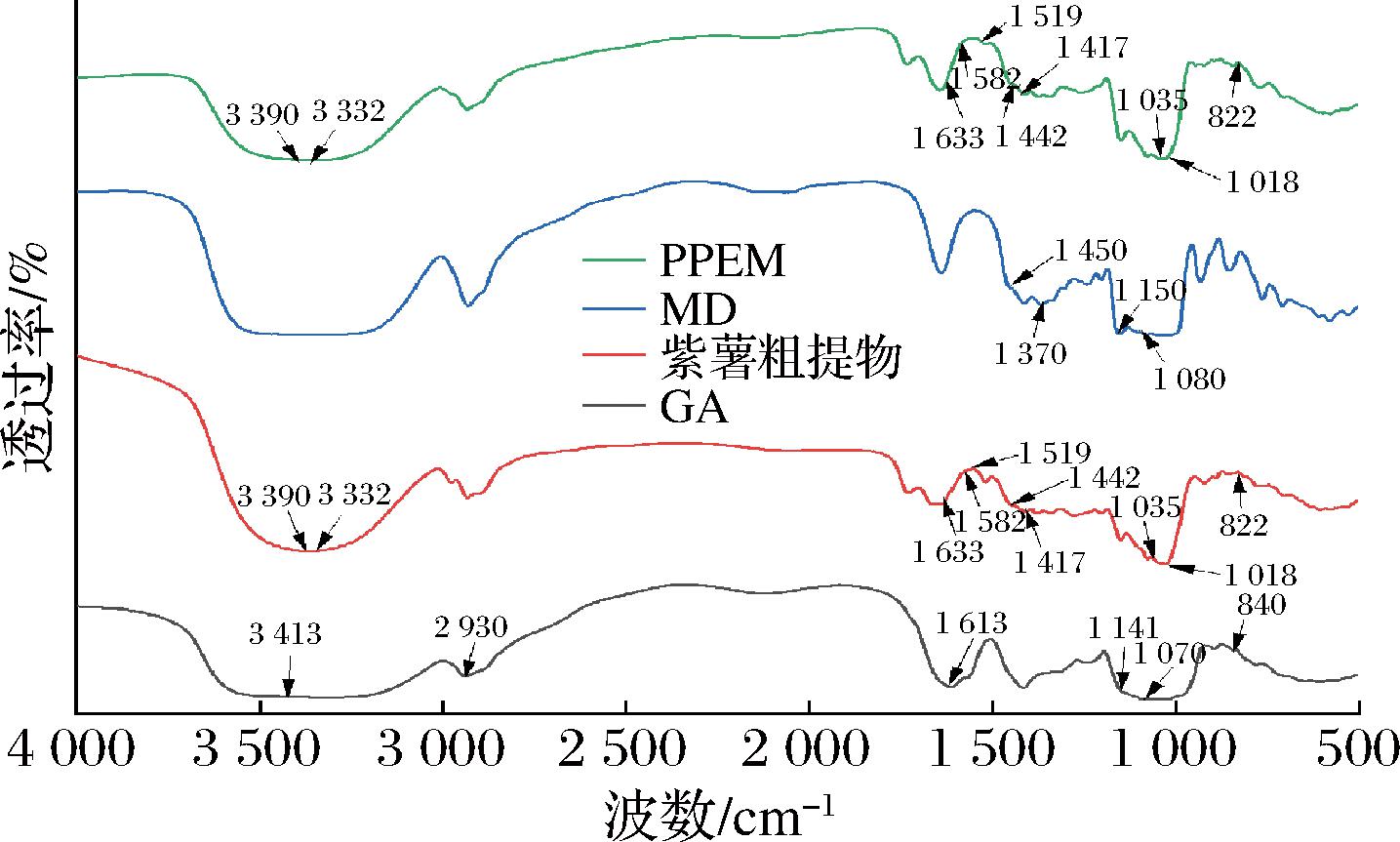
图2 不同样品及壁材的FTIR图谱
Fig.2 FTIR pattern of different samples and wall materials
由图2可知紫薯粗提物在3 332 cm-1处的宽频带吸收峰对应花青素中O—H的伸缩振动,1 633、1 519 和1 442 cm-1处对应花青素中芳香族的C![]() C伸展,属于花青素的特征吸收峰[43],1 035 cm-1处对应C—O键的伸缩振动。在1 582 cm-1波长处也有类似的峰,属于绿原酸等组分的对称和不对称伸缩振动[44]。3 390 cm-1宽吸收峰对应着绿原酸中的N—H的伸缩振动,1 417、1 018 cm-1为绿原酸中的芳环骨架振动吸收峰,而822 cm-1为C—H振动吸收峰[45]。当包埋物形成后,芯材和壁材之间的非共价键,如疏水作用、范德华力和氢键等会减弱,相应基团的吸收强度也会降低[46]。GA与芯材形成微胶囊后GA的酰胺I带出现了偏移,说明GA与芯材存在相互作用,同时相比于GA和MD的1 500~1 600 cm-1,PPEM也出现了相应的偏移,说明壁材和花青素之间存在氢键相互作用[47]。通过比较发现PPEM与紫薯粗提物的图谱基本相同,但在1 519 cm-1和3 390 cm-1处花青素和绿原酸的特征峰强度减弱,并没有出现新的吸收峰,说明紫薯粗提物的吸收峰大多被壁材的碳骨架掩盖,花青素和绿原酸被良好地包埋在MD和GA形成的薄膜中,包埋成功。这与陈程莉等[38]的研究结果相似。
C伸展,属于花青素的特征吸收峰[43],1 035 cm-1处对应C—O键的伸缩振动。在1 582 cm-1波长处也有类似的峰,属于绿原酸等组分的对称和不对称伸缩振动[44]。3 390 cm-1宽吸收峰对应着绿原酸中的N—H的伸缩振动,1 417、1 018 cm-1为绿原酸中的芳环骨架振动吸收峰,而822 cm-1为C—H振动吸收峰[45]。当包埋物形成后,芯材和壁材之间的非共价键,如疏水作用、范德华力和氢键等会减弱,相应基团的吸收强度也会降低[46]。GA与芯材形成微胶囊后GA的酰胺I带出现了偏移,说明GA与芯材存在相互作用,同时相比于GA和MD的1 500~1 600 cm-1,PPEM也出现了相应的偏移,说明壁材和花青素之间存在氢键相互作用[47]。通过比较发现PPEM与紫薯粗提物的图谱基本相同,但在1 519 cm-1和3 390 cm-1处花青素和绿原酸的特征峰强度减弱,并没有出现新的吸收峰,说明紫薯粗提物的吸收峰大多被壁材的碳骨架掩盖,花青素和绿原酸被良好地包埋在MD和GA形成的薄膜中,包埋成功。这与陈程莉等[38]的研究结果相似。
2.4 PPEM的XRD分析
通过XRD图谱分析微胶囊是否具有结晶或无定形结构,可用于判断微胶囊的稳定性[48]。一般来说,晶型结构比无定形结构具有更高的贮藏稳定性[49]。由图3可得,PPEM衍射角(2θ)为20.12°与壁材(18.62°~18.73°)和紫薯粗提物(22.1°)相比特征峰都发生了偏移,表明花青素和绿原酸与壁材成功络合。紫薯粗提物的衍射图形为宽而矮的峰,表明紫薯粗提物存在较多无定形的结构特征。这与代佳琳[50]发现的紫玉米穗轴花色苷的XRD图相同。壁材组表现出较尖锐的衍生峰,说明MD和GA表现为晶态,因其良好的有序状态会产生尖锐且明确的峰[51]。PPEM的衍射图形为一个较宽而高的漫反射峰,表明PPEM中无定型结构较粗提物减少,结晶度增加。同样采用真空冷冻干燥法,TAO等[52]证实蓝莓花色苷被MD和乳清蛋白包埋形成微胶囊粉末也有类似情况。随着紫薯粗提物的添加,PPEM衍生峰宽度介于2种壁材与粗提物之间,表明芯材与壁材发生了相互作用,破坏了MD和GA聚合物分子的紧密堆积,从而引起规则晶体的改变[48]。虽然PPEM与粗提物均含有无定形结构,但PPEM的衍射峰较粗提物的衍射峰更加尖锐,说明PPEM结晶程度大于粗提物,进一步证实了包埋之后活性成分稳定性增强。
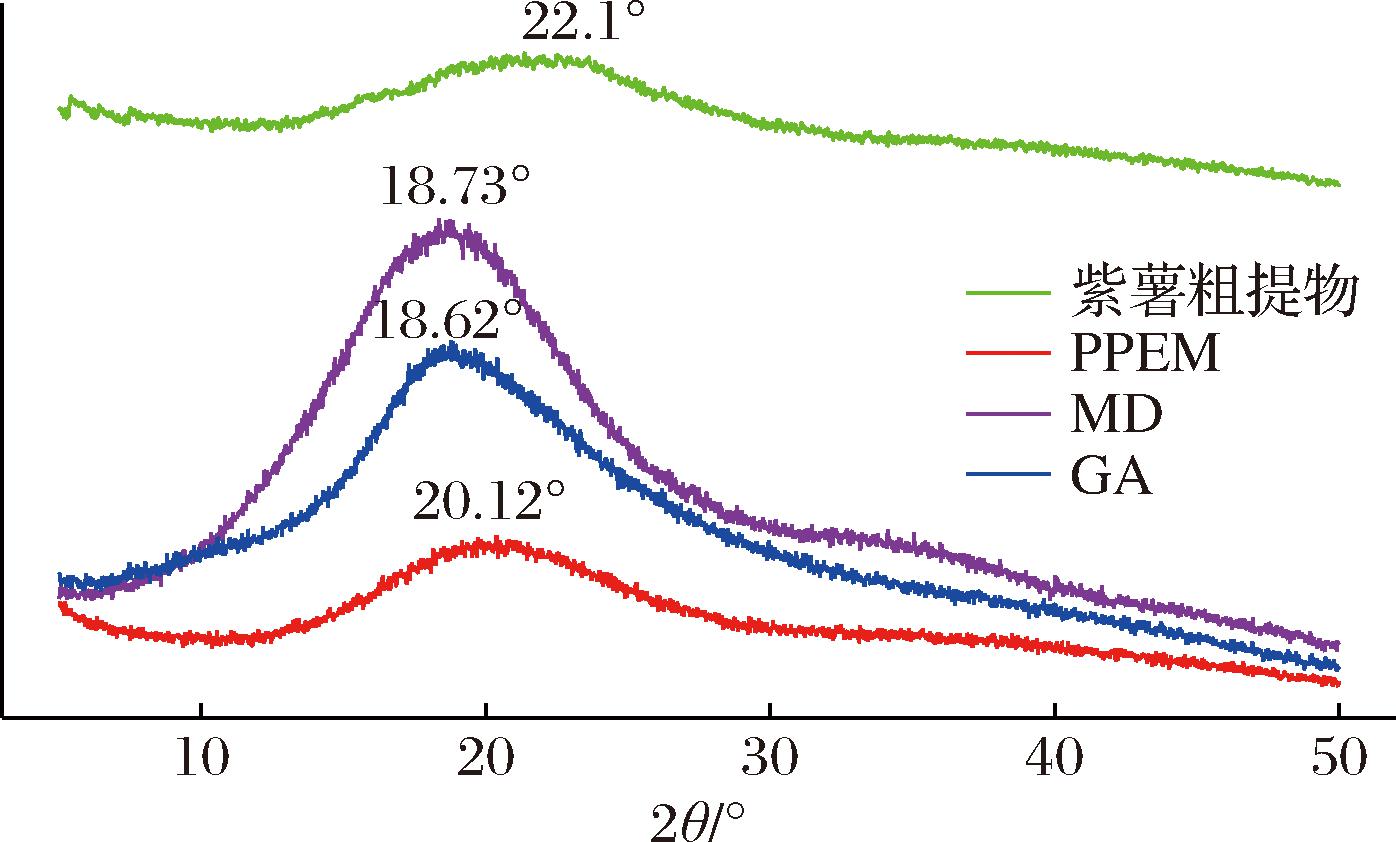
图3 不同样品及壁材的XRD分析图
Fig.3 XRD analysis plots of different samples and wall materials
2.5 PPEM的贮藏稳定性分析
由图4可知,随着贮藏时间的增长,PPEM的花青素和绿原酸保留率虽有所下降,但在相同时间均显著高于粗提物粉末(P<0.05)。这主要是因为随着贮藏期的延长,绿原酸分子结构中的邻二酚羟基会被空气氧化[53],花青素的C位被亲核攻击,也逐渐被氧化[54],导致花青素和绿原酸的质量降低。而微胶囊壁材阻隔了空气等因素与芯材的接触,使易氧化的花青素和绿原酸受到壁材保护[55]。当贮藏期为90 d时,PPEM较粗提物粉末花青素的保留率提高了15.99%;绿原酸保留率提高了16.08%。综合2种样品中各活性物质在贮藏过程中的变化发现,经微胶囊化后的花青素与绿原酸较粗提物粉末呈更稳定的状态。
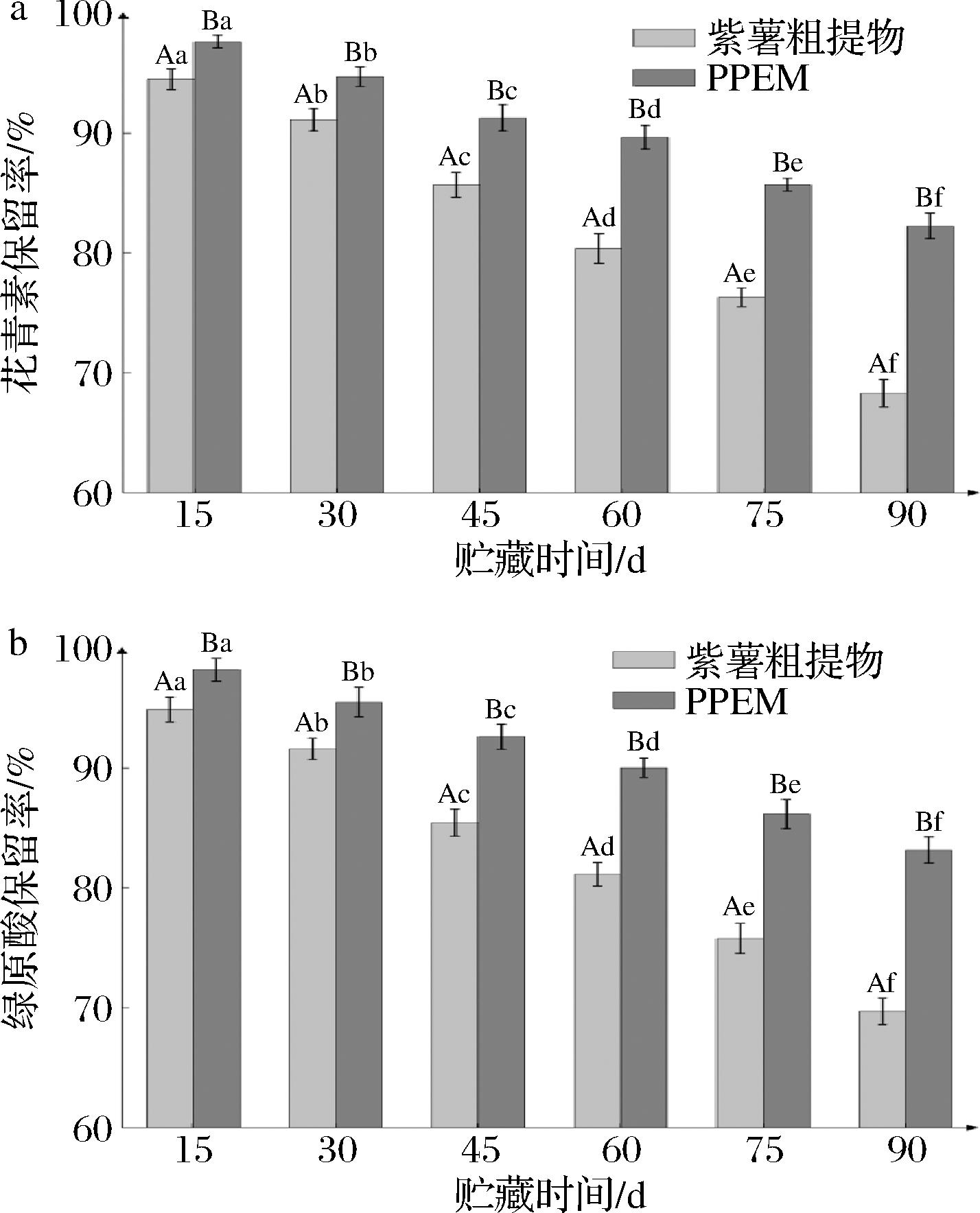
a-花青素保留率;b-绿原酸保留率
图4 贮藏时间对不同样品活性成分的影响
Fig.4 Effect of storage time on the active components of different samples
注:不同大写字母表示同一贮藏时间不同样品之间数据差异显著(P<0.05),不同小写字母代表同一样品不同贮藏时间下数据差异 显著(P<0.05)。
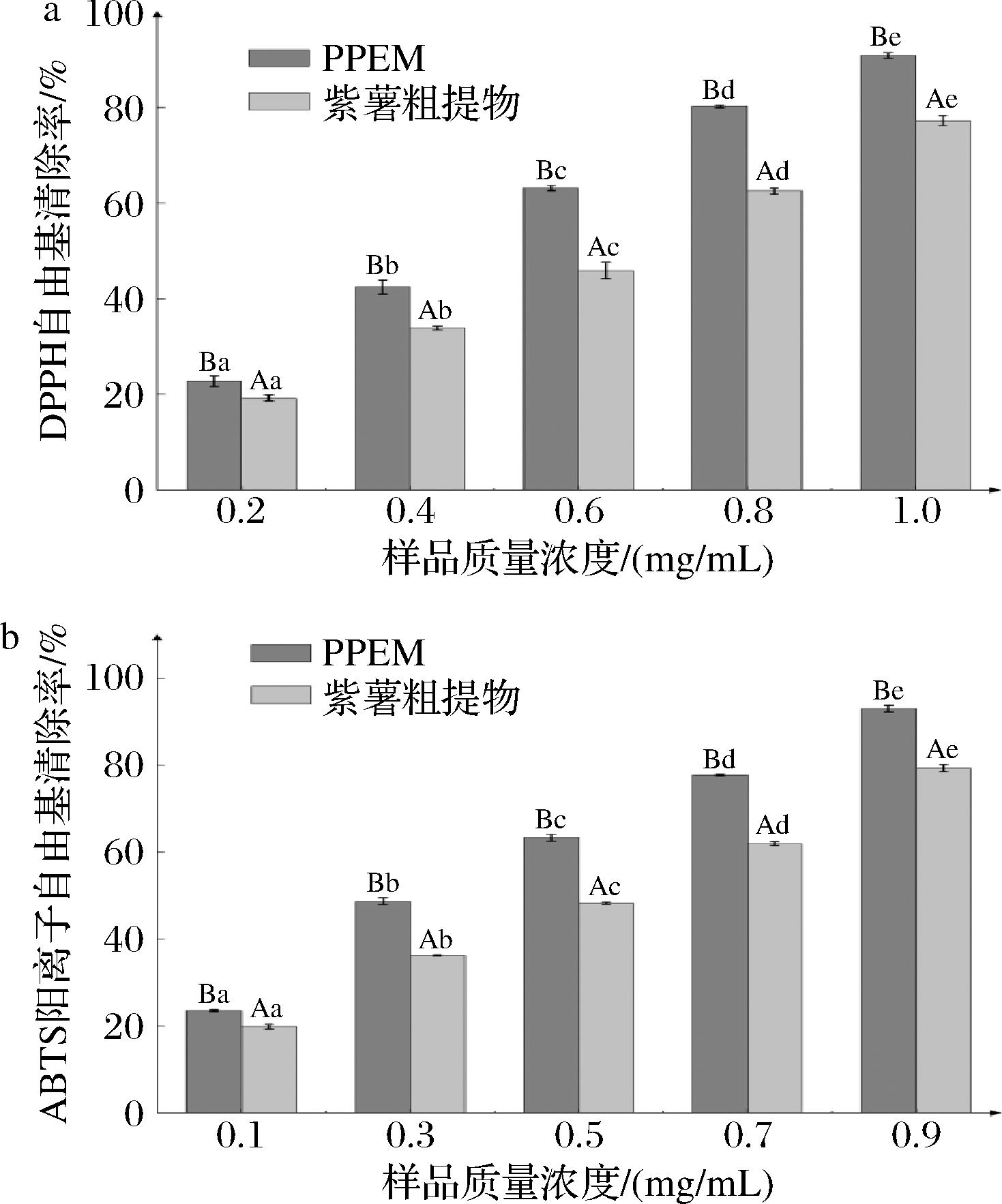
2.6 PPEM的抗氧化性分析
DPPH自由基和ABTS阳离子自由基的清除率是评价抗氧化能力的重要指标,IC50值越小证明抗氧化性能力越强[56]。未包埋的粗提物和PPEM对2种自由基清除率如图5所示,经计算,粗提物和PPEM清除DPPH自由基IC50分别为0.63、0.48 mg/mL,清除ABTS阳离子自由基IC50分别为0.51、0.36 mg/mL。
a-DPPH自由基清除率;b-ABTS阳离子自由基清除率
图5 不同样品的自由基清除效果
Fig.5 Scavenging effect of different samples on free radicals
注:不同大写字母表示同一浓度不同样品之间清除率差异显著(P<0.05),不同小写字母代表同一样品不同浓度下数据差异显著(P<0.05)。
从图5-a可得,同浓度下PPEM对DPPH自由基的清除率始终高于粗提物,故PPEM的抗氧化能力强于粗提物(P<0.05),这说明微胶囊壁材保护了芯材中抗氧化成分的稳定性从而提高了清除率。CHRANIOTI等[57]研究发现,GA或MD表面含有的羟基可能与粗提物中的供电基团(如醛和醇等)形成氢键,提高了包埋效果稳定性,使得PPEM的抗氧化能力提高。张佳佳等[58]也发现添加了MD和GA可显著提高芯材对DPPH自由基的清除能力,与本文结果一致。从图5-b可得,同浓度下PPEM对ABTS阳离子自由基的清除率也始终高于粗提物,其清除能力优于粗提物(P<0.05),这可能是因为壁材的存在,花青素和绿原酸等活性物质进入包埋空腔内后分子稳定性增加,芯材被保护从而抗氧化稳定性增加[59]。体外抗氧化实验结果,证明包埋可以有效提高微胶囊活性成分体外抗氧化能力。
2.7 PPEM的体外降糖结果
2.7.1 PPEM和粗提物对α-淀粉酶、α-葡萄糖苷酶的抑制结果
α-淀粉酶和α-葡萄糖苷酶是分解淀粉和影响肠道吸收的重要酶,它们通过水解α-D-1,4-糖苷键催化淀粉消化,可以通过抑制这2种酶的活性,延长淀粉的消化时间,从而达到控制血糖水平的目的[60]。粗提物和PPEM对α-淀粉酶和α-葡萄糖苷酶的抑制率如图6所示。经计算,粗提物和PPEM抑制α-淀粉酶的IC50分别为10.70、4.53 mg/mL,抑制α-葡萄糖苷酶的IC50分别为5.27、1.99 mg/mL。由图6可得,相同浓度条件下PPEM对2种酶的抑制率均显著强于粗提物(P<0.05),说明紫薯粗提物通过微胶囊化包埋后,其中的有效抑酶活性成分得到保护,对2种酶的抑制能力增加。大量研究表明,紫薯花青素和绿原酸对α-淀粉酶、α-葡萄糖苷酶有明显的抑制作用。张馨月[61]发现紫马铃薯花青素对α-淀粉酶、α-葡萄糖苷酶活性具有抑制作用;张勉羚等[62]研究表明紫薯花青素可与酶活性位点相结合,或与位点内的关键氨基酸相互作用,使酶的构象改变、活性下降;刘雪辉等[63]发现紫薯中绿原酸及其化合物对α-葡萄糖苷酶有显著抑制作用;史明威等[64]通过分子对接模拟,推断出绿原酸对淀粉酶抑制机制主要是通过氢键与酶催化活性位点的氨基酸残基和距活性位点一定距离的某些氨基酸残基结合,从而抑制酶活性,降低淀粉消化率。本实验的结果与上述相关报道类似,提示粗提物和PPEM均有一定的体外抑制淀粉酶活性和降糖能力,PPEM效果更加显著(P<0.05),可能是其中的花青素和绿原酸通过对α-淀粉酶和α-葡萄糖苷酶产生抑制作用,延长淀粉的消化时间来实现的。
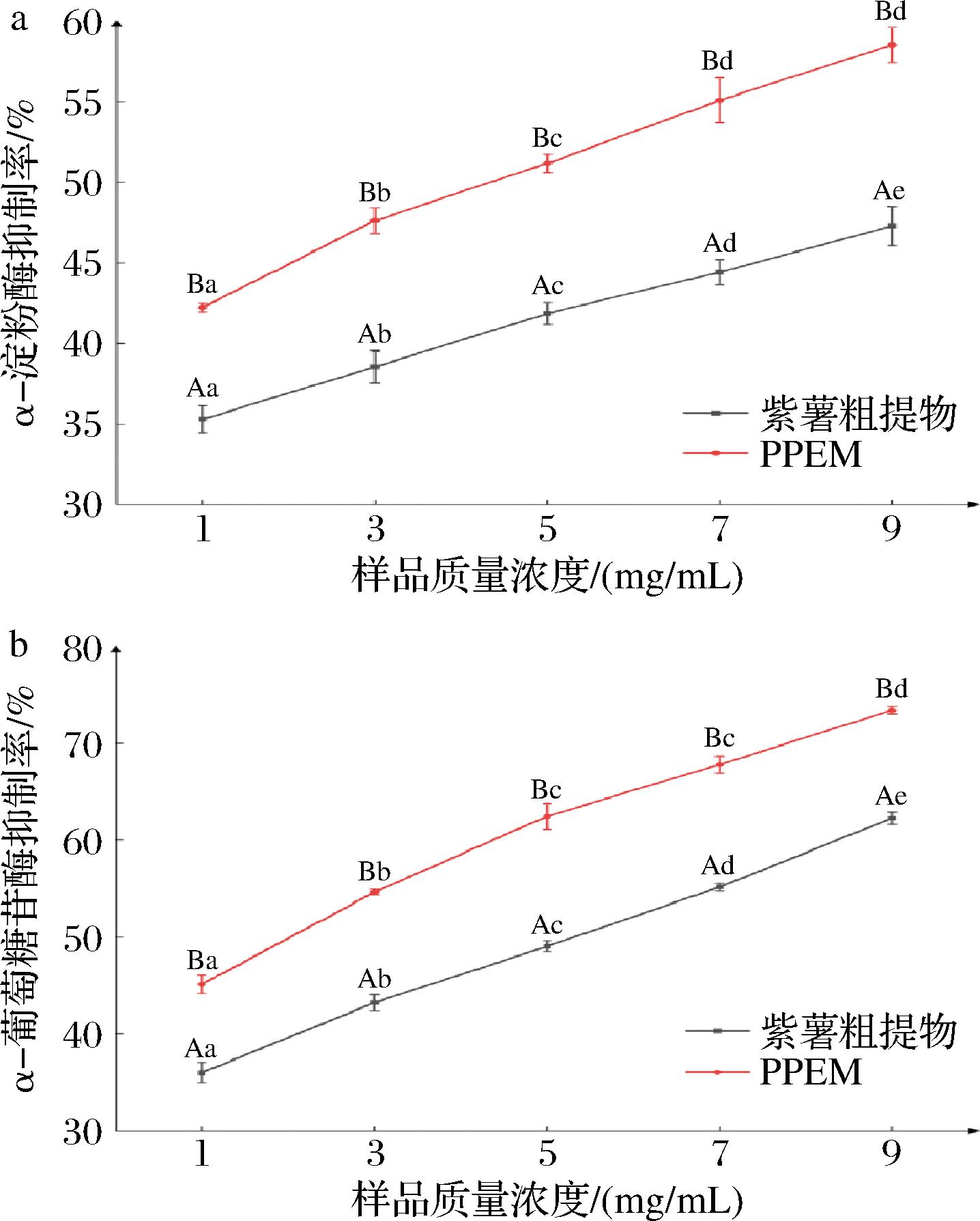
a-α-淀粉酶抑制率;b-α-葡萄糖苷酶抑制率
图6 不同样品对α-淀粉酶和α-葡萄糖苷酶的抑制率
Fig.6 Inhibitory rates of α-amylase and α-glucosidase by different samples
注:不同大写字母表示同一浓度不同样品之间差异显著(P<0.05),不同小写字母代表同一样品不同浓度下差异显著(P<0.05)。
2.7.2 PPEM和粗提物对α-淀粉酶、α-葡萄糖苷酶的紫外光谱分析
紫外光谱对分子构象的变化十分敏感,能反映蛋白质分子的微小结构振动,由于色氨酸和酪氨酸等芳香族氨基酸会引起电子激发,α-淀粉酶和α-葡萄糖苷酶在280 nm附近紫外吸收光谱有1个明显的吸收峰[65]。由图7所示,随着PPEM和粗提物浓度的增加,2种样品α-淀粉酶和α-葡萄糖苷酶的吸收峰强度也随之增加,紫外吸收峰的增幅逐渐变小。这与徐艳阳等[66]研究黑果腺肋花楸多酚对α-淀粉酶作用的紫外光谱结果一致。PPEM和粗提物与α-淀粉酶和α-葡萄糖苷酶相互作用后,改变了色氨酸和酪氨酸等芳香族残基的微环境,从而使其肽链延长,氨基酸残基暴露,亲水性增强,引起吸收强度发生变化[30,67],致使酶的构象发生变化。从图7来看,PPEM吸收峰强度均高于粗提物吸收峰强度,说明PPEM对2种酶的抑制能力强于粗提物,这与2.7.1节的结果一致。

a-PPEM与α-淀粉酶作用后;b-粗提物与α-淀粉酶作用后;c-PPEM与α-葡萄糖苷酶作用后;d-粗提物与α-葡萄糖苷酶作用后
图7 不同样品与α-淀粉酶、α-葡萄糖苷酶作用后的紫外吸收光谱
Fig.7 UV absorption spectra of different samples after interaction with α-amylase and α-glucosidase
2.7.3 PPEM和粗提物对α-淀粉酶、α-葡萄糖苷酶的荧光淬灭作用
α-淀粉酶和α-葡萄糖苷酶中存在的芳香族氨基酸(如色氨酸、苯丙氨酸和酪氨酸)会为该酶提供荧光性质,当存在猝灭剂时,荧光氨基酸的芳香部分和猝灭剂之间的π-π偶联会导致酶的荧光强度降低[31]。图8可以看出,随着PPEM和粗提物浓度的增加,2种样品对α-淀粉酶和α-葡萄糖苷酶的荧光强度降低,且最大荧光波长发生了明显的红移,表明PPEM和粗提物与2种酶发生相互作用,使α-淀粉酶和α-葡萄糖苷酶的疏水键断裂,氨基酸残基暴露出来,导致酶的结构发生变化,其活性下降[68]。荧光光谱说明PPEM和粗提物与酶结合能够淬灭淀粉消化酶的荧光,进一步证明其结合部位上色氨酸残基的环境发生了变化[30]。在相同条件下,PPEM的荧光强度均小于粗提物,说明PPEM对2种酶的抑制能力强于粗提物,也进一步证明微胶囊化后有效保护紫薯中降糖成分活性,增加其对α-淀粉酶和α-葡萄糖苷酶活性的抑制效果。

a-PPEM与α-淀粉酶作用;b-粗提物与α-淀粉酶作用;c-PPEM与α-葡萄糖苷酶作用;d-粗提物与α-葡萄糖苷酶作用
图8 不同样品分别与α-淀粉酶、α-葡萄糖苷酶作用后的荧光光谱
Fig.8 Fluorescence spectra of different samples after interaction with α-amylase and α-glucosidase
2.8 抗氧化活性与α-淀粉酶、α-葡萄糖苷酶抑制活性之间的相关性
表2、表3显示不同浓度的PPEM和粗提物与DPPH自由基和ABTS阳离子自由基的清除率及α-淀粉酶、α-葡萄糖苷酶抑制率之间均具有极显著正相关性(P<0.01),花青素和绿原酸浓度与各活性指标间也具有极显著正相关性(P<0.01),提示紫薯粗提物或PPEM所体现的抗氧化活性及体外降糖活性均与其中的花青素和绿原酸密切相关,进一步证实了紫薯花青素和绿原酸的相关活性功效。
表2 PPEM抗氧化指标与体外降糖活性指标的相关性
Table 2 Correlation between PPEM antioxidant indices with in vitro hypoglycemic activity indices
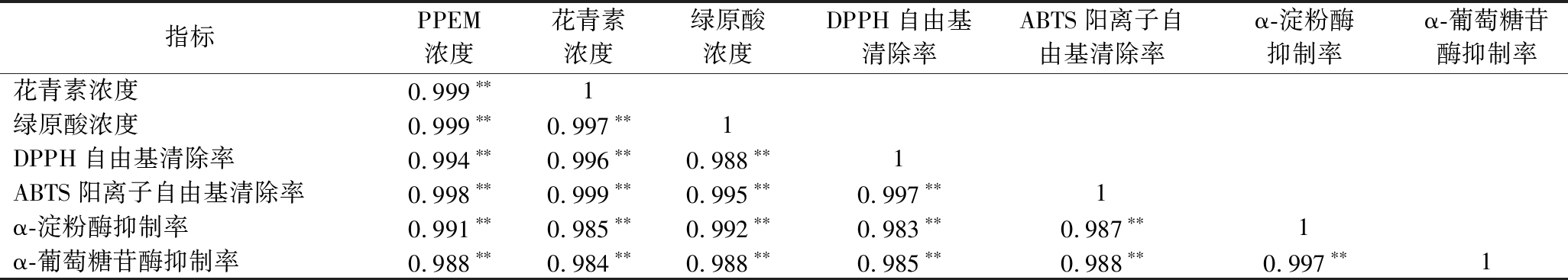
注:**在0.01级别(双尾),相关性显著(下同)。
指标PPEM浓度花青素浓度绿原酸浓度DPPH自由基清除率ABTS阳离子自由基清除率α-淀粉酶抑制率α-葡萄糖苷酶抑制率花青素浓度0.999∗∗1绿原酸浓度0.999∗∗0.997∗∗1DPPH自由基清除率0.994∗∗0.996∗∗0.988∗∗1ABTS阳离子自由基清除率0.998∗∗0.999∗∗0.995∗∗0.997∗∗1α-淀粉酶抑制率0.991∗∗0.985∗∗0.992∗∗0.983∗∗0.987∗∗1α-葡萄糖苷酶抑制率0.988∗∗0.984∗∗0.988∗∗0.985∗∗0.988∗∗0.997∗∗1
表3 粗提物抗氧化指标与体外降糖活性指标的相关性
Table 3 Correlation between crude extracts antioxidant indices with in vitro hypoglycemic activity indices
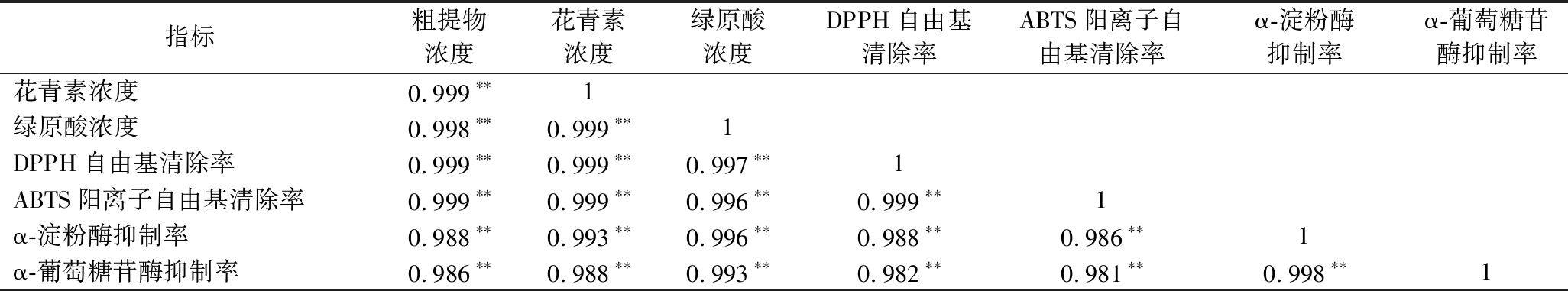
指标粗提物浓度花青素浓度绿原酸浓度DPPH自由基清除率ABTS阳离子自由基清除率α-淀粉酶抑制率α-葡萄糖苷酶抑制率花青素浓度0.999∗∗1绿原酸浓度0.998∗∗0.999∗∗1DPPH自由基清除率0.999∗∗0.999∗∗0.997∗∗1ABTS阳离子自由基清除率0.999∗∗0.999∗∗0.996∗∗0.999∗∗1α-淀粉酶抑制率0.988∗∗0.993∗∗0.996∗∗0.988∗∗0.986∗∗1α-葡萄糖苷酶抑制率0.986∗∗0.988∗∗0.993∗∗0.982∗∗0.981∗∗0.998∗∗1
3 结论
本文将紫薯粗提物中花青素和绿原酸同时包埋制备出PPEM,最大限度提升紫薯中活性成分利用率,并比较其包埋前后的物理性质、结构表征及生物活性。含水率、溶解度与堆密度结合SEM、FTIR、XRD分析结果从侧面提示微胶囊可保护紫薯活性物质不被破坏,显著提高活性成分稳定性(P<0.05),贮藏稳定性实验验证了这一结果,制备的PPEM粉末表面光滑具有良好的贮藏稳定性。与未包埋的粗提物相比,PPEM对DPPH自由基、ABTS阳离子自由基清除能力和对α-淀粉酶、α-葡萄糖苷酶的抑制率显著增强(P<0.05),说明微胶囊化能显著提高活性成分的抗氧化能力和体外降糖能力。综上,PPEM能同时改善紫薯中花青素和绿原酸等活性成分性质不稳定的问题,使其得到充分利用,可为紫薯有效降糖成分共包埋提供一定的理论依据,并为紫薯粗提物微胶囊的深入研究和开发利用提供参考。
[1] 邓少颖, 孙健, 朱红, 等.不同品种紫甘薯全粉挤压膨化圈品质特性研究[J].中国粮油学报, 2024, 39(6):67-75.DENG S Y, SUN J, ZHU H, et al.Quality properties of extruded rings of purple sweet potato whole powder from different varieties[J].Journal of the Chinese Cereals and Oils Association, 2024, 39(6):67-75.
[2] 张梦潇, 周文化, 周虹, 等.不同品种紫薯营养主成分及聚类分析[J].中国粮油学报, 2020, 35(1):19-25.ZHANG M X, ZHOU W H, ZHOU H, et al.Principal component analysis and cluster analysis of nutrition components in different purple-fleshed sweet potatoes[J].Journal of the Chinese Cereals and Oils Association, 2020, 35(1):19-25.
[3] 李瑞国, 曹岱.甘薯绿原酸的提取及抑菌作用[J].江苏农业科学, 2012, 40(4):266-268.LI R G, CAO D.Extraction and bacteriostasis of chlorogenic acid from sweet potato[J].Jiangsu Agricultural Sciences, 2012, 40(4):266-268.
[4] 贺炜. 紫甘薯花青素精制及抗氧化和降血糖作用的研究[D].长沙:湖南农业大学, 2010.HE W.The research of refine and antioxidant and hypoglycemic of anthocyanin from sweet potato[D].Changsha:Hunan Agricultural University, 2010.
[5] 贺凯. 紫肉甘薯的降糖及抗氧化活性研究[D].重庆:西南大学,2012.HE K.Separation of anti-hyperglycemia and antioxidant active ingredients from purple sweet potato[D].Chongqing:Southwest University,2012.
[6] JANG H H, KIM H W, KIM S Y, et al.In vitro and in vivo hypoglycemic effects of cyanidin 3-caffeoyl-p-hydroxybenzoylsophoroside-5-glucoside, an anthocyanin isolated from purple-fleshed sweet potato[J].Food Chemistry, 2019, 272:688-693.
[7] 徐青, 王代波, 刘国华, 等.花青素稳定性影响因素及改善方法研究进展[J].食品研究与开发, 2020, 41(7):218-224.XU Q, WANG D B, LIU G H, et al.Influencing factors and improving methods of anthocyanin stability[J].Food Research and Development, 2020, 41(7):218-224.
[8] 李文嘉, 徐彬, 邓文, 等.绿原酸功能及应用研究进展[J].河南农业, 2023(4):57-58.LI W J, XU B, DENG W, et al.Research progress on the function and application of chlorogenic acid[J].Agriculture of Henan, 2023(4):57-58.
[9] 王二雷, 黄佳莹, 段海章, 等.花色苷稳态化技术研究进展及应用前景[J].食品工业科技, 2024, 45(18):394-403.WANG E L, HUANG J Y, DUAN H Z, et al.Progress on the stabilization technology of anthocyanins and the application prospects[J].Science and Technology of Food Industry, 2024, 45(18):394-403.
[10] 安超, 张慧, 李琪, 等.紫甘薯色素果冻和微胶囊产品的开发[J].中国食品添加剂, 2021, 32(6):83-88.AN C, ZHANG H, LI Q, et al.Development of purple sweet potato pigment jelly and microcapsule products[J].China Food Additives, 2021, 32(6):83-88.
[11] 王立爽, 蒋裕琪, 于凤桐, 等.响应面法优化紫甘薯花青素微胶囊制备工艺[J].食品工业科技, 2017, 38(19):191-196.WANG L S, JIANG Y Q, YU F T, et al.Optimization of purple sweet potato anthocyanins microcapsules by response surface methodology[J].Science and Technology of Food Industry, 2017, 38(19):191-196.
[12] 林好, 陈圻宇, 黄庆谱, 等.紫薯提取物中花色苷的含量测定及抗氧化活性研究[J].中国食品添加剂, 2021, 32(4):16-22.LIN H, CHEN Q Y, HUANG Q P, et al.Determination of anthocyanins in purple sweet potato extract and study of its antioxidant activity[J].China Food Additives, 2021, 32(4):16-22.
[13] 韩豪, 刘明慧, 赵洋洋, 等.紫薯花青苷定性分析及其主要花青苷的制备与抗氧化活性研究[J].食品与发酵工业, 2019, 45(13):154-159.HAN H, LIU M H, ZHAO Y Y, et al.Qualitative analysis, isolation and antioxidant activity of anthocyanins in purple sweet potato[J].Food and Fermentation Industries, 2019, 45(13):154-159.
[14] 李辰, 韩宏昌, 王海峰, 等.紫薯花青素提取及其在pH响应显色WPU涂层的应用[J].塑料工业, 2022, 50(8):164-169.LI C, HAN H C, WANG H F, et al.Purple potato anthocyanins extraction and application in pH responsive WPU coating[J].China Plastics Industry, 2022, 50(8):164-169.
[15] 冯志强, 张阮冰, 段邓乐, 等.花色苷微胶囊的制备及其理化性质研究[J].包装工程, 2023, 44(15):9-15.FENG Z Q, ZHANG R B, DUAN D L, et al.Preparation and physicochemical properties of anthocyanin microcapsules[J].Packaging Engineering, 2023, 44(15):9-15.
[16] 唐榕. 桑葚主要活性成分稳定性研究及花色苷微胶囊的制备[D].南宁:广西大学,2018.TANG R.Study on the stability of main active components of mulberry and preparation of anthocyanin microcapsules[D].Nanning:Guangxi University, 2018.
[17] 宛美志.蔓越莓花色苷提取纯化工艺优化及微胶囊制备研究[D].沈阳:沈阳农业大学, 2018.WAN M Z.Optimization of extraction and purification process of cranberry anthocyanins and preparation of microcapsules[D].Shenyang:Shenyang Agricultural University, 2018.
[18] 于世莹, 王文秀, 马倩云, 等.紫马铃薯花色苷的提取、纯化及其稳定性研究[J].食品工业科技, 2020, 41(21):156-163.YU S Y, WANG W X, MA Q Y, et al.Extraction, purification and stability of purple potato anthocyanin[J].Science and Technology of Food Industry, 2020, 41(21):156-163.
[19] 郭蒙, 姜春红, 刘韬, 等.血满草叶中绿原酸提取工艺优化及抗氧化活性[J].中国饲料, 2023(21):53-60.GUO M, JIANG C H, LIU T, et al.Optimization of extraction process and antioxidant activity of chlorogenic acid from the leaves of Sambucus adnata Wall[J].China Feed, 2023(21):53-60.
[20] 邓微.紫玉米籽粒花色苷的提取及微胶囊产品贮藏稳定性研究[D].沈阳:沈阳农业大学,2023.DENG W.Study on extraction of anthocyanins from purple corn seed sand storage stability of microcapsule products[D].Shenyang:Shenyang Agricultural University,2023.
[21] 郁兴娜.柑橘皮β-胡萝卜素提取及微胶囊制备与应用研究[D].泰安:山东农业大学,2020.YU X N.Extraction of citrus peel beta-carotene and preparation and application of microcapsule[D].Tai’an:Shandong Agricultural University, 2020.
[22] 王影.蓝莓中多酚和花色苷的提取及微胶囊化研究[D].沈阳:沈阳农业大学, 2022.WANG Y.The Extraction of polyphenols and anthocyanins from blueberry and study of microencapsulation[D].Shenyang:Shenyang Agricultural University,2022.
[23] 陈湘粤. 桑椹花色苷的辅色作用及其微胶囊化研究[D].广州:华南理工大学, 2022.CHEN X Y.Study on the co-pigmentation effect of mulberry anthocyanins and its microencapsulation[D].Guangzhou:South China University of Technology, 2022.
[24] 张玉荣, 倪浩然, 吴琼, 等.茶树精油微胶囊包埋工艺优化及表征[J].河南工业大学学报(自然科学版), 2024, 45(5):33-40.ZHANG Y R, NI H R, WU Q, et al.Optimization and characterization of tea tree essential oil microcapsule embedding process[J].Journal of Henan University of Technology (Natural Science Edition), 2024, 45(5):33-40.
[25] 卢钏燚, 周静, 赵涛, 等.桑葚微胶囊对酸奶品质与风味的影响[J].食品与发酵工业, 2025, 51(1):312-321.LU C Y, ZHOU J, ZHAO T, et al.Effect of mulberry microcapsules on quality and flavor of yogurt[J].Food and Fermentation Industries, 2025, 51(1):312-321.
[26] 逄金鑫, 张怡, 邬松恒, 等.加工工艺对番茄红素微胶囊理化特性以及抗氧化活性的影响[J].食品与发酵工业, 2023, 49(21):145-152.PANG J X, ZHANG Y, WU S H, et al.Effects of processing technology on physicochemical properties and antioxidant activity of lycopene microcapsules[J].Food and Fermentation Industries, 2023, 49(21):145-152.
[27] 张汉辉, 程杏安, 李俊杰, 等.荔枝多酚微胶囊的制备工艺优化及其特性分析[J].食品工业科技, 2021, 42(23):201-208.ZHANG H H, CHENG X A, LI J J, et al.Optimization of preparation process of lichi polyphenols microcapsules and its characteristic analysis[J].Science and Technology of Food Industry, 2021, 42(23):201-208.
[28] 蒋美龄, 陈忠琴, 秦小明, 等.牡蛎降糖肽的结构表征及其协同花色苷的活性增效作用[J].大连海洋大学学报, 2023, 38(3):455-463.JIANG M L, CHEN Z Q, QIN X M, et al.Structural characterization and the synergistic effects with anthocyanin of oyster hypoglycemic peptides[J].Journal of Dalian Ocean University, 2023, 38(3):455-463.
[29] 周婷.黄杞叶醇提物生物活性研究及功能性食品开发[D].成都:成都大学,2022.ZHOU T.Study on the biological activity of the ethanol extract of engel hardiaroxburghiana wall leave sand functional food development[D].Chengdu:Chengdu University, 2022.
[30] 张静, 焦洁帆, 云少君, 等.原花青素和原儿茶酸对淀粉消化酶的联合抑制作用[J].食品工业科技, 2024, 45(20):105-113.ZHANG J, JIAO J F, YUN S J, et al.Combined inhibitory effects of procyanidins and protocatechuic acid on starch digestive enzymes[J].Science and Technology of Food Industry, 2024, 45(20):105-113.
[31] 朋毛德吉. 黑果枸杞花色苷与可溶性膳食纤维相互作用对α-葡萄糖苷酶抑制活性的影响研究[D].西宁:青海师范大学,2024.PENG M D J.Effect of interaction between Lycium ruthenicum Murr.anthocyanins and soluble dietary fiber on a-glucosidase inhibitory activity[D].Xining:Qinghai Normal University, 2024.
[32] 李萌, 张芹, 郑舒磊, 等.不同壁材对ARA微胶囊理化性质和稳定性的影响[J].农业工程学报, 2024, 40(12):295-303.LI M, ZHANG Q, ZHENG S L, et al.Effects of different wall materials on the physicochemical properties and stability of ARA oil microcapsules[J].Transactions of the Chinese Society of Agricultural Engineering, 2024, 40(12):295-303.
[33] 赵梦月, 段续, 任广跃, 等.山茱萸黄酮微胶囊制备工艺及性质[J].食品与发酵工业, 2023, 49(7):181-189.ZHAO M Y, DUAN X, REN G Y, et al.Preparation and properties of flavonoid microcapsules from Cornus officinalis[J].Food and Fermentation Industries, 2023, 49(7):181-189.
[34] 金旭冉, 张剑, 王文亮, 等.姜风味微胶囊制备与性质研究[J].食品与发酵工业, 2024, 50(15):112-118.JIN X R, ZHANG J, WANG W L, et al.Preparation and properties of ginger flavor microcapsules[J].Food and Fermentation Industries, 2024, 50(15):112-118.
[35] 鲍杰.微胶囊化对玫瑰花渣色素理化性质及稳定性的影响研究[D].北京:北京林业大学,2019.BAO J.Studies on the effects of microencapsulation on the physicochemical properties and stability of rose residue pigment[D].Beijing:Beijing Forestry University, 2019.
[36] 曹金安, 王景平, 徐友龙, 等.天然可生物降解聚合物壁材在微胶囊中的应用[J].材料导报, 2023, 37(18):225-243.CAO J A, WANG J P, XU Y L, et al.Application of natural biodegradable polymer wall materials in microcapsules[J].Materials Reports, 2023, 37(18):225-243.
[37] XUE R X, YUAN X, JIANG H, et al.Preparation and physicochemical analysis of Camellia sinensis cv.‘ziyan’ anthocyanin microcapsules[J].Foods, 2024, 13(4):618.
[38] 陈程莉, 李丰泉, 刁倩, 等.不同壁材对黑枸杞花青素微胶囊稳定性和缓释特性的影响[J].食品与发酵工业, 2020, 46(16):78-85.CHEN C L, LI F Q, DIAO Q, et al.Effects of different wall materials on the stability and sustained-release characteristics of anthocyanin microcapsules of Lycium ruthenicum Murr[J].Food and Fermentation Industries, 2020, 46(16):78-85.
[39] 周凯旋.山楂原花青素和多糖高效提取及体外模拟消化研究[D].保定:河北农业大学,2023.ZHOU K X.Study on efficient extraction and in vitro simulated digestion of Hawthorn proanthocyanidins and polysaccharides[D].Baoding:Hebei Agricultural University, 2023.
[40] 赵慧芳, 吴文龙, 李维林, 等.蓝莓多酚微胶囊的制备及体外消化特性研究[J].江西农业大学学报, 2024, 46(4):1001-1011.ZHAO H F, WU W L, LI W L, et al.Preparation and in vitro digestibility of blueberry polyphenols microcapsules[J].Acta Agriculturae Universitatis Jiangxiensis, 2024, 46(4):1001-1011.
[41] 谭睿, 申瑾, 董文江, 等.复合凝聚法制备绿咖啡油微胶囊及其性能[J].食品科学, 2020, 41(23):144-152.TAN R, SHEN J, DONG W J, et al.Preparation of green coffee oil microcapsules by complex coacervation method and its physicochemical properties[J].Food Science, 2020, 41(23):144-152.
[42] KANG Y R, LEE Y K, KIM Y J, et al.Characterization and storage stability of chlorophylls microencapsulated in different combination of gum Arabic and maltodextrin[J].Food Chemistry, 2019, 272:337-346.
[43] 张欢.原花青素微胶囊的制备及其性能研究[D].郑州:河南工业大学,2023.ZHANG H.Preparation ofproanthocyanidin microcapsulesand its performance study[D].Zhengzhou:Henan University of Technology, 2023.
[44] SARABANDI K, JAFARI S M, MAHOONAK A S, et al.Application of gum Arabic and maltodextrin for encapsulation of eggplant peel extract as a natural antioxidant and color source[J].International Journal of Biological Macromolecules, 2019, 140:59-68.
[45] 姚远.2种花楸属植物中3种活性物质的提取及绿原酸包埋物的制备[D].哈尔滨:东北林业大学,2022.YAO Y.Extraction of three active substances from two species of Sorbus and preparation of chlorogenic acid entrapment[D]. Harbin:Northeast Forestry University, 2022.
[46] 陈程莉, 李丰泉, 刁倩, 等.黑枸杞花青素微胶囊优化及理化特性分析[J].食品与发酵工业, 2020, 46(5):208-214.CHEN C L, LI F Q, DIAO Q, et al.Optimization and analysis of physical and chemical properties of black Lycium ruthenicum Murr anthocyanin microcapsules[J].Food and Fermentation Industries, 2020, 46(5):208-214.
[47] 王林.黑果腺肋花楸花青素微胶囊的制备及其活性研究[D].长春:长春工业大学,2024.WANG L.Preparation and activity research of Aronia melanocarpa anthocyanins microcapsules[D].Changchun:Changchun University of Technology, 2024.
[48] 任青霞, 赵华, 吴经纬, 等.酪蛋白源活性肽的微胶囊化及其对酸乳品质的影响[J].食品科学, 2024, 45(16):53-60.REN Q X, ZHAO H, WU J W, et al.Microencapsulation of casein-derived bioactive peptides and their effects on the quality of yogurt[J].Food Science, 2024, 45(16):53-60.
[49] 慕静怡, 胡发广, 张珍珍, 等.不同壁材对绿咖啡油微胶囊微观结构及其热稳定性的影响[J].热带作物学报, 2023, 44(3):647-660.MU J Y, HU F G, ZHANG Z Z, et al.Effects of different wall materials on the microstructure and thermal stability of green coffee oil microcapsules[J].Chinese Journal of Tropical Crops, 2023, 44(3):647-660.
[50] 代佳琳.紫玉米穗轴花色苷提取纯化及其稳态化复合物研究[D].沈阳:沈阳农业大学,2022.DAI J L.Extraction, purification and steady-state complex of anthocyanins from purple corn cob[D].Shenyang:Shenyang Agricultural University, 2022.
[51] 赵立铸, 裴志胜, 王会博, 等.热处理肌原纤维蛋白复凝聚法制备微胶囊及性能表征[J].食品工业科技, 2023, 44(11):1-12.ZHAO L Z, PEI Z S, WANG H B, et al.Preparation and characterization of microcapsules by heat treated myofibrillar protein coacervation[J].Science and Technology of Food Industry, 2023, 44(11):1-12.
[52] TAO Y, WANG P, WANG J D, et al.Combining various wall materials for encapsulation of blueberry anthocyanin extracts:Optimization by artificial neural network and genetic algorithm and a comprehensive analysis of anthocyanin powder properties[J].Powder Technology, 2017, 311:77-87.
[53] 张园园. 乳清蛋白/绿原酸/高酯果胶纳米复合物的构建及作用机制[D].长春:吉林大学,2023.ZHANG Y Y.Construction and action mechanism of whey protein/chlorogenicacid/high methoxy pectin nanocomplexes[D].Changchun:Jilin University,2023.
[54] 李海飞.黑果腺肋花楸花青素的提取及可食用膜开发[D].长春:长春工业大学,2023.LI H F.Extraction of anthocyanins from Aronia melanocarpa and aevelopment of edible Fil[D].Changchun:Changchun University of Technology,2023.
[55] 潘红芳.元宝枫叶总黄酮的提取及微胶囊制备工艺研究[D].杨凌:西北农林科技大学,2023.PAN H F.Study on the extraction and microcapsulepreparation of total flavonoids from leaf of Acer truncatum[D].Yangling:Northwest A&F University,2023.
[56] 黄珊, 刘嘉, 李贵华, 等.壁材对方竹叶黄酮微胶囊结构及抗氧化性能的影响[J].食品工业科技, 2021, 42(22):55-61.HUANG S, LIU J, LI G H, et al.Effects of wall materials on the structure and antioxidant activities of the bamboo leaves flavonoids microcapsules[J].Science and Technology of Food Industry, 2021, 42(22):55-61.
[57] CHRANIOTI C, TZIA C.Arabic gum mixtures as encapsulating agents of freeze-dried fennel oleoresin products[J].Food and Bioprocess Technology, 2014, 7(4):1057-1065.
[58] 张佳佳, 陈小兰, 夏宁, 等.赋形剂对冻干西番莲果粉理化特性及抗氧化活性的影响[J].现代食品科技, 2017, 33(7):199-204.ZHANG J J, CHEN X L, XIA N, et al.Effects of excipients on the physicochemical properties and antioxidant activity of freeze-dried passion fruit powder[J].Modern Food Science and Technology, 2017, 33(7):199-204.
[59] 黄珊, 刘辉, 周罗娜, 等.苦荞芽苗黄酮微胶囊的制备及其性质分析[J].食品工业科技, 2023, 44(13):63-70.HUANG S, LIU H, ZHOU L N, et al.Preparation and property analysis of flavonoids microcapsules from Tartary buckwheat sprout[J].Science and Technology of Food Industry, 2023, 44(13):63-70.
[60] 王闪.酶法合成绿原酸酰化衍生物及其抗氧化和α-淀粉酶/葡萄糖苷酶抑制活性研究[D].无锡:江南大学, 2021.WANG S.Study on antioxidant and α-amylase/glucosidase inhibition properties of ca acylated derivatives synthetized by enzyme[D].Wuxi:Jiangnan University, 2021.
[61] 张馨月.紫马铃薯花色苷提取工艺研究及其皮克林乳液特性分析[D].成都:成都大学,2024.ZHANG X Y.Study on the extraction process of purple fleshed potatoes anthocyanins and characterization of its pickering emulsion[D].Chengdu:Chengdu University, 2024.
[62] 张勉羚, 牛丽亚, 涂瑾, 等.不同熟化方式对速冻熟紫薯品质的影响[J].食品科学, 2023, 44(7):48-56.ZHANG M L, NIU L Y, TU J, et al.Effects of different cooking methods on the quality of quick-frozen cooked purple sweet potato[J].Food Science, 2023, 44(7):48-56.
[63] 刘雪辉, 李觅路, 谭斌, 等.紫甘薯茎叶中绿原酸及异绿原酸对α-葡萄糖苷酶的抑制作用[J].现代食品科技, 2014, 30(3):103-107.LIU X H, LI M L, TAN B, et al.Inhibitory effects of chlorogenic acid and isochlorogenic acid from purple sweet potato leaves on α-glucosidase[J].Modern Food Science and Technology, 2014, 30(3):103-107.
[64] 史明威, 张梦玥, 初鸿, 等.绿原酸对α-淀粉酶的抑制作用及其分子对接模拟[J].食品科学技术学报, 2023, 41(4):135-143.SHI M W, ZHANG M Y, CHU H, et al.Inhibition of chlorogenic acid on α-amylase and its molecular docking simulation[J].Journal of Food Science and Technology, 2023, 41(4):135-143.
[65] HUANG R N, ZHANG S X, PAN L L, et al.Spectroscopic studies on the interactions between imidazolium chloride ionic liquids and bovine serum albumin[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2013, 104:377-382.
[66] 徐艳阳, 仇洋, 王君旸, 等.黑果腺肋花楸多酚的抑菌效果及对α-淀粉酶活性的抑制作用[J].食品科学, 2018, 39(19):51-57.XU Y Y, QIU Y, WANG J Y, et al.α-amylase inhibitory activity and antibacterial activity of polyphenols from Aronia melanocarpa berries[J].Food Science, 2018, 39(19):51-57.
[67] 高义霞, 陶超楠, 郑婷, 等.乳苣不同溶剂提取物对α-淀粉酶的抑制作用及光谱研究[J].食品工业科技, 2018, 39(7):104-109.GAO Y X, TAO C N, ZHENG T, et al.Inhibition effects and spectrum of different solvent extracts from Mulgedium tataricum L.on α-amylase[J].Science and Technology of Food Industry, 2018, 39(7):104-109.
[68] JOYE I J, DAVIDOV-PARDO G, LUDESCHER R D, et al.Fluorescence quenching study of resveratrol binding to zein and gliadin:Towards a more rational approach to resveratrol encapsulation using water-insoluble proteins[J].Food Chemistry, 2015, 185:261-267.