夏秋茶(Camellia sinensis L.)作为山茶科山茶属植物的代表性农产品,具有显著的营养价值和健康功效。这种季节性茶叶富含多种生物活性成分,包括具有抗氧化作用的多酚类物质(如儿茶素)、具有抗炎特性的类黄酮化合物、具有免疫调节功能的多糖以及具有多种生理活性的蛋白质[1]。尤其是茶蛋白因其功能和营养价值(如抗氧化、抗高血压和乳化活性)而受到越来越多的关注[2]。然而,茶叶的刚性细胞壁结构主要由纤维素、半纤维素和果胶组成,限制了其蛋白质的有效提取和生物利用度[3]。高温高湿气流冲击漂烫(high-humidity hot air impingement blanching,HHAIB)技术作为一种新型物理预处理方法,其核心机理是通过高温(90~120 ℃)、高湿(相对湿度90%~95%)与高速气流(8~14 m/s)的协同作用,引发植物组织细胞壁多糖(如果胶)的解聚(降解率可达60%~70%)和蛋白质构象改变[4]。该技术在果蔬加工领域已取得显著成效,如在红辣椒处理中可使干燥时间缩短40%,活性成分保留率提高25%[5];在苹果加工中能有效改善细胞壁通透性,使多酚提取率提升35%。HHAIB诱导的蛋白质适度变性(如β-折叠含量增加15%~20%),可显著改善其功能特性[6]。
尽管HHAIB在果蔬组织改性中已有较多报道,但其对夏秋茶蛋白-多酚复合物的作用机制仍不明确。首先,HHAIB处理时间对复合物构象的影响缺乏定量解析,尤其是不同处理时间下蛋白质的展开-聚集平衡如何影响其与多酚的结合能力。其次,夏秋茶蛋白具有优异的乳化性和凝胶性,可作为疏水性活性物质的理想载体,而现有研究多聚焦静态复合体系的性能,HHAIB动态处理对复合物在模拟胃肠消化过程中保护活性物质(如姜黄素)的能力尚未探讨,其包封效率与乳液稳定性主要取决于蛋白质载体的界面特性,HHAIB预处理可能通过调控蛋白结构影响这些性能。此外,HHAIB参数(如处理时间)与复合物乳化稳定性、抗氧化活性及消化释放率的关联机制仍不清楚,限制了该技术在功能性食品中的应用。
本研究将HHAIB技术应用于夏秋茶加工,采用不同HHAIB处理时间 (0、30、90、150、210 s) 制备茶粉并提取茶叶蛋白-多酚复合物(tea protein-polyphenol complexes,TPC),系统考察处理时间对茶粉和TPC理化性质及其提取的TPC与果胶形成的TPC-Pect复合物对姜黄素Pickering乳液稳定性和消化特性的调控作用。通过多尺度表征,阐明HHAIB处理时间与茶叶组分结构修饰、TPC形成机制之间的构效关系以及乳化特性变化的机制,为后续TPC的功能性应用提供理论基础。研究结果首次系统揭示了HHAIB诱导的蛋白质构象变化与抗氧化活性、乳化特性的构效关系,不仅为夏秋茶的高值化利用提供了新方法,也为开发具有特定功能的TPC产品奠定了科学基础。通过优化HHAIB处理参数,有望获得具有优良功能特性的TPC,为其在食品、保健品等领域的应用开辟新途径。
1 材料与方法
1.1 材料和试剂
夏秋茶鲜叶源自贵州省遵义市湄潭县当地茶园。主要试剂包括:ABTS、DPPH、纤维素酶、胃蛋白酶,美国Sigma-Aldrich公司。其余化学试剂均为分析纯,国药集团化学试剂有限公司(上海)。
1.2 仪器与设备
F98荧光分光光度计,上海棱光技术有限公司;PHS-25 型PH计,上海仪电科学仪器股份有限公司;Q2048R型高速冷冻离心机,大龙兴创实验仪器(北京)股份公司。
1.3 HHAIB夏秋茶预处理
茶叶采用HHAIB系统处理:气流速度(14.0±0.5) m/s,处理温度110 ℃,环境相对湿度35%~40%[5],处理时间设置5个时间间隔(0、30、90、150、210 s),其中0 s组作为空白对照(相关原理如电子版增强出版附图1所示,https://doi.org/10.13995/j.cnki.11-1802/ts.043305)。热处理后,样品冷却至室温,开始干燥,所有处理均重复3次。

图1 不同HHAIB处理时间下茶叶粉末组织的 SEM 图像
Fig.1 SEM image of tea powder tissue under different HHAIB treatment time
1.4 夏秋茶的扫描电子显微镜(scanning electron microscope,SEM)分析
通过扫描薄金膜制备的干燥样品,使用加速电压为15.0 kV的SEM进行分析。
1.5 HHAIB处理后夏秋茶色泽测定
CIE颜色参数L*、a*和b*分别代表亮度、红绿度和蓝黄度。样品的色差(ΔE)通过公式(1)计算:
(1)
1.6 样品浸提液的制备
干燥的茶样研磨成细粉,然后过80目筛网。制备好的样品在4 ℃下保存。提取时,取1 g样品与10 mL体积分数75%乙醇混合,在180 r/min下摇晃3 h。随后,混合物以8 000 r/min 离心10 min,收集上清液作为样品提取物。经注射器过滤后,提取的样品在4 ℃下保存,以备进一步分析[7]。
1.6.1 HHAIB处理后茶叶中还原糖的测定
取100 μL样品与300 μL DNS试剂反应,95 ℃水浴5 min后冰浴终止。540 nm下测定吸光度,标准曲线线性方程为y=0.113 2x+0.087 3(R2=0.995 9),重复3次[8]。
1.6.2 HHAIB处理后茶中可溶性肽的测定
取茶粉(3 g)与27 mL的50 g/L三氯乙酸溶液混合,10 000 r/min匀浆2 min,4 ℃静置30 min后8 000 r/min离心10 min[9]。采用BCA法测定上清液肽含量(以BSA为标准品)。
1.6.3 HHAIB处理后茶中总酚含量的测定
参考国家标准GB/T 8313—2018《茶叶中茶多酚和儿茶素类含量的检测方法》
1.7 TPC的提取
为研究HHAIB预处理对TPC提取的影响,茶粉分别经0、30、90、150、210 s HHAIB处理后冻干研磨。取1 g茶粉加入20 mL 200 mmol/L NaCl,添加纤维素酶(200 U/g)于pH 5.0、37 ℃酶解2 h。灭酶后离心取上清液,(NH4)2SO4沉淀TPC,透析冻干得终产物(TPC0s、TPC30s、TPC90s、TPC150s和TPC210s),-40 ℃保存备用。实验重复3次。
1.7.1 TPC的冻融稳定性
将60 g/L样品悬浮液置于95 ℃的水浴中热处理30 min,随后立即转移至预先称重的10 mL离心管中。样品迅速冷却至室温(25±1) ℃,并在冰水浴中测量总质量[10]。
1.7.2 TPC的本征荧光光谱测量
荧光光谱采用F98型荧光分光光度计,采集光谱290~450 nm,激发波长为280 nm。
1.7.3 TPC的红外光谱
使用配备有氘化三甘氨酸硫酸盐检测器的Nicolet 6700傅里叶变换红外光谱(Fourier transform infrared,FTIR)仪进行红外光谱表征。
1.7.4 TPC的X射线衍射
TPC的晶体结构特征采用X射线衍射仪进行测定。实验参数设置如下:工作电压36 kV,工作电流20 mA,使用镍滤波的Cu Kα射线(波长λ=1.540 5 Å)。扫描范围为10°~45°(2θ),扫描速率设定为1°/min。
1.8 TPC的抗氧化能力
1.8.1 DPPH自由基清除能力
将100 μL不同浓度TPC溶液与300 μL 0.1 mol/L DPPH甲醇溶液混合,避光反应30 min后测定517 nm吸光度,按公式(2)计算清除率。
DPPH自由基清除活性![]()
(2)
1.8.2 ABTS阳离子自由基清除能力
将7 mmol/L ABTS与2.45 mmol/L K2S2O8等体积混合,避光反应16 h生成ABTS阳离子,稀释至734 nm吸光度为0.70±0.05。取300 μL ABTS阳离子溶液与100 μL TPC样品反应5 min,于734 nm测吸光度,按公式(3)计算清除率。
ABTS阳离子自由基清除活性![]() 100
100
(3)
1.9 TPC-果胶复合物稳定的姜黄素Pickering乳液制备
将TPC配制成20 g/L水溶液,(25±1) ℃、300 r/min搅拌4 h,4 ℃静置12 h后调pH至5.0(1 mol/L HCl)。同时制备含0.2 g/L NaN3的20 g/L果胶溶液,相同条件处理。按体积比1∶1混合两溶液,25 ℃、300 r/min搅拌30 min后调pH值至5.0[11],4 ℃保存备用。
将姜黄素溶于葵花籽油(1 g/L),冰浴避光300 r/min搅拌12 h,8 000 r/min离心10 min取上清液。按体积比2∶1混合TPC-果胶复合物溶液 (10 mL) 与姜黄素油相 (5 mL),避光搅拌1 h;20 000 r/min均质1 min,制得5种Pickering乳液[12],分别命名为0 s、30 s、90 s、150 s和210 s。
1.10 测定乳液姜黄素包封率
精确量取200 μL姜黄素乳液,加入1 mL无水乙醇,3 000 r/min离心20 min后收集上清液,用乙醇定容至1 mL,于425 nm波长处测定吸光度,计算油相中包埋的姜黄素含量。
1.11 测定TPC-果胶复合物稳定Pickering乳液的热稳定性及贮藏稳定性
取新鲜制备的乳液样品分别于32、60 ℃和90 ℃恒温处理30 min后,测定姜黄素保留率。贮藏稳定性实验设置4 ℃和25 ℃两种贮藏温度,分别于第1、2、3、4、5、15和30天取样检测[13],按公式(4)计算。
保留率![]()
(4)
式中:Cn,一段时间后乳剂中姜黄素质量浓度,μg/mL;C,乳剂中姜黄素的初始质量浓度,μg/mL。
1.12 Pickering乳液体外模拟消化实验
模拟胃相:乳液与模拟胃液(含2 g NaCl、7 mL HCl、3.2 g胃蛋白酶/L)按体积比1∶14混合,37 ℃、100 r/min消化1 h。模拟肠相:胃消化产物与模拟肠液(含胰酶2.4 mg/mL、脂肪酶3.6 mg/mL、胆酸钠4.3 mg/mL、CaCl2 0.6 mmol/L,pH 7.5磷酸盐缓冲液)按体积比1∶1混合,1 mol/L NaOH调pH值至7.0,37 ℃、100 r/min消化2 h[14]。
游离脂肪酸释放速率测定,在胰脂肪酶催化脂质水解过程中,使用0.1 mol/L NaOH溶液滴定,维持反应体系pH值恒定在7.0±0.1。每30 min记录NaOH消耗量,根据公式(5)计算游离脂肪酸的释放速率[15]。
游离脂肪酸的释放率![]()
(5)
式中:CNaOH、VNaOH、MLipid和mLipid分别代表NaOH的摩尔浓度(mol/L)、消耗的NaOH溶液的体积(L)、油的摩尔质量(g/mol)和样品中油的质量(g)。
姜黄素稳定性及生物可及性测定,完成模拟胃肠消化后,将消化液于4 ℃下10 000 r/min离心30 min收集胶束相。提取姜黄素,以甲醇为溶剂配制标准曲线,于420 nm波长处测定吸光度[16],按公式(6)、(7)分别计算。
稳定性![]()
(6)
生物可及性![]()
(7)
式中:ρD、ρI和ρB分别代表粗消化物、初始样品和透明中间胶束相中的姜黄素含量,g/mL。
1.13 统计分析
所有实验均重复进行3次,结果用“平均值±标准差”表示。采用SPSS 27.0.1进行单因素方差分析和Tukey检验。
2 结果与分析
2.1 HHAIB处理时间对茶粉色泽的影响
如表1所示,HHAIB处理显著影响茶粉色泽,L*值随处理时间延长持续降低(P<0.05),表明亮度下降;a*值上升反映叶绿素热降解导致绿色减弱。ΔE值先升后降,与美拉德反应及热敏成分(蛋白、碳水化合物)降解相关。结果表明,HHAIB处理通过影响色素和热反应改变茶粉色泽特性。
表1 不同HHAIB处理时间的茶粉色泽品质
Table 1 Color indexes of tea powder at different HHAIB times

注:不同小写字母表示差异显著(P<0.05) (下同)。
漂烫时间/sL∗a∗b∗ΔE052.50±0.30a0.67±0.06d20.36±0.269.84±0.33d3040.92±0.23b1.57±0.03c20.98±0.2111.61±0.20c9038.37±0.27c1.99±0.01a20.92±0.4214.19±0.28b15035.94±0.83d2.20±0.06a20.24±0.2916.65±0.84a21038.73±0.46c2.12±0.08ab22.14±0.3313.89±0.42b
2.2 HHAIB处理时间对微观结构的影响
如图1所示,未经处理的对照组(0 s)表现出由多面体薄壁细胞组成的组织结构完好,细胞壁完整。然而,长时间HHAIB处理(90~210 s)导致细胞壁破坏,引起细胞塌陷。这种结构退化可能是由于中间层果胶解聚,导致细胞壁断裂和组织软化[17]。前述发现表明,HHAIB处理显著改变了组织结构和质地特性。
2.3 HHAIB处理时间对茶粉主要成分的影响
结果表明(图2),各组分含量变化均呈现显著的时间依赖性非线性特征。总酚含量在90 s处理时达到峰值,主要由于细胞壁破坏促进酚类溶出[18],但过长时间处理(>150 s)会导致热降解损失。还原糖含量在90 s时最高,其变化趋势与蛋白质含量高度一致,证实短时HHAIB(<150 s)能有效促进细胞内容物释放,而长时间处理(210 s)则因美拉德反应和热变性导致显著降低。前述数据变化结果表明,90 s HHAIB处理可在各组分提取效率与稳定性间实现最佳平衡。
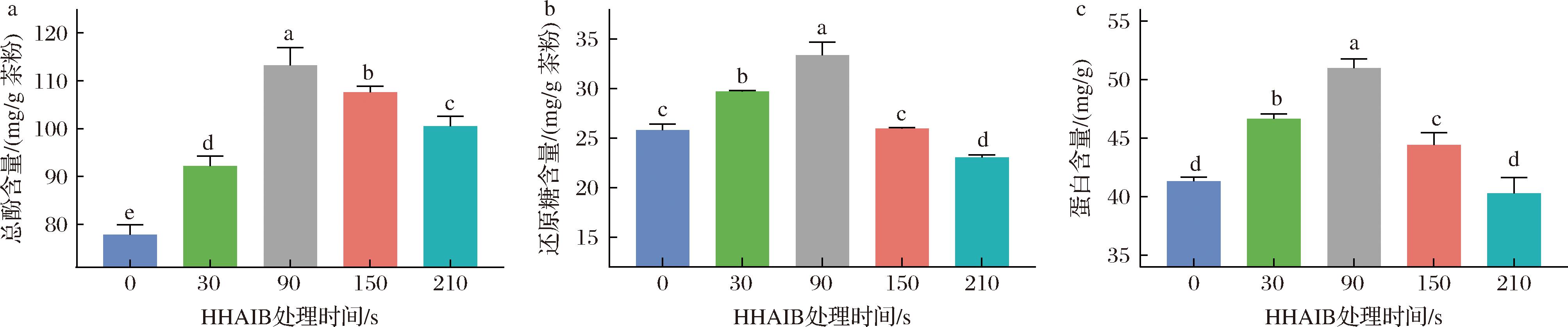
a-HHAIB处理时间对茶粉总酚含量的影响;b-HHAIB处理时间对茶粉还原糖含量的影响;c-HHAIB处理时间对茶粉蛋白质含量的影响
图2 不同HHAIB处理时间对茶粉主要成分的影响
Fig.2 Effect of different HHAIB treatment time on the main components
注:不同小写字母表示差异显著(P<0.05) (下同)。
2.4 HHAIB处理时间对TPC性能的影响
图3-a显示HHAIB处理时间对TPC提取率的影响。TPC得率呈现非线性变化:未处理组(0 s)与30 s处理组间无显著差异,90 s时显著提高至28.82%,表明此时细胞壁破坏和TPC释放效果最佳。延长处理则持续下降,这主要归因于热变性和美拉德反应导致的复合物降解[18]。
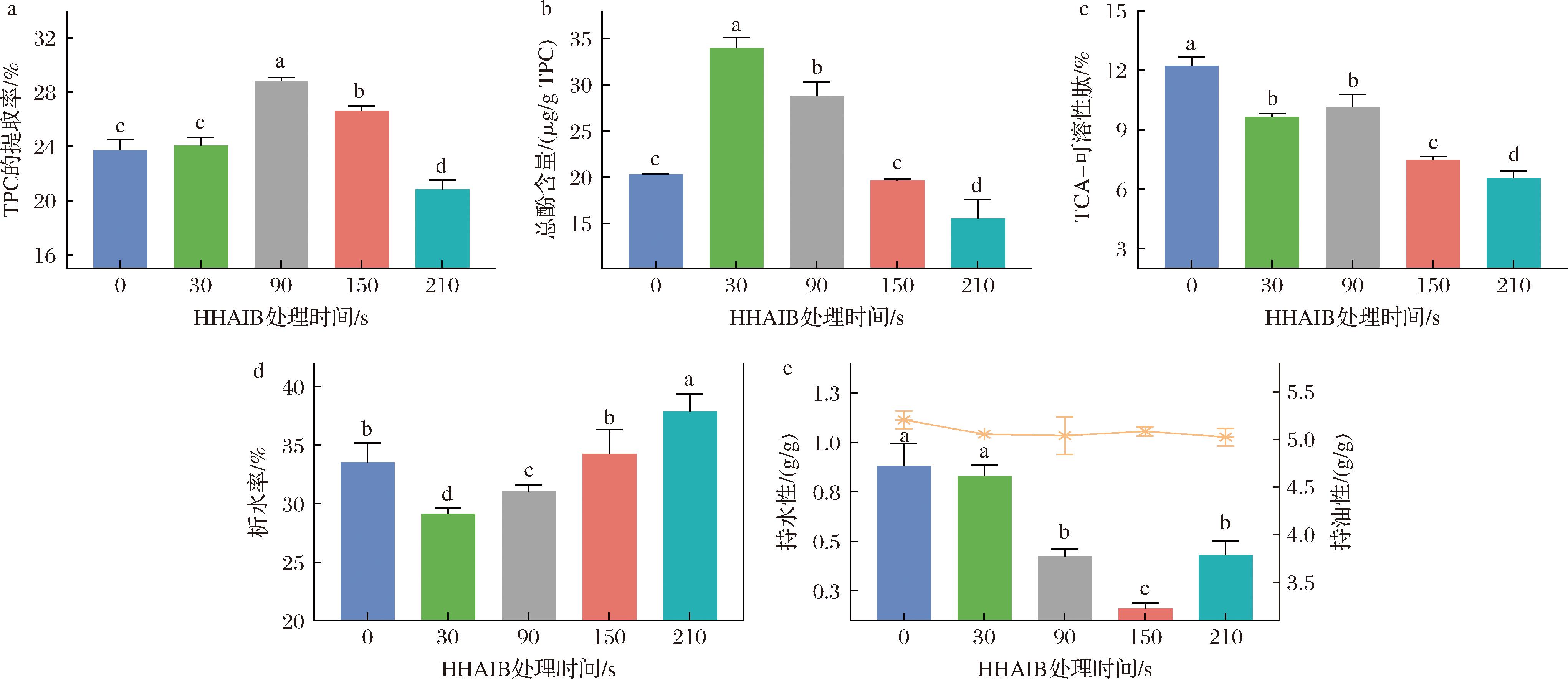
a-HHAIB处理时间对TPC提取率的影响;b-HHAIB处理时间对TPC总酚含量的影响;c-HHAIB处理时间对5% TCA可溶性肽含量影响;d-HHAIB处理时间对TPC析水率的影响;e-HHAIB处理时间对TPC持水/油性影响
图3 不同HHAIB处理时间对TPC性质的影响
Fig.3 Effect of different HHAIB treatment time on TPC properties
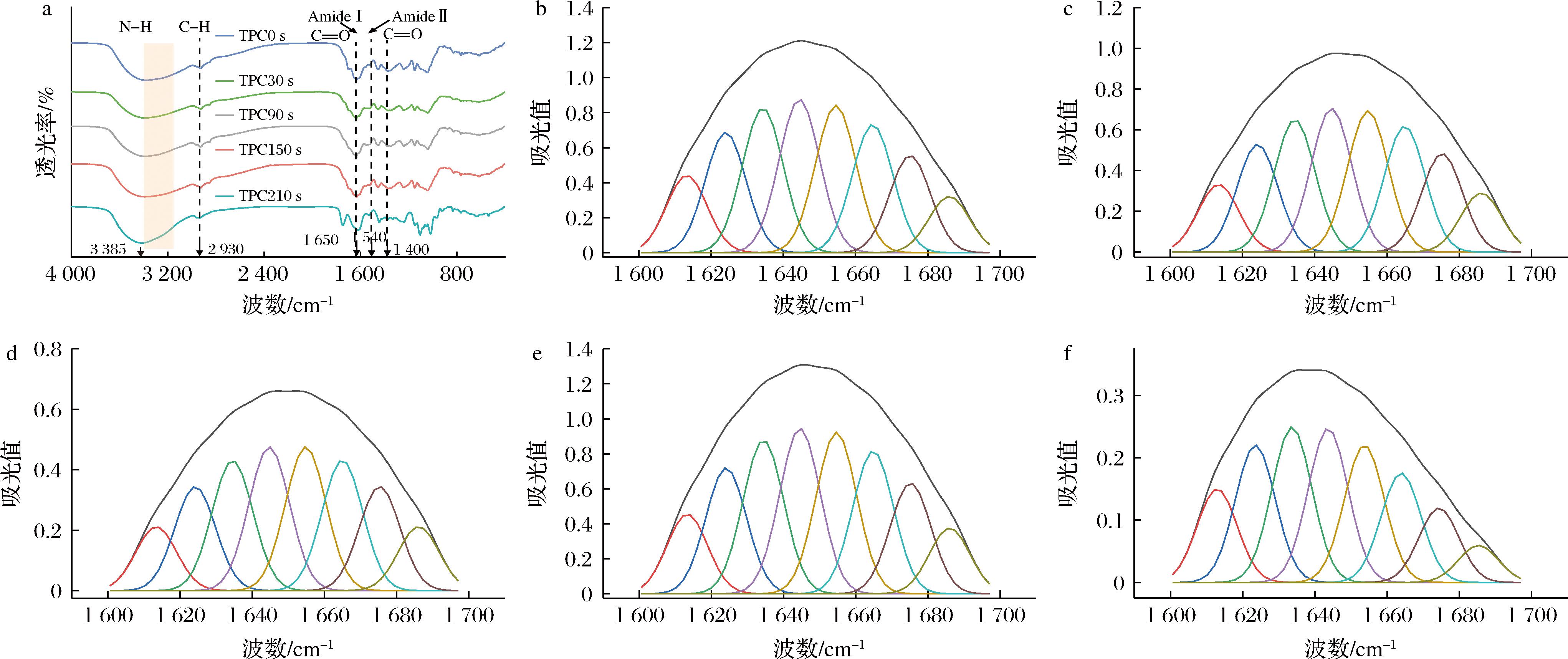
a-HHAIB处理时间对TPC红外光谱的影响;b、c、d、e、f-TPC0s、TPC30s、TPC90s、TPC150s、TPC210s的红外去卷积光谱
图4 不同HHAIB处理时间对TPC红外光谱的影响
Fig.4 Effect of different HHAIB treatment time on infrared spectra of TPC
图3-b揭示了总酚含量在30 s时达到峰值,这主要源于蛋白质部分变性暴露疏水结合位点和分子运动增强促进多酚-蛋白结合。而延长HHAIB处理时间(>90 s)则导致含量逐渐降低,其原因可能是蛋白质聚集掩盖结合位点和多酚氧化聚合[19]。210 s处理组含量显著降低,证实过度处理会破坏天然复合物结构,30 s为维持复合物稳定的最佳处理时间。
图3-c所示,经HHAIB处理后,TPC中可溶性肽含量持续下降,可能由于热湿作用促使肽段与多酚、还原糖等发生美拉德反应,生成不溶性聚合物[18]。
图3-d显示了HHAIB处理处理时间对TPC冻融稳定性的影响(以析水率为指标)。未处理组经30 s处理后稳定性改善,这与适度蛋白质变性增强疏水相互作用和网络结构形成有关。但延长处理时间(150~210 s)会导致析水率升高至37.87%,表明蛋白质过度降解引发结构坍塌[20]。
2.5 HHAIB处理时间对TPC的FTIR影响
图4-a显示HHAIB处理后TPC的FTIR特征:3 300 cm-1(N—H)、1 650 cm-1(C![]() O)和1 540 cm-1 (N—H/C—N)为特征峰[21]。150 s处理使酰胺I带红移5 cm-1 (1 654→1 649 cm-1),表明α-螺旋向β-折叠转化及相互作用增强;210 s出现蓝移,表示复合物解离。这些FTIR分析结果与荧光光谱(图5-b)数据相互印证,共同表明HHAIB通过调控蛋白质构象转变和多酚结合动力学来改变TPC功能特性。
O)和1 540 cm-1 (N—H/C—N)为特征峰[21]。150 s处理使酰胺I带红移5 cm-1 (1 654→1 649 cm-1),表明α-螺旋向β-折叠转化及相互作用增强;210 s出现蓝移,表示复合物解离。这些FTIR分析结果与荧光光谱(图5-b)数据相互印证,共同表明HHAIB通过调控蛋白质构象转变和多酚结合动力学来改变TPC功能特性。
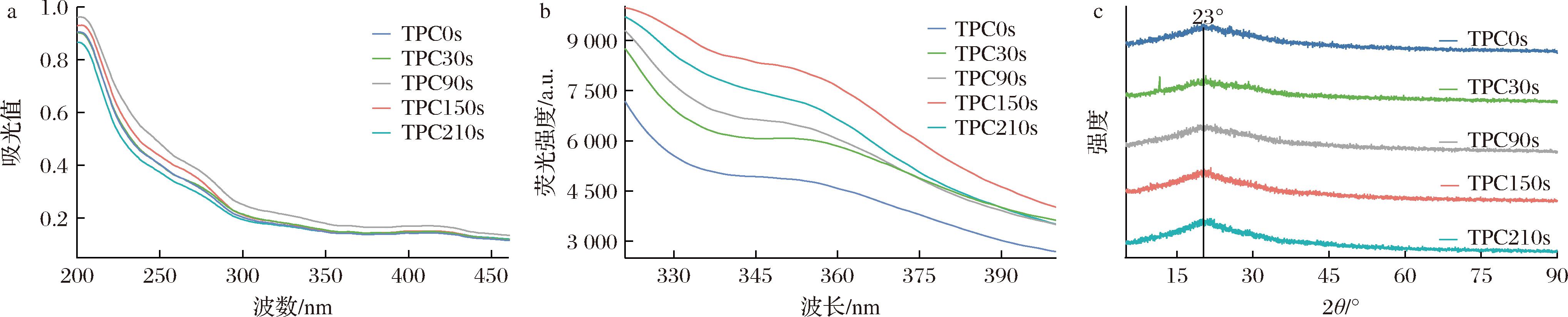
a-HHAIB处理对TPC的UV-Vis光谱影响;b-HHAIB处理时间对TPC的荧光光谱影响;c-HHAIB处理时间对TPC的X射线衍射光谱的影响
图5 HHAIB处理时间对TPC的UV-Vis吸光度、内源荧光、X射线衍射图谱的影响
Fig.5 Effect of HHAIB treatment time on TPC’s UV-Vis, fluorescence, and XRD spectra
结合FTIR与二级结构数据(表2)表明,HHAIB处理诱导TPC发生动态构象变化:150 s处理使酰胺I带红移(1 654→1 649 cm-1),α-螺旋向β-折叠转化,210 s时β-折叠含量达峰值43.00%。初期增强蛋白-多酚相互作用,但210 s处理导致复合物部分解离(酰胺I带蓝移,β-转角降至24.56%)[21]。150 s为最佳处理时间,可在最大化β-折叠形成的同时维持复合物稳定性,这对调控TPC在食品应用中的功能特性至关重要。
表2 HHAIB处理时间下夏秋茶中TPC的二级结构
Table 2 Secondary structure of TPC extracted from summer-autumn tea under different HHAIB conditions
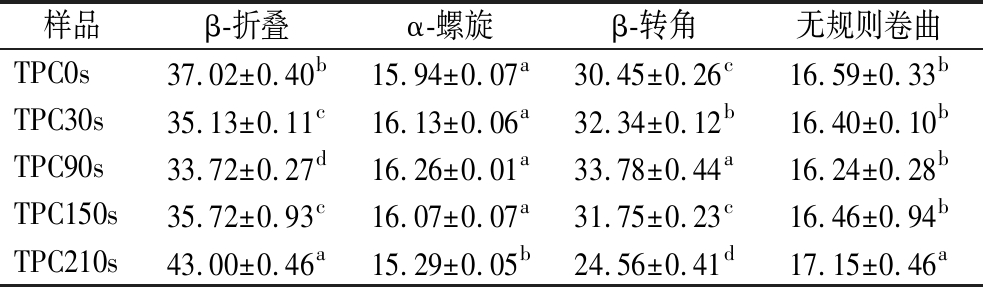
样品β-折叠α-螺旋β-转角无规则卷曲TPC0s37.02±0.40b15.94±0.07a30.45±0.26c16.59±0.33bTPC30s35.13±0.11c16.13±0.06a32.34±0.12b16.40±0.10bTPC90s33.72±0.27d16.26±0.01a33.78±0.44a16.24±0.28bTPC150s35.72±0.93c16.07±0.07a31.75±0.23c16.46±0.94bTPC210s43.00±0.46a15.29±0.05b24.56±0.41d17.15±0.46a
2.6 HHAIB处理时间对TPC的UV-Vis吸光度、内源荧光分析、X射线衍射影响
图5-a显示不同HHAIB处理时间下TPC的紫外-可见吸收光谱变化。275 nm和420 nm处的特征吸收峰分别反映不同结构特性。275 nm峰(源于芳香族氨基酸及多酚苯环结构)强度呈现先升后降趋势(30~90 s增强,150~210 s减弱),表明适度HHAIB处理可促进蛋白-多酚相互作用,而过度处理导致复合物解离[22]。图5-b显示TPC的内源荧光光谱变化,所有样品在345~375 nm处均出现色氨酸残基特征发射峰。150 s处理组荧光强度最高,210 s处理组次之,未处理组(0 s)最低。这种变化说明适度HHAIB处理通过改变色氨酸微环境极性和调控蛋白-多酚相互作用诱导蛋白质构象变化[23]。150 s处理组的荧光增强效应与FTIR检测的二级结构转变(表2)具有相关性,证实最优处理条件下可产生协同结构修饰。图5-c显示了HHAIB处理下TPC的X射线衍射图谱,2θ≈20°处的宽泛弥散峰证实其无定形结构特征。
2.7 HHAIB处理时间对TPC抗氧化活性的影响
2.7.1 DPPH自由基清除活性
如图6-a所示,不同HHAIB处理时间的TPC对DPPH自由基的清除能力呈现浓度依赖性。在50 μg/mL浓度下,TPC0s、TPC30s、TPC90s、TPC150s和TPC210s的清除率分别为(23.85±1.59)%、(28.58±0.43)%、(32.07±1.27)%、(20.57±0.44)%和(22.85±2.16)%。其中,TPC90s表现出最优异的清除能力,这与其增强的多酚结合能力直接相关。短时处理(≤90 s)可提升清除活性,而长时处理(150~210 s)则显著降低(P<0.05),这可能是由于蛋白质构象变化导致多酚结合能力下降所致[24]。
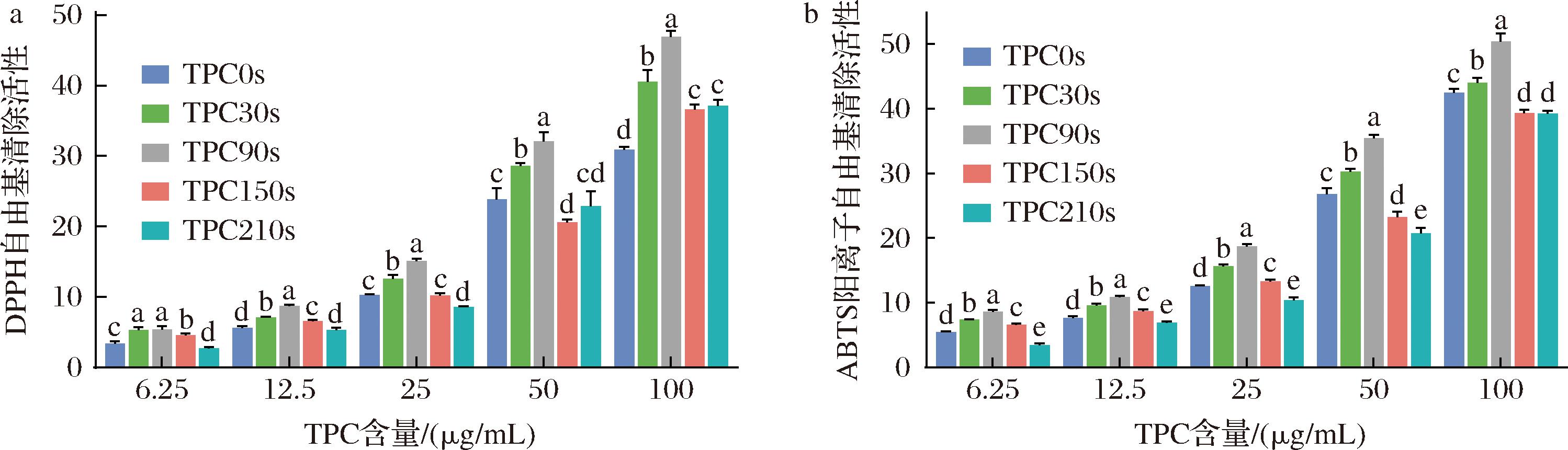
a-HHAIB处理对TPC DPPH自由基清除活性的影响;b-HHAIB处理对TPC ABTS阳离子自由基清除活性的影响
图6 HHAIB处理对TPC抗氧化性的影响
Fig.6 Effect of HHAIB treatment time on the oxidation resistance of TPC
2.7.2 ABTS阳离子自由基清除活性
图6-b显示TPC对ABTS阳离子自由基的清除作用同样呈现剂量依赖特征。同样在50 μg/mL浓度时, TPC90s仍保持最高活性。值得注意的是,相同浓度下TPC对ABTS阳离子的清除率普遍高于DPPH,这主要源于两类自由基溶解特性的差异:ABTS阳离子作为单阳离子自由基水溶性更佳,而DPPH作为油溶性自由基与TPC的水相特性匹配度较低。
2.8 HHAIB处理时间对乳液稳定性影响
2.8.1 包封率分析
如图7-a所示,不同HHAIB处理时间下姜黄素乳液的包封率呈现显著差异:短时处理(30~90 s)使EE较未处理组(0 s)提升11%~19%,90 s时达最大值79.13%[25]。这主要归因于HHAIB诱导的结构修饰,优化了油水界面的蛋白-多酚相互作用和通过可控蛋白质变性增强了乳化性能。而延长处理时间(>150 s)则导致包封率降低7%~18%,则与蛋白质聚集及姜黄素热降解有关。

a-HHAIB处理时间对乳液的包封率;b-HHAIB处理时间对保留率;c-HHAIB处理时间对4 ℃和25 ℃下储存1、2、3、4、5、15和30 d时不同条件下制备的姜黄素乳液的影响
图7 HHAIB处理时间对姜黄素乳液性质的影响
Fig.7 Effect of HHAIB treatment times on the properties of curcumin emulsions
2.8.2 热稳定性分析
如图7-b所示,经不同HHAIB时间预处理的TPC-果胶复合物稳定的姜黄素乳液在40~100 ℃范围内均呈现先升高后降低的保留率变化趋势[13]。未处理组(0 s)热稳定性最差,而HHAIB处理组显著改善,其中90 s处理组在100 ℃下仍能保持>70%的保留率。这种热保护作用呈现明显的时间依赖性,表明90 s为形成热稳定界面膜的最佳处理时间。
2.8.3 贮藏稳定性分析
图7-c显示不同HHAIB处理的TPC-果胶复合物乳液在贮藏过程中的稳定性变化[13]。所有样品在初期均保持均一,但从第2天开始出现时间和温度依赖的分层现象。未处理组(0 s)分层最快,HHAIB处理组稳定性改善,但210 s处理组效果逊于30~150 s组。高温(25 ℃)显著加速乳液失稳,结果表明,适度处理(30~90 s)通过增强TPC-果胶相互作用优化界面膜,过度处理(150~210 s)导致蛋白质过度变性。90 s处理组在不同温度下均表现最优,与热稳定性结果一致。
2.9 HHAIB处理时间对姜黄素负载TPC-果胶PEs的体外模拟消化的影响
2.9.1 游离脂肪酸释放特性
如图8-a所示,通过测定消化过程中游离脂肪酸释放速率发现,未处理组(0 s)在整个消化过程中释放最快(120 min时达71.89%),表明其界面结构最易被消化酶攻击。经HHAIB处理后,游离脂肪酸释放速率显著减缓,其中90 s处理组效果最为显著(120 min时仅释放31.28%,较未处理组降低39.60%)。这种消化延缓效应呈现处理时间依赖性:30 s和150 s处理组释放率居中,而210 s处理组保护效果下降。表明适度HHAIB处理(90 s)促进TPC-果胶形成更致密的复合界面结构。过短处理(30 s)复合结构不稳定,过长处理(210 s)导致蛋白质过度变性。TPC中多酚组分可能通过抑制消化酶活性延缓脂质消化[15]。结果表明90 s HHAIB处理可最优调控乳液消化特性。
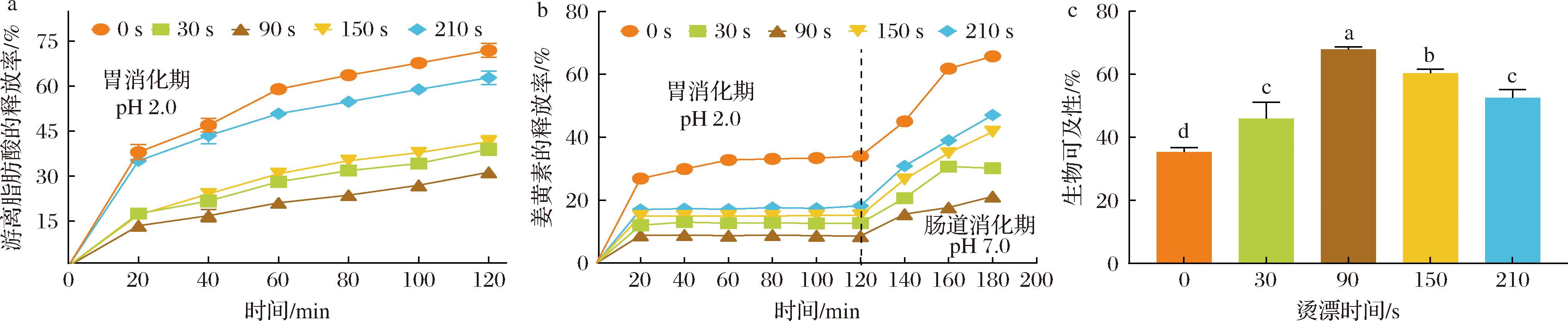
a-HHAIB处理时间对游离脂肪酸的释放速率的影响;b-HHAIB处理时间对姜黄素的释放速率的影响;c-HHAIB处理时间对姜黄素生物可及性的影响
图8 HHAIB处理对姜黄素乳液的体外消化活性的影响
Fig.8 Effect of HHAIB treatment on the in vitro digestion activity of curcumin emulsion
2.9.2 姜黄素稳定性
图8-b显示,在胃相消化阶段(pH 2.0),所有处理组姜黄素保留率均>70%,其中90 s处理组保护效果最佳。肠相阶段(pH 7.0),未处理组(0 s) 120 min内快速释放65.72%,而90 s处理组仅释放21.15%,表现出明显缓释特性。这归因于适度HHAIB处理(90 s)使蛋白-多酚-果胶形成致密三维网络结构,既能抵抗胃蛋白酶水解,又可调控胰酶对界面膜的分解速率[16]。值得注意的是,210 s处理组保护效果较90 s组下降约25.92%,证实过度处理会破坏复合物理想结构。
2.9.3 生物可及性分析
如图8-c所示,HHAIB处理时间与姜黄素生物可及性发现,未处理组(0 s)最低(约35.28%),30~90 s处理组逐步提升,90 s处理组达最佳效果(约67.78%),可能是形成更均匀稳定的界面膜结构,以及蛋白-多酚-果胶分子相互作用增强抗消化酶解能力。但210 s处理时生物可及性回落至约50%,表明过度处理会导致复合物结构破坏。
3 结论
本研究系统考察了不同HHAIB处理时间(0~210 s)对夏秋茶粉及其TPC理化性质的影响,并进一步探究了由此提取的TPC与果胶形成的TPC-Pect复合物对姜黄素Pickering乳液稳定性和消化特性的调控作用。TPC的结构分析显示,150 s处理组分子相互作用最强,总酚含量在30 s达到峰值(33.94 μg/g)。当TPC与果胶复合后,90 s处理组表现出最优异的乳液稳定性能:封装效率较未处理组提升19%,形成的致密界面层和三维网络结构显著提高了热稳定性和储存稳定性。体外消化研究表明,TPC-Pect复合物能有效调控消化过程,90 s处理组在肠阶段的姜黄素保留率较对照组高44.57%,最终生物可及性达67.78%,证实其作为脂溶性活性成分递送载体的应用潜力。结果表示适度的HHAIB处理优化了TPC的结构特性,既保留表面活性又形成稳定网络。综合表明,90 s HHAIB处理获得的TPC-Pect复合物是理想的姜黄素递送载体,且HHAIB是一种有效的茶叶成分改性技术,可用于构建稳定、功能化的乳液递送体系。
[1] WANG X, LI X X, LIU B, et al.Comparison of chemical constituents of Eurotium cristatum-mediated pure and mixed fermentation in summer-autumn tea[J].LWT, 2021, 143:111132.
[2] CAO M, CAO Z, TIAN J J, et al.Structural characterization and in vitro antioxidant activity of a novel polysaccharide from summer-autumn tea[J].Foods, 2024, 13(6):821.
[3] XU J, ZHANG Y Y, ZHANG M K, et al.Effects of foliar selenium application on Se accumulation, elements uptake, nutrition quality, sensory quality and antioxidant response in summer-autumn tea[J].Food Research International, 2024, 175:113618.
[4] WANG J, MUJUMDAR A S, DENG L Z, et al.High-humidity hot air impingement blanching alters texture, cell-wall polysaccharides, water status and distribution of seedless grape[J].Carbohydrate Polymers, 2018, 194:9-17.
[5] WANG J, FANG X M, MUJUMDAR A S, et al.Effect of high-humidity hot air impingement blanching (HHAIB) on drying and quality of red pepper (Capsicum annuum L.)[J].Food Chemistry, 2017, 220:145-152.
[6] ZHENG B J, ZHANG Z P, CHEN F, et al.Impact of delivery system type on curcumin stability:Comparison of curcumin degradation in aqueous solutions, emulsions, and hydrogel beads[J].Food Hydrocolloids, 2017, 71:187-197.
[7] ZHAO S Y, AN N N, ZHANG K Y, et al.Evaluation of drying kinetics, physical properties, bioactive compounds, antioxidant activity and microstructure of Acanthopanax sessiliflorus fruits dried by microwave-assisted hot air drying method[J].Journal of Food Engineering, 2023, 357:111642.
[8] JOSHI S M, GOGATE P R.Intensification of dilute acid hydrolysis of spent tea powder using ultrasound for enhanced production of reducing sugars[J].Ultrasonics Sonochemistry, 2020, 61:104843.
[9] SHANG X J, WEI Y B, GUO X, et al.Dynamic changes of the microbial community and volatile organic compounds of the northern Pike (Esox lucius) during storage[J].Foods, 2023, 12(13):2479.
[10] WANG X D, CHEN S, CUI Q, et al.Effect of pH on freeze-thaw stability of glycated soy protein isolate[J].Journal of Oleo Science, 2019, 68(3):281-290.
[11] AN Z N, LIU Z B, MO H Z, et al.Preparation of Pickering emulsion gel stabilized by tea residue protein/xanthan gum particles and its application in 3D printing[J].Journal of Food Engineering, 2023, 343:111378.
[12] LI L L, WANG W J, JI S P, et al.Soy protein isolate-xanthan gum complexes to stabilize Pickering emulsions for quercetin delivery[J].Food Chemistry, 2024, 461:140794.
[13] RAWAL K, WANG Y M, ANNAMALAI P K, et al.Enhancing the storage stability and shelf-life of plant-based Pickering emulsions through emulgel formation[J].Innovative Food Science &Emerging Technologies, 2024, 97:103795.
[14] ZHU Y, ZHOU Y, TIAN T, et al.In vitro simulated digestion and microstructure of peppermint oil nanoemulsion[J].Journal of Oleo Science, 2019, 68(9):863-871.
[15] CANET A, BONET-RAGEL K, BENAIGES M D, et al.Lipase-catalysed transesterification:Viewpoint of the mechanism and influence of free fatty acids[J].Biomass and Bioenergy, 2016, 85:94-99.
[16] LI Z L, PENG S F, CHEN X, et al.Pluronics modified liposomes for curcumin encapsulation:Sustained release, stability and bioaccessibility[J].Food Research International, 2018, 108:246-253.
[17] WANG J, PEI Y P, CHEN C, et al.High-humidity hot air impingement blanching (HHAIB) enhances drying behavior of red pepper via altering cellular structure, pectin profile and water state[J].Innovative Food Science &Emerging Technologies, 2023, 83:103246.
[18] HUANG J Y, HU Z H, HU L P, et al.The modification effects of Roselle anthocyanin film on shrimp texture via water distribution controlling and protein conformation maintenance[J].Food Bioscience, 2022, 49:101976.
[19] ORSAVOV J, JUR
J, JUR KOV
KOV T, BEDNA
T, BEDNA
 KOV
KOV R, et al.Total phenolic and total flavonoid content, individual phenolic compounds and antioxidant activity in sweet rowanberry cultivars[J].Antioxidants, 2023, 12(4):913.
R, et al.Total phenolic and total flavonoid content, individual phenolic compounds and antioxidant activity in sweet rowanberry cultivars[J].Antioxidants, 2023, 12(4):913.
[20] RAO Z N, KOU F B, WANG Q M, et al.Effect of superfine grinding chestnut powder on the structural and physicochemical properties of wheat dough[J].International Journal of Biological Macromolecules, 2024, 259:129257.
[21] ROZENBERG M, LANSKY S, SHOHAM Y, et al.Spectroscopic FTIR and NMR study of the interactions of sugars with proteins[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2019, 222:116861.
[22] HUANG X, YAN C J, LIN M, et al.The effects of conjugation of walnut protein isolate with polyphenols on protein solubility, antioxidant activity, and emulsifying properties[J].Food Research International, 2022, 161:111910.
[23] CHEN S W, TAO C Y, HUANG Y W, et al.Modulation of protein glutaminase α-helix and disulfide bonds in a sunflower pollen microgel microenvironment:A strategy to enhance enzyme activity and stability[J].Food Chemistry, 2025, 480:143561.
[24] REN L K, FAN J, YANG Y, et al.Enzymatic hydrolysis of broken rice protein:Antioxidant activities by chemical and cellular antioxidant methods[J].Frontiers in Nutrition, 2021, 8:788078.
[25] ARAIZA-CALAHORRA A, AKHTAR M, SARKAR A.Recent advances in emulsion-based delivery approaches for curcumin:From encapsulation to bioaccessibility[J].Trends in Food Science &Technology, 2018, 71:155-169.