粉葛是一种重要的药食同源植物,素有“亚洲人参”和“南葛北参”美誉。粉葛淀粉(kudzu starch,KS)大约占葛根干重的51.6% (质量分数)[1],此外还含有微量的异黄酮,在保健品和医疗产品的开发中具有广阔的应用前景。研究表明,利用物理、化学和酶的方法对KS进行修饰,KS的特性(包括糊化、老化回生、消化、黏度、界面活性等)得到改善和提升,这些改进潜在拓宽了其应用[2]。在外加条件(如热处理、溶剂处理)下,淀粉分子与外源酚类物质可以通过氢键或共价键相互作用,形成了具有V型结构的淀粉-酚类复合物[3]。这种结构变化进一步影响了复合物的消化率[4]。如蒲公英中黄酮类化合物改变了马铃薯淀粉的微观结构、结晶度和体外消化率[5]。在水热条件下,藜麦多酚和玉米淀粉可通过氢键形成V型包合物和非包合物,使玉米淀粉消化率降低[6]。
板栗(Castanea mollissima Blume)是一种多年生木本植物,广泛种植于中国、欧洲、北美等。板栗由板栗仁、板栗壳和板栗种皮等组成,目前板栗的传统加工方法多为将板栗仁自然风干、糖浆炒熟或煮熟,板栗壳和种皮多被丢弃[7]。研究发现,被丢弃的板栗种皮中含有大量的多酚和黄酮类物质,包括柚皮苷、异鼠李素、木犀草素、山奈酚等[8]。ZHANG等[7]使用热熔法将板栗种皮黄酮提取物(chestnut inner skin flavonoids extract,CSFE)与玉米淀粉、马铃薯淀粉和板栗淀粉复合,发现淀粉水解速度减缓,但对于不同的淀粉抑制效果不同。目前,有研究采用莓茶黄酮提取物与KS制备复合物,显著改善了原淀粉的消化性能[9],而鲜见有关于CSFE抑制KS快消化性的研究。本试验将对KS进行压热处理,然后辅助超声波,添加CSFE到糊化后的KS淀粉溶液中,制备获得粉葛淀粉-板栗种皮黄酮复合物(KS-CSFE),采用扫描电子显微镜(scanning electron microsope,SEM)和激光共聚焦扫描显微镜(confocal laser scanning microscope,CLSM)考察复合物形态结构,X射线衍射(X-ray diffraction,XRD)测定复合物的晶体结构,差示扫描量热(differential scanning calorimetry,DSC)法检测热特性表征淀粉内部结构变化,最后通过体外模拟消化和动力学曲线拟合计算淀粉水解速率。本研究运用改进的复合方法制备KS-CSFE,并通过双重模拟计算了复合物的预测血糖生成指数(glycemic index,GI),为研发KS低GI产品提供了理论依据。
1 材料与方法
1.1 材料与试剂
粉葛淀粉,广西藤县绿色田园葛业有限公司;板栗种皮,广西桂西北食品有限公司;DNS,北京索莱宝科技有限公司;无水葡萄糖、α-淀粉酶(10 U/mg)、葡萄糖苷酶(10 000 U/mL),上海源叶生物科技有限公司;柚皮苷、木犀草素、异鼠李素等标准品,成都曼思特生物科技有限公司;无水乙醇、盐酸、醋酸钠、KOH等(均为分析纯),西陇科学股份有限公司。
1.2 仪器与设备
TDL-350医用离心机,山东百欧医疗科技有限公司;T6新世纪紫外分光光度计,北京普析通用仪器有限责任公司;YXQ-LS-50A立式压力蒸汽灭菌锅,上海博讯实业有限公司;美国-TA-DSC2差示扫描量热仪,广东晟泽科技有限公司;Nicolet傅里叶红外光谱仪,美国Therom Fisher公司;XPert3 Powder X-射线衍射仪,荷兰帕纳科公司;SB-5200超声波清洗机,宁波新芝生物科技股份有限公司;EVO18扫描电子显微镜、LSM 880激光共聚焦显微镜,德国蔡司(ZEISS)公司;ZWY-240恒温培养振荡器,上海智城分析仪器制造有限公司;ExionLC高效液相色谱仪、X500Q-TOF高分辨质谱仪,AB Sciex公司。
1.3 试验方法
1.3.1 CSFE的提取
参考ZHENG等[10]的方法略有改动,称取5 g板栗种皮,加200 mL体积分数70%乙醇溶液,超声波提取90 min(超声波功率240 W),抽滤,40 ℃旋蒸浓缩6 h,冷冻干燥,即得CSFE。参考文献[8]的方法使用LC-MS定性分析提取物,其主要成分为:柚皮苷、木犀草素、异鼠李素、山奈酚、芹菜苷和槲皮素。随后,对这些成分进行了HPLC分析,其相对含量分别为:48.34%、15.32%、14.56%、10.73%、5.42%、1.20%。
1.3.2 KS-CSFE的制备
准确称取2 g KS,加40 mL纯净水分散均匀,置于高压灭菌锅中,121 ℃压热处理30 min。称取200 mg CSFE溶于10 mL乙醇中。将两者混匀后于70 ℃超声波处理30 min,冷却至常温后于-4 ℃中静置24 h,4 000 r/min离心30 min,-40 ℃冷冻干燥后粉碎,过150 μm筛孔,即得KS-CSFE。不添加的CSFE的KS进行同样的处理作为空白对照样品(Control)。
1.3.3 SEM和CLSM测定
SEM测定:将淀粉样品用导电胶固定在铝制样品板上,喷金。在1.0 kV、5.00 μm条件下,采用SEM观察样品颗粒微观形态结构并进行拍照,图像放大倍数为500、2 000。
CLSM测定:将淀粉样品均匀分散于1 mL纯净水中。吸取样品悬浮液于载玻片上,盖上盖玻片后置于CLSM下进行观察。物镜为20×,激发光谱为488 nm,发射光谱470~530 nm。
1.3.4 傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)测定
准确称取3 mg样品与300 mg KBr研细混匀,压片。测定条件:分辨率4 cm-1,范围4 000~400 cm-1;扫描3次后取平均值,得到样品的红外光谱图。
1.3.5 XRD测定
将一定量样品紧密填充于玻璃样品板上,并置于载物台上。X衍射条件为Cu靶,电压40 kV,电流30 mA,扫描步长为0.02°,扫描速度5°/min,测定范围5°~40°。相对结晶度使用Jade软件计算。
1.3.6 DSC测定
称取2 mg淀粉样品与纯净水以1∶5(g∶mL)的比例混合,室温条件下平衡24 h,DSC装置中糊化,设置升温范围10~110 ℃,升温速率10 ℃/min。以空坩埚为参考,载气为N2。从DSC数据中确定糊化的起始温度To、峰温度Tp和终止温度Tc,根据峰面积计算糊化焓值(ΔH)。
1.3.7 体外消化测定及餐后血糖指数预测
参考ZHENG等[11]的方法并稍作修改:称取100 mg淀粉样品分散在10 mL乙酸钠缓冲液(0.1 mol/L,pH 5.3)中,于37 ℃的恒温摇床中平衡30 min后加入5 mL混合酶溶液(α-淀粉酶100 U/mL,葡萄糖淀粉酶50 U/mL)。在摇床中持续振荡,在酶解后的10、20、30、45、60、120、180 min分别吸取1 mL消化液,用5 mL无水乙醇灭酶,4 000 r/min离心20 min。取1 mL上清液,加入DNS试剂,显色反应8 min。540 nm波长下测定吸光度值。通过公式(1)~公式(3)计算快消化淀粉(rapidly digestible starch,RDS),缓慢消化淀粉(slowly digestible starch,SDS)和抗性淀粉(resistant starch,RS)含量。
(1)
(2)
RS/%=(1-RDS-SDS)×100
(3)
式中:G0 min,样品游离葡萄糖质量,mg;G20 min,淀粉水解20 min产生的葡萄糖质量,mg;G120 min,淀粉水解120 min产生的葡萄糖质量,mg;TS,样品中总淀粉的质量,mg。
淀粉餐后GI预测利用ZHEN等[12]的方法建立KS体外消化动力学并对曲线进行动力学拟合,如公式(4)所示:
(4)
水解曲线下面积(area under curve,AUC) 计算见公式(5):
AUCexp=![]()
(5)
(6)
GI=0.862HI+8.189
(7)
式中:Ct,t时刻淀粉的水解率,%;C∞,淀粉消化最终平衡时的水解率,%;HI,水解指数(hydrolysis index,HI);k,一阶动力学速率常数,min-1;t,反应时间,min;Tint,两条直线相交的时间,min;Cint,Tint时的水解率,%。
1.4 数据与统计
所有实验均重复3次,结果以“平均值±标准差”表示,运用Excel 2021和Origin 2021软件进行数据处理和分析。
2 结果与分析
2.1 SEM和CLSM分析
KS与CSFE复合后,淀粉分子包埋了许多黄酮多酚类物质,其外观结构、空间结构等都会发生变化。KS、Control和KS-CSFE的SEM图如图1-a~图1-c所示。KS呈现多边形、球形和半球形颗粒,具有光滑的表面[13]。经压热处理后,Control颗粒呈现不规则块状结构,与文献[7]研究结果一致。这可能是因为淀粉经过压热处理充分糊化,破坏了原有的结构,与黄酮多酚类物质结合,在淀粉老化后形成较为致密的结构。KS-CSFE的表面变得粗糙且存在许多细小的颗粒,这可能是由于黄酮多酚类物质与淀粉分子之间的氢键作用,导致复合物的表面形态发生变化。
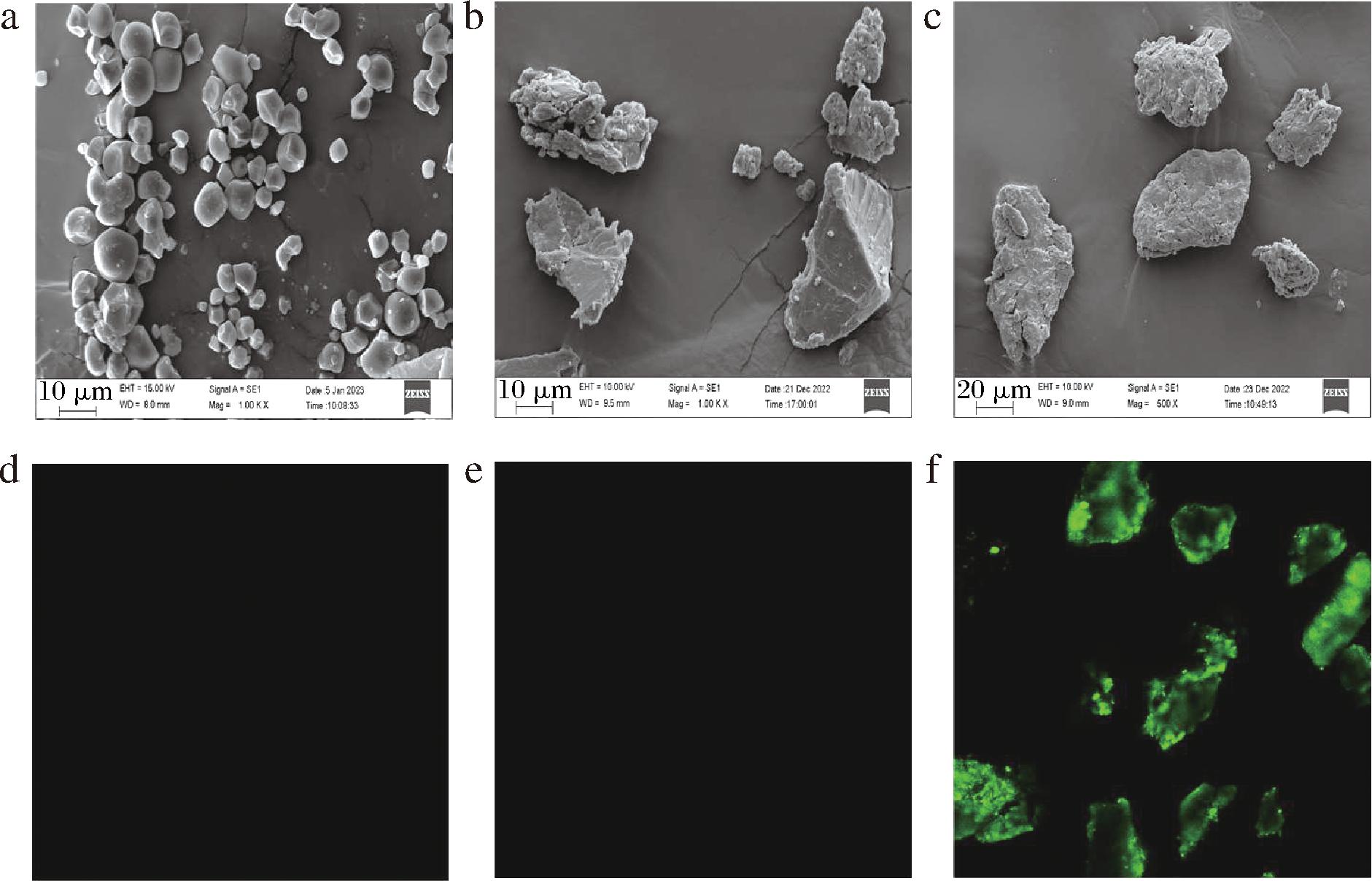
a-KS;b-Control;c- KS-CSFE;d-单荧光通道KS;e-单荧光通道Control;f-单荧光通道KS-CSFE
图1 KS、Control及KS-CSFE的SEM与CLSM图
Fig.1 SEM and CLSM images of KS,Control,and KS-CSFE
黄酮多酚类物质具有自发荧光性质,所以通过CLSM观察其在淀粉中的分布。如图1-d~图1-f所示,在单荧光通道视野下,KS和Control颗粒中均未出现荧光结构,KS-CSFE具有较强的绿色荧光。这个现象归因于板栗种皮提取物中富含黄酮多酚类化合物,与先前报道的莲子淀粉-茶多酚复合物的荧光结构一致[14],荧光观察的结果表明,黄酮多酚类物质在淀粉中的分布是均匀的。黄酮多酚类物质被有效包埋。
2.2 FTIR分析
如图2所示,3 382 cm-1处宽吸收峰是由淀粉分子间羟基伸缩振动产生的,2 921 cm-1表示—CH2键的伸缩振动,1 020 cm-1和1 080 cm-1的吸收峰与C—O键的伸缩振动有关[15]。与Control相比,KS-CSFE复合物在3 382 cm-1附近有较宽的峰型,这是因为黄酮多酚类化合物加入到淀粉中,带入了较多的多羟基结构,从而导致更大的氢键吸收峰面积。KS-CSFE中没有出现新的特征峰,这说明复合物的构建是通过物理作用进行。
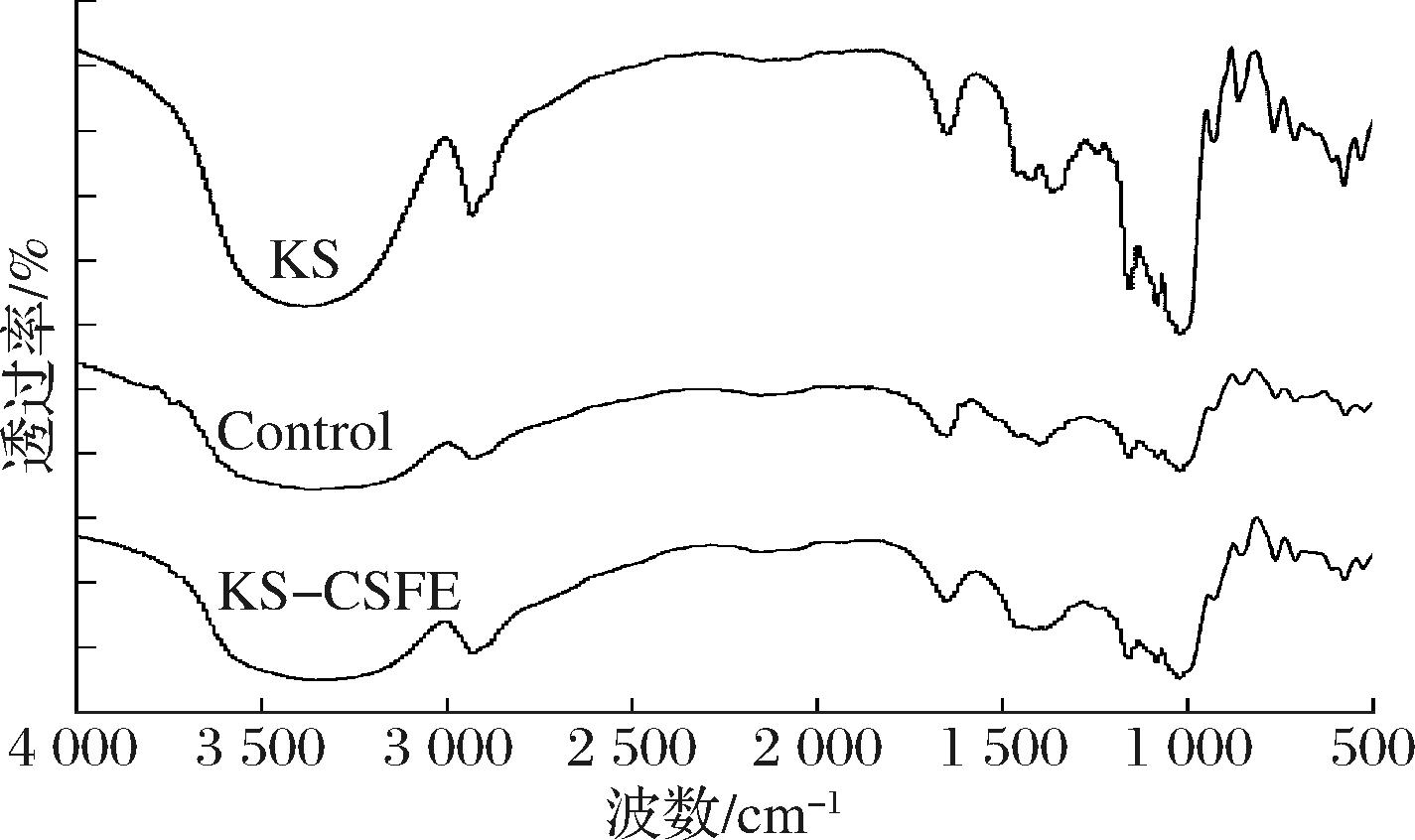
图2 KS、Control及KS-CSFE的红外光谱图
Fig.2 Infrared spectra of KS, Control, and KS-CSFE
淀粉样品的双螺旋的短程有序性可以通过1 047 cm-1/1 022 cm-1的FTIR吸光度比来表征[16]。如表1所示,KS-CSFE和Control的短程有序性显著低于KS(P<0.05),这是因为热处理破坏了KS的有序结构。而KS-CSFE的短程有序性较Control提高了0.04,表明CSFE进入淀粉的双螺旋内腔,提高了淀粉的有序度,进一步证明KS-CSFE复合物的形成[17]。
表1 KS、Control 和 KS-CSFE短程有序性
Table 1 Short-range order of KS, Control, and KS-CSFE

注:不同小写字母表示差异显著(P<0.05)(下同)。
名称IKS1.36±0.04aControl1.04±0.02bKS-CSFE1.08±0.03b
2.3 XRD分析
如图3所示,KS在15.0°、17.0°和23.0°处具有较明显的衍射峰,为A型晶体结构,相对结晶度为37.23%(表2)。压热处理后Control没有明显的特征峰且相对结晶度为0.08%,表明压热处理过程中破坏了KS的原有晶型结构[18]。KS-CSFE在13.0°和21.0°存在较为明显的特征峰,表现为V型复合物特征,可能是由于一部分CSFE内黄酮小分子化合物进入KS直链淀粉螺旋内的疏水空腔中以促进V型复合物。KS-CSFE在18.0°出现明显的特征峰,新峰的出现可能是由于一部分CSFE内黄酮化合物通过氢键作用结合在KS表面形成非包合复合物。研究表明CSFE与板栗淀粉复合后其淀粉晶型未发生改变[7],这可能与复合方法有关。如表2所示,KS-CSFE的结晶度相较于Control上升了12.13%。WANG等[19]将莲叶黄酮与淀粉复合后形成了新的晶体结构,LI等[20]在小麦淀粉中添加茶多酚后增加了结晶度,故可能是因为CSFE中黄酮多酚物质增加了淀粉的相对结晶度。
表2 KS、Control和KS-CSFE相对结晶度
Table 2 Relative crystallinity of KS, Control, and KS-CSFE

名称相对结晶度/%KS37.23±1.86aControl0.08±0.01bKS-CSFE12.21±1.72c
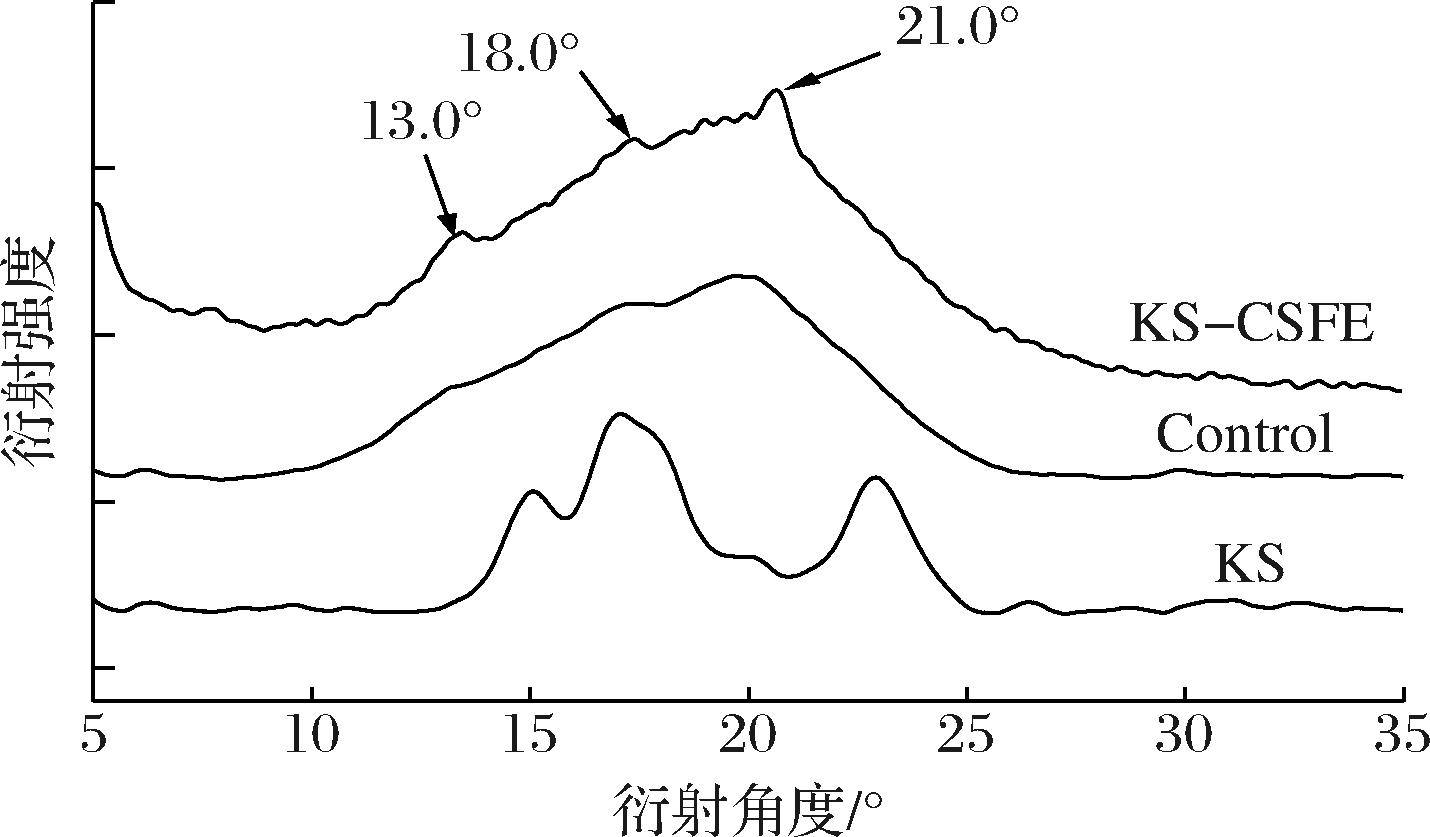
图3 KS、Control和 KS-CSFE X射线衍射图
Fig.3 X-ray diffractograms of KS, Control, and KS-CSFE
2.4 DSC分析
如表3所示,KS的起始温度(T0)、峰值温度(TP)和终值温度(Tc)的转变温度分别为73.12、82.68、93.92 ℃,糊化焓(ΔH)为2.46 J/g。与ZHANG等[21]报道的KS转变温度和糊化焓结果相似。Control几乎没有明显的吸热峰,这是因为压热处理破坏了淀粉的晶体结构,淀粉在处理过程中就已经部分或完全糊化,淀粉已经没有未糊化的结晶区可以熔化。研究表明,在高温高压处理下,淀粉发生糊化,淀粉的非晶区和结晶区受到严重破坏,促使直链淀粉浸出,这为黄酮多酚等活性提供了与直链淀粉形成复合物的机会,进而引起分子重排和重结晶结构。与Control淀粉相比,KS-CSFE的糊化焓(ΔH)有小幅度上升,说明KS与CSFE之间形成了新的相互作用,如氢键或共价键,进一步说明复合物的形成。
表3 KS、Control和KS-CSFE的热特性
Table 3 Thermal properties parameters of KS,Control,and KS-CSFE

T0/℃TP/℃TC/℃ΔH/(J/g)KS73.12±0.18a82.68±0.42a93.92±0.26a2.46±0.06aControl54.25±0.48b58.56±0.28b62.31±0.10b0.10±0.04bKS-CSFE86.63±0.36c105.81±0.46c115.42±0.42c0.54±0.18c
2.5 淀粉的消化曲线和RSD、SDS、RS含量分析
如图4所示,KS在前20 min内水解速率较快,120 min后消化曲线趋近于平衡,最终消化率为88.30%。GUAN等[22]研究表明,KS有较高的消化率,2 h消化接近93%。KS-CSFE的消化速率显著低于KS和Control(P<0.05),其最终消化率为63.21%。如表4所示,与KS相比,KS-CSFE中的RDS含量降低了19.28%,而RS含量增加了25.25%。与文献[7]中CSFE对玉米淀粉、马铃薯淀粉和板栗淀粉作用结果趋势一致。这是由于KS与CSFE之间形成了复合物,改变了淀粉的晶体结构,使淀粉结构更加紧密,从而阻碍了淀粉酶的酶解,降低了淀粉的消化率,这与XRD、FTIR和DSC测量结果一致。减少RDS的摄入有助于避免血糖水平的快速上升,维持血糖水平的稳定。
表4 KS、Control和KS-CSFE的RDS、SDS和RS含量
Table 4 RDS, SDS, and RS contents of KS, Control, and KS-CSFE

RDS/%SDS/%RS/%KS64.79±0.88a18.48±1.69a14.73±0.80aControl54.61±2.41b17.06±0.40a26.33±2.41bKS-CSFE45.51±1.61c14.78±1.24b39.98±0.84c
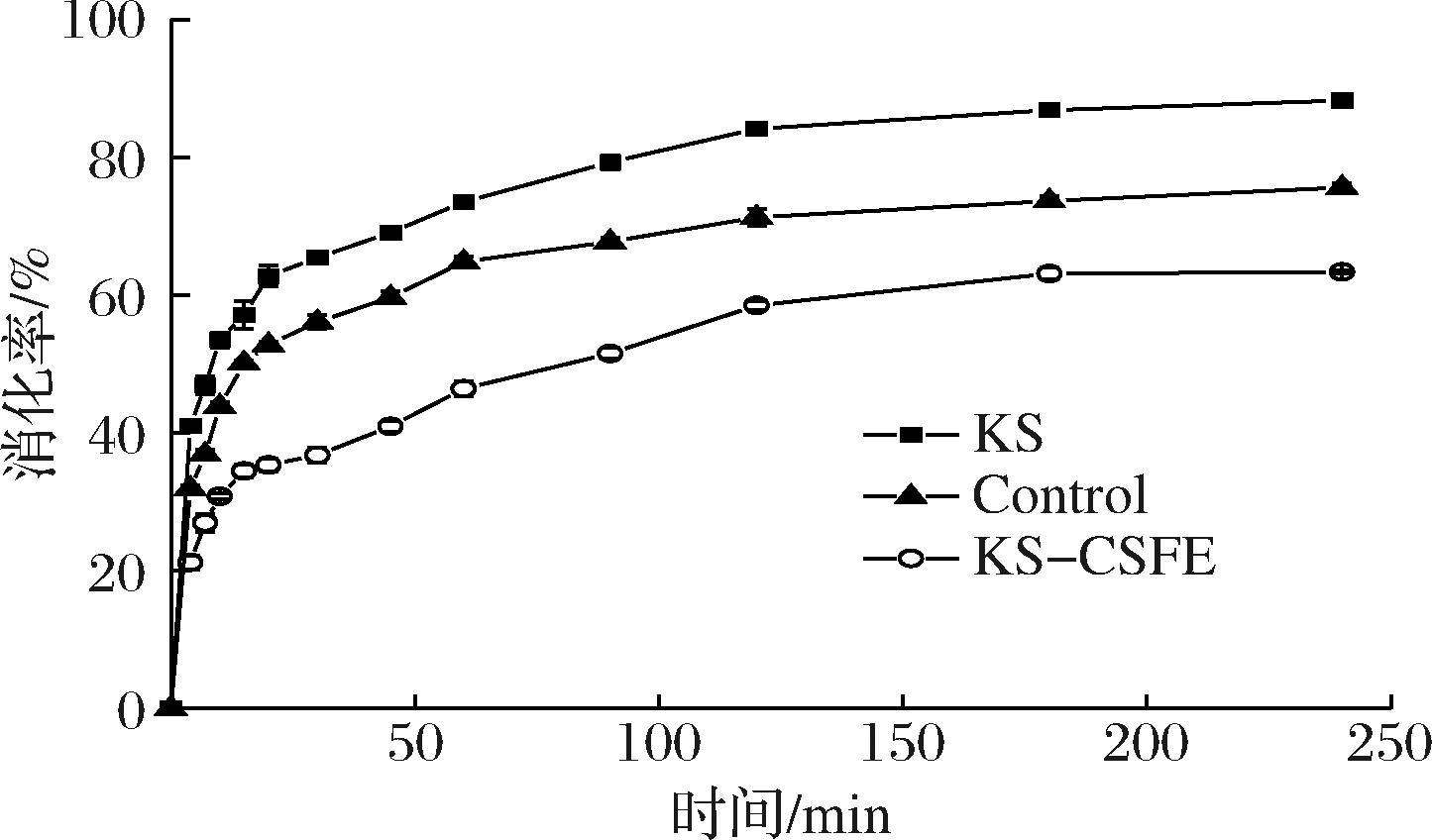
图4 KS、Control和KS-CSFE 消化曲线图
Fig.4 Digestion curves of KS, Control, and KS-CSFE
2.6 淀粉消化动力学和GI值分析
为了更好地了解KS和KS-CSFE的酶消化机理,拟合消化动力学模型估算了C∞、k和HI。根据LOS模型,淀粉的消化过程并非匀速进行,而是可以分为2个阶段,分别对应动力学常数k1、C1∞和k2、C2∞。如图5、表5所示,预测KS平衡浓度(C1∞)为62.82%,k1为0.159 min-1,k值的大小与淀粉水解到达C1∞的速率成正比[23],这表明KS具有快消化特征。KS-CSFE的C1∞和k1与KS相比,下降了27.47%和0.025 min-1,具有显著性差异(P<0.05)。可能是由于复合后颗粒表面的结晶结构导致了较低的酶亲和力,使得淀粉消化速率降低。
表5 KS、Control和KS-CSFE的消化动力学常数和GI值
Table 5 Digestion kinetic constants and GI values for KS, Control, and KS-CSFE

样品C1∞/%k1/min-1C2∞/%k2/min-1Tint/minGI值KS62.82±0.78a0.159±0.002a25.49±0.34b0.013±0.001a22.48±0.32a86.42±0.36aControl52.81±0.64b0.147±0.003b22.85±0.48c0.010±0.003a22.81±0.13a75.15±0.92bKS-CSFE35.35±0.72c0.134±0.003c28.05±0.31a0.012±0.002a24.20±0.22b54.72±0.42c
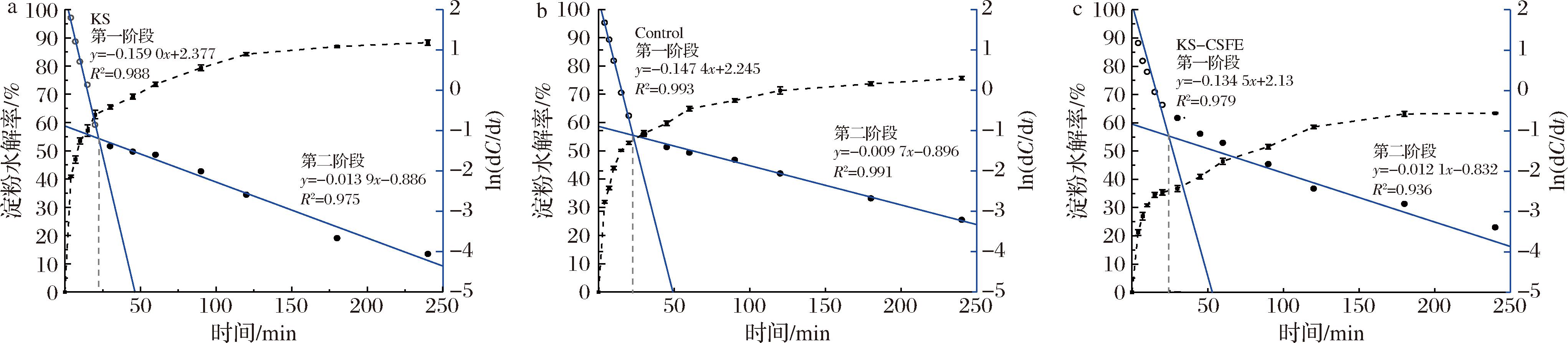
a-KS;b-Control;c-KS-CSFE
图5 KS、Control和KS-CSFE的LOS模型图
Fig.5 Plot of the LOS model for KS, Control, and KS-CSFE
研究表明,淀粉消化率曲线和LOS图分析获得的数据与GI值密切相关[24]。根据AUGUSTIN等[25]的研究,以白面包为标准,GI值>70为高GI食物,59~69为中GI食物,低于55为GI食物。KS和Control的GI值分别为86.42、75.15,属于高GI食品。而KS-CSFE的GI值下降至54.72,从高GI食品转变为低GI食品。因此,CSFE可以作为功能添加原料生产新型低GI的KS食品。
3 结论
本研究采用压热-超声波法制备KS-CSFE,并考察了KS-CSFE的结构和消化特性。SEM和CLSM结果表明KS-CSFE为致密的块状结构,且板栗种皮黄酮多酚已成功进入KS结构中;FTIR和XRD结果表明,CSFE的添加使Control短程有序性由1.04上升为1.08;KS由A型结构转化成了V+A型结构且结晶度提高了12.13%;DSC结果表明,复合后提高了KS的糊化温度;体外消化特征结果表明:与KS相比,KS-CSFE的RDS含量下降了19.28%,RS含量提高了25.25%。经动力学曲线拟合后发现KS-CSFE的C1∞和k1与KS相比,下降了27.47%和0.025 min-1,预估KS-CSFE的GI值为54.72,属于低GI食物。以上结果表明CSFE可以改变KS的结构,对其消化性的降低具有重要意义。
[1] 李臻, 赖富饶, 吴晖.葛根的营养成分分析[J].现代食品科技, 2011, 27(8):1010-1011;1019.LI Z, LAI F R, WU H.Analysis of the nutritional components of kudzu vine root[J].Modern Food Science and Technology, 2011, 27(8):1010-1011;1019.
[2] ZHAO Y G, ZHU X Y, FANG Y P.Structure, properties and applications of kudzu starch[J].Food Hydrocolloids, 2021, 119:106817.
[3] 赵蓓蓓, 贾祥泽, 孙思薇, 等.淀粉-多酚复合物理化及功能特性的研究进展[J].食品科学, 2018, 39(13):297-303.ZHAO B B, JIA X Z, SUN S W, et al.Advances in physicochemical and functional properties of starch-polyphenol complex[J].Food Science, 2018, 39(13):297-303.
[4] ZHU F.Interactions between starch and phenolic compound[J].Trends in Food Science &Technology, 2015, 43(2):129-143.
[5] HUANG Y M, WU P, CHEN X D.Mechanistic insights into the influence of flavonoids from dandelion on physicochemical properties and in vitro digestibility of cooked potato starch[J].Food Hydrocolloids, 2022, 130:107714.
[6] ZHANG Q Z, FAN S Y, XIE H J, et al.Polyphenols from pigmented quinoa as potential modulators of maize starch digestion:Role of the starch-polyphenol inclusion and non-inclusion complexes[J].Food Hydrocolloids, 2023, 144:108975.
[7] ZHANG Y Y, YANG Z L, LIU G G, et al.Inhibitory effect of chestnut (Castanea mollissima Blume) inner skin extract on the activity of α-amylase, α-glucosidase, dipeptidyl peptidase IV and in vitro digestibility of starches[J].Food Chemistry, 2020, 324:126847.
[8] 张雨阳. 板栗种皮黄酮提取物对淀粉体外消化性的影响[D].北京:北京林业大学, 2020.ZHANG Y Y.Effect of chestnut inner skin flavonoids extract on in vitro digestibility of starches [D].Beijing:Beijing Forestry University, 2020.
[9] 赵宁涛, 刘百成, 董新红, 等.莓茶黄酮提取物对粉葛淀粉结构和体外消化的影响[J].粮食与油脂, 2024, 37(4):124-128.ZHAO N T, LIU B C, DONG X H, et al.The effects of the flavonoid extracts from vine tea on structure and in vitro digestibility of kudzu starch[J].Cereals &Oils, 2024, 37(4):124-128.
[10] ZHENG M J, LEI S Z, WU H Q, et al.Effect of chitosan on the digestibility and molecular structural properties of lotus seed starch[J].Food and Chemical Toxicology, 2019, 133:110731.
[11] ZHANG H H, JIANG Y L, PAN J X, et al.Effect of tea products on the in vitro enzymatic digestibility of starch[J].Food Chemistry, 2018, 243:345-350.
[12] ZHEN Y Y, WANG K D, WANG J, et al.Increasing the pH value during thermal processing suppresses the starch digestion of the resulting starch-protein-lipid complexes[J].Carbohydrate Polymers, 2022, 278:118931.
[13] VAN DE VELDE F, VAN RIEL J, TROMP R H.Visualisation of starch granule morphologies using confocal scanning laser microscopy (CSLM)[J].Journal of the Science of Food and Agriculture, 2002, 82(13):1528-1536.
[14] GUO Z B, ZHAO B B, CHEN J, et al.Insight into the characterization and digestion of lotus seed starch-tea polyphenol complexes prepared under high hydrostatic pressure[J].Food Chemistry, 2019, 297:124992.
[15] RAZA H, AMEER K, REN X F, et al.Physicochemical properties and digestion mechanism of starch-linoleic acid complex induced by multi-frequency power ultrasound[J].Food Chemistry, 2021, 364:130392.
[16] HUANG S Q, CHAO C, YU J L, et al.New insight into starch retrogradation:The effect of short-range molecular order in gelatinized starch[J].Food Hydrocolloids, 2021, 120:106921.
[17] XU B G, ZHANG C, LIU Z B, et al.Starches modification with rose polyphenols under multi-frequency power ultrasonic fields:Effect on physicochemical properties and digestion behavior[J].Ultrasonics Sonochemistry, 2023, 98:106515.
[18] WU Y, CHEN Z X, LI X X, et al.Effect of tea polyphenols on the retrogradation of rice starch[J].Food Research International, 2009, 42(2):221-225.
[19] WANG M T, SHEN Q, HU L L, et al.Physicochemical properties, structure and in vitro digestibility on complex of starch with lotus (Nelumbo nucifera Gaertn.) leaf flavonoids[J].Food Hydrocolloids, 2018, 81:191-199.
[20] LI J W, SHEN M Y, XIAO W H, et al.Regulating the physicochemical and structural properties of different starches by complexation with tea polyphenols[J].Food Hydrocolloids, 2023, 142:108836.
[21] ZHANG Z L, YE J P, GUO D B, et al.Improving the instant properties of kudzu powder by complexing with different chain-length fatty acids[J].LWT, 2022, 167:113821.
[22] GUAN Y M, WANG M C, SONG X Q, et al.Study on structural characteristics, physicochemical properties, and in vitro digestibility of kudzu-resistant starch prepared by different methods[J].Food Science &Nutrition, 2023, 11(1):481-492.
[23] TIAN Y, LI M, TANG A X, et al.RS content and eGI value of cooked noodles (I):Effect of cooking methods[J].Foods, 2020 9(3):328.
[24] EDWARDS C H, COCHETEL N, SETTERFIELD L, et al.A single-enzyme system for starch digestibility screening and its relevance to understanding and predicting the glycaemic index of food products[J].Food &Function, 2019, 10(8):4751-4760.
[25] AUGUSTIN L S A, KENDALL C W C, JENKINS D J A, et al.Glycemic index, glycemic load and glycemic response:An international scientific consensus summit from the international carbohydrate quality consortium (ICQC)[J].Nutrition, Metabolism and Cardiovascular Diseases, 2015, 25(9):795-815.