腌制是肉制品加工过程中改善色泽、质地等特性的重要工序。传统干腌法以食盐或辅助腌制剂涂于肉样表面,通过与肌肉渗出液混合进行腌制[1]。虽能有效防止营养物质流失,但其腌制速度十分缓慢,通常需要数天甚至数月的时间[2]。长时间的腌制会导致生产效率低下,使企业在市场竞争中处于劣势。同时,还会导致肉样的质构等品质稳定性下降,进而使终产品标准化程度降低[3]。因此,有必要开发一种高效、实用的干腌辅助技术,以提高腌制速度,缩短腌制周期,同时调控干腌肉品的质构稳定性。
高压静电场(high voltage electrostatic field, HVEF)是一种非热加工技术,具有高效、节能、易操作等优点[4]。刺-板电极HVEF为非均匀电场,其电穿孔效应可使生物膜发生穿孔,通透性改变。此外,其还能够通过电晕放电电离空气产生臭氧与电晕风(含电子、自由基等)[5]。研究表明,HVEF(1.5、3.0 kV)辅助牛肉湿腌,可促进食盐渗透,缩短腌制时间,增加肌原纤维束膜破坏程度,使肌原纤维结构更为松散[6]。CHEN等[7]以不同强度(2.5、3.0、3.5、4.0 kV)HVEF辅助鱼肉腌制,证实HVEF可有效提高腌制速度,且3 kV时腌鱼硬度显著增加,超过3 kV时其硬度下降。可见,HVEF在缩短腌制周期、调控肉品质构方面具有巨大应用潜力。然而,关于HVEF对干腌期间肉品质构变化的影响机制鲜见报道。
组织蛋白酶活性、肌原纤维蛋白(myofibrillar protein, MP)的结构、降解和氧化被认为是加工技术调控肉品质构的关键机制[8-9]。HU等[10]报道称,在火腿腌制期间,组织蛋白酶B和L催化MP降解是使其口感改善的重要原因。BAO等[11]指出,氧化诱导的蛋白结构展开,有利于蛋白酶对其作用降解,使肉质变软。基于此,本研究根据预实验结果,以适度HVEF(8 kV, 15 h, 4 ℃)处理牛肉后,探究干腌期间(1、3、5、7 d)牛肉NaCl含量、质构、组织蛋白酶B和L的活性、MP的降解、氧化及结构特性的变化,以期为HVEF技术在肉制品干腌环节的应用提供理论依据。
1 材料与方法
1.1 材料与仪器
黄牛后腿肉购于四川宜宾翠屏区杰星食品经营部。20月龄公黄牛屠宰后,取去骨后腿肉,以冰袋保藏,6 h内运回实验室。4 ℃条件下,预冷排酸36 h后用于后续试验。铝箔锡纸与食盐均购于当地超市。
乙二醇-双-(2-氨基乙醚)四乙酸[glycol-bis-(2-aminoethylether)-N,N,N′,N′-tetraacetic acid, EGTA]、5,5,-二硫代双(2-硝基苯甲酸)、三氯乙酸、溴酚蓝(bromophenol blue,简称BPB)、2,4-二硝基苯肼,上海麦克林生化科技有限公司;乙酸乙酯、5H2O·CuSO4,成都科隆化学品有限公司;四水合酒石酸钾钠,国药集团化学试剂有限公司;牛组织蛋白酶B(Cath-B)ELISA科研试剂盒、牛组织蛋白酶L(Cath-L)ELISA科研试剂盒,江苏酶免生物科技有限公司;SDS-PAGE制备试剂盒、4×蛋白上样缓冲液,北京索莱宝科技有限公司;三色预染蛋白Marker(10~245 kDa),上海生工生物工程有限公司;实验用试剂均为分析纯及以上。
EFI-A1高压静电场发生装置,英都斯特(无锡)感应科技有限公司;DSM-25数显盐度计,上海力辰邦西仪器有限公司;TA-XT plus质构分析仪,英国Stable Micro Systems公司;FSH-2A高速分散均质机,杭州旌斐仪器科技有限公司;TGL-21M大容量高速冷冻离心机,上海卢湘仪离心机仪器有限公司;N5000PLUS 紫外可见分光光度计,上海佑科仪器仪表有限公司;Chirascan圆二色光谱仪,英国应用光物理公司;LS55荧光分光光度计,珀金埃尔默仪器公司。
1.2 试验方法
1.2.1 样品处理
排酸黄牛后腿肉,除去可见筋膜以滤纸吸去牛肉表面血水,修整规格为(2±0.1) cm×(2±0.1) cm×(2±0.1) cm、质量为(10±0.5) g的样品进行腌制处理,以未腌制的黄牛后腿肉作为腌制0 d样品。
1.2.2 样品干腌处理
参照ZHANG等[12]的腌制方法,并稍作修改。称取肉重2.5%的食盐对牛肉涂抹混匀后,以铝箔锡纸半包裹(暴露部分肉样)并随机分为2组,一组置于4 ℃的恒温冰箱中腌制作为对照组(refrigerator,RF)。另一组则置于刺-板电极HVEF设备中进行腌制,电场参数如下:极板为304不锈钢刺-板电极,未作包埋处理,极板尺寸为35 cm×35 cm,极板间距为15 cm,可装载样品量为10,电场强度:8 kV,15 h,4 ℃(前期预实验表明该腌制条件能够有效缩短牛肉达到腌制平衡的时间),该组记作HVEF组,具体设备处理方式如图1所示。2组肉样腌制处理15 h后,去除铝箔锡纸,分别装入真空密封袋真空处理,标记后将肉样置于4 ℃条件下继续腌制9 h,记作腌制1 d的样品。此后,在腌制第3、5、7天,再分别取样并于液氮中快速冷冻,随后存放在-80 ℃冰箱中,以备后续指标测定。
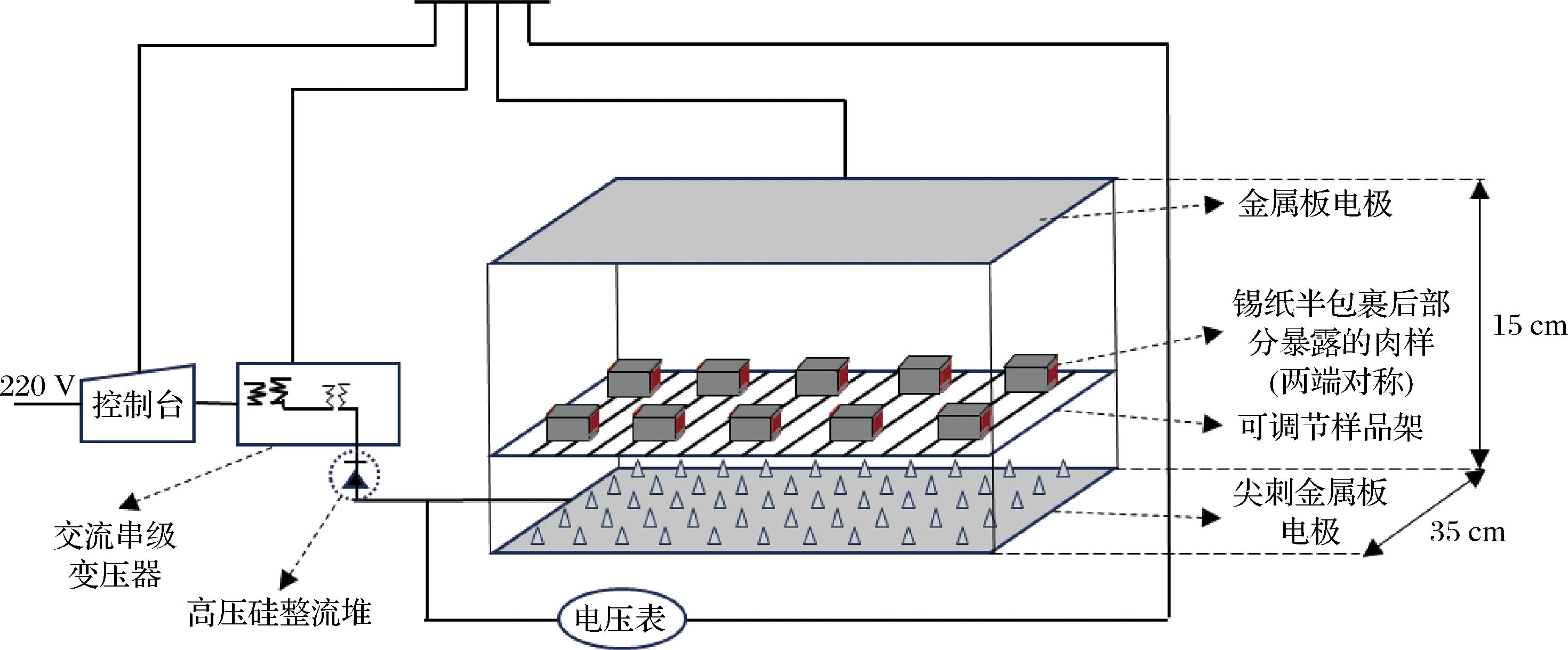
图1 HVEF处理腌制牛肉示意图
Fig.1 Diagram of HVEF processing cured beef
1.2.3 NaCl含量的测定
采用数显盐度计对样品NaCl含量进行测定,重复测3次。测定结果以NaCl含量占肉重的百分比(%)表示。
1.2.4 质构的测定
根据GUO等[13]的方法稍作修改。牛肉样品置于密封袋中, 80 ℃水浴20 min后取出肉样于室温下冷却至肉样中心温度为20~25 ℃,然后沿肌肉纤维平行方向切割成1 cm×1 cm×1.5 cm的小块,以型号为HDP/USR的探头,对肉样进行质构测定。测定条件为:测前速率5.00 mm/s;测中速率1.00 mm/s;测后速率5.00 mm/s;触发力为5 g;压缩比为40%。每个处理重复测试6个样本,每个样本测试2次。
1.2.5 组织蛋白酶B和L活性的测定
采用牛组织蛋白酶B(Cath-B)ELISA科研试剂盒和牛组织蛋白酶L(Cath-L)ELISA科研试剂盒分别测定组织蛋白酶B、L活性,每组重复3次。
1.2.6 肌原纤维小片化指数(myofibrillar fragmentation index,MFI)的测定
按CULLER等[14]的方法,适当修改。取4 g碎样于30 mL MFI缓冲液(100 mmol/L KCl、11.2 mmol/L K2HPO4、8.8 mmol/L KH2PO4、1 mmol/L EGTA、1 mmol/L MgCl2和1 mmol/L NaN3)中均质,离心(15 min,4 ℃,1 000×g)后去上清液,以300 mL MFI缓冲液重悬,再次离心弃去上清液,加15 mL MFI缓冲液重悬。将其质量浓度调至0.5 mg/mL。540 nm处测定悬液吸光度,以平均吸光度乘以200,即为MFI值。
1.2.7 MP的提取
参照ZHANG等[15]的方法,稍做修改。取4 g碎肉,置于4倍体积磷酸盐缓冲液A(0.1 mol/L KCl,1 mmol/L EGTA、20 mmol/L K2HPO4、20 mmol/L KH2PO4、2 mmol/L MgCl2,pH值 7.0)中匀浆,离心(15 min,4 ℃,4 500×g),去上清液留沉淀。重复3次后,将沉淀重悬于4倍体积缓冲液B(0.1 mol/L NaCl),再次匀浆离心,弃上清液留沉淀,重复3次。最后一次离心前,以干纱布去除结缔组织。将沉淀溶于缓冲液C(0.6 mol/L NaCl、20 mmol/L K2HPO4、20 mmol/L KH2PO4,pH值 7.0)作MP。以双缩脲法调整至同一质量浓度。
1.2.8 圆二色光谱的测定
参考CHEN等[16]的方法进行适当修改。将MP稀释至0.5 mg/mL,以磷酸盐缓冲液为背景,每个样品扫描3次,扣除背景后计算平均值。扫描波长:190~260 nm,步阶设置:1 nm,速率:50 nm/min。以CDNN软件计算出蛋白质二级结构的相对含量。
1.2.9 内源荧光强度的测定
参照ZHAO等[17]的方法,稍作修改。以磷酸盐缓冲液作空白对照,将MP溶液稀释至0.5 mg/mL,以LS55荧光分光光谱仪检测MP色氨酸荧光强度变化。激发波长290 nm,狭缝宽度10 nm,发射光谱范围300~400 nm。以磷酸盐缓冲液作对照,重复测3次。
1.2.10 表面疏水性的测定
参考CHELH等[18]的方法,稍作修改。MP溶液稀释至2 mg/mL,将1 mL蛋白溶液与200 μL 1 mg/mL溴酚蓝室温下混合摇匀10 min后,冷冻离心10 min(8 000 r/min,4 ℃)。取上清液在595 nm波长处测定吸光度。将200 μL 1 mg/mL的BPB溶液加入至1 mL磷酸盐缓冲液C中作为空白组,测定吸光度A0,重复测3次,表面疏水性以溴酚蓝结合量表示,按公式(1)计算。
(1)
式中:S,溴酚蓝结合量,μg;A0,空白吸光度;A,样品吸光度。
1.2.11 羰基含量的测定
参照OLIVER等[19]的方法并稍作修改。以缓冲液将MP质量浓度调至2 mg/mL,以2 mol/L HCl溶液作对照组,370 nm下测定吸光度,计算羰基含量,摩尔消光系数为22 000 L/(mol·cm),重复测3次,按公式(2)计算。
(2)
式中:K,羰基含量,nmol/mg;A,溶液吸光度;d,稀释倍数;ε,摩尔消光系数;2, MP溶液质量浓度,mg/mL。
1.2.12 总巯基含量的测定
参考KANG等[20]方法并适当修改。将MP溶液稀释至2 mg/mL,在412 nm处测量吸光度,摩尔消光系数为13 600 L/(mol·cm),结果以nmol/mg蛋白质总巯基表示,重复测3次,按公式(3)计算。
(3)
式中:M,总巯基含量,nmol/mg;A,溶液吸光度;d,稀释倍数;ε,摩尔消光系数;2,MP溶液质量浓度,mg/mL。
1.3 数据处理
每个指标测定3次。采用SPSS 25进行ANOVA分析,并使用Duncan法评估数据间的显著性差异,P<0.05为显著水平。利用Origin 2021对实验数据进行可视化处理。
2 结果与分析
2.1 HVEF处理后腌制过程中牛肉NaCl含量的变化
如图2所示,与腌制第0天肉样相比,腌制开始后HVEF组与RF组NaCl含量均显著上升(P<0.05),并保持这种趋势直至腌制结束。相较于RF组,腌制第1、3天,HVEF组的肉样的NaCl含量分别显著上升了0.20%、0.14%(P<0.05)。而当腌制期延长至5 d后,2组间肉样NaCl含量无显著差异(P>0.05)。这表明 HVEF 处理能够加速腌制过程中NaCl在肉样中的扩散,加快腌制速度,这种效果在腌制前期尤为显著。CHEN等[7] 报道称,对干腌鱼施加HVEF处理,显著加快了NaCl在鱼肉中的扩散。这种现象可能是HVEF 通过电晕放电使得具有不同电荷的离子向特定方向移动所导致。
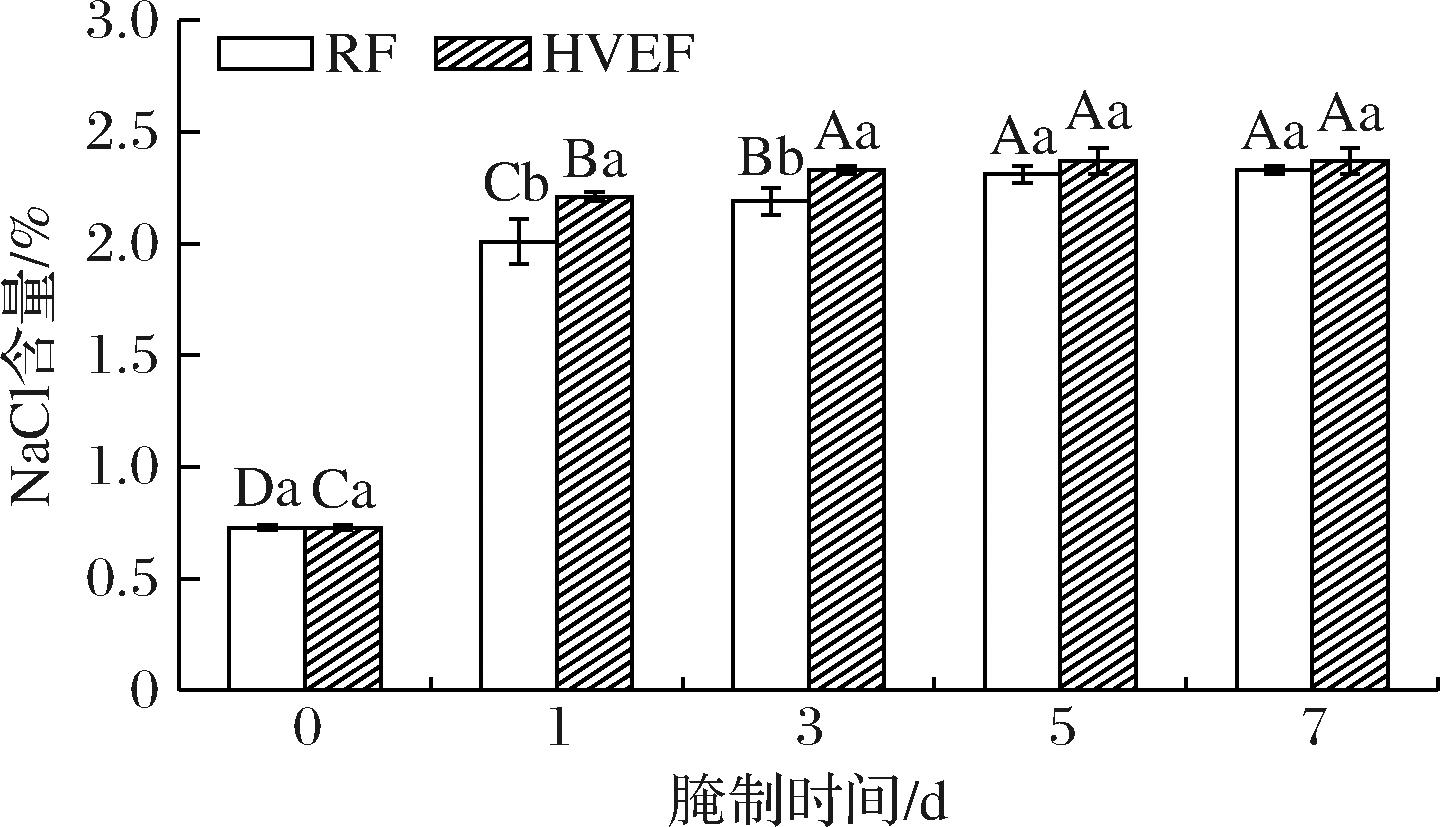
图2 HVEF处理后腌制过程中牛肉NaCl含量的变化
Fig.2 Changes in NaCl content of beef during the curing process after HVEF treatment
注:大写字母不同,表示相同处理、不同时间差异显著(P<0.05);小写字母不同,表示相同时间、不同处理差异显著(P<0.05)(下同)。
2.2 HVEF处理后腌制过程中牛肉质构特性的变化
肉品的质构特性是评价其整体质量和功能特性的重要指标,与消费者的购买意愿密切相关。如表1所示,与腌制第0 d相比,腌制第1天时,HVEF组与RF组肉样的硬度和咀嚼性均显著下降(P<0.05),这可能是由于腌制过程中,食盐通过与MP相互作用,增加了肌肉的水合作用及持水能力,从而使其质构特性得到改善[21]。整个腌制期,HVEF组与RF组肉样间的弹性、内聚性无显著差异(P>0.05)。与RF组相比,腌制第1天时,HVEF组肉样的硬度及咀嚼性均未见显著性差异(P>0.05);腌制时间延长至3 d时,HVEF组肉样的硬度显著下降了16.23%(P<0.05),咀嚼性显著下降了13.16%(P<0.05),这种差异一直延续至第7 d,表明HVEF处理能够显著改善腌制期间牛肉的质构特性。这种现象可能是由于HVEF通过电晕放电所产生的臭氧,促进了蛋白质的氧化变性而导致[7]。另一方面,MUNGURE等[22]报道称电场的电穿孔效应也可通过影响组织蛋白酶等内源蛋白酶的释放,对肉品的质构产生影响。
表1 HVEF处理后腌制过程中牛肉质构特性的变化
Table 1 Changes in the texture characteristics of beef during the curing process after HVEF treatment
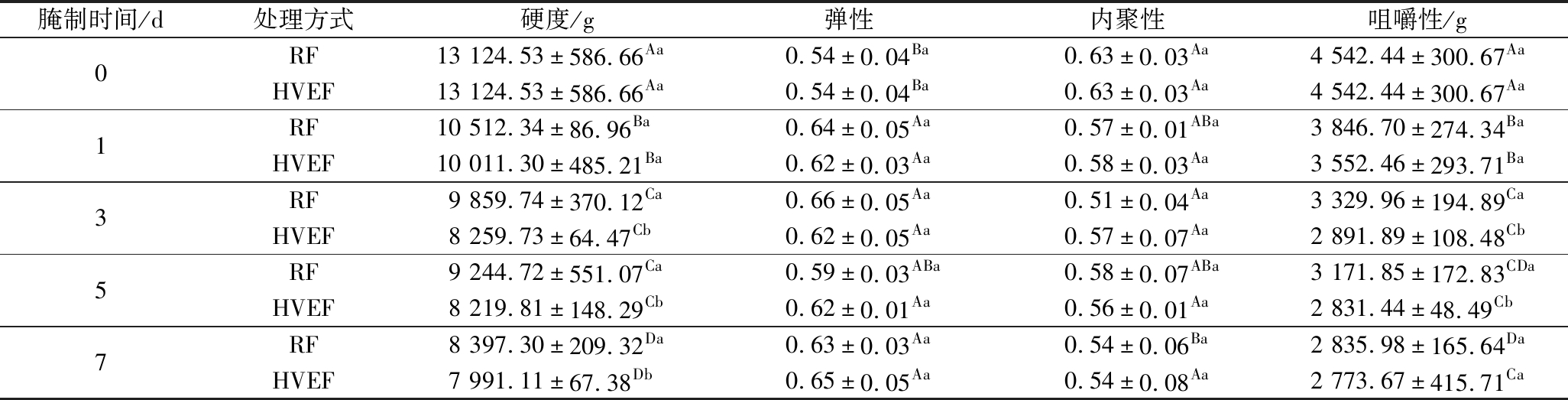
注:同一列中大写字母不同,表示相同处理、不同时间差异显著(P<0.05);同一列中小写字母不同,表示相同时间、不同处理差异显著(P<0.05)(下同)。
腌制时间/d处理方式硬度/g弹性内聚性咀嚼性/g0RF13 124.53±586.66Aa0.54±0.04Ba0.63±0.03Aa4 542.44±300.67AaHVEF13 124.53±586.66Aa0.54±0.04Ba0.63±0.03Aa4 542.44±300.67Aa1RF10 512.34±86.96Ba0.64±0.05Aa0.57±0.01ABa3 846.70±274.34BaHVEF10 011.30±485.21Ba0.62±0.03Aa0.58±0.03Aa3 552.46±293.71Ba3RF9 859.74±370.12Ca0.66±0.05Aa0.51±0.04Aa3 329.96±194.89CaHVEF8 259.73±64.47Cb0.62±0.05Aa0.57±0.07Aa2 891.89±108.48Cb5RF9 244.72±551.07Ca0.59±0.03ABa0.58±0.07ABa3 171.85±172.83CDaHVEF8 219.81±148.29Cb0.62±0.01Aa0.56±0.01Aa2 831.44±48.49Cb7RF8 397.30±209.32Da0.63±0.03Aa0.54±0.06Ba2 835.98±165.64DaHVEF7 991.11±67.38Db0.65±0.05Aa0.54±0.08Aa2 773.67±415.71Ca
2.3 HVEF处理后腌制过程中牛肉组织蛋白酶B和L活性的变化
组织蛋白酶是一类主要存在于溶酶体中的蛋白酶,在肉制品腌制过程中对蛋白质的降解起着至关重要的作用[23]。若组织蛋白酶提前释放,活性受到激发,可能会更早影响底物蛋白的降解,进而影响肉品的质构。
如图3所示,腌制期间,RF组从第1天起的组织蛋白酶B和L活性明显下降并持续至腌制结束,这可能是由于腌制开始后,食盐的渗透对组织蛋白酶活性产生了抑制作用,这与ZHOU等[24]报道的金华火腿在腌制期间组织蛋白酶B和L的活性均显著降低的结论相一致。然而,HVEF组中组织蛋白酶B和L活性在腌制第1天时相较于第0 d显著上升(P<0.05),随着腌制时间的延长出现下降的趋势。产生这种趋势的原因可能是,在腌制初期HVEF处理所引起的电穿孔效应对酶活性的影响占据主导地位,使得酶活性快速上升,而随着腌制时间延长,食盐渗透增多,其对组织蛋白酶活性的抑制效应增大,使得酶活性缓慢下降[25-26]。比较2个腌制组发现,腌制期间HVEF组的组织蛋白酶B和L活性均显著高于RF组(P<0.05),表明HVEF处理显著提高了腌制过程中牛肉样品组织蛋白酶B和L的活性,进一步验证了电场所产生的电穿孔效应可通过增强溶酶体膜的破裂,提前释放包含于溶酶体内的组织蛋白酶,从而使其活性上升[27-28]。
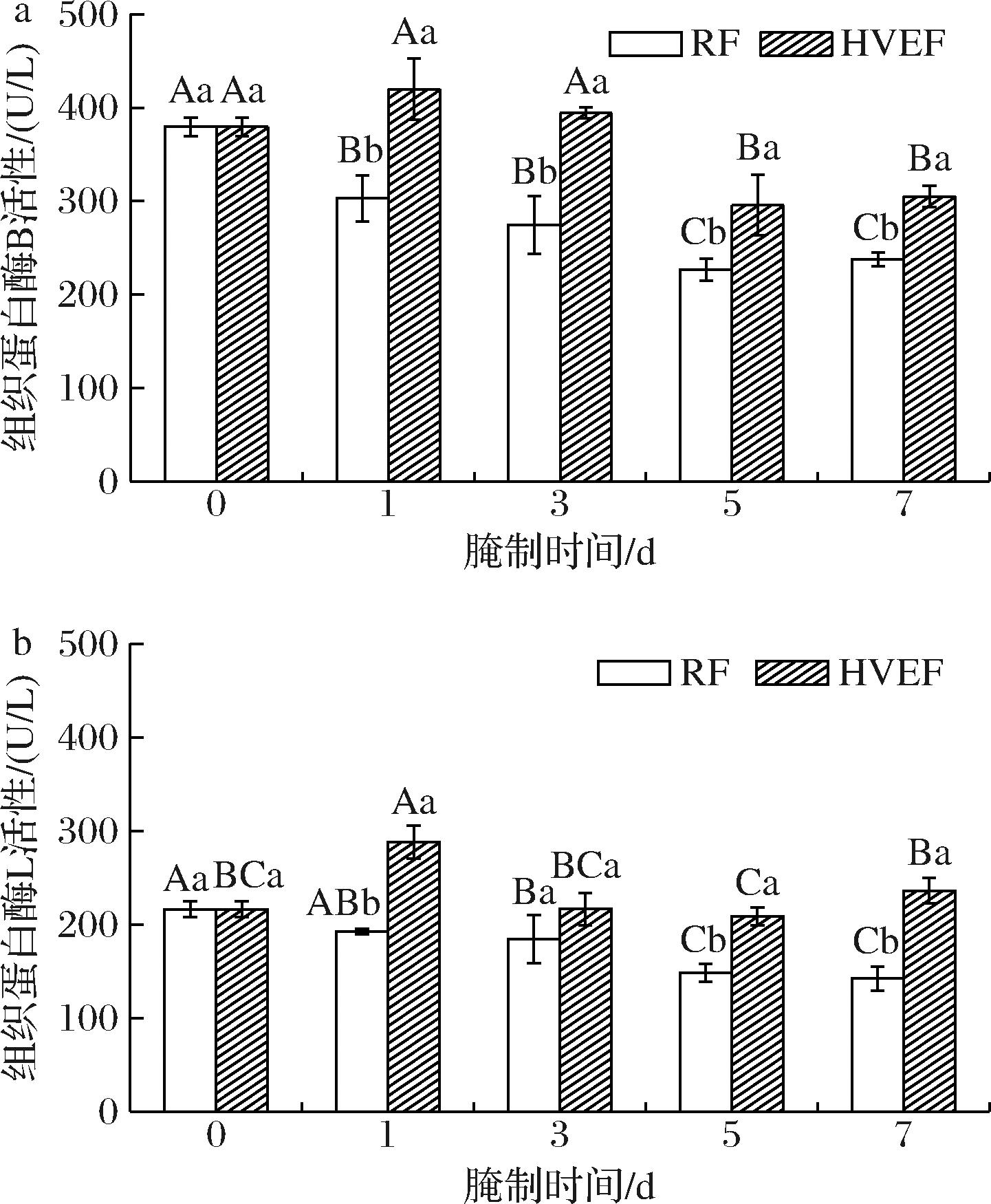
a-组织蛋白酶B;b-组织蛋白酶L
图3 HVEF处理后腌制过程中牛肉组织蛋白酶B和L活性的变化
Fig.3 Changes in the activity of beef Cathepsin B and L during the curing process after HVEF treatment
2.4 HVEF处理后腌制过程中牛肉MFI值的变化
MFI是评价肉品中MP降解程度的重要指标。MFI值越大,表明肌原纤维结构完整性受到的破坏越大,肉品的质构越好[29]。由图4可知,腌制第0 d时MFI值最小,为86.93。随着腌制时间的延长,HVEF组与RF组肉样的MFI值均呈上升趋势。JIN等[30]研究显示猪肉在经过腌制处理后,其MFI值显著上升,与本研究结果类似。从腌制第1~7天,HVEF组肉样的MFI值相比于RF组分别显著增长了10.95%、5.12%、14.99%和9.79%(P<0.05)。表明HVEF处理能够促进腌制期间MP的降解(P<0.05)。这与闫晓晶[31]在牛肉成熟过程中施加HVEF导致MFI值显著上升的结论相一致。可能原因是溶酶体中的组织蛋白酶被释放后,可有效降解肌原纤维蛋白,进而引起MFI值上升[32]。与本文2.3节的结果一致。
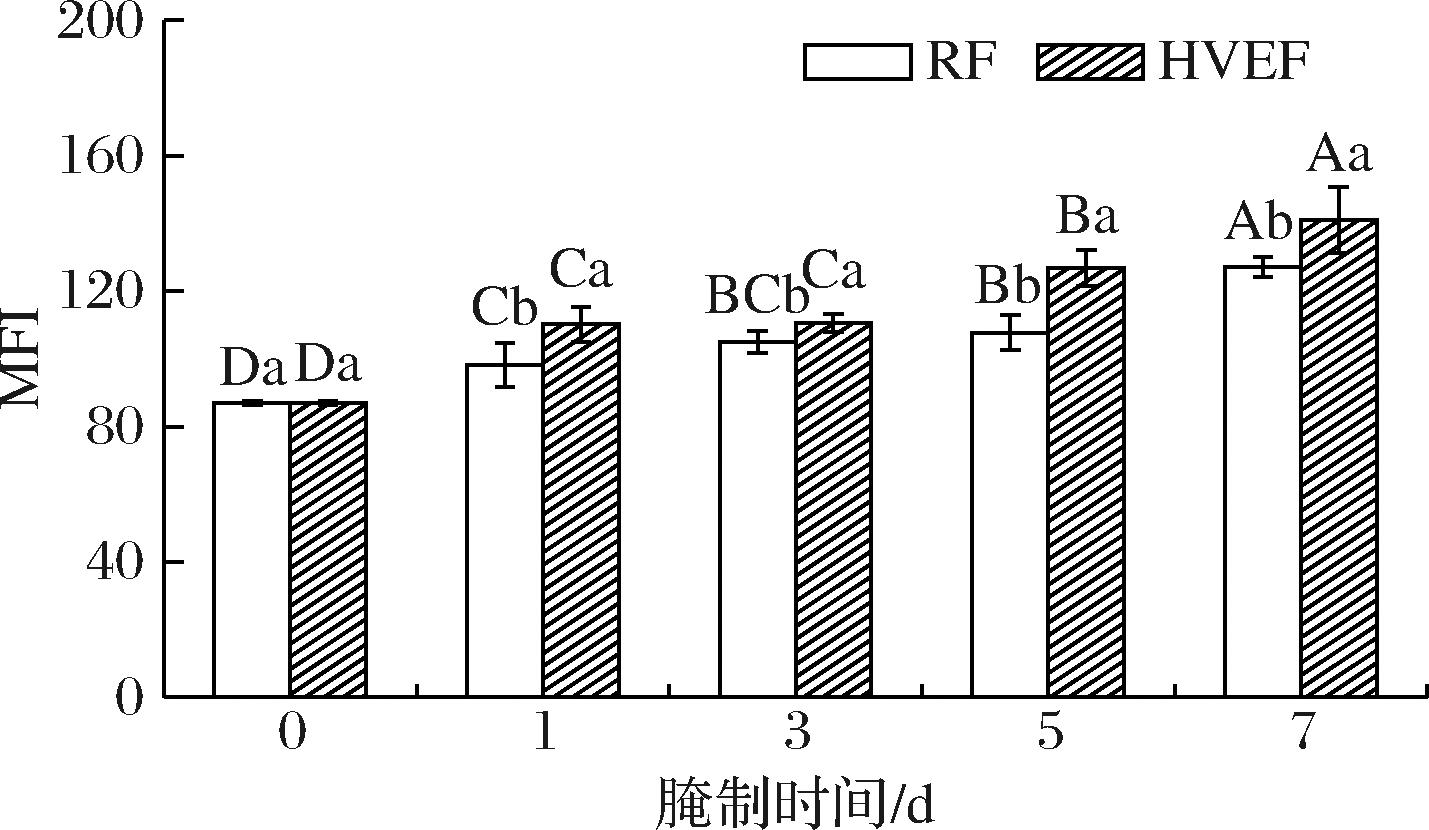
图4 HVEF处理后腌制过程中牛肉MFI的变化
Fig.4 Changes in beef MFI during the during process after HVEF treatment
2.5 HVEF处理后腌制过程中牛肉MP二级结构相对含量的变化
α-螺旋和无规卷曲分别代表蛋白质的有序和无序结构。α-螺旋为蛋白质中最稳定的结构,其稳定性主要取决于蛋白质肽链内的氢键,无规卷曲的紧密程度和构象稳定性相较于α-螺旋较差[33]。
由图5可知,腌制第0 d时牛肉MP的α-螺旋结构相对含量最高,为52.72%。随着腌制时间的延长,HVEF组与RF组的α-螺旋结构的相对含量均呈下降趋势,无规卷曲结构的相对含量保持上升。相较于RF组,腌制第1、3、5、7天,HVEF组MP的α-螺旋结构相对含量分别显著降低了1.72%、1.44%、2.89%、3.03%(P<0.05),无规卷曲结构的相对含量显著增加(P<0.05)。这表明HVEF处理促进了肽链内氢键的断裂,破坏了MP的有序结构并降低其稳定性。LUNG等[34]报道了使用电场辅助解冻鸭肉导致其蛋白质二级结构破坏,进而影响了鸭肉的持水力和嫩度,与本研究HVEF处理对蛋白质二级结构的影响具有一致性。

图5 HVEF处理后腌制过程中牛肉MP二级结构相对含量的变化
Fig.5 Changes in the relative content of the secondary structure of beef MP during the curing process after HVEF treatment
2.6 HVEF处理后腌制过程中牛肉MP内源荧光强度的变化
蛋白质的内源荧光强度取决于芳香族氨基酸残基,尤其是色氨酸残基,当色氨酸残基暴露在蛋白质表面时,通常会比被包埋在蛋白质的中心时出现更低的荧光强度,而荧光强度的降低说明蛋白质处于部分或完全展开状态,因此可通过荧光强度评估蛋白质的三级结构变化[35]。
如图6所示,腌制第0 d时牛肉MP内源荧光强度最高,而随着腌制时间的延长,HVEF组和RF组MP的荧光强度均逐渐下降。这表明腌制的过程导致了牛肉MP的变性,使其自然结构和排列方式发生改变。LIU等[36]也发现腌制使得草鱼MP的荧光强度降低。结果与本研究一致,整个腌制过程中,HVEF组MP的内源荧光强度均低于RF组。HUANG等[37]对鲶鱼MP施加40 kV HVEF处理后,得出了相似的结果。导致这种现象的原因可能是,HVEF电晕放电产生的臭氧和电晕风通过氧化修饰MP侧链使其结构发生改变,促使埋藏在分子内的色氨酸残基暴露在外部极性环境中。疏水残基的暴露增强了分子间疏水相互作用并促进了聚集体的形成,导致了MP内源荧光强度的下降[38]。
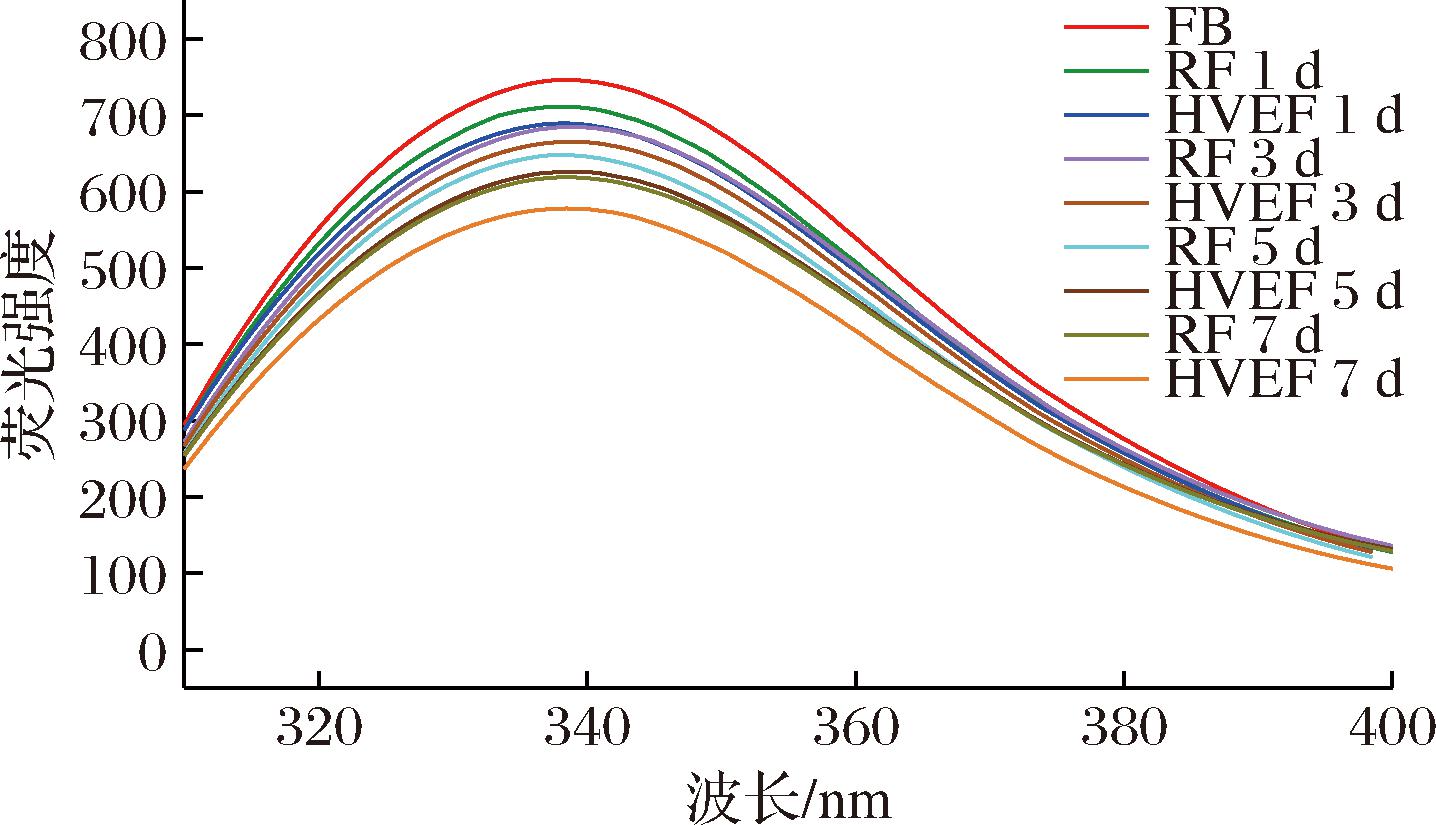
图6 HVEF处理后腌制过程中牛肉MP内源荧光强度的变化
Fig.6 Changes in the endogenous fluorescence intensity of beef MP during the curing process after HVEF treatment
2.7 HVEF处理后腌制过程中牛肉MP表面疏水性的变化
表面疏水性反映了蛋白质构象的变化,且与蛋白内部疏水区域的暴露程度密切相关[39]。蛋白质的变性能够诱导疏水基团的暴露,从而使得表面疏水性增加。因此,表面疏水性被用于评估蛋白质的氧化和变性。
如图7所示,腌制第0天肉样的溴酚蓝结合量最少,为27.31 μg。随着腌制时间的延长,HVEF组与RF组牛肉MP的溴酚蓝结合量呈上升趋势,鸡肉MP在腌制过程中表面疏水性的变化相似[40]。相较于RF组,腌制第1天时,HVEF组的表面疏水性未见显著差异(P>0.05),腌制时间延长至3 d,HVEF组牛肉MP表面疏水性显著升高了15.17%(P<0.05),且这种差异一直延续至腌制结束。上述结果表明HVEF处理可能通过促进MP内部疏水性氨基酸残基的氧化暴露,引起MP结构展开。ZHENG等[41]使用超声波辅助牛肉腌制,发现其通过提高蛋白氧化水平使MP表面疏水性增加,这一结果与本研究结论一致。
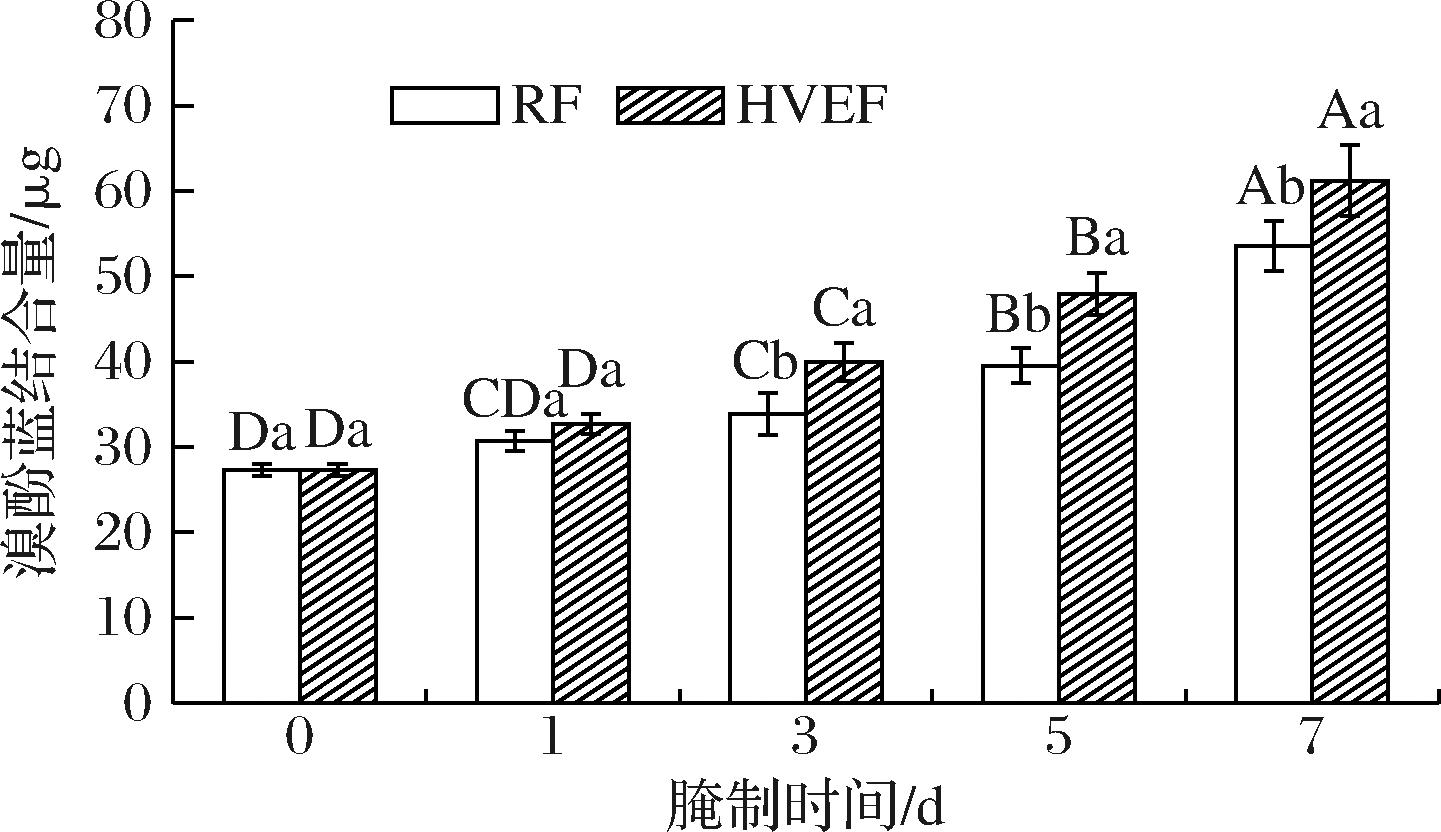
图7 HVEF处理后腌制过程中牛肉MP表面疏水性的变化
Fig.7 Changes in the hydrophobicity of beef MP surface during the curing process after HVEF treatment
2.8 HVEF处理后腌制过程中牛肉MP羰基含量的变化
蛋白质的氨基酸侧链含有较多精氨酸、脯氨酸和赖氨酸,这些氨基酸易被氧化形成羰基衍生物。羰基含量是衡量蛋白氧化程度的关键指标之一,羰基含量越高,表示蛋白氧化程度越高[42]。
由图8可知,腌制第0 d时牛肉MP的羰基含量最低,为3.87 nmol/mg。随着腌制时间的延长,HVEF组与RF组MP的羰基含量均显著上升(P<0.05),表明MP氧化程度加剧。腌制第1天时,HVEF组和RF组MP羰基含量无显著差异(P>0.05),腌制时间延长至3 d时,HVEF组MP的羰基含量相较于RF组显著提升了18.71%(P<0.05),该差异持续至腌制结束。这一结果表明HVEF处理可加速羰基衍生物的生成,促进MP的氧化。RAHBARI等[43]认为,HVEF电晕放电电离空气时所产生的臭氧,能够诱导鸡肉MP发生氧化变性。JIANG等[44]研究发现,臭氧诱导的轻度氧化能够使鲢鱼肌球蛋白羰基含量上升,这可能是由于臭氧的氧化性引发的自由基链式反应,攻击了MP的巯基及其他敏感部位,从而促进了羰基衍生物的生成。该机制同样适用于解释本研究中HVEF组在腌制中后期表现出显著的氧化现象。
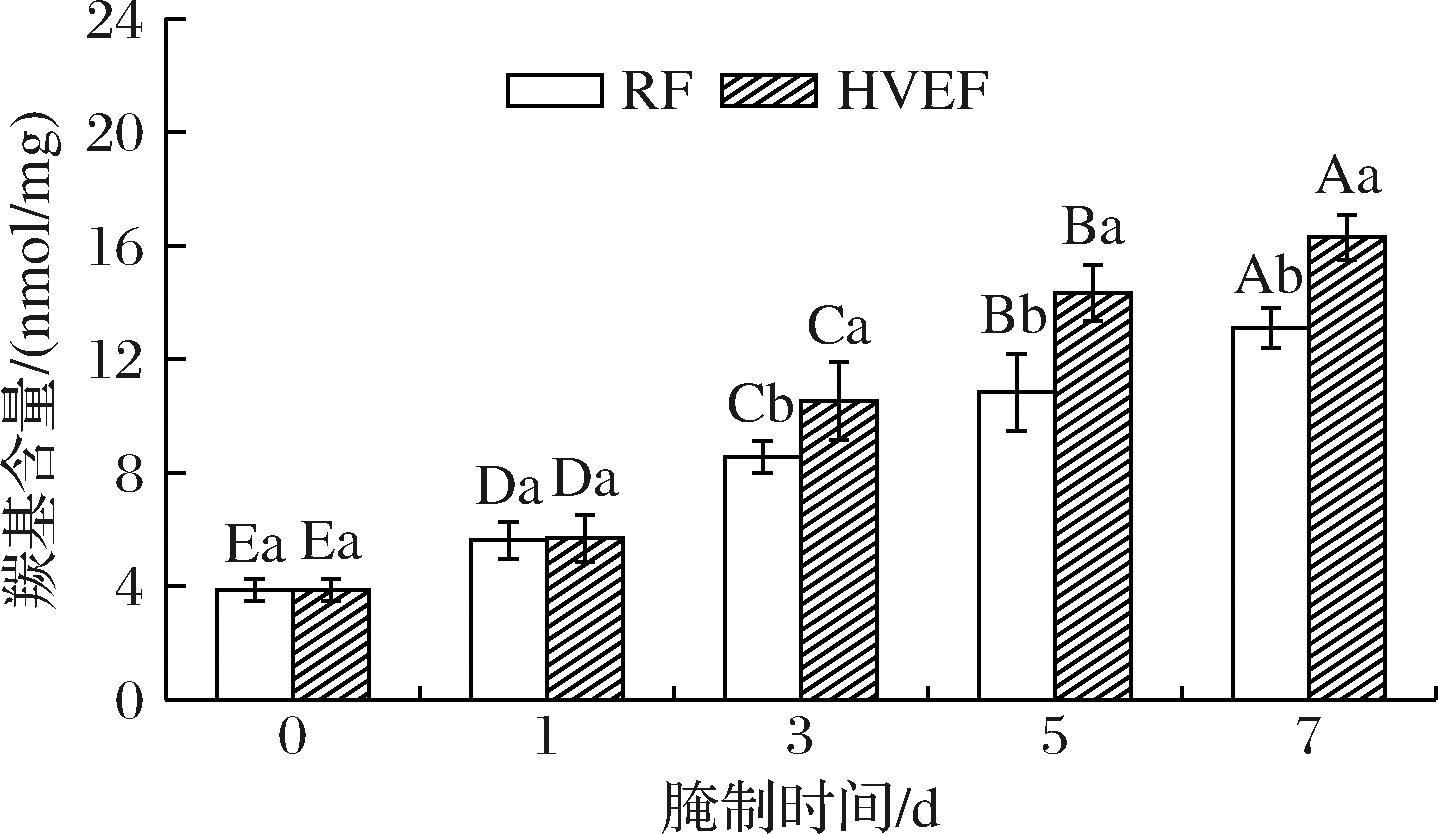
图8 HVEF处理后腌制过程中牛肉MP羰基含量的变化
Fig.8 Changes in the carbonyl content of beef MP during the curing process after HVEF treatment
2.9 HVEF处理后腌制过程中牛肉MP总巯基含量的变化
巯基是蛋白中最活跃且反应性最强的功能基团,对蛋白质结构的稳定性具有重要影响。位于相同或不同肽链间的半胱氨酸残基上的巯基通过脱氢,氧化形成二硫键,导致蛋白质变性,故可用巯基含量表征蛋白质氧化程度。
如图9所示,腌制第0 d时牛肉MP的巯基含量最高,为41.89 nmol/mg。随着腌制时间的延长,HVEF组与RF组牛肉MP的巯基含量均持续下降。叶路漫[45]研究发现,鱼肉MP的总巯基含量随着腌制时间的延长而下降。腌制第1天时,RF组和HVEF组MP总巯基含量未见显著差异(P>0.05),腌制第3天至结束,HVEF组相较于RF组总巯基含量分别显著降低了15.64%、18.04%、7.40%(P<0.05),表明HVEF处理显著促进了牛肉MP的巯基损失(P<0.05)。造成这种现象的原因可能是,HVEF处理所生成的臭氧,诱导氧化破坏了MP空间结构,促进了巯基转化为分子内、分子间二硫键[46],这与适度臭氧处理后,鳙鱼MP的巯基含量变化一致[47]。
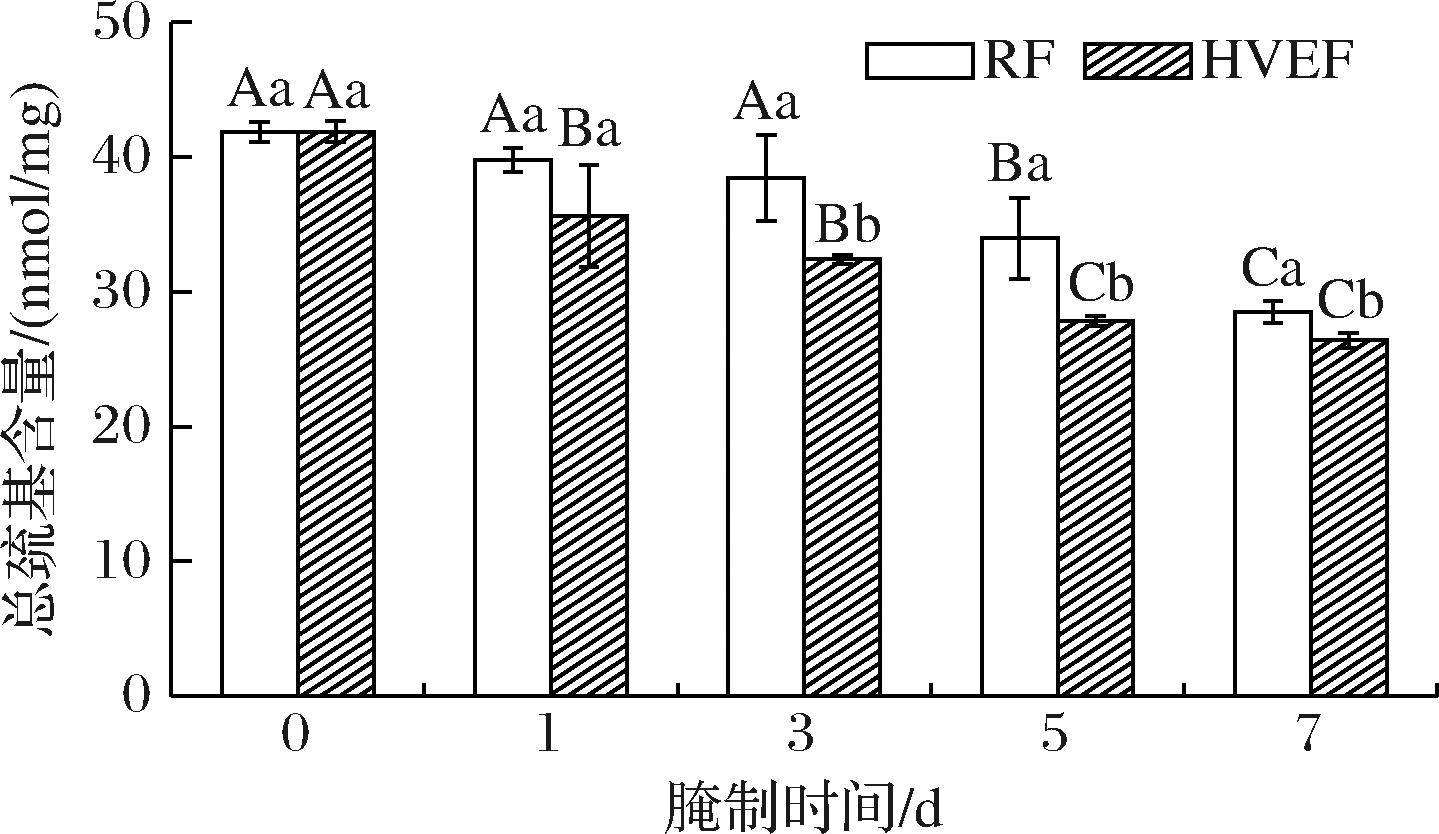
图9 HVEF处理后腌制过程中牛肉MP总巯基含量的变化
Fig.9 Changes in total urfhydryl content of beef during the curing process after HVEF treatment
3 结论
本研究系统评估了HVEF处理后,干腌期间牛肉质构及MP特性的变化。结果表明,与对照组相比,HVEF处理后,腌制1、3 d时,牛肉的NaCl含量分别显著增加了0.20%、0.14%(P<0.05),腌制速度得到提高。随着腌制时间的延长,腌制第3天时,牛肉的硬度和咀嚼性分别显著下降了16.23%、13.16%(P<0.05),这种效果延续至腌制结束。HVEF处理后,电穿孔效应加快了组织蛋白酶B和L的释放,显著提高了腌制期间组织蛋白酶的活性(P<0.05),从而促进了MP的降解,使MFI值显著升高(P<0.05)。此外,腌制第3天时,HVEF所产生的臭氧和电晕风,使MP羰基含量、表面疏水性分别显著上升了18.71%、15.17%(P<0.05),总巯基含量显著下降了15.64%(P<0.05),从而增加了MP的氧化程度,这种差异保持至腌制结束。HVEF处理引起的MP降解与氧化使MP构象稳定性下降,表现为腌制过程中α-螺旋结构占比显著下降(P<0.05),无规卷曲结构占比显著上升(P<0.05);内源荧光强度下降。综上,HVEF处理可提高牛肉腌制速度,并通过介导组织蛋白酶活性、MP的降解、氧化及结构特性的变化,使肉样的质构从腌制第3天起得到改善。本研究为HVEF在肉制品干腌工艺中缩短腌制周期、提升肉质和降低能耗等方面的应用提供了理论依据。
[1] YIN F, BAI X Y, WANG K, et al.Mechanism of tumbling-curing to improve beef quality:Insights from the structural and functional properties of myofibrillar protein[J].LWT, 2024, 207:116692.
[2] PAN Q, ZHOU Y, WANG Y, et al.Effects of ultrasound-assisted dry-curing on water holding capacity and tenderness of reduced-sodium pork by modifying salt-soluble proteins [J].Food Chemistry, 2024, 453:139704.
[3] BAO G L, NIU J, LI S B, et al.Effects of ultrasound pretreatment on the quality, nutrients and volatile compounds of dry-cured yak meat[J].Ultrasonics Sonochemistry, 2022, 82:105864.
[4] KANTAR S E, BOUSSETTA N, LEBOVKA N, et al.Pulsed electric field treatment of citrus fruits:Improvement of juice and polyphenols extraction[J].Innovative Food Science &Emerging Technologies, 2024, 46:153-161.
[5] QI M Y, LIU Q Y, LIU Y, et al.Staphylococcus aureus biofilm inhibition by high voltage prick electrostatic field (HVPEF) and the mechanism investigation[J].International Journal of Food Microbiology, 2022, 362:109499.
[6] 沙坤, 李思源, 张松山, 等.高压静电场辅助牛肉湿腌过程传质动力学分析[J].农业机械学报, 2022, 53(12):421-426;458.SHA K, LI S Y, ZHANG S S, et al.Mass transfer kinetics analysis of beef wet salted process assisted by high voltage electrostatic field[J].Transactions of the Chinese Society for Agricultural Machinery, 2022, 53(12):421-426;458.
[7] CHEN C B, WANG Z F, GAO Z L, et al.Effect of high-voltage electrostatic field salting on the quality of salt-reduced Yi ye Cheng golden pomfret [J].Food Chemistry:X, 2025, 26:102258.
[8] WARNER R D, WHEELER T L, HA M, et al.Meat tenderness:Advances in biology, biochemistry, molecular mechanisms and new technologies[J].Meat Science, 2022, 185:108657.
[9] ZHANG Y, LI S S, ZHAO L Z.Effects of thermal processing and temperature on the quality, protein oxidation, and structural characteristics of yak meat [J].Journal of Texture Studies, 2023, 54(5):659-670.
[10] HU S Q, ZHOU G H, XU X L, et al.Contribution of cathepsin B and L to endogenous proteolysis in the course of modern Jinhua ham processing [J].Food Control, 2022, 135:108584.
[11] BAO Y L, ERTBJERG P.Effects of protein oxidation on the texture and water-holding of meat:A review[J].Critical Reviews in Food Science and Nutrition, 2019, 59(22):3564-3578.
[12] ZHANG X X, BI S H, LI M M, et al.Study on activation strategy and effect of protease activity during the post-processing stage of dry-cured meat based on electrical stimulation [J].Food Control, 2024, 161:110363.
[13] GUO L N, HONG C, WANG W J, et al.Evaluation of low-temperature ultrasonic marination of pork meat at various frequencies on physicochemical properties, myoglobin levels, and volatile compounds [J].Meat Science, 2024,217:109606.
[14] CULLER R D, PARRISH JR F C, SMITH G C, et al.Relationship of myofibril fragmentation index to certain chemical, physical and sensory characteristics of bovine longissimus muscle[J].Journal of Food Science, 1978, 43(4):1177-1180.
[15] ZHANG R Y, XING L J, KANG D C, et al.Effects of ultrasound-assisted vacuum tumbling on the oxidation and physicochemical properties of pork myofibrillar proteins [J].Ultrasonics Sonochemistry, 2021,74:105582.
[16] CHEN J Y, REN Y X, ZHANG K S, et al.Site-specific incorporation of sodium tripolyphosphate into myofibrillar protein from mantis shrimp (Oratosquilla oratoria) promotes protein crosslinking and gel network formation[J].Food Chemistry, 2020, 312:126113.
[17] ZHAO J Y, DONG F J, LI Y Y, et al.Effect of freeze-thaw cycles on the emulsion activity and structural characteristics of soy protein isolate[J].Process Biochemistry, 2015, 50(10):1607-1613.
[18] CHELH I, GATELLIER P, SANTÉ-LHOUTELLIER V.Technical note:A simplified procedure for myofibril hydrophobicity determination[J].Meat Science, 2006, 74(4):681-683.
[19] OLIVER C N, AHN B W, MOERMAN E J, et al.Age-related changes in oxidized proteins[J].Journal of Biological Chemistry, 1987, 262(12):5488-5491.
[20] KANG D C, ZOU Y H, CHENG Y P, et al.Effects of power ultrasound on oxidation and structure of beef proteins during curing processing [J].Ultrasonics Sonochemistry, 2016, 33:47-53.
[21] CROPOTOVA J, TAPPI S, GENOVESE J, et al.Study of the influence of pulsed electric field pre-treatment on quality parameters of sea bass during brine salting [J].Innovative Food Science &Emerging Technologies, 2021, 70:102706.
[22] MUNGURE T E, FAROUK M M, BIRCH E J, et al.Effect of PEF treatment on meat quality attributes, ultrastructure and metabolite profiles of wet and dry aged venison Longissimus dorsi muscle [J].Innovative Food Science &Emerging Technologies, 2020, 65:102457.
[23] GARCíA-GARRIDO J A, QUILES-ZAFRA R, TAPIADOR J, et al.Activity of cathepsin B, D, H and L in Spanish dry-cured ham of normal and defective texture [J].Meat Science, 2000, 56(1):1-6.
[24] ZHOU C Y, WU J Q, TANG C B, et al.Comparing the proteomic profile of proteins and the sensory characteristics in Jinhua ham with different processing procedures [J].Food Control, 2019, 106:106694.
[25] BHAT Z F, MORTON J D, MASON S L, et al.Current and future prospects for the use of pulsed electric field in the meat industry [J].Critical Reviews in Food Science and Nutrition, 2019, 59(10):1660-1674.
[26] ZHAO G M, ZHOU G H, WANG Y L, et al.Time-related changes in cathepsin B and L activities during processing of Jinhua ham as a function of pH, salt and temperature [J].Meat Science, 2005, 70(2):381-388.
[27] L PEZ-PEDROUSO M, PÉREZ-SANTAESCOL
PEZ-PEDROUSO M, PÉREZ-SANTAESCOL STICA C, FRANCO D, et al.Molecular insight into taste and aroma of sliced dry-cured ham induced by protein degradation undergone high-pressure conditions[J].Food Research International, 2019, 122:635-642.
STICA C, FRANCO D, et al.Molecular insight into taste and aroma of sliced dry-cured ham induced by protein degradation undergone high-pressure conditions[J].Food Research International, 2019, 122:635-642.
[28] BHAT Z F, MORTON J D, MASON S L, et al.Pulsed electric field operates enzymatically by causing early activation of calpains in beef during ageing [J].Meat Science, 2019, 153:144-151.
[29] ZOU Y, YANG H, ZHANG M H, et al.The influence of ultrasound and adenosine 5′-monophosphate marination on tenderness and structure of myofibrillar proteins of beef[J].Asian-Australasian Journal of Animal Sciences, 2019, 32(10):1611-1620.
[30] JIN G F, LIU Y Y, ZHANG Y, et al.Underlying formation mechanisms of ultrasound-assisted brined porcine meat:The role of physicochemical modification, myofiber fragmentation and histological organization [J].Ultrasonics Sonochemistry, 2023, 94:106318.
[31] 闫晓晶. 高压静电场对牛肉成熟过程中品质变化的影响研究 [D].北京:中国农科院, 2021.YAN X J.Effects of high voltage electrostatic field on quality changes of beef during aging [D].Beijing:Chinese Academy of Agricultural Sciences, 2021.
[32] 刘淑华, 李彩云, 张玉斌.超高压联合乳酸钙处理对牛肉嫩化的影响[J].食品与发酵工业, 2024, 50(17):275-283.LIU S H, LI C Y, ZHANG Y B.Effect of high hydrostatic pressure combined with calcium lactate treatment on beef tenderization[J].Food and Fermentation Industries, 2024, 50(17):275-283.
[33] 张兴, 杨玉玲, 马云, 等.pH对肌原纤维蛋白及其热诱导凝胶非共价键作用力与结构的影响[J].中国农业科学, 2017, 50(3):564-573.ZHANG X, YANG Y L, MA Y, et al.Effects of pH on the non-covalent forces and structure of myofibrillar protein and heat induced gel[J].Scientia Agricultura Sinica, 2017, 50(3):564-573.
[34] LUNG C T, CHANG C K, CHENG F C, et al.Effects of pulsed electric field-assisted thawing on the characteristics and quality of Pekin duck meat[J].Food Chemistry, 2022, 390:133137.
[35] ZHU W H, HUAN H Z, BU Y, et al.Effects of hydroxyl radical induced oxidation on water holding capacity and protein structure of jumbo squid (Dosidicus gigas) mantle[J].International Journal of Food Science &Technology, 2019, 54(6):2159-2168.
[36] LIU J, XIE C X, MA W H, et al.Effects of ultrasound-assisted low-salt curing on water retention, tenderness and in vitro digestive characteristics of grass carp (Ctenopharyngodon idellus) [J].Ultrasonics Sonochemistry, 2025, 113:107214.
[37] HUANG J, QUE F, XIONG G Q, et al.Physicochemical and functional properties changes in myofibrillar protein extracted from channel catfish by a high-voltage electrostatic field[J].Food and Bioprocess Technology, 2023, 16(2):395-403.
[38] LIU M C, LI F H, TANG Y, et al.Effect of boiling treatment on linoleic acid-induced oxidation of myofibrillar protein in grass carp[J].Foods, 2024, 13(24):4153.
[39] RIEBROY S, BENJAKUL S, VISESSANGUAN W, et al.Acid-induced gelation of natural actomyosin from Atlantic cod (Gadus morhua) and burbot (Lota lota) [J].Food Hydrocolloids, 2009, 23(1):26-39.
[40] 孟嘉珺, 许树荣, 邓莎, 等.食盐腌制对鸡肉品质、肌原纤维蛋白结构和功能特性的影响[J].食品工业科技, 2022, 43(24):45-53.MENG J J, XU S R, DENG S, et al.Effects of salt marinating on chicken quality and structure characteristics, function characteristics of chicken myofibrin protein[J].Science and Technology of Food Industry, 2022, 43(24):45-53.
[41] ZHENG H S, HUANG C B, LIU S H, et al.Effect of ultrasound treatment on the oxidation and conformational structure of myofibrillar protein of beef marinated in red sour soup[J].Meat Science, 2025, 224:109779.
[42] GUO X, HU L, WANG Z P, et al.Effect of rutin on the physicochemical and gel characteristics of myofibrillar protein under oxidative stress[J].Journal of Food Biochemistry, 2021, 45(10):e13928.
[43] RAHBARI M, HAMDAMI N, MIRZAEI H, et al.Investigation of the histological and textural properties of chicken breast thawed by high voltage electric field[J].Journal of Food Process Engineering, 2020, 43(11):e13543.
[44] JIANG W X, HE Y F, XIONG S B, et al.Effect of mild ozone oxidation on structural changes of silver carp (Hypophthalmichthys molitrix) myosin[J].Food and Bioprocess Technology, 2017, 10(2):370-378.
[45] 叶路漫. 加工工艺对风干金鲳鱼制品品质作用的研究 [D].武汉:武汉轻工大学, 2019.YE L M.Study on the effect of processing technology on the quality of air-dried gold pomfret products [D].Wuhan:Wuhan Polytechnic University, 2019.
[46] HUANG H, SUN W Q, XIONG G Q, et al.Effects of HVEF treatment on microbial communities and physicochemical properties of catfish fillets during chilled storage [J].LWT, 2020, 131:109667.
[47] ZHANG T, XUE Y, LI Z J, et al.Effects of ozone-induced oxidation on the physicochemical properties of myofibrillar proteins recovered from bighead carp (Hypophthalmichthys nobilis)[J].Food and Bioprocess Technology, 2015, 8(1):181-190.