羊肚菌(Morchella spp.),又被称为羊肚蘑、编笠菌、羊肚菜等,是羊肚菌科、羊肚菌属真菌,因其表面凹凸不平,形似羊肚而得名,是一种风味独特、营养丰富的珍贵食用菌[1]。由于羊肚菌代谢旺盛,菌盖组织脆弱,采收及运输过程中极易遭受机械性损伤,导致褐变和品质退化,从而对其实用价值和经济收益产生负面影响[2]。因此,如何维持羊肚菌品质的稳定性,预防其腐败,已成为该领域亟需解决的关键技术难题。目前,羊肚菌的保鲜技术主要包括传统脱水干燥、微波真空干燥等物理方法,但这些方法存在营养成分流失以及对设备要求较高的问题;而使用化学保鲜剂虽然成本较低、操作简便,但其残留的化学物质对健康造成危害,且易造成环境污染。相比之下,利用从自然资源中提取的可生物降解多糖进行涂膜处理的生物保鲜技术,展现出其独特的优势。
羧甲基壳聚糖(carboxymethyl chitosan,CMCS)是一种水溶性壳聚糖衍生物,呈微黄色或白色粉末状,具有优异的生物降解性、水溶性、生物相容性和无毒等特性[3]。然而CMCS 抗氧化能力弱的缺点,限制了其在生产加工方面的应用。本研究对CMCS 进行合理的化学修饰,在其上接枝天然抗氧化多酚从而得到CMCS 的共聚物,在不改变CMCS 原有的优良性能基础上,提高CMCS 抗氧化性能。原花青素(proanthocyanidins,PA)是自然界广泛存在的天然抗氧化剂,作为一种特殊的黄酮类化合物,具有优良的抗炎、抗衰老、预防心血管疾病和抗肿瘤功能[4]。本文选择PA作为接枝物,利用自由基介导接枝法将其引入到CMCS 中,制备了原花青素-羧甲基壳聚糖接枝共聚物(proanthocyanidins-grafted-carboxymethyl chitosan,PA-CMCS)。对共聚物的性能进行了测定和比较,并将其应用到羊肚菌保鲜中,考察CMCS 及PA-CMCS 对新鲜羊肚菌品质的影响,为CMCS接枝共聚物在鲜品保鲜方面的研究提供理论基础。
1 材料与方法
1.1 材料与试剂
新鲜羊肚菌,产自新疆阿克苏地区;CMCS、PA、福林酚试剂,上海源叶生物科技有限公司;DPPH、ABTS,上海阿拉丁生化科技股份有限公司;KH2PO4、聚乙烯吡咯烷酮(polyvinylpyrrolidone,PVP)、Na2HPO4、BaCl2、邻苯二酚、过硫酸钾,上海国药集团。
1.2 实验仪器
UV-5500紫外-可见分光光度计,上海元析仪器有限公司;MS-H380-Pro型磁力加热搅拌器,大龙兴创实验仪器(北京)股份公司;LGJ-12A型真空冷冻干燥机,北京四环起航科技有限公司;3 kDa透析袋,北京索莱宝科技有限公司;LDZX-75L型高压蒸汽灭菌锅,上海申安医疗科技有限公司;PHS-2F 台式pH计,上海雷磁仪器有限公司;ENS-TDV质构仪,北京怡诺威腾科技发展有限公司;HH.S21-4型恒温水浴锅、BPH-162型电热恒温培养箱,上海博讯医疗生物仪器股份有限公司;SW-CJ-2D 型超净工作台,冰山松洋生物科技(大连)有限公司;FTIR-650G傅里叶变换红外光谱仪,珀金埃尔默企业管理(上海)有限公司。
1.3 PA-CMCS的制备
采用自由基介导接枝法,在LEI等[5]的方法上稍作调整。先称取1 g CMCS 溶于100 mL蒸馏水中,加入4 mL含有0.2 g抗坏血酸的H2O2 溶液(1 mol/L),搅拌60 min。根据PA与CMCS物质的量比(0.05∶1、0.1∶1、0.15∶1、0.2∶1、0.3∶1、0.4∶1),分别计算并在溶液中加入所需PA的量,搅拌至完全溶解。置于室温下反应12 h,向反应液中滴加1 mol/L NaOH溶液使其pH值至7.0。将反应溶液注入3 kDa截留分子质量的透析袋中,室温下用蒸馏水透析48 h(每6 h换1次透析水)。用高速离心机以 8 000 r/min 离心15 min,用纱布过滤,收集上清液。冷冻干燥24 h,得到PA-CMCS,置于干燥器中保存。
1.4 PA-CMCS 的结构表征
1.4.1 酚含量测定
采用福林酚法[6]。取2.5 mL PA-CMCS 溶液(1.0 mg/mL)与6.25 mL福林酚试剂(0.2 mol/L)混合,黑暗条件下静置反应5 min。向上述溶液中加入10 mL Na2CO3溶液(75 mg/mL),用蒸馏水定容至25 mL,30 ℃恒温水浴反应2 h 后在760 nm 处测其吸光度值。以PA为标准曲线计算PA-CMCS中的酚含量,用单位质量PA-CMCS 中含有PA的当量来表示(mg/g)。得到PA的标准曲线为Y=0.002 3X+0.349 3,R2=0.990 4。
1.4.2 紫外光谱测定
将PA-CMCS、PA和CMCS分别制成2 mg/mL 的样品溶液,用紫外可见分光光度计测定溶液在波长扫描范围为250~400 nm下的吸光度值。
1.4.3 傅里叶红外光谱测定
将样品与KBr 研磨成粉压片,用傅里叶变换红外光谱仪测定,波数4 000~400 cm-1,分辨率2 cm-1。
1.5 PA-CMCS 的功能性质
1.5.1 DPPH自由基清除能力的测定
参考YU等[7]的方法,实验重复测定3次,取平均值,DPPH自由基清除率按公式(1)计算:
DPPH自由基清除率![]()
(1)
式中:A0,乙醇溶液代替样品溶液测得的吸光值;As,样品溶液下吸光值。
1.5.2 ABTS阳离子自由基清除能力的测定
参考米佳等[8]的方法,实验重复测定3次,取平均值,ABTS阳离子自由基清除率按公式(2)计算:
ABTS阳离子自由基清除率![]()
(2)
式中:A0,PBS代替样品溶液测得的吸光值;As,样品溶液下吸光值。
1.5.3 抑菌性测定
采用抑菌圈法,将灭好菌的5 mm滤纸片放入40 mg/mL的样品溶液中浸泡1 h,然后置于涂好菌悬液的平板上,在恒温培养箱中培养24 h,观察并用游标卡尺测量抑菌圈直径。抑菌圈的直径越大,抗菌效果越好。
1.6 羊肚菌的保鲜
1.6.1 样品处理
将经过预冷的新鲜羊肚菌样品按质量等级均匀分成3组。1组用蒸馏水进行涂抹作为对照组,2组用一定浓度的CMCS进行涂抹,3组用一定浓度的PA-CMCS 进行涂抹。自然晾干后用纱布和保鲜膜包裹,于4 ℃恒温贮藏。第1、4、7、9、11、14天取样测定相关指标。
1.6.2 失重率
称量羊肚菌在贮藏期间的质量,以确定羊肚菌的质量损失,采用差重的方法计算失重率。
1.6.3 硬度
参考文献[9]的方法,采用质构仪对羊肚菌进行硬度分析。每组随机选取3朵羊肚菌,每朵羊肚菌菌柄各测试2次,试验中测试速度1 mm/s。通过硬度值来反映羊肚菌在贮藏期间组织软化的程度。
1.6.4 褐变度
采用OD值法[10],称取2 g羊肚菌,加0.4 g PVP于10 mL含0.15 mol/L NaCl溶液的0.2 mol/L柠檬酸-磷酸缓冲液(pH 6.8)中,冰浴研磨。研磨后8 000 r/min离心15 min,取上清液于波长450 nm处,测定吸光值,用此值大小表示褐变度。
1.6.5 多酚氧化酶(polyphenol oxidase,PPO)活性
参照李萍等[11]的方法,称取2 g羊肚菌,加10 mL PBS(pH=7.0)进行冰浴研磨,研磨后8 000 r/min离心15 min。取100 μL上清液,向其中加入3.9 mL NaOH溶液(0.1 mol/L)和1 mL邻苯二酚溶液(0.1 mol/L)。用紫外可见分光光度计测定溶液在波长410 nm处的吸光值在3 min内的变化,每10 s记1次。
1.6.6 呼吸强度
呼吸强度测定采用滴定分析法[12]测定。
1.6.7 相对电导率
采用电导率法测定[13],将5 g羊肚菌切成薄片,放在盛有50 mL重蒸馏水的烧杯中浸泡l h后弃去浸泡液,用滤纸吸干表面水分。再次放入装有50 mL重蒸馏水的烧杯中,在室温环境中静置3 h后用电导仪测定提取液的电导率,将羊肚菌浸泡溶液用万用炉加热煮沸0.5 h杀死组织细胞,冷却后测定提取液的电导率,按公式(3)计算:
相对电导率![]()
(3)
式中:L1,第一次测得的电导率,%;L2,第二次测得的电导率,%。
1.6.8 可溶性固形物
随机将3个羊肚菌放入研钵中研磨,用干净纱布榨汁,取少量汁液滴在手持糖度计的棱镜上测定。
1.6.9 菌落总数测定
采用菌落总数测试片,根据GB 4789.2—2022 《食品安全国家标准 食品微生物学检验 菌落总数测定》测定样品中菌落总数。
2 结果与分析
2.1 PA-CMCS结构表征
如图1所示,当CMCS与PA重复单元的物质的量比由1∶0.05提升至1∶0.3时,PA-CMCS的酚含量呈现显著上升趋势(P<0.05)。此现象可归因于反应初期CMCS链上PA基团的逐步累积。然而,当物质的量比进一步由1∶0.3增加至1∶0.4时,酚含量的提升不再显著(P>0.05)。这可能是因为CMCS的反应位点已被PA基团完全占据,CMCS与PA之间的反应已达饱和,此时得到最佳的接枝条件。因此,CMCS与PA重复单元的最佳物质的量比为1∶0.3,此时,PA-CMCS的酚含量为400.6 mg/g。
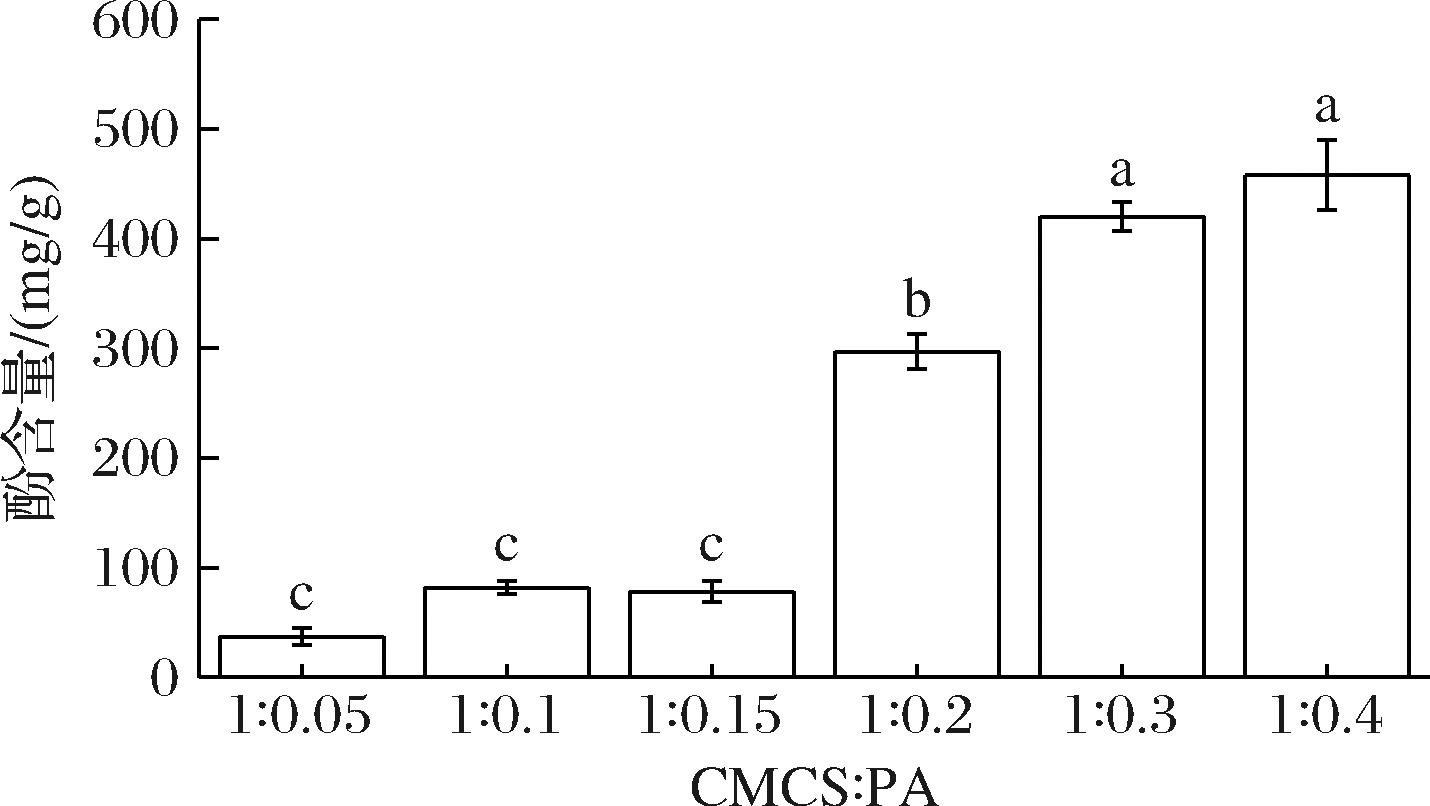
图1 PA-CMCS的酚含量
Fig.1 Phenol content of PA-CMCS
注:不同字母表示具有显著差异(P<0.05)(下同)。
大多数多糖在250~400 nm 的紫外可见光谱范围内没有吸收峰,而多酚含有芳香环,在此紫外可见光谱范围内一般具有明显的吸收峰[14]。由图2可知,CMCS在250~400 nm内没有吸收峰,PA在250~400 nm内有一个特征吸收峰,位于279 nm处,主要是由于PA具有苯环结构。在此波长范围内,PA与CMCS接枝共聚物也展现出一个特征吸收峰,其位于278 nm处。说明PA成功地和CMCS发生了接枝。
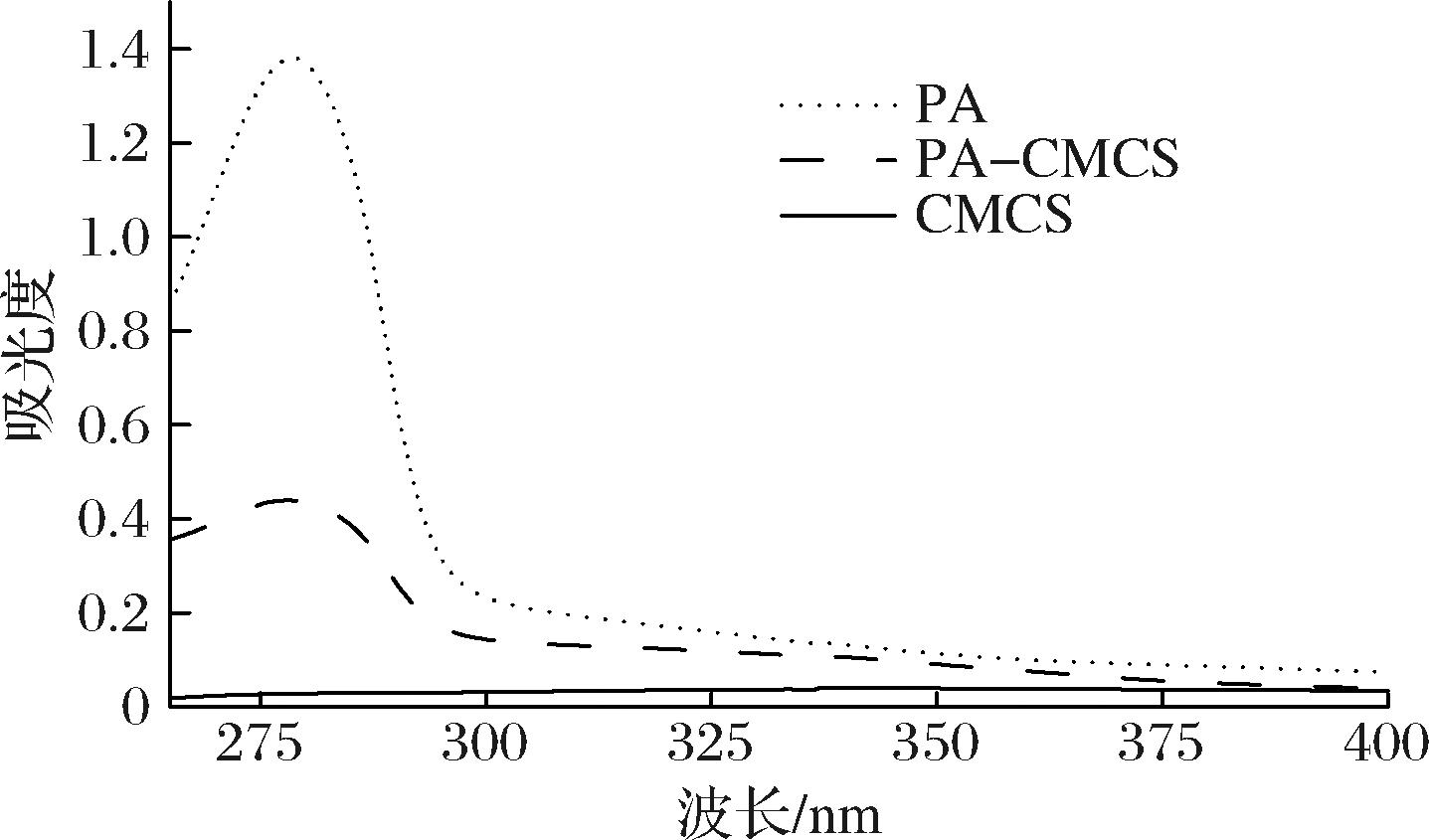
图2 PA-CMCS紫外光谱图
Fig.2 UV spectra of PA-CMCS
红外光谱分析能够分析化合物的官能团[15],可证实PA-CMCS 接枝物的形成。从图3可知,CMCS 在1 613 cm-1处的特征峰为—NH2 的N—H弯曲振动吸收峰与COO—的不对称伸缩振动吸收峰的重叠峰,在1 425 cm-1处的特征峰为COO—的对称伸缩吸收峰[16]。接枝后,PA-CMCS 的红外光谱较CMCS 发生了一些变化,为接枝物的成功形成提供了证据:1)PA-CMCS在1 631 cm-1处有新的吸收峰出现;2)分析PA-CMCS光谱数据,发现PA芳环特征峰出现在1 518、1 412、1 150 cm-1处,这有效证实了PA已成功接枝至CMCS 上;3)在CMCS光谱中观察到C—N和C—O的对称伸缩吸收峰,分别位于1 311、1 051 cm-1。这些特征峰同样出现在PA-CMCS光谱中,表明PA-CMCS保留了CMCS的多糖主链。
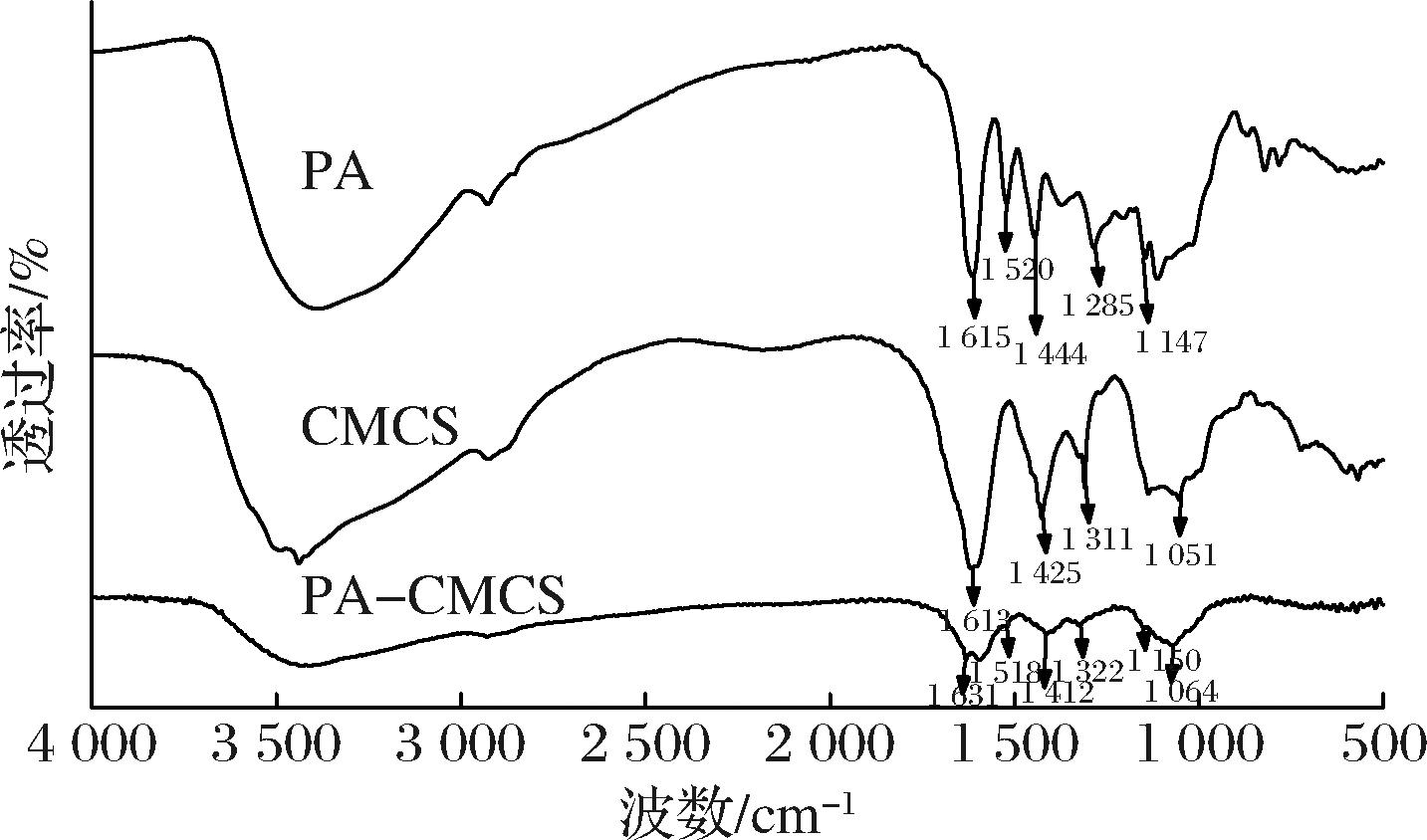
图3 PA-CMCS红外光谱图
Fig.3 Infrared spectra of PA-CMCS
2.2 PA-CMCS的功能性质
2.2.1 DPPH自由基清除能力
抗氧化剂将稳定的DPPH自由基(紫色)转化为非自由基形式的DPPH-H(黄色),DPPH自由基的清除能力与抗氧化剂的供氢能力密切相关。PA作为一种天然的抗氧化多酚化合物,因其富含酚羟基而展现出对DPPH自由基的显著清除能力[17]。如图4所示,在测试的浓度范围内,PA-CMCS的抗氧化性显著高于CMCS(P<0.05),在质量浓度为200 μg/mL时,其自由基清除率达到75.17%,这可能是由于CMCS上经过改性的酚酸基团提高了其氢或电子供应能力,PA作为天然抗氧化多酚化合物,由于含有大量的酚羟基,对 DPPH 自由基表现出了很强的清除能力。PA对 DPPH自由基的清除活性维持在80.0%左右,然而,CMCS对DPPH自由基的清除活性却非常弱,测试浓度下均低于5.0%,且其清除活性并未随浓度的变化而呈现出明显的波动。虽然CMCS 本身具有一定的抗氧化能力,但其本身的氢供体不足,且分子间和分子内的氢键削弱了羟基和氨基的活性,抑制了DPPH自由基清除能力,因此抗氧化活性并不理想。与CMCS相比,PA与CMCS接枝共聚物对DPPH自由基的清除能力显著提高(P<0.05)。在接枝后,PA-CMCS 对DPPH 自由基清除活性得到改善,其效果随浓度升高而不断增加。
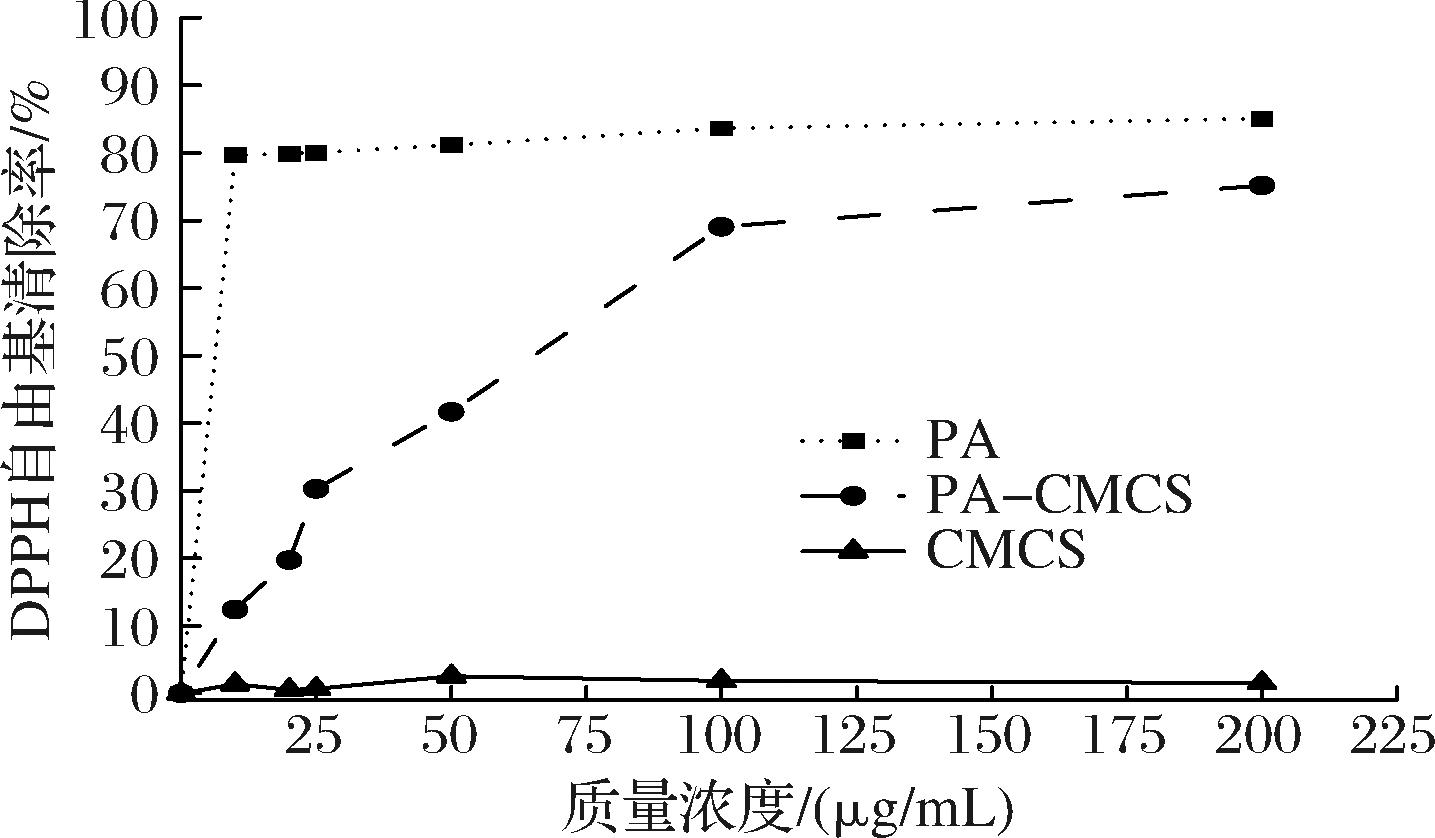
图4 PA-CMCS的DPPH自由基清除能力
Fig.4 DPPH radical scavenging capacity of PA-CMCS
2.2.2 ABTS阳离子自由基清除能力
由图5可知,在设定的测试浓度范围内,PA 展现出对ABTS阳离子自由基的高效清除能力,其清除率峰值达到了90.2%。但CMCS对ABTS阳离子自由基的清除能力较弱,其在测试浓度下的最高清除率仅为0.7%。在接枝后,PA-CMCS展现出对ABTS阳离子自由基的清除率浓度依赖性的特点,其清除活性随浓度递增而提升,在质量浓度为200 μg/mL时,其自由基清除率达到64.56%。
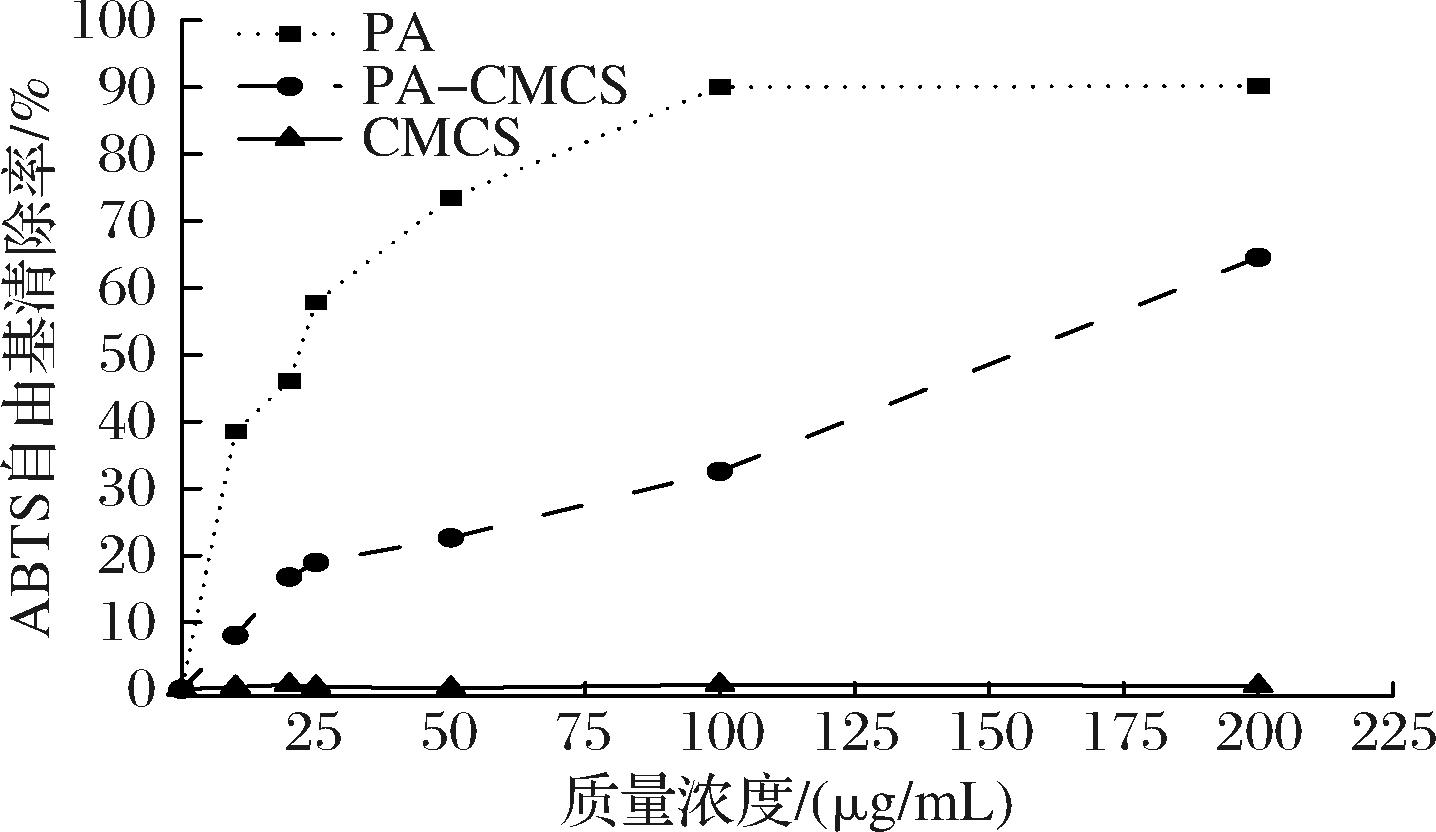
图5 PA-CMCS的ABTS阳离子自由基清除能力
Fig.5 ABTS cationic radical scavenging capacity of PA-CMCS
2.2.3 抑菌性
从表1可知,与CMCS相比,PA-CMCS具有更强的抑菌性。这表明PA接枝CMCS后,抑菌性提高,PA和CMCS的协同作用可以增强其抑菌作用。
表1 PA-CMCS及CMCS的抑菌圈直径
Table 1 Circle of inhibition diameters of PA-CMCS and CMCS

注:不同小写字母代表组间具有显著性差异(P<0.05)(下同)。
样品抑菌圈直径/mm大肠杆菌金黄色葡萄球菌枯草芽孢杆菌CMCS7.9±0.2b7.2±0.6b9.0±0.2aPA-CMCS9.9±0.6a9.14±0.7a10.6±0.7a
2.3 羊肚菌的保鲜作用
2.3.1 失重率
羊肚菌细胞表面的蒸腾作用导致水分流失,使其失重[18]。根据图6-a可知,各处理组的失重率随贮藏时间的增加而不断升高。对照组羊肚菌由于未经过保鲜涂膜处理,其失重率最高,在整个贮藏期间失重率上升到22.25%,呼吸作用和蒸腾作用是导致这种现象的主要原因。在贮藏第7天时,对照组的失重率达到10.89%,经CMCS处理的羊肚菌失重率为9.94%;而经过PA-CMCS处理的羊肚菌失重率仅为8.31%,显著低于对照组。在整个贮藏期间,经PA-CMCS涂膜处理的羊肚菌失重率都低于对照组,这说明PA-CMCS涂膜后能够减缓蒸腾作用,有效地阻止羊肚菌水分流失[19]。
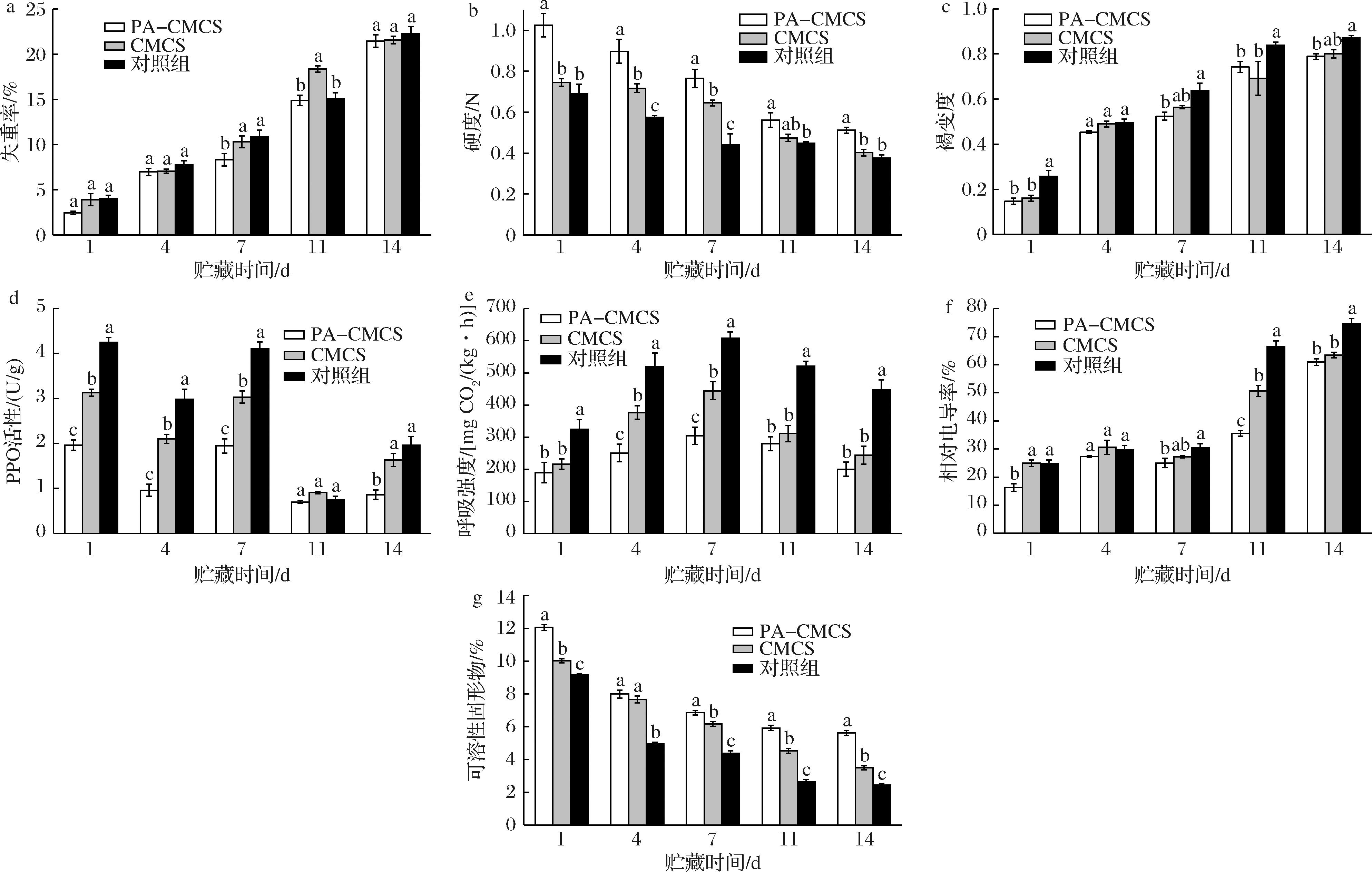
a-失重率;b-硬度;c-褐变度;d-PPO活性;e-呼吸强度;f-相对电导率;g-可溶性固形物
图6 PA-CMCS保鲜羊肚菌在贮藏期间的变化
Fig.6 Changes of Morchella preserved by PA-CMCS during storage
注:不同小写字母代表组间具有显著性差异(P<0.05)(下同)。
2.3.2 硬度
硬度是评价羊肚菌新鲜程度和品质的重要指标之一[20]。如图6-b所示,羊肚菌的硬度在整个贮藏期间总体呈现下降的趋势,且对照组羊肚菌硬度始终低于其他处理组。在整个贮藏期间,经PA-CMCS涂膜处理的羊肚菌硬度显著高于对照组,贮藏结束时,对照组硬度最低,仅为0.376 N。在贮藏第14天时,PA-CMCS和CMCS涂膜处理的2组羊肚菌硬度分别为0.512 N和0.402 N,较对照组分别高了36.17%和6.91%。说明PA-CMCS能有效地减缓羊肚菌果实的软化速度,可能是因为PA-CMCS能减少水分蒸发,抑制腐败菌繁殖,从而维持羊肚菌的硬度。
2.3.3 褐变度
羊肚菌富含多酚类物质,采摘后细胞结构被破坏,侵入大量的O2。多酚氧化酶与多酚物质结合,在O2存在的情况下,将多酚类物质氧化为醌类物质,醌类物质聚合形成黑色素,从而发生褐变。从图6-c可知,随着贮藏时间的增加,羊肚菌的褐变度也在加重,涂膜处理在一定程度上能抑制褐变。经PA-CMCS 涂膜处理的羊肚菌褐变度在第1、4、7、11、14天分别比对照组少43.02%、8.47%、17.87%、11.56%、9.62%,整体上优于CMCS 涂膜组和对照组。因此PA-CMCS 处理能有效缓解羊肚菌在贮藏期间的褐变程度,这可能是由于PA-CMCS 中含有的酚类物质起到了抗氧化作用,在羊肚菌表面形成了一层抗氧化的保护膜,阻碍了羊肚菌与空气接触发生氧化[21]。
2.3.4 PPO活性
PPO活性是导致羊肚菌在采后贮藏过程中出现组织褐变的重要因素之一[22]。通过图6-d可知,在贮藏初期,由于处于低温环境下,其PPO活性呈现出下降趋势。然而,随着贮藏时间的延长,羊肚菌逐渐进入成熟衰老阶段,其PPO活性开始逐渐上升。特别是在贮藏的第7天,羊肚菌的PPO 活性达到峰值,随后开始逐渐回落。经过PA-CMCS 涂膜处理的羊肚菌PPO 活性在贮藏第1、4、7、11、14天分别比对照组低53.88%、67.79%、53.88%、6.67%、56.12%。结果表明,PA-CMCS能够有效抑制羊肚菌PPO活性,有助于延长羊肚菌的贮藏期限。
2.3.5 呼吸强度
呼吸强度是判断羊肚菌采后保鲜情况的指标[23]。从图6-e可知,羊肚菌的呼吸强度在整个贮藏期间呈现先上升后下降的趋势。各组呼吸强度前期上升并在第7天时达到最大值,其中对照组的峰值最高,为608.40 mg CO2/(kg·h);PA-CMCS处理组的峰值最低,为304.25 mg CO2/(kg·h)。这可能是因为采后处理致使食用菌发生应激反应,新陈代谢加快,营养物质消耗增多,呼吸速率上升并且质量下降[18]。在贮藏第14天时PA-CMCS 处理组的呼吸强度最低,为200.03 mg CO2/(kg·h),说明PA-CMCS能有效抑制羊肚菌的呼吸作用,降低营养物质消耗的速率。
2.3.6 相对电导率
当羊肚菌损伤或者衰老时,细胞膜的通透性会增加,引起细胞内的电解质泄漏,从而相对电导率升高[24]。从图6-f可知,羊肚菌采后贮藏期间,其相对电导率整体呈现上升趋势。在贮藏第14天,对照组相对电导率达到了74.62%,经过PA-CMCS和CMCS涂膜处理的羊肚菌相对电导率为60.93%和63.45%。因此,通过PA-CMCS和CMCS涂膜处理可以有效保持羊肚菌贮藏期间细胞膜完整性。
2.3.7 可溶性固形物
可溶性固形物主要指果实中能溶于水的糖类、酸、维生素、矿物质等物质[25],可溶性固形物含量可以直接反映羊肚菌的成熟程度和品质。从图6-g可知,羊肚菌可溶性固形物含量在整个贮藏期间都在不断下降,这可能是由于羊肚菌呼吸作用消耗所致。在贮藏前期,对照组可溶性固形物含量下降幅度大于PA-CMCS 和CMCS 涂膜组。在贮藏第14天,PA-CMCS 组、CMCS 组和对照组的可溶性固形物含量分别下降至5.62%、3.49%和2.44%。经PA-CMCS 涂膜处理的羊肚菌可溶性固形物含量在整个贮藏期间变化较为平缓,数值整体上显著高于其他组,可能是PA-CMCS在一定程度上抑制了羊肚菌的生理代谢,使其呼吸和代谢减弱。因此,PA-CMCS 可以较好地延缓羊肚菌可溶性固形物的消耗,抑制其含量的下降。
2.3.8 菌落总数
微生物污染可导致食用菌感官质量的变化,产生难闻的气味并使组织软化[26]。从表2可知,到贮藏结束时,对照组羊肚菌的菌落总数显著高于PA-CMCS和CMCS涂膜组。经过PA-CMCS涂膜处理的羊肚菌菌落总数最少,可能是因为涂膜在羊肚菌表面形成的薄膜减少了羊肚菌与外界空气的接触,抑制了好氧菌的生长繁殖;以及PA-CMCS 本身具有一定的抗菌性,使得羊肚菌中菌落总数减少。
表2 PA-CMCS涂膜处理对羊肚菌菌落总数的影响
Table 2 Effect of PA-CMCS coating treatment on the total number of colony of Morchella
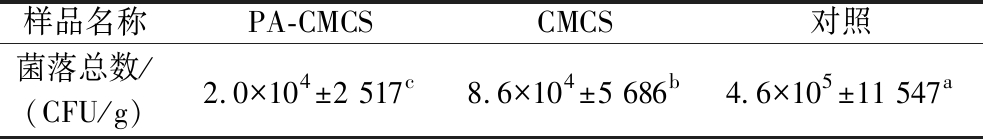
样品名称PA-CMCSCMCS对照菌落总数/(CFU/g)2.0×104±2 517c8.6×104±5 686b4.6×105±11 547a
3 结论
本研究以PA 与CMCS 为原料,制备了PA-CMCS,通过紫外光谱和红外光谱分析,证实了PA成功接枝至CMCS上。通过比较PA、CMCS及PA-CMCS的抗氧化性能和抑菌性能,发现经PA接枝后,CMCS 的抗氧化活性显著增强,抑菌活性也有所增强。同时评估在4 ℃恒温条件下,PA-CMCS对羊肚菌的保鲜效果。研究结果显示,与未经处理和仅用CMCS涂膜处理的羊肚菌相比,PA-CMCS在一定程度上能延缓羊肚菌样品的失重、硬度下降,抑制褐变程度及菌落总数的增长幅度,保持羊肚菌贮藏期间细胞膜完整性,抑制呼吸强度和PPO活性,表明PA-CMCS有助于延长羊肚菌的货架期。PA与CMCS接枝结合后,在羊肚菌贮藏过程中展现出抗氧化和抑菌的双重作用,PA-CMCS具有作为新型生物基食品包装材料的开发潜力。
[1] 刘伟, 徐恒, 王晓雨, 等.六妹羊肚菌子实体多肽分离纯化及抗氧化活性[J].食用菌学报, 2024, 31(1):94-101.LIU W, XU H, WANG X Y, et al.Isolation and purification of polypeptides from Morchella sextelata and their antioxidant activity[J].Acta Edulis Fungi, 2024, 31(1):94-101.
[2] 史宇, 孙飞龙, 王淑君, 等.羊肚菌保鲜技术研究进展[J].包装与食品机械, 2022, 40(2):102-106.SHI Y, SUN F L, WANG S J, et al.Research progress in preservation technology of Morchella esculenta[J].Packaging and Food Machinery, 2022, 40(2):102-106.
[3] GENG Y T, XUE H, ZHANG Z H, et al.Recent advances in carboxymethyl chitosan-based materials for biomedical applications[J].Carbohydrate Polymers, 2023, 305:120555.
[4] NIE F X, LIU L L, CUI J M, et al.Oligomeric proanthocyanidins:An updated review of their natural sources, synthesis, and potentials[J].Antioxidants, 2023, 12(5):1004.
[5] LEI F, WANG X Y, LIANG C X, et al.Preparation and functional evaluation of chitosan-EGCG conjugates[J].Journal of Applied Polymer Science, 2014, 131(3):app.39732.
[6] LI S Y, LI J S, ZHU Z Z, et al.Soluble dietary fiber and polyphenol complex in lotus root: Preparation, interaction and identification[J].Food Chemistry, 2020, 314:126219.
[7] YU C H, LIU X Y, PEI J C, et al.Grafting of laccase-catalysed oxidation of butyl paraben and p-coumaric acid onto chitosan to improve its antioxidant and antibacterial activities[J].Reactive and Functional Polymers, 2020, 149:104511.
[8] 米佳, 杨雪莲, 禄璐, 等.枸杞蜂花粉多糖超声波提取工艺优化及抗氧化活性分析[J].食品科学技术学报, 2020, 38(1):97-103.MI J, YANG X L, LU L, et al.Ultrasound-assisted extraction optimization and analysis of antioxidant activities of polysaccharides from bee pollen of wolfberry[J].Journal of Food Science and Technology, 2020, 38(1):97-103.
[9] 许瀛引, 谢丽源, 张志远, 等.微酸性电解水和紫外光结合对采后六妹羊肚菌的保鲜作用[J].菌物学报, 2021, 40(12):3332-3346.XU Y Y, XIE L Y, ZHANG Z Y, et al.Combined effects of slightly-acidic electrolyzed water and ultraviolet light on the postharvest quality of Morchella sextelata[J].Mycosystema, 2021, 40(12):3332-3346.
[10] 陈军, 陈洪彬, 郭凤仙, 等.氧化白藜芦醇协同抗坏血酸抑制余甘子酶促褐变的机制研究[J].中国食品学报, 2023, 23(01):240-249.CHEN J, CHEN H B, GUO F X, et al.Studies on inhibitory mechanism of oxyresveratrol combined with ascorbic acid on enzymatic browning in Phyllanthus emblica[J].Journal of Chinese Institute of Food Science and Technology, 2023, 23(1):240-249.
[11] 李萍, 于晋泽, 张娜, 等.不同包装材料对羊肚菌保鲜效果的影响[J].食品与发酵工业, 2019, 45(23):163-169.LI P, YU J Z, ZHANG N, et al.Effects of different packaging materials on the preservation of Morchella[J].Food and Fermentation Industries, 2019, 45(23):163-169.
[12] 孟晓曼, 孙亚男, 程儒杨, 等.低压静电场-真空协同保鲜对白玉菇采后品质和抗氧化代谢的影响[J].食品科学, 2022, 43(23):72-81.MENG X M, SUN Y N, CHENG R Y, et al.Effect of low-voltage electrostatic field-assisted vacuum storage on postharvest quality and antioxidant metabolism of white Hypsizygus marmoreus[J].Food Science, 2022, 43(23):72-81.
[13] 张沙沙, 朱立, 曹晶晶, 等.采后预处理对羊肚菌保鲜效果的影响[J].食品工业科技, 2016, 37(13):319-322.ZHANG S S, ZHU L, CAO J J, et al.Effect of the pretreatment on quality maintenance of morels[J].Science and Technology of Food Industry, 2016, 37(13):319-322.
[14] 张朝红. 多酚—羧甲基壳聚糖接枝物的制备及性能研究[D].天津:河北工业大学, 2023.ZHANG C H.Preparation and properties of polyphenol-carboxymethyl chitosan conjugates[D].Tianjin:Hebei University of Technology, 2023.
[15] 尹昕, 彭飞, 刘雪菲丹, 等.蓝斑背肛海兔卵多糖的理化界面性质比较[J].现代食品科技, 2024, 40(9):169-177.YIN X, PENG F, LIU X F D, et al.Comparison of the physicochemical and interfacial properties of the polysaccharides from Notarchus leachii freeri eggs[J].Modern Food Science and Technology, 2024, 40(9):169-177.
[16] 范晓坤. 基于壳聚糖的新型复合水凝胶的制备和性能研究[D].株洲:湖南工业大学, 2022.FAN X K.Preparation and performance study of new composite hydrogels based on chitosan[D].Zhuzhou:Hunan University of Technology, 2022.
[17] 贾瑞静. 原花青素—醛纤维素增强壳聚糖功能包装膜的性能研究[D].南宁:广西大学, 2023.JIA R J.Study on the properties of procyanidin-dialdehyde cellulose reinforced chitosan functional packaging film[D].Nanning:Guangxi University, 2023.
[18] 龚频, 王佳婷, 龙辉, 等.羊肚菌物理、化学保鲜方法及作用机制研究进展[J].食品与发酵工业, 2023, 49(24):312-320.GONG P, WANG J T, LONG H, et al.Advance in physical and chemical preservation methods and mechanism of Morchella esculenta[J].Food and Fermentation Industries, 2023, 49(24):312-320.
[19] 张金凤, 王海旭, 张雅娜, 等.虾青素-脱脂豆粕蛋白膜在番茄保鲜中的应用研究[J].发酵科技通讯, 2023, 52(4):205-211.ZHANG J F, WANG H X, ZHANG Y N, et al.Preservation effects of astaxanthin-defatted soybean meal protein film in tomato[J].Bulletin of Fermentation Science and Technology, 2023, 52(4):205-211.
[20] 张艳珍,谢永康,王菲,等.不同干燥方式对羊肚菌品质特性的影响[J].农业工程学报, 2024, 40(6):111-119.ZHANG Y Z, XIE Y K, WANG F, et al.Effects of different drying methods on the quality characteristics of Morchella[J].Transactions of the Chinese Society of Agricultural Engineering, 2024, 40(6):111-119.
[21] 王俊杰. 脐橙皮渣活性膜制备及保鲜效果研究[D].赣州:赣南师范大学, 2023.WANG J J.Study on the preparation and preservation effect of navel orange pomace active film[D].Ganzhou:Gannan Normal University, 2023.
[22] 吕蔷, 朱继英, 王相友.双孢蘑菇POD酶学特性及其与褐变的关系[J].园艺学报, 2016, 43(3):595-602.LYU Q, ZHU J Y, WANG X Y.Characteristics of peroxidase from Agaricus bisporus and its relationship with browning[J].Acta Horticulturae Sinica, 2016, 43(3):595-602.
[23] 吴克素. 辐照和温度对采后不同阶段板栗贮运效果的影响及货架期预测[D].武汉:华中农业大学, 2023.WU K S.Effects of irradiation and temperature on the storage and transportation effects of chestnut at different stages after harvesting and shelf life prediction[D].Wuhan:Huazhong Agricultural University, 2023.
[24] 金君, 辛树权, 韦欣霈, 等.自然越冬期软枣猕猴桃雌雄株的生理生化响应差异[J].长春师范大学学报, 2023, 42(10):86-91.JIN J, XIN S Q, WEI X P, et al.Analysis of cold resistance difference between male and female plants of Actinidia arguta during over-wintering period[J].Journal of Changchun Normal University, 2023, 42(10):86-91.
[25] BECKLES D M.Factors affecting the postharvest soluble solids and sugar content of tomato (Solanum lycopersicum L.) fruit[J].Postharvest Biology and Technology, 2012, 63(1):129-140.
[26] 谢佳妮, 郭若楠, 宾宇淇, 等.不同温度对真空包装下鲜切胡萝卜贮藏品质的影响[J].包装工程, 2023, 44(9):54-61.XIE J N, GUO R N, BIN Y Q, et al.Effects of different temperature on storage quality of fresh-cut carrots under vacuum packaging[J].Packaging Engineering, 2023, 44(9):54-61.