风味在肉制品的食用品质属性中起着极为重要的作用,是能被嗅觉细胞所感知的感官印象,可直接影响消费者对肉类产品的喜好和可接受性[1]。风味的形成原因较为复杂,主要为原料肉在热加工过程中通过脂质氧化、美拉德反应和硫胺素降解等反应形成[2],如醛类、醇类、酮类、酸类、酯类、烷烃类、含氮和含硫类化合物等。肉制品在加热过程中脂质会发生水解生成游离脂肪酸(free fatty acids, FFA),FFA氧化产生氢过氧化物,氢过氧化物可再进一步分解为挥发性风味物质[3],是醛醇等挥发性化合物的重要前体,也是肉制品形成挥发性化合物的重要途径[4]。磷脂是形成大量挥发性化合物的关键脂质成分,磷脂中含有大量的单不饱和脂肪酸(monounsaturated fatty acids,MUFA)和多不饱和脂肪酸(polyunsaturated fatty acids,PUFA),在氧化过程中会产生大量挥发性物质[5]。例如,油酸在热加工过程中可形成辛醛和壬醛等;亚油酸加热可形成己醛、2-壬烯醛、(E, E)-2,4-癸二烯醛等物质;花生四烯酸在热加工过程中可形成1-辛烯-3-醇[6]。与此同时,一些饱和脂肪酸(saturated fatty acid,SFA)也可分解为丙醛、丁醛、戊醛和庚醛等挥发性物质[7]。
研究表明,由于生猪日粮中脂肪酸含量不同,可导致原料肉中脂肪酸、蛋白质含量和脂质组成出现差异[8],而这些差异能直接影响热加工过程中的氧化程度,进而引起挥发性风味物质浓度出现差异[9-11]。酱油分离油脂是酱油发酵完成后对所有物质使用高压设备进行物理压榨后静置所获得的油料,其含量高达20%~35%[12],往往作为废弃物或作为植物肥料低价处理,附加值并未得到有效利用。以2023年全球酱油产量为例,每年酱油分离油脂含量达到134~234.5万t[13]。压榨分离油脂的脂肪酸具体组成如表1所示,可看出与大豆油组成存在较大差异,其中SFA和MUFA含量均显著高于大豆油,且∑n-3含量也显著增加,团队前期研究还表明,富含n-3 PUFA的基础日粮可改变生猪原料肉中挥发性风味物质浓度[14]。目前,常用GC-MS结合电子鼻等手段分析肉制品中挥发性风味物质及其气味属性。在GC-MS定性挥发性风味物质时,除了与质谱库中的挥发性化合物进行比对外,常采用挥发性化合物的线性保留指数(linear retention index, LRI)进行共同定性[15]。电子鼻是一种以特定传感器和模式识别系统组成的能快速提供被测样品整体信息、指示样品隐含特征的仪器,可直接通过收集器将样品中的挥发性物质采集至自身系统后进行实时分析,具有响应时间短和检测速度快等优点。在电子鼻传感器响应数据基础上,通过判别分析(discriminant analysis, DA)和偏最小二乘判别分析(partial least squares discriminant analysis, PLS-DA)等分析方法能够有效分析肉制品中复杂的香气特征[16]。
表1 日粮脂肪酸组成 单位:mg/100 g
Table 1 Composition of fatty acids in fatten feed

注:∑SFA为C14∶0、C15∶0、C16∶0、C17∶0、C18∶0、C20∶0、C22∶0与C24∶0之和;∑MUFA为C16∶1、C17∶1、C18∶1n7c、C18∶1n9c与C20∶1之和;∑PUFA为C18∶2n6c、C18∶3n3、C18∶3n6、C20∶4n6、C20∶2与C22∶4n6之和;∑n-6为C18∶2n6c、C20∶3n6、C20∶4n6与C22∶4n6之和;∑n-3为C18∶3n3之和;对照组为大豆油脂作为育肥油料;实验组为酱油分离油脂作为育肥油料;“—”代表未检出;同行不同小写字母代表2组数据存在显著差异。
对照组饲料实验组饲料P值C14∶00.69±0.06b0.88±0.04a0.001C15∶00.51±0.050.57±0.030.082C16∶0157.24±16.14181.35±12.470.056C17∶00.80±0.081.01±0.340.267C18∶024.03±2.32b30.70±1.56a0.003C20∶02.14±0.15b4.78±0.91a0.001C22∶02.39±0.26b3.65±0.27a0.001C24∶02.04±0.421.83±0.610.584C16∶10.70±0.070.66±0.030.783C17∶1—0.78±0.13C18∶1n9c160.38±9.71b277.29±58.75a0.008C18∶1n7c7.43±1.13b11.93±2.80a0.014C20∶12.70±0.26b3.52±0.45a0.019C18∶2n6c398.03±20.97349.24±37.440.063C18∶3n38.78±0.85b11.48±0.75a0.003C18∶3n62.01±0.17b2.95±0.58a0.020C20∶2—0.76±0.15C20∶4n6—0.98±0.25C22∶4n60.84±0.23—∑SFA189.83±14.30b224.77±11.96a0.010∑MUFA171.21±10.03b294.17±61.52a0.008∑PUFA409.65±21.45365.41±37.080.084∑n-6400.87±21.02353.17±37.310.067∑n-38.78±0.85b11.48±0.75a0.003n-6/n-345.91±3.79a30.92±4.18b0.002PUFA/SFA2.17±0.17a1.63±0.19b0.006
酱油残渣是酱油生产过程中产生的废弃物质,具有高盐、高油脂、高糖和高蛋白等特性,极易受到氧化和腐败等影响,如何对酱油废渣进行处理已成为酱油行业需要直面的问题[17]。随着我国酱油市场的逐渐增大,庞大的酱油渣产量合理综合利用的难题若无法处理,会给环境带来很大的压力。酱油分离油脂作为酱油残渣中含量较为丰富的物质,其利用价值也未得到更好满足,将其精炼后应用于生猪育肥行业,判断其能否作为生猪育肥中的替代基础油料极具应用价值。因此,本研究以酱油分离油脂(2 kg/100 kg)育肥的猪背最长肌为实验材料,以添加大豆油(2 kg/100 kg)育肥的猪背最长肌为对照,以上述炖煮和烤制猪肉产品为研究对象,采用测定各组间FFA含量、电子鼻以及GC-MS的方法来研究不同加工方式下2组加工肉风味信息之间具体存在的差异,揭示日粮中添加酱油分离油脂对育肥加工猪肉风味物质的影响,为酱油分离油脂的高值化应用提供理论与技术支撑。
1 材料与方法
1.1 材料与试剂
正己烷、无水乙醇、甲醇、乙醚、三氯甲烷、冰乙酸、无水硫酸钠(均为分析纯),成都市科隆化学品有限公司;正烷烃(C9~C31,98%)、十一烷酸甘油三酯(99%),上海源叶生物科技有限公司;2-甲基-3-庚酮(99%)、三氟化硼-甲醇(12.026 g/L),上海阿拉丁生化科技股份有限公司;酱油分离油脂,千禾味业食品股份有限公司。
1.2 仪器与设备
Clarus690-SQ8T气相色谱质谱联用仪搭配Elite-5 MS色谱柱(30 m×0.25 mm×0.25 μm),美国珀金埃尔默股份有限公司;QP2010 SE气相色谱质谱联用仪(Shimadzu,日本)搭配DB-WAX(30 m×0.25 mm×0.25 μm)色谱柱(安捷伦,美国);XPR204S/AC型万分之一天平,梅特勒托利多科技(中国)有限公司;B-5003-NH2型氨丙基硅胶固相萃取柱,湖南比克曼生物科技有限公司;LC-SPE-12FQ型固相萃取仪,上海力辰仪器科技有限公司;c-Nose便携式行业电子鼻,上海保圣实业发展有限公司;BPZ-6090-2真空干燥箱,上海一恒科学仪器有限公司;聚二甲基硅氧烷/聚二乙烯基苯(PDMS/DVB)固相微萃取头(65 μm, 1 cm),德国达姆施塔特默克集团。
1.3 原料采集
实验所需12头“杜洛克×长白猪×大约克夏”三元杂交猪均来自于成都市家家美食品有限责任公司。将12头猪仔转移到同一个饲养室,在育肥第一阶段使用新希望六和商业饲料(4 kg全价料/100 kg能量饲料)进行饲喂100 d,当生猪体重达到100 kg左右,将12头猪随机分成2组,进行第二阶段育肥。此阶段使用配制饲料进行育肥,对照组使用2 kg/100 kg大豆油作为基础油料进行饲养,实验组使用2 kg/100 kg酱油分离油脂作为基础油料进行饲养,企业酱油分离油脂制备过程大致如图1所示,2组日粮的脂肪酸组成如表1所示,实验日粮配方如表2所示。育肥实验结束时,12头猪平均质量为(140.79±3.58)kg。添加2 kg/100 kg大豆油育肥的生猪标记为对照组,添加2 kg/100 kg酱油分离油脂育肥的生猪标记为实验组,对照组生猪出栏质量为(140.75±4.02)kg,实验组生猪出栏质量为(140.83±3.14)kg。
表2 生猪育肥日粮营养组成 单位:kg/100 kg
Table 2 Nutrition composition of the feed used to fatten pigs
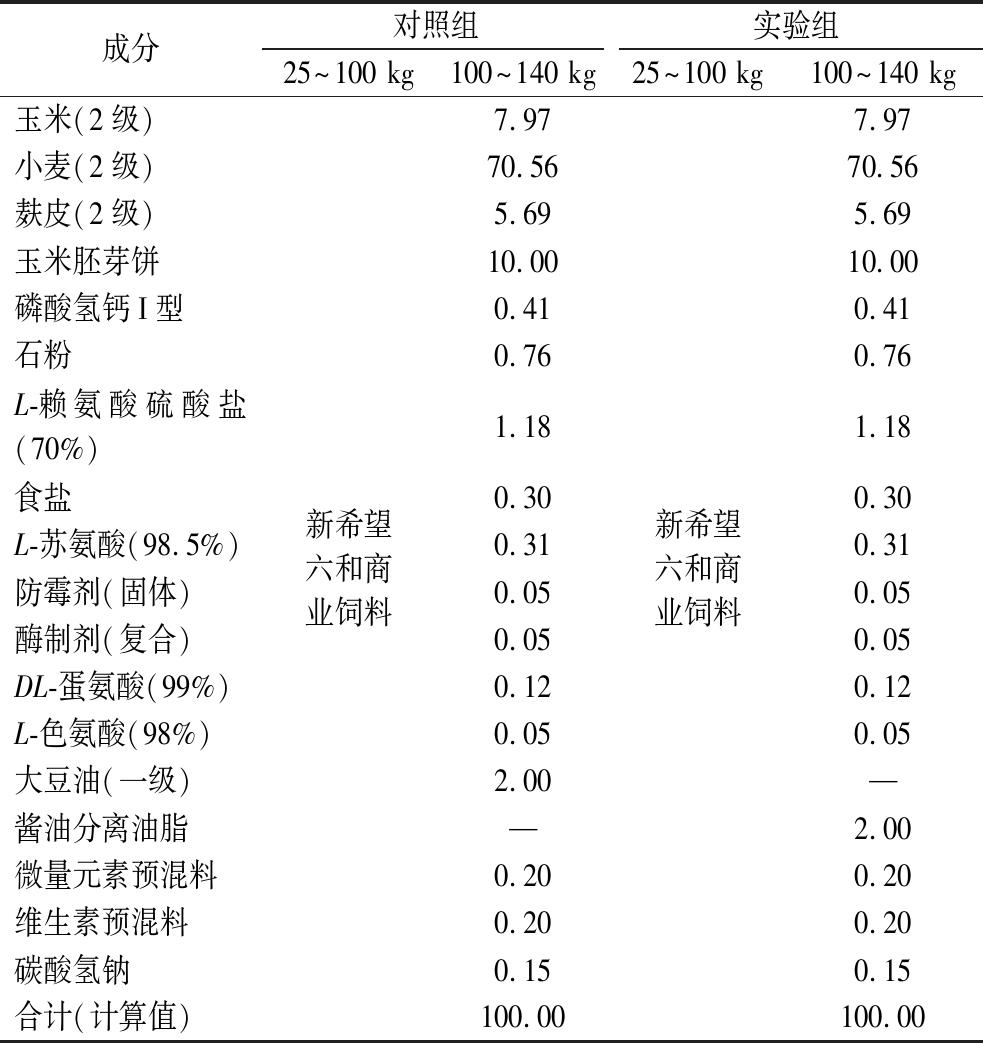
注:对照组为大豆油脂作为育肥油料;实验组为酱油分离油脂作为育肥油料;“—”代表未添加。
成分对照组实验组25~100 kg100~140 kg25~100 kg100~140 kg玉米(2级)小麦(2级)麸皮(2级)玉米胚芽饼磷酸氢钙I型石粉L-赖氨酸硫酸盐(70%)食盐L-苏氨酸(98.5%)防霉剂(固体)酶制剂(复合)DL-蛋氨酸(99%)L-色氨酸(98%)大豆油(一级)酱油分离油脂微量元素预混料维生素预混料碳酸氢钠合计(计算值)新希望六和商业饲料7.9770.565.6910.000.410.761.180.300.310.050.050.120.052.00—0.200.200.15100.00新希望六和商业饲料7.9770.565.6910.000.410.761.180.300.310.050.050.120.05—2.000.200.200.15100.00
图1 酱油分离油脂制备工艺
Fig.1 Preparation procedures of the soy sauce separates oil
将12头生猪运送到农场附近的当地屠宰场,静息12 h后,按照四川农业大学动物福利委员会制定的原则和指导方针,根据国家科研委员会《实验动物爱护与使用指南》(2011)进行屠宰。在4 ℃、87%湿度下排酸24 h后,采集胴体右侧第6~13根肋骨的背最长肌,去除可见的脂肪和结缔组织,通过冷链物流1 h内运送到实验室,真空包装用于后续实验。
1.4 样品制备
猪肉样品的炖煮和烤制处理方式具体如下,炖煮:将原料肉切割成2 cm×2 cm×2 cm大小,取150 g肉块于炖煮锅中,按照肉块与水1∶10质量比加水,使用电磁炉开始煮制,水沸腾后计时1 min,关火,撇去水和浮沫,再次按照相同质量比和条件加水煮制,水沸腾后计时,至肉块中心温度达到80 ℃以上。烤制:将肉块置于烤箱中,上下管温度设定200 ℃,烤箱预热后放肉,直至肉块中心温度至80 ℃以上。
1.5 实验方法
1.5.1 游离脂肪酸测定
参考孙为正[18]的方法进行脂质分离,采用氨丙基硅胶固相萃取柱分离脂质,使用前添加5 mL正己烷进行活化,称取10 mg提取脂质,置于3 mL正己烷中溶解,使用活化后的萃取柱进行吸附,使用3 mL乙酸-乙醚溶液(20 mL/L)洗脱游离脂肪酸,收集洗脱液,用N2干燥洗脱液。随后加入10 μL十一烷酸甘油三酯(10 mg/mL)和1 mL三氟化硼-甲醇溶液(12.026 g/L),在50 ℃水浴条件下甲酯化20 min,加入4 mL正己烷,混匀后静置1.5 h,取上清液于3 g Na2SO4中,除去残余水分,将上清液用0.45 μm有机系滤膜过滤,取1 μL进行GC-MS(Clarus690-SQ8T)分析。氦气作为载气,分流比1∶20,传输线和离子源温度分别设定为250 ℃和230 ℃,溶剂延迟3 min,扫描范围m/z 45~450。升温程序如下:120 ℃保持2 min,以4 ℃/min的速度升至200 ℃,保持2 min,以2 ℃/min升温至240 ℃,在240 ℃保持2 min。通过内标物十一烷酸甘油三酯的峰面积来计算各脂肪酸含量,选取NIST数据库中匹配度大于800的物质作为最终物质。
1.5.2 电子鼻测定
本仪器由18个电子感应探头组成,分别对应如下物质敏感:传感器探头 S-1(丙烷和烟雾)、S-2(乙醇、烟雾、异丁烷和甲醛)、S-3(臭氧)、S-4(硫化氢)、S-5(氨)、S-6(甲苯、丙酮、乙醇和氢气)、S-7(甲烷、天然气和沼气)、S-8(液化气)、S-9(甲苯、甲醛、苯、酒精、丙酮)、S-10(氢气)、S-11(液化气体和烷烃)、S-12(液化气、甲烷)、S-13(甲烷)、S-14(易燃气体和烟雾)、S-15(烟雾、异丁烷)、S-16(硫化物)、S-17(氮化物)、S-18(丙酮、乙醇)。
电子鼻的测定参考HUI等[19]的方法并进行一定修改,将2 g捣碎后的加工肉样放入20 mL带盖顶空小瓶中,在25 ℃下放置1 h,然后将连接传感器的空心针以1 L/min速率吸收样品的挥发性气体,吸取过程维持1 min,该仪器每秒会记录18个传感器的电导率(G/G0)变化(G,与样品接触的传感器的电导率;G0,传感器与活性炭过滤气体接触的电导率;挥发性香气浓度越强,G/G0离1越远,如果没有香气气体,G/G0为1)。完成一个样品后,用清洁空气吹扫系统3 min以重新平衡,然后再进行下一个样品检测。初步实验表明,G/G0在45 s后几乎保持,因此收集G/G0在48、49、50、51、52 s的特征值使用软件Xlstat 2019(Addinsoft公司,美国)进行分析。
1.5.3 挥发性化合物测定
1.5.3.1 挥发性物质提取
挥发性风味物质检测参照HUI等[20]的方法并稍作修改。取2.0 g粉碎后的加工肉样置于顶空进样瓶中,在样品中添加1.50 μL 2-甲基-3-庚酮(1.68 μg/μL,溶于甲醇溶液)作为内标,使用涂有65 μm聚二甲基硅氧烷/二乙烯基苯纤维的进样针萃取样品中的香气成分,将顶空进样瓶放置在50 ℃水浴条件下平衡15 min,随后使用萃取针吸附45 min,解吸温度250 ℃,解吸时间3 min。
收集的挥发性化合物使用气相质谱联用仪(QP2010 Shimadzu)进行测定,配备柱子信息为安捷伦DB-WAX(30 m×0.25 mm×0.25 μm)色谱柱。其中,前进样口温度250 ℃,载气(He)流速1.0 mL/min,不分流模式进样,升温程序:初始柱温40 ℃,保持3 min,以2 ℃/min升至70 ℃,以3 ℃/min升至130 ℃,再以10 ℃/min升至230 ℃,保持10 min。质谱扫描范围为 40~500 m/z,电子电离模式为70 eV,离子源温度为200 ℃,传输线温度为250 ℃。使用NIST 2.0质谱数据库和文献中报道的LRI鉴定挥发性化合物,其中,LRI以C9~C31正构烷烃混标为外标,按照样品GC-MS升温程序检测,根据正构烷烃混标出峰时间计算挥发性风味物质的保留指数,保留指数计算公式:LRI=100n+100(tx-tn)/(tn+1-tn),式中:n为碳个数,tx、tn与tn+1分别为未知挥发性风味物质、Cn与Cn+1的出峰时间,3种物质的出峰时间为tn<tx<tn+1。按内标法对挥发性化合物进行定量计算,结果报告为“平均值±标准误差”,单位为μg/g样品。
1.5.3.2 气味活性值(odor activity values, OAV)计算
OAV代表挥发性化合物对风味的贡献,它是通过计算其挥发性化合物浓度与各自气味阈值(Ci/Ti)的比率[21]。对于挥发性化合物i,Ci是其浓度(μg/m3),Ti是其阈值(μg/m3)。0≤OAV<1表明挥发性化合物对整体风味特征影响不大。当OAV≥1时,表示挥发性化合物对整体风味的性质有显著影响,OAV越大,挥发性化合物对整体风味的贡献就越大。
1.6 数据处理
每组实验重复3次,结果以“平均值±标准差”表示,采用SPSS 23.0软件中独立样本t检验对各加工组间进行数据分析,以判定不同加工方式间2组样品数据是否存在显著差异。转入育肥室的猪、选择屠宰的猪、胴体右侧猪背最长肌、处理肌肉样本的天数、加工过程中肉块切割大小以及温度细微变化为随机因子,补充酱油分离油脂的饲料、样品加工方式、猪背最长肌肉部位为固定因子。
使用Xlstat软件(2019版,Microsoft,美国)通过DA模型来分析不同加工方式下实验组(对照组和实验组)所获得的电子鼻(S1~S18)气味数据,以对照组和实验组为因变量(Y),以电子鼻中的传感器探针(S1~S18)为解释变量(X),以所有处理中的所有重复作为观察标记。在模型计算中,假设类内协方差矩阵不同,不考虑先验概率,并且在0.05水平检测到显著性。为了确定电子鼻传感器分别与具体某一组有更好的相关性,以便数据可视化,使用Xlstat软件进行PLS-DA模型分析,以电子鼻中的传感器探针(S1~S18)为解释变量(X),以不同处理(对照组和实验组)为因变量(Y),在模型计算中,运算法则设置为快速,停止条件(固定数为4),交叉验证方法为LOO,变量(center和reduce)和置信区间(%)为95。使用Xlstat软件建立PLS-DA模型分析相同加工方式同不同肉制品间的具体风味差异,以各加工组中的关键挥发性物质为解释变量(X),以不同处理(对照组和实验组)为因变量(Y),其余参数重复上述条件。使用Origin 2021对各加工组间OAV>1的风味物质绘制热图。
2 结果与分析
2.1 日粮中添加酱油分离油脂对猪肉制品挥发性风味物质前体的影响
日粮中添加不同油脂的2组原料肉经炖煮和烤制2种加工方式处理后FFA的含量如表3所示。
表3 日粮中不同油脂添加对加工猪肉制品中游离脂肪酸组成的影响 单位:mg/100 g肉样
Table 3 The effect of different oils addition in feed on free acid composition in pork meat products
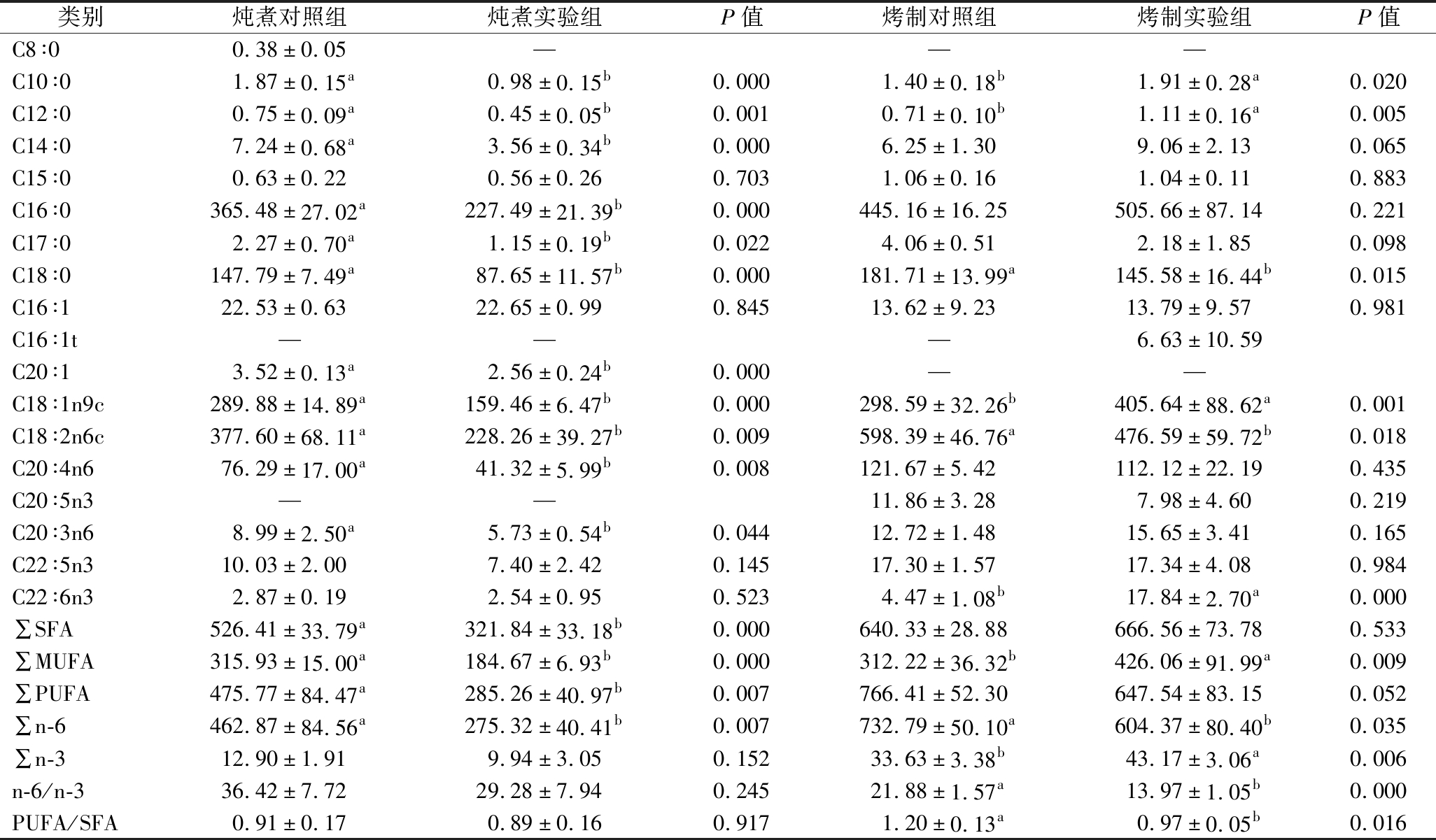
注:炖煮对照组为2 kg/100 kg大豆油脂作为基础油料饲喂所得原料肉经炖煮后样品;炖煮实验组为2 kg/100 kg酱油分离油脂作为基础油料饲喂所得原料肉经炖煮后样品;烤制对照组为2 kg/100 kg大豆油脂作为基础油料饲喂所得原料肉经烤制后样品;烤制实验组为2 kg/100 kg酱油分离油脂作为基础油料饲喂所得原料肉经烤制后样品;不同小写字母代表存在显著差异;“—”代表未检出;∑SFA为C8∶0、C10∶0、C12∶0、C14∶0、C15∶0、C16∶0、C17∶0与C18∶0之和;∑MUFA为C16∶1、C16∶1t、C20∶1与C18∶1n9c之和;∑PUFA为C18∶2n6c、C20∶4n6、C20∶5n3、C20∶3n6、C22∶6n3、C22∶5n3与C22∶6n3之和;∑n-6为C18∶2n6c、C20∶4n6与C20∶3n6之和;∑n-3为C20∶5n3、C22∶6n3、C22∶5n3与C22∶6n3之和。
类别炖煮对照组炖煮实验组P值烤制对照组烤制实验组P值C8∶00.38±0.05———C10∶01.87±0.15a0.98±0.15b0.0001.40±0.18b1.91±0.28a0.020C12∶00.75±0.09a0.45±0.05b0.0010.71±0.10b1.11±0.16a0.005C14∶07.24±0.68a3.56±0.34b0.0006.25±1.309.06±2.130.065C15∶00.63±0.220.56±0.260.7031.06±0.161.04±0.110.883C16∶0365.48±27.02a227.49±21.39b0.000445.16±16.25505.66±87.140.221C17∶02.27±0.70a1.15±0.19b0.0224.06±0.512.18±1.850.098C18∶0147.79±7.49a87.65±11.57b0.000181.71±13.99a145.58±16.44b0.015C16∶122.53±0.6322.65±0.990.84513.62±9.2313.79±9.570.981C16∶1t———6.63±10.59C20∶13.52±0.13a2.56±0.24b0.000——C18∶1n9c289.88±14.89a159.46±6.47b0.000298.59±32.26b405.64±88.62a0.001C18∶2n6c377.60±68.11a228.26±39.27b0.009598.39±46.76a476.59±59.72b0.018C20∶4n676.29±17.00a41.32±5.99b0.008121.67±5.42112.12±22.190.435C20∶5n3——11.86±3.287.98±4.600.219C20∶3n68.99±2.50a5.73±0.54b0.04412.72±1.4815.65±3.410.165C22∶5n310.03±2.007.40±2.420.14517.30±1.5717.34±4.080.984C22∶6n32.87±0.192.54±0.950.5234.47±1.08b17.84±2.70a0.000∑SFA526.41±33.79a321.84±33.18b0.000640.33±28.88666.56±73.780.533∑MUFA315.93±15.00a184.67±6.93b0.000312.22±36.32b426.06±91.99a0.009∑PUFA475.77±84.47a285.26±40.97b0.007766.41±52.30647.54±83.150.052∑n-6462.87±84.56a275.32±40.41b0.007732.79±50.10a604.37±80.40b0.035∑n-312.90±1.919.94±3.050.15233.63±3.38b43.17±3.06a0.006n-6/n-336.42±7.7229.28±7.940.24521.88±1.57a13.97±1.05b0.000PUFA/SFA0.91±0.170.89±0.160.9171.20±0.13a0.97±0.05b0.016
在炖煮肉制品中共检出了16种游离脂肪酸,其中8种SFA、3种MUFA、5种PUFA。SFA的含量最高,约占总FFA的40.30%,在对照组和实验组2种炖猪肉制品的SFA中,C16∶0占据了较高比例,分别达到69.42%和70.68%。整体而言,实验组中SFA、MUFA、PUFA和∑n-6均显著低于对照组,分别降低了69.42%、41.55%、42.13%和40.52%。在烤制方式下,肉制品中也检出了16种FFA,其中7种SFA、3种MUFA、6种PUFA,但仅有6种脂肪酸间存在明显差异,其中,实验组中C10∶0、C12∶0、C18∶1n9c和C22∶6n3含量显著大于对照组,而C18∶0和C18∶2n6c含量明显低于对照组,同时,2组肉制品中SFA和PUFA间差异并不显著,但实验组肉制品中的MUFA含量显著高于对照组,且酱油分离油脂饲喂的原料肉经烤制后,增加了∑n-3含量,降低了∑n-6含量和n-6/n-3比值,一些研究指出,过高的n-6/n-3脂肪酸比例会导致人体一些心血管疾病发生[22],而较低的n-6/n-3比值可以预防动脉粥样硬化的发生[23]。n-3 PUFA是一类对人体有益的FA,在降低肿瘤、肥胖和心脑血管疾病发病率方面有重要作用[24],同时其受热氧化过程中也会生成一些特定风味产物,这些差异也为后续肉制品中挥发性风味物质浓度不同提供了潜在影响[25]。
2.2 日粮中添加酱油分离油脂对猪肉制品电子鼻响应的影响
日粮中酱油分离油脂添加对猪肉制品气味的影响如图2所示。DA是能直观揭示肉制品气味差异的有效方法[14]。炖煮和烤制方式处理下的DA结果图(图2-a和图2-c)均表明,第一主成分F1的贡献率达到100%,与解释方差完全一致,说明此模型拟合的模型完全可信,能够反映不同加工猪肉样品间气味的特征信息。在炖煮方式处理下,日粮中添加酱油分离油脂育肥的猪肉样品投影于F1负方向,添加大豆油脂育肥的猪肉样品投影于F1正方向,明确分离现象表明2组样品之间气味存在显著差异(P<0.05);在烤制处理方式下,日粮中添加酱油分离油脂育肥的猪肉样品投影于F1负方向,添加大豆油脂育肥的猪肉样品投影于F1负方向,2组之间气味信息差距显著(P<0.05)。2组图像表明,在生猪育肥日粮中添加酱油分离油脂饲喂所得原料肉经炖煮和烤制处理后,其气味特征与常规大豆油处理组均存在显著差异。对照组和实验组的位置也均表明,F1可能是由于育肥猪日粮中不同油脂所导致的气味差异。

a-大豆油饲喂的原料肉经炖煮后的DA图;b-大豆油饲喂的原料肉经炖煮后的PLS-DA载荷图;c-酱油分离油脂饲喂的原料肉经烤制后的DA图;d-酱油分离油脂饲喂的原料肉经烤制后的PLS-DA载荷图
图2 日粮中不同油脂添加对加工猪肉制品中电子鼻响应的影响
Fig.2 Effect of different oils addition in feed on electronic nose responses in pork meat products
PLS-DA结果(图2-b和图2-d)呈现了不同加工方式后2组样品风味差异的响应传感器阵列。在炖煮方式处理下,日粮中添加酱油分离油脂育肥的猪肉样品与所有电子传感器探头均位于w*/c1负方向,而对照组肉制品位于w*/c1正方向,这说明2组肉制品电子传感器间存在显著差别,而S-15、S-1、S-3、S-8、S-2、S-7和S-9等7种传感器与剩下的11种传感器在w*/c2方向存在显著负相关关系,这说明S-15、S-1和S-3等7种传感器是区别2组炖煮肉制品的关键电子传感器。从电子鼻各探头信息可了解到,此种加工方式下,酱油分离油脂育肥的猪肉样品较大豆油育肥的猪肉样品而言,酮类和醛类物质浓度更为丰富,这与图5中的OAV相对应,和炖煮过程中肉制品的脂质氧化程度及游离脂肪酸含量差异有一定联系。在烤制方式处理下,日粮中添加酱油分离油脂育肥的猪肉样品与传感器S-11、S-12、S-7、S-5、S-4、S-6、S-8、S-14、S-1、S-2、S-3、S-9、S-16、S-17、S-18和S-15均位于w*/c1负方向,而对照组肉制品仅与传感器S-10和S-13位于w*/c1正方向,这说明分离油脂组的肉制品气味特征与对照组存在明显差别,同时,S-14、S-1、S-2、S-3、S-9、S-16、S-17、S-18和S-15等9个传感器与实验组样品位于w*/c2负方向,S-11、S-12、S-7、S-5、S-4、S-6和S-8等7个传感器位于w*/c2正方向,也说明实验组样品中对应S-1和S-2这8个传感器代表的气味更为浓郁,查阅电子鼻各探头信息发现,烤制方式下,酱油分离油脂育肥的猪肉样品中较大豆油组而言,醛类和硫化物类物质含量更为丰富。也说明了S-1、S-2、S-3、S-9、S-16、S-17、S-18、S-15与S-10、S-13所代表的气味信息是导致2组肉制品气味出现差异的重要原因。
由此可知,日粮中利用酱油分离油脂替代传统大豆油脂进行炖煮和烤制的猪肉制品会在一定程度上改变气味品质特性。
2.3 日粮中添加酱油分离油脂对猪肉制品挥发性风味物质的影响
2.3.1 日粮中添加酱油分离油脂对猪肉制品挥发性风味物质含量的影响
香气是衡量肉类质量的指标,含量丰富的易挥发性风味化合物可以通过刺激消费者嗅觉来增加食品的吸引力。图3为各实验组内的总离子峰图,见电子版增强出版附表1(https://doi.org/10.13995/j.cnki.11-1802/ts.042196,下同)揭示了日粮中添加酱油分离油脂对肉制品挥发性化合物形成的影响。在炖煮条件下,共鉴定出醛类12种、醇类7种、酮类4种、酯类2种、酸类8种、烷烃类5种以及其他化合物11种;在烤制条件下,共鉴定出醛类15种、醇类6种、酮类5种、酯类3种、酸类8种、烷烃类4种以及其他化合物17种。这些挥发风味物质主要来自前体物质参与的脂质氧化和美拉德反应等[26]。从所有肉制品中的挥发风味物质中各类物质总浓度来看,醛类物质浓度含量最高,占所有挥发风味物质浓度的50%左右;其次分别为醇类、烷烃类、酸类和其他剩余物质等。
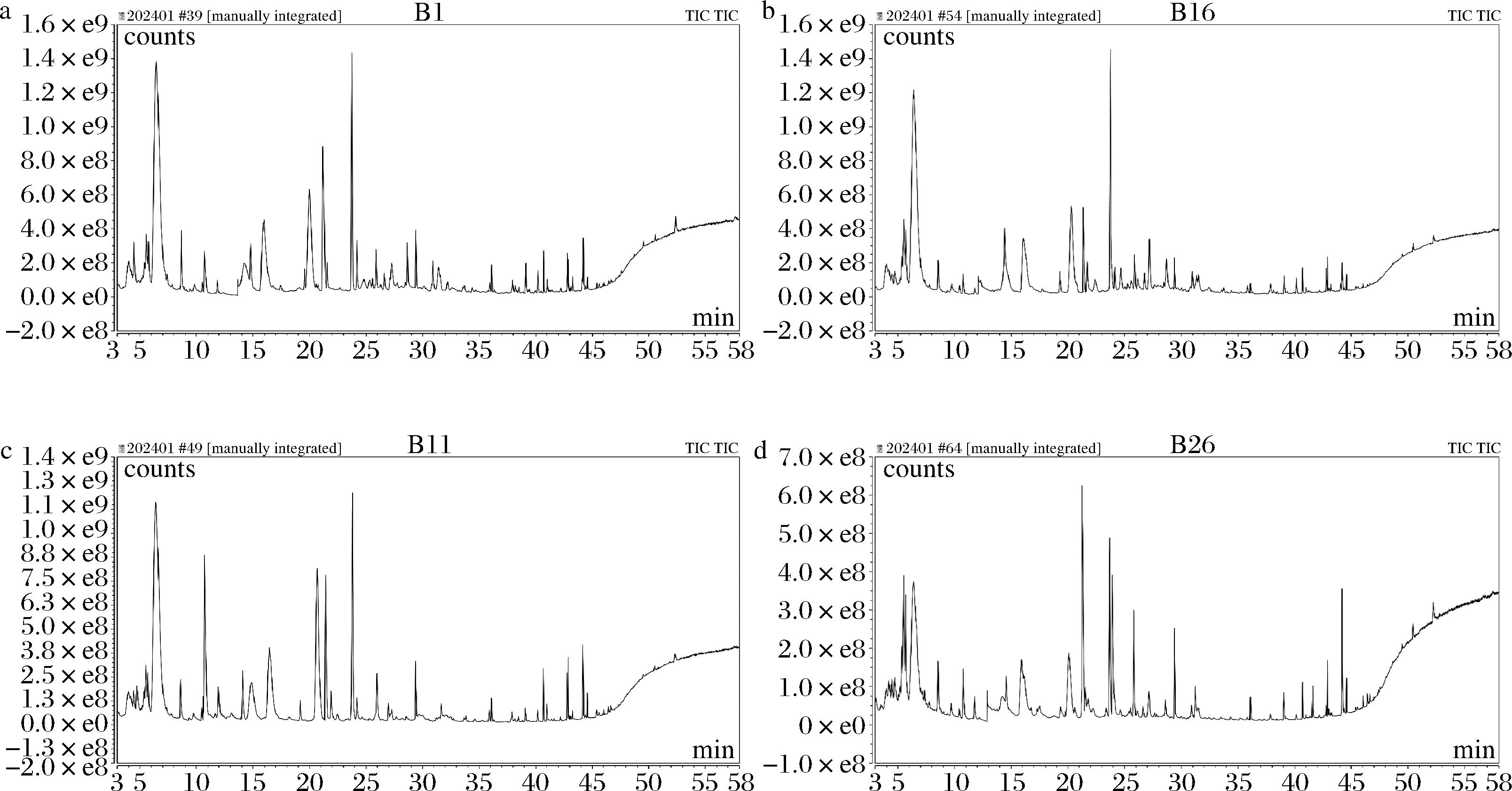
a-炖煮对照组;b-炖煮实验组;c-烤制对照组;d-烤制实验组
图3 日粮中不同添加油脂加工猪肉制品内离子流图
Fig.3 Total ion chromatograms of processed pork products with different oils addition in diets
醛类是脂质氧化降解和氨基酸Strecker降解反应产物中最常见的挥发性有机化合物,具有令人愉悦的花香和果香[27],其气味感知阈值低,对肉制品风味有相当大的影响,还可与其他化合物的羰基类物质反应产生其他挥发性物质[28]。对于醛类物质中最主要的正戊醛和正己醛而言,炖煮和烤制处理下2组肉制品间均无显著差异(P>0.05)。目前,正己醛认为主要来源于C18∶2n6c的分解[29],而在FFA含量中,不同加工方式下的不同组别间均存在显著差异,但正己醛含量却并无影响,NATALELLO等[30]也认为正己醛与亚油酸含量间并无关系,因此,本实验结果认为正己醛并非完全依靠亚油酸的分解。在炖煮处理下,实验组肉制品中仅反-2-辛烯醛、苯甲醛、反-2-壬醛和反,反-2,4-癸二烯醛这4种物质浓度显著大于对照组(P<0.05),其他8种醛类物质间均无显著差异,且2组肉制品中总醛类物质浓度间并没有显著差异,这可能是一些脂质和PUFA在加热过程中氧化不一所造成的[31]。在烤制方式下,2组肉制品中总醛类浓度无显著差异,但9种醛类间存在明显差异,其中,实验组肉制品中苯甲醛和苯乙醛浓度显著大于对照组(P<0.05),苯甲醛和苯乙醛是烘烤肉制品中常见的挥发性物质,根据以往研究显示,这2种物质与苯丙氨酸参与的美拉德反应有紧密关系[32],这说明2组肉制品中美拉德反应程度存在差异,同时,对照组中的正壬醛、反-2-辛烯醛、反-2-壬醛、2,6-二甲基苯甲醛、反,反-2,4-壬二烯醛、2-十一烯醛和2,4-癸二烯醛的浓度含量均显著大于实验组(P<0.05)。壬醛是一种仅通过PUFA衍生的脂质过氧化产物,而2组肉制品在FFA中的PUFA含量并无差异,造成这种原因可能是由于壬醛在某些氨基酸影响下通过还原反应生成了一些醇类物质[33],余下的6种醛类物质均来源于脂质热分解和不饱和脂肪酸降解2种反应[34],这说明2组肉制品在烘烤过程中脂质氧化和不饱和脂肪酸降解程度存在差异,进而使得后续一些醛类物质浓度出现差异,同时,烘烤过程中的美拉德反应也是导致各醛类浓度差异的重要原因。
醇类是本研究中检测到含量第二丰富的挥发性风味物质,通常是由脂质氧化、糖与氨基酸反应以及不饱和脂肪酸氧化分解形成[35],它们的气味阈值较高,对肉制品风味的贡献性不如醛类重要。其中,正戊醇和1-辛烯-3-醇是本实验中重要的醇类物质,两者含量均占据了总醇类物质的60%以上。1-辛烯-3-醇是加工猪肉中常见的不饱和醇,气味阈值相对较低,对猪肉制品整体风味而言有显著影响[36]。在炖煮方式处理下,实验组肉制品中总醇类物质浓度显著高于对照组,主要是由于正戊醇、1-辛烯-3-醇和正庚醇这3种醇类物质均显著大于对照组造成,正戊醇和1-辛烯-3-醇是由亚油酸和花生四烯酸氧化而来[37],对照组肉制品中2种PUFA含量高而正戊醇与1-辛烯-3-醇含量更低,这可能是由于对照组中生成的醇类物质在后续加热过程中继续氧化而损失[38],除此之外,在加热过程中的氨基酸代谢反应也会导致醇类物质浓度出现差异[33]。在烤制方式处理下,总醇类含量以及各组醇类物质中,其含量与炖煮处理下完全相反,对照组肉制品中正戊醇、正己醇、1-辛烯-3-醇和2-辛烯-1-醇的浓度均显著大于实验组,这也说明在烤制处理过程中,醇类物质不仅仅只受到特定脂肪酸影响,还与烘烤过程中发生的美拉德反应存在联系[39]。
酮类物质是由脂质氧化、美拉德反应和氨基酸降解产生的,对构成肉制品特有的香气特征有重要贡献[40],这些化合物也是形成吡嗪化合物的重要前体[35]。在炖煮方式处理下,对照组肉制品中仅检出2种酮类物质,而在实验组肉制品中含有4种,其中2,5,5-三甲基-3-己酮和3,5-辛二烯-2-酮仅在实验组肉制品中检出,3-辛烯-2-酮的浓度也显著高于对照组,这也使得实验组肉制品中整体酮类物质含量显著高于对照组,说明2组肉制品在炖煮过程中的氧化程度存在明显不同。在烤制方式处理下,共有5种酮类物质检出,其中实验组肉制品中3-羟基-2-丁酮和羟基丙酮浓度显著大于对照组,而3-辛烯-2-酮和3,5-辛二烯-2-酮浓度却与之相反,2组总酮类含量并无差异,说明酮类物质的生成与美拉德反应存在关联。
酯类常由脂质代谢产生的羧酸和醇类酯化形成,对肉的风味特性有很大贡献,酯类形成增加主要与美拉德反应有关[41]。在炖煮条件下,2组肉制品中酯类含量无显著差异。在烤制处理下,2组肉制品内亚硝酸乙酯和甲酸辛酯浓度存在明显差异,这也使得2组间的总酯类含量存在明显差距,这进一步说明2组原料肉在烘烤过程中美拉德反应程度存在差异。
酸类物质主要是加热过程中通过甘油三酯和磷脂的水解形成,也可能是由醇类和醛类物质继续氧化产生,其不仅是风味化合物,而且还是作为酮类和酯类的前体[42]。酸通常还会产生一些难闻的气味,如汗味和刺激性气味等。在本研究中共检测出了8种酸类物质,无论是炖煮还是烤制方式处理,仅有部分酸类物质间存在显著差异,但2组肉制品中总酸类浓度并无明显影响。
烷烃主要来源于脂肪酸分解,具有较高的气味阈值,因此对整体香气的贡献较小[43]。而在图5中的OAV贡献图中可看出,这类物质并不会对猪肉风味产生影响。炖煮方式下实验组肉制品中烷烃类物质较对照组更为丰富,且总含量显著大于对照组。在烤制处理下,2组肉制品中均检出4种烷烃类物质,实验组肉制品中各物质含量均显著大于对照组,这些物质也丰富了加工肉制品中挥发性物质的种类。
吡嗪是一种具有独特香气的杂环化合物,是美拉德反应后独有的挥发性化合物,具有坚果或烘烤香气,其气味阈值较低,能对烘烤肉制品中的香气具有一定贡献。大多数吡嗪是由氨基酸和α-羰基化合物之间的Strecker反应衍生出的2个α-氨基羰基缩合而成,可以显著促进食品的感官属性[44]。附表1可看出,仅在烘烤方式处理下检测出了2,6-二甲基吡嗪和3-乙基-2,5-二甲基吡嗪化合物,且实验组肉制品中的2组物质含量显著高于对照组,间接说明2组肉制品在烘烤过程中美拉德反应程度存在差异。吡咯是一种具有甜味、坚果味和烤面包味的挥发性物质,由二羰基化合物与还原糖的羰基反应形成糖胺,然后发生重排和缩合反应而成[45],也是一种重要的美拉德反应标志物,在本实验中,也仅在烘烤处理方式下检出,且实验组肉制品中2-乙酰吡咯含量也显著高于对照组,这进一步说明了2组原料肉在加工过程中发生美拉德反应的剧烈程度存在差异。
总体而言,挥发性化合物分析结果表明,日粮中添加酱油分离油脂可能通过改变脂肪酸谱来进一步改善猪肉制品中的风味特征。尽管不同加工方式下2组肉制品总挥发性物质浓度无显著差异,但改变了自身一些特定挥发性物质浓度,这对改变2组肉制品中的风味组成信息提供了帮助。
本研究利用PLS-DA模型的投影变量重要性(variable importance projection, VIP)和载荷图来揭示酱油分离油脂作为基础油料饲喂所得原料肉经炖煮和烤制后,与传统大豆油组肉制品中挥发性风味物质的差异。VIP是通过计算每个自变量在PLS-DA中的贡献度来反映其重要性,VIP值越大,表明该自变量对因变量的贡献越大。找出相应VIP>1的关键风味物质后,在PLS-DA模型中对筛选出的风味物质再次进行标记,以找出不同肉制品间存在的具体差异。
在图4-a中可以看出,炖煮方式肉制品中VIP>1的关键挥发性风味物质主要有2-甲基癸烷、3-甲基癸烷、3-辛烯-2-酮、反-2-壬醛、十二酰胺、1-辛烯-3-醇、正戊醇、反-2-辛烯醛、正丙酸、反,反-2,4-癸二烯醛、正己醛、对甲酚、反-2-十二碳烯醇、苯甲醛、正庚醇、亚硝酸乙酯、2-辛烯-1-醇、正壬醛和苯甲酸等19种,图4-b为2组肉制品的PLS-DA载荷图,同时标记出上述19种关键挥发性风味物质,可以看出对照组肉制品仅与亚硝酸乙酯和反-2-十二碳烯醇位于w*/c1的正方向,相比之下,实验组肉制品中与剩余的17种挥发性风味物质位于w*/c1的负方向。这说明添加2 kg/100 kg酱油分离油脂的生猪原料肉经炖煮后,肉制品中正己醛、反,反-2,4-癸二烯醛和正庚醇等17种挥发物的浓度含量较高,但也降低了亚硝酸乙酯和反-2-十二碳烯醇的含量。其中,正己醛、反,反-2,4-癸二烯醛和正庚醇等7种挥发性物质位于w*/c2的正方向;对甲酚、3-辛烯-2-酮、苯甲酸以及1-辛烯-3-醇等12种风味物质与实验组肉制品位于w*/c2的负方向,说明在上述这19种化合物中,对甲酚和3-辛烯-2-酮等12种风味物质的浓度变化是导致这2组肉制品的挥发性物质种类及浓度存在差异的最主要原因,这与电子鼻的结果一致。炖煮肉制品中大部分挥发性风味物质主要来源于脂质氧化[46],这说明在炖煮方式处理下,经分离油脂饲喂的猪肉制品中脂质氧化程度与常规大豆油组存在差异,而造成这种差异的原因可能与2组肉制品中脂肪酸含量及脂质差异存在联系。

a-炖煮条件下2组加工肉中VIP类型;b-炖煮条件下2组加工肉的PLS-DA图;c-烤制条件下2组加工肉中VIP类型;d-烤制条件下2组加工肉的PLS-DA图
图4 日粮中添加不同油脂对加工猪肉制品中关键风味物质的影响
Fig.4 The effect of different oils addition in feed on key volatile compounds in pork meat products
图4-c可以看出,烤制方式肉制品中VIP>1的关键挥发性风味物质主要有2-乙酰吡咯、3-甲基癸烷、1-辛烯-3-醇、3-辛烯-2-酮、5-甲基癸烷、3-乙基-2,5-二甲基吡嗪、甲酸辛酯和2-甲基癸烷等32种挥发性风味物质,图4-d为2组肉制品的PLS-DA载荷图,同时标记出上述32种关键挥发性风味物质,可以看出对照组肉制品与正戊醇、1-辛烯-3-醇和甲酸辛酯等17种物质位于w*/c1的正方向,实验组肉制品与甲酰胺、3-羟基-2-丁酮和苯乙醛等15种物质位于w*/c1的负方向。这说明饲喂2 kg/100 kg酱油分离油脂的生猪原料肉经烤制后增强了肉制品中甲酰胺、3-羟基-2-丁酮和苯乙醛等15种挥发物的浓度,但也相对降低了正戊醇和1-辛烯-3-醇等17种挥发物的含量。羟基丙酮和正戊醇等14种挥发性物质位于w*/c2的正方向,甲酰胺和2-辛烯-1-醇等18种挥发性物质位于w*/c2的负方向,这说明正戊醇、正壬醛、甲酰胺和3-羟基-2-丁酮等18种风味物质是导致2组肉制品中挥发性物质种类及浓度存在差异的关键原因,这与电子鼻结果大致相似。烘烤肉制品中大部分挥发性风味物质来源于脂质氧化和美拉德反应共同作用[47],图4-d中的美拉德反应、脂质氧化的标志性吡嗪类和醛醇类物质进一步揭示了在烘烤方式处理下,经分离油脂饲喂的猪肉制品中脂质氧化和美拉德反应程度与常规大豆油组存在差异,而造成这种差异的原因可能与2组肉制品中脂肪酸含量及氨基酸类物质等存在联系。
总的来说,饲喂酱油分离油脂可通过脂质氧化和美拉德反应来进一步影响肉制品中风味特征。
2.3.2 日粮中添加酱油分离油脂对猪肉制品OAV的影响
如图5所示,在炖煮加工方式下,2组之间的风味特征存在一定差异,这种差距主要体现在醛、醇类物质中。醛类化合物已被证明具有较低的气味阈值和独特的气味特征,其OAV相对较高。实验组熟肉中正己醛、正壬醛、反-2-辛烯醛、苯甲醛、反-2-壬醛、反,反-2,4-壬二烯醛、反,反-2,4-癸二烯醛、正戊醇、1-辛烯-3-醇、正庚醇和2-乙基己醇的OAV均明显大于对照组,这说明这些物质对区分2组加工肉风味有着重要作用,这与图2炖煮方式下2组猪肉的电子鼻数据相吻合。同时,2组间3-辛烯-2-酮、正戊酸、苯乙烯、二甲基三硫和黄樟素的OAV也存在明显不同。这说明日粮中添加酱油分离油脂的猪肉在炖煮处理下,自身脂质氧化程度与传统大豆油组存在显著差异。
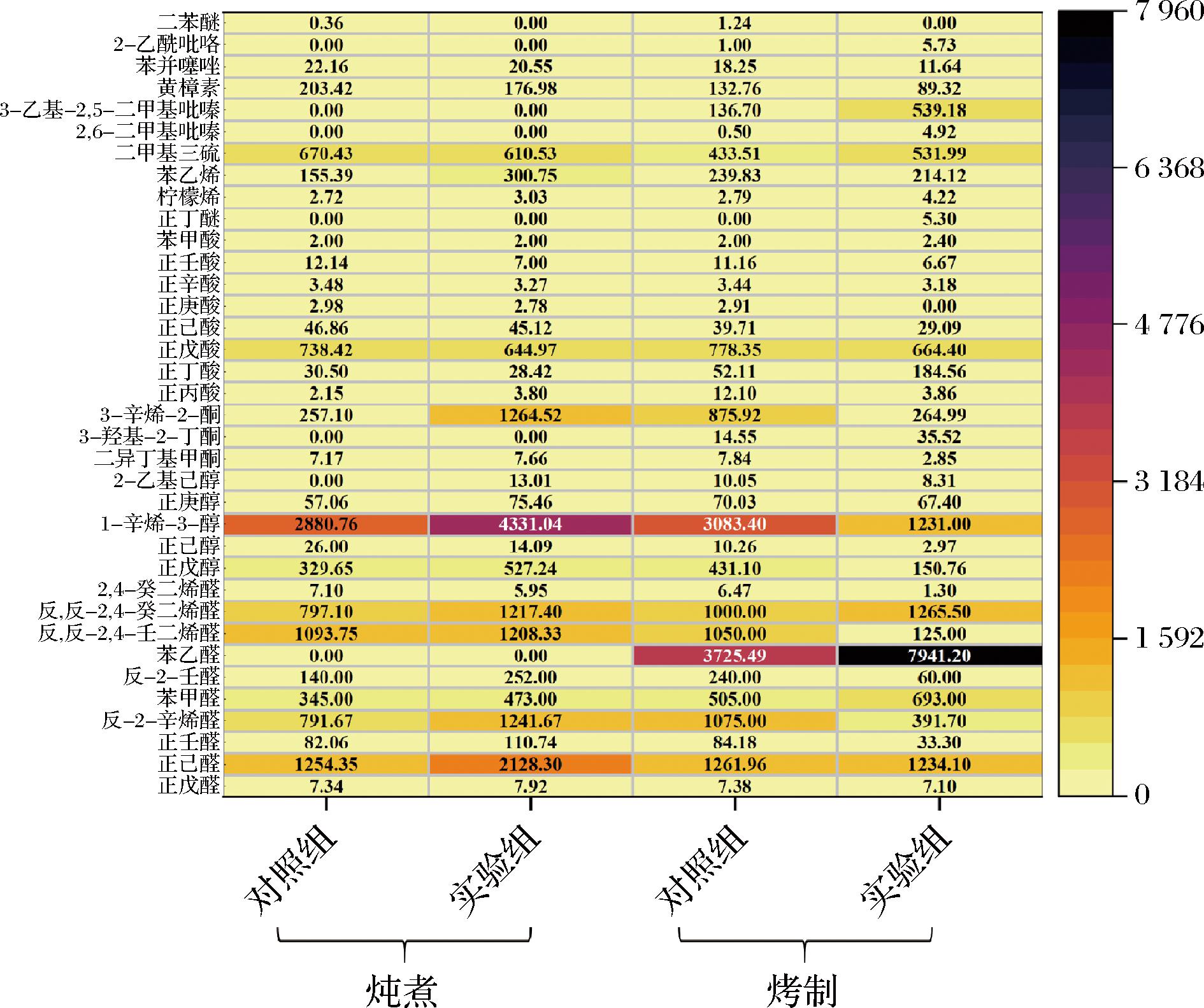
图5 日粮中不同油脂加工后猪肉中的OAV差异
Fig.5 Differences OAV in processed pork with different oil in dietary
在烤制加工处理下的对照组中,正壬醛、反-2-辛烯醛、反-2-壬醛、反,反-2,4-壬二烯醛、正戊醇、正己醇、1-辛烯-3-醇、3-辛烯-2-酮、正戊酸、正庚酸和黄樟素的OAV均明显大于实验组;而在实验组中,苯甲醛、苯乙醛、反,反-2,4-癸二烯醛、3-羟基-2-丁酮、正丁酸、正丁醚、二甲基三硫、3-乙基-2,5-二甲基吡嗪和2-乙酰吡咯的OAV更大。这与图2烤制方式下2组猪肉的电子鼻数据大致相似。说明分离油脂饲喂的猪肉经烤制后,自身脂质氧化与美拉德反应程度存在明显区别,正是这种区别进而导致对猪肉整体的风味特征产生影响。
3 结论
本研究首次探究了在生猪日粮中使用2 kg/100 kg酱油分离油脂替换2 kg/100 kg大豆油脂所得原料肉进行炖煮和烤制处理后对猪背最长肌风味及前体物质的影响。结果表明,炖煮方式下,由于C16∶0、C18∶1n9c与C18∶2n6c含量均显著低于对照组,使得实验组肉制品中SFA、MUFA和PUFA含量显著低于对照组肉制品,而在烤制方式中,C18∶1n9c含量增加使得实验组肉制品中MUFA含量显著高于对照组。炖煮和烤制方式中,对照组肉制品与实验组肉制品间的电子鼻信息存在显著差异。通过检测肉制品中所有挥发性风味物质含量并进行PLS-DA模型分析,分别具体揭示了引起炖煮和烤制方式下2组肉制品出现风味差异的12种和15种关键风味物质。最后通过OAV计算得知了单个挥发性风味物质的贡献程度,也鉴定出在炖煮加工方式下不同油脂处理组肉制品气味特征中起主要贡献的物质是1-辛烯-3-醇,而苯乙醛是烤制加工后肉制品中主要的气味特征贡献物质。总体而言,炖煮和烤制处理下,在育肥猪的饮食中使用酱油分离油脂有利于加工肉制品的风味和品质发展。
[1] DEL BIANCO S, NATALELLO A, LUCIANO G, et al.Influence of dietary cardoon meal on volatile compounds and flavour in lamb meat[J].Meat Science, 2020, 163:108086.
[2] TAN C M, LI X F, YU Y Q, et al.Effects of five thermal processing methods on the physicochemical properties and flavor characteristics of grass carp meat[J].LWT, 2024, 206:116599.
[3] 孙承锋, 周楠, 朱亮, 等.卤猪肉加工过程中游离脂肪酸、游离氨基酸及核苷酸变化分析[J].现代食品科技, 2016, 32(6):200-206.SUN C F, ZHOU N, ZHU L, et al.Changes in free fatty acid, free amino acid, and nucleotide content during preparation of stewed pork[J].Modern Food Science and Technology, 2016, 32(6):200-206.
[4] 李林. 微生物在发酵酸鱼中对脂质变化和风味组成的影响[D].无锡:江南大学, 2019.LI L.Effects of microorganisms on lipid changes and flavor composition in fermented sour fish[D].Wuxi:Jiangnan University, 2019.
[5] DOM NGUEZ R, PATEIRO M, GAGAOUA M, et al.A comprehensive review on lipid oxidation in meat and meat products[J].Antioxidants, 2019, 8(10):429.
NGUEZ R, PATEIRO M, GAGAOUA M, et al.A comprehensive review on lipid oxidation in meat and meat products[J].Antioxidants, 2019, 8(10):429.
[6] AL-DALALI S, LI C, XU B C.Insight into the effect of frozen storage on the changes in volatile aldehydes and alcohols of marinated roasted beef meat:Potential mechanisms of their formation[J].Food Chemistry, 2022, 385:132629.
[7] LI C, AL-DALALI S, WANG Z P, et al.Investigation of volatile flavor compounds and characterization of aroma-active compounds of water-boiled salted duck using GC-MS-O, GC-IMS, and E-nose[J].Food Chemistry, 2022, 386:132728.
[8] LIU X, XIA B, HU L T, et al.Maillard conjugates and their potential in food and nutritional industries:A review[J].Food Frontiers, 2020, 1(4):382-397.
[9] SUN Q W, MU Q Q, YAN Y, et al.Krill oil showed a good application potential as the dietary lipid source on the growth, physiology, nutritional quality, and flavor of the edible meat of the oriental river prawns (Macrobrachium nipponense)[J].Aquaculture Reports, 2023, 32:101721.
[10] DE OLIVEIRA MAIA PARENTE M, ROCHA K S, BESSA R J B, et al.Effects of the dietary inclusion of babassu oil or buriti oil on lamb performance, meat quality and fatty acid composition[J].Meat Science, 2020, 160:107971.
[11] JER NIMO E, ALVES S P, PRATES J A M, et al.Effect of dietary replacement of sunflower oil with linseed oil on intramuscular fatty acids of lamb meat[J].Meat Science, 2009, 83(3):499-505.
NIMO E, ALVES S P, PRATES J A M, et al.Effect of dietary replacement of sunflower oil with linseed oil on intramuscular fatty acids of lamb meat[J].Meat Science, 2009, 83(3):499-505.
[12] 王颖. 酿造酱油回收油脂的理化性质分析及精炼[D].广州:华南农业大学, 2017.WANG Y.Analysis and refining of physicochemical properties of recovered oil from brewed soy sauce[D].Guangzhou:South China Agricultural University, 2017.
[13] JI C F, PETCHKONGKAEW A, VAN RUTH S, et al.The crucial importance of soy sauce authenticity:Global trade, adulteration risks, and analytical challenges[J].Trends in Food Science &Technology, 2024, 152:104666.
[14] HUI T, LI Q Q, FANG Z F, et al.Sensory qualities markers of n-3 PUFA enriched fresh pork meat fattened by linseed oil and selenium methionine[J].Food Chemistry, 2025, 464:141832.
[15] GHADER M, SHOKOUFI N, ES-HAGHI A, et al.Headspace solid-phase microextraction (HS-SPME) combined with GC-MS as a process analytical technology (PAT) tool for monitoring the cultivation of C.tetani[J].Journal of Chromatography B, 2018, 1083:222-232.
[16] KAN Q X, CAO L, HE L P, et al.Tracing the change of the volatile compounds of soy sauce at different fermentation times by PTR-TOF-MS, E-nose and GC-MS[J].Food Chemistry:X, 2025, 25:102002.
[17] 吴昌正, 关梓杰, 童星.酱油渣微生物高效转化研究进展[J].广东化工, 2022, 49(21):111-113;121.WU C Z, GUAN Z J, TONG X.Research progress on efficient microbial transformation of soy sauce lees[J].Guangdong Chemical Industry, 2022, 49(21):111-113;121.
[18] 孙为正. 广式腊肠加工过程中脂质水解、蛋白质降解及风味成分变化研究[D].广州:华南理工大学, 2011.SUN W Z.Studies on lipolysis, protelysis and flavor compounds during processing of Cantonese sausage [D].Guangzhou:South China University of Technology, 2011.
[19] HUI T, FANG Z F, HAMID N, et al.Effect of variable pressure-assisted immersion process using (-)-epicatechin on the color, flavor, and polycyclic aromatic hydrocarbons content in roasted beef meat[J].LWT, 2023, 178:114602.
[20] HUI T, FANG Z F, MA Q L, et al.Effect of cold atmospheric plasma-assisted curing process on the color, odor, volatile composition, and heterocyclic amines in beef meat roasted by charcoal and superheated steam[J].Meat Science, 2023, 196:109046.
[21] JIANG H, ZHANG M T, YE J J, et al.HS-SPME-GC-MS and OAV analyses of characteristic volatile flavour compounds in salt-baked drumstick[J].LWT, 2022, 170:114041.
[22] HARRIS W S, TINTLE N L, IMAMURA F, et al.Blood n-3 fatty acid levels and total and cause-specific mortality from 17 prospective studies[J].Nature Communications, 2021, 12:2329.
[23] DUGAN M E R, VAHMANI P, TURNER T D, et al.Pork as a source of omega-3 (n-3) fatty acids[J].Journal of Clinical Medicine, 2015, 4(12):1999-2011.
[24] SUN Y M, ZHANG H, ZHANG R Y, et al.Effects of n-3 polyunsaturated fatty acids and selenomethionine supplementation on physicochemical properties, oxidative stability and endogenous enzyme activities of fresh pork loin[J].Food Chemistry:X, 2024, 24:101949.
[25] NATALELLO A, PRIOLO A, VALENTI B, et al.Dietary pomegranate by-product improves oxidative stability of lamb meat[J].Meat Science, 2020, 162:108037.
[26] HAN D, ZHANG C H, FAUCONNIER M L, et al.Characterization and differentiation of boiled pork from Tibetan, Sanmenxia and Duroc×(Landrac×Yorkshire) pigs by volatiles profiling and chemometrics analysis[J].Food Research International, 2020, 130:108910.
[27] SUN X X, YU Y M, SALEH A S M, et al.Characterization of aroma profiles of Chinese four most famous traditional red-cooked chickens using GC-MS, GC-IMS, and E-nose[J].Food Research International, 2023, 173:113335.
[28] KERTH C R, MILLER R K.Beef flavor:A review from chemistry to consumer[J].Journal of the Science of Food and Agriculture, 2015, 95(14):2783-2798.
[29] ELMORE J S, COOPER S L, ENSER M, et al.Dietary manipulation of fatty acid composition in lamb meat and its effect on the volatile aroma compounds of grilled lamb[J].Meat Science, 2005, 69(2):233-242.
[30] NATALELLO A, MENCI R, LUCIANO G, et al.Effect of dietary pomegranate by-product on lamb flavour[J].Meat Science, 2023, 198:109118.
[31] ZHAN F L, SUN L X, ZHAO G M, et al.Multiple technologies combined to analyze the changes of odor and taste in Daokou braised chicken during processing[J].Foods, 2022, 11(7):963.
[32] LIU J, WAN P, XIE C F, et al.Brown sugar aroma:Key aroma-active compounds, formation mechanisms and influencing factors during processing[J].Journal of Food Composition and Analysis, 2024, 128:106076.
[33] LIU Q Q, GU X J, WEN R X, et al.Changes in meat quality and volatile flavor compounds profile in beef loin during dry-aging[J].LWT, 2024, 205:116500.
[34] ZHANG M, CHEN M F, FANG F, et al.Effect of sous vide cooking treatment on the quality, structural properties and flavor profile of duck meat[J].International Journal of Gastronomy and Food Science, 2022, 29:100565.
[35] FENG S L, LI P J, LI Y S, et al.Volatile profiles and characteristic odorants in camellia seeds with different heat pretreatments[J].Food Chemistry, 2025, 468:142497.
[36] WANG Q, LI X F, XUE B, et al.Low-salt fermentation improves flavor and quality of sour meat:Microbiology and metabolomics[J].LWT, 2022, 171:114157.
[37] YANG Z H, HOU Y R, ZHANG M, et al.Unraveling proteome changes of Sunit lamb meat in different feeding regimes and its relationship to flavor analyzed by TMT-labeled quantitative proteomic[J].Food Chemistry, 2024, 437:137657.
[38] SUN X L, ZHANG B, HAN J J, et al.Effect of roasting temperature and time on volatile compounds, total tocopherols, and fatty acids of flaxseed oil[J].Journal of Food Science, 2022, 87(4):1624-1638.
[39] JIN W G, FAN X R, JIANG C Y, et al.Characterization of non-volatile and volatile flavor profiles of Coregonus peled meat cooked by different methods[J].Food Chemistry:X, 2023, 17:100584.
[40] ZHANG L, HU Y Y, WANG Y, et al.Evaluation of the flavour properties of cooked chicken drumsticks as affected by sugar smoking times using an electronic nose, electronic tongue, and HS-SPME/GC-MS[J].LWT, 2021, 140:110764.
[41] JIANG S, XIA D, WANG X M, et al.Analysis of aroma-active compounds in four Chinese dry-cured hams based on GC-O combined with AEDA and frequency detection methods[J].LWT, 2022, 153:112497.
[42] WANG H L, YANG P, LIU C, et al.Characterization of key odor-active compounds in thermal reaction beef flavoring by SGC×GC-O-MS, AEDA, DHDA, OAV and quantitative measurements[J].Journal of Food Composition and Analysis, 2022, 114:104805.
[43] XI B N, ZHANG J J, XU X, et al.Characterization and metabolism pathway of volatile compounds in walnut oil obtained from various ripening stages via HS-GC-IMS and HS-SPME-GC-MS[J].Food Chemistry, 2024, 435:137547.
[44] LIANG Y F, WANG K, YANG Q F, et al.The antioxidant activities and flavor properties of glycated bighead carp meat hydrolysates produced with galactose and galacto-oligosaccharides[J].LWT, 2022, 158:113104.
[45] YIN W T, SHI R, LI K, et al.Effect of microwave pretreatment of sunflower kernels on the aroma-active composition, sensory quality, lipid oxidation, tocopherols, heterocyclic amines and polycyclic aromatic hydrocarbons of sunflower oil[J].LWT, 2022, 170:114077.
[46] DOU L, LIU C, SU R N, et al.Effects of dietary arginine supplementation on muscle structure, meat characteristics and lipid oxidation products in lambs and its potential mechanisms of action[J].Meat Science, 2024, 216:109581.
[47] WANG J P, XU S Y, WANG Y L, et al.Elucidating the effect of various roasting methods on the water-holding capacity and volatile flavor profiles of ultrasound-assisted pickled roast duck meat[J].International Journal of Gastronomy and Food Science, 2024, 38:101006.