豆豉是一种传统的发酵豆制品,通常由大豆或黑豆通过微生物发酵制成,以其独特的风味和丰富的营养深受消费者喜爱[1]。根据豆豉发酵过程优势微生物种类的不同,可分为曲霉型豆豉、毛霉型豆豉、根霉型豆豉、细菌型豆豉和脉孢菌型豆豉五大类,中国豆豉主要有曲霉型豆豉、毛霉型豆豉和细菌型豆豉三大类[2]。豆豉在生产过程中原料经过微生物发酵形成挥发性化合物(如酯类、酸类、醇类、萜烯等)形成豆豉独特的香气,原料中的不挥发大分子化合物逐渐被水解成为氨基酸、肽、糖、不挥发有机酸等,成为构成豆豉的味觉和味感的关键化合物。近年来,研究人员开始研究豆类发酵食品中功能性的多肽,这些多肽主要有降血脂、降血糖、降血压和抗氧化等功能[3-4],而豆豉降压肽的研究鲜有报道。
高血压作为一种心血管疾病,成为全球公共卫生关注的焦点,世界卫生组织(World Health Organization,WHO)发布的《全球高血压报告》指出全球30~79岁成人的高血压患病率约为33%[5]。《中国心血管健康与疾病报告2022》显示,我国高血压患病人数已达2.45亿,是我国目前患病人数最多的慢性非传染病[6]。血压由多种机制调节,其中一种机制已证明血压水平与血管紧张素转化酶(angiotensin converting enzyme,ACE)的活性相关。ACE作为一种锌离子(Zn2+)金属肽酶,在生物体内通过激肽释放酶系统和肾素-血管紧张素系统作为血压调节的关键限速酶。因此,抑制ACE活性已成为治疗高血压的有效方法。来自天然蛋白质的ACE抑制活性肽正引起科学家越来越多的关注。近年来,人们从多种食物资源中分离出具有ACE抑制性质的食品衍生肽,如腐乳[7]、奶酪[8]和玉米[9]等。
在多肽的分离技术方面,超滤技术凭借环保、高效分离的特点可以将小分子质量的多肽与大分子蛋白质有效分离,同时使用不同的滤膜将多肽根据分子质量的大小有效进行分段提取[10]。静电场轨道阱质谱技术作为高分辨质谱工具,具有良好的质量精度和广泛的动态范围,能够对复杂样品进行高灵敏度的检测和鉴定[11]。液相色谱的高效分离能力与高分辨质谱技术的精准分析性能,不仅能对复杂多肽样品高效纯化有利,还能在生物活性多肽的鉴定和结构分析中展现出极大的潜力。纳升液相色谱-静电场轨道阱高分辨质谱(nanoflow liquid chromatography-orbitrap mass spectrometry,NanoLC-Orbitrap-MS)技术结合了高分离度、高精确性和高灵敏度等多种优势,能灵敏快速地鉴定多肽和蛋白,结合数据库搜索,短时间内获得大分子物质的序列数据,这一技术联合策略已用于多肽药代动力学[12]、复杂体系中蛋白质及多肽鉴定[13]、蛋白谱库的建立[14]等。本研究以中国目前市面上最常见的3种不同发酵类型豆豉为对象,基于NanoLC-Orbitrap-MS技术对豆豉中的多肽成分进行分离、鉴定,并探讨其中的ACE抑制肽活性,为提高豆豉的附加值提供了有益的尝试。
1 材料与方法
1.1 材料与试剂
3种豆豉样品,即曲霉型豆豉、毛霉型豆豉和细菌型豆豉,分别简写为S-D、Y-G和S-B,均为市售成品豆豉,超市采购后在4 ℃下保存备用。超纯水使用Millipore-Q系统制备。ACE(源自兔肺)、乙腈、三氟乙酸(trifluoroacetic acid,TFA),均为色谱级,Sigma-Aldrich公司;合成肽(纯度≥95%),南京肽谷生物科技有限公司;ACE试剂盒,日本同仁化学公司。
1.2 仪器与设备
Centrifuge 5418冷冻离心机,德国Eppendorf公司;MS-S磁力加热搅拌器,大龙兴创实验仪器有限公司;Labscale TFF超滤系统,美国Millipore公司;EASY-nLC 1200纳升液相色谱仪、Q Exactive HF-X质谱仪,美国赛默飞公司;Cytation 3微孔板读数仪,美国BioTek公司。
1.3 样品脱盐
样品脱盐通过使用100 mg的Sep-Pak C18柱进行,按照制造商的说明操作。首先用500 μL的80%乙腈(体积分数,下同)溶液活化柱子2次,然后用2%乙腈(含0.1% TFA,体积分数,下同)进行2次平衡。接着,将冻干的肽组分溶解在200 μL的2%乙腈(含0.1% TFA)中。加载样品后,用1 mL的2%乙腈(含0.05% TFA)洗涤C18柱2次,接着用1 mL的80%乙腈进行洗脱,以收集纯化的肽。最后,将洗脱液冻干后,存储在-20 ℃,以便后续分析。
1.4 超滤分离豆豉中的ACE抑制肽
参考WEI等[15]分离酒糟多肽的方法,改进了豆豉多肽的超滤分离方法。从豆豉水提物中通过使用特定分子质量的纤维素超滤膜进行分离,其截留分子质量为3 kDa。通过使用超滤系统完成超滤步骤,并获得了小于3 kDa的超滤截留液。经冷冻干燥后,储存于-20 ℃备用。
1.5 NanoLC-Orbitrap-MS鉴定豆豉多肽
将3种不同豆豉脱盐后收集的组分分别冻干后复溶,样品使用纳升液相色谱仪与质谱仪联用进行分析,并利用蛋白数据库检索软件PEAKS Online进行多肽的解析鉴定。
色谱柱:熔融石英毛细管柱(25 cm×75 μm,1.7 μm);流动相:A 100%乙腈、B超纯水(0.1%甲酸);洗脱梯度:0~0.5 min,8% B;0.5~52.5 min,8%~32% B;52.5~53 min,32%~95% B;53~60 min,95% B;流速300 nL/min;进样量1 μL。
质谱条件:质谱仪在正离子模式和数据依赖性采集(data dependent acquisition,DDA)方式获取多肽数据。喷雾电压设置为2.1 kV,毛细管加热温度保持在320 ℃。对于全MS扫描,分辨率设定为60 000(m/z 200),扫描范围为m/z 300~1 200。全MS的自动增益控制(automatic gain control,AGC)目标设置为3×106,最大注入时间(injection time,IT)为30 ms。高能碰撞解离(high energy collision dissociation,HCD)碎裂在28 V的碰撞能量下进行。对于MS/MS,AGC目标值设为1×105,分辨率为30 000,IT为50 ms。隔离窗口固定在1.6 m/z。
1.6 ACE抑制活性测定
ACE抑制活性通过ACE试剂盒和紫外检测系统进行测定,根据试剂盒厂商提供的技术手册进行操作。向样品孔中加入20 μL的样品溶液,向空白1和空白2孔中分别加入20 μL去离子水。向每个孔中加入20 μL的底物缓冲液。再向空白2孔中加入20 μL去离子水,而向样品孔和空白1孔中加入20 μL的酶工作溶液。将含有上述溶液的所有孔在37 ℃下孵育1 h。随后,向每个孔中加入200 μL的指示剂工作溶液,并再孵育10 min。使用微孔板读数仪在450 nm波长下记录吸光度。ACE抑制活性按公式(1)计算:
ACE抑制活性![]()
(1)
式中:A对照,阳性对照的吸光度;A空白,加入超纯水的空白的吸光度;A样品,样品的吸光度。
此外,还通过非线性回归法测定了一些肽和样品的半抑制浓度(half inhibitory concentration,IC50),即抑制50% ACE活性所需的肽浓度,通过非线性曲线拟合ACE抑制率与抑制剂浓度来计算。
1.7 ACE抑制肽的分子动力学测定和分子对接
基于LAN等[16]的方法并作适当改进。以马尿酰-组氨酰-亮氨酸(hippuryl-His-Leu,HHL)作为ACE的底物,将ACE、标准多肽和HHL分别溶解于0.1 mol/L硼酸缓冲液(含0.3 mol/L NaCl溶液,pH 8.3)。总计加入20 μL的ACE溶液(0.1 U/mL)和50 μL不同浓度的HHL(3、1.5、0.75、0.325 mmol/L),与50 μL的标准多肽溶液共同孵育。酶促反应在37 ℃下进行10 min后,通过加入100 μL的1.0 mol/L HCl溶液终止反应。反应释放的马尿酸通过UPLC进行分析,并在228 nm波长下检测吸光度。通过Lineweaver-Burk图绘制分析在有无多肽(0.0、0.5、1.0 mg/mL)条件下的ACE活性动力学变化。
为了模拟目标多肽与ACE之间的分子相互作用机制,使用Autodock Tools 1.5.6软件包进行了分子对接模拟。在对接过程中,采用了来源于蛋白数据库(http://www.rcsb.org/pdb/home/home.do)的三维人ACE-利辛普利复合物晶体结构(1O86.pdb)作为受体。目标多肽的三维结构通过ChemBioDraw 14.0生成,并使用ChemBio3DUltra 14.0软件进行了能量最小化。在对接之前,1O86中的所有异源分子,包括水分子,均被去除,而辅因子Zn2+和Cl-则被保留。在ACE模型中添加了极性氢原子。以Zn2+的坐标(x:43.817,y:38.308,z:46.652)为中心,构建了66 Å×66 Å×66 Å且网格间距为0.375 Å的网格图,用作结合位点。通过Autodock 4.2软件的灵活对接工具,进行了肽配体与ACE模型之间的分子对接。选择了拉马克遗传算法,进行了100次运算。通过比较目标多肽对接构象中的结合能值,选取活性口袋中的最低结合能作为最佳构象。使用PyMOL 2.3.2(1.3r1,DeLano Scientific LLC,美国加州)对蛋白质-配体相互作用图进行了可视化分析。
2 结果与分析
2.1 豆豉水溶性多肽分析
已有的研究结果表明,食品体系中具有ACE的抑制活性的多肽主要集中在分子质量<3 kDa的组分中[17-19]。因此,本研究利用NanoLC-Orbitrap-MS技术全面分析了曲霉(S-D)、毛霉(Y-G)和细菌型(S-B)3种发酵类型的豆豉超滤组分(<3 kDa)中的内源性水溶性多肽,在3类豆豉中共鉴定出多肽2 587种,其中毛霉型豆豉最多(1 392种),其次是根霉型豆豉(1 303种),细菌型豆豉相对多肽种类最少(208种)。
从图1-a可以看出,分子质量<3 kDa组分中3种豆豉水溶性提取物中多肽的长度主要集中在5~15个氨基酸之间。细菌型豆豉提取物中短肽(5~10个氨基酸)占比较高,而曲霉和毛霉型豆豉提取物中长肽(>15 个氨基酸)的比例显著增加。图1-b显示了3种提取物中肽的分子质量分布特征。结果表明,细菌型豆豉提取物中的肽分子质量主要分布在600~1 200 Da范围内,而曲霉和毛霉型豆豉提取物中高分子质量多肽(>1 500 Da)的比例明显高于细菌型豆豉。从图1-c中可以看出,3种豆豉中多肽氨基酸组成Pro(脯氨酸)占比最高,达到17%,其次是Gln(谷氨酰胺,8.5%)和Glu(谷氨酸,8.3%),Asp(天冬氨酸)、Gly(甘氨酸)和Val(缬氨酸)的比例也相对较高,而Trp(色氨酸)和Ala(丙氨酸)的比例较低。上述结果表明,不同类型豆豉肽提取物在肽段组成方面存在差异,包括长度分布、分子质量范围及氨基酸组成,同时也暗示了其潜在的功能特性和应用方向。这些数据为后续研究豆豉肽的功能评价及产品开发提供了重要依据。

a-不同氨基酸长度的多肽数量;b-多肽分子质量分布;c-多肽氨基酸组成分析
图1 三种豆豉水溶性多肽成分的统计分析
Fig.1 Statistical analysis of peptides from three types of Douchi
2.2 豆豉水溶性多肽分析
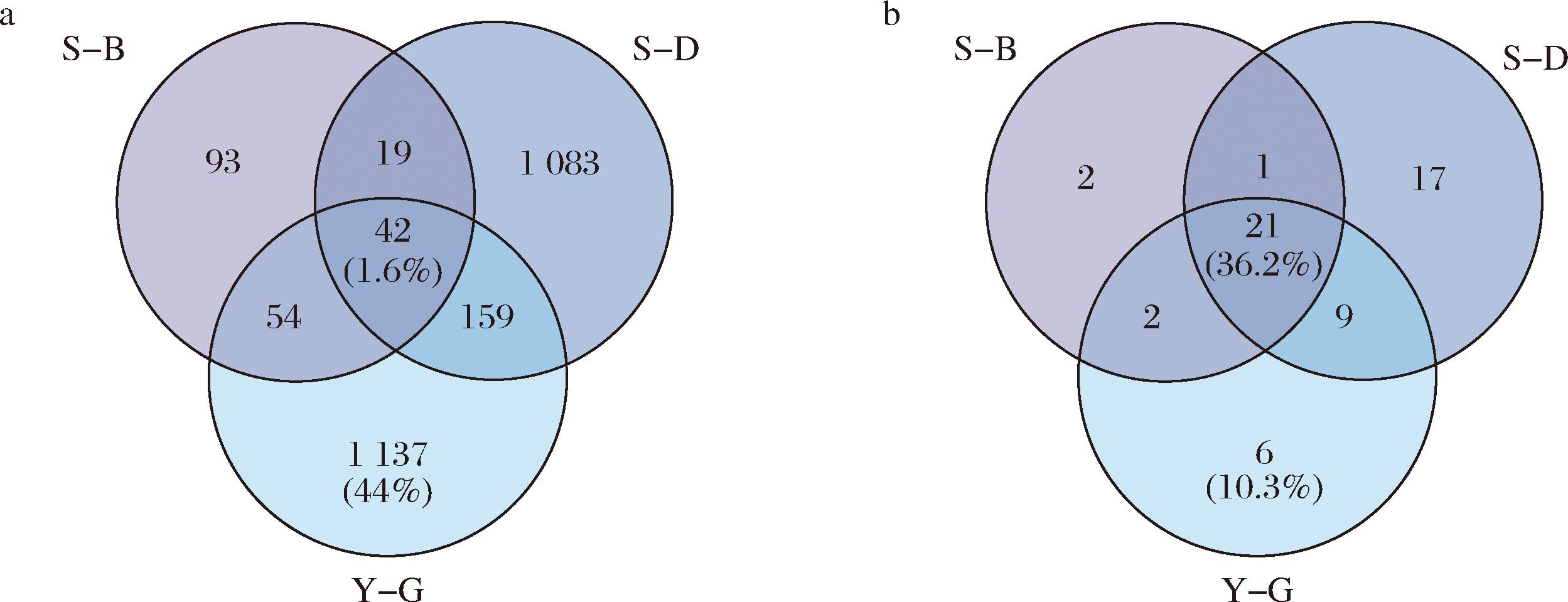
本研究进一步考察了3种发酵类型豆豉中水溶性多肽的分布差异和蛋白来源,图2-a和图2-b分别展示了3种发酵类型豆豉的多肽和前体蛋白信息Venn图。3种发酵类型豆豉共有42个水溶性多肽(占比1.6%),对应于21个前体蛋白(占比36.2%)(表1),表明这3种发酵类型豆豉的多肽成分差异显著,这些差异可能由不同发酵方式所引起。
表1 三种豆豉中42种共有的多肽及其蛋白来源
Table 1 42 kinds of common peptides and their protein sources in three types of Douchi

多肽序列分子质量/Da强度(S-B)强度(S-D)强度(Y-G)蛋白来源VVPPGHPF848.454 58.43×1089.84×1082.76×107Q04672|SBP_SOYBNIIDTNSL774.412 33.61×1083.56×1081.17×109P04405|GLYG2_SOYBN;P04776|GLYG1_SOYBNYEGNWGP821.334 42.10×1081.07×1092.92×108P02858|GLYG4_SOYBNGGVLIVPQ781.4698 1.91×1083.45×1081.72×107P04405|GLYG2_SOYBNLVIDGRGHL978.5611.75×1081.28×1071.07×107Q04672|SBP_SOYBNSVIKPPTDEQQQRPQ1 749.900 91.19×1081.46×1071.20×109P04776|GLYG1_SOYBNVPTGVAW728.385 71.17×1081.15×1078.12×107P04405|GLYG2_SOYBN;P04776|GLYG1_SOYBNVIKPPTDEQQQRPQ1 662.868 97.74×1076.58×1092.41×108P04776|GLYG1_SOYBNKFLVPPQESQK1 299.718 67.28×1073.22×1082.19×107P04776|GLYG1_SOYBNSVIKPPTDEQQ1 240.629 96.12×1072.67×1081.60×107P04776|GLYG1_SOYBNTWNPNNKPF1 116.535 36.02×1071.32×1082.71×107P04405|GLYG2_SOYBN;P04776|GLYG1_SOYBN;P11828SFLVPPQESQR1 286.661 95.74×1075.82×1085.21×107P04405|GLYG2_SOYBNSVIKPPTDE984.512 85.67×1074.22×1091.13×108P04776|GLYG1_SOYBNIKPPTDEQQQRPQ1 563.800 55.18×1071.71×1072.42×106P04776|GLYG1_SOYBNKTNDRPSIGNLAGAN1 526.785.14×1072.31×1082.46×107P04405|GLYG2_SOYBN;P11828|GLYG3_SOYBNHTNPTKPINL1 133.619 34.24×1071.18×1086.51×107Q8RVH5|7SBG2_SOYBNDEDEQPRPIPF1 341.620 14.00×1072.09×1083.67×108P0DO15|GLCA2_SOYBN;P0DO16|GLCA1_SOYBNGGSVLSGF722.359 93.77×1072.34×1087.49×108P02858|GLYG4_SOYBN;P04347|GLYG5_SOYBNKIGGIGTVPVGR1 152.697 93.62×1078.49×1071.05×107P25698|EF1A_SOYBNKYQGNSGPLVNP1 272.646 22.51×1071.92×1082.59×107P04347|GLYG5_SOYBNDEGEQPRPFP1 170.530 52.01×1071.12×1081.22×108P11827|GLCAP_SOYBNDEGEQPRPF1 073.477 81.62×1073.60×1071.01×108P11827|GLCAP_SOYBNVREDENNPF1 118.499 31.57×1071.29×1088.43×107F7 J077|GLCB2_SOYBN;P25974|GLCB1_SOYBNGGLSVISPK856.501 81.56×1075.03×1085.50×106P02858|GLYG4_SOYBN;P04347|GLYG5_SOYBNEEDEDEQPRPIPFPR1 852.859 11.54×1071.81×1084.85×107P0DO15|GLCA2_SOYBN;P0DO16|GLCA1_SOYBNTFRGIPN803.4291.36×1071.45×1084.65×107P08170|LOX1_SOYBN;P38417|LOX4_SOYBN;P09186GPVQLPY772.411 91.29×1073.37×1071.73×107P09439|LOX2_SOYBN;P08170|LOX1_SOYBN;P24095DEDEQPRPIP1 194.551 61.17×1078.49×1074.91×106P0DO15|GLCA2_SOYBN;P0DO16|GLCA1_SOYBNYVPRDENLGHL1 311.657 11.00×1077.68×1072.27×108P08170|LOX1_SOYBNSVIKPPTDEQQQ1 749.900 91.19×1081.46×1071.20×109P04776|GLYG1_SOYBN
续表1

多肽序列分子质量/Da强度(S-B)强度(S-D)强度(Y-G)蛋白来源LKVREDENNPF1 359.678 28.05×1062.82×1083.39×108F7 J077|GLCB2_SOYBN;P25974|GLCB1_SOYBNIRHFNEGDVL1 198.609 56.76×1063.18×1076.24×108P02858|GLYG4_SOYBN;P04347|GLYG5_SOYBNKVREDENNPF1 246.594 26.54×1065.27×1071.11×108F7 J077|GLCB2_SOYBN;P25974|GLCB1_SOYBNIKPPTDEQQQRP1 435.741 96.15×1069.02×1089.51×107P04776|GLYG1_SOYBNLPTDIIS757.422 15.86×1063.31×1081.55×107P09186|LOX3_SOYBNLPTDILS757.422 15.86×1063.31×1081.55×107P24095|LOXX_SOYBNHHTNPTKPINL1 270.678 25.54×1069.06×1085.69×107Q8RVH5|7SBG2_SOYBNEDEQPRPIP1 079.524 75.32×1064.99×1081.85×107P0DO15|GLCA2_SOYBN;P0DO16|GLCA1_SOYBNRNGLHLP805.455 95.02×1061.45×1081.12×107P02858|GLYG4_SOYBNLPRDEAFGH1 040.503 94.92×1064.53×1072.05×107P38417|LOX4_SOYBN;P09186|LOX3_SOYBNYVVNPDNDENLR1 446.6743.54×1065.24×1082.70×108P11827|GLCAP_SOYBNVIKPPTDEQQQRP1 534.810 32.36×1064.61×1091.83×107P04776|GLYG1_SOYBN
a-多肽;b-前体蛋白
图2 三种豆豉多肽分布的Venn图
Fig.2 Venn diagram of the distribution of three types of Douchi peptides
根据近年的研究,ACE抑制肽的氨基酸序列主要具有以下特征:一级氨基酸序列中大量存在疏水性氨基酸,而在C端,Pro、Leu等正电荷氨基酸残基的存在可以显著提升其ACE抑制能力;此外,当N端含有芳香族或碱性氨基酸时,肽的活性通常较高[20]。在这42个共有的水溶性多肽中,发现大多数肽段含有带有疏水性侧链的脂肪族氨基酸残基(占比90.4%)和芳香族氨基酸残基(占比50.0%),如表2所示。据报道,疏水氨基酸通过氢键和疏水相互作用与ACE的活性位点结合,对ACE的抑制活性有显著贡献[21]。研究进一步测定了42种共有多肽的ACE抑制活性,发现多肽VVPPGHPF的抑制活性最高,其IC50常数为(43.01±1.16) μmol/L。
表2 三种豆豉42种共有多肽中具有特定类型氨基酸的多肽数量及占比
Table 2 The number and proportion of peptides with specific types of amino acids among the 42 common peptides in three types of Douchi

氨基酸组成多肽数量多肽占比/%带有疏水性侧链的脂肪族氨基酸3890.4带有疏水性侧链的芳香族氨基酸2150.0带有中性侧链的氨基酸3890.4带有正电荷侧链的氨基酸3685.7带有负电荷侧链的氨基酸3685.7
2.3 多肽ACE抑制模型的确定
为了进一步阐明ACE抑制肽与ACE之间的相互作用机制,本研究选取了ACE抑制活性最高的多肽VVPPGHPF进行ACE抑制模型的测定,采用Lineweaver-Burk图法分析了VVPPGHPF的抑制动力学,使用了4种底物浓度(0.325、0.75、1.5和3 mmol/L HHL)和3种VVPPGHPF浓度(0、0.5和1 mg/mL)。根据图3所示的结果,3条直线在y轴(1/V)上交于一点,表明VVPPGHPF是ACE的竞争性抑制剂;VVPPGHPF可以与ACE的催化位点的关键残基竞争结合,从而形成ACE-VVPPGHPF复合物,并随后降低ACE与HHL之间的亲和力。近年来,人们已经鉴定出多种竞争性ACE抑制肽,包括来自软体动物的Trp-Pro-Met-Gly-Phe[22]、来自隐翅豆种子的Phe-His-Ala-Pro-Trp-Lys[23]以及来自牛酪蛋白的Tyr-Gln-Lys[24]。此外,有报道表明,肽的竞争抑制与肽的C末端和N末端存在疏水性氨基酸有关[25]。
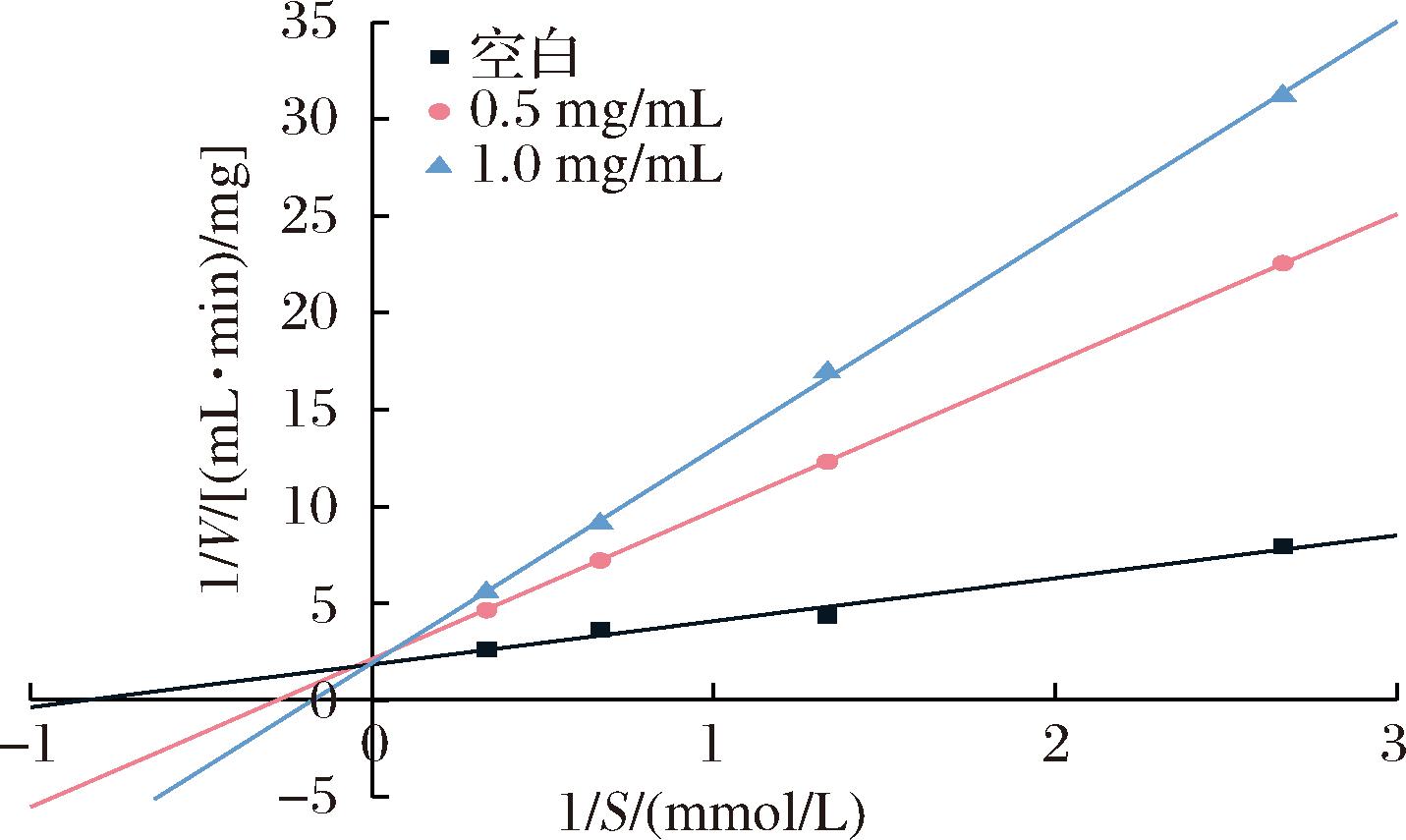
图3 VVPPGHPF抑制模型的Lineweaver-Burk图
Fig.3 Lineweaver-Burk plots for the ACE inhibition pattern of VVPPGHPF
2.4 基于分子对接的ACE抑制肽机制
研究ACE与ACE抑制肽的配体-受体互作机制为未来特定性开发和合成ACE抑制肽提供了重要的参考。为了阐明ACE与VVPPGHPF之间的分子相互作用,本研究采用分子对接工具AutoDock 4.2进行了柔性分子对接模拟[25]。VVPPGHPF在ACE活性位点内的最稳定结合构象表现出-6.72 kcal/mol的结合亲和力。如图4所示,VVPPGHPF与ACE的结合主要通过与残基Arg522、Glu403、Glu384、Ser355、Tyr360和Ala354形成6个氢键实现,氢键的距离范围为2.0~3.0 Å。此外,ACE的主要活性位点包括3个活性口袋(S1、S2和S1′)以及1个Zn2+。S1口袋包含残基Ala354、Glu384和Tyr523,而S2口袋则由Gln281、His353、Lys511、His513和Tyr520组成;S1′口袋仅由Glu162构成。如图4所示,Glu384侧链羧酸基团中的氧原子作为氢键受体,可能与多肽VVPPGHPF中Pro的氨基氢形成氢键。Ala354侧链羧酸基团中的氧原子作为氢键受体,可能与多肽VVPPGHPF中Phe侧链的氨基氢形成氢键。从空间结构上看,这些氢键的形成依赖于多肽构象与ACE活性位点的互补性,即多肽的疏水性残基(如Val、Pro、Phe)可能通过范德华力与S1口袋的疏水区域紧密结合,同时极性残基通过氢键锚定在Glu384和Ala354附近,形成稳定的相互作用网络。这些分子模拟为VVPPGHPF与人源ACE之间的相互作用提供了证据,这将为未来研究针对人源ACE的肽类抑制机制提供有价值的信息。
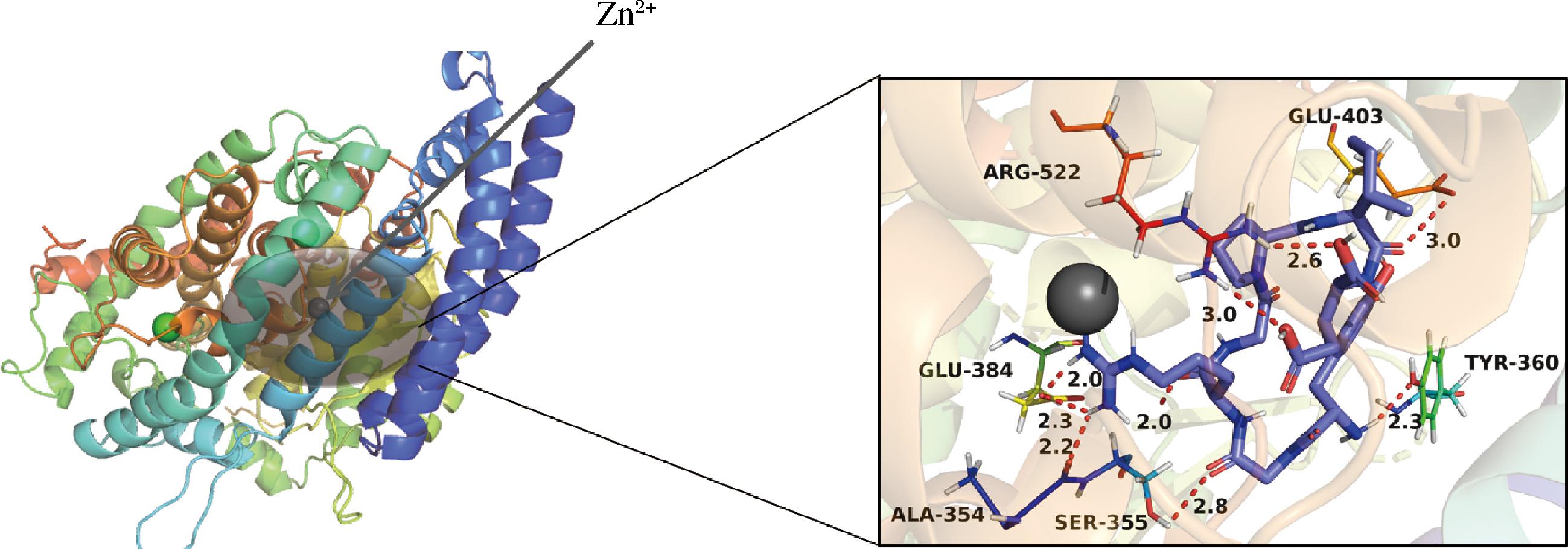
图4 VVPPGHPF的分子对接模拟图
Fig.4 Docking simulation of VVPPGHPF binding to ACE
3 结论
本研究从中国市面上常见的3种不同发酵类型豆豉(曲霉型、毛霉型和细菌型)中鉴定出2 587种水溶性多肽,其中毛霉型豆豉含有最多的多肽种类(1 392种),其次是曲霉型豆豉(1 303种),细菌型豆豉相对较少(208种)。这些多肽在长度分布、分子质量范围及氨基酸组成上均表现出显著差异。3种发酵类型豆豉中共有42个水溶性多肽,对应于21个前体蛋白,大多数含有疏水性氨基酸和芳香族氨基酸残基,ACE抑制活性分析表明多肽VVPPGHPF具有最强的抑制活性,其IC50常数为(43.01±1.16) μmol/L。采用Lineweaver-Burk图法分析了其抑制动力学,结果表明VVPPGHPF可能协同参与了ACE活性位点的竞争性抑制。此外,通过分子对接模拟进一步阐明了VVPPGHPF与ACE之间的分子相互作用,发现VVPPGHPF可能与ACE的S1口袋产生了氢键作用力,表现出-6.72 kcal/mol的结合亲和力。本研究成功鉴定出豆豉中具有ACE抑制活性的多肽成分,并探究了其与ACE的相互作用机制,为鉴定豆豉的健康价值提供了理论依据,也为未来开发针对高血压等心血管疾病的功能性食品提供了新思路。
[1] JIANG L W, CHEN Y, ZHAO T T, et al.Analysis of differential metabolites in Liuyang Douchi at different fermentation stages based on untargeted metabolomics approach[J].Food Chemistry:X, 2025, 25:102097.
[2] 谢艳华, 谢靓, 李跑, 等.GC-MS分析毛霉型、细菌型、曲霉型豆豉中脂肪酸组成[J].中国油脂, 2017, 42(7):115-119;123.XIE Y H, XIE L, LI, P, et al.GC-MS analysis of fatty acid composition in mucor-type, bacterial-type and aspergillus -type douchi[J].China Oils and Fats, 2017, 42(7):115-119;123.
[3] CHATTERJEE C, GLEDDIE S, XIAO C W.Soybean bioactive peptides and their functional properties[J].Nutrients, 2018, 10(9):1211.
[4] LI T N, ZHANG X R, REN Y Y, et al.Antihypertensive effect of soybean bioactive peptides:A review[J].Current Opinion in Pharmacology, 2022, 62:74-81.
[5] 周伊恒, 吕垚, 杨梓钰, 等.英国和爱尔兰高血压学会《成人高血压转诊路径及治疗管理》共识声明解读[J].中国全科医学, 2025, 28(10):1173-1178.ZHOU Y H, LYU Y, YANG X Y, et al.Interpretation of the consensus statement of the British and Irish hypertension societies on adult hypertension referral pathway and therapeutic management[J].Chinese General Practice, 2025, 28(10):1173-1178.
[6] 马丽媛, 王增武, 樊静, 等.《中国心血管健康与疾病报告2022》要点解读[J].中国全科医学, 2023, 26(32):3975-3994.MA L Y, WANG Z W, FAN J, et al.Interpretation of report on cardiovascular health and diseases in China 2022[J].Chinese General Practice, 2023, 26(32):3975-3994.
[7] WEI G M, ZHAO F R, ZHANG Z Y, et al.Identification and characterization of umami-ACE inhibitory peptides from traditional fermented soybean curds[J].Food Chemistry, 2025, 465(Pt 2):142160.
[8] SANDHU R, MANN B, SHARMA R, et al.Identification and molecular docking of ACE inhibitory peptides derived from sodium substituted cheddar cheese[J].International Journal of Peptide Research and Therapeutics, 2024, 30(6):59.
[9] CHANAJON P, HAMZEH A, TIAN F, et al.Hypotensive effect of potent angiotensin-I-converting enzyme inhibitory peptides from corn gluten meal hydrolysate:Gastrointestinal digestion and transepithelial transportation modifications[J].Food Chemistry, 2025, 462:140953.
[10] HUANG X C, GAO T T, CHEN X, et al.Taste characteristics of salty peptides from Porphyra haitanensis and the synergistic saltiness enhancement with CaCl2[J].Food Chemistry, 2024, 461:140901.
[11] ZHANG Y Y, MA S J, LI H X, et al.Preparation, separation, and identification of antioxidant peptides from protein hydrolysate of Polygonatum cyrtonema Hua[J].Food Bioscience, 2024, 62:105351.
[12] MAO S Y, JIN W, FU S S, et al.Strategies for mapping protein hydrolysate profiles and pharmacokinetics based on non-targeted proteomics combining skyline-aided quantitative techniques[J].Analytica Chimica Acta, 2023, 1265:341272.
[13] DEKKER P M, BOEREN S, SACCENTI E, et al.Network analysis of the proteome and peptidome sheds light on human milk as a biological system[J].Scientific Reports, 2024, 14:7569.
[14] YANG X K, BAI H C, YIN L J, et al.Evaluation of allergenic protein profiles in three Chinese high-oleic acid peanut cultivars using NanoLC-Orbitrap mass spectrometry[J].Food Science and Human Wellness, 2023, 12(3):851-860.
[15] WEI D, FAN W L, XU Y.In vitro production and identification of angiotensin converting enzyme (ACE) inhibitory peptides derived from distilled spent grain prolamin isolate[J].Foods, 2019, 8(9):390.
[16] LAN X D, SUN L X, MUHAMMAD Y, et al.Studies on the interaction between angiotensin-converting enzyme (ACE) and ACE inhibitory peptide from Saurida elongata[J].Journal of Agricultural and Food Chemistry, 2018, 66(51):13414-13422.
[17] 张璐, 甘雨嫣, 钟玉旺, 等.青刺果ACE抑制肽的分离纯化、结构鉴定及其体外活性评价[J].中国食品学报, 2024, 24(7):321-331.ZHANG L, GAN Y Y, ZHONG Y W, et al.Isolation, identification, structure characterization and in vitro activity evaluation of ACE Inhibitory peptides from Prinsepia utilis[J].Journal of Chinese Institute of Food Science and Technology, 2024, 24(7):321-331.
[18] 刘华宇, 廖彭莹, 张天丰, 等.鳖蛋黄血管紧张素转化酶抑制肽分离纯化及活性分析[J].食品科学, 2025, 46(1):40-48.LIU H Y, LIAO P Y, ZHANG T F, et al.Separation, purification, and activity analysis of angiotensin converting enzyme inhibitory peptides in enzymatically hydrolyzed egg yolk of Chinese soft-shelled turtle[J].Food Science, 2025, 46(1):40-48.
[19] LI M Y, FAN W L, XU Y.Identification of angiotensin converting enzyme (ACE) inhibitory and antioxidant peptides derived from Pixian broad bean paste[J].LWT, 2021, 151:112221.
[20] XIANG L, QIU Z C, ZHAO R J, et al.Advancement and prospects of production, transport, functional activity and structure-activity relationship of food-derived angiotensin converting enzyme (ACE) inhibitory peptides[J].Critical Reviews in Food Science and Nutrition, 2023, 63(10):1437-1463.
[21] WANG X M, CHEN H X, FU X G, et al.A novel antioxidant and ACE inhibitory peptide from rice bran protein:Biochemical characterization and molecular docking study[J].LWT, 2017, 75:93-99.
[22] YU F M, ZHANG Z W, LUO L W, et al.Identification and molecular docking study of a novel angiotensin-I converting enzyme inhibitory peptide derived from enzymatic hydrolysates of Cyclina sinensis[J].Marine Drugs, 2018, 16(11):411.
[23] SHIH Y H, CHEN F A, WANG L F, et al.Discovery and study of novel antihypertensive peptides derived from Cassia obtusifolia seeds[J].Journal of Agricultural and Food Chemistry, 2019, 67(28):7810-7820.
[24] XUE L, WANG X D, HU Z H, et al.Identification and characterization of an angiotensin-converting enzyme inhibitory peptide derived from bovine casein[J].Peptides, 2018, 99:161-168.
[25] 张迎阳, 董亚云, 邹平, 等.橄榄仁抗氧化肽的分离鉴定及分子对接[J].食品与发酵工业, 2024, 50(5):189-198.ZHANG Y Y, DONG Y Y, ZOU P, et al.Isolation, identification and molecular docking of antioxidant peptides from olive kernel[J].Food and Fermentation Industries, 2024, 50(5):189-198.