葡萄果实的成分和含量构成了葡萄酒品质的物质基础,同时进一步影响着葡萄酒的质量。研究表明,除了品种、栽培和气象等因素外,采收时间对葡萄果实品质也有影响。在其他条件相同的情况下,及时采收成熟度适宜的葡萄果实是确保葡萄酒高品质的关键[1]。因此,研究最佳采收时间以及在此期间内的物质变化,对于控制酿酒葡萄和葡萄酒的质量至关重要[2]。
一般来说,葡萄的成熟过程是一个动态的演进过程,涵盖了从果实发育初期到浆果完全成熟的多个复杂变化阶段。这些变化使葡萄达到最佳品质,适于食用或酿造加工。在实际操作中,通常利用测量基本理化参数(如糖度、总酸、pH值和颜色强度等)来评估葡萄的成熟程度[3]。然而,酿制优质葡萄酒所需的良好原料不仅包括充足的糖分和适当的酸度,还包括葡萄的其他成分。因此,全面了解和掌握葡萄成熟时的各项指标对于评估葡萄原料的品质、判断采收时机以及预测葡萄酒的质量已成为葡萄酒研究领域的热点。
代谢组学作为现代组学研究的重要领域之一,通过高通量分析,能够全面揭示样品中的代谢物变化。近年来,代谢组学技术在植物科学研究中得到了广泛应用,并成为果蔬研究中评估其生长、发育及其品质的重要工具[4]。与传统的理化分析方法相比,代谢组学能够更全面地反映果实在成熟过程中的代谢变化,为确定最佳采收期提供更精准的数据支持。例如,DEGU等[5]采用液相色谱-质谱联用技术,详细分析了赤霞珠(Cabernet Sauvignon)和西拉(Shiraz)葡萄从转色期到采收期的代谢产物,发现两者在初级代谢物变化上有相似的趋势。ALI等[6]使用核磁共振技术的代谢组学方法,对比研究了多瑞加(Touriga Nacional)和阿尔瓦里奥(Alvarinho)品种代谢产物的异同。结合代谢组学和蛋白质组学的方法,也能研究葡萄果实中代谢物质积累的机制。此外,除了作为系统性比较不同葡萄品种代谢产物的重要工具外,代谢组学技术还常用于葡萄品种区分,以及外界环境条件对葡萄生长发育影响等方面。因此,基于代谢组学技术在葡萄及葡萄酒研究领域中的应用,将有助于全面理解葡萄果实中代谢物的变化情况,并为确定葡萄的最佳采收时间提供科学依据。
本研究以甘肃河西走廊张掖市临泽县的赤霞珠葡萄为研究对象,从花后83 d(接近成熟期)开始,持续至花后101 d进行连续采样。通过测定样品的理化指标、多酚含量及代谢组学分析,综合评估葡萄的成熟度变化,深入探讨代谢物变化规律及其潜在因素,并借助代谢组学分析为采收期的确定提供了额外的信息,帮助进一步确认最佳采收期,从而为该地区赤霞珠葡萄采收时间的科学判断提供了数据支持和理论依据。
1 材料与方法
1.1 材料与试剂
赤霞珠葡萄来自甘肃省张掖市临泽县板桥镇(东经100°19′49″,北纬39°15′22″)的甘肃张掖国风葡萄酒业有限责任公司种植基地。采样时间分别是花后83~101 d阶段每3 d取样1次。葡萄样品的采集遵循随机均匀采样的原则,选择8行取样行,在每行的阴阳两面随机选取葡萄串样品,分别在葡萄串阴阳两面的上、中、下3部位选取具有代表性的葡萄果粒,取样后立即装入保鲜袋,并于阴凉地放置,样品于当天运至实验室,用液氮速冻后保存备用。
甲醇、乙腈(色谱纯),Merck公司;甲酸(色谱纯),Aladdin公司;盐酸、甲醇、Na2CO3、没食子酸、醋酸、醋酸钠、KCl、儿茶素和单宁酸(分析纯),天津市光复科技发展有限公司;福林-肖卡(分析纯),厦门海标科技有限公司;芦丁、对二甲基氨基肉桂醛、福林-丹尼斯等(分析纯),上海源叶生物科技有限公司;斐林试剂和次甲基蓝指示剂的配制遵循了GB/T 603—2023《化学试剂 试验方法中所用制剂及制品的制备》规定。
1.2 仪器与设备
ExionLCTMAD超高效液相色谱仪,美国SCIEX公司;Applied Biosystems 4500 QTRAP三重四极杆质谱仪,美国赛默飞世尔科技公司;3-18K高速冷冻离心机,德国Sigma公司;FA2004B电子天平,上海佑科仪器仪表有限公司;SB-C18色谱柱(2.1 mm×100 mm,1.8 μm),美国安捷伦公司;MM400研磨仪,德国Retsch公司;T9CS双光束紫外-可见分光光度计,北京普析通用仪器有限责任公司;pH计,上海仪电科学仪器股份有限公司。
1.3 实验方法
1.3.1 葡萄基本理化指标的测定
百粒重等基本理化指标的测定参照郭淑萍等[7]的方法;可滴定酸含量(以酒石酸计)的测定用NaOH滴定法[8];还原糖的测定参照辛秀兰等[9]的方法;pH的测定采用pH计;百粒重采用称重法;总可溶性固形物采用手持折光仪测定。
1.3.2 酚类物质测定
总酚、总花色苷、总单宁、总黄烷醇、总类黄酮分别采用福林-肖卡法[10]、pH示差法、福林-丹尼斯法[11]、p-DMACA法[12]、NaNO2-AlCl3比色法[12]测定。
1.3.3 基于广泛靶向的代谢组学方法测定
样品的制备:使用研磨仪将真空冷冻干燥后的样品研磨至粉末状(30 Hz,1.5 min)。称取50 mg粉末,溶解于1.0 mL 70%(体积分数)甲醇提取液中,在4 ℃下浸提过夜,每30 min涡旋1次,每次持续30 s,以提高提取效率。提取液经离心(12 000 r/min,3 min)后,吸取上清液,用0.22 μm微孔滤膜过滤,并保存于进样瓶中,用于超高效液相色谱-电喷雾离子化-三重四极杆质谱联用仪(ultra performance liquid chromatography-electrospray ionization-triple quadrupole quadrupole mass spectrometry,UPLC-ESI-QQQ)分析。
UPLC-ESI-QQQ色谱分析条件:使用Agilent SB-C18液相色谱柱(1.8 μm,2.1 mm×100 mm)进行目标化合物的分离;流动相由0.1%体积分数甲酸水溶液(A相)和0.1%体积分数甲酸乙腈溶液(B相)构成。通过梯度洗脱法对样品进行测定[13],初始比例设置为95% A相与5% B相;在9 min内,梯度线性调整至5% A相与95% B相,并在此比例下维持1 min;之后在1 min内迅速回调至95% A相与5% B相,并在此条件下维持2.9 min。流速0.35 mL/min,柱温控制在40 ℃,注射体积4 μL。
UPLC-ESI-QQQ质谱条件:采用电喷雾离子源,温度设为550 ℃,离子喷雾电压在正离子模式下为5 500 V,负离子模式下为-4 500 V。离子源气体Ⅰ(GSⅠ)、气体Ⅱ(GSⅡ)和气帘气(CUR)的压力分别为50、60和25 psi,碰撞诱导解离(collision-activated dissociation,CAD)参数设置为高。在三重四极杆质谱中,每个离子对通过优化的去簇电压(declustering potential,DP)和碰撞能量(collision energy,CE)进行扫描检测。
1.4 数据处理
以上所有实验均设置3个重复,数据处理采用Microsoft Office Excel 2016,使用IBM SPSS Statistics 26进行方差分析,并通过Duncan’s多重比较法在0.05的置信水平下分析数据的显著性差异。图形通过Origin 2021软件进行绘制。
2 结果与分析
2.1 赤霞珠葡萄果实发育过程中基本理化指标和酚类物质含量变化
2.1.1 赤霞珠葡萄果实基本理化指标的变化
为了研究采收时间对赤霞珠葡萄的影响,本研究在花后83~101 d(2023年8月至10月)进行了连续采样。如图1所示,尽管果实的结构特征变化较小,但其化学成分发生了显著变化。尤其是可溶性固形物和还原糖含量自花后83 d开始逐步积累,且在花后91 d时出现明显的增加(可溶性固形物从23.71°Brix增至26.70°Brix,还原糖从237.37 g/L增至273.27 g/L,P<0.05,图1-a)。与此相对,随着葡萄逐渐成熟,可滴定酸含量从花后83 d起逐步下降(由6.57 g/L降至3.97 g/L,P<0.05),同时pH值从3.75升高至4.55(P<0.05,图1-b),表明葡萄在成熟过程中酸度的减少与糖分积累的同步变化。这些理化指标的变化与果实的百粒重呈现出直接关系。图1-c显示,从花后83~96 d,百粒重从118.33 g增加至130.00 g,增加幅度接近10%(P<0.05),反映了葡萄果实在成熟过程中水分和可溶性固形物的积累,进一步支持了前述的糖分增加变化。此外,细胞成熟度指数(cell maturity index,CMI)作为衡量葡萄成熟度的重要指标,也在不同花后时间表现出变化。通常来说,CMI值反映了在不同酸性条件下花色苷的提取能力,值越小说明葡萄成熟度越高。如图1-d所示,CMI值在花后83~93 d期间呈逐渐下降趋势,从0.26降至0.15,显示出葡萄在此阶段成熟度较高。然后,CMI值在93 d后开始回升,至101 d时增至0.29,这可能与葡萄过熟过程中果皮硬度变化有关,导致花色苷的提取率发生变化[14]。
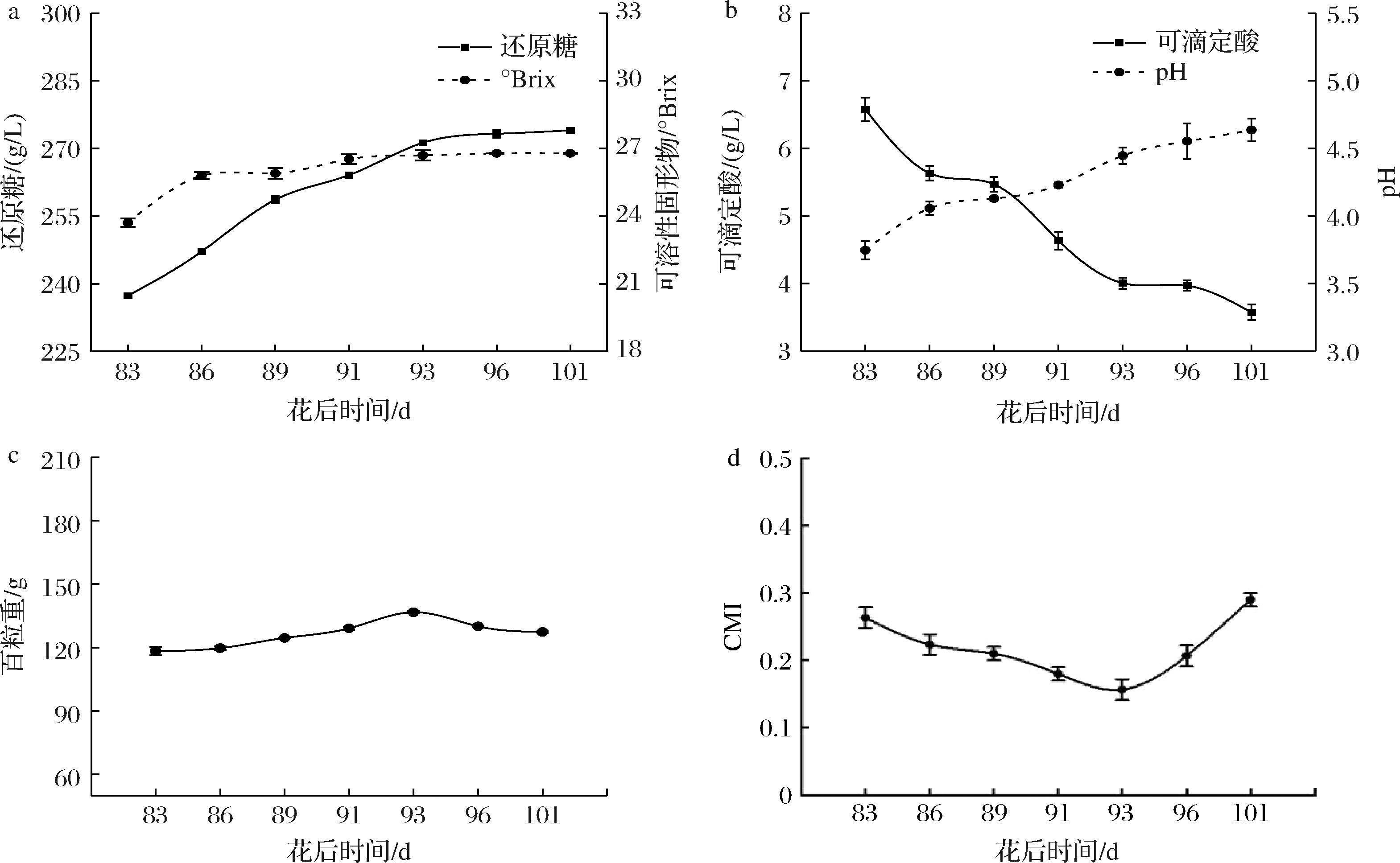
a-还原糖和可溶性固形物;b-可滴定酸和pH;c-百粒重;d-CMI
图1 不同花后时间基本理化指标
Fig.1 Basic physicochemical indexes at different post-flowering time
一般而言,葡萄的采收时间主要依据其理论成熟度来决定(主要通过测量葡萄的含糖量和含酸量计算糖酸比来判断)。根据这些指标,初步推测花后86~96 d为当地赤霞珠葡萄可能的采收时间。然而,这种评估方法主要关注葡萄的糖酸平衡,却忽视了酚类物质和其他关键成分的含量。因此,为了进一步确定葡萄的采收期,对样品果实的酚类物质进行了分析。
2.1.2 赤霞珠葡萄果实酚类物质含量的变化
酚类物质是葡萄中重要的次生代谢产物,其含量变化直接影响葡萄酒的口感、色泽及抗氧化性能。如图2-a所示,赤霞珠葡萄果皮的总酚含量在花后83~93 d期间逐渐增加,从34.51 mg/g上升至41.84 mg/g(P<0.05),并在花后93 d达到最高值(41.84 mg/g,P<0.05)。此后,总酚含量开始下降,到花后101 d时降至34.76 mg/g(P<0.05)。除总酚外,单宁、花色苷和黄酮等其他酚类物质也对葡萄的品质起着重要作用。如图2-b所示,果皮中的总单宁含量自花后83 d开始逐渐上升,并在花后89~93 d期间达到最大值(10.47~10.72 mg/g),随后开始下降,至花后101 d时降至9.60 mg/g。图2-c显示,果皮中的总类黄酮含量在花后93 d达到峰值(25.05 mg/g),之后逐步下降,到花后101 d降至24.35 mg/g(P<0.05)。同时,图2-d展示了皮总黄烷醇含量的变化趋势,在花后93 d时含量最高(3.45 mg/g),随后逐渐下降,到花后101 d降至3.18 mg/g。总花色苷的含量也表现出一定的变化趋势。从花后83 d开始,总花色苷含量逐渐增加,达到花后96 d的最高值(8.63 mg/g),随后略有下降,到花后101 d时降至7.86 mg/g(图2-e)。
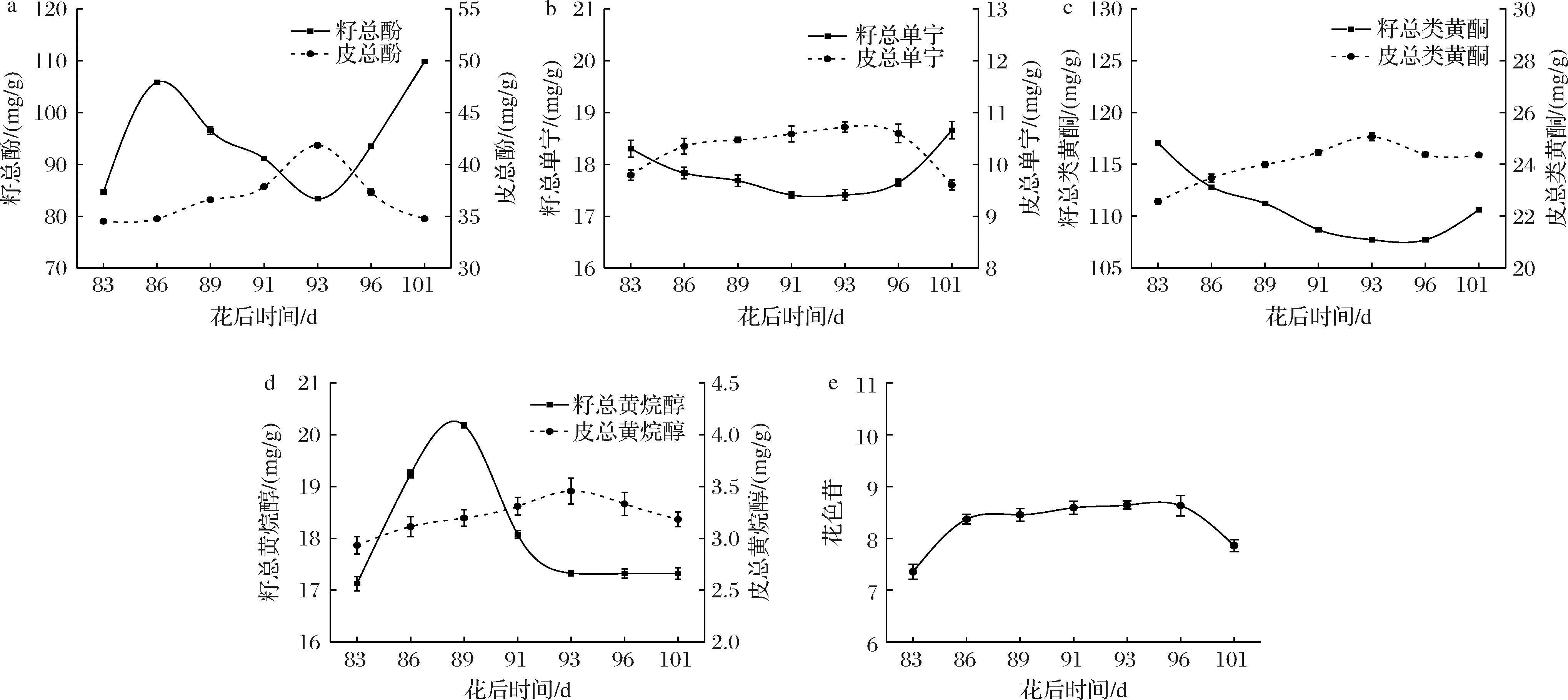
a-皮总酚和籽总酚;b-皮单宁和籽单宁;c-皮总类黄酮和籽总类黄酮;d-皮总黄烷醇和籽总黄烷醇;e-花色苷
图2 不同花后时间的多酚含量
Fig.2 Polyphenol content at different post-flowering time
由图2-a可知,果籽中的总酚含量呈持续下降趋势,从花后86 d开始逐渐下降,直至花后93 d达到最低值(85.35 mg/g),然后开始上升,至花后101 d达到109.85 mg/g(P<0.05)。此外,籽中的总类黄酮含量在花后83 d达到最大值(117.04 mg/g),然后开始下降,在花后86~93 d期间保持在112.80~107.71 mg/g(图2-c)。籽中的总黄烷醇含量在花后91 d开始缓慢下降,保持在18.08~17.32 mg/g,变化趋势相对平稳,未出现明显波动(P<0.05)(图2-d)。
综合分析赤霞珠葡萄果实在花后83~101 d期间的理化和酚类指标变化,发现花后91~96 d期间,葡萄的酚类物质含量普遍较高,且这些指标在这一阶段变化较为显著。因此,基于这些指标的变化,初步建议花后91~96 d可作为当地赤霞珠葡萄的最佳采收期。同时,为了深入了解该时间段内果实化学成分的变化,本研究进一步采用UPLC-ESI-QQQ技术对花后91~96 d的葡萄样品进行广泛靶向代谢组学分析,研究其成分积累与变化情况。
2.2 基于UPLC-ESI-QQQ技术对采收期赤霞珠葡萄的广泛靶向代谢组学分析
2.2.1 样品质控分析
为确保样品分析的质量和可靠性,本研究首先对所有样本进行了质控分析,图3-a和图3-b展示了正离子模式和负离子模式的总离子流图。质控分析结果表明,代谢产物的总离子流具有较高的曲线重叠度,说明质谱信号稳定,检测过程中的波动较小。同时,色谱峰的基线稳定,且各色谱峰得到有效分离,表明分析条件能够保证数据的重复性和可靠性。
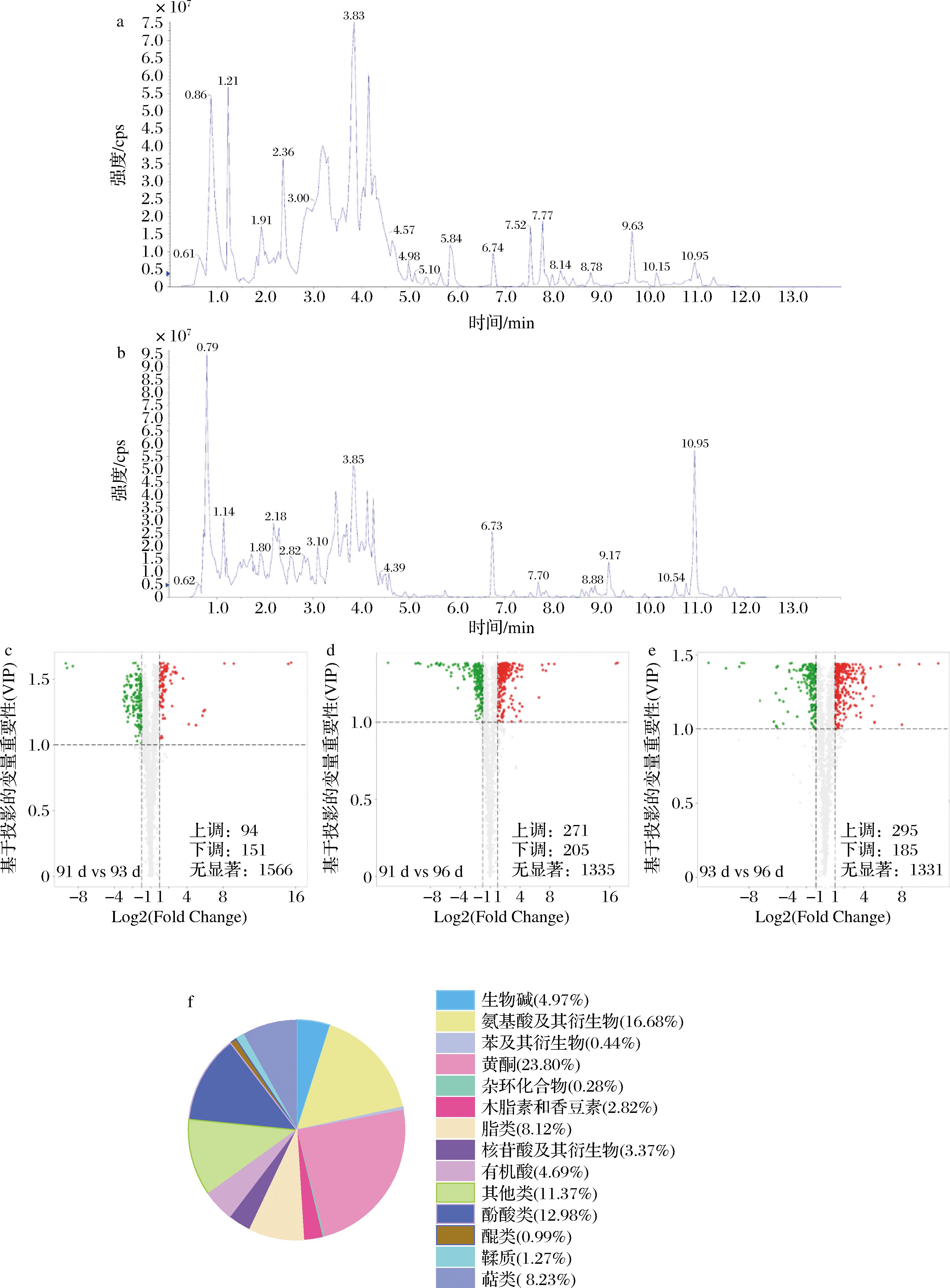
a-正离子流图;b-负离子流图;c-91 d vs 93 d火山图;d-91 d vs 96 d火山图;e-93 d vs 96 d火山图;f-代谢物分类图
图3 样本检测总离子流图、火山图和代谢物分类
Fig.3 Total ion chromatograms of sample detections,volcano plots, and classification of metabolites
2.2.2 代谢成分分析和差异代谢物的筛选
在UPLC-ESI-QQQ平台的检测条件下,结合公共代谢物数据库和多元统计分析方法,对花后91、93、96 d的赤霞珠葡萄样品进行了代谢物分析,检测到11类共1 811种主要代谢产物,分别为:黄酮类(431种)、氨基酸及其衍生物类(302种)、酚酸类(235种)、萜类(149种)、脂质类(147种)、有机酸类(85种)、生物碱类(71种)、核苷酸及其衍生物类(61种)、木脂素和香豆素类(51种)、鞣质类(23种)以及其他类代谢物(45种)。其中,黄酮类、氨基酸及其衍生物类和酚酸类的化合物数量占比较高,分别是代谢物总体的23.80%、16.68%、12.98%(图3-f)。这些代谢物覆盖了葡萄成熟过程中多个重要的代谢途径,为后续的差异代谢物筛选提供了数据支持。
为了探讨葡萄样品中代谢物花后91~96 d的变化,比较分析了采样时间点(花后91 d与93 d,花后91 d与96 d,花后93 d与96 d)葡萄样品代谢物的相对含量。通过筛选VIP值≥1且P<0.05的代谢物,进一步分析了这些代谢物的变化倍数,筛选出了显著差异的代谢物,并借助火山图(图3-c~3-e)展示了这些代谢物在3个采样时间点之间的表达水平及其统计学差异。具体来说,3个时间段之间的差异代谢物数量分别为:花后91 d与93 d之间有245个差异代谢物,花后91 d与96 d之间有476个差异代谢物,而花后93 d与96 d之间则有480个差异代谢物。通过log2FC排序分析,筛选出了变化倍数最大的前20个代谢物,其中包括上调和下调的代谢物。例如,在“花后91 d与93 d”的比较中,上调的前10种代谢产物包括6种黄酮、1种酚酸、2种醌、1种氨基酸及其衍生物以及1种其他类物质;下调的代谢物则包括5种黄酮、2种氨基酸及其衍生物和2种酚酸。在“花后91 d与96 d”的结果中,上调的差异代谢产物包括2种黄酮、1种醌、2种氨基酸及其衍生物和2种其他类化合物;下调的差异代谢物包括5种黄酮,6种酚酸,1种氨基酸及其衍生物和1种其他类化合物。在“花后93 d与96 d”比较中,上调的差异代谢产物包括1种黄酮、2种酚酸、1种氨基酸及其衍生物、3种其他类和1种萜类;下调的差异代谢产物包括5种酚酸、3种黄酮、2种氨基酸及其衍生物、1种醌和1种其他类。
上述结果表明,差异物质主要集中于黄酮类、氨基酸及其衍生物和酚酸类等物质。尽管花后91~96 d的时间间隔有限,但数据显示,在这几天内,非挥发性代谢产物的含量和种类却发生了显著变化。因此,还需进一步对这些变化进行深入分析。
2.2.3 不同采收期赤霞珠葡萄差异代谢物的动态变化
2.2.3.1 酚类物质
酚类物质在葡萄果实的色泽和风味形成中起着关键作用,尤其对红葡萄酒的品质具有重要影响。在“花后91 d与93 d”、“花后91 d与96 d”和“花后93 d与96 d”的比较分析中,黄酮类物质的变化表现显著,分别检测到89种、155种、135种黄酮类物质,占所有差异代谢物的52.24%、45.16%、45.53%。这些数据表明,黄酮类物质在不同成熟阶段的变化尤为突出,可能与葡萄果实的成熟度和风味形成密切相关。
黄烷-3-醇类物质是葡萄中主要的多酚化合物,广泛存在于果皮、果肉和种子中,是葡萄酒苦涩味的主要来源,同时显著影响葡萄的颜色(作为辅色因子)[15]及其他风味特性。不同品种的葡萄在成熟过程中黄烷-3-醇的积累模式有所不同。因此,了解特定产地葡萄品种在成熟阶段黄烷-3-醇的变化趋势,尤其是在采收时的含量变化,对于提升葡萄品质及后期酿酒过程至关重要。根据代谢物变化,筛选出了在花后91~96 d期间差异显著的3种黄烷-3-醇代谢物,分别是儿茶素(图4-a)、表儿茶素(图4-b)和没食子儿茶素(图4-c)。结果显示,儿茶素的含量从花后91 d的9.69×106(峰面积)下降至花后93 d的3.1×106,随后急剧下降至花后96 d的3.51×105(P<0.05)。这可能与葡萄果实的成熟度和果皮硬度的变化有关,导致酚类物质的释放和积累发生显著波动。表儿茶素的变化趋势与儿茶素类似,从花后91 d的1.29×106下降至花后96 d的5.42×105,降幅为32.07%(P<0.05)。没食子儿茶素也显示出相似的下降趋势,从花后91 d的6.16×105降至花后96 d的1.48×105,降幅为24.26%(P<0.05)。这些反映了葡萄在成熟过程中酚类物质的动态变化,特别是黄烷-3-醇类物质在成熟后的快速下降。黄烷-3-醇类化合物是葡萄酒中重要的类黄酮化合物,为葡萄酒提供苦味和收敛性。研究发现,葡萄成熟度的差异会影响其果实中黄烷-3-醇含量进入葡萄酒的变化。在果实成熟后期,黄烷-3-醇中的单体物质通过聚合作用形成聚合物,从而导致葡萄果实中进入葡萄酒的黄烷-3-醇含量减少[16]。
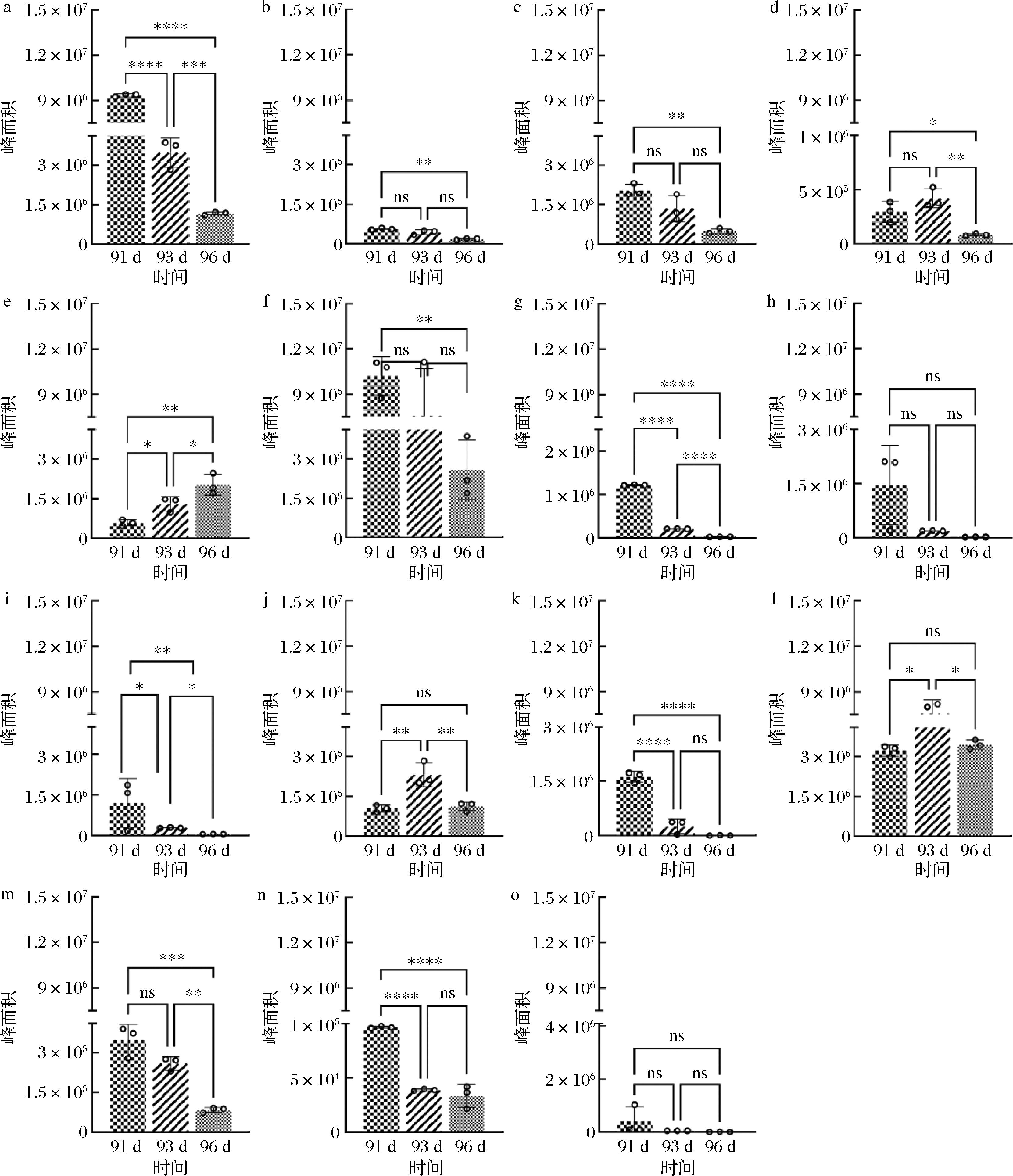
a-儿茶素;b-表儿茶素;c-没食子儿茶素;d-二甲花翠素-3-O-葡萄糖苷;e-花青素-3-O-(6″-O-咖啡酰)-葡萄糖苷;f-甲基花青素-3-O-(6″-O-咖啡酰)-葡萄糖苷;g-山奈酚-3-O-葡萄糖苷;h-山奈酚-3-O-半乳糖苷;i-异鼠李素-3-O-葡萄糖苷;j-原儿茶酸;k-绿原酸;l-L-色氨酸;m- L-精氨酸;n-L-亮氨酸;o-还原型谷胱甘肽
图4 不同花后时间差异代谢物含量
Fig.4 Differential metabolite content at different post-flowering time
注:*表示结果在统计学上差异显著(P<0.05);**表示差异非常显著(P<0.01);***表示差异极其显著(P<0.001);****表示差异高度显著(P<0.000 1);ns表示无显著性差异。
花色苷作为葡萄果实黄酮类物质的关键成分,对葡萄和葡萄酒的色泽有显著影响。在花后91、93、96 d的样品中筛选出了3种花色苷类代谢物:二甲花翠素-3-O-葡萄糖苷(图4-d)、花青素-3-O-(6″-O-咖啡酰)-葡萄糖苷(图4-e)和甲基花青素-3-O-(6″-O-咖啡酰)-葡萄糖苷(图4-f)。这些代谢物在不同时间点变化显著。例如,花青素-3-O-(6″-O-咖啡酰)-葡萄糖苷的含量从花后91 d的1.15×105增加到花后93 d的2.89×105,而二甲花翠素-3-O-葡萄糖苷的含量则从花后91 d的1.39×105降至96 d的2.55×104。甲基花青素-3-O-(6″-O-咖啡酰)葡萄糖苷等物质也显示出类似下降趋势,其含量分别在花后93 d和96 d下降了23.38%和51.96%。这可能与葡萄果实成熟过程中的生理变化密切相关,进一步影响了葡萄与葡萄酒的外观颜色。
黄酮醇和酚酸也是重要的多酚次生代谢物,与葡萄的生长发育密切相关。在不同时间点的比较中,筛选出了若干具有显著差异的代谢物。例如,山奈酚-3-O-葡萄糖苷(图4-g)的含量在花后91~96 d显著下降,从91 d的1.372×106降至93 d的6.42×104,并在96 d时进一步降至1.01×104。同样,山奈酚-3-O-半乳糖苷(图4-h)和异鼠李素-3-O-葡萄糖苷(图4-i)的含量也分别从花后91 d的4.4×105和3.62×105下降到96 d的9.49×103和1.87×104。而原儿茶酸(图4-j)和绿原酸(图4-k)的含量则表现出先升后降的趋势。原儿茶酸从花后91 d的3.1×105增至93 d的1.69×106,随后在93~96 d降至3.33×105。绿原酸的含量则表现出持续下降的趋势,从花后91 d的1.87×106下降至花后93 d的7.68×104,并在96 d进一步下降至2.84×103。
2.2.3.2 氨基酸及其衍生物
氨基酸种类和含量是反映葡萄酒品质的重要指标,不仅是关键的呈味物质,也是重要的香气前体(如亮氨酸、缬氨酸、异亮氨酸和苯丙氨酸),显著增强葡萄酒的感官特征。本研究分析了3个时间段的葡萄样品,筛选出了L-色氨酸(图4-l)、L-精氨酸(图4-m)、L-亮氨酸(图4-n)等氨基酸及其衍生物(如还原型谷胱甘肽,图4-o)等显著差异的代谢物。其中,L-精氨酸的含量从花后91 d的3.104×105下降至花后96 d的2.5×104,显示出明显的减少趋势。L-色氨酸也表现出类似地下降趋势,从花后93 d的5.28×106增加至花后96 d的3.27×106。L-亮氨酸的含量在花后91 d 为1.02×105,逐渐减少至花后96 d 的1.0×104。这可能与葡萄成熟过程中氨基酸的代谢变化有关[17]。另外,还发现还原型谷胱甘肽的含量在花后93 d时显著波动,尤其在花后96 d,含量从1.5×104降至3.19×103,达到最低值。这一变化将对葡萄成熟过程中抗氧化能力造成影响[18]。
2.2.4 主成分分析(principal component analysis,PCA)和聚类分析
在对代谢物数据进行标准化处理后,对所有样本进行了聚类分析(图5)。分析结果显示,花后91 d和93 d的葡萄样品归为一类,表明这2个时间点的样品在代谢物积累模式上有较高的相似性。相比之下,花后96 d的样品与这2个时间点的样品在代谢物组成和相对含量方面存在显著差异。为进一步了解3组葡萄样品之间的差异,采用了PCA,结果表明,花后91 d和93 d的样品之间差异较小,而花后96 d的样品则与前两者有明显的不同。
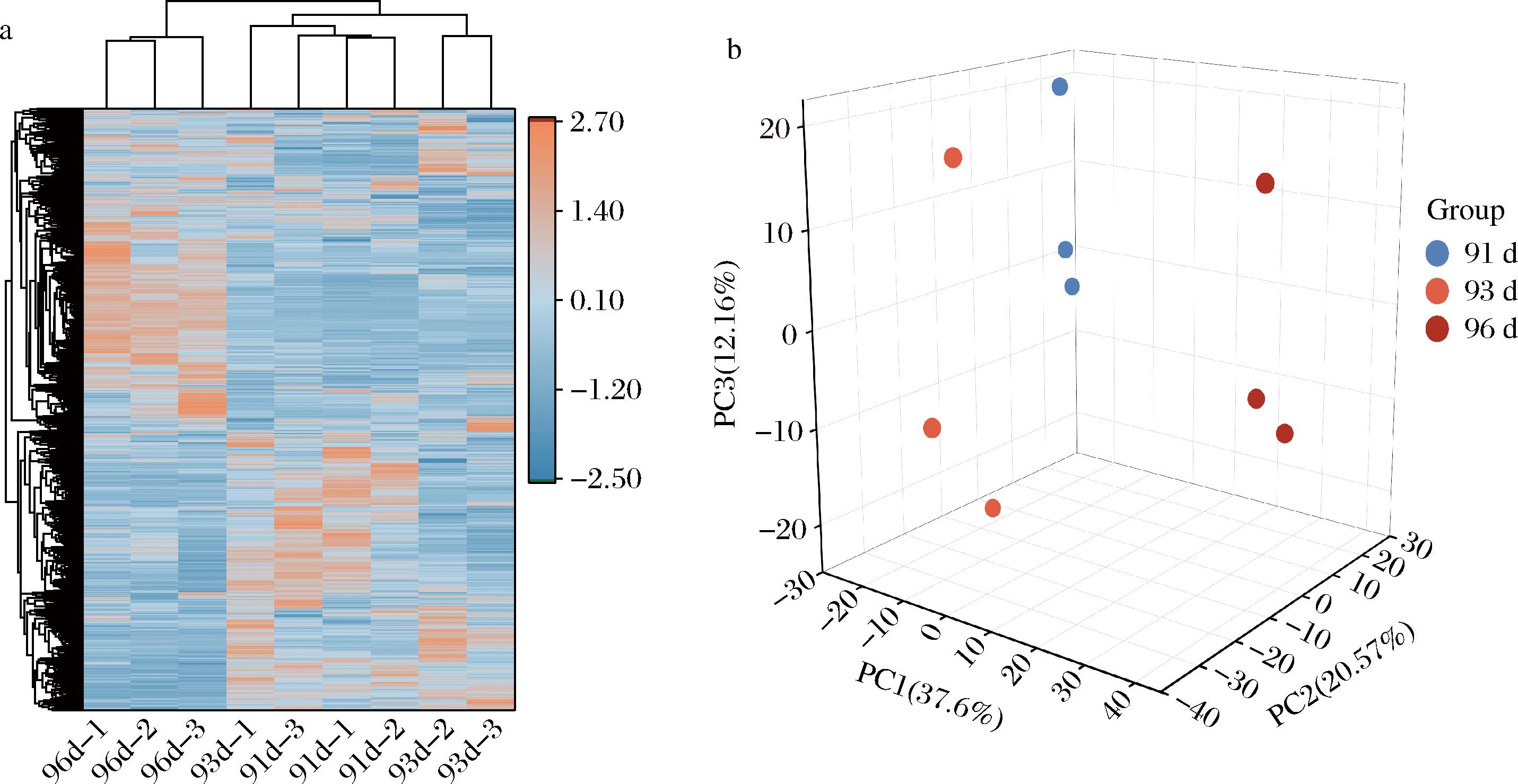
a-花后91、93、96 d样品聚类热图;b-花后91、93、96 d PCA图
图5 不同花后时间代谢物组别聚类热图和PCA图
Fig.5 Hierarchical clustering heatmap of metabolite groups and PCA plot at different post-flowering time
2.3 差异代谢物的代谢通路分析
利用KEGG(Kyoto Encyclopedia of Genes and Genomes)数据库对差异代谢物进行代谢通路富集分析(图6),结果显示,“花后91 d与93 d”“花后91 d与96 d”和“花后93 d与96 d”的差异代谢物分别归类到31条、69条和75条代谢途径中。其中,植物次生代谢途径,特别是黄酮和黄酮醇的代谢途径,富集了最多的差异代谢物。而咖啡因代谢、鞘脂代谢等其他代谢途径的富集则较为有限。进一步分析显示,差异代谢物主要来源于黄酮和黄酮醇代谢途径下的酚类化合物,如儿茶素、表儿茶素和没食子儿茶素等。这些化合物在不同采收期的变化,可能成为判断最佳采收期的重要标志。

a-91 d vs 93 d KEGG富集分析;b-91 d vs 96 d KEGG富集分析;d-93 d vs 96 d KEGG富集分析
图6 不同花后时间差异代谢物KEGG富集分析
Fig.6 KEGG enrichment analysis of differential metabolites at different post-flowering time
3 讨论
葡萄果实的成熟是葡萄生长发育过程中的关键环节。在这一阶段,果实中的各种代谢产物会经历复杂的变化,特别是糖、酸和多酚类物质的种类及其含量变化,这些变化与葡萄的最终品质密切相关。研究表明,葡萄从转色到成熟这一时期对酿酒葡萄的品质具有决定性影响,因此,准确确定酿酒葡萄的最佳采收期对于确保葡萄酒的品质至关重要。
当前,生产中主要依赖葡萄的理论成熟度来判断采收期。传统研究往往侧重于对葡萄基本理化指标(如糖度、酸度、pH值)及其酚类物质的定性分析。例如,张军翔等[19]在研究蛇龙珠葡萄时,提出了基于含糖量的采收期标准。常远[20]则在新疆吐哈产区的葡萄品质研究中,结合酸含量和酚类物质,构建了成熟度评价指标体系。此外,一些研究尝试结合果实的糖含量和成熟系数来评估葡萄成熟度,从而确定适宜的采收期。这些方法多关注糖酸平衡,但未充分考虑酚类物质和其他关键成分的含量变化。若要全面评估其内在品质,还需要结合代谢组学等方法进行深入研究。因此,本研究通过代谢组学方法,对赤霞珠葡萄的成熟过程进行了更为细致的分析。结果发现,赤霞珠葡萄果实中共检测到1 811种代谢物,特别是黄酮类、氨基酸及其衍生物和酚酸类物质的变化较为显著。通过理化指标、多酚含量和代谢组学分析的综合评估,推测花后91~93 d为当地赤霞珠葡萄最佳采收期。在不同地区,赤霞珠葡萄的最佳采收期有所不同。例如,在法国为8月中下旬[21]、河北怀来县为9月下旬到10月上旬[22],山西晋中地区为9月中下旬[23],在河北省昌黎地区,赤霞珠葡萄的最适采收期为10月上中旬[24]。本研究中,张掖地区的最佳采收期为9月末或10月初,与上述地区相比,较为符合赤霞珠的采收规律。
此外,KEGG分析表明,差异显著的代谢物主要参与植物的次生代谢途径,尤其是黄酮和黄酮醇代谢途径。儿茶素、表儿茶素、没食子儿茶素、二甲花翠素-3-O-葡萄糖苷、花青素-3-O-(6″-O-咖啡酰)-葡萄糖苷、甲基花青素-3-O-(6″-O-咖啡酰)-葡萄糖苷、山奈酚-3-O-葡萄糖苷、山奈酚-3-O-半乳糖苷和异鼠李素-3-O-葡萄糖苷等化合物,可能是判断最佳采收期的重要指标。同时,葡萄果实转色后花色苷开始迅速积累,并于果实成熟时含量达到最高。此时花色苷的组分、含量以及提取率很大程度上决定了其在酒中的含量和葡萄酒的相关品质[25]。
研究显示,植物内源代谢物的种类繁多,总量在20万至100万种之间[26]。因此,对这些代谢产物进行全面研究,对深入理解植物生命活动具有重要意义。不过,尽管本研究利用代谢组学技术为赤霞珠葡萄的采收期提供了一些有价值的见解,但也存在一定的局限性。例如:1)本研究未涉及葡萄香气的分析,而香气是影响葡萄酒品质的重要组成部分,对消费者的接受度和葡萄酒的市场表现具有直接影响。因此,香气分析的缺失可能限制了对葡萄整体品质评估的全面性;2)本研究未涉及葡萄酒酿造的验证判断,因此尚无法验证所推荐的最佳采收期对葡萄酒品质的实际影响;3)本研究虽然揭示了葡萄采收期内代谢物的动态变化,但尚未深入构建代谢通路与调控网络,若能进一步完善这一环节,这将能提高研究结果的可靠性,并为构建合理的酿酒葡萄成熟度指标体系及快速检测方法提供更多的理论支持。因此,上述问题将是后续研究的重要方向。
4 结论
科学确定葡萄的最佳采收期对于保证葡萄酒的品质和实现高质量葡萄酒生产至关重要。为此,本研究以甘肃河西走廊产区的赤霞珠葡萄为实验材料,在接近成熟的花后83~101 d期间进行连续采样,并对样品的基本理化指标和多酚含量进行测定。同时,应用UPLC-ESI-QQQ技术,对花后91、93、96 d的葡萄样品进行了广泛靶向代谢组学分析。结果表明,赤霞珠葡萄果实中共检测到1 811种代谢物。综合理化指标、多酚含量及代谢组学分析,推测花后91~93 d为最佳采收期。此外,KEGG分析显示,差异显著的代谢物主要参与次生代谢途径,尤其是黄酮和黄酮醇的代谢,并推测关键化合物如儿茶素、表儿茶素、没食子儿茶素、二甲花翠素-3-O-葡萄糖苷、花青素-3-O-(6″-O-咖啡酰)-葡萄糖苷、甲基花青素-3-O-(6″-O-咖啡酰)-葡萄糖苷、山奈酚-3-O-葡萄糖苷、山奈酚-3-O-半乳糖苷和异鼠李素-3-O-葡萄糖苷,可能是判断最佳采收期的重要指标。本研究结合理化分析与代谢组学技术,提出了一种更加全面和科学的葡萄采收期评估方法,这将为葡萄种植管理和葡萄酒品质提升提供一定的数据支持和科学依据。
[1] 梁艳英, 刘旭, 隋银强, 等.几个红色酿酒葡萄品种成熟度研究[J].北方园艺, 2013(7):1-4.LIANG Y Y, LIU X, SUI Y Q, et al.Study on the maturity of a few of red Vitis vinifera varities[J].Northern Horticulture, 2013(7):1-4.
[2] 莫寅斌, 唐虎利.新疆玛纳斯县梅鹿辄葡萄最佳采收期的研究[J].酿酒, 2011, 38(5):38-41.MO Y B, TANG H L.Study on best harvest time of merlot grape from Manasi County in Xinjiang[J].Liquor Making, 2011, 38(5):38-41.
[3] 张琪, 朱丹, 牛广财, 等.沙棘果酒发酵动力学及其抗氧化活性[J].食品与发酵工业, 2019, 45(15):53-58.ZHANG Q, ZHU D, NIU G C, et al.Fermentation kinetics and antioxidant activity of sea buckthorn wine[J].Food and Fermentation Industries, 2019, 45(15):53-58.
[4] ZHANG L Y, YU Y B, YU R Z.Analysis of metabolites and metabolic pathways in three maize (Zea mays L.) varieties from the same origin using GC-MS[J].Scientific Reports, 2020, 10:17990.
[5] DEGU A, HOCHBERG U, SIKRON N, et al.Metabolite and transcript profiling of berry skin during fruit development elucidates differential regulation between Cabernet Sauvignon and Shiraz cultivars at branching points in the polyphenol pathway[J].BMC Plant Biology, 2014, 14:188.
[6] ALI K, MALTESE F, FORTES A M, et al.Pre-analytical method for NMR-based grape metabolic fingerprinting and chemometrics[J].Analytica Chimica Acta, 2011, 703(2):179-186.
[7] 郭淑萍, 杨顺林, 杨玉皎, 等.GA3和CPPU对无核翠宝葡萄果实品质的影响[J].果树学报, 2022, 39(10):1834-1844.GUO S P, YANG S L, YANG Y J, et al.Effect of GA3 and CPPU treatments on fruit quality of Wuhe Cuibao grape[J].Journal of Fruit Science, 2022, 39(10):1834-1844.
[8] 张瑜, 王鹏飞, 穆霄鹏, 等.喷施不同叶面肥对‘农大4号’欧李果实糖酸含量的影响[J].山东农业科学, 2019, 51(3):77-80;91.ZHANG Y, WANG P F, MU X P, et al.Effects of spraying different foliar fertilizers on sugar and acid contents of nongda 4 Cerasus humilis fruit[J].Shandong Agricultural Sciences, 2019, 51(3):77-80;91.
[9] 辛秀兰, 李小萍, 马越, 等.HPLC-ELSD法测定红树莓果实中水溶性糖含量[J].吉林农业大学学报, 2009, 31(5):624-627.XIN X L, LI X P, MA Y, et al.Determination of water-soluble sugars in red raspberry by high performance liquid chromatography with evaporative light scattering detector(HPLC-ELSD)[J].Journal of Jilin Agricultural University, 2009, 31(5):624-627.
[10] 李静, 聂继云, 王孝娣, 等.Folin-Ciocalteus法测定葡萄和葡萄酒中的总多酚[J].中国南方果树, 2007, 36(6):86-87.LI J, NIE J Y, WANG X D, et al.Determination of total polyphenols in grape and wine by folin-ciocalteus method[J].South China Fruits, 2007, 36(6):86-87.
[11] 翦祎, 韩舜愈, 张波, 等.单一pH法、pH示差法和差减法快速测定干红葡萄酒中总花色苷含量的比较[J].食品工业科技, 2012, 33(23):323-325;423.JIAN Y, HAN S Y, ZHANG B, et al.Comparison of single pH method, pH-differential method and substraction method for determining content of anthocyanins from red wine[J].Science and Technology of Food Industry, 2012, 33(23):323-325;423.
[12] 孙永蓉, 宫鹏飞, 李蔚, 等.茉莉酸甲酯处理对‘黑比诺’葡萄果皮酚类物质及其抗氧化活性的影响[J].食品与发酵工业, 2021, 47(12):196-202.SUN Y R, GONG P F, LI W, et al.Effects of methyl jasmonate treatment on phenolic compounds and antioxidant activity of ‘Pinot Noir’grape peel[J].Food and Fermentation Industries, 2021, 47(12):196-202.
[13] 邵淑贤, 陈潇敏, 林燕萍, 等.不同产地黄观音乌龙茶的广泛靶向代谢组学分析[J].食品与生物技术学报, 2022, 41(9):57-67.SHAO S X, CHEN X M, LIN Y P, et al.Widely targeted metabolomic analysis of Huang Guanyin oolong tea from different areas[J].Journal of Food Science and Biotechnology, 2022, 41(9):57-67.
[14] 刘旭, 杨丽, 张芳芳, 等.酿酒葡萄成熟期间果实质地特性和花色苷含量变化[J].食品科学, 2015, 36(2):105-109.LIU X, YANG L, ZHANG F F, et al.Changes in textural properties and anthocyanins content of wine grape during maturation[J].Food Science, 2015, 36(2):105-109.
[15] FANG F, TANG K, HUANG W D.Changes of flavonol synthase and flavonol contents during grape berry development[J].European Food Research and Technology, 2013, 237(4):529-540.
[16] MONAGAS M, G MEZ-CORDOVÉS C, BARTOLOMÉ B, et al.Monomeric, oligomeric, and polymeric flavan-3-ol composition of wines and grapes from Vitis vinifera L.Cv.Graciano, Tempranillo, and Cabernet Sauvignon[J].Journal of Agricultural and Food Chemistry, 2003, 51(22):6475-6481.
MEZ-CORDOVÉS C, BARTOLOMÉ B, et al.Monomeric, oligomeric, and polymeric flavan-3-ol composition of wines and grapes from Vitis vinifera L.Cv.Graciano, Tempranillo, and Cabernet Sauvignon[J].Journal of Agricultural and Food Chemistry, 2003, 51(22):6475-6481.
[17] 王亚钦. 果穗曝光对酿酒葡萄氨基酸积累及葡萄酒发酵香气合成的影响[D].北京:中国农业大学,2015.WANG Y Q.Effects of fruit cluster exposure on amino acid accumulation in wine grapes and synthesis of volatile compounds during wine fermentation[D].Beijing:China Agricultural University, 2015.
[18] 梁红敏, 高德艳, 全巧玲, 等.基于代谢组学分析GSH对霞多丽葡萄酒代谢产物的影响[J].食品科学, 2023, 44(18):286-293.LIANG H M, GAO D Y, QUAN Q L, et al.Metabolomics analysis of the effect of reduced glutathione on metabolites of chardonnay wine[J].Food Science, 2023, 44(18):286-293.
[19] 张军翔, 顾沛雯, 马永明.宁夏银川地区酿酒葡萄采收期的研究[J].宁夏农学院学报, 2001, 22(3):24-26.ZHANG J X, GU P W, MA Y M.Study on the time of harvest of vine grape in Yinchuan area[J].Journal of Ningxia Agricultural College, 2001, 22(3):24-26.
[20] 常远. 新疆吐哈产区酿酒葡萄成熟指标体系研究[D].杨凌:西北农林科技大学, 2019. CHANG Y.Research on the mature indicator system of wine grape cultivated in tuha area of Xinjiang [D].Yangling:Northwest A&F University, 2019.
[21] 王思新, 孔庆山, 刘崇怀.葡萄单品种酿酒试验报告[J].葡萄栽培与酿酒, 1998(1):41-43.WANG S X, KONG Q S, LIU C H.Experimental report on wine-making of single grape variety[J].Sino-Overseas Grapevine &Wine, 1998(1):41-43.
[22] 修德仁, 周润生, 晁无疾, 等.干红葡萄酒用品种气候区域化指标分析及基地选择[J].葡萄栽培与酿酒, 1997(3):22-26.XIU D R, ZHOU R S, CHAO W J, et al.Index analysis of climate regionalization for dry red wine varieties and the varieties base selection[J].Sino-Overseas Grapevine &Wine, 1997(3):22-26.
[23] 贾希友, 于凤云.赤霞珠葡萄丰产栽培技术措施[J].河北果树, 1998(1):27-28.JIA X Y, YU F Y.High-yield cultivation techniques of cabernet sauvignon grapes[J].Hebei Fruits, 1998(1):27-28.
[24] 石友荣, 齐永顺, 张京政, 等.赤霞珠葡萄适宜采收期研究[J].河北果树, 2007(6):10-11.SHI Y R, QI Y S, ZHANG J Z, et al.Study on the suitable harvest time of cabernet sauvignon grapes[J].Hebei Fruits, 2007(6):10-11.
[25] R O SEGADE S, SOTO V
O SEGADE S, SOTO V ZQUEZ E, D
ZQUEZ E, D AZ LOSADA E.Influence of ripeness grade on accumulation and extractability of grape skin anthocyanins in different cultivars[J].Journal of Food Composition and Analysis, 2008, 21(8):599-607.
AZ LOSADA E.Influence of ripeness grade on accumulation and extractability of grape skin anthocyanins in different cultivars[J].Journal of Food Composition and Analysis, 2008, 21(8):599-607.
[26] DIXON R A, STRACK D.Phytochemistry meets genome analysis, and beyond[J].Phytochemistry, 2003, 62(6):815-816.