单核细胞增生李斯特菌(Listeria monocytogenes, LM),简称单增李斯特菌,是一种兼性厌氧无芽孢、革兰氏阳性杆状细菌,广泛存在于自然环境中。它能引发人类和动物的李斯特菌病,易感人群为儿童、老年人、免疫功能低下者和孕妇,感染后临床表现复杂多样,从轻缓的流感样症状,到严重的脑膜炎和败血症、孕妇流产甚至死亡,李斯特菌病的死亡率高达20%~40%[1]。1985 年美国最早报告的李斯特菌病疫情与某一品牌奶酪有关,涉及142例疾病、28例死亡和20例胎儿流产[2]。2023年,欧盟27个成员国报道李斯特菌病确诊病例数为2 952例,发病率0.66/10万,比2022年上升了5.8%,创下了自2007年以来所报告的最高病例数[3]。2011年至2016年,中国19个省份报告了253例侵袭性李斯特菌病病例,总病死率为25.7%[4]。张智芳等[5]总结了国内2010—2023年报告的李斯特菌病例,全国27个省(市、自治区和直辖市)共报告临床病例693例,其中北京市报告病例数最多占23.7%(164/693),发现李斯特菌病的总病死率为17.2%,新生儿的病死率为27.1%。总之,LM引发的食源性疾病在世界范围内对食品安全和人类健康造成了较为严重的威胁,应当引起足够重视,在食品生产和销售过程中加强对该菌的检测和控制。
LM病暴发与牛奶和奶制品、肉类和肉制品以及新鲜农产品有关。2018年,南非出现了有史以来最大的LM食源性疾病暴发事件,食用被污染的肉干香肠导致937人感染,造成193人死亡[6]。2011年,美国科罗拉多州爆发了一次近90年来最严重的食源性疾病,导致147人感染LM,其中有33例死亡和1例流产,该疫情与被LM污染的哈密瓜密切相关[7]。因此,为保证食品加工和供应的安全,使用抗生素、消毒剂等控制LM的生长和繁殖,成为了目前最为广泛的手段。但长此以往,不仅导致细菌耐药性增强,还可能在食品中残留,对人体健康构成潜在威胁[8]。
在此背景下,天然抑菌活性成分的研究和开发成为极具潜力的新途径和新趋势。植物活性成分是指从植物组织中提取出的化学结构明确的生物活性分子及其衍生物,广泛应用于食品保鲜、医药和农业等领域[9-11]。这些活性成分的来源丰富多样,包括各种草本植物、香料、调味品、药用植物等[12]。它们不仅可以提高食品的品质,还能发挥抗氧化、抗炎、抗肿瘤、增强免疫力、保护心脑血管等多种功效,在促进人体健康、预防疾病方面也发挥着重要作用[13]。我国地域辽阔,植物资源丰富,在开发运用植物源活性成分方面具有得天独厚的优势。目前,植物源抑菌活性成分的研究主要围绕大肠杆菌、金黄色葡萄球菌、沙门氏菌等常见的菌种,国内外也有一些针对植物源抑制LM活性成分的探讨,但缺乏对其进行综合分类,以及从破坏LM生物膜、细胞代谢和毒力因子等机制的系统性总结。本文综合分析了目前已有的研究,梳理了酚类、萜类、生物碱类等可以抑制LM的植物活性成分,阐述了其结构与特性。同时,剖析植物活性成分作用于细菌生物膜、细胞代谢和毒力因子等环节的抑菌机制。
1 植物源抑LM活性成分
植物源抑菌活性成分的分类主要基于其化学结构和和生物活性,归纳起来主要包括萜烯类、多酚类、生物碱类、精油类等化合物,具有杀菌、抗炎、抗氧化、抗肿瘤等功能(表1)。萜烯类化合物广泛存在于植物体内,具有多样的生物活性,通过干扰细菌细胞膜的功能发挥抑菌作用。多酚类物质富含酚羟基,凭借强抗氧化性和对细菌代谢酶的抑制,展现出良好的抑菌效果。生物碱类因含氮杂环结构,抑菌作用机制独特,可阻断细菌的蛋白质合成过程。精油类成分挥发性强,能迅速作用于细菌,改变其生理状态。
表1 常见植物源活性成分的种类、来源及生物活性
Table 1 Species, source and efficacy of common plant-derived antibacterial active components

名称代表化合物植物来源生物活性功能萜烯单萜、倍半萜、二萜、三萜、四萜针叶树、石斛、柑橘类水果杀菌、防腐、镇静、抑制肿瘤多酚类黄酮类、酚酸类、芪类蔬果、茶叶、坚果、可可、大豆抗氧化、抗炎、抑制肿瘤、调节毛细血管功能生物碱类吡啶类、异喹啉类、莨菪类、吲哚类罂粟科、茄科、豆科、麻黄科杀菌、抗炎、抗氧化、抑制肿瘤精油类醇类、醛类、酸类草本植物萃取平衡体内机能、美容养颜皂苷类甾体皂苷、三萜皂苷人参、豆类、桔梗、甘草抗菌及抗病毒、增强免疫力多糖类淀粉、纤维素、半纤维素茶叶、苦瓜、人参、黄芪抗肿瘤、抗菌、抗氧化、降血糖血脂
1.1 萜烯类
萜类化合物作为一类广泛存在于各类植物中的天然有机化合物,其分子结构以异戊二烯单位为基础。大量研究已证实萜类化合物对人类健康具有积极作用,且在食品防腐领域展现出巨大潜力[14]。由于其具备抗虫、抗疟、抑菌等多种生物活性,在应对耐药病原体方面前景广阔[15]。目前,已有众多具有抑制LM活性的萜类成分被成功分离鉴定。
DEEPASREE等[16]依据类药五原则筛选出40个萜类化合物,并开展分子对接与动态模拟研究。结果显示,在这40种萜类化合物中,证实了vouacapan与毒力蛋白的强相互作用,对LM的抑制作用最为显著,且稳定性良好。DI MATTEO等[17]进行了开链单萜柠檬醛对英诺克李斯特菌和LM细胞损伤的比较研究,发现柠檬醛对这2种菌均有抑菌活性,抑菌效果与培养液中柠檬醛的浓度相关。该特性使其可应用于活性包装,以防止食品二次污染,或与其他保鲜技术联合使用。QIN等[18]从杜松子和紫茎泽兰中提取出一种双环倍半萜烯δ-cadinene,可有效控制牛奶中LM的生长,其最低抑菌浓度(minimum inhibitory concentration,MIC)为5 μL/mL,最低杀菌浓度(minimum bactericidal concentration,MBC)为10 μL/mL。李兆亭等[19]从胡椒中提取出了包括蒈烯、柠檬烯、水芹烯等12种萜类化合物,结果表明胡椒油中的萜类化合物能够显著抑制LM的生长,MIC为0.05%,即使在相对较低浓度下也是如此,0.1%萜类化合物也可显著抑制LM的生长。
1.2 多酚类
多酚类化合物是一类具有酚羟基结构的次生代谢产物,主要包括黄酮类、酚酸类和芪类等(表2),广泛存在于植物的茎、果实、叶、花等部位,尤其是酚酸类和黄酮类在抑制LM上表现出了巨大的潜力,为食品保鲜领域提供了新的天然抑菌选择[20-21]。
表2 植物多酚类主要化合物
Table 2 Classification of main plant-derived antibacterial active components

酚类化合物名称主要活性成分主要活性功能黄酮类黄酮类黄酮醇黄烷酮黄烷醇芹菜素、木犀草素、黄芩黄素、白杨素槲皮素、杨梅素、芦丁、山奈酚、高良姜素、柚皮素、橙皮素儿茶素、表儿茶素、表没食子儿茶素、表儿茶素没食子酸酯、表没食子儿茶素没食子酸酯、原花青素抗氧化、抗炎、抗癌和神经保护[27]、预防心血管疾病、糖尿病、肠道菌群失调和代谢功能障碍相关脂肪性肝病[28]酚酸类羟基苯甲酸类羟基肉桂酸类羟基苯甲酸、没食子酸、原儿茶酸、鞣花酸、可水解的单宁(没食子单宁、鞣花单宁)肉桂酸、香豆酸、芥子酸、没食子酸、香草酸、丁香酸、丁香苷、阿魏酸、咖啡酸、绿原酸、迷迭香酸、姜黄素强效的抗氧化、抗菌、抗炎和抗癌特性[29]芪类二苯乙烯白藜芦醇、白藜芦醇-反式-二氢二聚体抗氧化、抗炎和免疫调节、预防心血管疾病、癌症和神经退行性疾病等[30]
BOUARAB-CHIBANE等[22]观察了35 种多酚对3种革兰氏阴性菌和3种革兰氏阳性菌菌株生长的影响,LM对这些多酚都表现出了敏感性,其中酚酸类化合物的衍生物如白藜芦醇和木酚素对该细菌的活性最高,分别为100%和97.9%,没食子酸丁酯抑菌效果也很可观,细菌相对负荷差(bacterial load difference,BLD)为100%,其次是咖啡酸1,1-二甲基烯丙基酯,也有72.3%的抗LM活性;而在黄酮类化合物中,表没食子儿茶素没食子酸酯、槲皮素3-β-D-葡萄糖苷、紫杉醇BLD值分别为100%、75.1%、69.4%。BANERJI等[23]确定丁香和肉桂水提取物对LM毒力基因生物膜起始、分散和表达的有效性,活性成分丁香酚和肉桂醛下调了生物膜中毒力基因的表达和细胞外DNA(eDNA)的释放。DACOREGGIO等[24]从Eugenia pyriformis Cambess(一种桃金娘科的巴西本土物种)叶片中鉴定出了24种酚类化合物,经过实验分析,显示出主要对革兰氏阳性菌的作用,该叶片在当地被认为是农业废弃物,但是它们作为生物活性化合物来源的潜在用途很有研究价值。QIAN等[25]从多实验角度证明了木犀草素能够抑制金黄色葡萄球菌和单核细胞增生李斯特菌的生长,并显示出对它们强大的抗菌活性,其中LM的MIC值为32 μg/mL。AZI等[26]分析探讨发酵大豆乳清中的酚类化合物对大肠杆菌0157∶H7 和LM的抗菌作用,采用转录组学方法验证了FSP可用于控制食品中的大肠杆菌0157∶H7 和LM的致病和增殖。
1.3 生物碱类
生物碱类化合物是一类含氮的有机碱,这些化合物是在植物的次生代谢过程中产生的,用于防御食草动物、昆虫和微生物病原体,具有多样的化学结构和抗病、抗癌和抗肿瘤等生物活性[31]。它们在自然界中广泛分布,在抗菌领域具备良好的应用潜力。
LI等[32]研究了一种天然异喹啉生物碱小檗碱(berberine,BBR)的聚集诱导发光(aggregation induced emission,AIE)型天然产物对LM的光动力抗菌性能,结果显示BBR介导的光动力过程具有出色的抗菌活性,光动力灭菌被认为是传统抗菌方法中很有前途的一种替代方案,而找到AIE特性的光敏剂就是一个重点,天然产物为光动力灭菌开辟了一条新途径。生物碱类成分是博落回属植物质量控制的常用标志物,李瑞等[33]研究了目前已从博落回属植物中分离鉴定的89种生物碱类成分,其中白屈菜红碱对革兰阳性菌具有较强的抑制作用,MIC为0.156 mg/mL。DE ALC NTARA ALMEIDA等[34]通过咖啡因在小鼠体内外对LM的抗菌活性进行研究,发现咖啡因具有抗感染的潜力,可以改善实验性感染的LM后续出现的炎症,但是在体外对LM没有直接的抗菌活性。赵猛等[35]对钩吻全株中的生物碱的抑菌活性进行测定,结果显示,钩吻生物碱具有广谱抗菌性,对李斯特菌、金黄色葡萄球菌、大肠杆菌等7 种供试菌都具有抑菌活性,随着生物碱浓度的增加,抑菌效果也随之加强,其中对LM表现出了显著的抑菌效果。
NTARA ALMEIDA等[34]通过咖啡因在小鼠体内外对LM的抗菌活性进行研究,发现咖啡因具有抗感染的潜力,可以改善实验性感染的LM后续出现的炎症,但是在体外对LM没有直接的抗菌活性。赵猛等[35]对钩吻全株中的生物碱的抑菌活性进行测定,结果显示,钩吻生物碱具有广谱抗菌性,对李斯特菌、金黄色葡萄球菌、大肠杆菌等7 种供试菌都具有抑菌活性,随着生物碱浓度的增加,抑菌效果也随之加强,其中对LM表现出了显著的抑菌效果。
1.4 精油类
精油是几种低分子质量挥发性化合物的复杂组合,通常储存在植物的油管、树脂管和毛状体中。来自不同植物的精油表现出多种不同的生物活性,例如抗氧化、抗菌、抗真菌、抗寄生虫和杀病毒活性[36]。由于其包含很多不同成分的混合物,性质复杂,识别其中的活性抗菌化合物很有难度,故将其归作一类来论述。
EL-ZEHERY等[37]测定了百里香油、姜黄油、欧芹油、大蒜油等10 种精油对LM和大肠杆菌等5种病原菌株的抑制作用,4种精油在对抗单核细胞增生李斯特菌上表现突出,即肉桂、丁香、百里香和大蒜精油。KONG等[38]从桧木中提取了挥发性生物活性物质桧木精油(hinoki essential oil,HEO),HEO通常在汽车和住宅环境中用于除臭防虫,但在抑菌实验中,HEO显示出令人满意的双重抗LM和抗金黄色葡萄球菌活性,基于这些发现,可以合理地考虑 HEO作为食品防腐剂的潜在应用。KIM等[39]使用琼脂扩散法筛选了24种精油在西红柿汁中的抗菌活性,6种精油(肉桂、柠檬、柠檬草、牛至、薄荷和百里香精油)对LM表现出相对较强的抑制活性(抑制区直径≥35.0 mm)。ISEPPI等[40]研究了麝香草、鼠尾草精油和一种从海产品中分离出的细菌素bacLP17的抗LM活性,结果显示,2种精油联合使用具有协同作用,但与细菌素联合使用的抗菌效果更好,联合使用可能是控制海产品中LM浮游细胞和固着细胞的有效途径。
1.5 其他
在天然植物的庞大资源库中,抑制LM的活性成分远不止萜类、酚类、生物碱类和精油类。醇类凭借独特化学结构干扰细菌代谢,阻碍其营养摄取与能量转换;多糖类既能增强机体免疫,激活免疫细胞对细菌的吞噬,又能直接作用于细胞壁,破坏其稳定性;有机酸类通过调节pH值,抑制细菌酶活性;萘醌类则参与氧化还原,产生自由基破坏细菌生物大分子。这些物质都是天然植物对抗LM的有力武器,为抗菌研究提供了丰富素材。
DIAS等[41]探讨了芳樟醇对LM毒力因子的影响以及降低其耐受力方面的潜在用途,观察到芳樟醇对LM生物膜形成有抑制作用,对毒力因子、渗透耐受等都表现出了明显的抑制作用,即使在较低浓度下也能克服LM在食品安全领域带来的一些问题。张梦圆等[42]比较了硒化乌拉尔甘草多糖和乌拉尔甘草多糖对LM体内、体外的抗菌活性,结果显示各剂量的2种多糖都表现出了对LM的抑制作用,其中240 mg/mL的硒化多糖抑制效果最佳。温燕龙等[43]从辣木种子中提取了辣木籽素,这是一种异硫氰酸酯,经实验发现辣木籽素对LM具有较强的抑菌活性,其MIC为400 μmol/L,即使是1×MIC辣木籽素对LM生长抑制效果都十分明显,生物膜形成、细菌表面疏水性、泳动性和黏附性等均明显受到影响。LI等[44]研究了一种从紫草中提取出来的脂溶性萘醌类化合物紫草素对LM的抑菌效果,实验显示紫草素对LM的最低抑制浓度范围为25~100 μg/mL。
2 植物源活性成分抑制LM的机制研究
2.1 干扰生物膜功能
LM在食品工业设备及各类环境中具有顽强的生存能力,这主要归因于其强大的生物膜形成能力。其生物膜由多糖、蛋白质、核酸等物质构成,通过分泌胞外聚合物,逐步聚集形成复杂三维结构。该结构赋予LM对紫外线、低水分活度、高渗透压以及抑菌剂处理等不利环境更强的耐受性,使其能在恶劣条件下长久存活[45]。因此,生物膜结构的破坏将直接或间接导致细菌代谢障碍,最终死亡。植物中众多活性成分通过改变生物膜表面的电荷或直接作用于细菌的细胞壁和细胞膜,导致膜的失衡和细胞内外物质的异常流动(图1)。
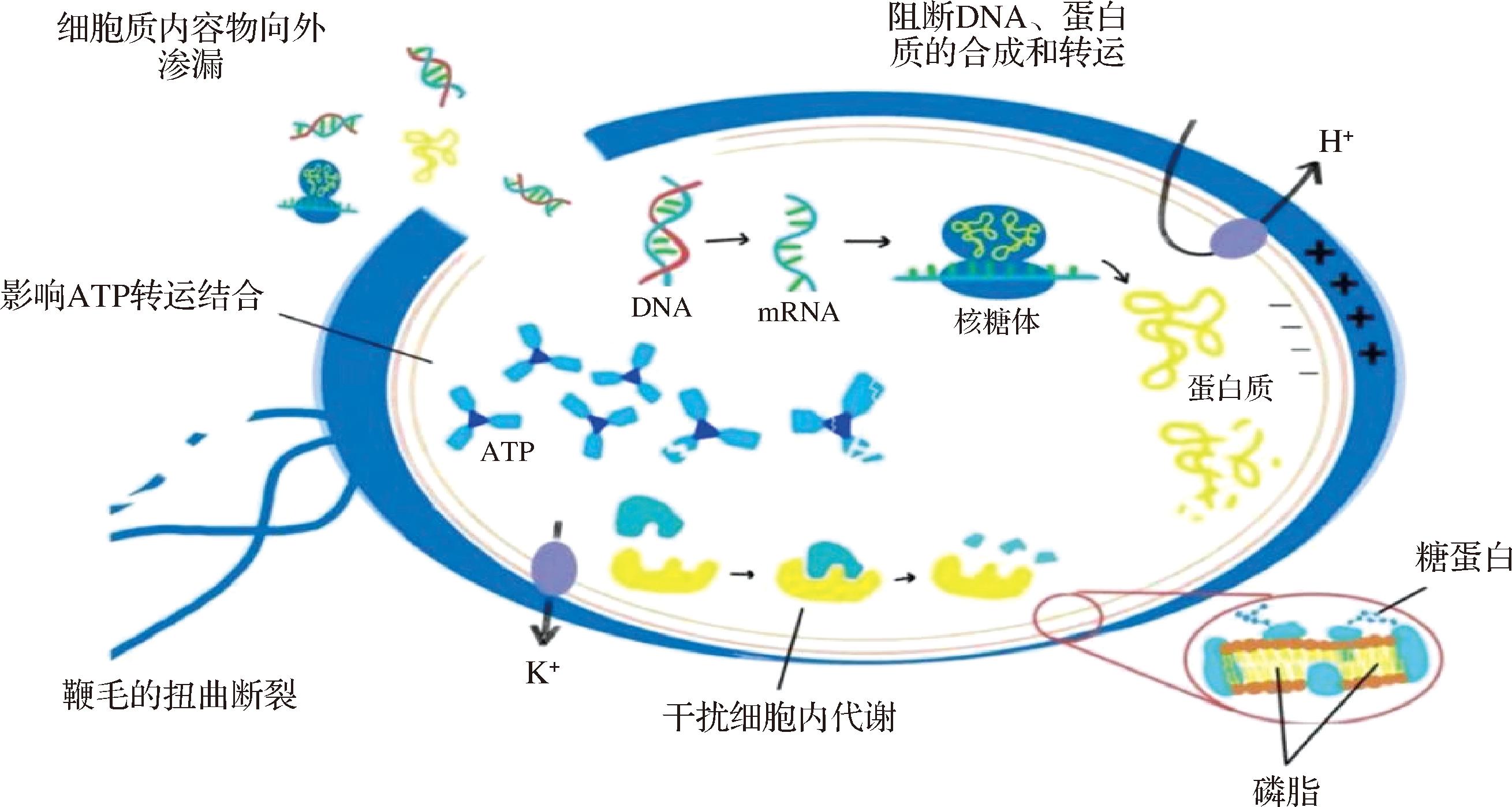
图1 植物活性成分抑制LM生物膜和细胞代谢的机制(改编自文献[47])
Fig.1 Mechanism by which plant-derived antibacterial active components inhibit LM biofilm and cell metabolism
细菌正常情况下表面净电荷为负,并与介质中存在的反离子电荷相平衡,这是其生存的关键特性。电位的变化会影响细菌的代谢和细胞表面的通透性,导致死亡或抑制生长[46]。ZAMUZ等[47]对大量酚类化合物进行总结分析,其中酚酸类和黄酮类主要通过改变细胞膜的电位,导致LM细胞内容物流失,削弱细胞的防御力,从而使细菌更易受到抑制和破坏。LIU等[48]发现4-羟基苯乙酸处理后的LM相对电导率急剧升高,细胞表面电荷被扰乱,导致电解质泄漏。BAI等[49]发现相比百里醌和乳酸链球菌素的单独作用,能够引起LM膜电位的改变,影响细胞代谢,从而抑制细菌的生长。WU等[50]也证明了芝麻醇和乳酸链球菌素联合处理显著增加了LM悬浮液的电导率,改变了细胞膜的通透性,导致细菌去极化和跨膜pH梯度。
细菌的细胞质膜承担着渗透调节、呼吸作用、物质运输、脂质合成等责任,因此膜的完整性对细菌至关重要。LI等[44]将LM暴露于紫草素下,发现生物膜的完整性和三维结构被破坏。随着紫草素浓度的增加,生物被膜结构由致密变为松散,附着在表面的细菌数量逐渐减少。ZENG等[51]研究证实丹皮酚不仅能够有效破坏LM细胞膜完整性,还能分解其成熟生物膜。鞭毛与细菌黏附作用密切相关,对LM的生物膜形成至关重要,BUATONG等[52]使用浓度为4×MIC的表没食子儿茶素没食子酸酯处理单核细胞增生李斯特菌后,观察到菌体生物膜遭到严重破坏,鞭毛发生扭曲,LM附着在食物表面的能力明显降低。黑胡椒精油及其活性成分胡椒碱对LM均展现出良好的抗生物膜活性,对多物种生物膜形成的影响与处理时间和浓度呈正相关[53]。FANCELLO等[54]从撒丁岛柠檬叶中提取出精油,其活性成分复杂,包含柠檬烯、月桂烯和其他单萜化合物,气态精油靶向细菌细胞壁和质膜,经处理后的LM细胞呈现出明显的细胞壁和质膜破裂,细胞内部也出现损伤和畸形。
2.2 干扰细胞质代谢
细胞质代谢是细胞内所发生的用于维持生命的一系列有序化学反应,细菌的新陈代谢包括合成代谢和分解代谢两部分,二者共同维持细菌的生长、繁殖和能量平衡。众多植物源抑菌活性物质在这一复杂代谢过程中发挥关键作用,它们可作为诱导剂或抑制剂,阻断菌体细胞的正常代谢进程(图1)。
分解代谢是细菌内部将大分子底物(如糖类、氨基酸、脂类等)分解为小分子前体,并释放能量(如ATP)和还原力(如NADH)。GUO等[55]实验表明经牛至精油处理的LM细胞内 ATP明显减少,脂质过氧化,其浓度与LM中的脂质氧化程度呈正相关。补骨脂种子的乙醇提取物通过干扰ATP的结合,阻断细胞能量供应,进而导致细胞损伤,抑制细菌生长[56]。HAN等[57]验证了柠檬烯可通过抑制呼吸复合物和ATP酶活性,阻碍ATP合成,抑制LM生长。超氧化物歧化酶作为细菌分解代谢过程中副产物的清洁剂,胡璇等[58]发现益智精油能够作用于LM细胞内的超氧化物歧化酶,打破其原有的动态平衡,导致酶活力发生变化,同时诱导大量自由基生成,影响细菌代谢。
合成代谢则是利用分解代谢提供的能量和小分子前体,合成细菌生长所需的大分子物质(如肽聚糖、核苷酸、磷脂等)。CHEN等[59]发现肉豆蔻酸添加至乳制品中,能够与LMDNA特异性结合,进而诱导DNA构象发生改变,运用流式细胞术进一步证实了肉豆蔻酸还会影响细胞程序性死亡过程,从而有效抑制LM的生长。KANG等[60]研究表明香茅醛通过影响LM的蛋白质合成过程、核糖体组装以及代谢调控等关键生物过程,显著抑制了其生长和存活。RecA蛋白作为细菌中应激诱导反应(SOS反应)DNA修复的重要物质,让其成为药物耐药性研究的重要靶点,OJHA等[61]观察到香豆酸中的酚类化合物是有效的RecA抑制剂,能够抑制LM中RecA蛋白驱动的一系列生化活性,包括单链DNA(ssDNA)结合、链交换、ATP水解以及RecA共蛋白酶活性等。通过抑制这些大分子物质合成路径,植物活性成分有效阻止了细菌的扩散和繁殖。
2.3 干扰毒力基因表达
毒力基因严格且协调地调控表达,对于细菌病原体在宿主体内不同环境中的适应存活能力和感染宿主的能力至关重要[62]。植物活性物质中,有部分化合物主要通过干扰LM毒力基因正常的表达来达到抑制其表面黏附、组织侵袭、毒素产生等效果。
MIAO等[63]发现0.78 μg/mL和1.56 μg/mL的百里醌能够下调LM的转录调节基因(prfA)、鞭毛蛋白基因(flaA)、QS反应调节因子(agrA)、李斯特菌溶菌素O基因(hly)和应激反应因子(sigB)的转录,sigB参与细菌耐酸、耐冷和渗透压适应,且还能降低磷脂酰胆碱磷脂酶编码基因(plcB)和内化蛋白调控基因(inlB)的转录水平,这2个基因与宿主细胞的黏附和侵袭密切相关,进而降低细菌的毒力和生长。MARINI等[64]研究表明大麻精油处理后的LM显示鞭毛运动基因和转录调节基因 prfA 下调,形成生物膜和侵入Caco-2细胞的能力也显著降低,抑制了组织侵袭。CUI等[65]发现在辣木油的处理下,LM的毒力基因(prfA、plcA、hly、actA、plcB、inlA和inlB)的表达不同程度地被抑制,从而降低其活性。BYUN等[66]评估了天然芳香族化合物(百里香酚、丁香酚、香芹酚和柠檬醛)与李斯特菌特异性噬菌体混合物对LM的作用效果,结果显示在感染复数为100时,MIC的天然芳香族化合物与噬菌体混合物的体外联合处理,毒力相关基因(flaA、motB、hlyA、prfA和actA)和应激反应(sigB)基因的表达显著下调。Agr群体感应(quorum sensing,QS)系统有助于LM的生物膜形成,JIANG等[67]评估了肉桂醛对LM Agr系统中组氨酸激酶AgrC和反应调节因子AgrA的影响,结果表明肉桂醛在AgrA-P中充当AgrA的竞争性抑制剂,导致Agr系统的转录受到抑制,进而影响细菌生物膜的形成。ROY等[68]在槲皮素对LM毒力抑制作用研究中,发现槲皮素对参与运动(flaA、fbp)、QS(agrA)和毒力(hlyA、prfA)的不同基因表达都有不同程度的影响,通过槲皮素浓度的升高,生物膜形成以及与鞭毛运动、毒力和群体感应相关的靶基因的表达水平都显著降低。
3 结论与展望
本文探讨了多种类植物活性成分对LM的抑制效果及抑菌机制,包括作用于菌体的生物膜、鞭毛、细胞器、毒力基因等,最终影响LM的生长和增殖。目前植物源抑菌活性物质在食品保鲜中已经展现出具有良好的应用效果,但在食品工业中的广泛应用还存在一些问题:a)植物源提取物的成分复杂,抑菌的有效成分不明,需进一步开发提纯和鉴定;b)抑菌机制研究尚不系统和深入,部分植物活性成分缺乏深入系统的机制研究;c)抑菌活性会受到食品成分的影响,需根据植物活性成分的浓度剂量等评估抑菌效果及人体能接受的最大用量;d)现有的植物抑菌活性物质不能满足不同食品多样化体系的各种需求。因此,未来研究可从抑菌成分、抑菌机理、联合作用及应用开发等方面持续发力,以实现更广泛的应用及更高的经济效益。
同时,深入探究植物源活性物质的成分构成和抑菌机理,对开发新型天然抑菌剂、防腐剂意义重大。优化提取工艺,综合考虑提取纯化率和经济可行性。运用分子生物学中的基因编辑技术,如CRISPR/Cas9,可精准敲除细菌中与植物源抑菌剂作用相关的基因,明确其具体作用靶点。借助生物化学中的蛋白质组学和代谢组学分析,能全面解析细菌在植物源抑菌剂作用下蛋白质和代谢产物的变化,从而揭示其作用的分子机制。研究植物源抑菌剂对细菌细胞膜的脂质过氧化影响、对细胞壁合成关键酶的抑制作用、对蛋白质合成过程中核糖体功能的干扰以及对DNA复制解旋酶和聚合酶的作用等,为设计更高效的抑菌剂筑牢理论根基。
大量研究已证实2种以上植物源抑菌活性成分联合使用可达到相加或协同作用的效果,使得部分单独使用抑菌效果微弱的活性物质发挥价值。例如上文中提到的几种酚酸、几种精油的协同使用,充分展示了1+1>2的效果。此外,未来还可探索与生物保鲜剂(如微生物发酵产物)、纳米材料(如纳米银)等不同类型制剂的联合应用,挖掘更多协同抑菌模式,提高抑菌效果,保障食品安全。
因此,植物源抑菌活性成分在不同食品体系中的应用开发是未来研究重点,例如将这些植物活性成分研发成更有针对性的抑菌剂。针对肉制品,考虑其高蛋白质和脂肪含量,开发富含茶多酚、迷迭香提取物的植物源抑菌剂,利用其抗氧化和抑菌双重功效,延缓肉制品氧化和微生物滋生;对于乳制品,研究以乳铁蛋白结合植物精油的抑菌活性成分,确保在乳制品的复杂营养环境中稳定发挥作用;针对蔬菜和水果,开发可喷涂、可包装的植物源抑菌剂,如以海藻酸钠为载体的植物源抑菌涂膜剂,延长其保鲜期。还可根据食品加工、贮存、运输需求,将植物源抑菌剂制成固体粉末用于干燥食品、液体喷雾用于生鲜食品、气体熏蒸剂用于仓储食品,满足多样化保鲜需求。随着技术不断进步与消费者需求的转变,植物源抑菌活性物质有望在食品保鲜和食品安全领域发挥更大效能,为人类健康和环境保护作出积极贡献。
[1] TCHOUMI S Y, CHUKWU C W.A multi-population approach to epidemiological modeling of Listeriosis transmission dynamics incorporating food and environmental contamination[J].Healthcare Analytics, 2024, 5:100344.
[2] ROGALLA D, BOMAR P.A.Listeria monocytogenes[M].StatPearls.Treasure Island (FL).2025.
[3] European Food Safety Authority (EFSA), European Centre for Disease Prevention and Control (ECDC).The European union one health 2023 zoonoses report[J].EFSA Journal, 2024, 22(12):e9106.
[4] LI W W, BAI L, FU P, et al.The epidemiology of Listeria monocytogenes in China[J].Foodborne Pathogens and Disease, 2018, 15(8):459-466.
[5] 张智芳, 刘雪杰, 陈伟伟, 等. 2010—2023年中国文献报告李斯特菌病病例流行特征分析[J]. 中国人兽共患病学报, 2025, 41(6):653-659.ZHANG Z F, LIU X J, CHEN W W, et al. Characteristics of listeriosis cases reported in the literature in China, 2010—2023[J]. Chinese Journal of Zoonoses, 2025, 41(6):653-659.
[6] THOMAS J, GOVENDER N, MCCARTHY K M, et al.Outbreak of listeriosis in South Africa associated with processed meat[J].The New England Journal of Medicine, 2020, 382(7):632-643.
[7] MCCOLLUM J T, CRONQUIST A B, SILK B J, et al.Multistate outbreak of listeriosis associated with cantaloupe[J].The New England Journal of Medicine, 2013, 369(10):944-953.
[8] HANES R M, HUANG Z Y.Investigation of antimicrobial resistance genes in Listeria monocytogenes from 2010 through to 2021[J].International Journal of Environmental Research and Public Health, 2022, 19(9):5506.
[9] DRIF A I, YÜCER R, DAMIESCU R, et al.Anti-inflammatory and cancer-preventive potential of chamomile (Matricaria chamomilla L.):A comprehensive in silico and in vitro study[J].Biomedicines, 2024, 12(7):1484.
[10] ZHANG D, IVANE N M A, HARUNA S A, et al.Recent trends in the micro-encapsulation of plant-derived compounds and their specific application in meat as antioxidants and antimicrobials[J].Meat Science, 2022, 191:108842.
[11] KONOZY E H E, OSMAN M E M, DIRAR A I, et al.Revolutionizing therapeutics:The dazzling world of plant lectins[J].Journal of King Saud University - Science, 2024, 36(8):103318.
[12] LI S, JIANG S X, JIA W T, et al.Natural antimicrobials from plants:Recent advances and future prospects[J].Food Chemistry, 2024, 432:137231.
[13] FAVELA-GONZ LEZ K M, HERN
LEZ K M, HERN NDEZ-ALMANZA A Y, DE LA FUENTE-SALCIDO N M.The value of bioactive compounds of cruciferous vegetables (Brassica) as antimicrobials and antioxidants:A review[J].Journal of Food Biochemistry, 2020, 44(10):e13414.
NDEZ-ALMANZA A Y, DE LA FUENTE-SALCIDO N M.The value of bioactive compounds of cruciferous vegetables (Brassica) as antimicrobials and antioxidants:A review[J].Journal of Food Biochemistry, 2020, 44(10):e13414.
[14] MASYITA A, MUSTIKA SARI R, DWI ASTUTI A, et al.Terpenes and terpenoids as main bioactive compounds of essential oils, their roles in human health and potential application as natural food preservatives[J].Food Chemistry:X, 2022, 13:100217.
[15] MAHIZAN N A, YANG S K, MOO C L, et al.Terpene derivatives as a potential agent against antimicrobial resistance (AMR) pathogens[J].Molecules, 2019, 24(14):2631.
[16] DEEPASREE K, SUBHASHREE V.Molecular docking and dynamic simulation studies of terpenoid compounds against phosphatidylinositol-specific phospholipase C from Listeria monocytogenes[J].Informatics in Medicine Unlocked, 2023, 39:101252.
[17] DI MATTEO A, LAVORGNA M, RUSSO C, et al.Natural plant-derived terpenes:Antioxidant activity and antibacterial properties against foodborne pathogens, food spoilage and lactic acid bacteria[J].Applied Food Research, 2024, 4(2):100528.
[18] QIN R, YANG S P, FU B, et al.Antibacterial activity and mechanism of the sesquiterpene δ-cadinene against Listeria monocytogenes[J].LWT, 2024, 203:116388.
[19] 李兆亭, 陈文学, 韩迎洁, 等.胡椒油中萜类化合物对单增李斯特菌抑菌机理及在冷鲜肉中的应用[J].食品工业科技, 2019, 40(19):89-93.LI Z T, CHEN W X, HAN Y J, et al.Antibacterial mechanism of terpenoids in pepper oil against Listeria monocytogenes and its application in cold meat[J].Science and Technology of Food Industry, 2019, 40(19):89-93.
[20] POZZO L, GRANDE T, RAFFAELLI A, et al.Characterization of antioxidant and antimicrobial activity and phenolic compound profile of extracts from seeds of different Vitis species[J].Molecules, 2023, 28(13):4924.
[21] KITSIOU M, PURK L, IOANNOU C, et al.On the evaluation of the antimicrobial effect of grape seed extract and cold atmospheric plasma on the dynamics of Listeria monocytogenes in novel multiphase 3D viscoelastic models[J].International Journal of Food Microbiology, 2023, 406:110395.
[22] BOUARAB-CHIBANE L, FORQUET V, LANTÉRI P, et al.Antibacterial properties of polyphenols:Characterization and QSAR (quantitative structure-activity relationship) models[J].Frontiers in Microbiology, 2019, 10:829.
[23] BANERJI R, MAHAMUNE A, SAROJ S D.Aqueous extracts of spices inhibit biofilm in Listeria monocytogenes by downregulating release of eDNA[J].LWT, 2022, 154:112566.
[24] DACOREGGIO M V, SANTETTI G S, IN CIO H P, et al.Phenolic compounds profile of optimised green and eco-friendly extracts of Eugenia pyriformis leaves:An alternative for antioxidant and antibacterial applications[J].Natural Product Research, 2025, 39(5):1422-1427.
CIO H P, et al.Phenolic compounds profile of optimised green and eco-friendly extracts of Eugenia pyriformis leaves:An alternative for antioxidant and antibacterial applications[J].Natural Product Research, 2025, 39(5):1422-1427.
[25] QIAN W D, LIU M, FU Y T, et al.Antimicrobial mechanism of luteolin against Staphylococcus aureus and Listeria monocytogenes and its antibiofilm properties[J].Microbial Pathogenesis, 2020, 142:104056.
[26] AZI F, LI Z Y, XU P, et al.Transcriptomic analysis reveals the antibacterial mechanism of phenolic compounds from kefir fermented soy whey against Escherichia coli 0157:H7 and Listeria monocytogenes[J].International Journal of Food Microbiology, 2022, 383:109953.
[27] LI Y, SUN C, YAO D Y, et al.A review of microRNAs and flavonoids:New insights into plant secondary metabolism[J].International Journal of Biological Macromolecules, 2025, 309:142518.
[28] LI X P, XIE E J, SUN S M, et al.Flavonoids for gastrointestinal tract local and associated systemic effects:A review of clinical trials and future perspectives[J].Journal of Advanced Research, 2025.
[29] FU L L, CHEN T Y, ZHUANG X Y, et al.Tuning the amphiphilicity of agarose by grafting phenolic acids:A versatile approach for developing lutein-loaded emulsion gels[J].International Journal of Biological Macromolecules, 2025, 304(Pt 2):140733.
[30] OKAMOTO S, KAKIMARU S, KOREISHI M, et al.Resveratrol, a food-derived polyphenol, promotes Melanosomal degradation in skin fibroblasts through coordinated activation of autophagy, lysosomal, and antioxidant pathways[J].Journal of Functional Foods, 2025, 125:106672.
[31] 刘德江, 郭乐乐, 田立娟, 等.三种猕猴桃茎中总生物碱提取工艺优化及抑菌活性分析[J].食品工业科技, 2023, 44(16):195-203.LIU D J, GUO L L, TIAN L J, et al.Optimization of extraction process and antibacterial activity of total alkaloids from three kinds of Actinidia stems[J].Science and Technology of Food Industry, 2023, 44(16):195-203.
[32] LI Q Y, WANG B C, PENG S Y, et al.Photodynamic inactivation of Listeria monocytogenes using a natural aggregation-induced emission photosensitizer and its application in salmon preservation[J].LWT, 2024, 193:115762.
[33] 李瑞, 陈义莲, 彭婧媛, 等.博落回属药用植物化学成分、药理活性及质量控制方法研究进展[J].中国现代中药, 2025, 27(1):170-188.LI R, CHEN Y L, PENG J Y, et al.Research progress on chemical composition, pharmacological activity, and quality control methods of medicinal plant Macleaya R.Br[J].Modern Chinese Medicine, 2025, 27(1):170-188.
[34] DE ALC NTARA ALMEIDA I, MANCEBO DORVIGNY B, SOUZA TAVARES L, et al.Anti-inflammatory activity of caffeine (1, 3, 7-trimethylxanthine) after experimental challenge with virulent Listeria monocytogenes in Swiss mice[J].International Immunopharmacology, 2021, 100:108090.
NTARA ALMEIDA I, MANCEBO DORVIGNY B, SOUZA TAVARES L, et al.Anti-inflammatory activity of caffeine (1, 3, 7-trimethylxanthine) after experimental challenge with virulent Listeria monocytogenes in Swiss mice[J].International Immunopharmacology, 2021, 100:108090.
[35] 赵猛, 路美玲, 赵雅婷, 等.钩吻解剖结构及钩吻生物碱抑菌作用研究[J].林产化学与工业, 2023, 43(2):105-115.ZHAO M, LU M L, ZHAO Y T, et al.Anatomical structure of Gelsemium elegans Benth and the antibacterial action of alkaloids[J].Chemistry and Industry of Forest Products, 2023, 43(2):105-115.
[36] BHAVANIRAMYA S, VISHNUPRIYA S, AL-ABOODY M S, et al.Role of essential oils in food safety:Antimicrobial and antioxidant applications[J].Grain &Oil Science and Technology, 2019, 2(2):49-55.
[37] EL-ZEHERY H R A, ZAGHLOUL R A, ABDEL-RAHMAN H M, et al.Novel strategies of essential oils, chitosan, and nano- chitosan for inhibition of multi-drug resistant:E.coli O157:H7 and Listeria monocytogenes[J].Saudi Journal of Biological Sciences, 2022, 29(4):2582-2590.
[38] KONG P F, ZULFIKAR A, THANGUNPAI K, et al.Efficient encapsulation of Hinoki essential oil with β-cyclodextrin using an ultrasound-aided co-precipitation technique for dual anti-Listeria monocytogenes and anti-Staphylococcus aureus activities[J].International Journal of Biological Macromolecules, 2024, 270:132382.
[39] KIM J, KIM H, BEUCHAT L R, et al.Synergistic antimicrobial activities of plant essential oils against Listeria monocytogenes in organic tomato juice[J].Food Control, 2021, 125:108000.
[40] ISEPPI R, CAMELLINI S, SABIA C, et al.Combined antimicrobial use of essential oils and bacteriocin bacLP17 as seafood biopreservative to control Listeria monocytogenes both in planktonic and in sessile forms[J].Research in Microbiology, 2020, 171(8):351-356.
[41] DIAS J P, DOMINGUES F C, FERREIRA S.Linalool reduces virulence and tolerance to adverse conditions of Listeria monocytogenes[J].Antibiotics, 2024, 13(6):474.
[42] 张梦圆, 朱晓庆, 谷新利, 等.硒化乌拉尔甘草多糖和乌拉尔甘草多糖对单核细胞增生李斯特菌抗菌活性的研究[J].黑龙江畜牧兽医, 2023(11):110-115.ZHANG M Y, ZHU X Q, GU X L, et al.Study on the antibacterial activity of selenizing Glycyrrhiza uralensis polysaccharide and Glycyrrhiza uralensis polysaccharide against Listeria monocytogenes[J].Heilongjiang Animal Science and Veterinary Medicine, 2023(11):110-115.
[43] 温燕龙, 张楠, 李文云, 等.辣木籽素对单增李斯特菌的抑制作用[J].现代食品科技, 2023, 39(4):62-70.WEN Y L, ZHANG N, LI W Y, et al.Inhibitory effect of moringin from Moringa oleifera seeds on Listeria monocytogenes[J].Modern Food Science and Technology, 2023, 39(4):62-70.
[44] LI J H, LI S Q, LI H Z, et al.Antibiofilm activity of shikonin against Listeria monocytogenes and inhibition of key virulence factors[J].Food Control, 2021, 120:107558.
[45] 刘昀阁. 单增李斯特菌生物膜形成特性及天然抑菌物质对其抑制机理的研究 [D].泰安:山东农业大学, 2021.LIU Y G.The study of Listeria monocytogenes biofilm formation characteristics and the inhibition mechanism of natural antimicrobial compounds in the biofilm development[D].Tai’an:Shandong Agricultural University.
[46] RASAMIRAVAKA T, LABTANI Q, DUEZ P, et al.The formation of biofilms by Pseudomonas aeruginosa:A review of the natural and synthetic compounds interfering with control mechanisms[J].BioMed Research International, 2015, 2015(1):759348.
[47] ZAMUZ S, MUNEKATA P E S, DZUVOR C K O, et al.The role of phenolic compounds against Listeria monocytogenes in food.A review[J].Trends in Food Science &Technology, 2021, 110:385-392.
[48] LIU Y J, SHI C H, ZHANG G L, et al.Antimicrobial mechanism of 4-hydroxyphenylacetic acid on Listeria monocytogenes membrane and virulence[J].Biochemical and Biophysical Research Communications, 2021, 572:145-150.
[49] BAI F T, GUO D, WANG Y Y, et al.The combined bactericidal effect of nisin and thymoquinone against Listeria monocytogenes in Tryptone Soy Broth and sterilized milk[J].Food Control, 2022, 135:108771.
[50] WU M J, DONG Q L, SONG X, et al.Effective combination of nisin and sesamol against Listeria monocytogenes[J].LWT, 2023, 176:114546.
[51] ZENG Q, FU Y T, YANG M, et al.Effect of paeonol against bacterial growth, biofilm formation and dispersal of Staphylococcus aureus and Listeria monocytogenes in vitro[J].Biofouling, 2022, 38(2):173-185.
[52] BUATONG J, MITTAL A, MITTRAPARP-ARTHORN P, et al.Bactericidal action of shrimp shell chitooligosaccharide conjugated with epigallocatechin gallate (COS-EGCG) against Listeria monocytogenes[J].Foods, 2023, 12(3):634.
[53] DOS SANTOS E A R, ERENO TADIELO L, ARRUDA SCHMIEDT J, et al.Inhibitory effects of piperine and black pepper essential oil on multispecies biofilm formation by Listeria monocytogenes, Salmonella Typhimurium, and Pseudomonas aeruginosa[J].LWT, 2023, 182:114851.
[54] FANCELLO F, PETRETTO G L, MARCEDDU S, et al.Antimicrobial activity of gaseous Citrus limon var pompia leaf essential oil against Listeria monocytogenes on ricotta salata cheese[J].Food Microbiology, 2020, 87:103386.
[55] GUO P, LI Z Y, CAI T, et al.Inhibitory effect and mechanism of oregano essential oil on Listeria monocytogenes cells, toxins and biofilms[J].Microbial Pathogenesis, 2024, 194:106801.
[56] LI H N, WANG C Y, WANG C L, et al.Antimicrobial effects and mechanisms of ethanol extracts of Psoralea corylifolia seeds against Listeria monocytogenes and Methicillin-resistant Staphylococcus aureus[J].Foodborne Pathogens and Disease, 2019, 16(8):573-580.
[57] HAN Y J, SUN Z C, CHEN W X.Antimicrobial susceptibility and antibacterial mechanism of limonene against Listeria monocytogenes[J].Molecules, 2020, 25(1):33.
[58] 胡璇, 黄英, 王凯, 等.益智精油化学成分分析及其对单核细胞增生李斯特氏菌的抑菌机理[J].食品科学, 2024, 45(16):140-150.HU X, HUANG Y, WANG K, et al.Chemical component analysis of Alpinia oxyphylla miq.essential oil and its antimicrobial mechanism against Listeria monocytogenes[J].Food Science, 2024, 45(16):140-150.
[59] CHEN X R, ZHAO X C, DENG Y H, et al.Antimicrobial potential of myristic acid against Listeria monocytogenes in milk[J].The Journal of Antibiotics, 2019, 72(5):298-305.
[60] KANG K, LIU X S, LI P Y, et al.Exploring Citronella’s inhibitory mechanism against Listeria monocytogenes and its utilization in preserving cheese[J].Food Microbiology, 2024, 122:104550.
[61] OJHA D, PATIL K N.p-Coumaric acid inhibits the Listeria monocytogenes RecA protein functions and SOS response:An antimicrobial target[J].Biochemical and Biophysical Research Communications, 2019, 517(4):655-661.
[62] MEIRELES D, POMBINHO R, CABANES D.Signals behind Listeria monocytogenes virulence mechanisms[J].Gut Microbes, 2024, 16(1):2369564.
[63] MIAO X, LIU H H, ZHENG Y Y, et al.Inhibitory effect of thymoquinone on Listeria monocytogenes ATCC 19115 biofilm formation and virulence attributes critical for human infection[J].Frontiers in Cellular and Infection Microbiology, 2019, 9:304.
[64] MARINI E, MAGI G, FERRETTI G, et al.Attenuation of Listeria monocytogenes virulence by Cannabis sativa L.essential oil[J].Frontiers in Cellular and Infection Microbiology, 2018, 8:293.
[65] CUI H Y, LI H, LI C Z, et al.Inhibition effect of Moringa oil on the cheese preservation and its impact on the viability, virulence and genes expression of Listeria monocytogenes[J].Lwt, 2020, 134:110163.
[66] BYUN K H, SANG H H, CHOI M W, et al.Control of Listeria monocytogenes in food industry by a combination treatment of natural aromatic compound with Listeria-specific bacteriophage cocktail[J].Food Research International, 2024, 177:113859.
[67] JIANG X B, KANG R, YU T, et al.Cinnamaldehyde targets the LytTR DNA-binding domain of the response regulator AgrA to attenuate biofilm formation of Listeria monocytogenes[J].Microbiology Spectrum, 2023, 11(3):e0030023.
[68] ROY P K, SONG M, PARK S Y.The inhibitory effect of quercetin on biofilm formation of Listeria monocytogenes mixed culture and repression of virulence[J].Antioxidants, 2022, 11(9):1733.