炎症是一个复杂的生理过程,是对有害刺激的反应,能够清除病原体和修复受损组织[1],一旦炎症反应过于激烈或持续时间过长,便会对机体造成损伤,其临床表现多为红肿、发热、疼痛等[2]。在病情加剧的情况下,一些炎症反应信号通过血液和淋巴传播到全身,可能引发组织与器官的功能性障碍,进而诱发结肠炎、关节炎、糖尿病等一系列急慢性病症[3-5],严重干扰人体正常生理活动。因此,控制炎症对于预防疾病至关重要。目前临床治疗炎症主要依赖非甾体类或类固醇药物,但这些药物可能引起肾功能不全、水肿、骨质疏松等不良反应[6-7]。随着对植物活性成分研究的持续深入,人们逐渐意识到植物中很多活性成分在调控炎症反应方面具有显著作用,且相较于合成药物,天然成分的协同效应和多靶点特性可能降低单一通路过度抑制带来的副作用风险,这一发现为炎症性疾病的治疗与预防开辟了新的途径[8]。因此,深入探索植物的抗炎活性成分及其作用机制,对于开发创新性的抗炎治疗方案具有重要的现实意义。
生姜(Zingiber officinale Roscoe),姜科属多年生草本植物,原产于东南亚地区,属于热带及亚热带植物,现广泛种植于亚洲东部国家如中国、印度和印度尼西亚[9]。生姜性辛、微温,富含姜辣素类、黄酮类、挥发油、生姜多糖以及生姜糖蛋白等多种活性成分[10],这些活性成分不仅赋予了生姜温中止呕、化痰止咳、解鱼蟹毒及解表散寒的传统药用价值[11],更为现代临床开发抗炎药物提供了重要的天然化合物来源[12]。基于其悠久的药用传统,现代药理研究证实,生姜活性成分在肝纤维化、哮喘等相关炎症疾病动物模型中展现出显著抗炎效应[13-14]。值得注意的是,生姜活性成分的抗炎作用呈现多靶点调控特征,其可通过调控核因子κB(nuclear factor kappa-light-chain-enhancer of activated B cells, NF-κB)和丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)等关键炎症信号通路,有效抑制肿瘤坏死因子-α(tmor necrosis factor-α,TNF-α)、白介素-6(interleukin-6,IL-6)等促炎因子的转录和表达[15],最终实现系统性抗炎效应。
然而,目前关于生姜抗炎活性成分的研究较为分散,尚未形成系统的研究体系,研究热点多集中于探究生姜中单一活性成分的抗炎作用,各成分之间的协同作用机制未得到充分探讨。基于此,本文概述了生姜的抗炎活性成分,并系统归纳了生姜的抗炎作用机制以及在关节炎、溃疡性结肠炎、系统性红斑狼疮等炎症性疾病中的应用,以期推动生姜抗炎作用机制的深入研究,为生姜在抗炎领域的综合应用及功能开发提供参考依据。
1 生姜的抗炎活性成分
生姜中功能性成分丰富,目前从生姜中分离得到的抗炎活性成分主要包括姜辣素类、黄酮类、挥发油、生姜多糖以及生姜糖蛋白等。
1.1 姜辣素
生姜的辛辣成分主要归属于姜辣素类化合物,主要存在于生姜的根茎中,由多种化合物组成,对生姜特有风味以及生物活性功能起着决定性作用。姜辣素类化合物的化学结构相对复杂,但均含有3-甲氧基-4-羟基苯基官能团,其结构见图1,依据其官能团所连接的烃链的不同特性,可将姜辣素类化合物划分为姜酚类、姜烯酚类、姜油酮类等[16]。

图1 生姜中常见姜辣素类和黄酮类化合物结构图[16-19,26,29]
Fig.1 Structure of common gingerlicin and flavonoid compounds in ginger[16-19,26,29]
姜酚类物质是姜辣素类化合物中的主要成分,占总姜辣素类化合物的60%~85%,其化学本质是一系列具有β-羟基酮特征结构的烷基链同系物衍生物[17]。姜酚类化合物的含量受生姜品种、生长周期及加工方式影响显著:新鲜生姜中姜酚类含量丰富,而干燥、加热处理会导致其发生脱水反应,转化为姜烯酚类化合物[18]。姜酚类次生代谢产物根据烷基侧链长度的差异可分为不同亚型,主要包括6-姜酚、8-姜酚、10-姜酚等10余种,其中6-姜酚是不同类型姜酚中含量最丰富的成分,在总姜酚含量中占比79%~82%,其化学结构为1-(4-羟基-3-甲氧基苯基)-5-羟基-3-癸酮,分子结构中的β-羟基酮基团和C6烷基链使其具有良好的脂溶性和生物活性[19]。谢燕飞等[20]通过脂多糖(lipopolysaccharide, LPS)刺激RAW264.7巨噬细胞构建体外炎症模型,发现6-姜酚能够有效抑制NO生成及IL-6的蛋白分泌量,显著降低IL-6、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)、环氧合酶2(cyclooxygenase 2,COX-2)的基因转录水平,进而调控免疫细胞的增殖分化过程、表型转化及程序性死亡,从而系统性地调控炎症反应进程。然而,不同烷基链长度的姜酚同系物的生物学效应具有显著差异。李冰[21]通过分子对接实验发现,6-姜酚的C6烷基链可精准嵌入磷酸二酯酶4(phosphodiesterase 4,PDE4)活性口袋,通过氢键和π-π堆积作用抑制PDE4蛋白表达,促使细胞内环磷酸腺苷(cyclic adenosine monophosphate,cAMP)水平升高2.3倍,进而抑制TNF-α和IL-6分泌。10-姜酚的烷基链较长(n=9),尽管对PDE4的抑制活性低于6-姜酚,但其在骨关节炎模型中表现出独特作用。孙晨皓[22]通过构建大鼠骨关节炎模型发现,10-姜酚可以通过调控Kelch样环氧氯丙烷相关蛋白1(Kelch-like ECH-associated protein 1, Keap1)/核因子E2相关因子2(nuclear factor-E2-related factor 2, Nrf2)/抗氧化反应元件(antioxidant response element, ARE)信号通路,促使Nrf2蛋白向细胞核内转运,提升血红素加氧酶-1和醌氧化还原酶-1等关键抗氧化酶基因的转录水平,从而清除过量活性氧(reactive oxygen species,ROS)并抑制NF-κB介导的炎症级联反应,进而延缓骨关节炎的进展。
姜烯酚作为生姜中的另一种姜辣素类化合物,主要包括6-姜烯酚、8-姜烯酚及10-姜烯酚等,作为姜酚类物质经过脱水或特定处理转化而得的烷基酚类衍生物,姜烯酚因其独特的亲电子及羰基官能团[18],相较于姜酚展现出更为显著的抗炎功效。在分子机制层面,姜烯酚可通过靶向多条炎症通路发挥协同调控作用。在神经病理性疼痛模型中8-姜烯酚可瞬时激活瞬时受体电位香草酸亚型1(transient receptor potential vanilloid 1,TRPV1)通道并降低其蛋白表达,阻断NOD样受体(nucleotide-binding oligomerization domain-like receptors, NLRs)热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3,NLRP3)炎症小体组装,使背根神经节和血清中白细胞介素-1β(interleukin-1beta,IL-1β)表达量降低,这种效应与抑制NLRP3/ASC/caspase-1信号轴活化密切相关,提示其在神经炎症调控中具有重要价值[23]。在LPS诱导的小鼠巨噬细胞(RAW 264.7)模型中,6-姜烯酚(10 μmol/L)展现出显著抗炎活性,可强效抑制NO和前列腺素E2(prostaglandin E2,PGE2)产生,且作用强度优于等浓度的6-姜辣素,是潜在的抗炎活性成分[24]。此外,姜烯酚在呼吸系统炎症性疾病中也展现出独特优势。YOCUM等[25]通过建立屋尘螨(house dust mite,HDM)抗原诱导的哮喘小鼠模型,发现慢性腹腔注射6-姜烯酚(6.6 mmol/L溶液,50 μL,每日2次)能显著降低支气管肺泡灌洗液,减少嗜酸性粒细胞与淋巴细胞浸润,且降低肺组织IL-4浓度达51%。
姜油酮[zingerone, 4-(4-羟基-3-甲氧基苯基)-2-丁酮],又称姜酮或香草基丙酮,是生姜中的主要活性成分之一[26]。在6-羟基多巴胺诱导的小鼠帕金森病模型中,姜油酮[65 nmol/(kg·d)]腹腔注射连续干预7 d后,可显著减轻纹状体多巴胺及其代谢物DOPAC(3,4-dihydroxyphenylacetic acid)、HVA(homovanillic acid)的耗竭(均P<0.05),并提升血清超氧化物清除活性(serum superoxide scavenging activity,SOSA);同时,该保护作用可被超氧化物歧化酶(superoxide dismutase,SOD)抑制剂二乙基二硫代氨基甲酸盐(diethyldithiocarbamate,DDC)完全阻断,表明其抗炎效应与系统性抗氧化能力增强密切相关[27]。在葡聚糖硫酸钠(dextran sulfate sodium,DSS)诱导的溃疡性结肠炎模型中,姜油酮[20 mg/(kg·d)]干预组经尾静脉注射连续处理后,可观察到疾病活动指数(disease activity index,DAI)评分显著降低,结肠长度缩短程度减轻,结肠组织病理损伤明显改善;同时结肠促炎因子表达下降,阻断转化生长因子-β(transforming growth factor-β,TGF-β)表达升高(均P<0.05)[28]。
1.2 黄酮类化合物
黄酮类化合物广泛存在于植物组织中,是植物次生代谢产物的重要组成部分,其基本碳链结构为C6-C3-C6,且多以苷类或碳糖苷的形式存在,其结构见图1。其中黄酮醇类、黄酮类是生姜中的主要黄酮类化合物,其含量虽低于姜辣素类化合物,但在调节免疫细胞表型和炎症信号通路中也发挥着关键作用。
黄酮醇类化合物的显著特征在于其C2-C3位置的不饱和碳环结构,以及C4位的氧化和C3位的羟基化修饰,这些结构特征使其成为黄酮类化合物中生物活性最突出的亚类之一[29]。在生姜中,主要的黄酮醇类化合物包括槲皮素(quercetin,3,3′,4′,5,7-五羟基黄酮)、山柰酚(kaempferol,3,4″,5,7-四羟基黄酮)及其糖苷衍生物芦丁(rutin,槲皮素-3-O-芸香糖苷)等,它们可以通过多靶点调控机制在炎症反应中发挥关键作用。在LPS诱导的RAW264.7巨噬细胞模型中,槲皮素(10 μmol/L)可显著下调M1型巨噬细胞标志物iNOS、IL-6和TNF-α的表达,同时上调M2型标志物甘露糖受体和IL-10的生成,通过重塑巨噬细胞表型平衡改善炎症反应[30]。还有研究进一步表明,槲皮素对胶原诱导的关节炎模型具有显著改善作用,可减轻关节肿胀度,抑制血清及关节组织中促炎细胞因子(如IL-6、TNF-α)的分泌,其效果与剂量呈正相关[31]。山柰酚与槲皮素结构相似,均为黄酮醇类化合物,二者可通过调节AGE-RAGE、TNF和MAPK等信号通路,调控炎症因子释放水平,进而参与炎症反应[32]。芦丁是槲皮素与芸香糖结合的糖苷,通过糖基化修饰显著提升水溶性,其高水溶性制剂可使炎症关键介质血栓素B2水平降低48%(P<0.05),在临床测试中,受口罩压迫的皮肤区域经1%制剂处理1 d后,红斑面积减少23.1%,且与安慰剂组差异显著(P<0.05)[33]。在脊髓损伤模型中,芦丁(50 mg/kg)通过抑制p38 MAPK磷酸化和TGF-β/Smad信号传导,使炎症介质IL-1β和TNF-α的表达量分别下降54.3%和62.7%,同时促进神经胶质细胞修复,减少脊髓组织坏死面积[34]。此外,针对神经系统炎症,芦丁(100 mg/kg,口服7周)可显著缓解CuSO4诱导的大鼠脑部炎症反应:与CuSO4单独处理组相比,芦丁联合给药可使脑组织中NO水平显著降低,同时COX-2和诱导型iNOS的过度表达被显著抑制,且联合治疗组大鼠脑皮质层神经元退行性病变及坏死灶明显减少[35]。
生姜中的双羟黄酮,尤其是7,8-二羟基黄酮(7,8-dihydroxyflavone,7,8-DHF),能够通过下调NF-κB和MAPK信号通路,显著抑制LPS诱导的炎症介质产生,可能成为炎症性疾病的新型治疗剂[36]。在LPS诱导的BV2小胶质细胞模型中,30~70 μmol/L 7,8-DHF预处理可显著抑制促炎介质的释放,降低NO水平,减少PGE2的生成,同时抑制TNF-α、IL-1β等促炎细胞因子的分泌[37]。此外,7,8-DHF作为黄酮类家族成员和选择性原肌球蛋白激酶受体B激动剂,在LPS诱导的RAW264.7巨噬细胞中(5~50 μmol/L浓度范围)可显著抑制iNOS、COX-2蛋白表达及NO生成,通过抑制NF-κB与MAPK通路发挥抗炎作用,且在测试浓度下无细胞毒性[36]。
1.3 挥发油
生姜挥发油作为典型的萜类化合物集合体,根据萜类骨架碳原子数的差异,可将其分为单萜烯类(C10)和倍半萜烯类(C15)两大类别。作为典型的C10萜类物质,单萜烯类化合物是一类由2个异戊二烯单元构成碳骨架的萜类物质[38]。生姜挥发油单萜烯含量约占挥发油总量的15%~25%,主要包括柠檬醛(8.2%~12.5%)及蒎烯(3.8%~5.6%)等,这些化合物在炎症性疾病中展现出显著地治疗潜力。柠檬醛(3,7-二甲基-2,6-辛二烯醛)在小鼠模型中展现出显著的抗炎活性:灌胃给予0.10 mL/kg柠檬醛可抑制二甲苯诱导的耳肿胀,0.30 mL/kg剂量能降低乙酸诱导的腹腔毛细血管通透性,同时0.10 mL/kg剂量可显著减少乙酸引起的小鼠扭体反应[39]。作为双环单萜代表,α-蒎烯的特殊的桥环结构(双环[3.1.1]庚烷)使其具有显著细胞膜穿透性,在LPS诱导的小鼠腹腔巨噬细胞炎症模型中,α-蒎烯(0.2~20 μmol/L)以剂量依赖方式显著降低关键炎症介质水平,在20 μmol/L浓度内未表现细胞毒性[40]。
倍半萜类作为C15萜烯化合物,是由3个异戊二烯单元组成的天然有机化合物[38],生姜挥发油中的倍半萜类化合物种类繁多,主要包括α-姜烯(13.81%~19.74%)、β-倍半水芹烯(5.08%~6.22%)和姜黄烯(tr~5.52%),三者合计占比可达挥发油总量的18.89%~31.48%[41]。α-姜烯作为生姜挥发油中含量最丰富的倍半萜成分,其特有的双环[4.4.0]癸烷骨架结构使其在抑制血管生成方面表现出独特优势。研究表明,在皮下海绵植入诱导炎症的小鼠模型中,连续9 d局部注射α-姜烯(0.01、0.1、1 mg/kg)显著降低了植入物内巨噬细胞的活化,明显抑制了炎症相关基质金属蛋白酶2和基质金属蛋白酶9的活性,此外,α-姜烯处理还促进了植入物周围胶原蛋白的沉积,这些结果直接证明了α-姜烯具有显著的抗炎活性[42]。β-倍半水芹烯具有特殊的双环[6.3.0]十一烷结构,其可剂量依赖性地抑制二甲苯诱导的小鼠耳肿胀、角叉菜胶诱导的小鼠足肿胀及醋酸诱导的血管通透性增加,显著降低水肿足组织中过氧化物酶活性和丙二醛的含量,并抑制角叉菜胶诱导的足组织中促炎因子的产生[43]。
此外,生姜挥发油的抗炎功效不仅依赖于单一活性成分,更源于单萜烯与倍半萜类成分的协同作用。李晓乐[44]发现生姜挥发油中的活性成分对Toll样受体基因表达有显著影响:在小鼠实验中,相较于正常对照组,模型对照组的Toll样受体2基因表达水平明显升高;而施以生姜挥发油干预后,阳性对照组及生姜挥发油高、低剂量组的表达水平显著降低(P<0.001),体现出生姜挥发油这类活性成分在调节相关基因表达方面的重要作用。HERVE等[45]在雌性日本鹌鹑模型中观察到,口服给予100、150 μL/kg体重的生姜根茎挥发油可显著降低血清肝损伤标志物:与对照组相比,天门冬氨酸转氨酶活性显著降低(P<0.05),在100、150 μL/kg剂量组分别降至109.19、111.78 U/L(对照组为133.72 U/L);丙氨酸转氨酶活性也显著降低(P<0.05),在100、150 μL/kg剂量组分别降至47.78、39.55 U/L(对照组为105.25 U/L),且丙氨酸转氨酶的降低呈现剂量依赖性。
1.4 其他潜在抗炎活性成分
1.4.1 生姜多糖
生姜多糖是从生姜中提取出的一类水溶性杂多糖,其结构特性涵盖了多个关键要素,这些特性不仅包括了单糖的组成与序列,还涉及糖苷键的分子质量、在多糖中的具体连接位置以及糖苷键的立体构型等[46]。LIAO等[47]研究发现,生姜多糖的分子质量分布范围较宽,介于11.81~1 831.75 kDa,其构成的单糖种类中,葡萄糖(40%~50%)和甘露糖(20%~30%)占主要地位,同时还含有少量的鼠李糖、半乳糖、木糖以及阿拉伯糖。在抗炎反应过程中,巨噬细胞能够特异性地识别甘露糖及半乳糖这2种单糖成分,进而调节炎症反应,激活免疫细胞,发挥抑制炎症反应的作用[48]。汪妮等[49]采用热水浸提-乙醇沉淀法结合Sevag脱蛋白工艺,获得得率为(2.91±0.25)%、总糖含量(43.44±0.99)%的生姜多糖组分,发现该成分在糖尿病模型中能特异性增加Adlercreutzia、Akkermansia和Lactobacillus等有益菌属丰度,同时抑制Prevotella等致病菌增殖,通过调节肠道菌群平衡发挥抗炎作用。ZHENG等[50]发现生姜多糖(经130 ℃亚临界水改性后)在400 μg/mL浓度下能显著促进RAW264.7巨噬细胞增殖,并通过增强吞噬活性及显著提升炎症介质分泌水平发挥免疫调节功能;该活性与130 ℃下多糖链构象适度伸展(半刚性链)及分子质量(7.425×105 g/mol)密切相关,当温度超过130 ℃后活性急剧下降。此外,HOU等[51]发现,生姜多糖能够提高脑缺血再灌注大鼠脑组织中超氧化物歧化酶的活性水平,有效抑制自由基的生成,减轻脑组织损伤,显示出抗氧化与抗炎的协同效应。
1.4.2 生姜糖蛋白
糖蛋白是由低聚糖链与蛋白质通过共价键作用形成的结合蛋白,其糖肽键类型为—O—型连接,单糖组成主要为阿拉伯糖和葡萄糖,且这些糖蛋白组分对DPPH自由基、羟自由基和超氧阴离子自由基均表现出显著的清除能力,并具有一定的还原能力[52],这为生姜糖蛋白抗炎作用的机制研究提供了关键结构依据。陈月皎[53]系统解析了生姜糖蛋白的糖链结构特征及糖基化修饰模式,发现生姜糖蛋白含有10个N-糖基化位点,其中6个位点的肽段序列与原始蛋白具有直接关联,并且通过KEGG通路富集分析发现,保守寡聚高尔基体复合体和拓扑异构酶Ⅱ等与免疫调节密切相关的蛋白可能参与生姜糖蛋白的生物合成过程。冯麟等[54]通过琼脂扩散法和微量肉汤稀释法研究发现,生姜糖蛋白对革兰氏阳性菌(金黄色葡萄球菌)和革兰氏阴性菌(大肠杆菌)均表现出广谱抗菌活性,这种抗菌特性可能通过破坏病原微生物细胞膜完整性或抑制关键代谢酶活性实现,而病原体感染往往与炎症反应相互促进,表明生姜糖蛋白可能通过多靶点发挥抗炎作用。综上所述,生姜糖蛋白的糖基化特性、抗菌活性及其与免疫调控蛋白的关联性,共同构成了其多维度抗炎作用的潜在机制。然而,目前鉴于生姜中糖蛋白含量较低,且相关研究文献相对匮乏,关于其抗炎作用的具体分子机制尚未得到直接阐明。
综上所述,生姜作为天然抗炎资源,其根茎中蕴含丰富的活性成分,主要包括姜辣素类、黄酮类、挥发油、多糖及糖蛋白五大类。姜辣素类以姜酚、姜烯酚和姜油酮为核心,其中姜酚的β-羟基酮结构与烷基链差异赋予其脂溶性及靶向特性,姜烯酚的亲电子羰基增强抗炎强度,姜油酮则因高温转化形成的高稳定性香草基-丙酮结构而备受关注。黄酮类化合物涵盖槲皮素、山柰酚、芦丁及7,8-二羟基黄酮,其C6-C3-C6骨架及邻位羟基修饰强化了免疫调节能力。挥发油由单萜烯(如柠檬醛、α-蒎烯)和倍半萜烯(如α-姜烯、β-倍半水芹烯)组成,萜类骨架的脂溶性与协同效应显著提升抗炎效能。此外,生姜多糖以葡萄糖、甘露糖为主链的杂多糖结构通过菌群调节发挥抗炎作用,而糖蛋白则依赖N-糖基化修饰与寡糖链特性展现广谱抗菌潜力。这些成分通过多维度、多靶点的协同作用,共同构建了生姜独特的抗炎物质基础。
2 抗炎机制
生姜富含多种生物活性成分,这些成分构成了其抗炎作用的坚实基础,它们通过多种机制协同作用,共同发挥抗炎作用。这些机制包括但不限于调控炎症介质的释放、干预炎症信号通路的激活、调节免疫系统细胞的功能,以及维持肠道菌群的平衡等。
2.1 调控炎症介质释放
炎症介质是指在炎症反应中起作用的一系列生物分子,它们包括但不限于细胞因子、趋化因子、补体成分等。促炎细胞因子是炎症介质中的一部分,由免疫细胞和非免疫细胞合成和分泌的小分子多肽类物质,包括IL-1、IL-6和TNF等[55]。生姜中的抗炎活性成分能通过抑制促炎细胞因子的生成,缓解炎症反应(图2)[20,25,55-57]。谢燕飞等[20]发现6-姜酚(5~20 μmol/L)能够通过特异性抑制MAPK信号通路中细胞外调节蛋白激酶1/2、C-Jun氨基末端激酶和p38蛋白的磷酸化,显著降低LPS诱导的RAW264.7细胞炎症反应,使NO释放量减少30.84%、IL-6分泌量降低至(36.42±1.53) ng/mL,并下调IL-6、iNOS、COX-2的mRNA转录水平,该机制为抗炎药物开发提供了新靶点。6-姜酚也能够通过抑制丝氨酸-苏氨酸Akt-MTOR-STAT3信号通路及小胶质细胞的过度激活,进而降低促炎细胞因子IL-1β、IL-6以及诱导性iNOS的表达水平,实现抑制小胶质细胞介导的神经炎症效应[56]。JO等[57]在发现8-姜酚作为对抗滑膜炎的有效分子,对类风湿性关节炎患者和3D滑膜培养系统中TNF-α、IL-1β和IL-17等炎症因子介导的炎症和迁移显示出显著的抑制作用。YOCUM等[25]研究发现在HDM诱导的哮喘小鼠模型中,6-姜烯酚(6.6 mmol/L腹腔注射)显著降低肺组织IL-4水平达51%,体外实验进一步表明,6-姜烯酚(10~25 μmol/L)通过抑制NF-κB信号通路活化减少CD4+ T细胞分泌促炎细胞因子IL-2、TNF-α、干扰素-γ(interferon-gamma, IFN-γ),同时增强cAMP浓度。
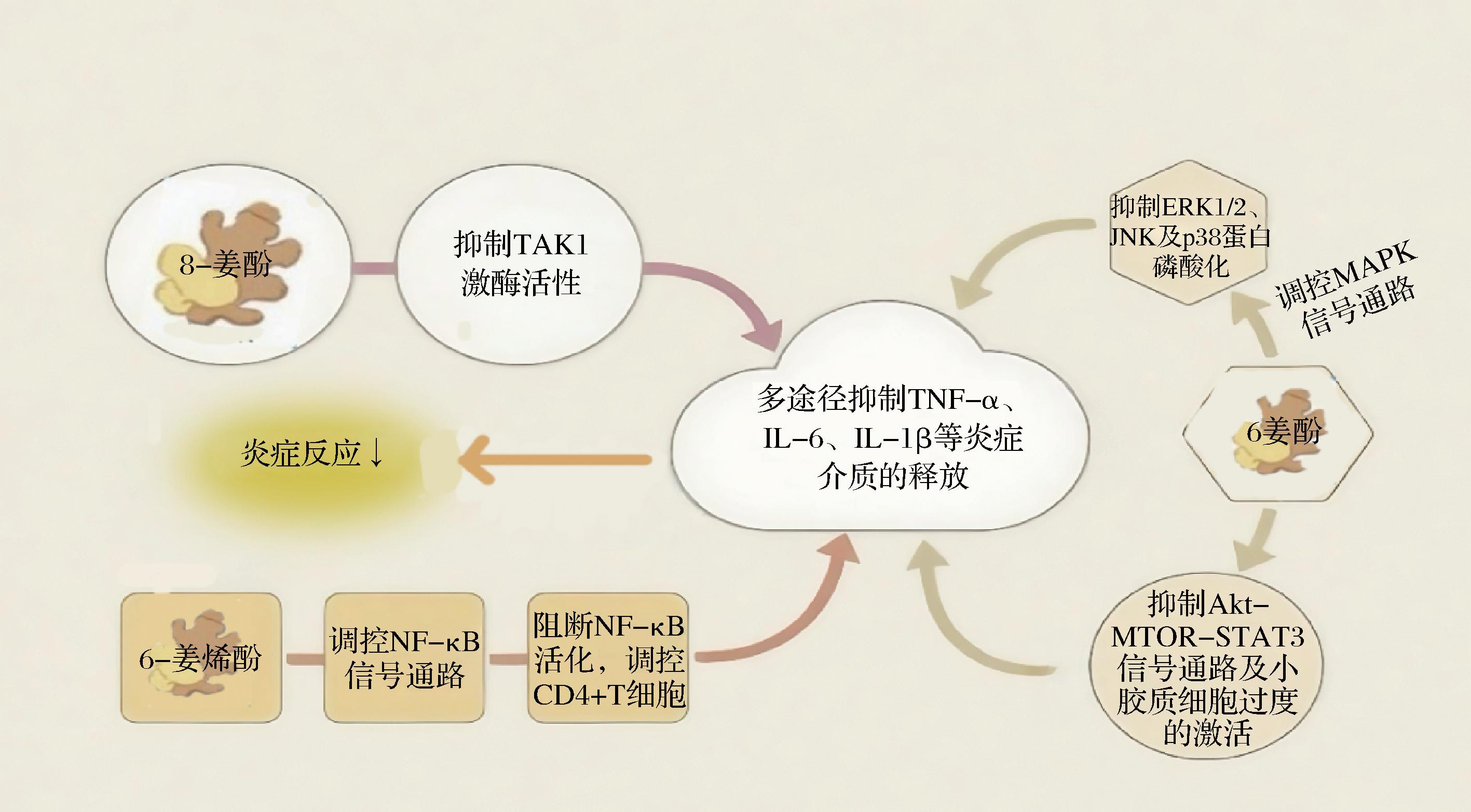
图2 生姜活性成分调控炎症介质释放的作用机制图[20,25,55-57]
Fig.2 Mechanism diagram of ginger active components modulating the release of inflammatory mediators[20,25,55-57]
2.2 调控炎症信号通路
信号传导途径在炎症反应及细胞因子的产生过程中扮演着至关重要的角色,它是一系列酶促反应通路,能够将细胞外的分子信号通过细胞膜传递至细胞内部,进而发挥其生物学效应。
2.2.1 核因子κB(NF-κB)
NF-κB信号传导途径涵盖了受体组件、信号分子、IκB(inhibitor of NF-κB)激酶复合体、IκB蛋白质以及NF-κB二聚体结构,经由一系列有序的分子间相互作用,实现信号的传递与调控。NF-κB家族包括p65、RelB等亚基,其活性受IκB蛋白家族(如IκBα、IκBβ)调控,后者通过结合NF-κB抑制其核转位。该信号通路在免疫和炎症调控中扮演着核心角色,其家族成员和相关蛋白构成了复杂的调控网络。生姜中的活性成分可以通过多种机制干预这一信号通路,从而发挥抗炎作用(图3)[13,20,22,58-60]。姜酚被证实能够通过调控NF-κB信号通路,如上调闭锁小带蛋白-1和紧密连接蛋白-1的表达、抑制蛋白激酶B(Akt)和NF-κB信号通路的激活,减轻炎症反应。10-姜酚能够通过阻断ROS介导的NF-κB通路活化,使促炎细胞因子TNF-α、IL-6及炎症介质COX-2的转录水平下降58%~72%,同时抑制IκBα蛋白降解和p65亚基核转位,最终减少软骨基质破坏并延缓骨关节炎进展。姜烯酚的抗炎作用机制同样与多靶点调控NF-κB信号通路密切相关。QIU等[13]通过构建CCl4诱导的小鼠肝纤维化模型发现20 mg/(kg·d)姜烯酚腹腔注射可有效抑制肝组织内巨噬细胞浸润及NLRP3炎性体活化,其机制涉及抑制IκBα磷酸化及p65核转位,使NF-κB通路关键蛋白表达量降低42%~57%,同时显著下调TNF-α(降低68%)、IL-1β(降低51%)等促炎因子水平,从而减轻肝组织炎症反应及纤维化程度。在血管平滑肌细胞增殖的研究中,陈磊等[58]研究发现,6-姜烯酚能显著下调血管平滑肌细胞(vascular smooth muscle cell,VSMCs)中TLR4的蛋白表达水平(P<0.05),并同时抑制其下游关键炎症信号分子NF-κB的蛋白表达(P<0.05),说明6-姜烯酚可通过下调TLR4/NF-κB通路抑制血管平滑肌细胞增殖。
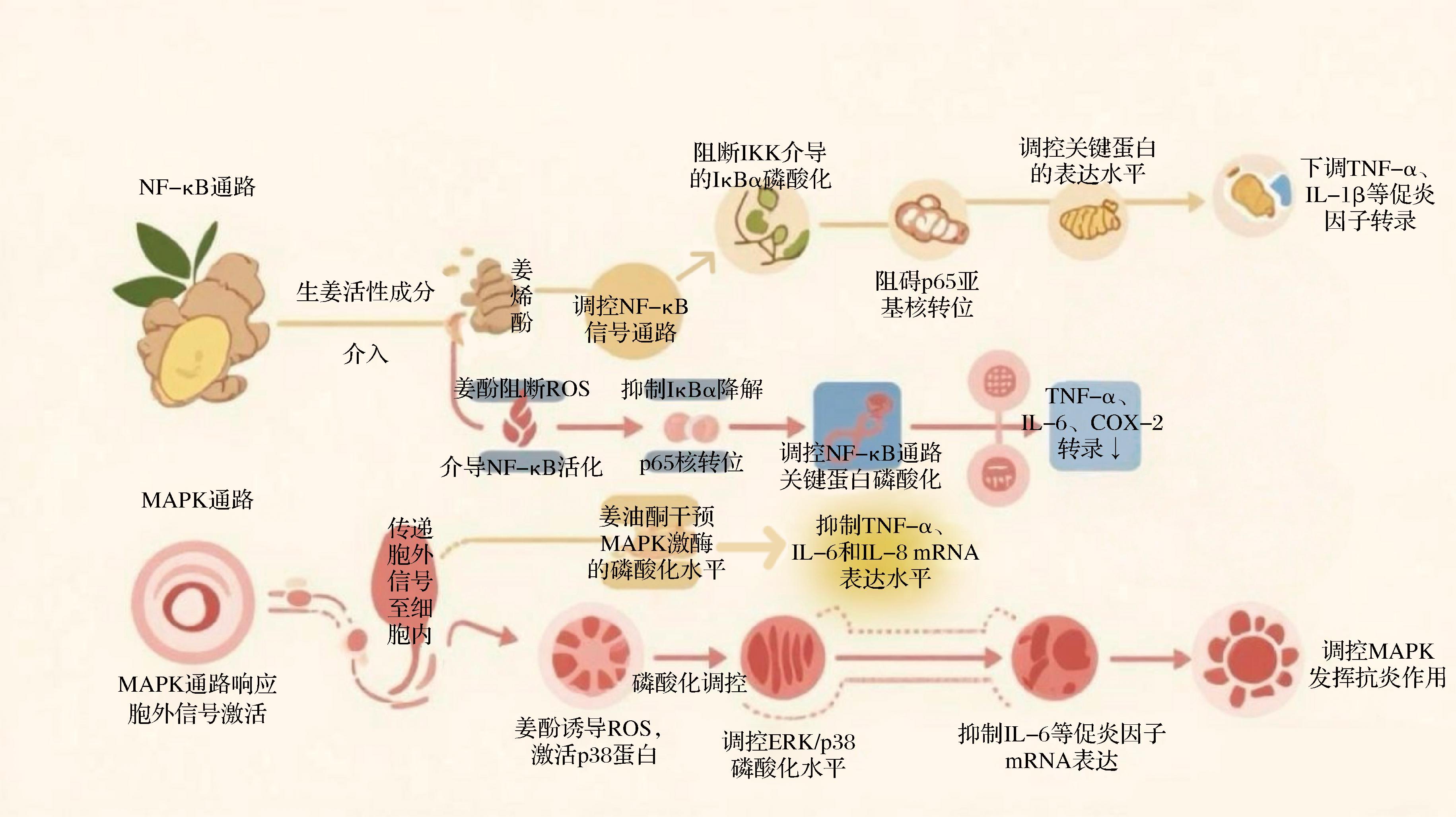
图3 生姜活性成分调控炎症信号通路的作用机制图[13,20,22,58-60]
Fig.3 Mechanism diagram of ginger active components modulating inflammatory signaling pathways[13,20,22,58-60]
2.2.2 丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路
MAPK,一类丝氨酸/苏氨酸蛋白激酶,在哺乳动物体内普遍存在。此类激酶可能响应多种细胞外信号或刺激因素而激活,包括但不限于物理应激、炎症细胞因子、生长因子等。MAPK家族的信号传导途径主要包括ERK、JNK/SAPK、p38MAPK以及ERK5/BMK1等。生姜中的活性成分如姜辣素类、黄酮类在体内能够干预MAPK信号通路,进而影响炎症反应(图3)。姜油酮可降低MAPK信号通路中p38和c-Jun N末端激酶的磷酸化水平,并有效抑制TNF-α、IL-6及IL-8 mRNA的表达水平,此发现为生姜对骨关节炎具有潜在积极药理作用的观点提供了支持[59]。在乳腺癌细胞模型中,杨崇等[60]发现8-姜酚对乳腺癌细胞的抑制作用呈现剂量依赖性特征,经8-姜酚处理72 h后,对MDA-MB-231细胞和人乳腺癌细胞MCF-7的IC50值分别为(22.06±2.93) μmol/L和(35.77±5.96) μmol/L,其分子机制涉及诱导细胞内活性氧的产生,进而激活MAPK信号通路中的P38蛋白;同时,Western blot分析显示,8-姜酚处理显著上调了P38的磷酸化水平。谢燕飞等[20]发现经50 μmol/L 6-姜酚预处理后,LPS诱导的RAW264.7细胞炎症模型组的磷酸化ERK、JNK和p38的蛋白表达比率分别下降至对照组的63.4%、32.5%和40%,进一步机制研究揭示,6-姜酚可通过抑制MAPK通路(ERK/JNK/p38磷酸化),降低COX-2和iNOS等炎症介质的转录活性,这种多靶点调控特性为开发新型抗炎药物提供了理论支持。
2.3 调节免疫系统细胞
2.3.1 对中性粒细胞的作用
中性粒细胞作为先天免疫系统的吞噬细胞,能够通过释放中性粒细胞胞外陷阱(neutrophil extracellular trap,NETs)来捕获和杀死病原体,在清除人体感染因子和细胞碎片中起着重要作用。但NETs的过度形成也会导致炎症和组织损伤。姜辣素类化合物在调节中性粒细胞功能方面展现出显著潜力,具体表现为对NETs相关过程的抑制作用(图4)。ALI等[61]证明了6-姜辣素、8-姜辣素和10-姜辣素能降低与NETs相关的髓过氧化物酶(myeloperoxidase,MPO)水平,缓和中性粒细胞对LPS、豆蔻酰佛波醇乙酯及系统性红斑狼疮相关刺激的反应,且这3种姜辣素均可抑制中性粒细胞内H2O2的生成,并通过减少活性氧生成来降低NETosis形成。此外,6-姜辣素还具备降低PDE4活性的能力,通过调节cAMP水平和增加cAMP依赖性蛋白激酶A的水平,在几乎所有炎症细胞中发挥显著的抗炎作用[62]。ZHU等[63]通过建立脓毒症小鼠模型,发现姜油酮能够通过激活Nrf2信号通路,抑制活性氧的产生,进而调节中性粒细胞的活性,显著抑制NETs的形成,减轻炎症反应。
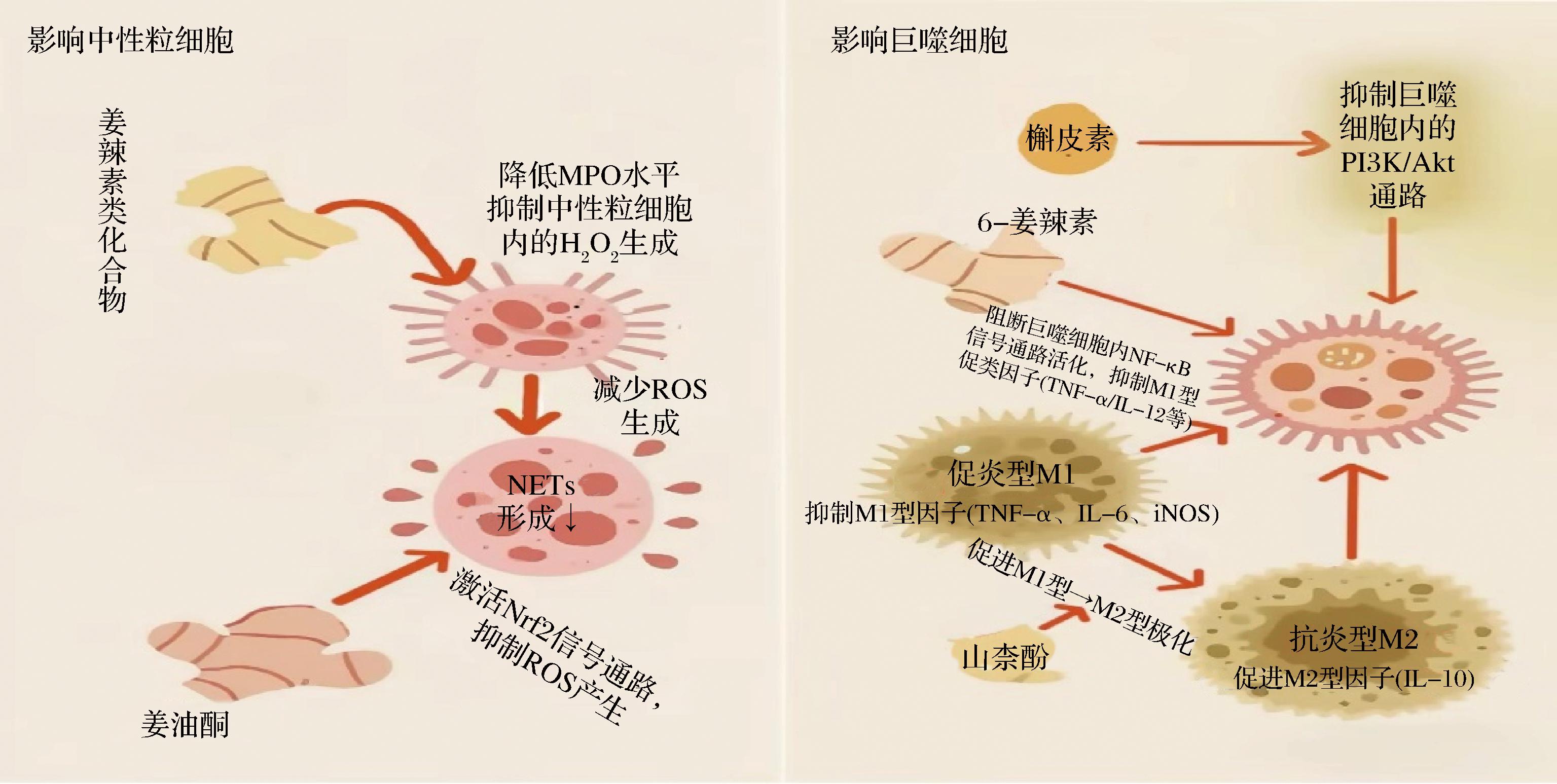
图4 生姜活性成分调节免疫系统细胞的作用机制图[61-66]
Fig.4 Mechanism diagram of ginger active components regulating immune cells[61-66]
2.3.2 对巨噬细胞的影响
巨噬细胞作为抵御病原体入侵的第一道防线,是具有高度可塑性的免疫细胞,分为促炎的M1型和抗炎的M2型。M1型巨噬细胞在感染初期迅速增殖,产生促炎介质导致损伤;而M2型巨噬细胞则在炎症的后期阶段发挥着关键作用,它们能够释放出一系列抗炎因子和生长因子,有效促进组织的修复,进而保护机体。生姜中的姜辣素类成分对巨噬细胞极化具有双向调节作用(图4)[61-66]。在LPS诱导的小鼠腹膜巨噬细胞模型中,6-姜辣素通过阻断NF-κB信号通路的活化,显著抑制了巨噬细胞分泌促炎细胞因子TNF-α、IL-1β、IL-12和受激活调节正常T细胞表达和分泌因子(regulated upon activation normal T cell expressed and secreted,RANTES),且不影响巨噬细胞表面共刺激分子B7.1 (CD80)、B7.2 (CD86) 和主要组织相容性复合体Ⅱ类分子(major histocompatibility complex,MHC Ⅱ)的LPS诱导表达,也不影响巨噬细胞的抗原提呈功能,这些结果表明,6-姜辣素选择性地抑制巨噬细胞的促炎反应,同时保留其关键的免疫激活功能,为治疗炎症提供了潜在机制[64]。罗小志等[65]研究发现,山柰酚可作用于TNF、IL-6、IL-10、BCL2-Associated X的蛋白质、B淋巴细胞瘤-2基因等18个核心靶点,显著抑制M1型巨噬细胞极化相关促炎因子TNF-α、IL-6及iNOS的基因与蛋白表达(P<0.05),同时促进M2型巨噬细胞极化相关抗炎因子IL-10的表达(P<0.05);KEGG富集分析进一步表明,山奈酚通过调控TNF信号通路介导巨噬细胞从促炎性M1型向抗炎性M2型极化,从而减轻心肌缺血再灌注损伤。此外,ZHANG等[66]研究证实,槲皮素(20 μmol/L)预处理能显著抑制LPS诱导的RAW264.7细胞中TNF-α、IL-6及IL-1β的mRNA表达、蛋白分泌及释放,其核心抗炎机制在于槲皮素能有效抑制Akt的磷酸化,从而调控巨噬细胞内PI3K/Akt信号通路的活性,并通过分子对接实验显示,槲皮素能特异性结合巨噬细胞关键靶点Akt1的活性位点,为其治疗炎症性疾病提供了新的机制依据。
2.4 调节肠道菌群
在正常生理状态下,机体内的肠道菌群处于一种动态平衡的状态,保护肠道免受有害菌的侵袭及定植;然而,一旦这种稳态被打破,菌群的数量和比例就会出现失调现象,导致原籍细菌数量减少及菌群结构变化,使肠道天然屏障作用逐渐减弱,导致细胞和机体受损,并诱发炎症反应[67]。生姜中的姜辣素类化合物、黄酮类、生姜多糖等活性成分能够通过正向调节菌群,显著改善肠道菌群的组成和多样性,有效地维持机体内部环境的稳定状态(图5)[49,67-68]。在结肠炎模型小鼠中,生姜多糖显著降低了结肠炎小鼠体内致病菌如变形菌门和厚壁菌门的相对丰度,同时增加了有益菌如鼠李糖乳杆菌等的相对丰度,在一定程度恢复了结肠炎小鼠肠道菌群的失调,改变肠道菌群的比例结构,确保肠道菌群的平衡状态,进而减轻结肠炎的病症[68]。而在糖尿病小鼠模型中,16S rRNA高通量测序结果显示,生姜多糖能够显著增加糖尿病小鼠肠道内有益菌如阿德勒克氏菌属(Adlercreutzia)、阿克曼氏菌属(Akkermansia)和乳酸杆菌属(Lactobacillus)的相对丰度,同时降低有害菌如普雷沃氏菌属(Prevotella)的丰度,这种调节作用有助于恢复肠道菌群的平衡,改善糖尿病小鼠的肠道微环境,进而减轻炎症反应,改善糖尿病小鼠的代谢紊乱[49]。CHEN等[69]的研究则进一步揭示了生姜中6-姜酚对肠道菌群的调节机制,他们发现生姜泻心汤中的活性成分6-姜酚能够通过增加疣微菌门的相对丰度,降低弯曲杆菌门和梭杆菌门的相对丰度,正向调节肠道菌群的结构和多样性,从而显著改善了DSS诱导的溃疡性结肠炎。
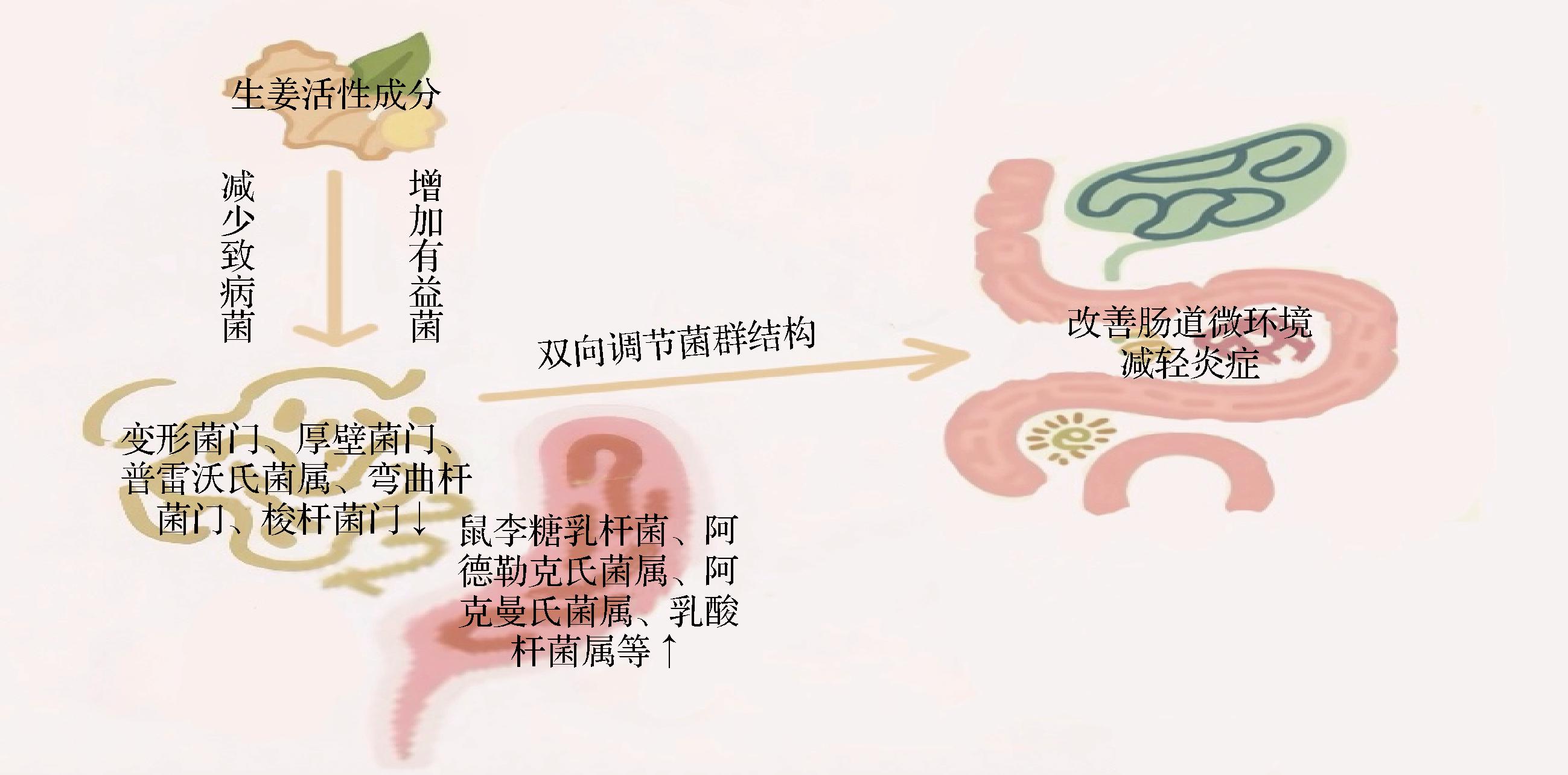
图5 生姜活性成分调节肠道菌群的作用机制图[49,67-69]
Fig.5 Mechanism of ginger active components in modulating gut microbiota[49,67-69]
生姜抗炎活性成分通过多靶点调控与通路协同作用,呈现显著的抗炎效应,其主要活性成分的抗炎特性及作用机制汇总内容见表1。其核心机制包括:(1)抑制促炎介质释放,如姜酚类成分通过阻断NF-κB核转位降低IL-6、TNF-α等细胞因子表达,黄酮类成分通过调控JAK/STAT和MAPK通路实现促炎/抗炎介质平衡;(2)干预关键信号通路,包括抑制NF-κB通路的IκBα磷酸化降解和p65核转位,以及调节MAPK通路中ERK、JNK、p38的磷酸化水平,从转录源头遏制炎症级联反应;(3)调节免疫细胞功能,如抑制中性粒细胞NETosis形成,调控巨噬细胞M1/M2极化,并通过抑制TLR4/MyD88信号轴降低促炎因子分泌;(4)重塑肠道菌群稳态,通过增加有益菌丰度、抑制致病菌增殖改善肠道微环境。这些多维度机制协同作用,为开发基于生姜活性成分的精准抗炎药物提供了科学依据。
表1 生姜主要活性成分抗炎特性及作用机制汇总表
Table 1 Summary of anti-inflammatory properties and mechanism of action of the main active ingredients of ginger
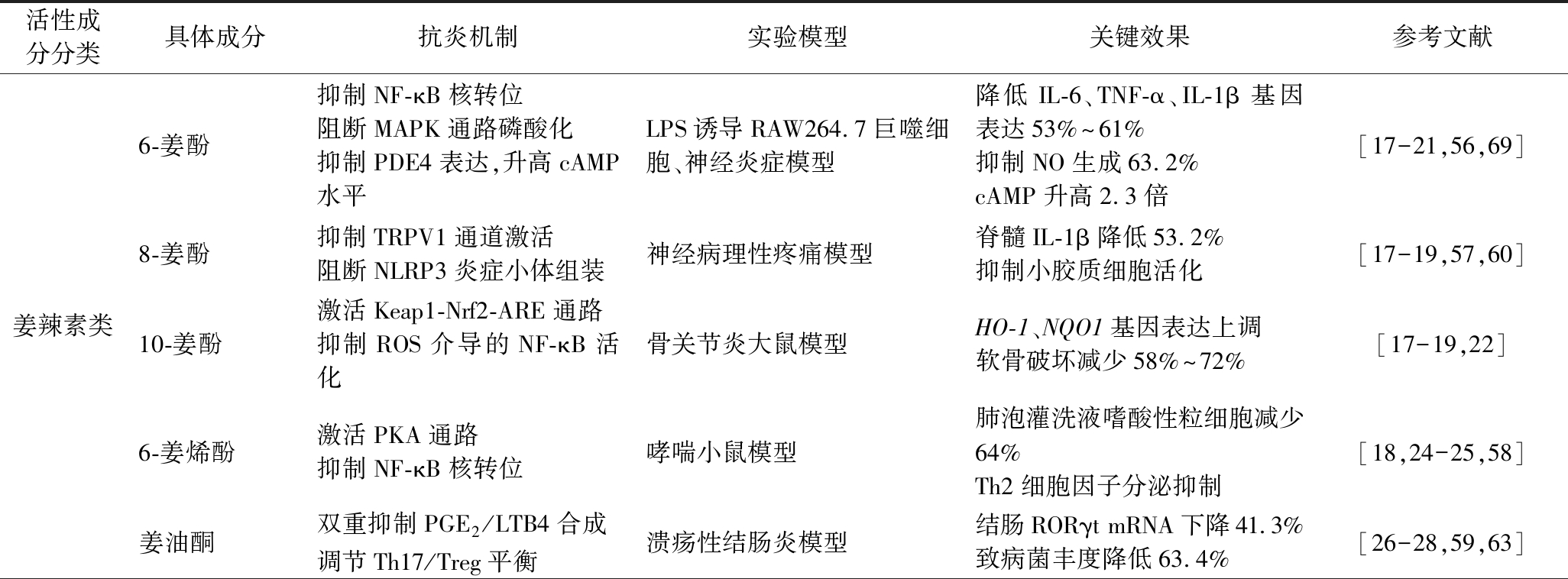
活性成分分类具体成分抗炎机制实验模型关键效果参考文献姜辣素类6-姜酚抑制NF-κB核转位阻断MAPK通路磷酸化抑制PDE4表达,升高cAMP水平LPS诱导RAW264.7巨噬细胞、神经炎症模型降低IL-6、TNF-α、IL-1β基因表达53%~61%抑制NO生成63.2%cAMP升高2.3倍[17-21,56,69]8-姜酚抑制TRPV1通道激活阻断NLRP3炎症小体组装神经病理性疼痛模型脊髓IL-1β降低53.2%抑制小胶质细胞活化[17-19,57,60]10-姜酚激活Keap1-Nrf2-ARE通路抑制ROS介导的NF-κB活化骨关节炎大鼠模型HO-1、NQO1基因表达上调软骨破坏减少58%~72%[17-19,22]6-姜烯酚激活PKA通路抑制NF-κB核转位哮喘小鼠模型肺泡灌洗液嗜酸性粒细胞减少64%Th2细胞因子分泌抑制[18,24-25,58]姜油酮双重抑制PGE2/LTB4合成调节Th17/Treg平衡溃疡性结肠炎模型结肠RORγt mRNA下降41.3%致病菌丰度降低63.4%[26-28,59,63]
续表1

活性成分分类具体成分抗炎机制实验模型关键效果参考文献黄酮类槲皮素抑制iNOS/COX-2表达促进巨噬细胞M2极化LPS诱导RAW264.7细胞、关节炎模型IL-6/TNF-α分泌减少关节肿胀度降低26%[30-31,66]山柰酚双向调控JAK/STAT与NF-κB通路LPS炎症模型IL-6/IL-1β mRNA降低48.9%~45.6%[32,65]芦丁抑制p38 MAPK磷酸化阻断TGF-β/Smad信号脊髓损伤模型IL-1β/TNF-α表达下降54%~62%脊髓坏死面积减少[33-35]7,8-二羟基黄酮抑制TLR4/MyD88复合物阻断ERK/JNK/p38磷酸化BV2小胶质细胞模型NO生成减少68.3%(IC50=15.2 μmol/L)iNOS/COX-2蛋白降低58%~61%[36-37]挥发油柠檬醛α,β-不饱和醛基结构介导急性炎症动物模型IL-6/TNF-α抑制率62.3%/58.9%足肿胀抑制优于吲哚美辛[39]α-蒎烯桥环结构增强膜穿透性LPS诱导RAW264.7细胞NO/PGE2减少58.4%/49.6%(10~50 μmol/L)[40]α-姜烯双环骨架抑制血管生成慢性炎症模型新生血管密度降低42%~58%(logP=4.2)[41-42]β-倍半水芹烯阻断STAT3磷酸化LPS诱导巨噬细胞NO抑制率72.4%(10 μmol/L)[41,43]多糖类生姜多糖调节肠道菌群平衡抑制TLR4/NF-κB通路糖尿病小鼠模型DSS结肠炎模型有益菌丰度提高2.1倍促炎因子mRNA降低50%~60%[49-51,68]糖蛋白类生姜糖蛋白N-糖基化修饰调控免疫广谱抗菌活性体外抗菌试验金黄色葡萄球菌/大肠杆菌抑制潜在抗炎靶点预测[53-54]
3 生姜抗炎活性成分在炎症性疾病方面的应用
3.1 关节炎
关节炎是指由炎症、感染、创伤或其他因素引起的关节炎性病变,其病理在于关节骨骼受损,伴随滑膜持续性发炎,进而引发关节疼痛、肿胀以及僵硬等症状。近年来,生姜活性成分在关节炎治疗中的作用受到广泛关注,相关研究为开发新型抗炎药物提供了重要依据。JO等[57]基于佐剂诱导关节炎大鼠模型证实,8-姜酚可显著改善关节炎病症:经8-姜酚干预后,模型大鼠关节肿胀度下降达40%,步态异常改善率超过65%,有效缓解了关节活动障碍;同时,关节滑膜增生与软骨破坏等炎症引发的病理损伤被显著逆转,关节组织的炎症状态得到有效控制。HEIDARI-BENI等[70]开展的随机双盲试验证实,含生姜活性成分的复方制剂在治疗慢性膝骨关节炎中展现出显著的抗炎作用,该研究通过测量关键炎症介质PGE2水平评估效果,发现经过4周干预,含生姜的复方制剂组(每日摄入姜辣素15 mg)与萘普生药物组均能显著降低患者血清PGE2水平(P<0.001),且2组间降幅无统计学差异(P=0.112),提示该制剂降低PGE2的效果与合成抗炎药萘普生相当,且可能具有更好的安全性特征。在临床应用层面,BAEK等[71]纳入100例符合Kellgren-Lawrence分级Ⅰ-Ⅱ标准的轻度膝骨关节炎患者,将其随机分为干预组(每日口服含30%蒸姜提取物GGE03的胶囊1.6 g,相当于0.48 g提取物)和安慰剂组,持续干预12周后,干预组(n=49)疼痛VAS评分较基线显著降低(15.20±5.86) mm(P<0.000 1),优于安慰剂组的(3.19±5.56) mm;WOMAC总分改善(10.00±5.24)分(P<0.000 1),患者整体评估显示,干预组症状改善程度显著优于安慰剂组,且无药物相关不良事件报告;研究证实蒸姜提取物(含1.15 mg/g标准化1-脱氢-6-姜烯二酮)可安全有效改善骨关节炎症状。
3.2 溃疡性结肠炎
肠道微生物群落与自身免疫系统的失调,往往容易诱发炎症性肠病的发生,溃疡性结肠炎是一种慢性非特异性结肠疾病,其主要临床表现包括腹痛、腹泻以及黏液脓血便等症状[72]。近年来研究发现,生姜中蕴含的多种抗炎活性成分在结肠炎的治疗中展现出潜在价值,为探索结肠炎的天然药物治疗路径提供了新思路。CHEN等[69]在DSS诱导的结肠炎小鼠模型中通过给予6-姜酚干预,发现6-姜酚能够通过增强肠道屏障功能,降低肠道通透性,并增加紧密连接蛋白和黏蛋白的表达,抑制了结肠炎小鼠体重的减少和便血情况,降低了DAI评分,进而能够显著抑制结肠炎小鼠的炎症反应,有效修复受损的肠道屏障,为结肠炎的治疗提供了新的潜在策略。李敬等[28]发现姜酮可通过抑制RORγt/IL-17A通路降低辅助性T淋巴细胞17(T-helper 17,Th17)细胞异常活化,同时促进调节性T细胞在结肠部位的免疫调节功能,从而重塑Th17/Treg免疫平衡,发挥治疗小鼠溃疡性结肠炎作用。LIANG等[73]发现姜烯酮A能够通过靶向IL-17RA信号通路抑制炎症反应,并恢复肠道屏障功能,从而有效缓解结肠炎;在DSS诱导的结肠炎小鼠模型中,姜烯酮A能够显著降低结肠组织中促炎细胞因子IL-1β、IL-6、TNF-α、IL-17和MPO的水平,同时抑制血清中这些促炎细胞因子的表达。
3.3 呼吸道炎症
呼吸道炎症是指由感染、过敏、环境刺激或其他因素引起的呼吸道组织的炎症反应,可以分为急性和慢性2种类型,常见的疾病包括哮喘、支气管炎和过敏性鼻炎等。生姜抗炎活性成分可通过多靶点调控炎症信号通路、抑制促炎因子释放、改善气道高反应性及氧化应激,从而对哮喘、过敏性鼻炎等呼吸道炎症发挥治疗作用。在哮喘病治疗方面,YOCUM等[25]发现长期给予6-姜烯酚可有效缓解屋尘螨抗原诱导的小鼠肺部炎症反应,改善因哮喘引发的气道功能异常,并有效减少肺组织中的炎症细胞浸润、缓解支气管和肺泡的水肿及损伤,且其治疗效果与传统抗哮喘药物作用方向一致,但来源于天然植物特性使其具有更好的安全性优势。ZHANG等[74]通过液相色谱-质谱联用技术分析发现,哮喘患者口服生姜提取物(含6-姜酚15 mg)后,其血浆中6-姜酚及其代谢产物的峰值浓度分别达到2.3 μmol/L和5.7 μmol/L,生物利用度较健康人群提高22%,进一步证实了姜酚类化合物能够抑制COX-2活性减少PGE2生成,并降低支气管肺泡灌洗液中中性粒细胞浸润数量,提示姜酚及其代谢物在哮喘患者中具有稳定的抗炎药效。VAGHELA等[75]发现5%姜辣素水提物(350~700 mg/kg)可显著延长组胺诱导的豚鼠预惊厥时间(PCT),其中高剂量组(700 mg/kg)PCT从(73.1±3.3) s提升至(119.5±29.9) s;与福莫特罗+布地奈德联用时,低剂量生姜组(350 mg/kg)保护率达(73.27±3.08)%,表明其抗炎活性成分可通过抑制气道平滑肌痉挛及炎症反应,作为哮喘辅助治疗降低气道高反应性。YAMPRASERT等[76]开展双盲随机对照试验,纳入80例中-重度过敏性鼻炎患者,随机分为口服生姜提取物组(含6-姜酚71.13 mg/g与6-姜烯酚19.65 mg/g,每日剂量500 mg)和氯雷他定组(10 mg/d),干预6周后评估疗效,结果发现生姜组TNSS评分较基线显著降低(7.48→3.42,降幅54.3%),与氯雷他定组(7.38→4.11,降幅44.3%)无统计学差异(P=0.276);且生姜组通过稳定肥大细胞膜抑制炎症介质释放,显著增加鼻腔容积;安全性方面,生姜组不良反应以嗳气(72.22%)为主,显著低于氯雷他定组的嗜睡(25%)等全身性副作用。
3.4 心血管炎症
心血管疾病是全球范围内的主要致死病因之一,其发病机制复杂,涉及炎症、氧化应激、脂质代谢紊乱等多种因素。生姜抗炎活性成分在心血管炎症调节中的作用逐渐成为研究热点,相关研究为开发新型心血管保护药物提供了重要科学依据。HAN等[77]研究发现,10-姜酚预处理的大鼠心肌梗死面积显著减小,心功能改善,心肌组织病理变化减轻,这表明10-姜酚能够显著改善心肌缺血再灌注损伤,其作用机制涉及激活JAK2/STAT3信号通路,抑制L型钙通道,同时调节心肌细胞内Ca2+稳态,改善心肌细胞的能量代谢和电生理功能,进而减轻缺血导致的心肌细胞凋亡和炎症浸润。这一研究揭示了10-姜酚通过双重机制(信号通路调节与离子稳态调控)在心肌缺血损伤中发挥抗炎及保护作用,为心肌缺血的治疗提供了新的靶点。PANYOD等[78]通过构建ApoE-/-小鼠模型,证实了生姜精油及其成分柠檬醛对动脉粥样硬化具有显著的改善效应,结果显示,生姜精油和香茅醛处理组小鼠的主动脉斑块发生率显著降低,血浆胆固醇、高密度脂蛋白胆固醇和低密度脂蛋白胆固醇水平显著下降,血糖稳态和胰岛素抵抗得到改善;此外,实验组还能降低氧化三甲胺水平,同时重塑肠道菌群组成,促进有益菌增殖并抑制有害菌过度生长,减轻血管内皮炎症反应,减缓动脉粥样斑块的形成与发展。该研究首次明确了生姜活性成分通过“肠道菌群-代谢产物-血管炎症”轴调节动脉粥样硬化的机制,为从肠道微生态角度防治心血管疾病开辟了新思路。
生姜及其活性成分在炎症性疾病的临床治疗中展现出显著疗效和广泛适用性。针对关节炎,多项随机对照试验证实,生姜制剂可使骨关节炎患者疼痛评分降低30%以上,疗效与传统非甾体抗炎药相当且胃肠副作用更少。在溃疡性结肠炎治疗中,动物和临床研究显示生姜成分能有效修复肠道屏障、降低疾病活动指数达40%,并通过调节免疫平衡缓解黏膜损伤。对于哮喘和过敏性鼻炎等呼吸道炎症,生姜提取物可使气道阻力下降超60%,鼻部症状改善率接近50%,其效果与常规药物相当但耐受性更优。在心血管领域,生姜活性成分能减少动脉粥样硬化斑块形成超50%,并显著缩小心肌梗死面积。现有证据表明,生姜通过多靶点抗炎作用在关节炎、肠道疾病、呼吸道及心血管炎症中实现症状缓解与组织修复,其天然来源特性及良好的安全性为炎症性疾病的综合管理提供了创新治疗策略。
4 结语
生姜作为“药食同源”的典型植物,蕴含姜辣素类、黄酮类、挥发油、多糖及糖蛋白等多种活性成分,通过调控炎症信号通路、重塑免疫细胞功能、调节肠道菌群稳态及抑制促炎介质释放等多维度机制,构建了独特的抗炎效应网络。现有研究已证实,其在关节炎、溃疡性结肠炎、呼吸道炎症及心血管炎症等疾病模型中展现出显著治疗潜力,且天然来源特性赋予其安全性优势,为炎症性疾病的防治提供了创新思路。
然而,当前研究仍存在关键挑战,活性成分层面,生姜中的抗炎活性成分的研究较为分散,各组分间协同作用机制尚未完全阐明;机制研究层面,部分通路(如JAK/STAT、TLR4/MyD88)在不同炎症微环境中的特异性调控机制仍需细化,且跨器官炎症联动效应的研究不足;转化应用层面,临床研究多基于粗提物,缺乏针对单一成分的剂量-效应关系分析,且长期毒性数据有限。未来研究可聚焦以下方向,利用代谢组学、蛋白组学等多组学技术,解析活性成分间的协同作用网络,明确“多成分-多靶点”的动态调控模式;结合基因编辑技术(如CRISPR-Cas9)构建炎症模型,精准定位关键作用靶点,阐释成分-靶点-通路的层级调控机制;开展高质量临床研究,尤其是针对特定炎症性疾病的随机双盲试验,验证生姜提取物的有效性与安全性,并探索其与现有抗炎药物的联合应用潜力。此外,基于肠道菌群-炎症轴的机制研究,有望为生姜活性成分的精准递送与剂型开发提供新策略。
[1] SOLIER S, MÜLLER S, CA EQUE T, et al.A druggable copper-signalling pathway that drives inflammation[J].Nature, 2023, 617(7960):386-394.
EQUE T, et al.A druggable copper-signalling pathway that drives inflammation[J].Nature, 2023, 617(7960):386-394.
[2] STANKE-LABESQUE F, GAUTIER-VEYRET E, CHHUN S, et al.Inflammation is a major regulator of drug metabolizing enzymes and transporters:Consequences for the personalization of drug treatment[J].Pharmacology &Therapeutics, 2020, 215:107627.
[3] LAN L, HUANG C X, LIU D Q, et al.WNT2B activates macrophages via NF-κB signaling pathway in inflammatory bowel disease[J].FASEB Journal, 2024, 38(6):e23551.
[4] HE W J, TANG M, GU R F, et al.The role of p53 in regulating chronic inflammation and PANoptosis in diabetic wounds[J].Aging and Disease, 2024, 16(1):373-393.
[5] ZHOU S R, ZHAO G Y, CHEN R, et al.Lymphatic vessels:Roles and potential therapeutic intervention in rheumatoid arthritis and osteoarthritis[J].Theranostics, 2024, 14(1):265-282.
[6] 韦忠娜,邹弢,邱智,等.非甾体抗炎药不良反应报告43例分析[J].临床合理用药, 2023, 16(24):158-160.WEI Z N, ZOU T, QIU Z, et al.Analysis of 43 cases of adverse reactions to nonsteroidal anti-inflammatory drugs[J].Chinese Journal of Clinical Rational Drug Use, 2023, 16(24):158-160.
[7] 杨璐, 邹清梅.糖皮质激素在临床应用中的不良反应及预防策略[J].世界临床药物, 2024, 45(5):449-453.YANG L, ZOU Q M.Adverse reactions and prevention strategies of glucocorticoids in clinical application[J].World Clinical Drug, 2024, 45(5):449-453.
[8] ALLEGRA M.Antioxidant and anti-inflammatory properties of plants extract[J].Antioxidants, 2019, 8(11):549.
[9] 王海平, 宋江萍, 张晓辉, 等.姜蒜种质资源研究现状及发展建议[J].植物遗传资源学报, 2022, 23(5):1233-1240.WANG H P, SONG J P, ZHANG X H, et al.Research status and development suggestions for ginger and garlic germplasm resources[J].Journal of Plant Genetic Resources, 2022, 23(5):1233-1240.
[10] ZHANG M M, ZHAO R, WANG D, et al.Ginger (Zingiber officinale Rosc.) and its bioactive components are potential resources for health beneficial agents[J].Phytotherapy Research, 2021, 35(2):711-742.
[11] 国家药典委员会.中华人民共和国药典:一部[M].2020年版.北京:中国医药科技出版社,2020:104.National Pharmacopoeia Commission.Pharmacopoeia of the People’s Republic of China:Part I [M].2020 edition.Beijing:China Medical Science and Technology Press, 2020:104.
[12] 王欢欢, 孔巧丽, 郭琴, 等.生姜的古代文献沿革分析及现代药理研究进展[J].中药新药与临床药理, 2021, 32(10):1582-1590.WANG H H, KONG Q L, GUO Q, et al.Analysis of ancient documents and research progress in modern pharmacology of ginger[J].Traditional Chinese Drug Research and Clinical Pharmacology, 2021, 32(10):1582-1590.
[13] QIU J L, CHAI Y N, DUAN F Y, et al.6-Shogaol alleviates CCl4-induced liver fibrosis by attenuating inflammatory response in mice through the NF-κB pathway[J].Acta Biochimica Polonica, 2022, 69(2):363-370.
[14] ZHU Y J, WANG C Y, LUO J J, et al.The protective role of Zingerone in a murine asthma model via activation of the AMPK/Nrf2/HO-1 pathway[J].Food &Function, 2021, 12(7):3120-3131.
[15] P ZM
ZM NDI K, SZÖLLÖSI A G, FEKETE T.The “root” causes behind the anti-inflammatory actions of ginger compounds in immune cells[J].Frontiers in Immunology, 2024, 15:1400956.
NDI K, SZÖLLÖSI A G, FEKETE T.The “root” causes behind the anti-inflammatory actions of ginger compounds in immune cells[J].Frontiers in Immunology, 2024, 15:1400956.
[16] LIU Y, LIU J C, ZHANG Y Q.Research progress on chemical constituents of Zingiber officinale Roscoe[J].BioMed Research International, 2019, 2019(1):5370823.
[17] SEMWAL R B, SEMWAL D K, COMBRINCK S, et al.Gingerols and shogaols:Important nutraceutical principles from ginger[J].Phytochemistry, 2015, 117:554-568.
[18] MAGHRABY Y R, LABIB R M, SOBEH M, et al.Gingerols and shogaols:A multi-faceted review of their extraction, formulation, and analysis in drugs and biofluids to maximize their nutraceutical and pharmaceutical applications[J].Food Chemistry:X, 2023, 20:100947.
[19] KOU X R, WANG X Q, JI R Y, et al.Occurrence, biological activity and metabolism of 6-shogaol[J].Food &Function, 2018, 9(3):1310-1327.
[20] 谢燕飞, 王冉, 朱金华, 等.6-姜酚对脂多糖致RAW264.7细胞炎症模型的作用及机制研究[J].中药药理与临床, 2021, 37(3):72-75.XIE Y F, WANG R, ZHU J H, et al.Anti-inflammatory effect of 6-gingerol on LPS-induced RAW264.7 cells and its mechanism[J].Pharmacology and Clinics of Chinese Materia Medica, 2021, 37(3):72-75.
[21] 李冰.生姜挥发油成分分析及其主要活性成分6-姜酚的抗炎机制初步探究[D].沈阳:中国医科大学, 2019.LI B.Studies on the chemical composition of the essential oil from Ginger and the anti-inflammatory mechanisms of Its main active component6-Gingerol[D].Shenyang:China Medical University, 2019.
[22] 孙晨皓.10-姜酚通过Keap1-Nrf2-ARE信号通路延缓骨关节炎进展的研究[D].扬州:扬州大学, 2023.SUN C H.Study on 10-gingerol delaying the progression of osteoarthritis through Keap1-Nrf2-ARE signal pathway[D].Yangzhou:Yangzhou University, 2023.
[23] 凌金颖.8-姜酚对神经病理性疼痛的镇痛作用及机制初探[D].南京:南京中医药大学,2022.LING J Y.Study on the effect and mechanism of 8-shogaol on neuropathic pain[D].Nanjing:Nanjing University of Chinese Medicine, 2022.
[24] PAN M H, HSIEH M C, HSU P C, et al.6-Shogaol suppressed lipopolysaccharide-induced up-expression of iNOS and COX-2 in murine macrophages[J].Molecular Nutrition &Food Research, 2008, 52(12):1467-1477.
[25] YOCUM G T, HWANG J J, MIKAMI M, et al.Ginger and its bioactive component 6-shogaol mitigate lung inflammation in a murine asthma model[J].American Journal of Physiology.Lung Cellular and Molecular Physiology, 2020, 318(2):L296-L303.
[26] RAJAN I, NARAYANAN N, RABINDRAN R, et al.Zingerone protects against stannous chloride-induced and hydrogen peroxide-induced oxidative DNA damage in vitro[J].Biological Trace Element Research, 2013, 155(3):455-459.
[27] KABUTO H, NISHIZAWA M, TADA M K, et al.Zingerone [4-(4-hydroxy-3-methoxyphenyl)-2-butanone] prevents 6-hydroxydopamine-induced dopamine depression in mouse striatum and increases superoxide scavenging activity in serum[J].Neurochemical Research, 2005, 30(3):325-332.
[28] 李敬, 罗娅, 张晟伟, 等.姜酮缓解葡聚糖硫酸钠盐诱导小鼠结肠炎的作用机制研究[J].陆军军医大学学报, 2023, 45(6):519-529.LI J, LUO Y, ZHANG S W, et al.Mechanism of zingerone alleviating colitis induced by dextran sodium sulfate in mice[J].Journal of Army Medical University, 2023, 45(6):519-529.
[29] ZHANG Z J, CAO M Z, SHANG Z X, et al.Research progress on the antibacterial activity of natural flavonoids[J].Antibiotics, 2025, 14(4):334.
[30] TSAI C F, CHEN G W, CHEN Y C, et al.Regulatory effects of quercetin on M1/M2 macrophage polarization and oxidative/antioxidative balance[J].Nutrients, 2022, 14(1):67.
[31] SHEN P, LIN W J, BA X, et al.Quercetin-mediated SIRT1 activation attenuates collagen-induced mice arthritis[J].Journal of Ethnopharmacology, 2021, 279:114213.
[32] 卯明艳,杨时骐,王高强,等.基于网络药理学探讨槲皮素联合山柰酚治疗DPN的作用机制[J].牡丹江医学院学报, 2023, 44(2):44-49.MAO M Y, YANG S Q, WANG G Q, et al.Explore the mechanism of quercetin combined with kaempferol in the treatment of DPN based on Network pharmacology[J].Journal of Mudanjiang Medical University, 2023, 44(2):44-49.
[33] DE TOLLENAERE M, DURDURET A, CHAPUIS E, et al.A highly soluble form of rutin for instant resolution of mask-wearing related disorders[J].Journal of Cosmetic Dermatology, 2024, 23(5):1734-1744.
[34] 宋宏亮.芦丁通过抗氧化、抗炎、抑制p38 MAPK通路实现脊髓损伤后神经保护的机制研究[D].济南:山东大学, 2018.SONG H L.Neuroprotective Mechanisms of rutin for spinal cord injury through anti-oxidation and anti-inflammation and inhibition of p38 mitogen activated protein kinase pathway[D].Jinan:Shandong University, 2018.
[35] AROWOOGUN J, AKANNI O O, ADEFISAN A O, et al.Rutin ameliorates copper sulfate-induced brain damage via antioxidative and anti-inflammatory activities in rats[J].Journal of Biochemical and Molecular Toxicology, 2021, 35(1):e22623.
[36] PARK H Y, KIM G Y, HYUN J W, et al.7, 8-Dihydroxyflavone exhibits anti-inflammatory properties by downregulating the NF-κB and MAPK signaling pathways in lipopolysaccharide-treated RAW264.7 cells[J].International Journal of Molecular Medicine, 2012, 29(6):1146-1152.
[37] PARK H Y, PARK C, HWANG H J, et al.7, 8-Dihydroxyflavone attenuates the release of pro-inflammatory mediators and cytokines in lipopolysaccharide-stimulated BV2 microglial cells through the suppression of the NF-κB and MAPK signaling pathways[J].International Journal of Molecular Medicine, 2014, 33(4):1027-1034.
[38] ASHOUR M, WINK M, GERSHENZON J.Biochemistry of terpenoids:monoterpenes, sesquiterpenes and diterpenes[J].Annual Plant Reviews, 2010, 40:258-303.
[39] 张明发, 沈雅琴.柠檬醛的利胆溶石和镇痛抗炎作用的实验研究[J].抗感染药学, 2014, 11(4):280-284.ZHANG M F, SHEN Y Q.Experimental studies on choleresis, litholysis, analgesia and AntiInflammation of citral[J].Anti-infection Pharmacy, 2014, 11(4):280-284.
[40] KIM D S, LEE H J, JEON Y D, et al.Alpha-pinene exhibits anti-inflammatory activity through the suppression of MAPKs and the NF-κB pathway in mouse peritoneal macrophages[J].The American Journal of Chinese Medicine, 2015, 43(4):731-742.
[41] 刘琳琪, 刘玉环, 赵晨曦, 等.不同产地生姜主要活性成分的比较分析[J].天然产物研究与开发, 2015, 27(6):1016-1021.LIU L Q, LIU Y H, ZHAO C X, et al.Comparative analysis of main active constituents in ginger samples collected from different origins[J].Natural Product Research and Development, 2015, 27(6):1016-1021.
[42] FERREIRA B A, SILVA R F, DE MOURA F B R, et al.α-zingiberene, a sesquiterpene from essential oil from leaves of Casearia sylvestris, suppresses inflammatory angiogenesis and stimulates collagen deposition in subcutaneous implants in mice[J].Natural Product Research, 2022, 36(22):5858-5862.
[43] 郭立敏, 吕洁丽, 张来宾.天然倍半萜类化合物抗炎作用机制的研究进展[J].中国中药杂志, 2018, 43(20):3989-3999.GUO L M, LYU J L, ZHANG L B.Research progress on anti-inflammatory mechanism of natural sesquiterpenoids[J].China Journal of Chinese Materia Medica, 2018, 43(20):3989-3999.
[44] 李晓乐.姜精油的纯化与抗炎活性研究[D].合肥:合肥工业大学, 2016.LI X L.Research on purification of ginger essential oil and its anti-inflammatory activity[D].Hefei:University of Technology, 2016.
[45] HERVE T, RAPHAЁL K J, FERDINAND N, et al.Effects of ginger (Zingiber officinale, Roscoe) essential oil on growth and laying performances, serum metabolites, and egg yolk antioxidant and cholesterol status in laying Japanese quail[J].Journal of Veterinary Medicine, 2019, 2019:7857504.
[46] YANG X L, WEI S Q, LU X M, et al.A neutral polysaccharide with a triple helix structure from ginger:Characterization and immunomodulatory activity[J].Food Chemistry, 2021, 350:129261.
[47] LIAO D W, CHENG C, LIU J P, et al.Characterization and antitumor activities of polysaccharides obtained from ginger (Zingiber officinale) by different extraction methods[J].International Journal of Biological Macromolecules, 2020, 152:894-903.
[48] HOU C Y, CHEN L L, YANG L Z, et al.An insight into anti-inflammatory effects of natural polysaccharides[J].International Journal of Biological Macromolecules, 2020, 153:248-255.
[49] 汪妮, 陈梦霞, 孟凡强, 等.生姜多糖的提取及其对糖尿病小鼠肠道菌群的调节作用[J].食品工业科技, 2023, 44(4):278-286.WANG N, CHEN M X, MENG F Q, et al.Extraction of polysaccharide from Zingiber officinale Roscoe and its regulatory effect on intestinal flora in diabetic mice[J].Science and Technology of Food Industry, 2023, 44(4):278-286.
[50] ZHENG Q, CHENG Z R, DUAN Y Q, et al.Effect of subcritical water temperature on the chain conformation and immune activity of ginger polysaccharides[J].International Journal of Biological Macromolecules, 2024, 261:129833.
[51] HOU M D, GAO J, LIU Z Q, et al.Antioxidant and immunomodulatory activities in vitro of a neutral polysaccharide from ginger (Zingiber officinale)[J].Starch-Stärke, 2021, 73(9-10):2100048.
[52] 刘晓飞, 侯艳, 马京求, 等.发芽糙米糖蛋白结构表征及抗氧化性能分析[J].中国食品学报, 2021, 21(7):328-337.LIU X F, HOU Y, MA J Q, et al.Structure characterization and antioxidant properties analysis of germinated brown rice glycoprotein[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(7):328-337.
[53] 陈月皎.生姜糖蛋白的糖链结构及糖基化位点的鉴定[D].锦州:渤海大学, 2019.CHEN Y J.Characterization of n-glycan structure and n-glycosylation of ginger glycoproteins[D].Jinzhou:Bohai University, 2019.
[54] 冯麟, 李荣英, 王婷, 等.生姜中活性物质糖蛋白的提取工艺及抗菌活性[J].食品工业, 2021, 42(6):73-76.FENG L, LI R Y, WANG T, et al.Extraction technology and antibacterial activity of glycoprotein from ginger[J].The Food Industry, 2021, 42(6):73-76.
[55] 李秋月, 许海玉, 杨洪军.促炎因子TNF-α, IL-1β, IL-6在神经病理性疼痛中的研究进展[J].中国中药杂志, 2017, 42(19):3709-3712.LI Q Y, XU H Y, YANG H J.Effect of proinflammatory factors TNF-α, IL-1β, IL-6 on neuropathic pain[J].China Journal of Chinese Materia Medica, 2017, 42(19):3709-3712.
[56] LIU Y, DENG S J, ZHANG Z, et al.6-Gingerol attenuates microglia-mediated neuroinflammation and ischemic brain injuries through Akt-mTOR-STAT3 signaling pathway[J].European Journal of Pharmacology, 2020, 883:173294.
[57] JO S, SAMARPITA S, LEE J S, et al.8-Shogaol inhibits rheumatoid arthritis through targeting TAK1[J].Pharmacological Research, 2022, 178:106176.
[58] 陈磊, 胡子成, 周毅, 等.6-姜烯酚通过下调TLR4/NF-κB通路抑制血管平滑肌细胞增殖[J].第三军医大学学报, 2016, 38(3):245-250.CHEN L, HU Z C, ZHOU Y, et al.6-shogaol suppresses vascular smooth muscle cells proliferation by inhibiting TLR4/NF-κB signaling pathway[J].Journal of Third Military Medical University, 2016, 38(3):245-250.
[59] RUANGSURIYA J, BUDPROM P, VIRIYAKHASEM N, et al.Suppression of cartilage degradation by zingerone involving the p38 and JNK MAPK signaling pathway[J].Planta Medica, 2017, 83(3-4):268-276.
[60] 杨崇, 傅若秋, 高宁.8-姜酚抑制乳腺癌细胞增殖的分子机制研究[J].第三军医大学学报, 2019, 41(5):406-414.YANG C, FU R Q, GAO N.Molecular mechanism of inhibition of 8-gingerol on proliferation of breast cancer cells[J].Journal of Third Military Medical University, 2019, 41(5):406-414.
[61] ALI R A, GANDHI A A, DAI L P, et al.Antineutrophil properties of natural gingerols in models of lupus[J].JCI Insight, 2021, 6(3):e138385.
[62] TAVARES L P, NEGREIROS-LIMA G L, LIMA K M, et al.Blame the signaling:Role of cAMP for the resolution of inflammation[J].Pharmacological Research, 2020, 159:105030.
[63] ZHU Y J, WANG D X, LUO J J, et al.Zingerone inhibits the neutrophil extracellular trap formation and protects against sepsis via Nrf2-mediated ROS inhibition[J].Oxidative Medicine and Cellular Longevity, 2022, 2022(1):3990607.
[64] TRIPATHI S, MAIER K G, BRUCH D, et al.Effect of 6-gingerol on pro-inflammatory cytokine production and costimulatory molecule expression in murine peritoneal macrophages[J].Journal of Surgical Research, 2007, 138(2):209-213.
[65] 罗小志, 刘德昭, 黄锋.基于网络药理学探讨山柰酚在心肌缺血再灌注损伤中的作用机制[J].中国医学前沿杂志(电子版), 2023, 15(5):58-63.LUO X Z, LIU D Z, HUANG F.Network pharmacological study on the mechanism of kaempferol in myocardial ischemia-reperfusion[J].Chinese Journal of the Frontiers of Medical Science (Electronic Version), 2023, 15(5):58-63.
[66] ZHANG J W, LI H Y, WANG W, et al.Assessing the anti-inflammatory effects of quercetin using network pharmacology and in vitro experiments[J].Experimental and Therapeutic Medicine, 2022, 23(4):301.
[67] 王秋波,唐淼龙,李伟,等.肠道微生物菌群失调与类风湿关节炎炎症反应的相关性[J].中国老年学杂志, 2021, 41(4):812-815.WANG Q B, TANG M L, LI W, et al.Correlation between intestinal microbiota dysregulation and inflammatory response in rheumatoid arthritis[J].Chinese Journal of Gerontology, 2021, 41(4):812-815.
[68] GUO S S, GENG W Y, CHEN S, et al.Ginger alleviates DSS-induced ulcerative colitis severity by improving the diversity and function of gut microbiota[J].Frontiers in Pharmacology, 2021, 12:632569.
[69] CHEN C, LIN X H, XIE Y M, et al.Shengjiang Xiexin Decoction ameliorates DSS-induced ulcerative colitis via activating Wnt/β-Catenin signaling to enhance epithelium renovation and modulating intestinal flora[J].Phytomedicine, 2025, 139:156456.
[70] HEIDARI-BENI M, MORAVEJOLAHKAMI A R, GORGIAN P, et al.Herbal formulation “turmeric extract, black pepper, and ginger” versus Naproxen for chronic knee osteoarthritis:A randomized, double-blind, controlled clinical trial[J].Phytotherapy Research, 2020, 34(8):2067-2073.
[71] BAEK H I, SHEN L, HA K C, et al.Effectiveness and safety of steamed ginger extract on mild osteoarthritis:A randomized, double-blind, placebo-controlled clinical trial[J].Food &Function, 2024, 15(18):9512-9523.
[72] PAN Y P, ZHANG H J, LI M H, et al.Novel approaches in IBD therapy:Targeting the gut microbiota-bile acid axis[J].Gut Microbes, 2024, 16(1):2356284.
[73] LIANG J, DAI W G, LIU C H, et al.Gingerenone a attenuates ulcerative colitis via targeting IL-17RA to inhibit inflammation and restore intestinal barrier function[J].Advanced Science, 2024, 11(28):2400206.
[74] ZHANG S W, DIMANGO E, ZHU Y D, et al.Pharmacokinetics of gingerols, shogaols, and their metabolites in asthma patients[J].Journal of Agricultural and Food Chemistry, 2022, 70(31):9674-9683.
[75] VAGHELA J H, VADGAMA V K, PUROHIT B M.Bronchodilatory effect of Zingiber officinale Roscoe (ginger) in guinea pigs[J].Tropical Journal of Pharmaceutical Research, 2020, 19(4):845-849.
[76] YAMPRASERT R, CHANVIMALUENG W, MUKKASOMBUT N, et al.Ginger extract versus Loratadine in the treatment of allergic rhinitis:A randomized controlled trial[J].BMC Complementary Medicine and Therapies, 2020, 20(1):119.
[77] HAN X, QI J Y, YANG Y K, et al.Protective mechanisms of 10-gingerol against myocardial ischemia may involve activation of JAK2/STAT3 pathway and regulation of Ca2+ homeostasis[J].Biomedicine &Pharmacotherapy, 2022, 151:113082.
[78] PANYOD S, WU W K, PENG S Y, et al.Ginger essential oil and citral ameliorates atherosclerosis in ApoE-/- mice by modulating trimethylamine-N-oxide and gut microbiota[J].NPJ Science of Food, 2023, 7:19.