能量耗竭学说、代谢产物堆积学说、中枢保护性抑制学说以及自由基学说是现代关于运动性疲劳的形成机制的四大理论体系,得到了广泛的认可,且在田径运动,特别是跑步类运动中体现明显[1-2]。近年来的研究趋势表明,自由基引发的氧化损伤与运动性疲劳之间的关联性日益受到学界重视,氧化损伤在疲劳发生机制中的重要作用已得到广泛认可[3]。氧化损伤与细胞能量代谢的改变能够刺激腺苷酸激活蛋白激酶(adenylate activated protein kinase,AMPK)的活性,进而实现对能量代谢的调控功能[4]。同时,过氧化物酶体增殖物激活受体γ共激活因子1-α(peroxisome proliferator-activated receptor γ coactivator 1α,PGC-1α)通过激活线粒体基因转录相关因子,不仅能够增强能量代谢酶的活性,还能提升骨骼肌的抗疲劳能力[5]。在AMPK/PGC-1α信号通路被充分激活和强化后,肌肉组织中线粒体的氧化磷酸化过程得到显著加速,代谢副产物的生成减少,从而有效提高了肌肉细胞的能量产生效率[6]。乳酸菌在能量、代谢产物、中枢系统和自由基调节中均能发挥有效作用,因此可能对运动机体的调控也能发挥相应作用[6-11]。
随着科学研究的深入,益生菌在运动营养领域的应用价值正日益凸显,其在作为功能性营养补充剂方面的研究也取得了一系列重要进展。研究表明,多种特异性益生菌在运动表现提升方面展现出显著的效果,尤其在提升体力和增强耐力方面[7-8]。研究表明四川泡菜中特有的乳酸菌凭借其优异的肠道定植能力,在调节肠道微生态平衡、促进机体健康方面展现出独特的应用价值[9]。这些研究成果为益生菌在运动营养领域的进一步应用奠定了坚实的理论基础。相关研究通过分析运动员肠道微生物菌群组成,发现稳定的肠道菌群体系是运动员维持优异运动表现的关键因素之一,这一发现深刻揭示了肠道微生态与运动机能之间密切的相互作用关系[10]。这些研究结果为深入探索微生物-肠道-运动表现三者之间的内在关联提供了重要的科学依据。
系统性且基于循证医学原理的运动干预策略已被广泛证实为防控及改善慢性疾病及其并发症的关键措施。其中,有氧运动因其在提升心血管效能及优化能量代谢循环方面的显著作用,在增强生理适应能力方面展现出独特优势[11]。然而,现代生活节奏的加快使得个体常常陷入高强度工作压力与不良生活习惯的双重困境,由此产生的氧化损伤与慢性疲劳综合症不仅影响了正常的运动执行能力,也导致了生理功能减退与持续性亚健康状态的恶化[12]。短乳杆菌常来源于自然发酵食品,来源安全,且因为其具备很强的耐盐和耐酸性,能够在胃液和肠液等极端环境中存活,可以有效定殖于肠道发挥作用,是一类天然的益生菌[13]。四川泡菜发酵环境为酸性泡菜水,因此存活的乳酸菌多具备很好的耐酸性,具有益生菌潜质[14],但关于短乳杆菌对运动机体调节作用的研究几乎未见。本研究聚焦于本团队从自然发酵泡菜的样品中成功分离并鉴定出的短乳杆菌CQPC12(Lactobacillus brevis CQPC12,LB-CQPC12),就其通过调节肠道微生态平衡对氧化损伤及运动跑步功能衰退的干预机制展开深入研究。通过结合LB-CQPC12对肠道菌群的调控效应,初步揭示了该菌株在提升耐力跑步机能的作用机制,为推进该益生菌的临床应用提供了坚实的理论基础。
1 材料与方法
1.1 材料与试剂
自然发酵泡菜汁由本团队在重庆南岸区农贸市场采集。
本研究中实验小鼠为SPF昆明小鼠,雌雄各半(结果分析不区分雌雄,合并分析),6周龄,体重为(22±2) g,由湖南斯莱克景达实验动物有限公司提供,实验动物许可证号为SYXK(湘)2024-0019。动物实验实施经重庆第二师范学院儿童营养与健康发展协同创新中心实验动物伦理委员会批准,实验动物伦理审查号为2023080019B,本研究中动物实验按国家标准GB/T 35892—2018《实验动物 福利伦理审查指南》要求实施和操作。
短乳杆菌SHBCC D11087 DSMZ6235,上海保藏微生物中心;短乳杆菌CICC6239,中国工业微生物菌种保藏管理中心。
MRS(DeMan, Rogosa and Sharpe)培养基、革兰氏染色液试剂盒,青岛海博生物技术有限公司;40 g/L多聚甲醛固定液,北京兰杰柯科技有限公司;小鼠尿素氮(blood urea nitrogen,BUN)试剂盒,上海科艾博生物技术有限公司;小鼠糖原、CK试剂盒,南京建成生物工程研究所;小鼠乳酸测定试剂盒,上海酶澳生物科技有限公司;TRlzol试剂,合肥博美生物科技有限责任公司;RNase-Free water、2×Taq plus Master Mix、SYBR Green PCR Mastermix、ddH2O,北京索莱宝科技有限公司;细菌基因组DNA提取试剂盒,上海源叶生物科技有限公司;D-半乳糖、巯基乙酸钠,上海麦克林生化科技股份有限公司;猪胆盐,上海士锋生物科技有限公司;抗坏血酸、NaCl(分析纯)、胃蛋白酶,天津市众联化学试剂有限公司;放射免疫沉淀法裂解缓冲液(radio immunoprecipitation assay buffer,RIPA buffer)、苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF)蛋白酶抑制剂、一抗、二抗,美国赛默飞公司。
1.2 仪器与设备
BI-I50A低温生化培养箱,施都凯仪器设备(上海)有限公司;Biomate3S紫外可见分光光度计、Stepone Plus实时荧光定量PCR仪,美国赛默飞公司;BX43显微镜,日本奥林巴斯公司;Nano-300微量分光光度计,杭州奥盛仪器有限公司;ZH-PT八通道实验动物跑台,安徽正华生物仪器设备有限公司;Tanon 5200凝胶成像系统,上海天能生命科学有限公司。
1.3 方法
1.3.1 菌株分离纯化
取1 mL自然发酵泡菜汁样本,采用无菌生理盐水按体积比1∶10进行梯度稀释,制备10-1至10-6系列稀释液。选取10-4、10-5、10-6三个适当稀释梯度,各取100 μL稀释菌液行平板涂布,于37 ℃恒温培养箱中培养24~48 h,系统观察并详细记录平板上显现的菌落特征。随后,选取形态学特征差异显著的菌落进行基质划线分离,在37 ℃条件下继续培养48 h。重复上述单菌落划线分离操作2~3次,直至获得形态学特征一致且均匀的单一菌株纯培养物。
1.3.2 菌株初步鉴定
选取纯化平板中典型单菌落,接种于5 mL MRS液体培养基中,于37 ℃恒温摇床培养24 h。取1 mL培养菌液转至无菌离心管中,4 000 r/min离心10 min,去除上清液后,将菌体沉淀重悬于无菌生理盐水中。采用标准革兰氏染色法进行显微形态学观察,根据染色特性对菌株进行初步鉴定,其中革兰氏染色呈阳性反应的菌株初步判定为乳酸菌属(Lactobacillus spp.)。
1.3.3 菌株DNA提取
将经过纯化鉴定的候选目标菌株接种于MRS液体培养基,于37 ℃恒温培养箱中培养18~24 h。待菌液生长至对数后期,按照细菌基因组DNA提取试剂盒说明书进行操作,提取菌株基因组DNA。完成提取后,采用统一编号系统对DNA样本进行标识,并于-20 ℃超低温冰箱中长期保存,供后续分子生物学分析使用。
1.3.4 菌株基因组DNA PCR扩增
对上述菌株提取的DNA继续进行PCR扩增,PCR扩增体系包括上游通用引物27F(5′-AGA GTT TGA TCC TGG CTC AG-3′)1.0 μL,下游通用引物1495R(5′-CTA CGG CTA CCT TGT TAC GA-3′)1.0 μL,2×Taq plus Master Mix 12.5 μL,模板DNA 1.0 μL,无菌ddH2O 9.5 μL;同时设置阴性对照,以无菌超纯水替代模板DNA进行平行扩增。然后在预变性:94 ℃、 5 min;扩增循环(29个循环):94 ℃、30 s,55 ℃、30 s,72 ℃、1 min;末端延伸:72 ℃、5 min条件下进行PCR扩增。将检测成功的PCR产物送交北京擎科生物技术有限公司进行双向测序。获得测序结果后,使用NCBI数据库的BLAST进行在线序列比对分析,确定菌株的系统发育地位。
1.3.5 菌株耐受3 g/L胆盐的能力测定
参考文献[13]方法,取5 mL经活化的菌悬液,以2%(体积分数)的接种量分别接入含0.3%胆盐的MRS-THIO培养基和不含胆盐的MRS-THIO培养基中,并以未接种的MRS-THIO培养基为空白对照。所有培养物置于37 ℃恒温培养箱中培养24 h后,使用分光光度计测定各培养体系在600 nm波长处的吸光度值(OD600nm)。根据测定结果,按照公式(1)计算菌株对胆盐的耐受能力。
胆盐耐受力/%
(1)
1.3.6 菌株耐受人工胃液测定
参考文献[13]方法,量取5 mL含待测菌的培养基至10 mL无菌离心管中,然后3 000 r/min离心10 min,弃去上清液,收集菌体沉淀,加入5 mL无菌生理盐水重悬,制成均匀菌悬液。取1 mL菌悬液与9 mL pH 3.0人工胃液混合后立即取1 mL混合液作为0 h初始样品,其余9 mL混合液置于恒温摇床(37 ℃,150 r/min)培养3 h。最后将0 h和3 h样品分别进行10倍梯度稀释,采用平板涂布法接种于MRS固体培养基,37 ℃恒温培养48 h,按照公式(2)计算菌体存活率,评估人工胃液处理对菌体生存的影响[13]。
存活率![]()
(2)
1.3.7 动物模型
将100只KM小鼠在恒温(20±1)℃、相对湿度30%~40%的条件下进行1周的环境适应。随后随机将动物分为5个处理组(n=20):空白对照组(NC组)、造模组(MC组)、抗坏血酸干预组(AA组)以及低、高剂量乳酸菌干预组(LB-CQPC12-L组和LB-CQPC12-H组),每组按编号1~5和11~15为雌性个体,6~10和16~20为雄性个体。实验周期共10周,其中前6周除NC组外,其余各组均每日腹腔注射50 g/L D-半乳糖溶液[100 mg/(kg BW·d)];NC组注射等量无菌生理盐水。自第7周起,AA组给予抗坏血酸溶液[150 mg/(kg BW·d)];LAB-L组和LAB-H组分别灌胃0.75×109、1.5×109 CFU/(kg BW·d)的LB-CQPC12菌液;MC组和NC组给予2 mL无菌蒸馏水。干预4周后,于末次给药48 h内依次进行耐力跑步测试(间隔6 h),最终经颈椎脱臼法处死动物,采集肝脏样本用于后续检测[14]。
1.3.8 耐力跑步运动实验
采用8通道小鼠跑步机进行耐力测试,跑步机坡度为10°。实验开始时,以10 m/min的初始速度让小鼠适应5 min,随后每10 min递增一次速度,依次调整为16、21、26、31、36、41、46 m/min,直至小鼠达到力竭状态。力竭判定标准为小鼠在跑步过程中累计受到10次电击刺激和小鼠无法继续跑步并停留在电击区超过10 s。过程中记录每只小鼠从开始跑步到力竭的总运动时间,作为耐力评估指标[14]。
1.3.9 小鼠血清指标的测定
实施灌胃实验最后一天在灌胃干预结束2 h后,采用眼眶静脉丛采血法对所有编号1~20号小鼠进行首次血液样本采集。次日耐力跑步实验完成后,按以下时间点进行二次采血:1~10号小鼠于耐力跑步结束5 min后采血;11~20号小鼠于耐力跑步结束30 min后采血。所有血液样本立即置于4 ℃环境下,以1 500 r/min离心10 min,分离上层血清。依据相关试剂盒操作规范对1~10号小鼠的2次采血样本检测血清乳酸含量和对11~20号小鼠样本同步检测肌酸激酶、尿素氮及乳酸水平。
1.3.10 小鼠组织指标的测定
取小鼠腓肠肌和肝脏组织样本,按1∶9(g∶mL)比例加入预冷生理盐水,使用组织匀浆器在冰浴条件下充分匀浆。将制备好的组织匀浆液以3 000 r/min离心15 min(4 ℃),收集上清液。按照检测试剂盒操作规范,对编号11~20号小鼠的腓肠肌组织匀浆液进行肌糖原含量测定,同时对肝脏组织匀浆液进行肝糖原含量检测。
1.3.11 小鼠肝脏组织的病理学切片观察
取编号11~20号实验小鼠的肝脏组织样本,经预冷生理盐水反复漂洗3次后,迅速浸入10%(体积分数)中性缓冲福尔马林固定液中。固定完成后,组织样本在4 ℃条件下进行梯度乙醇脱水处理48 h。采用常规石蜡包埋技术对脱水后的组织进行包埋处理,使用旋转式切片机制备5~10 μm厚度的连续切片。切片经脱蜡水化后,采用苏木精-伊红双染法进行染色处理,染色后的切片经中性树胶封固后,在光学显微镜下观察并记录肝脏组织的病理形态学改变[15]。
1.3.12 小鼠组织mRNA的表达测定
精确称取11~20号小鼠肝脏和腓肠肌组织各0.2 g,经预冷生理盐水漂洗后剪碎。加入1 mL TRlzol裂解液进行组织匀浆,采用氯仿-异丙醇法提取总RNA。使用紫外分光光度计测定RNA样品在260 nm 和280 nm处的吸光值,要求A260/A280比值在1.8~2.0之间。采用琼脂糖凝胶电泳验证RNA完整性后,将RNA质量浓度统一调整为1 μg/μL。取1 μg 总RNA,按照反转录试剂盒说明书操作,在20 μL反应体系中进行逆转录反应,合成cDNA第一链。然后实施实时荧光定量PCR检测,反应体系(20 μL)包含SYBR Green Master Mix 10 μL、cDNA模板 1 μL、上下游引物(10 μmol/L)各1 μL、无核酸酶水7 μL;反应程序设置为95 ℃、60 s下预变性;循环反应(40个循环):95 ℃、15 s下变性,55 ℃、30 s下退火/延伸,72 ℃、35 s下延伸,95 ℃、30 s和55 ℃、35 s下熔解曲线分析。以GAPDH为内参基因,采用2-ΔΔCT法计算目标基因(AMPK、PGC1-α、SOD2和GPx1)的相对表达量[14]。
1.3.13 小鼠组织蛋白的表达测定
取约0.1 g小鼠腓肠肌组织样本,加入1 mL RIPA裂解液(含10 μL PMSF蛋白酶抑制剂)进行充分裂解。裂解液经4 ℃高速离心(12 000 r/min,4 min)后,弃去中间蛋白层,收集上清液。采用BCA法测定蛋白浓度,并用稀释缓冲液调整至终质量浓度50 μg/mL。将蛋白样品与上样缓冲液按液液比4∶1比例混合,100 ℃变性5 min后,进行SDS-PAGE(预制胶,50 min)。电泳结束后,通过湿转法将蛋白转移至PVDF膜。转膜完成后,用含50 g/L脱脂奶粉的TBST封闭1 h,TBST洗涤3次,每次5 min。封闭后的膜分别与一抗(1∶500稀释)和二抗(1∶1 000稀释)在25 ℃孵育,孵育时间分别为2、1 h。最后,使用超敏化学发光底物显影,通过凝胶成像系统检测AMPKα1和PGC1-α/β的表达水平。
1.3.14 小鼠肠道内容物中微生物的mRNA表达测定
实验组(11~20号)小鼠处死后,无菌条件下采集大肠内容物200 mg,加入1 mL无菌PBS使用组织匀浆器在冰浴条件下匀浆30 s,然后静置5 min使大颗粒沉淀。将上清液转移至15 mL离心管中1 000 r/min离心5 min去除残渣,取上清液6 000 r/min离心10 min收集微生物。接着同样采用氯仿-异丙醇法提取肠微生物的总RNA,采用1.3.12节所使用的方法选取5类特征性菌群作为检测指标进行微生物的mRNA测定,分别为总细菌(通用引物)、厚壁菌门(Firmicutes特异性引物)、拟杆菌门(Bacteroidetes特异性引物)、乳酸杆菌属(Lactobacillus特异性引物)和双歧杆菌属(Bifidobacterium特异性引物)[14]。
1.4 数据分析
本研究采用标准化的实验动物测量方法,对所有实验组小鼠的各项指标进行了系统检测。实验数据采用“平均数±标准差”的统计描述方式呈现。在数据分析阶段,运用SPSS 22.0统计软件包进行单因素方差分析(One-way ANOVA),以P<0.05作为差异具有统计学意义的判定标准,对各实验组间的数据差异进行统计学比较。
2 结果与分析
2.1 菌株观察及体外抗人工胃液和胆盐效果
观察发现,CQPC12菌株的菌落颜色以白色或乳白色为主,形态呈规则的圆形,边缘轮廓清晰整齐,且具有润泽光滑的表面质地。通过油镜(100×)观察,CQPC12菌株的显微形态如图2所示,其细胞主要表现为长杆状和短杆状结构,未观察到任何出芽生殖现象。根据细胞形态特征,初步鉴定CQPC12菌株属于杆菌类。然后通过PCR扩增产物测序后经BLAST程序比对分析显示CQPC12与GenBank 数据库中已知短乳杆菌(GenBank 登录号NC_008497.1菌株)的同源性达99%,CQPC12测序结果显示其为短乳杆菌,正式命名为短乳杆菌CQPC12(Lactobacillus brevis CQPC12,LB-CQPC12),并送交中国微生物菌种保藏管理委员会普通微生物中心进行登记保藏,保藏编号为CGMCC No.19339。
LB-CQPC12在pH 3.0 人工胃液中的存活率达到了82.66%;CQPC12短乳杆菌在0.3%胆盐中的存活率较高,达到了68.97%,LB-CQPC12抗人工胃酸和胆盐的能力均强于商用短乳杆菌CICC6239和短乳杆菌SHBCC D11087(见电子版增强出版附表1所示,https://doi.org/10.13995/j.cnki.11-1802/ts.042935),表明其具有较强的耐受胆盐能力,且优于商用菌株,具备深入研究和利用的潜质。
2.2 LB-CQPC12对小鼠耐力跑步的影响
在力竭运动测试中,NC组小鼠的耐力表现显著优于其他组别,而MC组动物的运动持续时间明显缩短(详见附图2)。实验数据显示,LB-CQPC12与AA干预后,氧化损伤小鼠的运动能力均得到显著改善(P<0.05)。值得注意的是,高剂量LB-CQPC12(LB-CQPC12-H)的干预效果最好,其作用强度不仅高于低剂量组(LB-CQPC12-L),也显著优于AA组。
2.3 LB-CQPC12对氧化损伤小鼠跑步后血清乳酸浓度的影响
在力竭运动前的静息状态下,各组小鼠的血清乳酸浓度无统计学差异(P<0.05),均维持在较低水平。然而,运动后5 min,所有组别的血清乳酸水平均显著升高,且组间差异显著(P<0.05)。具体而言,MC组的血清乳酸浓度显著高于其他组,依次为AA组、LB-CQPC12-L组、LB-CQPC12-H组和NC组。运动后30 min,各组血清乳酸浓度均出现下降,但组间差异仍然显著(P<0.05)。其中,LB-CQPC12-H组的血清乳酸水平最低(仅次于NC组),而LB-CQPC12-L组和AA组略高,MC组则持续保持最高值(详见附表2)。
2.4 LB-CQPC12对氧化损伤小鼠血清和组织生化指标的影响
NC组的腓肠肌组织MG含量及肝脏HG水平显著高于其他组别,而MC组的MG与HG水平均处于最低值。实验表明,抗坏血酸和LB-CQPC12干预能有效提高氧化损伤小鼠的MG和HG含量,其中高剂量LB-CQPC12(LB-CQPC12-H组)的作用效果优于低剂量组(LB-CQPC12-L组)及AA组。在血清指标方面,MC组的尿素氮和肌酸激酶水平呈现与其他组相反的趋势,其数值显著高于干预组。各干预组中,AA组的BUN和CK水平最高,随后依次为LB-CQPC12-L组、LB-CQPC12-H组,NC组则维持最低水平(详见附表3)。
2.5 LB-CQPC12对氧化损伤小鼠肝组织病理学影响
肝组织病理学分析结果(图1)显示,NC组小鼠肝组织结构完整,肝小叶边界清晰,肝细胞呈典型的放射状排列于中央静脉周围。与之形成鲜明对比的是,MC组小鼠肝组织呈现明显的病理改变,包括肝小叶结构紊乱、肝细胞排列异常,并可见细胞膜完整性破坏、核碎裂以及凋亡小体形成等特征性损伤表现。实验干预结果显示,LB-CQPC12和AA处理均能显著改善氧化损伤诱导的肝组织损伤。其中,高剂量LB-CQPC12(LB-CQPC12-H)处理组的肝小叶结构恢复最为显著,基本接近正常组织结构;而低剂量LB-CQPC12(LB-CQPC12-L)和AA处理组虽有一定改善效果,但仍可观察到部分肝细胞结构异常和损伤迹象。
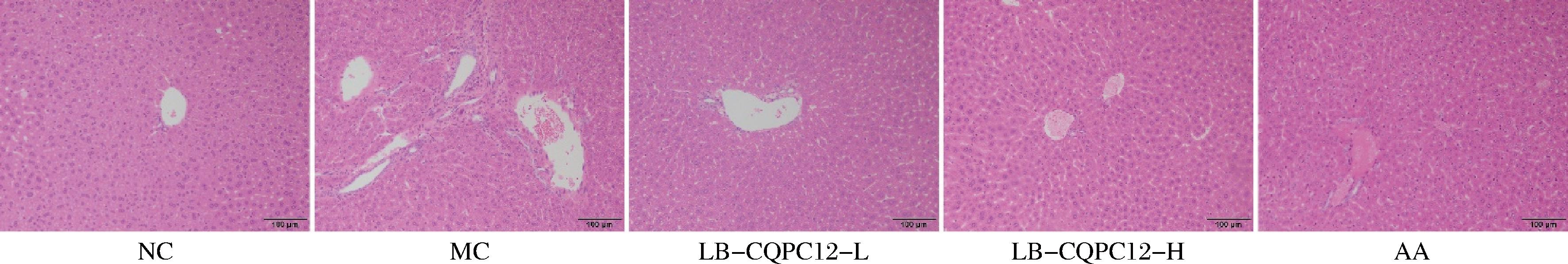
图1 氧化损伤小鼠的肝脏组织病理学变化
Fig.1 Pathological changes in liver tissue of mice with oxidative damage
2.6 LB-CQPC12对氧化损伤小鼠组织mRNA表达的影响
如图2所示,与MC组相比,AA和不同剂量LB-CQPC12(LB-CQPC12-L和LB-CQPC12-H)处理后,上述抗氧化和能量代谢相关基因的mRNA表达均呈现显著上调(P<0.05)。值得注意的是,高剂量LB-CQPC12-H的干预效果最为突出,其基因表达上调幅度显著优于AA组和低剂量组(LB-CQPC12-L)。NC组各检测指标的表达水平在所有实验组中均保持最高值。
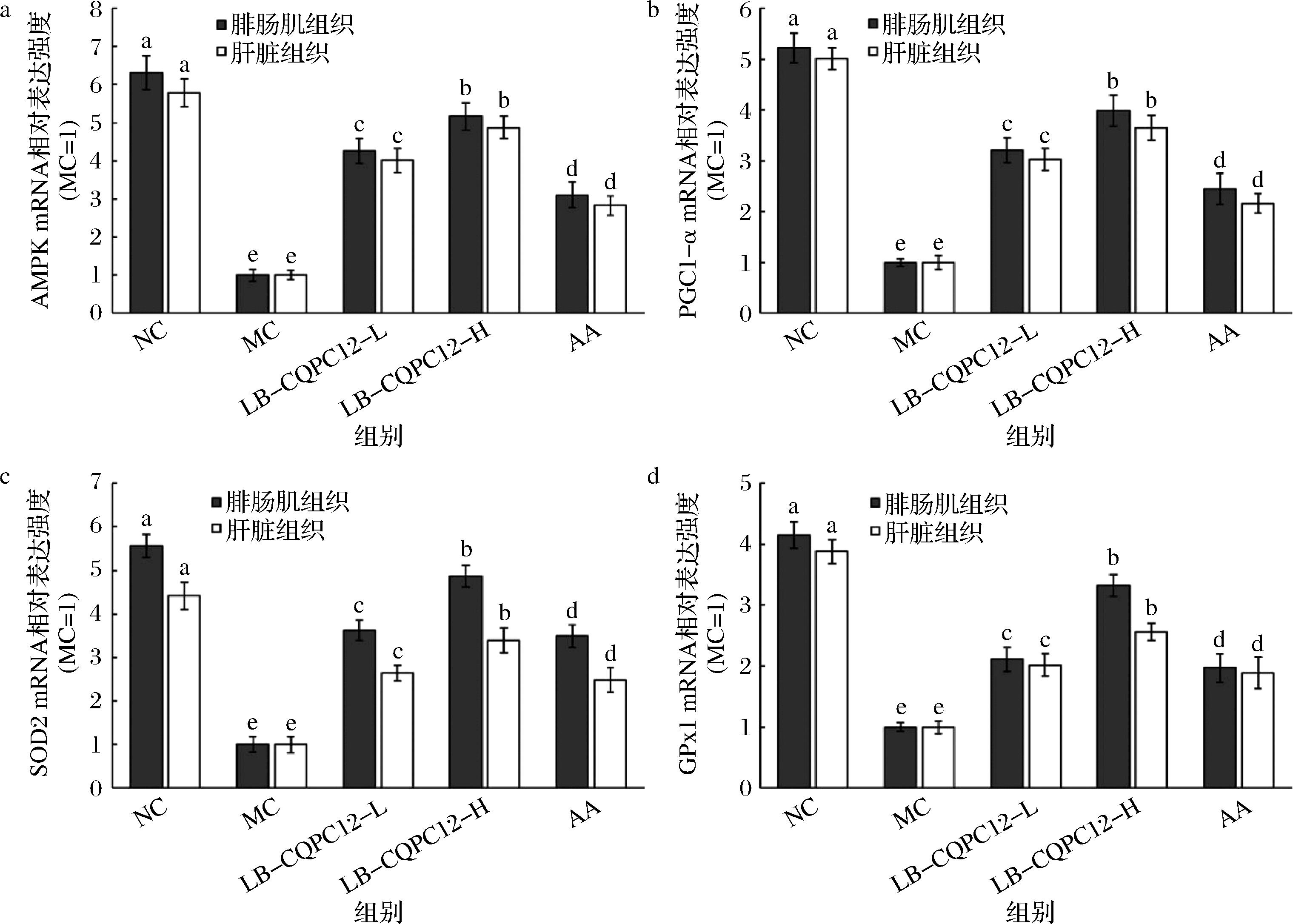
a-AMPK;b-PGC1-α;c-SOD2;d-GPx1
图2 氧化损伤小鼠腓肠肌组织和肝脏组织中AMPK、PGC1-α、SOD2和GPx1 mRNA表达的水平(n=10)
Fig.2 MRNA expression levels of AMPK, PGC1-α, SOD2, and GPx1 in the gastrocnemius muscle tissue and liver tissue of mice with oxidative damage (n=10)
注:不同小写字母表示组间差异具有统计学意义(P<0.05);相同字母标注则表明组间差异无统计学意义(P≥0.05)(下同)。
2.7 LB-CQPC12对氧化损伤小鼠腓肠肌组织蛋白表达的影响
Western blot实验结果显示正常组(NC小鼠)腓肠肌组织的AMPKα1和PGC1-α/β蛋白表达水平最强(图3),而氧化损伤(MC组)小鼠腓肠肌组织的AMPKα1和PGC1-α/β表达水平最弱。LB-CQPC12-L和LB-CQPC12-H上调氧化损伤小鼠AMPKα1和PGC1-α/β表达的效果强于AA,且LB-CQPC12-H的上调能力最强。
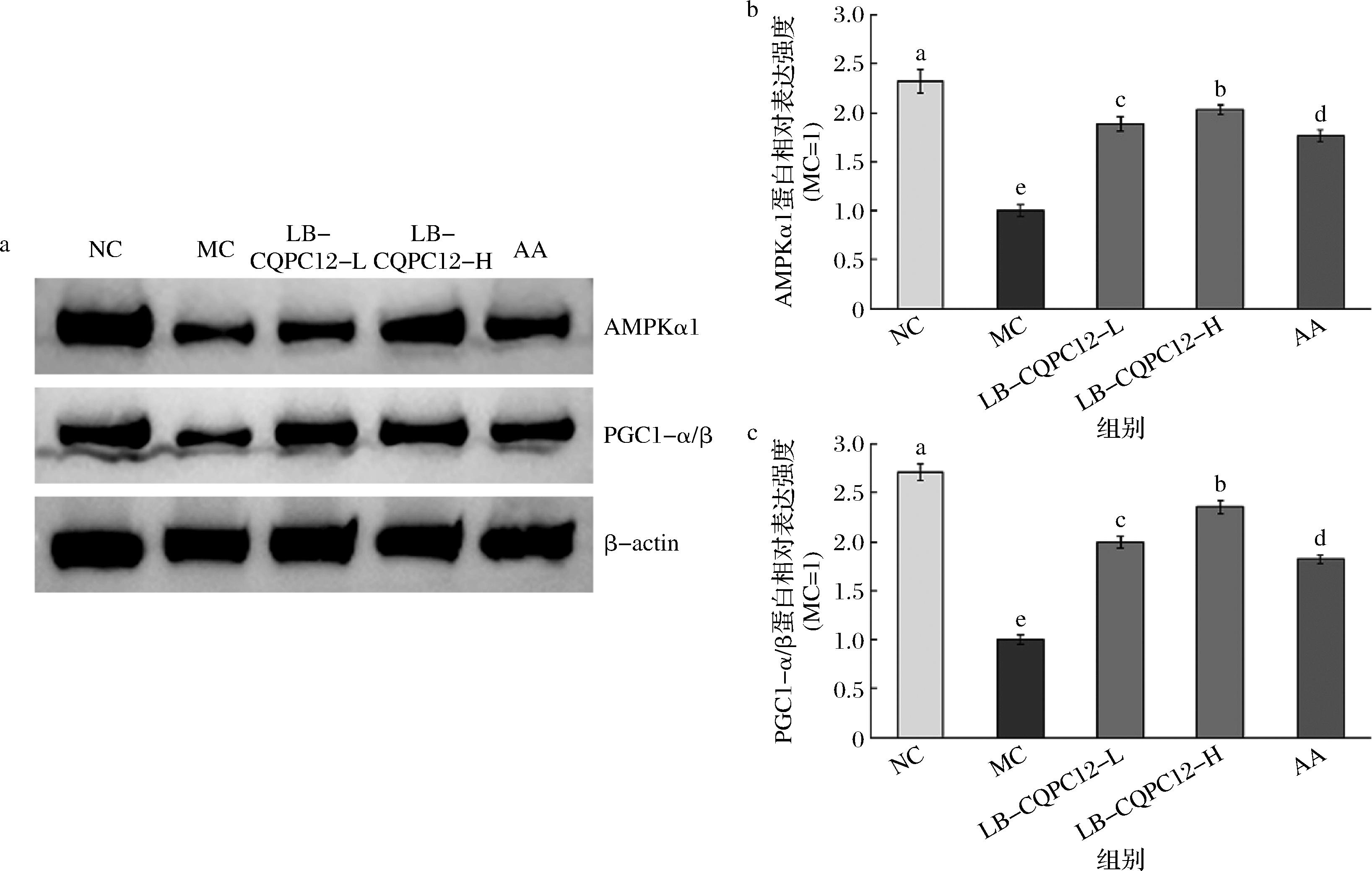
a-Western blot;b-AMPKα1;c-PGC1-α/β
图3 氧化损伤小鼠腓肠肌组织中AMPKα1和PGC1-α/β蛋白表达的水平(n=10)
Fig.3 Protein expression levels of AMPKα1 and PGC1-α/β in the gastrocnemius muscle tissue of mice with oxidative damage (n=10)
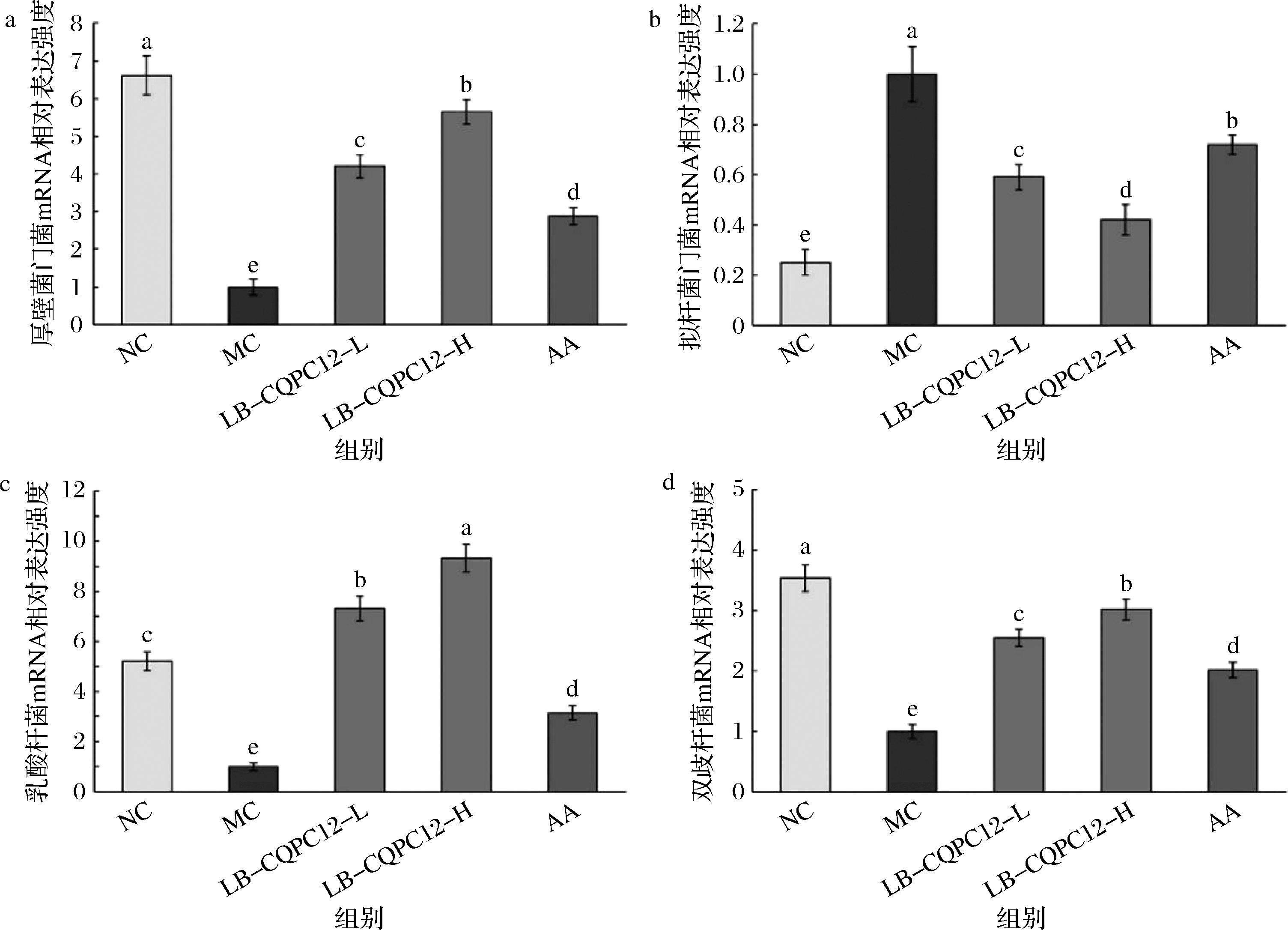
a-厚壁菌门;b-拟杆菌门;c-乳酸杆菌;d-双歧杆菌
图4 氧化损伤小鼠肠道内容物中拟杆菌门、厚壁菌门、双歧杆菌和乳酸杆菌的mRNA表达水平(n=10)
Fig.4 MRNA expression levels of Bacteroidetes, Firmicutes, Bifidobacterium, and Lactobacillus in intestinal contents of mice with oxidative damage (n=10)
2.8 LB-CQPC12对氧化损伤小肠道内容物中微生物mRNA表达的影响
肠道菌群分析结果(图4)显示,NC组小鼠肠道微生物组成呈现显著特征性分布,拟杆菌门的基因表达量显著低于其他组别(P<0.05),而厚壁菌门和双歧杆菌的相对丰度则显著占优。这种分布特征表明NC组肠道菌群以厚壁菌门为优势菌群,拟杆菌门比例最低。实验干预后,LB-CQPC12处理显著改变了MC组小鼠的肠道菌群结构,表现为厚壁菌门和双歧杆菌丰度显著增加,同时拟杆菌门丰度相应降低。值得注意的是,LB-CQPC12干预组(包括LB-CQPC12-L和LB-CQPC12-H)显示出更显著的益生效应,其乳酸杆菌丰度不仅显著高于MC组和AA组(P<0.05),甚至超过了NC组的基准水平。
3 讨论
四川泡菜采用高盐、低pH的发酵方式,泡菜发酵过程中pH逐渐降低,此环境下存活的乳酸菌能通过质子泵、细胞膜修饰、碱性物质合成等方式维持胞内pH稳定;且其中部分菌株能通过胆盐水解酶分解胆盐,增强在肠道环境中的存活率[16]。具备良好抗酸和抗胆盐能力的乳酸菌具备进入肠道定殖发挥益生菌功效的可能,因此实验室条件下常用体外抗人工胃酸和胆盐检测来初步筛选出具有益生菌潜质的菌株[17]。本研究中LB-CQPC12具有较好的体外抗胃酸和胆盐效果,初步具备了益生菌菌株的能力,被筛选出进行后续研究。
良好的体能状态对保持较高的运动耐力也至关重要。在实验研究中,通常采用动物最大跑步距离来量化其运动耐力,该指标不仅能直观反映机体的抗疲劳能力,还可作为评估抗氧化应激水平的重要依据[18]。已有研究表明,部分具有益生特性的乳酸菌表现出显著的抗氧化活性,可能对提升机体活力和运动能力具有积极作用[19]。本研究通过构建小鼠氧化损伤模型,与造模组相比,LB-CQPC12干预组小鼠的跑步持续时间显著延长,提示该菌株可能具有改善运动耐力的潜在功效。
血乳酸是肌肉组织在缺氧条件下进行糖酵解时产生的重要代谢终产物,随着运动负荷的增加,肌肉组织需氧量急剧上升,当氧气供应不足时,糖酵解途径被激活,乳酸生成速率显著提高,导致血液中乳酸浓度快速累积。这种代谢变化不仅会降低肌肉收缩效率,还会影响组织的氧利用率,进一步加剧乳酸蓄积现象,血液乳酸水平升高往往伴随着能量的大量消耗和疲劳感的产生[20]。本实验数据与这一理论相符,力竭运动后小鼠血乳酸浓度显著升高,但随着恢复时间的延长呈现逐渐下降的趋势。值得注意的是,补充LB-CQPC12的实验组表现出更好的乳酸清除能力,说明该菌株可能通过调节代谢途径来减轻运动性乳酸堆积,从而发挥保护作用。
氧化应激状态下,持续性运动负荷可能引发糖脂代谢紊乱,同时加速蛋白质和氨基酸的分解消耗。在高强度或耐力性运动过程中,机体代谢活动显著增强,产生包括尿素氮及活性氧簇在内的多种代谢副产物,这些物质被认为是诱发运动性疲劳的关键介质。这些代谢产物的异常蓄积不仅会破坏机体内环境稳态,还可能对重要器官造成功能性损伤[21]。肌酸激酶作为能量代谢系统的关键酶,在骨骼肌组织中含量丰富。剧烈运动引发的肌纤维损伤会导致细胞膜完整性破坏,促使肌酸激酶大量渗入血液循环,表现为血清肌酸激酶活性显著上升[22]。在能量储备方面,糖原作为重要的储能物质主要分布于肝脏和骨骼肌。其中肝糖原参与血糖调控,而肌糖原直接为肌肉收缩提供能量底物。在持续运动过程中,糖原的渐进性分解为机体供能,其耗竭状态与运动性疲劳的发生密切相关,因此糖原代谢的动态平衡对运动能力具有重要调控作用[23]。现有研究表明,特定益生菌株可通过调节肌糖原、肝糖原、肌酸激酶及尿素氮等代谢指标来改善运动机能[14]。本研究发现,LB-CQPC12菌株能显著改善氧化应激小鼠的上述代谢指标及血乳酸水平,不仅有效减轻氧化损伤程度,还明显提升了实验动物的运动耐力和运动效能。
高强度运动状态下,机体代谢水平急剧升高,伴随血液循环加速和肌肉代谢产物积累。极限运动负荷会显著增加肝脏代谢压力,进而诱发肝组织损伤,此类损伤可以通过病理学观察得到确认[24]。本研究通过组织学观察证实,力竭跑步确实会导致肝脏病理改变,而补充LB-CQPC12能够明显改善这种损伤状况。
AMPK作为细胞能量代谢的核心调控因子,在缺氧、缺血或运动应激等条件下被激活。其活化可显著促进葡萄糖转运和脂肪酸氧化代谢,同时抑制糖异生、蛋白质合成及脂质合成等耗能过程。PGC-1α作为重要的转录共激活因子,在调控脂肪酸β氧化、葡萄糖稳态维持以及线粒体生物合成等生理过程中发挥关键作用。通过靶向调控AMPK/PGC-1α信号通路,可有效优化运动过程中的能量代谢效率,从而延缓运动性疲劳并提高运动耐力[25]。已有研究证实,规律性耐力训练能够上调骨骼肌组织中SOD和GPX等重要抗氧化酶的活性[26]。与这些发现相呼应,本研究发现LB-CQPC12干预组小鼠的SOD2和GPx1表达水平显著高于MC组,提示该菌株可能通过增强内源性抗氧化防御系统,发挥肝脏保护作用并改善运动能力。
科学证据表明,正常的肠道菌群可将膳食成分转化为具有生物活性的代谢产物,这些物质能够调节能量代谢相关因子,增强肌肉功能并优化运动能力[27]。特别值得注意的是,部分肠道共生菌具有代谢乳酸的能力,可减轻运动后乳酸堆积对肌肉组织的负面影响,进而提高运动耐力[28]。在氧化应激状态下,肠道菌群结构的变化会直接影响肠道生理功能。菌群失调可能导致肠蠕动异常、黏液分泌减少及肠屏障功能受损,促使内毒素易位进入血液循环,加剧氧化应激反应[29]。研究表明,氧化损伤可导致肠道优势菌群比例改变,表现为拟杆菌门丰度升高而双歧杆菌数量下降[30-31]。值得注意的是,厚壁菌门中的某些乳酸菌属菌株已被证实可增强内源性抗氧化酶活性[32]。本研究发现,经LB-CQPC12干预后,氧化应激小鼠肠道中厚壁菌门和双歧杆菌的相对丰度显著提高,而拟杆菌门比例则明显降低。作为乳酸菌属的一员,LB-CQPC12干预组小鼠肠道乳酸菌丰度显著高于正常对照组。这些结果与前期临床研究发现的运动员肠道菌群稳定性与运动表现呈正相关的结论相符[10],提示LB-CQPC12可能通过调节肠道微生态平衡来改善机体功能并增强运动能力。
本研究结果显示,LB-CQPC12能有效降低氧化应激水平,同时增强腓肠肌组织的能量代谢效率,最终显著提升实验动物的抗疲劳能力和运动表现。值得注意的是,在模拟人体常规摄入剂量条件下,LB-CQPC12表现出比传统抗氧化剂维生素C更优异的生物活性。这些发现不仅阐明了该菌株改善氧化应激状态下运动功能的潜在机制,更为开发针对高强度运动或衰老相关氧化损伤的功能性食品提供了理论依据,对推动国产益生菌产品的创新研发具有重要意义。需要指出的是,后续仍需开展更多临床研究以验证这些发现的普适性,这将是LB-CQPC12相关研究的重要发展方向。
[1] 关静涛, 廖力坚, 王丽娟.基于Nrf2信号通路的骨骼肌氧化应激作用探讨藏红花素对小鼠力竭运动疲劳的改善作用[J].中国食品添加剂, 2023, 34(6):66-77.GUAN J T, LIAO L J, WANG L J.Exploration of the oxidative stress effect of skeletal muscle based on Nrf2 signaling pathway:The improvement effect of crocin on exhaustive exercise fatigue in mice using[J].China Food Additives, 2023, 34(6):66-77.
[2] 左群, 于新凯.助运动员恢复疲劳的特殊营养物质[J].中国体育教练员, 2004, 12(3):16-17;48.ZUO Q, YU X K.Supplementary of special nutrition in recovery process of athletes[J].China Sports Coaches, 2004, 12(3):16-17;48.
[3] 高照, 杨杏萍, 张援, 等.运动后氧化应激水平及合理补充抗氧化剂的科学评价方法[J].中国组织工程研究, 2017, 21(28):4577-4584.GAO Z, YANG X P, ZHANG Y, et al.Scientific assessment of post-exercise oxidative stress and reasonable antioxidant supplement[J].Chinese Journal of Tissue Engineering Research, 2017, 21(28):4577-4584.
[4] 杨波, 周玉龙.咖啡活性成分咖啡豆醇改善递增负荷运动大鼠能量代谢的机制[J].分子植物育种, 2023, 21(8):2722-2729.YANG B, ZHOU Y L.Mechanism of kahweol, the active component of coffee, improving energy metabolism in rats with incremental load exercise[J].Molecular Plant Breeding, 2023, 21(8):2722-2729.
[5] 张媛, 漆正堂, 郭维, 等.耐力训练对高脂膳食大鼠骨骼肌线粒体脂肪氧化及PGC-1α基因表达的影响[J].天津体育学院学报, 2010, 25(3):193-196.ZHANG Y, QI Z T, GUO W, et al.Effects of endurance training on mitochondrial lipid oxidation and PGC-1α gene expression of high-fat diet rats’ skeletal muscle[J].Journal of Tianjin University of Sport, 2010, 25(3):193-196.
[6] 张国华. AMPK/PGC-1α通路与运动诱导的骨骼肌线粒体生物合成[J].广州体育学院学报, 2007, 27(6):100-104.ZHANG G H.AMPK/PGC-1α signaling pathway and exercise induced mitochondrial biogenesis of skeletal muscle[J].Journal of Guangzhou Sport University, 2007, 27(6):100-104.
[7] HUANG W C, WEI C C, HUANG C C, et al.The beneficial effects of Lactobacillus plantarum PS128 on high-intensity, exercise-induced oxidative stress, inflammation, and performance in triathletes[J].Nutrients, 2019, 11(2):353.
[8] SALARKIA N, GHADAMLI L, ZAERI F, et al.Effects of probiotic yogurt on performance, respiratory and digestive systems of young adult female endurance swimmers:A randomized controlled trial[J].Medical Journal of the Islamic Republic of Iran, 2013, 27(3):141-146.
[9] 周先容, 谭仟, 母健菲, 等.泡菜源乳酸菌的分离筛选及其对小鼠氧化应激水平的改善作用[J].现代食品科技, 2020, 36(9):17-25.ZHOU X R, TAN Q, MU J F, et al.Isolation and screening of lactic acid bacteria from pickle and its improvement effect on oxidative stress level in mice[J].Modern Food Science and Technology, 2020, 36(9):17-25.
[10] 乔德才, 陈敬, 魏桂芳, 等.采用DNA指纹图谱技术分析中长跑运动员肠道菌群结构特征[J].中国运动医学杂志, 2004, 23(5):517-521.QIAO D C, CHEN J, WEI G F, et al.Bacterial community structural dynamics in intestinal tract of long and middle distance runners by DNA fingerprinting analysis[J].Chinese Journal of Sports Medicine, 2004, 23(5):517-521.
[11] 张月华, 刘显东.有氧运动与营养干预对防治糖尿病的实验研究[J].体育科技文献通报, 2007, 15(10):97-99.ZHANG Y H, LIU X D.Research of aerobics and nutritional intervene on the prevention and cure in diabetes mellitus[J].Bulletin of Sport Science &Technology, 2007, 15(10):97-99.
[12] 聂晓莉, 薛琪, 罗仁, 等.维康颗粒对疲劳型亚健康大鼠线粒体再生功能的影响[J].暨南大学学报(自然科学与医学版), 2013, 34(2):150-153.NIE X L, XUE Q, LUO R, et al.Effect of Weikang granule on mitochondrial dysfunction in rats with sub-health fatigue[J].Journal of Jinan University (Natural Science &Medicine Edition), 2013, 34(2):150-153.
[13] 罗强, 李幸洋, 陈炼红, 等.传统发酵泡菜中乳酸菌种群组成及优良菌株产酸耐酸特性分析[J].食品科学, 2021, 42(2):158-163.LUO Q, LI X Y, CHEN L H, et al.Composition of lactic acid bacteria in traditional Chinese pickles and analysis of acid production and acid tolerance characteristics of excellent strains[J].Food Science, 2021, 42(2):158-163.
[14] 骞宇, 陈孝勇, 易若琨, 等.环境胁迫下食窦魏斯氏菌的耐受性评价[J].食品工业科技, 2018, 39(24):128-133;138.QIAN Y, CHEN X Y, YI R K, et al.Tolerability of Weissella cibaria under different environmental stresses[J].Science and Technology of Food Industry, 2018, 39(24):128-133;138.
[15] 贺波, 赵欣, 谭晓红, 等.植物乳植杆菌CQPC03提升氧化应激损伤小鼠运动能力及肝脏保护作用[J].食品工业科技, 2025, 46(11):359-368.HE B, ZHAO X, TAN X H, et al.Improvement of exercise ability and liver protection in oxidative stress-induced mice by lactiplantibacillus plantarum CQPC03[J].Science and Technology of Food Industry, 2025, 46(11):359-368.
[16] 周桢, 凌琪华, 王倩, 等.清胰汤对肝缺血再灌注损伤小鼠的肝脏保护作用及铁死亡机制研究[J].中国中医急症, 2024, 33(1):27-31.ZHOU Z, LING Q H, WANG Q, et al.Study on the protective effect of qingyi decoction on hepatic ischemia-reperfusion injury in mice and the mechanism of ferroptosis[J].Journal of Emergency in Traditional Chinese Medicine, 2024, 33(1):27-31.
[17] 史梅莓, 伍亚龙, 杨恺, 等.四川泡菜中潜在益生性植物乳杆菌的筛选及安全性评价[J].食品工业科技, 2022, 43(22):165-172.SHI M M, WU Y L, YANG K, et al.Screening and safety evaluation of potential probiotic Lactobacillus plantarum in Sichuan Paocai[J].Science and Technology of Food Industry, 2022, 43(22):165-172.
[18] 孟祥晨, 李雪, 姚蕾, 等.两株植物乳杆菌作为潜在益生菌的体外评价[J].东北农业大学学报, 2015, 46(9):44-51.MENG X C, LI X, YAO L, et al.In vitro evaluation of two Lactobacillus plantarum as potencial probiotics[J].Journal of Northeast Agricultural University, 2015, 46(9):44-51.
[19] 曹海信, 赵启权, 李世明.生物自由基与运动性疲劳的研究进展[J].四川体育科学, 2006, 25(4):33-35.CAO H X, ZHAO Q Q, LI S M.Study progress in free radical and sport fatigue[J].Sichuan Sports Science, 2006, 25(4):33-35.
[20] 曹露, 漆正堂, 刘纯羽, 等.高强度间歇运动和中等强度耐力运动对DEN暴露小鼠脂肪恶病质的影响及机制研究[J].中国体育科技, 2025, 61(3):55-69.CAO L, QI Z T, LIU C Y, et al.Effects and mechanisms of high intensity interval exercise and moderate intensity endurance exercise on adipose Cachexia in DEN-exposed mice[J].China Sport Science and Technology, 2025, 61(3):55-69.
[21] 邓潇潇, 周雅琳, 冯霞, 等.Lactobacillus delbrueckii subsp.bulgaricus KSFY07对D-半乳糖诱导的氧化衰老小鼠运动能力的提升作用[J].食品与发酵工业, 2023, 49(7):49-58.DENG X X, ZHOU Y L, FENG X, et al.Enhancement of Lactobacillus delbrueckii subsp.bulgaricus KSFY07 on exercise capacity in D-galactose-induced oxidative aging mice[J].Food and Fermentation Industries, 2023, 49(7):49-58.
[22] 孙建, 康宗华, 郭焘, 等.槟榔芯中生物碱的提取及其对睡眠干扰小鼠体力疲劳模型的影响[J].食品与发酵科技, 2025, 61(1):49-55.SUN J, KANG Z H, GUO T, et al.Extraction of alkaloids from betel nut cores and their effects on a sleep-disturbed mice model of physical fatigue[J].Food and Fermentation Science &Technology, 2025, 61(1):49-55.
[23] 刘园园, 崔晶, 金鑫.芍药花多糖理化特性分析及其抗运动疲劳作用研究[J].保鲜与加工, 2025, 25(3):133-142.LIU Y Y, CUI J, JIN X.Analysis of physicochemical properties and anti-exercise fatigue effects of polysaccharides from Paeonia lactiflora flower[J].Storage and Process, 2025, 25(3):133-142.
[24] 陈瑶, 郭子渊.血清肌酸激酶与运动训练控制[J].冰雪运动, 2014, 36(4):75-79.CHEN Y, GUO Z Y.Serum creatine kinase and sports training control[J].China Winter Sports, 2014, 36(4):75-79.
[25] 张锐, 白海军, 刘佳.松杉灵芝多糖结构分析及对小鼠运动性疲劳的缓解作用[J].中国食品添加剂, 2023, 34(4):69-78.ZHANG R, BAI H J, LIU J.Structural analysis of Ganoderma tsugae polysaccharide and its alleviative effect on exercise-induced fatigue in mice[J].China Food Additives, 2023, 34(4):69-78.
[26] 杨谦慧. 运动维护人体屏障功能的AMPK途径探究[J].体育科技文献通报, 2024, 32(9):271-274.YANG Q H.Exercise in maintaining the body’s barrier function by AMPK pathway[J].Bulletin of Sport Science &Technology, 2024, 32(9):271-274.
[27] 黄彬. 运动、氧化应激与机体的抗氧化能力[J].湖北体育科技, 2001, 20(3):61-63.HUANG B.Exercises, oxidative stress and body antioxidant capacity[J].Journal of Hubei Sports Scicnce, 2001, 20(3):61-63.
[28] 李颖, 王一芳, 林瑜辉, 等.肠道菌群介导脑卒中后功能修复的研究进展[J].临床神经病学杂志, 2024, 37(2):149-152.LI Y, WANG Y F, LIN Y H, et al.Research progress on the critical role of gut microbiota mediating in functional recovery after stroke[J].Journal of Clinical Neurology, 2024, 37(2):149-152.
[29] 孙红梅, 孙强, 张茂林.耐力运动过程中肠道菌群与线粒体交互作用研究进展[J].山东体育学院学报, 2022, 38(4):76-84.SUN H M, SUN Q, ZHANG M L.Research progress on the interaction between intestinal flora and mitochondria during endurance exercise[J].Journal of Shandong Sport University, 2022, 38(4):76-84.
[30] 毛玲娜, 宋震亚.与久坐者相比, 职业运动员的肠道群在代谢组分, 尤其是功能代谢水平上有所不同[J].中华外科杂志, 2017, 55(9):711.MAO L N, SONG Z Y.The microbiome of professional athletes differs from that of more sedentary subjects in composition and particularly at the functional metabolic level[J].Chinese Journal of Surgery, 2017, 55(9):711.
[31] 杨启航, 蒲锐, 陈子扬, 等.肠道菌群与骨质疏松及运动干预[J].中国组织工程研究, 2024, 28(26):4250-4256.YANG Q H, PU R, CHEN Z Y, et al.Intestinal flora and osteoporosis and exercise intervention[J].Chinese Journal of Tissue Engineering Research, 2024, 28(26):4250-4256.
[32] 刘宝军, 王映淞, 邢静.肠道菌群与肥胖的关联及运动干预策略研究[J].当代体育科技, 2025, 15(1):5-8.LIU B J, WANG Y S, XING J.Research of the association between gut microbiota and obesity and exercise intervention strategies[J].Contemporary Sports Technology, 2025, 15(1):5-8.