高原地区低温、低氧和低压的环境对人体的生理机能和代谢过程产生深远影响,如果机体未能及时适应高海拔环境,便可能诱发一系列高原病。低压低氧环境常导致中枢神经系统功能障碍,继而引发高原缺氧性脑病,其典型症状包括头痛、疲劳、精神异常以及共济失调等,严重时甚至可能危及生命[1]。因此,探索应对脑缺氧的有效防护措施成为高原病研究的关键方向之一。目前,阶梯习服、综合锻炼和低氧预适应等方法可在一定程度上增强机体的高原适应能力[2],但耗时较长,难以满足快速进驻高原的需求。此外,临床常用的药物如碳酸苷酶抑制剂(乙酰唑胺、醋甲唑胺等)和激素类药物(地塞米松、布地奈德等)在带来一定疗效的同时也存在显著的毒副作用[3]。例如,乙酰唑胺可能导致机体麻木、味觉障碍、多尿及疲劳[4],地塞米松则可诱发高血糖和骨质疏松等[5]。因此,开发安全高效的防治手段成为急需攻克的难题,其中膳食干预被视为缓解缺氧损伤的重要研究方向。
蔓菁是传统高原居民的重要食物来源之一,因其耐寒、耐贫瘠的特点,成为高寒地区的重要作物。蔓菁的根、茎、叶均可食用,且富含多糖、吲哚、皂苷、黄酮等诸多功能成分,表现出抗缺氧、降血脂及抗疲劳等诸多功效[6]。然而,已有研究只是通过常压耐缺氧实验、急性脑缺血性缺氧实验和亚硝酸钠中毒存活实验表明蔓菁能延长小鼠的缺氧存活时间[7],初步显示蔓菁具有抗缺氧活性,但并未模拟真实的高原低压低氧环境,也未深入探究其对缺氧诱导脑损伤的具体保护作用及潜在机制。近年来,肠道菌群已被证明在机体健康中扮演着重要角色,肠道微环境的紊乱也与低压低氧息息相关。有研究发现,枸杞多糖能通过调节肠道菌群的失衡减轻脑缺血再灌注损伤[8],表明肠道菌群稳态在脑功能的维持和脑损伤的修复中发挥着重要作用,这为肠道微生物的调控或脑保护提供新视角。基于此,本研究对蔓菁在低压低氧小鼠模型中的脑损伤保护作用及肠道菌群的影响进行全面分析,揭示蔓菁发挥抗缺氧功效的实现途径,为缺氧诱导脑损伤的防治提供新的研究思路。
1 材料与方法
1.1 材料与试剂
蔓菁购自西藏拉萨;超氧化物歧化酶(superoxide dismutase, SOD)、过氧化氢酶(catalase, CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)、丙二醛(malondialdehyde, MDA)、ATP、己糖激酶(hexokinase, HK)、磷酸-6-果糖激酶(phosphofructokinase, PFK)、丙酮酸激酶(pyruvate kinase, PK)、乳酸脱氢酶(lactate dehydrogenase, LDH)检测试剂盒,南京建成科技有限公司;40 g/L多聚甲醛,兰杰柯科技有限公司;25 g/L戊二醛,上海迈瑞尔化学技术有限公司;TUNEL细胞凋亡检测试剂盒、HIF-1α一抗、Occludin一抗、ZO-1一抗、10 g/L锇酸、EPON 812树脂、醋酸铀、枸橼酸铅,武汉塞维尔生物科技有限公司;AMPure XP beads试剂盒,上海美吉生物医药科技有限公司。
1.2 仪器与设备
ProOX-810动物低压氧控制系统,上海塔望智能科技有限公司;KQ-600KDB高功率数控超声仪,昆山市超声仪器有限公司;RE-52AA旋转蒸发仪,上海亚荣生化仪器厂;Epoch2全波长多功能酶标仪,美国伯腾仪器有限公司;NIKON ECLIPSE C1荧光显微镜、NIKON ECLIPSE E100光学显微镜,日本尼康仪器有限公司;JEM-2100透射电镜,日本电子株式会社;QuantiFluor-ST型荧光计,上海美吉生物医药科技有限公司。
1.3 实验方法
1.3.1 蔓菁水提物的制备
蔓菁洗净晒干后切块粉碎,取10 g蔓菁粉末,加入100 mL蒸馏水,浸泡0.5 h后,用沸水回流提取1 h,收集澄清滤液并重复提取2次。将滤液合并后于60 ℃旋蒸浓缩,并用蒸馏水定容至100 mL得蔓菁水提物(Brassica rapa L.extract, BE)[9]。
1.3.2 低压低氧小鼠模型构建
6周龄雄性BALB/c小鼠购自维通利华实验动物有限公司,动物方案已获得江南大学动物伦理委员会的批准(JN.No20240330b0700513[148])。如图1所示,适应性饲喂5 d后,将所有小鼠随机分为3组(n=10):常压常氧(NN)组、低压低氧(HH)组和1 g/(kg·d)蔓菁水提物(BE)组。从第6天开始,每天早上灌胃给药,连续灌胃7 d。第13天时,将HH组和BE组小鼠置于低压氧舱中适应30 min后,以5 m/s的速度升至6 000 m,缺氧7 d,期间每天定时打开低压氧舱进行灌胃给药[10-11]。低压低氧暴露结束后,以5 m/s的速度将低压氧舱降至正常海拔,将小鼠逐笼取出,采用异氟烷吸入麻醉,眼球取血后脱臼处死,立即解剖取其脑、结肠组织及内容物。此外,试验期间记录各组小鼠的日均采食量及日均饮水量,发现各组间均无显著性差异(P>0.05)。
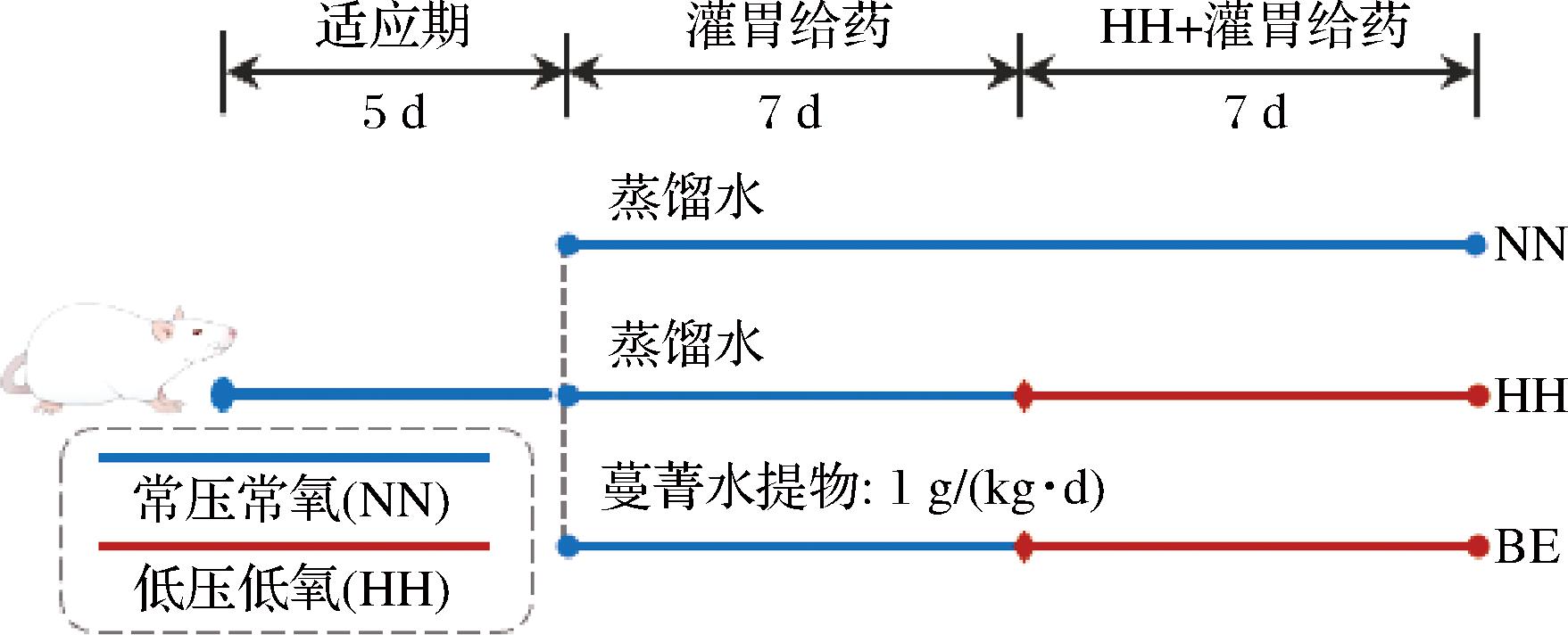
图1 动物实验方案
Fig.1 Design for animal experiments
1.3.3 组织病理学检测
脑组织用40 g/L多聚甲醛固定后,脱水浸蜡并置于包埋机中,待蜡块凝固后切成5 μm厚的切片。然后进行脱蜡(二甲苯Ⅰ、Ⅱ)和脱水(分级乙醇),并用苏木精-伊红(hematoxylin-eosin,HE)染色。最后采用光学显微镜观察脑组织的病理变化。
1.3.4 细胞凋亡检测
固定后的脑组织经石蜡包埋后切成4 μm薄片,脱蜡至水后进行修复(蛋白酶K工作液),再滴加破膜工作液进行孵育。加入末端转移酶、脱氧尿苷三磷酸及平衡缓冲液于37 ℃孵育2 h后,用DAPI染液避光孵育10 min,封片后通过荧光显微镜进行观察。
1.3.5 免疫组化分析
将脑组织和结肠组织切片用柠檬酸钠缓冲液进行抗原修复,30 g/L牛血清白蛋白溶液封闭处理后加入对应的一抗(HIF-1α、Occludin或ZO-1一抗),并在4 ℃下过夜孵育。接着加入小鼠/兔二抗孵育50 min后,滴加二氨基联苯胺显色液,并用苏木精复染。最后经梯度乙醇脱水和封片后用光学显微镜获取免疫组化图像,并用Image J软件分析。
1.3.6 透射电镜分析
取约1 mm×1 mm×1 mm海马CA1区组织块,立即投入25 g/L戊二醛中固定。然后在10 g/L锇酸中固定2 h,并于室温下通过梯度乙醇脱水。将样品包埋于EPON 812树脂后切成约60 nm超薄切片,经醋酸铀和枸橼酸铅染色后,利用透射电镜采集图像进行观察。
1.3.7 生化指标测定
根据试剂盒说明书,检测小鼠血清中SOD、CAT、GSH-Px和MDA水平,以及海马组织中ATP、HK、PFK、PK和LDH含量。
1.3.8 肠道微生物组测序
首先,从结肠内容物中提取基因组DNA,并利用通用引物(341F,5′-CCTACGGGNGGCWGCAG-3′;805R,5′-GACTACHVGGGTATCTAATCC-3′)对样品16S rRNA基因的V3~V4高变区进行PCR扩增。扩增产物经20 g/L琼脂糖凝胶电泳检测以确认扩增效果。使用AMPure XP beads试剂盒对PCR产物进行纯化处理后,用QuantiFluor-ST微型荧光计定量检测,检测合格后采用MiSeq测序平台进行PE300测序。
1.4 数据统计与分析
实验数据以“平均数±标准差”表示。采用IBM SPSS Statistics 26进行单因素方差分析(ANOVA)计算组间差异,并采用GraphPad Prism 9软件绘图。
2 结果与分析
2.1 BE对HH小鼠脑组织病理学的影响
为了确定BE对脑损伤的保护功效,采用HE染色对脑组织进行形态学观察,代表性的病理切片如图2-a所示。HH组小鼠的海马和皮质区表现出明显的病理损伤,细胞核固缩、深染,细胞形态异常且排列稀疏,有一定的空泡化现象,说明在HH状态下小鼠脑组织会发生一定程度的水肿,并可能伴随细胞凋亡或功能障碍。而与HH组相比,BE组小鼠的海马和皮质区细胞皱缩和深染现象减轻,细胞结构较为清晰且排列整齐。表明BE对HH引起的脑组织水肿有一定的预防作用,并可能抑制细胞凋亡和炎症反应,在一定程度上恢复了脑组织稳态,从而维持脑组织的正常结构。

a-HE染色;b-免疫荧光;c-TUNEL阳性细胞比例
图2 BE对HH小鼠脑组织病理学及细胞凋亡的影响
Fig.2 Effect of BE on brain histopathology and cell apoptosis in HH mice
注:*P<0.05和**P<0.01表示与HH组比较具有统计学差异,#P<0.05和##P<0.01表示与NN组比较具有统计学差异(下同)。
2.2 BE对HH小鼠脑组织细胞凋亡的影响
缺氧或缺血等应激刺激可激活内源性凋亡途径,尤其在神经系统中,脑组织对缺氧环境非常敏感,过度的细胞凋亡会导致脑功能损害[12],因此抑制细胞凋亡是减轻脑组织缺氧损伤的有效治疗策略。为了探究BE是否可能通过抑制细胞凋亡缓解脑组织病理损伤,采用TUNEL染色进行观察,结果如图2-b~图2-c所示。HH组脑组织中观察到大量阳性凋亡细胞,而BE组海马CA1、CA2、CA3、DG和皮质区中细胞凋亡率与HH组相比分别显著下调56.56%(P<0.05)、53.24%(P<0.01)、51.71%(P<0.05)、58.87%(P<0.05)和67.23%(P<0.01)。结果表明,BE可能通过抑制缺氧诱导的细胞凋亡,进而减轻脑组织病理损伤和维持脑组织结构的完整性,使受损的脑功能得到恢复。
2.3 BE对HH小鼠氧化应激及能量代谢的影响
急性和长期暴露于HH环境可导致线粒体电子传递链中还原当量的积累,进一步增加活性氧(reactive oxygen species,ROS)的产生,导致氧化应激损伤。如图3-a~图3-d所示,与NN组相比,HH组小鼠血清中抗氧化酶SOD、CAT和GSH-Px的活性分别显著下调16.34%(P<0.01)、39.35%(P<0.01)和37.42%(P<0.05),而MDA含量显著上调647.37%(P<0.01)。BE干预后血清中抗氧化酶活性有所恢复,SOD、CAT和GSH-Px活性与HH组相比分别上调14.94%(P<0.01)、15.91%和40.55%,且SOD含量接近正常水平,同时MDA含量显著下调74.41%(P<0.01)。说明BE能通过提升抗氧化防御系统的活性,有效减轻缺氧诱导的氧化损伤。

a-SOD;b-CAT;c-GSH-Px;d-MDA;e-ATP;f-HK;g-PFK;h-PK;i-LDH
图3 BE对HH小鼠氧化应激及能量代谢的影响
Fig.3 Effect of BE on oxidative stress and energy metabolism in HH mice
在低氧环境下,由于氧气供应不足,导致线粒体氧化磷酸化过程受限,脑组织被迫通过增强无氧代谢来弥补能量供给的不足[13]。由图3-e~图3-i可知,HH组海马组织中ATP含量有一定程度的降低,而BE干预后ATP含量显著上调17.19%(P<0.05)。此外,HH组海马组织中HK、PFK和PK活力有下降趋势,而LDH活力显著增加(P<0.01)。BE干预后海马组织中HK、PFK和PK活力与HH组相比分别显著上调30.36%(P<0.01)、32.77%(P<0.01)和22.89%(P<0.05),LDH活力显著下调7.84%(P<0.05),从而有助于提高海马组织中的ATP含量。说明BE能够增加HH环境下海马组织中无氧酵解关键酶的活力,保持其正常的能量代谢。
2.4 BE对HH小鼠海马CA1区线粒体超微结构的影响
在细胞损伤的过程中,特别是神经组织缺氧造成线粒体功能障碍,引起细胞膜离子泵功能下降导致线粒体肿胀,甚至成为球形空泡化线粒体[14]。作为细胞能量代谢的核心,线粒体功能障碍不仅会导致能量供应不足,无法维持细胞的基本代谢需求,还会引起ROS的过度积累诱发氧化应激损伤。此外,线粒体外膜破裂会释放细胞色素c,从而激活凋亡级联反应,导致细胞死亡[15]。因此通过观察线粒体结构是否改善,可以评估BE的保护作用是否涉及线粒体相关的机制。如图4所示,红色箭头代表肿胀的线粒体,HH组海马CA1区线粒体(M)发生显著改变,其内部嵴结构消失,呈现空泡状形态,外膜出现模糊和断裂,同时伴随粗面内质网(rough endoplasmic reticulum,RER)扩张,说明线粒体功能已严重受损。而BE干预后线粒体形态基本完整,肿胀程度明显减轻,说明BE可能通过维持线粒体的正常结构和功能,进而调控线粒体介导的氧化应激、能量代谢和凋亡信号等途径,阻断了缺氧损伤的恶性循环。
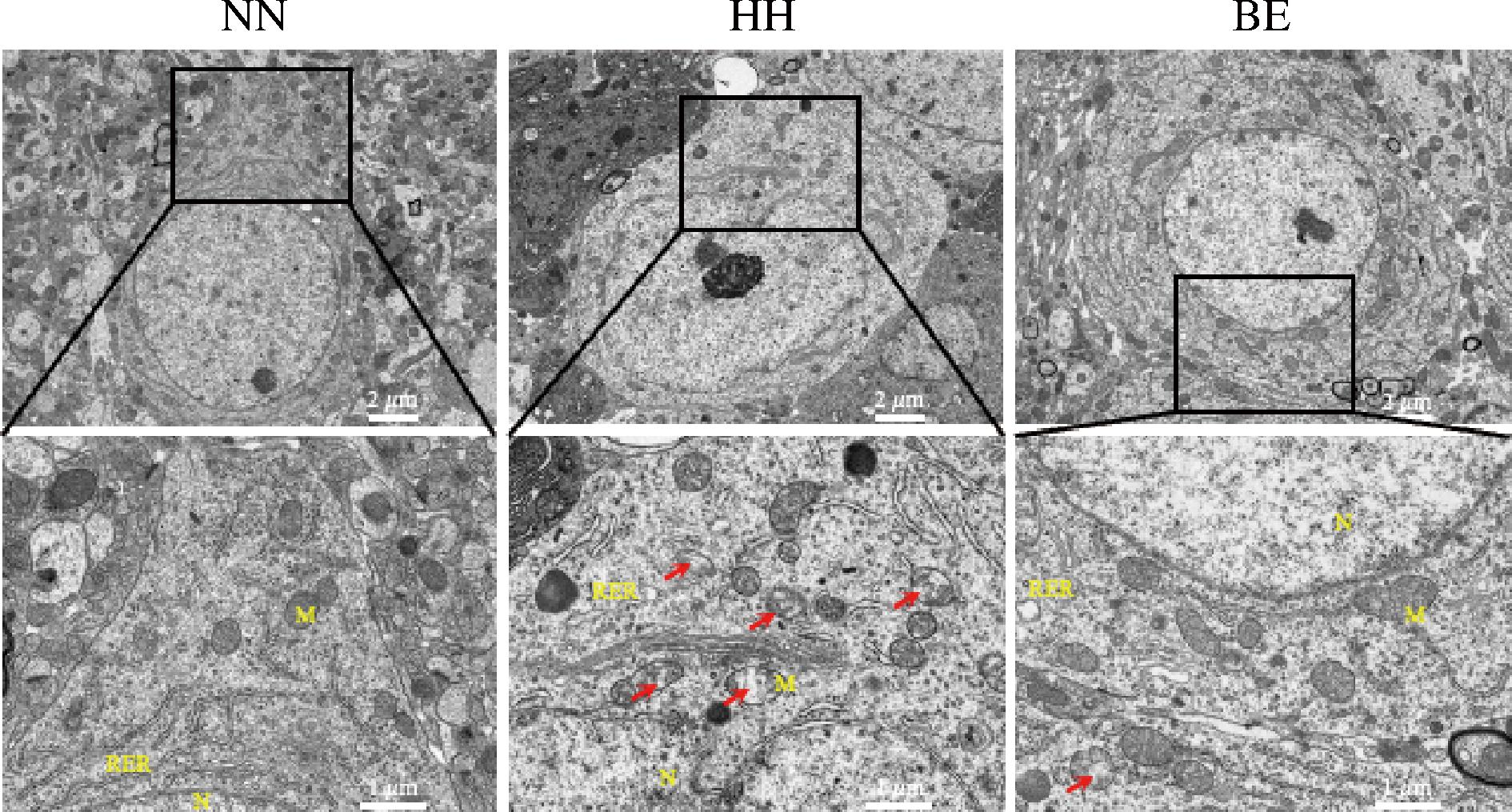
图4 BE对HH小鼠海马CA1区线粒体超微结构的影响
Fig.4 Effect of BE on mitochondrial ultrastructure in the hippocampal CA1 region of HH mice
2.5 BE对HH小鼠脑组织HIF-1α表达的影响
HIF-1α是缺氧响应的核心调节因子,其通过调控一系列靶基因的表达,帮助细胞适应低氧供应。HIF-1α能够促进无氧酵解途径以增加ATP的供能,并诱导血管内皮生长因子的表达促进血管生成,还能激活抗氧化防御机制减轻氧化损伤[16]。因此通过测定HIF-1α的表达,可以评估BE干预是否增强了脑组织对缺氧的适应能力,从而提供对BE保护机制的深入理解。如图5所示,HH组脑组织中呈现大量HIF-1α阳性细胞,说明HH环境能够激活HIF-1α以促进细胞适应和生存。与HH组相比,BE干预能够进一步增加海马组织中HIF-1α的表达,使海马CA1区HIF-1α平均光密度值显著上调11.39%(P<0.05),说明BE可以增强脑组织对缺氧的适应能力,也揭示了BE可能通过调控HIF-1α下游信号通路减轻缺氧损伤。相反,BE干预却使皮质区HIF-1α平均光密度值显著下调13.37%(P<0.05),这可能因为不同脑区对BE干预的响应有所不同,海马组织可能更依赖于HIF-1α来应对低氧环境,而在皮质区中BE可能引发过度的抗氧化作用缓解HH引起的氧化应激,从而减少细胞对HIF-1α的依赖。

a-免疫组化;b-HIF-1α平均光密度值
图5 BE对HH小鼠脑组织HIF-1α表达的影响
Fig.5 Effect of BE on HIF-1α expression in brain tissue of HH mice
2.6 BE对HH小鼠肠道菌群的影响
2.6.1 BE对HH小鼠肠道紧密连接蛋白的影响
Occludin和ZO-1是调节肠道通透性和维持肠黏膜屏障功能中的关键紧密连接蛋白,而肠道通透性的增加会导致有害物质透过肠壁进入血液,诱发全身性炎症反应[17]。如图6所示,与NN组相比,HH组结肠组织中Occludin和ZO-1蛋白的表达分别显著下调25.57%(P<0.05)和8.11%(P<0.05),说明肠道屏障功能受损。而BE干预可在一定程度上提高Occludin和ZO-1蛋白的表达,尤其使ZO-1蛋白的表达显著上调8.60%(P<0.05),并恢复至正常水平。表明BE能够改善肠道组织形态并维持肠道屏障功能,间接减轻全身炎症对脑组织的损伤。

a-Occludin免疫组化;b-ZO-1免疫组化;c-Occludin平均光密度值;d-ZO-1平均光密度值
图6 BE对HH小鼠肠道紧密连接蛋白的影响
Fig.6 Effect of BE on intestinal tight junction proteins in HH mice
2.6.2 BE对HH小鼠肠道菌群多样性的影响
越来越多的研究证实了肠道菌群对大脑健康的重要调控作用,为了探究BE作用于肠道菌群改善缺氧诱导脑损伤的可能机制,进行了肠道微生物组测序分析。α多样性用于评估群落的丰富度及单个样本的多样性,如图7-a~图7-d所示,BE干预后Ace和Chao 1指数与HH组相比分别显著上调21.24%(P<0.01)和21.15%(P<0.01),但是2组之间的Simpson和Shannon指数无显著差异,说明BE可在一定程度上影响HH小鼠肠道菌群的丰富度。β多样性分析中样本点之间的距离反映了微生物群落组成的相似性,如图7-e~图7-f所示,BE组与HH组的样本点分布在不同区域,距离疏远,样本聚类分析显示了类似的结果(图7-g),说明BE显著重塑了HH小鼠的肠道菌群。
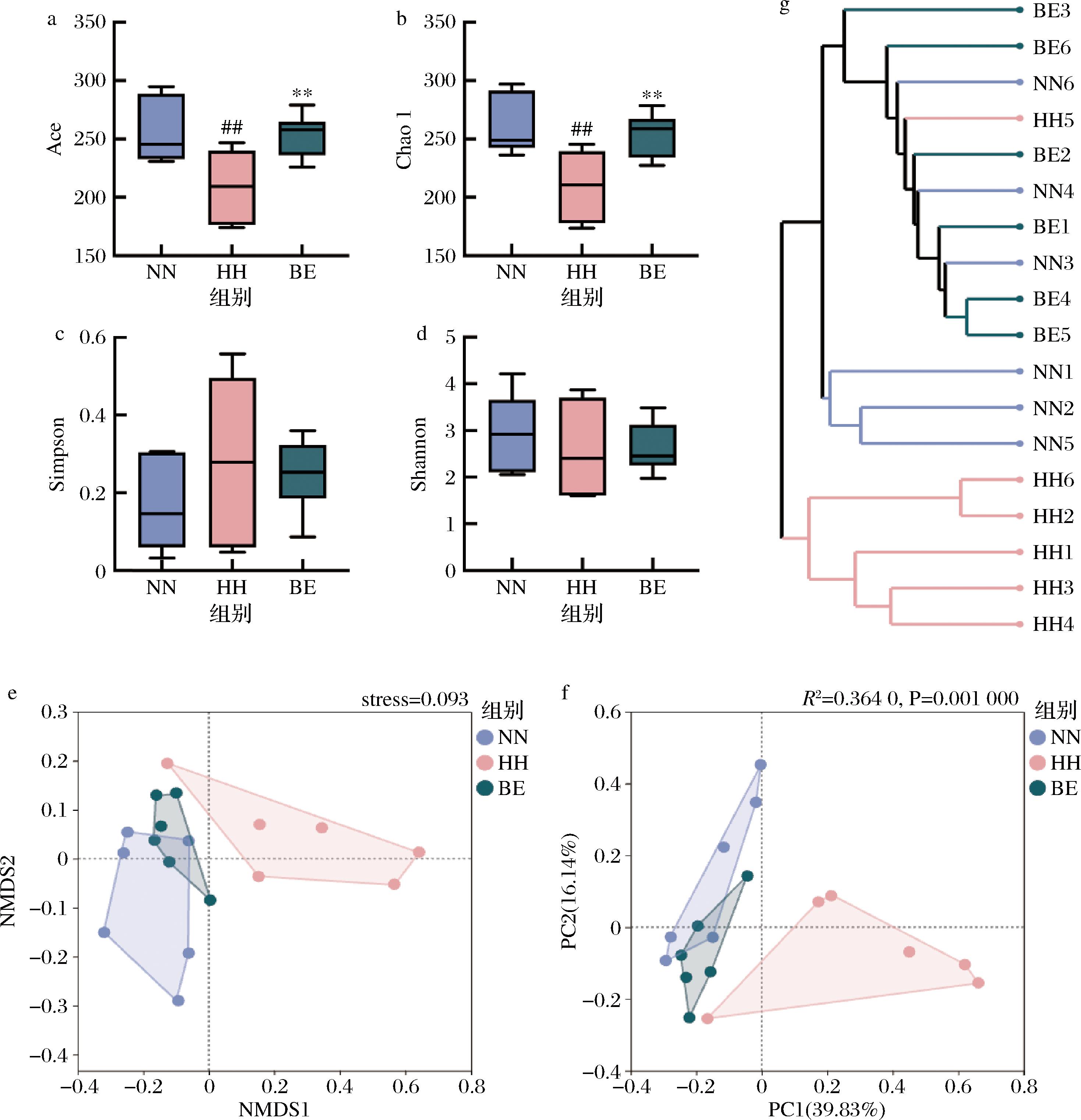
a-Ace指数;b-Chao 1指数;c-Simpson指数;d-Shannon指数;e-非度量多维尺度分析 (non-metric multidimensional scaling,NMDS);f-主坐标分析(principal coordinates analysis,PCoA);g-聚类树形图
图7 BE对HH小鼠肠道菌群多样性的影响
Fig.7 Effect of BE on the diversity of gut microbiota in HH mice
2.6.3 BE对HH小鼠肠道菌群组成的影响
如图8所示,在属水平上对HH小鼠的肠道菌群组成进行分析。结果表明,与NN组相比,HH组小鼠中Lactobacillus、Alistipes和Candidatus_Saccharimonas的相对丰度分别显著下调56.74%(P<0.05)、72.33%(P<0.05)和99.93%(P<0.01),而Streptococcus的相对丰度显著上调649.13%(P<0.01)。与HH组相比,BE干预后Lactobacillus的相对丰度显著上调192.06%(P<0.01),而Erysipelatoclostridium和Streptococcus的相对丰度分别显著下调99.57%(P<0.05)和86.90%(P<0.01)。基于LEfSe(linear discriminant analysis effect size)分析进一步探索各组中存在显著差异的微生物,HH组的特征微生物是Bacteroides、Erysipelatoclostridium和Escherichia-Shigella等,BE干预后的特征微生物为Anaeroplasma。已有研究表明,Lactobacillus具有神经保护作用,能减少多巴胺能神经元的死亡和胶质反应[18];Alistipes与短链脂肪酸的生成密切相关,有助于提高宿主免疫系统并维持肠道屏障功能[19];Candidatus_Saccharimonas的丰度与抗氧化酶活性呈正相关,并与炎症因子水平呈负相关[20];Anaeroplasma的富集与紧密连接蛋白的表达呈正相关[21]。相反,Erysipelatoclostridium 是促进小鼠肠道屏障损伤的致病菌[22],Streptococcus可诱发炎症和疾病[23],而Escherichia-Shigella可通过刺激NF-κB信号通路诱导TNF-α和IL-1β的分泌[24]。以上结果表明,BE可能通过改善肠道菌群组成,促进Lactobacillus、Alistipes、Candidatus_Saccharimonas和Anaeroplasm等有益菌的增殖,抑制Erysipelatoclostridium、Streptococcus和Escherichia-Shigella等有害菌的生长,进而缓解缺氧损伤。

a-肠道菌属的相对丰度;b-关键菌群分析;c-LEfSe分析
图8 BE对HH小鼠肠道菌群组成的影响
Fig.8 Effect of BE on the composition of gut microbiota in HH mice
2.7 肠道菌群与脑保护指标的相关性分析
如图9所示,对各组小鼠肠道菌属与细胞凋亡、氧化应激、能量代谢和紧密连接蛋白等相关指标进行相关性分析。Candidatus_Saccharimonas、Enterorhabdus、Eubacterium_siraeum和Candidatus_Arthromitus与TUNEL阳性凋亡细胞数呈显著负相关(P<0.05),且与抗氧化能力呈显著正相关(P<0.05)。此外,BE干预上调的Eubacterium_xylanophilum、Alistipes和Lactobacillus与能量代谢水平呈显著正相关(P<0.05)。Occludin和ZO-1的表达与Eubacterium_xylanophilum和Monoglobus呈显著正相关(P<0.05),说明肠道菌群可能通过促进紧密连接蛋白的表达维护肠道屏障的完整性。因此在HH环境下,BE可能通过调节肠道菌群,尤其是Candidatus_Saccharimonas、Enterorhabdus、Eubacterium_xylanophilum和Lactobacillus等肠道有益菌,进一步与细胞凋亡、氧化应激、能量代谢和紧密连接蛋白表达相联系,从而对缺氧诱导的脑损伤发挥保护效应。
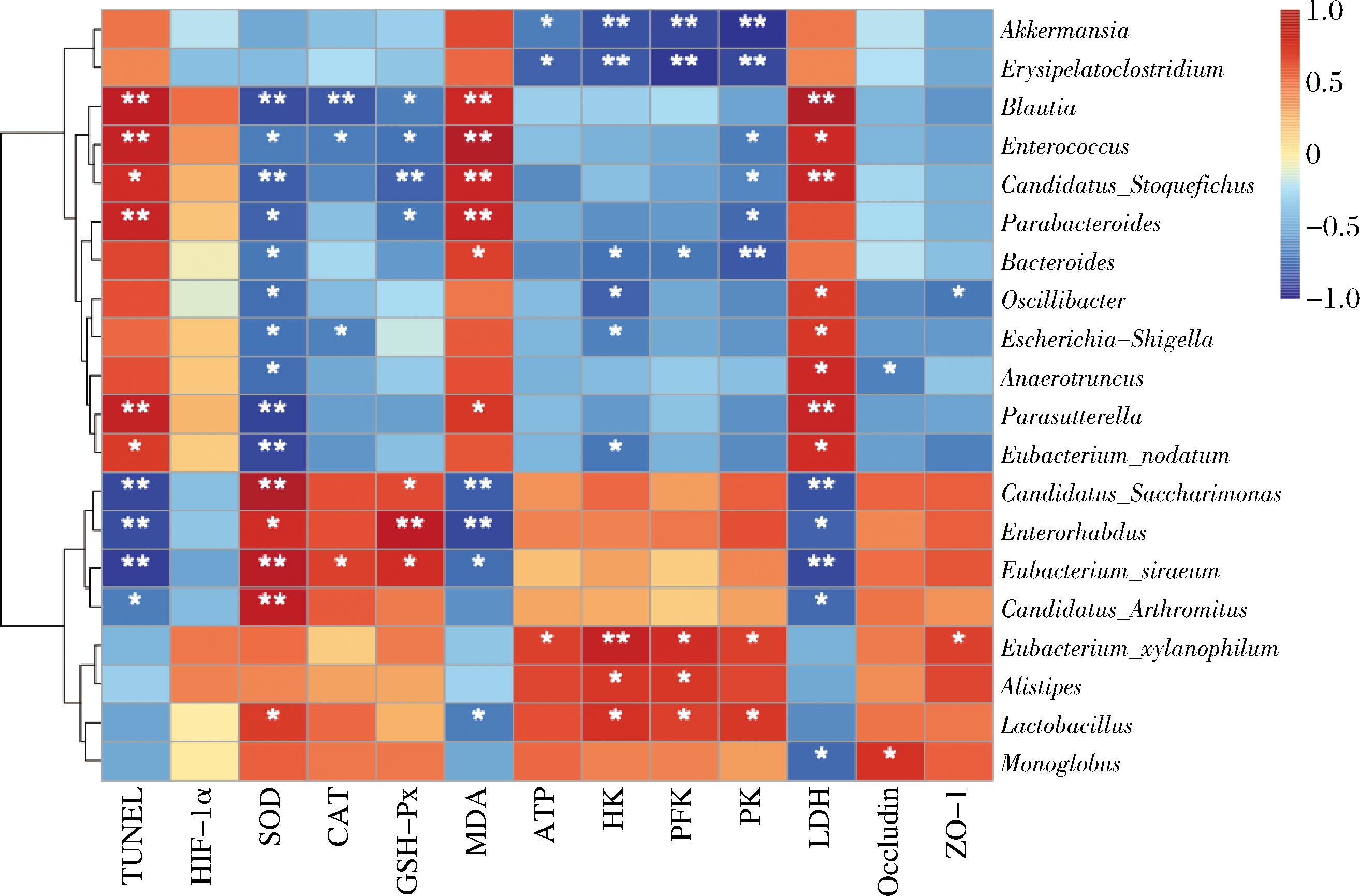
图9 肠道菌群与脑保护指标的相关性
Fig.9 Correlation between gut microbiota and brain protection indicators
注:*表示在P<0.05水平上相关,**表示在P<0.01水平上相关。
3 结论与讨论
本文以蔓菁为研究对象,利用模拟海拔高度6 000 m的低压低氧小鼠模型,系统探讨了蔓菁对缺氧诱导脑损伤的保护作用及潜在机制。结果表明,蔓菁能显著改善脑组织病理损伤,保护神经元免受缺氧诱导的细胞凋亡,并提高抗氧化酶及无氧酵解关键酶的活性以缓解氧化应激损伤和维持正常的能量代谢。此外,蔓菁还能改善线粒体功能障碍以调控线粒体介导的下游过程,同时通过上调HIF-1α的表达增强机体对低氧的适应。进一步研究表明,蔓菁能维持肠道屏障功能,并调节低压低氧小鼠肠道菌群的组成和多样性,促进Lactobacillus、Alistipes、Candidatus_Saccharimonas和Anaeroplasm等有益菌的增殖,抑制Erysipelatoclostridium、Streptococcus和Escherichia-Shigella等有害菌的生长。相关性分析显示,多种肠道菌属与细胞凋亡、氧化应激、能量代谢和紧密连接蛋白的表达呈现显著的相关性,从而可能对缺氧诱导的脑损伤发挥保护效应。
综上,本研究揭示了蔓菁改善缺氧诱导脑损伤的多重潜在机制,包括抑制细胞凋亡、缓解氧化应激、调节能量代谢、维持线粒体功能、增强低氧适应能力以及调节肠道菌群。研究结果不仅有助于理解蔓菁抗缺氧的作用机制,也为蔓菁作为膳食补充成分在防治缺氧损伤中的应用提供了理论支持。
[1] 刘梦瑶, 赵春阳, 商廿颍, 等.高原缺氧性脑病的非临床药效学评价体系 [J].药学学报, 2023, 58(6):1515-1520.LIU M Y, ZHAO C Y, SHANG N Y, et al.Non clinical pharmacodynamic evaluation system of high-altitude hypoxic brain injury [J].Acta Pharmaceutica Sinica, 2023, 58(6):1515-1520.
[2] XIE J X, XIE S W, ZHONG Z F, et al.Hypoxic preacclimatization combining intermittent hypoxia exposure with physical exercise significantly promotes the tolerance to acute hypoxia[J].Frontiers in Physiology, 2024, 15:1367642.
[3] 史喜德, 周世强, 刘峰舟, 等.高原低氧习服的研究进展[J].中国现代医学杂志, 2022, 32(24):40-49.SHI X D, ZHOU S Q, LIU F Z, et al.Research progress on acclimatization to high-altitude hypoxia[J].China Journal of Modern Medicine, 2022, 32(24):40-49.
[4] SCHMICKL C N, OWENS R L, ORR J E, et al.Side effects of acetazolamide:A systematic review and meta-analysis assessing overall risk and dose dependence[J].BMJ Open Respiratory Research, 2020, 7(1):e000557.
[5] MALKAWI A K, ALZOUBI K H, JACOB M, et al.Metabolomics based profiling of dexamethasone side effects in rats[J].Frontiers in Pharmacology, 2018, 9:46.
[6] PAUL S, GENG C G, YANG T H, et al.Phytochemical and health-beneficial progress of turnip (Brassica rapa)[J].Journal of Food Science, 2019, 84(1):19-30.
[7] 谢玥, 马超, 蒋思萍, 等.西藏芫根提取物对小鼠抗缺氧作用的初步研究[J].四川动物, 2009, 28(6):853-856.XIE Y, MA C, JIANG S P, et al.Primary study on anti-hypoxia activity of Bassia rapa L.extract in mice[J].Sichuan Journal of Zoology, 2009, 28(6):853-856.
[8] 吴彩霞, 王腾飞, 余建强.枸杞多糖预处理对小鼠脑缺血-再灌注损伤的保护作用[J].中药材, 2015, 38(7):1454-1459.WU C X, WANG T F, YU J Q.Lycium barbarum polysaccharide pretreatment attenuates cerebral ischemic reperfusion injury by inhibiting apoptosis in mice[J].Journal of Chinese Medicinal Materials, 2015, 38(7):1454-1459.
[9] 王铖, 喻忠茹, 李安怡, 等.芫根提取物对长期运动诱导疲劳小鼠的骨骼肌稳态的保护作用 [J].食品与发酵工业, 2023, 49(17):44-52.WANG C, YU Z R, LI A Y, et al.Protective effect of Brassica rapa L.extract on skeletal muscle homeostasis in long-term exercise-induced fatigue mice [J].Food and Fermentation Industries, 2023, 49(17):44-52.
[10] ZHENG H N, SU Y T, SUN Y, et al.Echinacoside alleviates hypobaric hypoxia-induced memory impairment in C57 mice[J].Phytotherapy Research, 2019, 33(4):1150-1160.
[11] LI S S, HU W Y, GONG S H, et al.The role of PRRC2B in cerebral vascular remodeling under acute hypoxia in mice[J].Advanced Science, 2023, 10(25):e2300892.
[12] DENG C B, LI J, LI L Y, et al.Effects of hypoxia ischemia on caspase-3 expression and neuronal apoptosis in the brain of neonatal mice[J].Experimental and Therapeutic Medicine, 2019, 17(6):4517-4521.
[13] MARRIF H, JUURLINK B H.Astrocytes respond to hypoxia by increasing glycolytic capacity[J].Journal of Neuroscience Research, 1999, 57(2):255-260.
[14] YANG Y, HAN C, SUN Y, et al.Effects of acute high-altitude exposure on morphology and function of retinal ganglion cell in mice[J].Investigative Ophthalmology &Visual Science, 2024, 65(10):19.
[15] KALPAGE H A, WAN J M, MORSE P T, et al.Cytochrome c phosphorylation:Control of mitochondrial electron transport chain flux and apoptosis[J].The International Journal of Biochemistry &Cell Biology, 2020, 121:105704.
[16] KLETKIEWICZ H, HYJEK M, JAWORSKI K, et al.Activation of hypoxia-inducible factor-1α in rat brain after perinatal Anoxia:Role of body temperature[J].International Journal of Hyperthermia, 2018, 34(6):824-833.
[17] YANG J X, LI W Y, WANG Y W.Capsaicin reduces obesity by reducing chronic low-grade inflammation[J].International Journal of Molecular Sciences, 2024, 25(16):8979.
[18] BELTR N-VELASCO A I, REIRIZ M, UCEDA S, et al.Lactiplantibacillus (Lactobacillus) plantarum as a complementary treatment to improve symptomatology in neurodegenerative disease:A systematic review of open access literature[J].International Journal of Molecular Sciences, 2024, 25(5):3010.
N-VELASCO A I, REIRIZ M, UCEDA S, et al.Lactiplantibacillus (Lactobacillus) plantarum as a complementary treatment to improve symptomatology in neurodegenerative disease:A systematic review of open access literature[J].International Journal of Molecular Sciences, 2024, 25(5):3010.
[19] DAVID L A, MAURICE C F, CARMODY R N, et al.Diet rapidly and reproducibly alters the human gut microbiome[J].Nature, 2013, 505(7484):559-563.
[20] YANG L C, WANG Y B, LI Z W, et al.Brain targeted peptide-functionalized chitosan nanoparticles for resveratrol delivery:Impact on insulin resistance and gut microbiota in obesity-related Alzheimer’s disease[J].Carbohydrate Polymers, 2023, 310:120714.
[21] WU Y J, ZHANG X Y, TAO S Y, et al.Maternal supplementation with combined galactooligosaccharides and casein glycomacropeptides modulated microbial colonization and intestinal development of neonatal piglets[J].Journal of Functional Foods, 2020, 74:104170.
[22] BURKE K E, LAMONT J T.Clostridium difficile infection:A worldwide disease[J].Gut and Liver, 2014, 8(1):1-6.
[23] ZHAO J B, HU J H, MA X.Sodium caprylate improves intestinal mucosal barrier function and antioxidant capacity by altering gut microbial metabolism[J].Food &Function, 2021, 12(20):9750-9762.
[24] QIAN Q F, QIU D, WU Z L, et al.Apple polyphenol extract alleviates DSS-induced ulcerative colitis and linked behavioral disorders via regulating the gut-brain axis[J].Food Bioscience, 2023, 53:102720.