高血糖是一种由长期高糖饮食引起的肥胖疾病[1]。随着生活水平的提高、饮食结构的变化以及肥胖人数的增加,高血糖的发病年龄逐渐年轻化且发病范围不断扩大[2]。若机体长期处于高血糖水平,将显著增加患糖尿病的概率。糖尿病是一种会对人体健康造成严重威胁的非传染性慢性疾病[3]。因此,血糖调控对于糖尿病及其并发症的预防与改善具有至关重要的作用。目前,糖尿病主要通过胰岛素注射和口服降糖药治疗[4]。然而,胰岛素注射存在作用时间短、成本高和低血糖等不良反应[5]。此外,高血糖患者长期使用双胍类降糖药可能会引起恶心、腹痛、胀气等不良反应,有一定的副作用[6]。因此,近年来开发降血糖的功能性食品逐渐成为研究热点。
青稞主要产于中国的青海、西藏、云南、四川等地区[7],富含蛋白质、淀粉、脂肪、维生素B等营养成分,具有调节血糖、补充体力、健脾养胃的功效,非常适合现代人在调整饮食模式时食用[8]。尽管已有研究探讨了青稞粉的降血糖效果,但随着时代的不断发展以及食品加工技艺的持续精进,以青稞为主要原料的食品品类愈发繁多,如青稞燕麦粥、青稞面包、青稞薯片、青稞饭卷、青稞鱼面、青稞气泡饮料等[9]。但青稞降血糖作用机制仍不明确,并且对青稞在茶饮品方面的开发研究较少。
基于此,本研究以C57BL/6J小鼠作为实验动物,饲喂高脂饲料建立高血糖模型,通过用青稞复配茶(highland barley blended tea,HBBT)干预模型鼠探究其降血糖、降血脂和减肥功效。研究结果可为HBBT对高血糖的改善效果及机制提供理论依据,并为青稞资源在功能食品中的应用提供参考。
1 材料与方法
1.1 主要材料与试剂
青稞复配茶(青稞、葛根、藤茶、红枸杞、杭白菊、甜菊叶),青海省新丁香粮油有限责任公司;无特定病原体动物(specific pathegon free,SPF)级雄性C57BL/6J小鼠,北京维通利华实验动物技术有限公司;超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、丙二醛(malondialdehyde,MDA)试剂盒、过氧化氢酶(catalase,CAT)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-PX)试剂盒、总胆固醇(total cholesterol,TC)试剂盒、甘油三酯(triglyceride,TG)试剂盒、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)试剂盒、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)试剂盒,南京建成生物工程研究所;胰岛素试剂盒、抵抗素试剂盒、脂联素(adiponectin,ADP)试剂盒、磷酸烯醇式丙酮酸羧激酶(phosphoenolpyruvate carboxykinase,PEPCK)试剂盒、TNF-α试剂盒、IL-6试剂盒、IL-1β试剂盒,南京森贝伽生物科技有限公司;0.9%(质量分数)生理盐水,上海禾丰制药有限公司;盐酸二甲双胍片(药品),江苏德源药业股份有限公司;高脂饲料(D12492),江苏省协同医药生物工程有限责任公司;PBS、葡萄糖,均为分析纯,上海麦克林生化科技股份有限公司。
1.2 主要仪器与设备
AX224ZH/E电子分析天平,奥豪斯仪器(常州)有限公司;HHS数显恒温水浴锅,上海博讯实业有限公司医疗设备;LXJ-Ⅱ高速离心机,上海安亭科学仪器厂;UV-3200紫外分光光度计,上海美谱达仪器有限公司;FS-1电动匀浆机,上海比朗仪器有限公司;RT-6100酶标仪,深圳雷杜生命科学股份有限公司。
1.3 实验方法
1.3.1 青稞复配茶的制备
HBBT是按照青稞(6 g)、葛根(0.35 g)、枸杞(1 g)、藤茶(1 g)、杭白菊(0.3 g)和甜菊叶(0.03 g)的配比装入玉米纤维袋中配制而成。前期已经优化并得出最佳冲泡工艺:将茶包放入300 mL,100 ℃水中冲泡15 min,重复冲泡3次,然后将青稞复配茶旋蒸浓缩、冷冻干燥制备成茶粉末,按照不同比例复溶后干预小鼠。
1.3.2 动物实验
该研究所涉及动物实验由江南大学实验动物伦理委员会审议通过,许可证号:SYXK(苏)2021-0056,伦理编号:JN.No20240115c0680530[009]。将雄性6周龄SPF级健康C57BL/6J小鼠作为实验对象,分为6组,空白组(CG)10只,模型组(MG)及青稞复配茶低剂量组(T-LG)、中剂量组(T-MG)、高剂量组(T-HG)每组各12只,阳性药物组(PG)10只,共68只。12 h光照/黑暗循环,光照时间段为8:00~20:00,在常规条件下饲养,室温为20~26 ℃,湿度为40%~70%,补充饮食饮水,并保持动物房洁净卫生。
小鼠首先在SPF级动物房中适应环境7 d,期间自由摄取纯净水和基础饲料。适应期后,对小鼠进行体重和血糖检测,记录初始血糖值。CG组继续饲喂普通饲料和水,而MG组、PG组及青稞复配茶低、中、高剂量组则饲喂高脂定制饲料。每周固定时间称量体重和检测空腹血糖值(fasting blood glucose,FBG),持续9周。当小鼠体重超过正常对照组20%,随机血糖值高于11.1 mmol/L,并且至少2只小鼠血脂指标超过正常范围时,认为模型建立成功,并记录此时的体重和血糖值。
模型建立成功后,CG组继续饲喂普通饲料,其他组在继续饲喂高脂饲料的同时,开始进行药物干预。MG组和CG组小鼠每天给予生理盐水灌胃(0.1 mL/10 g),PG组小鼠给予盐酸二甲双胍溶液灌胃(150 mg/kg),而青稞复配茶组小鼠则给予不同剂量的青稞复配茶灌胃:低剂量组(1.45 g/kg)、中剂量组(2.9 g/kg)、高剂量组(5.8 g/kg)。每周调整青稞茶灌胃剂量以适应小鼠体重的变化,并在灌胃前后定期测量小鼠的FBG。整个实验过程中,每天观察并记录小鼠的精神状况,直至实验结束。
在实验的最后阶段,小鼠禁食不禁水8 h后称重和麻醉,通过眼眶静脉采血法收集血液,静置后离心取血清,用于测定血清生化指标和炎症因子等指标。随后对小鼠进行断颈处理,取出肝脏并称重,肝脏组织用4%(质量分数)多聚甲醛固定后进行苏木精-伊红(hematoxylin-eosin,HE)染色,观察肝脏的形态变化。其余组织则保存于-80 ℃冰箱中以备后续分析。
1.3.3 血糖指标测定
1.3.3.1 FBG测定
小鼠适应环境1周后,饲养期间每周固定时间对小鼠禁食不禁水8 h后采用尾尖穿刺采血法检测小鼠FBG[10]。
1.3.3.2 口服糖耐量测定
给予小鼠4周的阳性药物及青稞复配茶灌胃后,对小鼠禁食8 h但不禁水。实验中用2.00 g/(kg·bw)的葡萄糖溶液,分别给予6组小鼠灌胃。之后在0、30、60、90、120 min时,采取尾尖穿刺取血的方式检测各组小鼠的血糖水平[11]。记录各组小鼠的血糖变化,并计算和分析血糖曲线下面积(area under the curve,AUC)。
1.3.4 理化指标测定
血清TC、TG、LDL-C、HDL-C、胰岛素、抵抗素、ADP、TNF-α、IL-6、IL-1β及肝脏中的TC、TG、SOD、MDA、CAT、GSH-PX、PEPCK依据试剂盒操作指南检测。
1.3.5 肝脏组织切片染色
将新鲜的小鼠肝组织保存在4%(质量分数)多聚甲醛溶液中固定,石蜡包埋处理后进行HE染色,最后在光学显微镜下观察[12]。
1.4 数据处理
对数据进行分析,计量资料用“平均数±标准偏差”表示。用Graphpad Prism 9和OriginPro 2021做图,组间比较采用单因素方差分析和t检验,P<0.05表示有显著统计学差异。
2 结果与分析
2.1 HBBT活性物质测定
使用苯酚-硫酸法测定青稞复配茶中多糖的含量。采用紫外分光光度法测定总黄酮和总多酚的含量。采用HPLC检测葛根素和二氢杨梅素含量,结果如表1所示。
表1 在最佳冲泡工艺参数下青稞复配茶提取物的主要活性物质含量
Table 1 Main active substance content of highland barley blended tea extract under optimal brewing process parameters

主要活性成分含量单位多酚143.39±2.72mg/包黄酮24.56±0.39mg/包多糖419.3±4.47mg/包浸出物0.95±0.06g/包二氢杨梅素96.08±9.48mg/包葛根素4.43±1.24mg/包
2.2 HBBT对小鼠体重的影响
经过4周的HBBT干预,T-HG组小鼠较CG组毛发更光亮,行动依旧迅速且敏捷,整体精神状态良好,表现出较高的活力。相比之下,MG组小鼠则显得精神不振,体型肥胖,动作迟缓且活动量减少。如图1所示,与CG组相比,MG组小鼠体重显著增高(P<0.01),而PG组和不同剂量的青稞复配茶组小鼠较MG组小鼠体重有所降低,说明青稞复配茶有减肥功效。其中,T-HG小鼠体重相较于T-LG和T-MG降低程度最大且与PG组相差较小,由此可见高剂量青稞复配茶改善肥胖效果与药物盐酸二甲双胍相近。
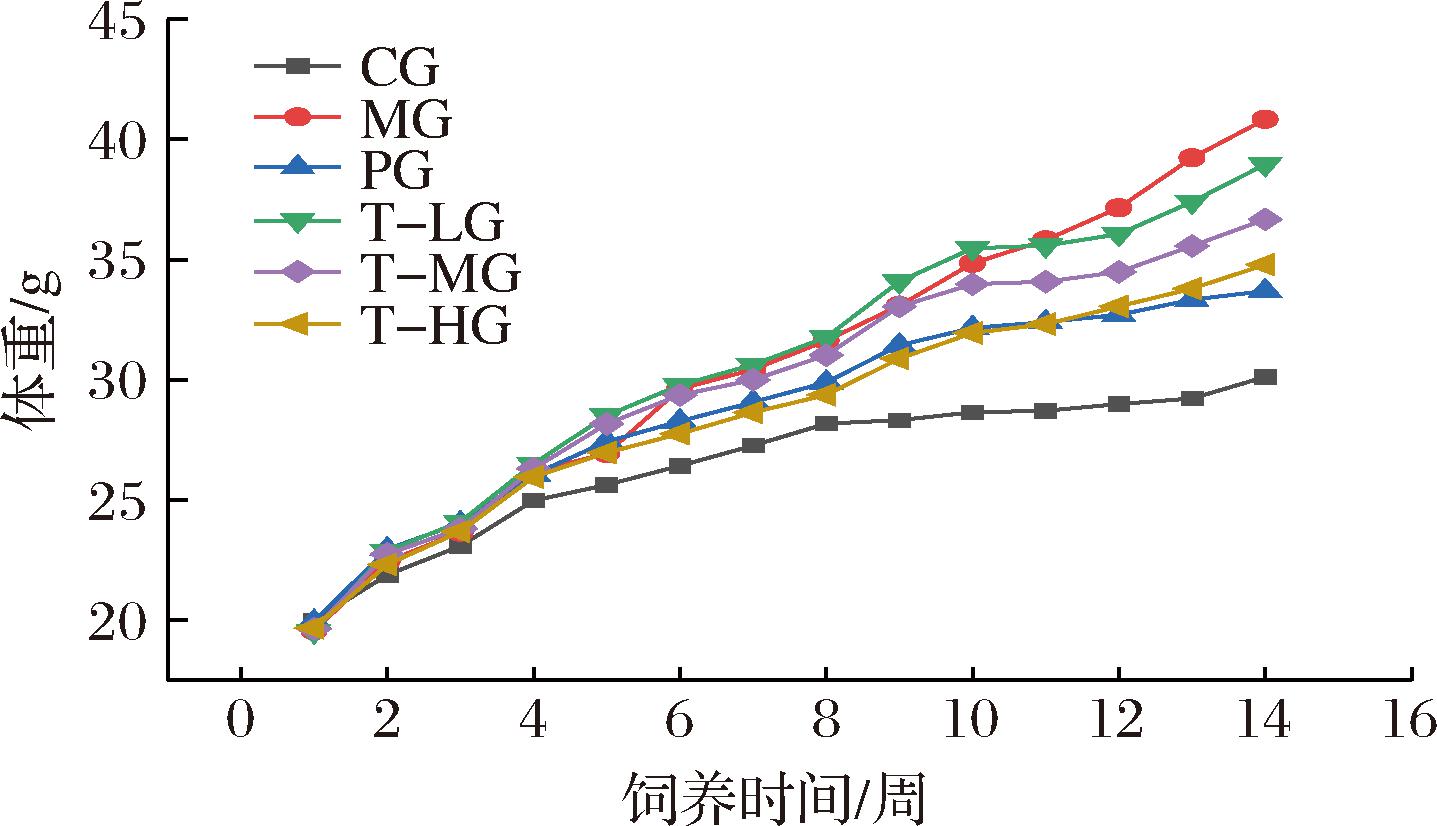
图1 饲养期间各组小鼠体重变化
Fig.1 Changes in body weight of mice in each group during feeding period
2.3 HBBT对小鼠FBG的影响
如图2-a所示,饲喂小鼠高脂饲料9周后,各组小鼠FBG较CG组都显著升高(P<0.05),说明造小鼠高血糖模型成功。给予小鼠HBBT干预4周,CG组的FBG基本保持不变,而MG组的FBG持续增长,PG组FBG较MG组显著下降(P<0.01)。HBBT各组的变化与PG组一致,较MG组都显著下降(P<0.01)。表明HBBT对高血糖小鼠的血糖有一定的改善作用。这或许是因为HBBT中存在多酚、黄酮等活性成分,通过提升胰岛素的敏感度、减轻胰岛素抵抗以及加速血糖转化为糖原的过程,进而有效降低了FBG水平,与之前的研究一致[13-14]。
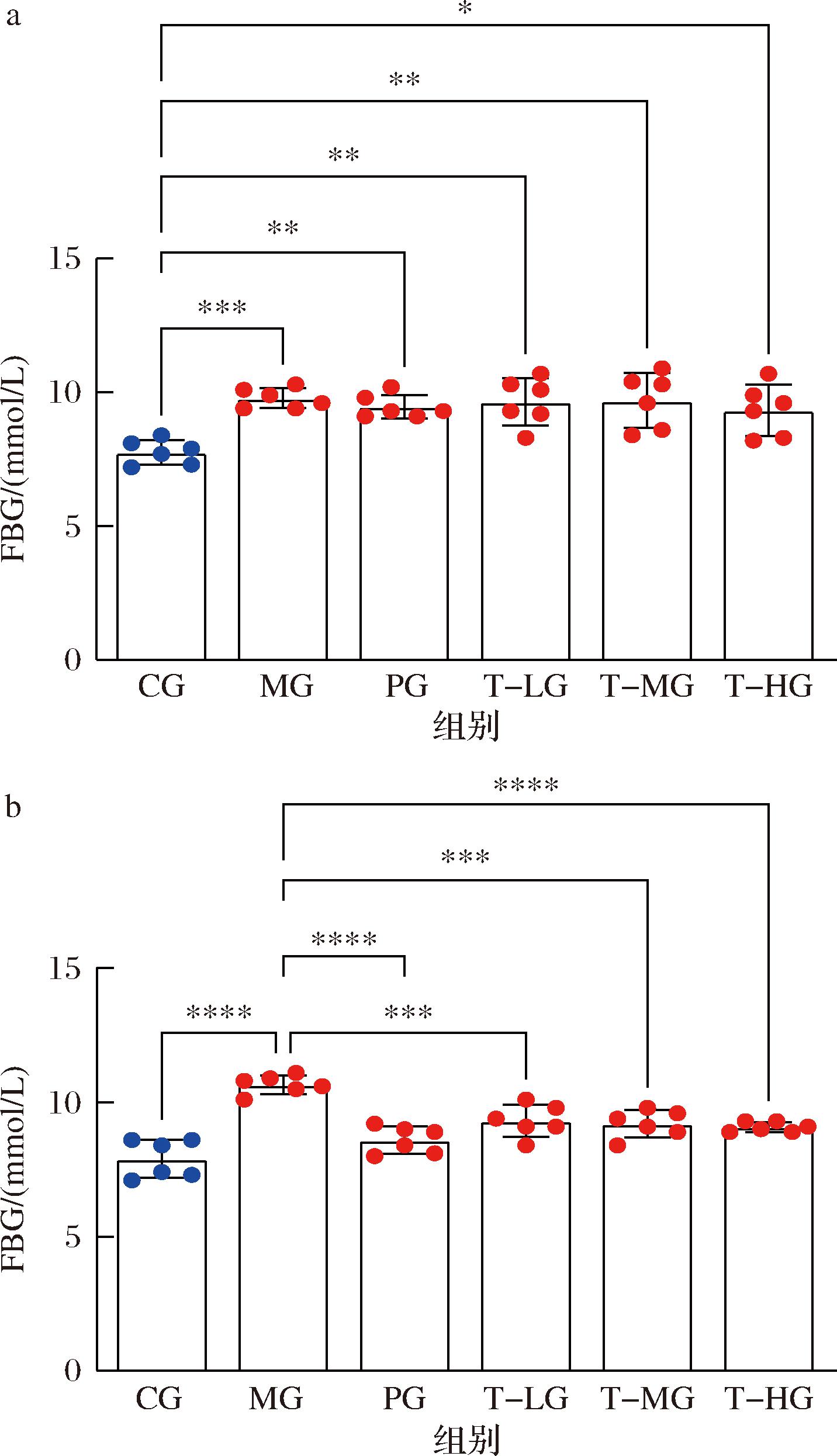
a-高脂饲料干预9周后;b-HBBT干预4周后
图2 HBBT对小鼠FBG的影响
Fig.2 Effect of HBBT on FBG levels in mice
注:*表示存在显著性差异(P<0.05),**表示(P<0.01),***表示(P<0.001),****表示(P<0.000 1)(下同)。
2.4 HBBT对小鼠糖耐量的影响
按照1.3.3.2节方法进行小鼠糖耐量实验,给予葡萄糖灌胃后各时间点小鼠FBG如图3-a所示,呈现先升高后降低的趋势。葡萄糖耐受性通常以AUC来衡量。AUC的数值大小反映了机体利用和清除葡萄糖的能力,AUC值越高,表明机体对葡萄糖的耐受性越差;反之,AUC值越低,表明机体对葡萄糖的耐受性越好[15]。如图3-b所示,MG组小鼠AUC较CG组显著增加(P<0.01),表明9周的高脂饮食干预降低了小鼠对葡萄糖的耐受能力。与MG组相比,PG组和HBBT各剂量组的AUC值均显著降低(P<0.01),表明给予小鼠HBBT干预增强了高血糖小鼠对葡萄糖的耐受能力。因此,HBBT能够增强小鼠的葡萄糖耐受能力。
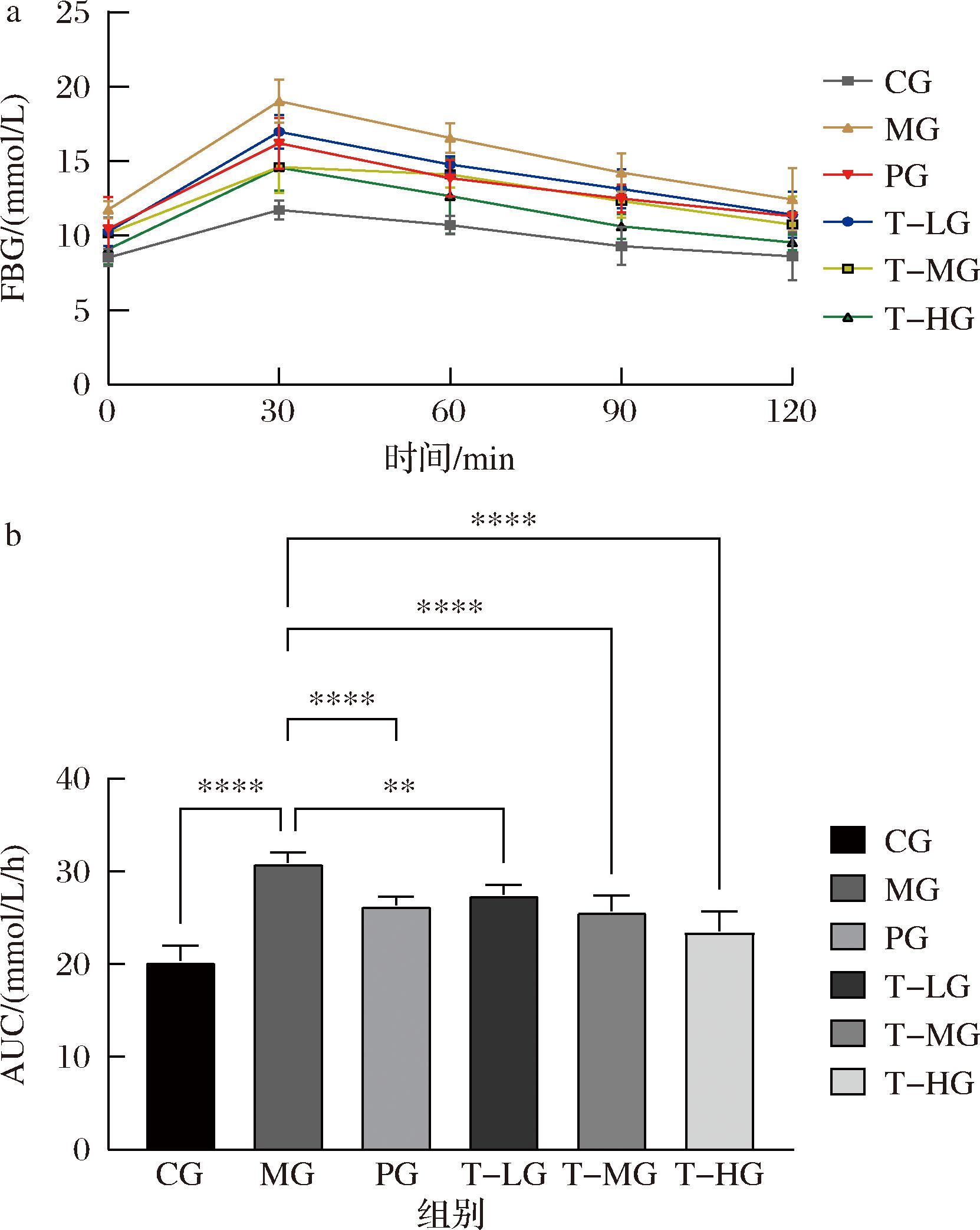
a-FBG;b-AUC
图3 HBBT对小鼠葡萄糖耐受量的影响
Fig.3 Effect of HBBT on glucose tolerance in mice
2.5 HBBT对小鼠血清酶活力影响
由图4-a~图4-d可知,MG组与CG组相比,血清TC、TG和LDL-C水平显著升高(P<0.01),而HDL-C水平则显著降低(P<0.01),说明高脂饮食会导致小鼠血脂代谢紊乱。而T-HG较MG组小鼠血清TC、TG和LDL-C水平显著降低(P<0.01),而HDL-C水平则显著升高(P<0.01),表明高剂量的HBBT能够调节小鼠血脂代谢,减轻高脂饮食诱导的小鼠血脂水平紊乱。

a-TC;b-TG;c-HDL-C;d-LDL-C;e-TNF-α;f-IL-6;g-IL-1β;h-胰岛素;i-抵抗素;j-ADP
图4 HBBT对小鼠血清酶活力的影响
Fig.4 Effect of HBBT on serum enzyme activity in mice
注:图中ns表示不存在显著性差异(下同)。

a-TC;b-TG;c-SOD;d-MDA;e-CAT;f-GSH-Px;g-PEPCK
图5 HBBT对小鼠肝脏酶活力的影响
Fig.5 Effect of HBBT on liver enzyme activity in mice

a-CG;b-MG;c-PG;d-T-LG;e-T-MG;f-T-HG
图6 HBBT对高血糖小鼠肝脏组织病理学研究(HE染色,200×)
Fig.6 Pathological study of HBBT on liver tissue of hyperglycemic mice
由图4-e~图4-g可知,MG组与CG组相比,血清TNF-α、IL-6和IL-1β水平显著升高(P<0.01),而HBBT各剂量组较MG组小鼠血清TNF-α、IL-6和IL-1β水平显著降低(P<0.01),说明HBBT能够降低高血糖小鼠血清炎症因子水平。胰岛素水平的变化可以反映机体对血糖调节的生理状态[16]。
如图4-h,T-MG和T-HG能够显著增加MG组胰岛素水平(P<0.01),说明HBBT能够通过提高胰岛素分泌来调节机体血糖水平。抵抗素与胰岛素抵抗密切相关,其可能通过减弱肝脏、骨骼肌及脂肪组织对胰岛素的反应性,阻断胰岛素信号传导路径,进而影响糖和脂质的正常代谢,导致血糖平衡失调[17]。如图4-i所示,HBBT各剂量组抵抗素水平显著低于MG组(P<0.01),进而调节机体血糖代谢。ADP对能量代谢和胰岛素敏感性具有显著影响,能够促进脂肪酸氧化,调节脂肪分解与利用,增加机体对葡萄糖的摄取和利用,抑制肝脏葡萄糖生成,减少胰岛素抵抗,提高胰岛素敏感性,从而在血糖水平调节中发挥重要作用[18]。如图4-j所示,T-HG能够显著升高MG组(P<0.01)ADP水平,调节机体糖脂代谢。
2.6 HBBT对小鼠肝脏酶活力影响
由图5-a、图5-b知,MG组与CG组相比,肝组织TC和TG水平显著升高(P<0.01),而T-HG较MG组小鼠肝组织TC和TG水平显著降低(P<0.01),说明高剂量的HBBT能够调节小鼠肝组织血脂代谢。由图5-c~图5-f可知,MG组与CG组相比,肝组织SOD、CAT和GSH-PX水平显著降低(P<0.01),MDA水平显著升高(P<0.01),而T-HG较MG组小鼠肝组织SOD、CAT和GSH-PX水平显著升高(P<0.01),MDA水平显著降低(P<0.01),说明高剂量的HBBT能够提高小鼠肝组织抗氧化能力,减轻肝组织氧化损伤。PEPCK是肝脏和肾脏中糖异生的限速酶,也是三羧酸循环通量的关键调节器[19]。如图5-g所示,MG组PEPCK水平较CG组显著升高(P<0.01),反映了肝脏对糖异生需求的增加,而HBBT各剂量组显著降低了MG组PEPCK水平(P<0.01),表明HBBT能够通过调节肝脏糖异生途径调节机体血糖水平。
2.7 HBBT对小鼠肝脏组织病理学分析
由图6可知,CG组小鼠肝脏结构完好且边界分明,无空洞出现,肝细胞规则排列,未观察到细胞变性或坏死,细胞核周围间隙均一,无炎症细胞异常增殖。相比之下,MG组小鼠肝细胞内出现大量空泡样结构,组织结构混乱,肝细胞肿胀并呈现空泡样变性,胞质变得透明且疏松。在PG组中,肝脏细胞排列相对规整,虽有空泡存在,但未见炎症细胞增生。T-LG组肝脏细胞排列欠整齐,空泡样结构及炎症细胞增生相较于MG组有所减轻,但依然较为显著。T-MG组肝脏细胞排列较为规整,空泡样结构显著减少,炎症细胞增生现象不明显。而T-HG组肝脏细胞排列整齐,未见明显空泡样结构,仅存在轻微的脂肪变性和水肿现象,较MG组大幅改善。这表明HBBT各组均能改善糖尿病小鼠肝细胞受损情况,T-HG改善效果最佳。
3 结论与讨论
本实验选用青稞作为主要原料,并以枸杞、葛根、藤茶、杭白菊和甜菊叶为辅,共同配制出HBBT,探究其对高血糖小鼠的降糖作用。研究发现,HBBT能够降低高脂饲料诱导的高血糖小鼠体重升高趋势、显著降低高血糖小鼠FBG并提高其糖耐量;通过调节血脂成分,具体表现为降低TC、TG以及LDL-C的浓度,同时提升HDL-C的含量,缓解血脂代谢紊乱;并且具备减轻肝脏氧化应激反应以及维护肝细胞完整性等多重功效;通过降低小鼠血清TNF-α、IL-6和IL-1β的水平来减少小鼠炎症;通过显著升高胰岛素和ADP水平,显著降低抵抗素和PEPCK水平调节机体糖脂代谢,维持血糖稳定;通过显著提高SOD、CAT和GSH-Px水平,显著降低MDA水平,减少高血糖小鼠机体氧化损伤程度;HE染色结果显示,HBBT能够减轻肝组织的变性情况,明显减少肝组织空泡状结构,改善糖尿病肝损伤。
[1] WITEK K, WYDRA K, FILIP M.A high-sugar diet consumption, metabolism and health impacts with a focus on the development of substance use disorder:A narrative review[J].Nutrients, 2022, 14(14):2940.
[2] XU Y, LU J L, LI M, et al.Diabetes in China part 1:Epidemiology and risk factors[J].The Lancet Public Health, 2024, 9(12):e1089-e1097.
[3] SHARMA K, AKRE S, CHAKOLE S, et al.Stress-induced diabetes:A review[J].Cureus, 2022, 14(9):e29142.
[4] NKONGE K M, NKONGE D K, NKONGE T N.Insulin therapy for the management of diabetes mellitus:A narrative review of innovative treatment strategies[J].Diabetes Therapy, 2023, 14(11):1801-1831.
[5] MCCALL A L.Insulin therapy and hypoglycemia[J].Endocrinology and Metabolism Clinics of North America, 2012, 41(1):57-87.
[6] DUTTA S, SHAH R B, SINGHAL S, et al.Metformin:A review of potential mechanism and therapeutic utility beyond diabetes[J].Drug Design, Development and Therapy, 2023, 17:1907-1932.
[7] 陆培, 安明哲, 李茂, 等.青稞营养成分研究进展及其应用现状[J].酿酒科技, 2022(7):110-116.LU P, AN M Z, LI M, et al.Research progress and application of nutrient substances in highland barley[J].Liquor-Making Science &Technology, 2022(7):110-116.
[8] 夏虎, 晏熙玥, 卢利聃, 等.青稞的营养功能及其高值化利用研究进展[J].食品工业科技, 2022, 43(20):403-413.XIA H, YAN X Y, LU L D, et al.Progress on nutritional function and high-value utilization of hulless barley[J].Science and Technology of Food Industry, 2022, 43(20):403-413.
[9] 吴雨晴, 张佳琪, 范蓓, 等.加工对青稞营养成分及生物活性影响的研究进展[J].食品工业科技, 2024, 45(5):8-17.WU Y Q, ZHANG J Q, FAN B, et al.Research progress on the effects of processing on nutrients and biological activity of highland barley[J].Science and Technology of Food Industry, 2024, 45(5):8-17.
[10] FU J, LIU S, LI M Y, et al.Optimal fasting duration for mice as assessed by metabolic status[J].Scientific Reports, 2024, 14:21509.
[11] KENNARD M R, NANDI M, CHAPPLE S, et al.The glucose tolerance test in mice:Sex, drugs and protocol[J].Diabetes, Obesity and Metabolism, 2022, 24(11):2241-2252.
[12] ROWLEY J E, RUBENSTEIN G E, MANUEL S L, et al.Tissue-specific fixation methods are required for optimal in situ visualization of hyaluronan in the ovary, kidney, and liver[J].Journal of Histochemistry and Cytochemistry, 2020, 68(1):75-91.
[13] SHAHWAN M, ALHUMAYDHI F, ASHRAF G M, et al.Role of polyphenols in combating Type 2 Diabetes and insulin resistance[J].International Journal of Biological Macromolecules, 2022, 206:567-579.
[14] RUSSO B, PICCONI F, MALANDRUCCO I, et al.Flavonoids and insulin-resistance:From molecular evidences to clinical trials[J].International Journal of Molecular Sciences, 2019, 20(9):2061.
[15] 隋春红, 何岩涛, 徐亚维, 等.慢性间歇性低压低氧对糖尿病小鼠糖代谢关键酶基因表达和启动子区甲基化的影响[J].环境与职业医学, 2024, 41(8):911-918.SUI C H, HE Y T, XU Y W, et al.Effects of chronic intermittent hypobaric hypoxia on expression and promoter region methylation of key enzyme genes related to glucose metabolism in diabetic mice[J].Journal of Environmental and Occupational Medicine, 2024, 41(8):911-918.
[16] RAHMAN M S, HOSSAIN K S, DAS S, et al.Role of insulin in health and disease:An update[J].International Journal of Molecular Sciences, 2021, 22(12):6403.
[17] SONG R J, WANG X, MAO Y Q, et al.Resistin disrupts glycogen synthesis under high insulin and high glucose levels by down-regulating the hepatic levels of GSK3β[J].Gene, 2013, 529(1):50-56.
[18] IWASHIMA Y, HORIO T, SUZUKI Y, et al.Adiponectin and inflammatory markers in peripheral arterial occlusive disease[J].Atherosclerosis, 2006, 188(2):384-390.
[19] MONTAL E D, DEWI R, BHALLA K, et al.PEPCK coordinates the regulation of central carbon metabolism to promote cancer cell growth[J].Molecular Cell, 2015, 60(4):571-583.