米糠作为稻谷加工的主要副产物,集中了稻米约60%以上的营养素[1],但目前米糠大部分被用作动物饲料和燃料等[2-3],米糠中的酚类大多以结合态形式存在,人体缺乏相应的消化酶,导致生物利用度较低[4],米糠存在易氧化酸败、口感粗糙,加工性能差等问题[5],也阻碍了其在食品中的应用,米糠资源尚未得到充分利用。微生物发酵作为食品加工的重要手段,通常能改善原料的营养组成和品质特性,利用微生物的功能特性改善米糠的活性成分以促进结合态多酚转化为游离态,提高其生物利用度。有研究报道米糠经过乳酸菌发酵处理后表面结构变得松散,溶解性增加[6];乳酸菌和酵母菌共发酵使脱脂米糠游离态多酚含量提高了19.3%,总酚和总黄酮含量分别提高了29.0%和128.7%,并增加了其对牛黄胆酸钠的吸附能力[7];米糠中的酚类物质多以结合态形式与纤维素、木质素等结合,微生物发酵是通过破坏其间的酯键和降解纤维素来释放酚类物质,该法不仅能提高米糠中营养物质的利用率,发酵的米糠还具有一定的保健作用。米糠发酵液具有抗氧化活性和对羟自由基介导的DNA损伤的保护作用[8];米根霉发酵的米糠对乳酸杆菌和双歧杆菌有明显的增殖效果,促进了肠道益生菌产生短链脂肪酸[9];枯草芽胞杆菌固态发酵米糠具有降低高血脂大鼠甘油三酯的功能[10];黑木耳发酵米糠有效减轻了高血脂小鼠肝组织损伤程度[11];有研究比较了4种乳酸菌的抗氧化活性,筛选出其中植物乳植杆菌(Lactiplantibacillus plantarum)发酵脱脂米糠的抗氧化活性相对最强,总酚和总黄酮含量相对最高[12];目前研究集中在菌株发酵米糠营养成分的改善、产品的应用、体外抗氧化活性评估,而针对植物乳植杆菌发酵米糠的体内试验鲜有研究。
秀丽隐杆线虫(Caenorhabditis elegans)作为一种食品营养功能评价的模型生物,具有与人类基因同源性高、研究结果易于观察、能够在实验室大批量培养等优点,常应用于食品营养的抗衰老、抗氧化和预防氧化应激损伤等功能评价[13]。最近的研究报道,龙眼多糖能缓解秀丽隐杆线虫的氧化应激损伤[14];提取出的艾叶黄酮类化合物在线虫中表现出较强的抗氧化能力和抗逆性,减少了活性氧的积累[15];在慢性和急性氧化应激条件下,证明了蟋蟀中活性肽通过降低活性氧水平、增加参与多种抗氧化途径的gst-4基因表达诱导抗氧化作用,显著延长了线虫的寿命[16]。应用氧化应激的秀丽隐杆线虫模型在医疗、食品功能性评价中具有良好的应用前景。然而,目前关于米糠发酵液抗氧化作用及体内缓解氧化应激损伤的效果尚未报道。
因此,本研究通过植物乳植杆菌YI-Y2013发酵米糠,分析发酵过程中米糠发酵液的营养组成及抗氧化活性变化,并利用氧化应激的秀丽隐杆线虫模型探究米糠发酵液抗衰老的潜在功能,以期为米糠资源的转化利用提供理论依据。
1 材料与方法
1.1 材料与试剂
米糠(来源于糙米)由金健米业提供;植物乳植杆菌 YI-Y2013源自本实验室,保存于中国典型培养物保藏中心(CCTCC NO:M2017533);秀丽隐杆线虫野生型(N2)、大肠杆菌(Escherichia coli)OP50由中南大学提供;线虫生长培养基(nematode growth medium,NGM),山东拓普生物工程有限公司;其他试剂均为分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
LDZF-30L-Ⅰ高压蒸汽灭菌锅,上海申安医疗器械厂;DHP-9031智能生化培养箱,上海一恒科学仪器有限公司;S22pc分光光度计,上海棱光技术有限公司;DC401冷冻干燥机,雅马拓科技贸易有限公司;CX23光学显微镜,日本奥林巴斯公司;DK-2000-ⅢL恒温水浴锅,天津泰斯特仪器有限公司;ZQZY-78BES振荡培养箱,上海知楚仪器有限公司;TG16离心机,湖南长沙东旺实验仪器有限公司。
1.3 试验方法
1.3.1 植物乳植杆菌发酵米糠
准确称取米糠样品,以料液比1∶2(g∶mL)加入去离子水,于121 ℃灭菌30 min,冷却至室温;以105 CFU/mL的浓度接种植物乳植杆菌菌液,于37 ℃培养箱中发酵0、24、48 h;4 000 r/min离心20 min后分离上清液,作为发酵过程中的研究组。未进行发酵而直接离心所得的上清液,作为空白对照组。
1.3.2 米糠发酵液成分测定
将米糠发酵液冷冻干燥48 h后磨粉过筛得到固体粉末,参照GB 5009.7—2016 《食品安全国家标准 食品中还原糖的测定》测定可溶性总糖含量;参照GB 5009.5—2016 《食品安全国家标准 食品中蛋白质的测定》测定蛋白质含量;采用福林酚比色法测定多酚含量,以没食子酸为标准品,根据回归方程y=0.023 9x+0.038(x为没食子酸的质量浓度,单位μg/mL,y为吸光度,R2=0.999 4),绘制没食子酸标准曲线,计算总酚含量,并以每100 g干基所含没食子酸当量表示(mg GAE/100 g DW)。
1.3.3 米糠发酵液成分测定
1.3.3.1 羟自由基清除率
准确称取米糠发酵液冷冻干燥后的粉末样品,与蒸馏水混合,配制0.05、0.1、0.25、0.5、1 mg/mL质量浓度的发酵液,并以体积比1∶1分别添加6 mol/L FeSO4溶液、2.4 mol/L H2O2溶液,混匀;反应10 min,加入1 mL 6 mol/L水杨酸,30 ℃反应30 min后,于510 nm测定吸光度。以相同浓度的维生素C标准液为对照,每组3个平行,取平均值。羟自由基清除率计算如公式(1)所示:
羟自由基清除率![]()
(1)
式中:A1,1 mL样品溶液的吸光值;A0,1 mL去离子水的吸光值。
1.3.3.2 DPPH自由基清除率
准确称取米糠发酵液冷冻干燥后的粉末样品,与蒸馏水混合,配制0.2、0.4、0.6、0.8、1.0、1.2 mg/mL的发酵液,分别加入0.04 mg/mL DPPH-无水乙醇溶液,混匀;反应30 min后,于517 nm测定吸光度。以相同浓度的维生素C标准溶液为对照组,每组3个平行,取平均值。DPPH自由基清除率计算如公式(2)所示:
DPPH自由基清除率![]()
(2)
式中:A2,2 mL样品溶液+2 mL DPPH溶液的吸光值;A3,2 mL去离子水+2 mL DPPH溶液的吸光值;参比溶液为2 mL去离子水+2 mL无水乙醇。
1.3.4 米糠发酵液体内抗衰老活性测定
1.3.4.1 秀丽隐杆线虫的传代培养和寿命测定
大肠杆菌OP50的培养:将冷冻保存的大肠杆菌菌液解冻后,取200 μL菌液加至5 mL的LB液体培养基,在37 ℃振荡培养12 h即得大肠杆菌OP50菌液。
秀丽隐杆线虫的培养:对照组与传代组线虫均培养于涂有50 μL OP50菌液的NGM培养基中,倒置培养于20 ℃的培养箱中。每隔12 h观察线虫生长情况,防止杂菌污染。在线虫数量较多、菌液即将耗尽时转移线虫,使用M9缓冲液将线虫洗下,于1.5 mL离心管中静置2 min,将下沉的线虫转移至新的食物盘中,按上述相同条件培养。
秀丽隐杆线虫的同步化:将线虫于NGM食物盘上活化;选择处于产卵期的线虫培养板,用M9缓冲液冲洗,收集虫卵,并制成虫卵悬浮液;加入5 mL M9溶液于20 ℃摇床上低速振荡培养,得到L1期幼虫;离心,继续将L1期幼虫于20 ℃恒温培养48 h,获得L4期线虫。
线虫寿命测定:参考PATANANAN等[17]的方法并略作修改。取1 mg/mL不同发酵时间(0、24、48 h)的样品溶液,以体积比1∶10与大肠杆菌OP50菌液加到NGM培养基中,涂布均匀,挑取L4期线虫于不同培养基中,每组30条、3个平行,20 ℃下恒温培养;每隔24 h使用取虫器末端轻轻触碰线虫头部,在体视显微镜下观察,若线虫虫体在多次触碰后均无反应则视为死亡,记录存活线虫数量,并将存活线虫转移至新的食物盘中,重复上述操作,直至盘中线虫全部死亡。寿命测定重复3次,以平均值绘制线虫寿命曲线。空白组为纯大肠杆菌OP50培养液。
1.3.4.2 秀丽隐杆线虫抗热应激寿命测定
取样品溶液培养3 d后的线虫至OP50培养基中,每组30条、3个平行;37 ℃恒温培养,每30 min观察并记录线虫存活情况,直至全部死亡。
1.3.4.3 秀丽隐杆线虫抗氧化应激寿命测定
取样品溶液培养3 d后的线虫至10 mmol/L H2O2的OP50培养基中,每组30条、3个平行;20 ℃下恒温培养,每2 h观察并记录线虫存活率,至全部死亡。
1.4 数据处理
试验结果以“平均值±标准误差”来表示,使用Origin 2018分析数据并绘图,利用SPSS 26.0软件进行数据处理和显著性分析,P<0.05表示统计学差异显著。
2 结果与分析
2.1 米糠发酵液营养成分
如表1所示,米糠发酵液中可溶性糖和蛋白质随发酵时间的增加而下降,而多酚含量呈相反趋势。发酵24 h后,米糠可溶性糖由8.4%下降至1.9%,在发酵初期,植物乳植杆菌利用米糠中的单糖和双糖快速生长,同时代谢产生水解酶并对糖类进行降解,总糖含量快速下降;发酵后期随基质环境变化,植物乳植杆菌利用糖的速度变慢,总糖含量下降减缓。发酵24 h后蛋白质含量下降了2.4%,其原因可能是植物乳植杆菌产生的蛋白酶,将蛋白质水解成小分子的氨基酸、有机酸等,导致蛋白质含量下降。植物乳植杆菌发酵米糠24、48 h后的多酚含量分别为15.2、17.3 mg/100 g,是未发酵组的1.32倍、1.50倍。米糠酚类物质主要为阿魏酸、对羟基苯甲酸及对香豆酸等,多为不溶性结合酚,并以酯化或糖基化形式与细胞壁中的生物大分子结合,发酵过程中植物乳植杆菌代谢产生β-葡萄糖苷酶、α-淀粉酶、漆酶等活化酶,将细胞壁基质中的结合酚水解成游离酚使多酚含量增加[18]。也可能是花青素类等物质在发酵过程中的转化,增加了米糠多酚的含量[19]。
表1 发酵时间对米糠液中营养成分的影响
Table 1 Effect of fermentation time on the nutritional components in rice bran broth

注:同列不同字母表示组间具有显著性差异 (P<0.05)。
发酵时间/h蛋白质含量/%可溶性糖含量/%多酚含量/(mg/100 g)014.9±0.7a8.4±0.4c11.5±0.6c2412.5±0.7b1.9±0.1a15.2±0.8b4812.7±0.79b1.7±0.1b17.3±0.9a
2.2 米糠发酵液抗氧化活性评价
米糠发酵会产生许多生物活性成分,如植物甾醇、黄酮、多酚等,具有较高的抗氧化活性。羟自由基是一种活泼的氧自由基,可穿过细胞膜引起细胞发生氧化损伤。如图1-a所示,米糠发酵液对羟自由基清除能力随提取物浓度的增加而提高。当发酵液质量浓度为1.0 mg/mL时,24 h发酵组羟自由基清除率达72.5%,比未发酵组高了10%以上。如图1-b所示,DPPH自由基清除率随浓度的增加而上升。低浓度时不同发酵时间组的DPPH清除率差异不显著,在使用0.6 mg/mL以上质量浓度时,48 h的发酵组(清除率高达78.2%)明显高于未发酵组,可能是因为植物乳植杆菌发酵促进了米糠中游离酚的含量增加,而酚类化合物特殊化学结构可促使芳环上的羟基提供氢或电子,并赋予自由基清除活性和金属螯合电位的能力,具有强抗氧化、抗癌、抗炎等多种有益特性[20]。
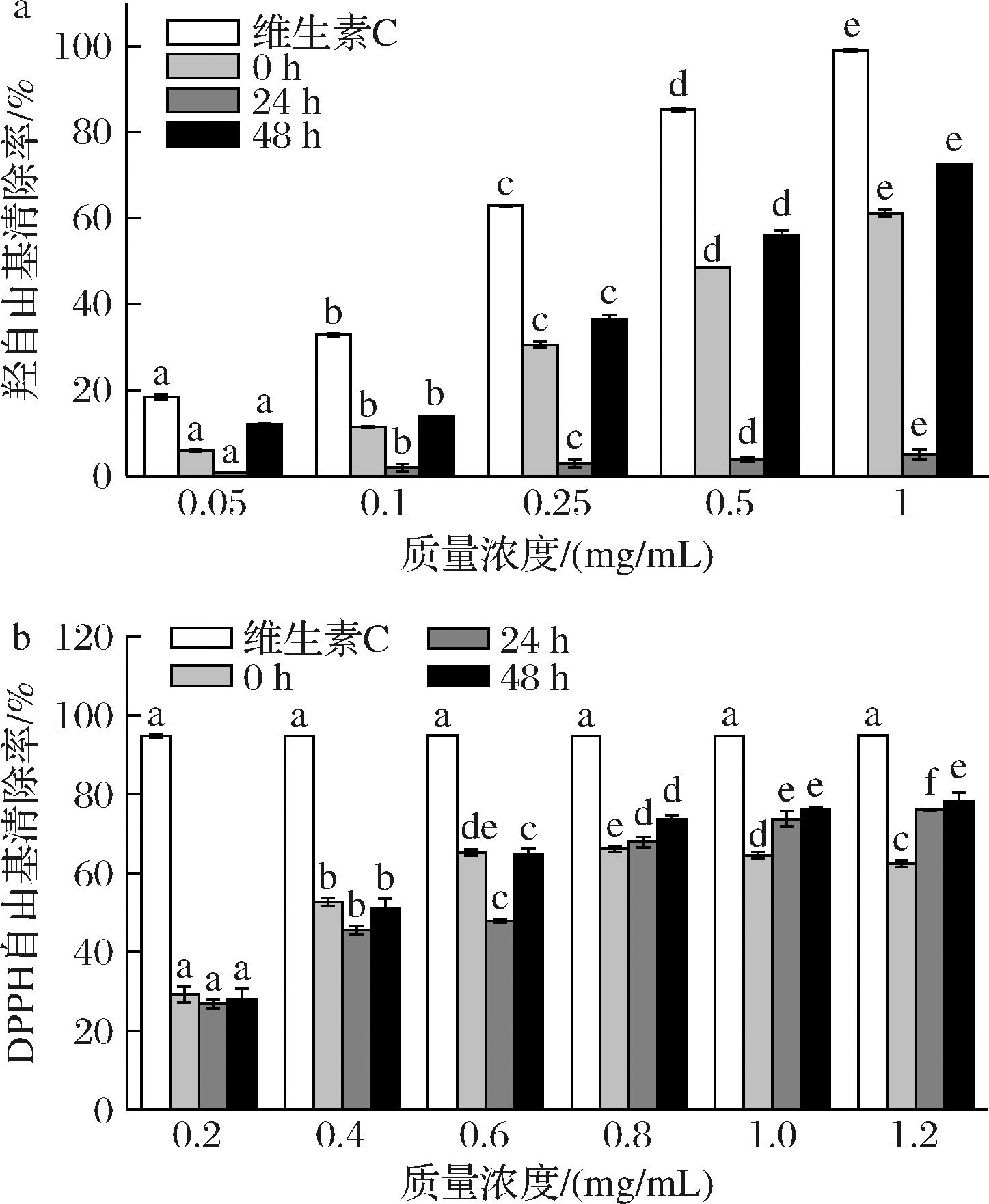
a-羟自由基;b-DPPH自由基
图1 米糠发酵液对羟自由基和DPPH自由基清除率的影响
Fig.1 Effect of rice bran fermentation broth on the scavenging rate of hydroxyl radicals and DPPH radicals
注:不同字母表示各组之间具有显著性差异 (P<0.05)。
2.3 米糠发酵液对秀丽隐杆线虫抗衰老的影响
2.3.1 米糠发酵液对秀丽隐杆线虫寿命的影响
体外抗氧化试验发现1.0 mg/mL质量浓度米糠发酵液具有较强的清除自由基能力,显著高于未发酵组,因此选取该质量浓度的米糠发酵液,测定不同发酵时间下秀丽隐杆线虫存活率。如图2所示,与空白组和未发酵组比较,发酵组线虫存活率曲线明显右移,存活率升高。
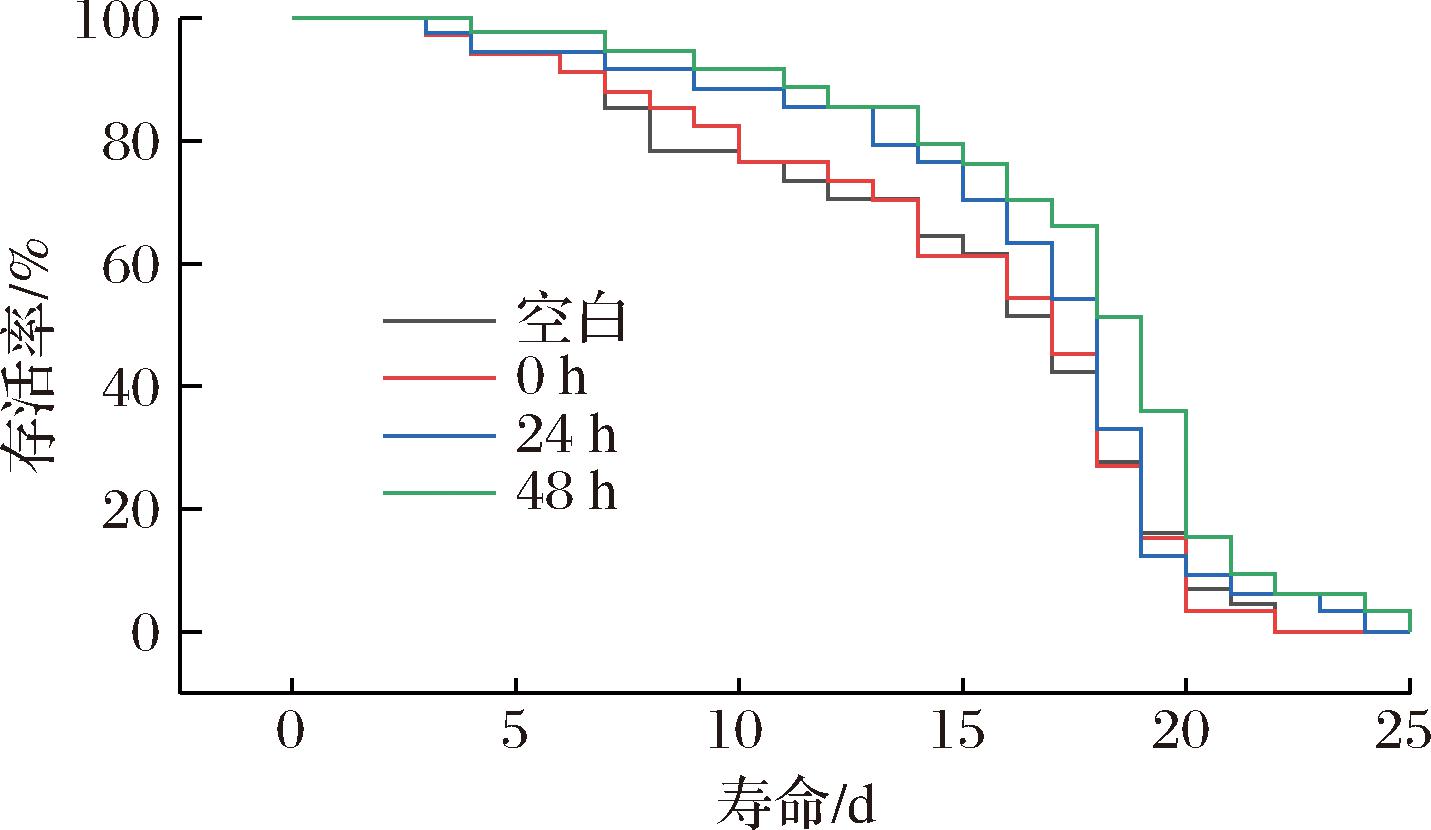
图2 米糠发酵液对秀丽线虫寿命的影响
Fig.2 Effect of fermented rice bran broth on lifespan of C. elegans
当喂养至16~20 d时,平均存活率增加了20%以上;24、48 h发酵组平均寿命分别提高了6%和12%,最长寿命提高了9%、13%(表2)。
表2 米糠发酵液对秀丽线虫寿命的影响
Table 2 Effect of fermented rice bran broth on lifespan of C. elegans

组别平均寿命/d最长寿命/d空白1623发酵0 h1622发酵24 h1724发酵48 h1825
这与严静等[21]的研究结果相似,米糠发酵过程中产生的多酚类活性成分会进入线虫胞内成为外源抗氧化剂参与氧化应激反应,当遇到游离自由基时,多酚类活性成分有效缓解了线虫体内的氧化损伤,延长了线虫寿命;另一方面可能是发酵米糠产生的氨基酸、多肽等能够参与线虫体内活性酶的代谢通路,从而延长了线虫的寿命[22]。结果表明,植物乳植杆菌发酵米糠液具有延长秀丽隐杆线虫寿命的作用。
2.3.2 米糠发酵液对秀丽隐杆线虫抗热应激的影响
秀丽隐杆线虫最适生存温度为20 ℃,温度过高时会使线虫胞内产生急性热损伤而死亡。如图3所示,37 ℃时线虫存活率下降了80%以上,且发酵组存活率高于未发酵组。热诱导2 h后,48 h发酵组存活率显著提高,是空白组的3倍、未发酵组的2倍;3.5 h后,存活率提高了15%;空白组和未发酵组在3.5 h时存活率降至0%,而24 h和48 h发酵组的存活率在4 h时降至0%。米糠发酵液中的阿魏酸、香草酸等参与线虫合成调控热应激的蛋白因子,从而可能增加了线虫的热应激抵抗力[23]。因此,米糠发酵液可提高线虫对热应激的保护作用,延长秀丽隐杆线虫在热应激条件下的寿命。
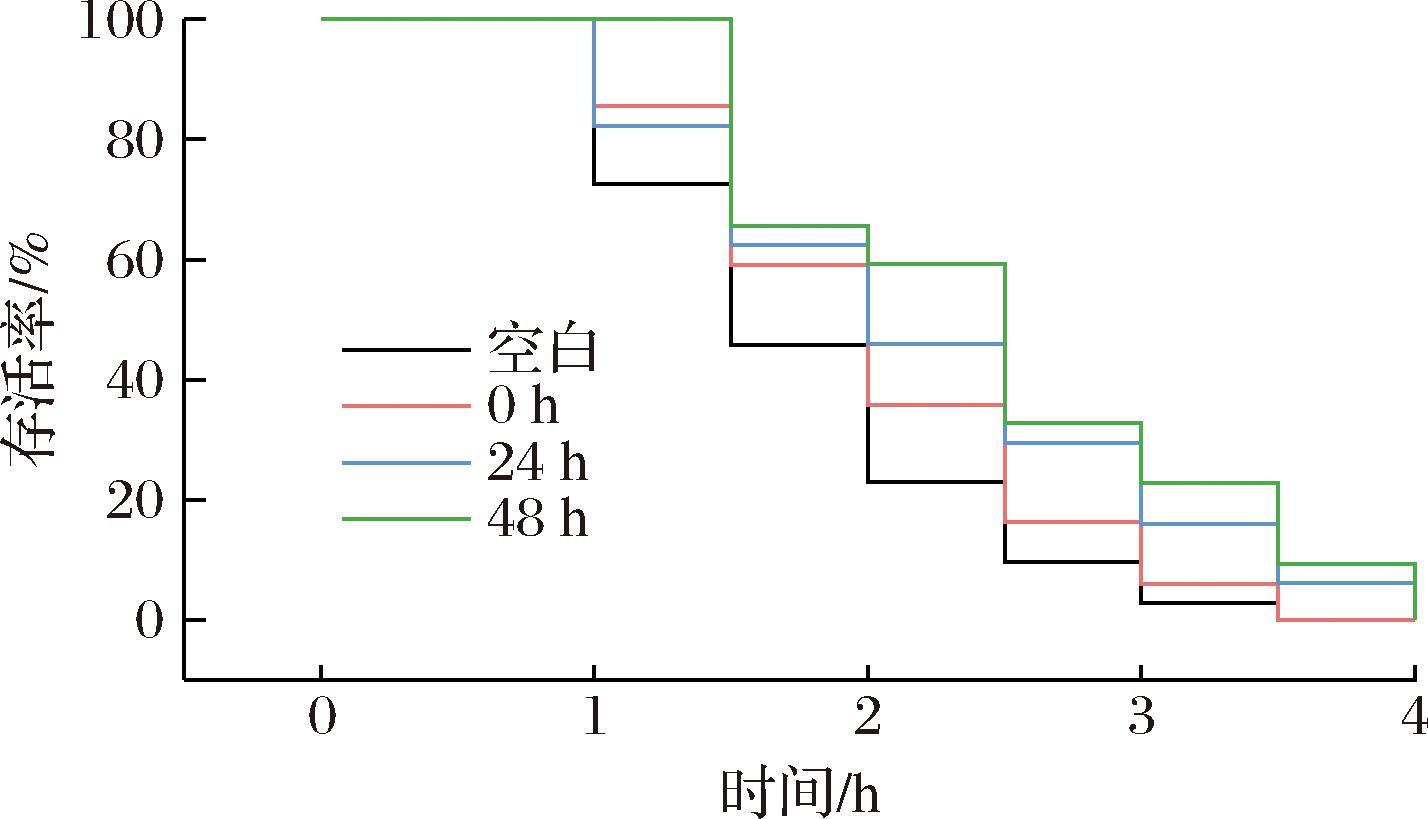
图3 米糠发酵液对秀丽线虫抗热应激的影响
Fig.3 Effect of fermented rice bran broth on heat resistance of C. elegans
2.3.3 米糠发酵液对秀丽隐杆线虫抗氧化应激的影响
H2O2作为细胞内常见的活性氧,过量的活性氧诱导会导致生物体细胞的结构及分子功能发生氧化损伤。建立了H2O2诱导秀丽隐杆线虫氧化损伤模型如图4所示,线虫存活率在6 h后显著下降。与空白组相比,48 h发酵组的存活率在12 h时增加了25%,明显高于其他组;48 h发酵组整体寿命曲线右移;当线虫的存活率达到0%时,48 h发酵组的寿命是空白组寿命的125%。表明米糠发酵液能增强线虫对H2O2的氧化损伤抵抗力。可能是因为米糠发酵液中的活性成分(如羟基苯甲酸、γ-谷维素等)在进入线虫细胞后会对细胞核产生保护作用,延缓了细胞核氧化损伤[23],从而延长了秀丽隐杆线虫的寿命。
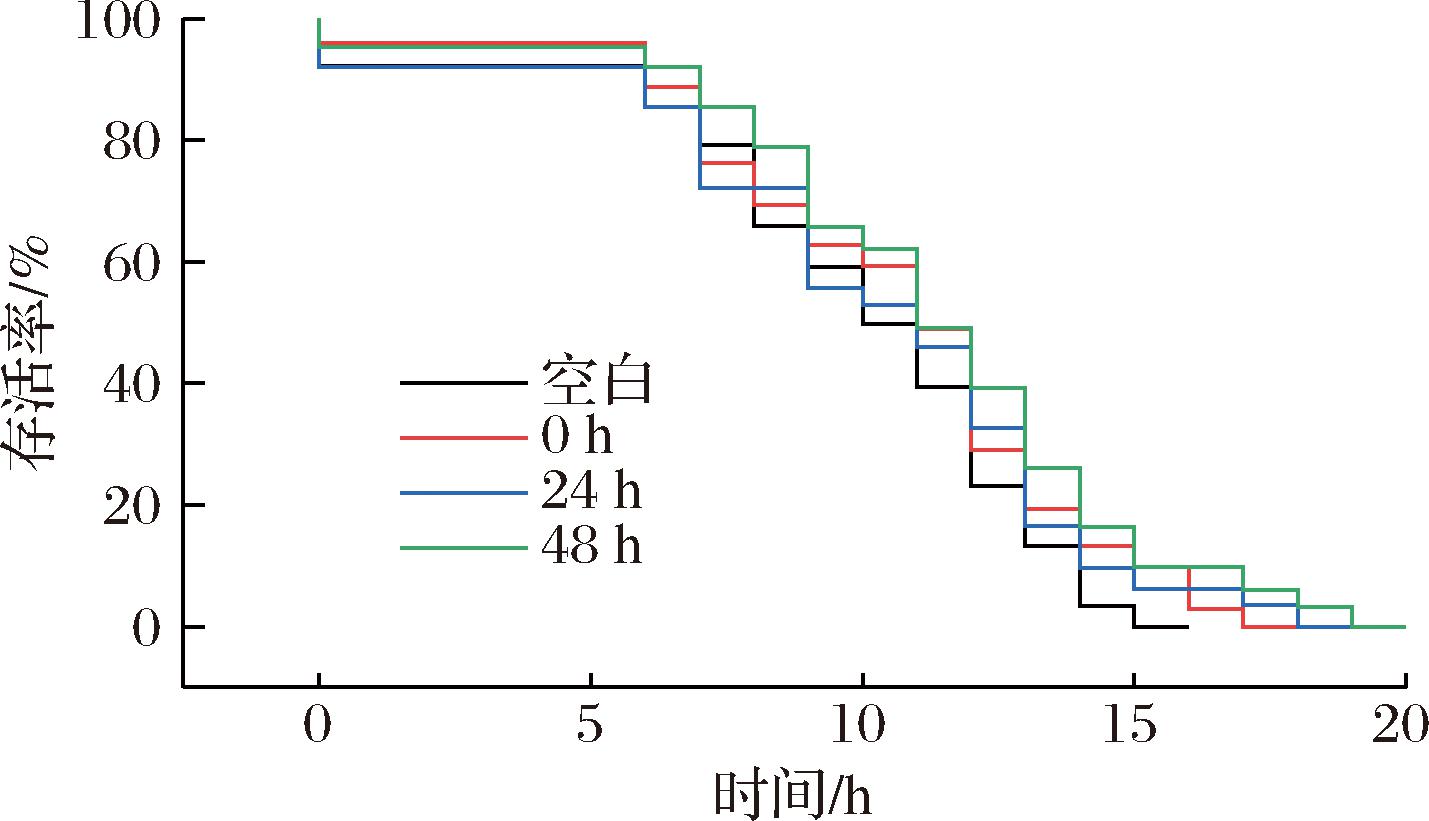
图4 米糠发酵液对秀丽隐虫抗氧化应激的影响
Fig.4 Effect of fermented rice bran broth on anti-oxidative of C. elegans
3 结论
本研究利用植物乳植杆菌发酵米糠,测定0、24、48 h时间段下米糠发酵液的基础营养成分与体外抗氧化活性,进一步建立热应激和H2O2氧化应激的秀丽隐杆线虫模型分析米糠发酵液对线虫的抗衰老作用。随着发酵时间的延长,其可溶性糖与蛋白含量显著下降,多酚含量显著增加,与对照组相比,48 h发酵组的多酚含量提高了1.5倍,羟自由基和DPPH自由基清除率分别增加了10%、15%以上;秀丽隐杆线虫模型结果显示喂养发酵液组的秀丽隐杆线虫平均寿命增加了12%~18%,且在热应激及氧化应激下寿命增加了15%、25%,说明了米糠发酵液具有延长寿命的潜力。以上结果表明发酵可以增加米糠提取液的多酚含量,增强抗氧化活性,进而使得线虫的抗衰老能力显著增强。本文初步探索了植物乳植杆菌发酵米糠体外抗氧化活性及氧化应激下对秀丽隐杆线虫抗衰老的影响规律,但有关米糠中特定功能活性成分对线虫的微观调节机制仍待进一步探究。
[1] KODAPE A, KODAPE A, DESAI R.Rice bran:Nutritional value, health benefits, and global implications for aflatoxin mitigation, cancer, diabetes, and diarrhea prevention[J].Food Chemistry, 2025, 464:141749.
[2] DEBI M R, WICHERT B A, LIESEGANG A.Anaerobic fermentation of rice bran with rumen liquor for reducing their fiber components to use as chicken feed[J].Heliyon, 2022, 8(4):e09275.
[3] WANCURA J H C, ALBARELLO M, HOLLAS S R, et al.Combined production of biofuel precursors, platform chemicals, and catalyst material from the integral processing of rice bran[J].Energy Conversion and Management, 2024, 317:118860.
[4] ZHANG B, ZHANG Y J, LI H Y, et al.A review on insoluble-bound phenolics in plant-based food matrix and their contribution to human health with future perspectives[J].Trends in Food Science &Technology, 2020, 105:347-362.
[5] NAJAMUDDIN U, GORJI S G, FITZGERALD M.Effect of post-milling process on the oxidation of the rice bran[J].Journal of Cereal Science, 2023, 111:103678.
[6] 曾锐, 汪卓, 陈菁, 等.乳酸菌发酵对海红米糠的结构和功能特性的影响[J].食品与发酵工业, 2023, 49(11):119-124.ZENG R, WANG Z, CHEN J, et al.Effects of lactic acid bacteria fermentation on structure and functional properties of sea red rice bran[J].Food and Fermentation Industries, 2023, 49(11):119-124.
[7] 张慧娟, 冯雪佳, 曹欣然, 等.生物改性对脱脂米糠营养特性及功能特性的影响[J].中国油脂, 2021, 46(5):109-116.ZHANG H J, FENG X J, CAO X R, et al.Effects of biological modification on nutritional and functional properties of defatted rice bran[J].China Oils and Fats, 2021, 46(5):109-116.
[8] PENG Z, QIAO B L, LI B, et al.Preparation, flavor component and antioxidant activity analysis of Lactiplantibacillus plantarum NCU137 fermented rice protein[J].Food Bioscience, 2024, 62:105017.
[9] 张夏秋, 刘丽娅, 王丽丽, 等.米根霉发酵米糠工艺优化及其益生活性研究[J].核农学报, 2020, 34(10):2280-2289.ZHANG X Q, LIU L Y, WANG L L, et al.Optimization of the fermentation process of rice bran with Rhizopus oryzae and its probiotic activities[J].Journal of Nuclear Agricultural Sciences, 2020, 34(10):2280-2289.
[10] WANG Y M, ZHENG W J, XU B, et al.Comparison of rice bran characteristics fermented by mono- or di-strain probiotics based on omics technology[J].LWT, 2024, 209:116763.
[11] NEMOTO H, OTAKE M, MATSUMOTO T, et al.Prevention of tumor progression in inflammation-related carcinogenesis by anti-inflammatory and anti-mutagenic effects brought about by ingesting fermented brown rice and rice bran with Aspergillus oryzae (FBRA)[J].Journal of Functional Foods, 2022, 88:104907.
[12] 张嘉妮, 张晓轩, 王大毛, 等.乳酸菌发酵改善脱脂富硒米糠的抗氧化活性[J].食品科学, 2023, 44(24):146-154.ZHANG J N, ZHANG X X, WANG D M, et al.Improvement of antioxidant activity of defatted selenium-enriched rice bran by lactic acid bacteria fermentation[J].Food Science, 2023, 44(24):146-154.
[13] LIN Y G, LIN C X, CAO Y, et al.Caenorhabditis elegans as an in vivo model for the identification of natural antioxidants with anti-aging actions[J].Biomedicine &Pharmacotherapy, 2023, 167:115594.
[14] GUO X H, XIN Q C, WEI P, et al.Antioxidant and anti-aging activities of Longan crude and purified polysaccharide (LP-A) in nematode Caenorhabditis elegans[J].International Journal of Biological Macromolecules, 2024, 267:131634.
[15] HU Q, LIU Z G, GUO Y J, et al.Antioxidant capacity of flavonoids from Folium Artemisiae Argyi and the molecular mechanism in Caenorhabditis elegans[J].Journal of Ethnopharmacology, 2021, 279:114398.
[16] MUDD N, MARTIN-GONZALEZ F S, FERRUZZI M, et al.In vivo antioxidant effect of edible cricket (Gryllodes sigillatus) peptides using a Caenorhabditis elegans model[J].Food Hydrocolloids for Health, 2022, 2:100083.
[17] PATANANAN A N, BUDENHOLZER L M, ESKIN A, et al.Ethanol-induced differential gene expression and acetyl-CoA metabolism in a longevity model of the nematode Caenorhabditis elegans[J].Experimental Gerontology, 2015, 61:20-30.
[18] YI C P, XIE L, CAO Z F, et al.Effects of rice bran fermented with Lactobacillus plantarum on palatability, volatile profiles, and antioxidant activity of brown rice noodles[J].International Journal of Food Science &Technology, 2022, 57(8):5048-5056.
[19] LIN S M, ZHANG X X, WANG J R, et al.Effect of lactic acid bacteria fermentation on bioactive components of black rice bran (Oryza sativa L.) with different milling fractions[J].Food Bioscience, 2024, 58:103684.
[20] 杨庆华, 张亚飞, 田晓静, 等.谷物发酵产品的营养功能提升与益生功能研究进展[J].食品与发酵工业, 2022, 48(17):304-312.YANG Q H, ZHANG Y F, TIAN X J, et al.Research progress on the improvement of nutritional function and probiotic performance of cereal fermented products[J].Food and Fermentation Industries, 2022, 48(17):304-312.
[21] 严静, 薛秋艳, 王旸, 等.发酵米荞对高脂肪秀丽隐杆线虫的降脂及抗氧化作用[J].食品工业科技, 2023, 44(6):8-15.YAN J, XUE Q Y, WANG Y, et al.Hypolipidemic and antioxidant effects of fermented rice buckwheat on high-fat Caenorhabditis elegans[J].Science and Technology of Food Industry, 2023, 44(6):8-15.
[22] 卢翔, 张翔宇, 李晨.小米糠多肽抗氧化活性及对秀丽隐杆线虫延寿作用初析[J].山西农业科学, 2022, 50(11):1542-1548.LU X, ZHANG X Y, LI C.Antioxidant activity of polypeptides from millet bran and its lifespan- prolonging effect on Caenorhabditis elegans[J].Journal of Shanxi Agricultural Sciences, 2022, 50(11):1542-1548.
[23] PALLAUF K, DUCKSTEIN N, RIMBACH G.A literature review of flavonoids and lifespan in model organisms[J].Proceedings of the Nutrition Society, 2017, 76(2):145-162.