自由基作为代谢产物,在生物体系中一般处于动态平衡,由于其化学性质极其活跃,会从邻近的细胞掠夺电子,从而损伤机体的组织和细胞,导致细胞衰老或凋亡[1]。研究表明自由基还与多种慢性疾病有关,包括衰老、糖尿病、癌症等[2-4]。因此,研发具备抗氧化特性和自由基清除功能的新型功能性食品正日益受到重视。目前使用的抗氧化剂中,天然来源的抗氧化剂往往更受消费者青睐。植物多糖来源广泛,安全性高,同时,还具有诸多生物活性,包括抗氧化性、降血糖活性、增强免疫力[5-7]等等,因此,以植物多糖为原料,研发新型抗氧化剂成为当前热点之一。
川明参(Chuanminshen violaceum)作为药食同源的道地药材,食用历史悠久,常作为炖食或蒸食的药膳辅料。据不完全统计,川明参中的天然活性物质约有200余种,主要有香豆素、萜类及多糖类化合物,其中多糖含量达20%以上[8],具有较好的开发价值。在天然多糖上进行化学修饰,引入新的化学基团往往能提高天然多糖的生物活性,曹磊等[9]对圆苞车前子的硫酸化产物研究证明,经过修饰的多糖具有更优异的抗氧化活性,王瑞[10]研究发现硫酸化修饰的金线莲多糖具有更好的自由基清除能力。课题组之前的研究表明,川明参粗多糖(Chuanminshen violaceum polysaccharides,CVPs)也具有一定的抗氧化活性,为提高其生物活性,本研究拟采用浓硫酸法制备硫酸化川明参粗多糖(sulfated Chuanminshen violaceum polysaccharides,S-CVPs),层析柱分离出纯化组分硫酸化川明参多糖(purified sulfated Chuanminshen violaceum polysaccharide components,S-CVPs-1-G),以H2O2诱导的HepG2细胞氧化应激模型来研究S-CVPs-1-G的抗氧化活性,对细胞毒性、细胞活力、抗氧化酶活力进行综合评价,再对具有良好抗氧化能力的S-CVPs-1-G进行结构解析,从而为抗氧化功能性食品和健康产品的开发提供理论基础。
1 材料与方法
1.1 材料及试剂
川明参干燥根茎,万州中药城;人肝癌细胞HepG2、胰酶、细胞增殖毒性检测试剂盒-8(cell counting kit-8,CCK8-8)、磷酸盐缓冲液(posphate buffered saline,PBS)、BCA(bicinchoninic acid,BCA)蛋白定量试剂盒、完全培养基,武汉塞维尔科技有限公司;超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、丙二醛(malondialdehyde,MDA)试剂盒,索莱宝科技有限公司;活细胞/死细胞染色试剂盒,碧云天生物技术有限公司;1-环已基-2-吗啉乙基碳二亚胺对甲苯磺酸盐、硼氘化钠,安徽泽升科技股份有限公司。
1.2 仪器与设备
Varioskan Flash酶标仪,美国Thermo公司;UV-2550紫外-可见分光光度计,日本岛津仪器有限公司;SCIENTZ-10N冷冻干燥机,宁波新芝冻干设备股份有限公司;3131细胞培养箱,美国Thermo Fisher有限公司;5920R低速离心机,德国Eppendorf公司;7890A-5977B气质联用仪,美国安捷伦公司;Bruker DRX-600核磁共振波谱仪,德国布鲁克仪器公司;DMi8荧光显微镜,德国Leica公司。
1.3 实验方法
1.3.1 S-CVPs-1-G的制备
采用课题组之前报道的方法[11]提取CVPs。利用Sevag法除蛋白质,将蛋白质除尽的样品浓缩,采用3倍体积的无水乙醇进行醇沉过夜。随后离心、沉淀收集、溶解、透析和冻干处理,制得CVPs。参考文献[12],确定了以下硫酸化步骤:将30 mL浓硫酸与10 mL正丁醇按体积比混合,加入到冰水浴磁力搅拌的锥形瓶中。缓慢加入2.5 g硫酸铵,待混匀后加入2.0 g CVPs。反应进行1.5 h,用4 mol/L的NaOH溶液终止反应,将pH调至中性,之后进行旋蒸,将浓缩液转移到3 500 Da透析袋中透析48 h。收集透析液并浓缩后进行冻干,从而得到S-CVPs。最后,通过DEAE-52纤维素柱(2.5 cm×60 cm)和Sephadex G-100葡聚糖凝胶柱(2.5 cm×60 cm)进行洗脱、冻干处理,制得S-CVPs-1-G。
1.3.2 HepG2 细胞的培养
细胞用含有10%(体积分数)胎牛血清、1%(体积分数)青霉素、1%(体积分数)链霉素的完全培养基中,置于37 ℃、5%(体积分数)CO2、相对湿度在85%以上的细胞培养箱中培养。当细胞密度达到80%~90%,且细胞形态较为一致时,除去旧培养基,用适量PBS清洗细胞后加入0.25%(体积分数)胰蛋白酶溶液消化,轻微晃动培养皿,使其与贴壁细胞充分接触[13]。置于培养箱消化3 min,用3 mL完全培养基终止反应,轻轻吹打细胞使其完全脱离,转移至无菌离心管中。吹打均匀后,1 000 r/min离心 5 min,弃上清液。加入1 mL完全培养基反复吹打,使细胞分散均匀,按1∶2比例传代培养。
1.3.3 细胞毒性实验
1.3.3.1 S-CVPs-1-G对HepG2 细胞存活率的影响
参考郭增旺等[14]的方法,取对数生长期的HepG2细胞以1×105个/mL(100 μL)的密度接种于96孔板,于37 ℃、5% CO2培养箱中培养24 h,边缘孔用PBS补充,消除边缘效应,于细胞培养箱中培养。待细胞贴壁完全,弃去旧培养基,PBS充分洗涤细胞后,用含不同质量浓度S-CVPs-1-G(0.1、0.5、1、2、3、4、5、10、15 mg/mL)的完全培养基处理细胞,每孔100 μL。培养24 h后弃去旧培养基,用PBS洗涤细胞,加入CCK-8试剂。孵育90 min后在450 nm处测定吸光度。
1.3.3.2 H2O2诱导的HepG2细胞氧化损伤模型的建立
细胞接种方法同1.3.3.1节。待细胞贴壁完全,弃去旧培养基,PBS充分洗涤细胞后,用含不同浓度H2O2(0、100、200、300、400、500、600、800、1 000 μmol/L)的完全培养基处理细胞,诱导细胞发生氧化应激,每孔100 μL。培养0.5 h后弃去旧培养基,用PBS洗涤细胞,更换新的完全培养基培养24 h。用 CCK-8法测定H2O2对细胞存活率的影响,计算如公式(1)所示。
细胞存活率![]()
(1)
1.3.4 S-CVPs-1-G对H2O2诱导HepG2细胞损伤的修复作用
细胞接种方法同1.3.3.1节。待细胞贴壁完全,弃去旧培养基,PBS充分洗涤细胞。将细胞分为:对照组、模型组、样品组、维生素C组。采用CCK-8法测定各组的细胞存活率,计算如公式(1)所示,细胞给药情顺序如表1所示。
表1 细胞给药顺序表
Table 1 Table of cell dosing sequences
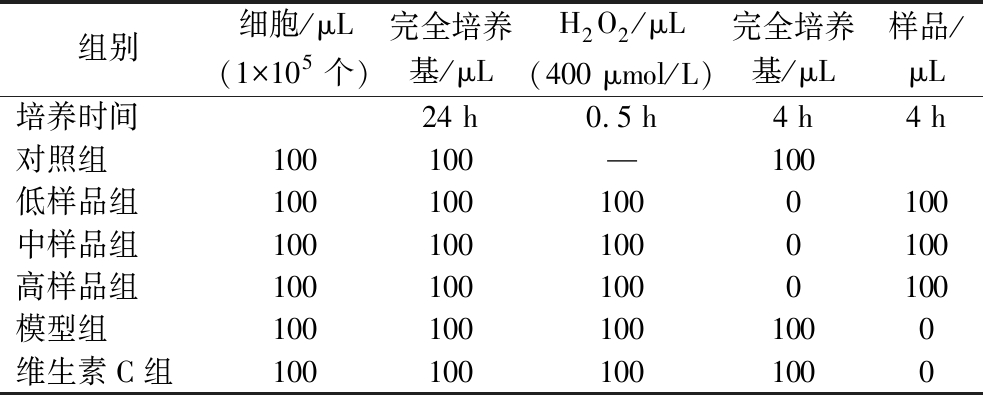
注:“—”表示用同体积完全培养基替代H2O2,细胞用完全培养基24 h培养后,PBS充分洗涤细胞后按上表给药。
组别细胞/μL(1×105个)完全培养基/μLH2O2/μL(400 μmol/L)完全培养基/μL样品/μL培养时间24 h0.5 h4 h4 h对照组100100—100低样品组1001001000100中样品组1001001000100高样品组1001001000100模型组1001001001000维生素C组1001001001000
1.3.5 细胞内SOD活力、MDA含量及CAT活力的测定
参考邢路娟[15]的方法,将细胞密度为1×105个/mL 的HepG2细胞接种于6孔细胞培养板中,每孔2 mL,后续培养及分组方法同1.3.4节。处理结束,弃去旧培养基,用PBS洗涤细胞,参照各检测试剂盒的操作说明,测定各组细胞内SOD的活力和MDA的含量以及CAT的活力。
1.3.6 Calcein-AM/PI双色荧光凋亡染色
利用Calcein-AM/PI荧光染色法评估细胞活力,该方法通过检测酯酶活性和细胞膜完整性来区分活细胞与死细胞[16]。细胞培养和分组步骤参照1.3.4节。处理完成后,移除旧培养基,用PBS清洗细胞。随后,每孔加入100 μL稀释的Calcein-AM溶液,放入37 ℃培养箱中避光孵育20 min,然后用PBS清洗细胞3次。加入50 μL稀释的PI溶液,在37 ℃下避光反应5 min,再用PBS清洗细胞2~3次,将细胞置于荧光显微镜下进行观察。
1.3.7 理化指标测定
采用氯化钡-明胶法[12]、HPLC[17]和高效凝胶渗透色谱法(high-performance gel permeationchromatography,HPGPC)[18]对S-CVPs-1-G的硫酸化取代度、单糖组成及分子质量进行测量。
1.3.8 S-CVPs-1-G甲基化测定
使用GC-MS对S-CVPs-1-G进行甲基化分析。称取5 mg样品,经甲基化、水解及乙酰化处理后上机检测[19]。
1.3.9 S-CVPs-1-G核磁分析
取适量的多糖样品溶解于99.9%的D2O中,使用Bruker DRX-600核磁共振波谱仪对样品的1H谱和13C谱进行测定。对样品进行氢-氢相关谱(correlation spectroscopy,COSY)、异核单量子相干谱(heteronuclear single quantum coherence,HSQC)、异核多键相关谱(heteronuclear multiple bond correlation,HMBC)、核奥弗豪泽效应谱(nuclear overhauser effect spectroscopy,NOESY)的采集。通过MestRanova对核磁数据进行处理和分析[20]。
1.3.10 数据处理
采用SPSS 27.0软件对数据进行统计分析,显著性分析采用单因素方差分析(analysis of variance,ANOVA),P<0.05时,表示具有统计学意义;结果均以“平均数±标准差”表示,每组实验重复3次,实验结果图通过Origin、GraphPad Prism 9软件绘制。
2 结果与分析
2.1 S-CVPs-1-G对HepG2细胞存活率的影响
在一定质量浓度范围内,S-CVPs-1-G对HepG2细胞的活性不会产生影响,当超过该范围,会对细胞产生毒性作用[21]。细胞活性能够直观地表达细胞的损伤情况,选择CCK-8试剂盒检测不同质量浓度S-CVPs-1-G对HepG2细胞存活率的影响,确定安全给药浓度范围。如图1所示,S-CVPs-1-G在0.1~10.0 mg/mL时,HepG2细胞的存活率均大于95%,与对照组细胞无显著性差异(P>0.05)。当给药质量浓度达到15 mg/mL时,细胞存活率下降到了83.45%,表明细胞受到了损伤,同时,在0.5、1、2 mg/mL时有较高的细胞存活率,分别为102.69%、97.90%、98.43%,因此,选取0.5、1、2 mg/mL为低、中、高浓度组进行后续实验。
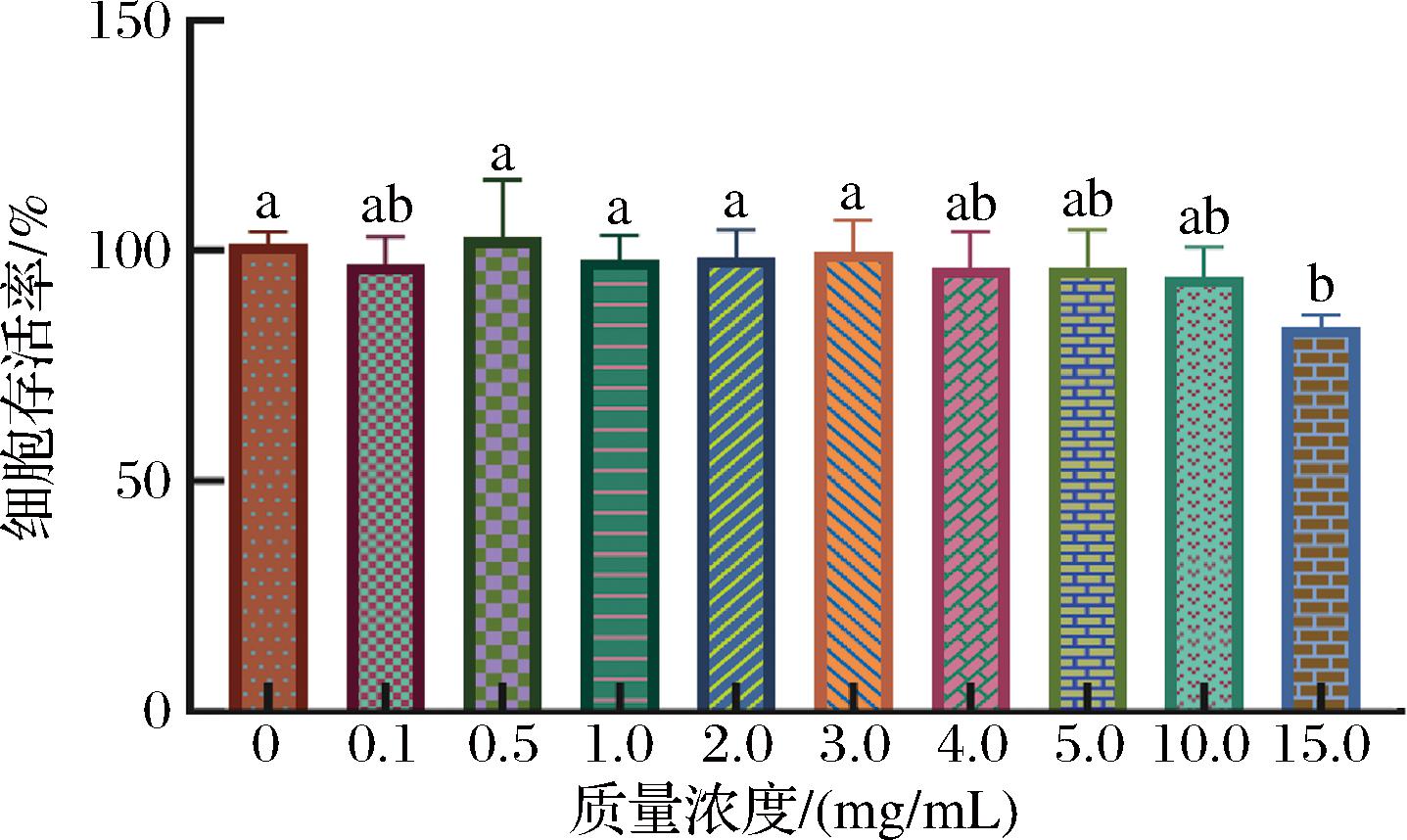
图1 不同质量浓度S-CVPs-1-G对HepG2细胞存活率的影响
Fig.1 Effects of different mass concentrations of S-CVPs-1-G on the survival rate of HepG2 cells
注:柱形图中的不同小写字母表示各组分间差异性显著(P<0.05)(下同)。
2.2 H2O2诱导HepG2细胞建立氧化损伤模型
如图2所示,不同浓度H2O2能够引起HepG2细胞不同程度的氧化损伤。随着H2O2浓度的提高,细胞存活率呈现下降趋势,并且与对照组相比差异显著(P<0.05)。为了构建既满足损伤标准又不对细胞造成永久性损害的模型,细胞生存率应控制在50%左右,生存率过高或过低均可能对后续样品的反应效率产生影响[22]。HepG2细胞经过400 μmol/L的H2O2处理后,细胞存活率为57.20%,处于适宜的浓度范围内。H2O2浓度提升到500 μmol/L时,细胞存活率为44.89%,细胞凋亡过多。因此,确定400 μmol/L 的H2O2浓度为最佳损伤浓度,以此为基础建立氧化损伤模型。
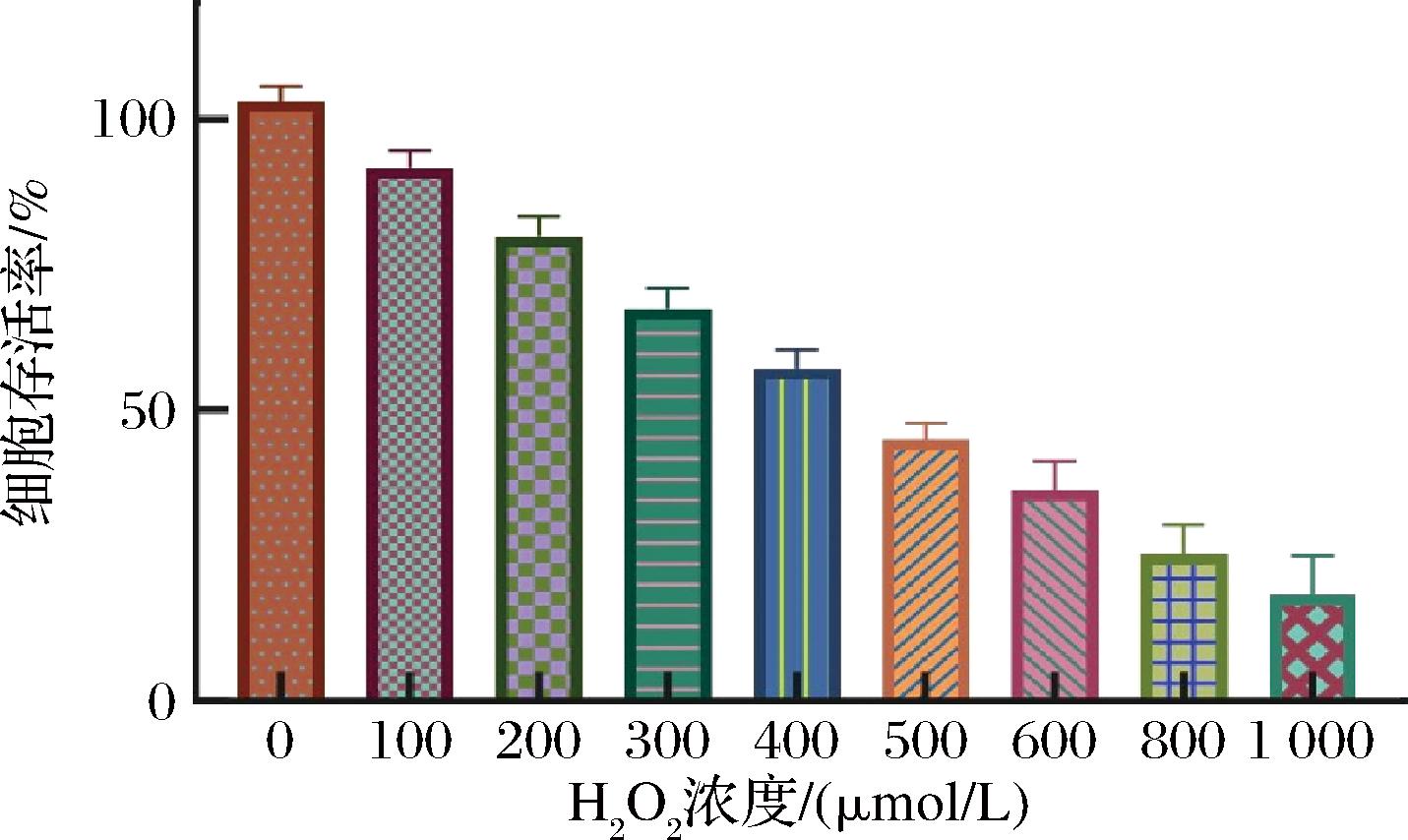
图2 不同浓度H2O2对HepG2细胞存活率的影响
Fig.2 Effects of different concentrations of H2O2on the survival rate of HepG2 cells
2.3 S-CVPs-1-G对H2O2诱导HepG2细胞的影响
通过H2O2诱导细胞建立氧化损伤模型探究S-CVPs-1-G对HepG2细胞氧化损伤的修复作用,如图3所示,与对照组相比,H2O2诱导的模型组细胞存活率降至59.11%,经低、中、高质量浓度CVPs处理组的细胞存活率分别为68.43%、74.77%、79.57%,分别较模型组提高了9.32%、15.66%、20.64%,经低、中、高浓度 S-CVPs-1-G处理组的细胞存活率分别为72.46%、79.75%、89.27%,较模型组提高了13.35%、20.64%、30.16%,表明经过处理的细胞抵抗H2O2损伤效果明显提升,即CVPs及S-CVPs-1-G均表现出对氧化损伤的修复作用,同时,经硫酸化处理的S-CVPs-1-G抑制效果明显优于CVPs。
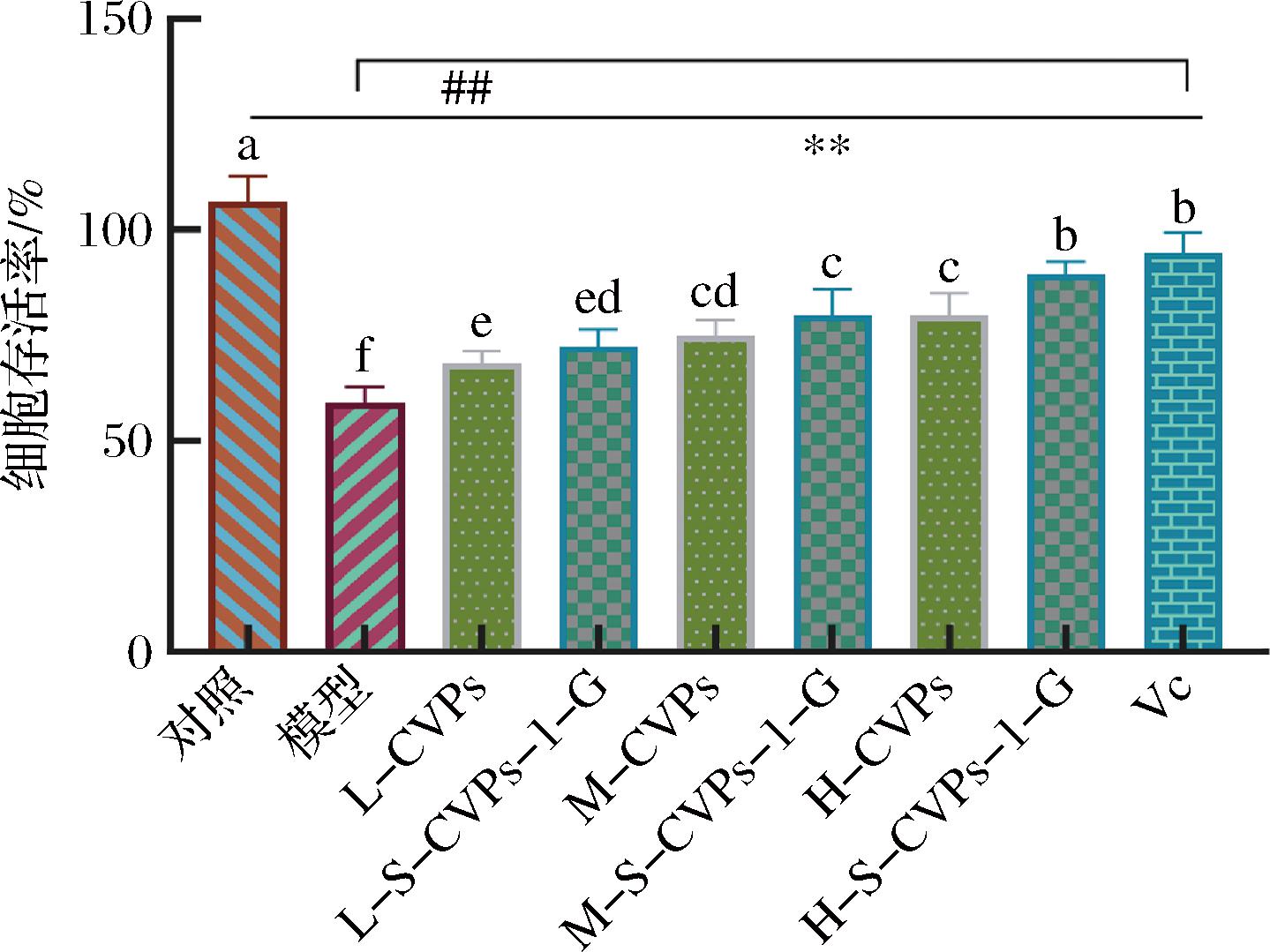
图3 CVPs及S-CVPs-1-G对氧化损伤HepG2细胞的修复作用
Fig.3 Repair effect of CVPs and S-CVPs-1-G on oxidatively damaged HepG2 cells
注:“**”表示各组与对照组之间存在显著性差异,“##”表示各组与模型组之间存在显著性差异(P<0.05)(下同)。
2.4 S-CVPs-1-G对HepG2细胞内CAT活力、SOD活力及MDA含量的影响
如图4-a所示,模型组中的酶活力显著低于对照组(P<0.05),这表明H2O2对这CAT活力产生了显著的抑制作用。S-CVPs-1-G处理后,CAT活力较模型组显著增强(P<0.05),其中低、中、高浓度组的CAT活力分别增长了0.50、1.03、1.81 U/mg prot,在CVPs的处理下,低、中、高浓度组的CAT活力分别增长了0.21、0.57、1.02 U/mg prot,这表明CVPs及S-CVPs-1-G对细胞的CAT活力有促进作用,且S-CVPs-1-G效果优于CVPs。如图4-b所示,H2O2对细胞SOD活力也产生了显著的抑制作用。S-CVPs-1-G处理后,SOD活力较模型组显著增强(P<0.05),其中低、中、高浓度组的SOD活力分别增长了1.68、2.99、4.55 U/mg prot,在CVPs的处理下,低、中、高浓度组的SOD活力分别增长了0.90、1.73、2.66 U/mg prot,这表明CVPs及S-CVPs-1-G对细胞的SOD活力有促进作用,且S-CVPs-1-G效果优于CVPs。MDA含量可以作为评估细胞氧化损伤程度的指标之一[23]。如图4-c所示,MDA在模型组中积累最多,在对照组中最少,H2O2能够诱导HepG2细胞生成MDA,在S-CVPs-1-G处理组中,MDA的含量随着S-CVPs-1-G浓度的增加而减少,其中高浓度组的MDA含量显著低于模型组(P<0.05),这表明S-CVPs-1-G能够在一定程度上抑制MDA的生成,改善脂质过氧化状态,并且这种抑制作用呈现出浓度依赖性。
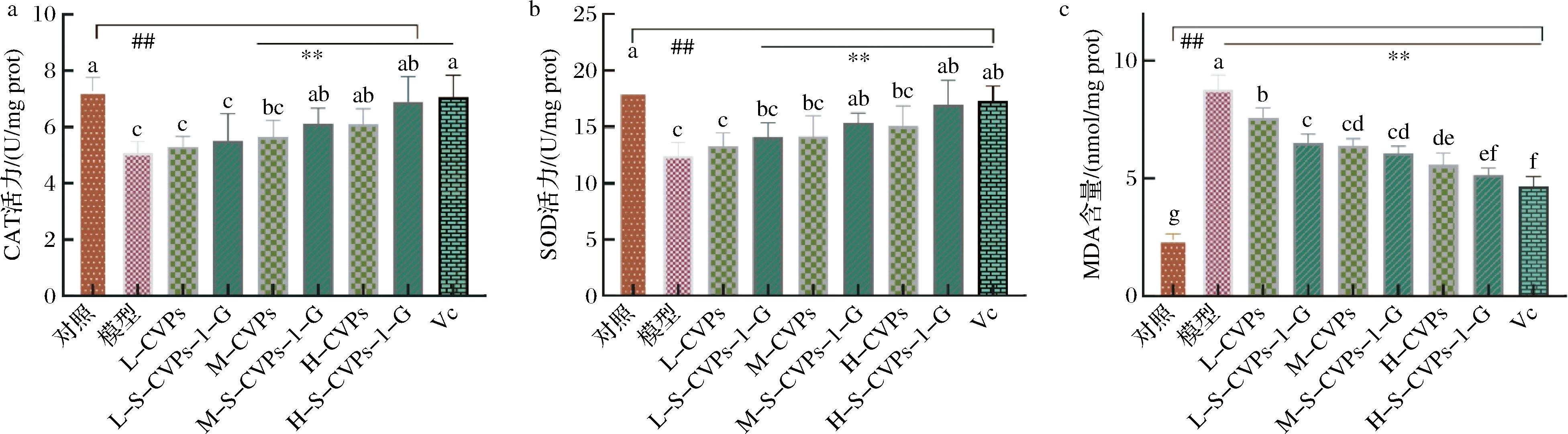
a-CAT;b-SOD;c-MDA
图4 S-CVPs-1-G对细胞内CAT活力、SOD活力及MDA含量的影响
Fig.4 Effects of S-CVPs-1-G on intracellular CAT activity, SOD activity, and MDA content
2.5 Calcein-AM/PI双色荧光凋亡染色
Calcein-AM仅对活细胞进行染色,使细胞质发出绿色荧光,而作为核染色剂的PI则不会染色具有完整质膜的活细胞,仅对死细胞的细胞核进行染色[24]。如图5所示,与对照组相比,模型组细胞密度降低,绿色荧光减弱,红色细胞核更为明显,这表明H2O2诱导的HepG2细胞氧化应激促进了细胞凋亡。然而,与模型组相比,加入不同浓度的CVPs及S-CVPs-1-G后,绿色荧光强度均有所增强,且随着CVPs及S-CVPs-1-G浓度的增加,绿色荧光强度进一步增强,红色荧光强度有一定的降低,显示出浓度依赖性的效应。因此,CVPs及S-CVPs-1-G能够修复H2O2引起的HepG2细胞形态学变化,且S-CVPs-1-G的修复效果优于CVPs。

图5 Calcein-AM/PI双色荧光凋亡染色结果
Fig.5 Calcein-AM/PI two-color fluorescent apoptosis staining results
注:A,正常组;B,模型组;C,维生素C组;D、E和F分别表示低、中、高质量浓度的CVPs;G、H和I分别表示低、中、高浓度的S-CVPs-1-G。
2.6 S-CVPs-1-G的理化结果
按1.3.7节的方法测定理化指标,氯化钡-明胶法回归方程分别为y=0.037x+0.137。其中标准曲线R2>0.99,结果如表2所示,其中硫酸化取代度为0.40。单糖组成中,葡萄糖占比最高,其次为半乳糖醛酸,同时,S-CVPs-1-G的分子质量为4.2 kDa。
表2 S-CVPs-1-G的理化指标
Table 2 Physicochemical indexes of S-CVPs-1-G

多糖组分取代度单糖组成葡萄糖/%半乳糖醛酸/%半乳糖/%甘露糖/%分子质量/kDaS-CVPs-1-G0.40±0.0489.326.371.051.144.2
2.7 S-CVPs-1-G的甲基化结果
采用甲基化分析来判断糖苷键连接方式。结合S-CVPs-1-G单糖组成及占比和GC-MS检测结果,甲基化糖中物质含量占比与单糖组成结果基本一致。如表3所示,S-CVPs-1-G主要由4个不同的糖残基组成,包括t-Glc(p)、4-GalA(p)、4-Glc(p)、4,6-Glc(p),其摩尔比分别为15.28%、13.01%、57.87%、9.12%,除此之外,还有少量的t-GalA(p)、6-Glc(p)、3,4-GalA(p),通过以上S-CVPs-1-G甲基化检出的7种糖残基可推测出,S-CVPs-1-G糖苷键的主要成分是→4)-GlcA(p)-(1→。
表3 S-CVPs-1-G甲基化分析结果
Table 3 Results of methylation analysis of S-CVPs-1-G

序号保留时间/min糖苷键类型甲基化产物摩尔比/%116.759t-Glc(p)1,5-di-O-acetyl-2,3,4,6-tetra-O-methyl glucitol15.28217.416t-GalA(p)1,5-di-O-acetyl-2,3,4,6-tetra-O-methyl galactitol1.66319.7494-GalA(p)1,4,5-tri-O-acetyl-2,3,6-tri-O-methyl galactitol13.01420.0664-Glc(p)1,4,5-tri-O-acetyl-2,3,6-tri-O-methyl glucitol57.87520.4846-Glc(p)1,5,6-tri-O-acetyl-2,3,4-tri-O-methyl glucitol1.87621.8943,4-GalA(p)1,3,4,5-tetra-O-acetyl-2,6-di-O-methyl galactitol1.18723.2734,6-Glc(p)1,4,5,6-tetra-O-acetyl-2,3-di-O-methyl glucitol9.12
2.8 S-CVPs-1-G的核磁结果
通过端基质子信号化学位移判断S-CVPs-1-G糖苷键类型,如图6-a所示,S-CVPs-1-G共有6个H-1端基信号,其中5.31、5.30、5.13、5.01、4.88、4.56标记为A-F,通过H-1端基信号判断,既有α糖苷键又有β糖苷键。相应地,在图6-b 13C-NMR找出异头碳信号峰,为99.91、99.72、99.60、98.49、95.83、91.83,结合COSY、HSQC、HMBC、NOSEY二维谱图及相关文献报道分析进一步确定残基化学的碳氢信号,具体结果如下:
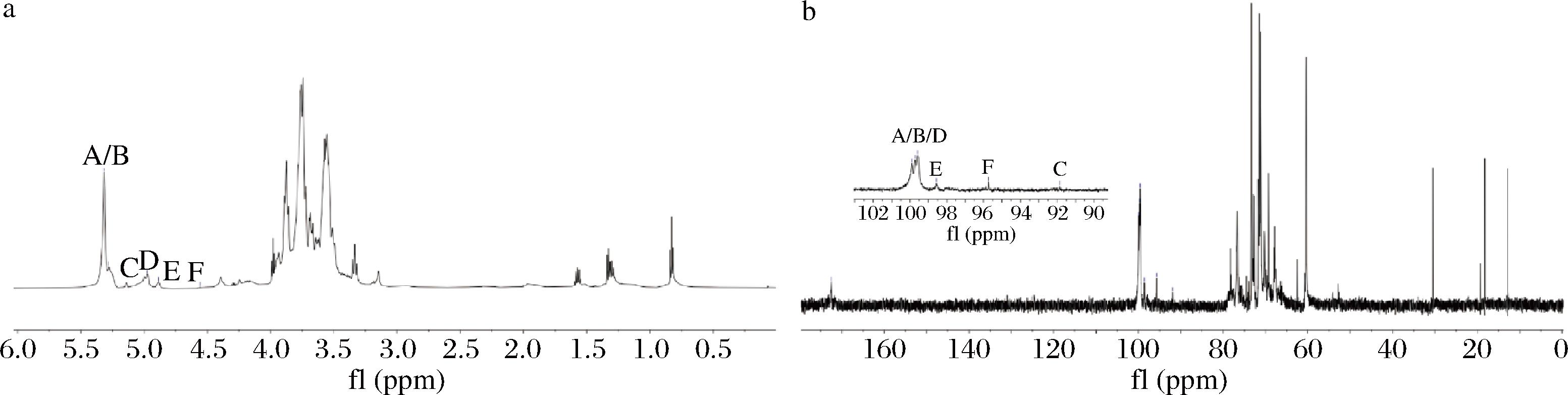
a-1H-NMR;b-13C-NMR
图6 S-CVPs-1-G的1H-NMR 和13C-NMR
Fig.6 1H-NMR and 13C-NMR of S-CVPs-1-G
对于残基A:其δH1/C1信号为5.32/99.80 ppm,通过δH1信号在COSY谱图(图7-a)中发现H-1(δ5.32 ppm)与δ3.54 ppm有明显的相关信号,确定了δ3.54 ppm为H-2信号,在HSQC谱图(图7-b)上找到对应的C-2信号为71.33 ppm,则δH2/C2信号为3.54/71.33 ppm,通过COSY谱图中δ3.87 ppm与δH2信号有相关性,因此确定δ3.87 ppm为H-3信号,根据H-3信号在HSQC谱图上找到对应的C-3信号为73.26 ppm,则δH3/C3 信号为3.87/73.26 ppm,以此类推,确定H-4/C-4、H-5/C-5、H-6/C-6的化学信号分别为3.57/76.86、3.75/71.76、3.70/62.56,经查阅文献比较[25-26],该残基碳氢信号与→4)-α-D-Glcp-(1→基本一致,结合甲基化、单糖组成结果分析,将残基A归属为→4)-α-D-Glcp-(1→。同理,将其余残基一一归属,结果如表4所示。
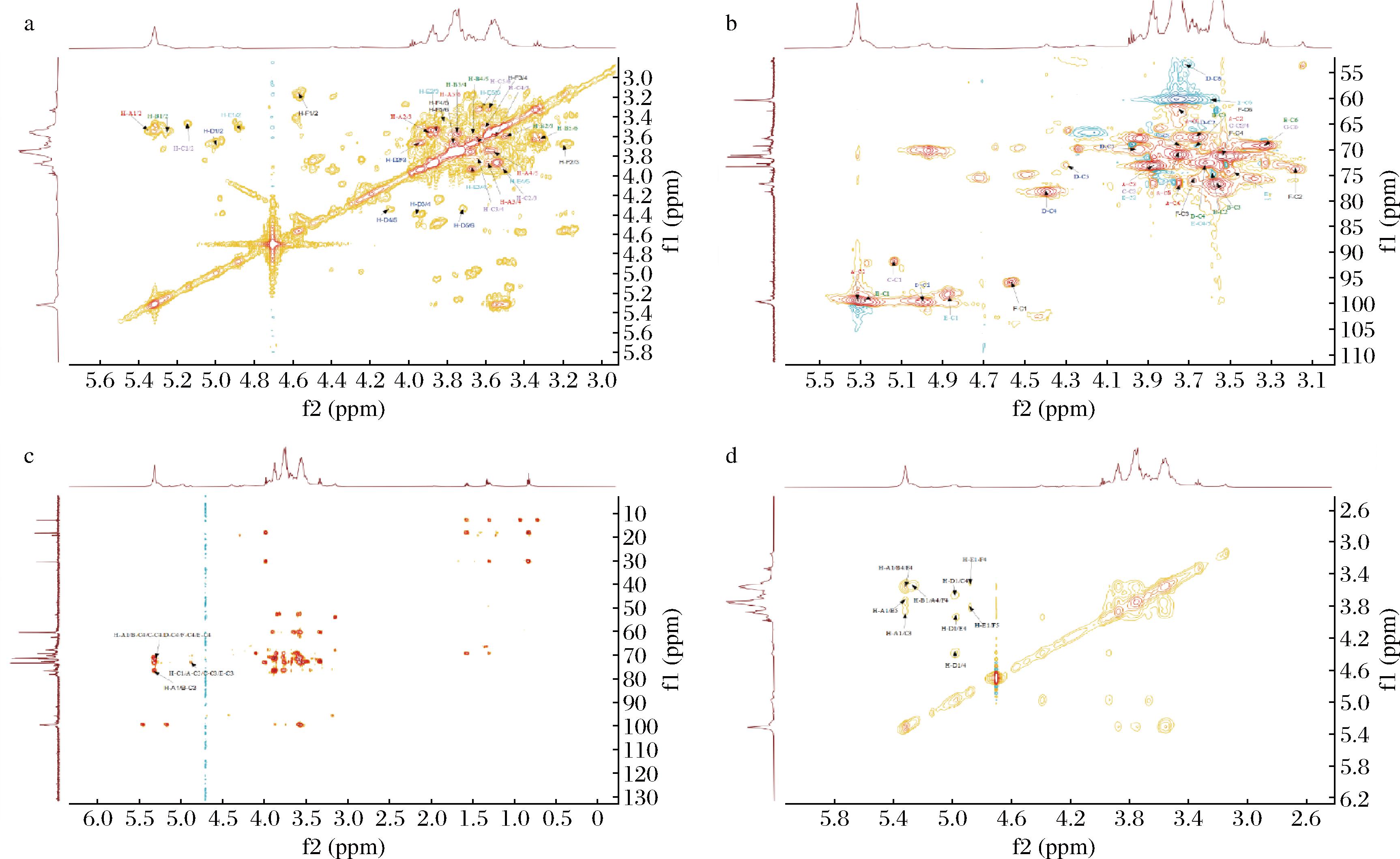
a-COSY;b-HSQC;c-HMBC;d-NOESY
图7 S-CVPs-1-G的结构解析
Fig.7 Structural analysis of S-CVPs-1-G
表4 S-CVPs-1-G化学位移表
Table 4 S-CVPs-1-G chemical shift table
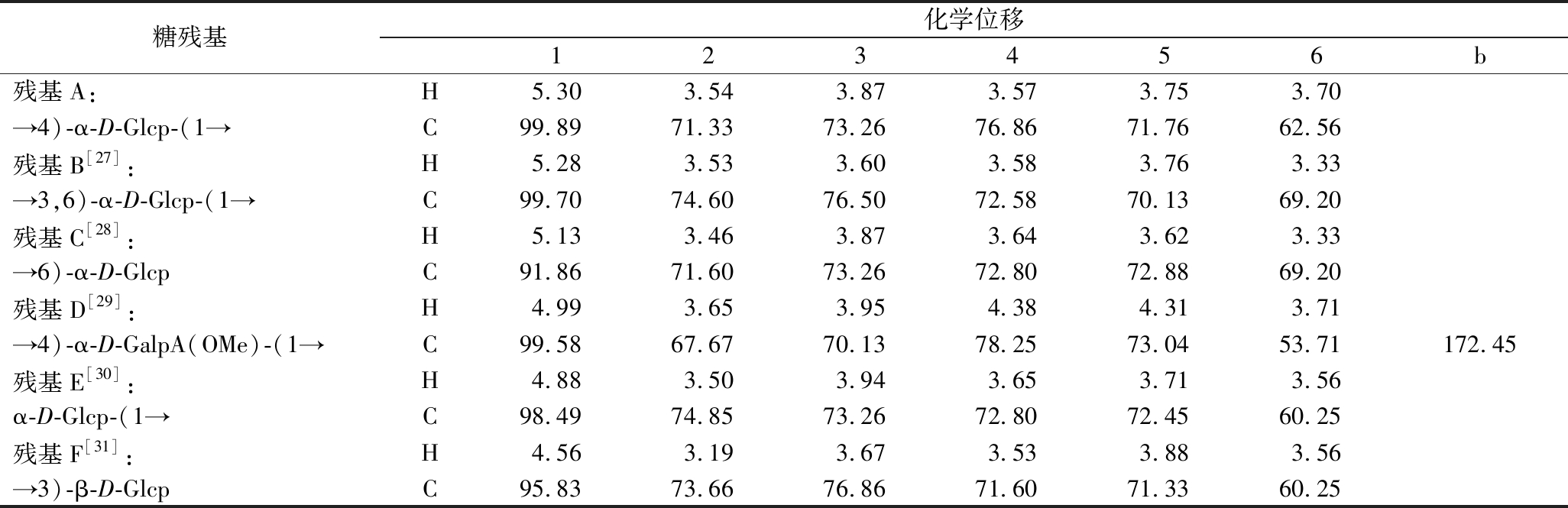
糖残基化学位移123456b残基A:H5.303.543.873.573.753.70→4)-α-D-Glcp-(1→C99.8971.3373.2676.8671.7662.56残基B[27]:H5.283.533.603.583.763.33→3,6)-α-D-Glcp-(1→C99.7074.6076.5072.5870.1369.20残基C[28]:H5.133.463.873.643.623.33→6)-α-D-GlcpC91.8671.6073.2672.8072.8869.20残基D[29]:H4.993.653.954.384.313.71→4)-α-D-GalpA(OMe)-(1→C99.5867.6770.1378.2573.0453.71172.45残基E[30]:H4.883.503.943.653.713.56α-D-Glcp-(1→C98.4974.8573.2672.8072.4560.25残基F[31]:H4.563.193.673.533.883.56→3)-β-D-GlcpC95.8373.6676.8671.6071.3360.25
通过HMBC和NOSEY可以推测糖残基之间的连接顺序。HMBC(图7-c)谱图中存在δ5.31/76.54关联信号,表明残基A的H-1和另一个残基A的C-4之间存在关联性,即残基A之间可通过1,4糖苷键相连。同时,残基A的H-1与残基B的C-3有关联信号,表明残基A与残基B可通过1,3糖苷键相连。NOSEY(图7-d)谱图中残基A的H-1分别与残基B的C-4、残基C的C-3、残基E的C-5、残基F的C-4存在耦合信号(δ5.31/3.86,3.72,3.53),说明残基A通过1,3糖苷键与残基C相连、通过1,4糖苷键与残基B和残基F相连、通过1,5糖苷键与残基E相连;残基B的H-1与残基A,F的H-4存在耦合信号(δ5.27/3.53),表明残基B与残基A,F间通过1,4糖苷键相连,残基D的H-1与残基C的H-4,与残基E的H-4有耦合信号(δ4.96/3.94,3.66),说明残基D可通过 1,4糖苷键与残基C和残基E相连,残基E的H-1与残基F的H-4,5有耦合信号(δ4.87/3.81,3.51),说明残基E通过1,4糖苷键和1,5糖苷键与残基F相连。结合文献报道,推测S-CVPs-1-G是以→4)-Glcp-(1→4)-α-Glcp-(1→为主链,同时含有少量→4)-α-Glcp-(1→3)-β-Glcp-(1→4)-α-D-GalpA(OMe)-(1→的葡聚糖[31-32]。
3 结论与讨论
本研究以S-CVPs-1-G为研究对象,通过H2O2诱导HepG2细胞构建氧化应激损伤模型,比较了S-CVPs-1-G与CVPs的抗氧化能力差异,以细胞存活率、SOD活力、CAT活力及MAD含量评价抗氧化活力,结合甲基化和核磁结果分析S-CVPs-1-G结构。细胞实验表明,在H2O2诱导的HepG2细胞氧化损伤中,CVPs和S-CVPs-1-G均显著提高了细胞存活率,能够缓解氧化应激后的形态变化,并减少细胞凋亡。此外,与CVPs相比,S-CVPs-1-G显示出更优的效果。S-CVPs-1-G能显著降低细胞内的MDA含量,维持细胞膜结构的稳定,提升抗氧化酶活性。S-CVPs-1-G是以→4)-Glcp-(1→4)-α-Glcp-(1→为主链,同时含有少量→4)-α-Glcp-(1→3)-β-Glcp-(1→4)-α-D-GalpA(OMe)-(1→的葡聚糖。
研究初步确定了S-CVPs-1-G结构,并且证明了S-CVPs-1-G具有一定的抗氧化能力,改性后的川明参多糖羟基上的氢被硫酸基团取代,改变了多糖的理化性质,使其水溶性增加,进而增强S-CVPs-1-G的抗氧化活性,但具体的增强机制仍需进一步探索。未来的研究可以集中深入探讨不同程度结构变化与抗氧化能力之间的关系和阐明硫酸化多糖作用机制2个方面。通过综上所述,本研究的结果为阐明S-CVPs增强抗氧化机制提供了理论基础,这将进一步推动川明参的开发利用,促进其在保健食品和药物领域的应用。
[1] SHARMA V, MEHDI M M.Oxidative stress, inflammation and hormesis:The role of dietary and lifestyle modifications on aging[J].Neurochemistry International, 2023, 164:105490.
[2] HE S Y, XIA J, JIA H J, et al.Peficitinib ameliorates 5-fluorouracil-induced intestinal damage by inhibiting aging, inflammatory factors and oxidative stress[J].International Immunopharmacology, 2023, 123:110753.
[3] MALLIK S, PARIA B, FIRDOUS S M, et al.The positive implication of natural antioxidants on oxidative stress-mediated diabetes mellitus complications[J].Journal of Genetic Engineering and Biotechnology, 2024, 22(4):100424.
[4] 陈嘉逸, 张芸, 侯俊玲, 等.抗氧化和促氧化机制在抗肿瘤治疗中的相似性与差异性[J].生物化工, 2024,10(4):218-221;226.CHEN J Y, ZHANG Y, HOU J L, et al.Similarities and differences of antioxidant and pro-oxidant mechanisms against tumor[J].Biological Chemical Engineering, 2024,10(4):218-221;226.
[5] SONG F F, NING F, FENG Y Y, et al.The polysaccharides from blackened jujube with ultrasonic assistance extraction:Optimization of extraction conditions, antioxidant activity and structural analysis[J].LWT, 2024, 213:117077.
[6] CHANG M W, LIU K L, ZHU G S, et al.Structural characterization and hypoglycaemic effects on type 2 diabetic mice of Spirulina platensis polysaccharides and Se-modified polysaccharides[J].Food Bioscience, 2025, 64:105826.
[7] 段伟伟. 沙蒿多糖和不同锌源对绒山羊羔羊生产性能、抗氧化、免疫及肠道健康的影响[D].呼和浩特:内蒙古农业大学, 2024. DUAN W W.Effects of Artemisia sphaerocephala Krasch polysaccharide and different zine sources on production performance, antioxidant, immune and intestinal health in cashmere goat kids[D].Hohhot:Inner Mongolia Agricultural University, 2024.
[8] 高涛, 唐华丽, 罗振宇, 等.川明参粗多糖初级结构解析及其体外抗氧化活性[J].中国食品学报, 2021,21(8):275-282.GAO T, TANG H L, LUO Z Y, et al.Primary structure analysis and antioxidant activity in vitro of crude polysaccharide from Chuanminshen violaceum[J].Journal of Chinese Institute of Food Science and Technology, 2021,21(8):275-282.
[9] 曹磊, 刘伟, 王俊龙, 等.硫酸化制备圆苞车前子低黏多糖及其结构表征和抗氧化活性研究[J].天然产物研究与开发, 2024,36(1):26-36.CAO L, LIU W, WANG J L, et al.Preparation of low viscosity polysaccharide from Plantago ovata Forsk by sulfation method and its structural characterization and antioxidant activities[J].Natural Product Research and Development, 2024,36(1):26-36.
[10] 王瑞. 金线莲多糖及其衍生物抗氧化活性及抗疲劳研究[J].保鲜与加工, 2024,24(8):44-50.WANG R.Study on antioxidant and antifatigue activities of polysaccharides from Anoectochilus roxburghii and the derivatives[J].Storage and Process, 2024,24(8):44-50.
[11] 高涛, 罗振宇, 罗黄洋, 等.川明参多糖的超声辅助酶法提取及其体外抗氧化活性[J].食品研究与开发, 2020,41(23):86-92.GAO T, LUO Z Y, LUO H Y, et al.Ultrasound-assisted enzymatic extraction of polysaccharides from Chuanminshen violaceum and its antioxidant activity in vitro[J].Food Research and Development, 2020,41(23):86-92.
[12] 李思雨. 小球藻多糖提取纯化及其改性研究[D].南宁:广西民族大学, 2022.LI S Y.Study on extraction, purification and modification of Chlorella polysaccharide[D].Nanning:Guangxi Minzu University, 2022.
[13] MENG L Y, YU D D, LIN J N, et al.Structural characterization, HepG2 cell cytoprotective ability, and antioxidant mechanism of novel antioxidant peptides identified from black soldier fly larvae (Hermetia illucens L.)[J].Food Chemistry, 2025, 463:141462.
[14] 郭增旺, 樊乃境, 田海芝, 等.小米糠黄酮H2O2致HepG2氧化应激损伤的保护作用[J].食品科学, 2020,41(5):159-165.GUO Z W, FAN N J, TIAN H Z, et al.Protective effects of flavonoids from millet bran on H2O2-induced oxidative stress injury in HepG2 cells[J].Food Science, 2020,41(5):159-165.
[15] 邢路娟. 宣威火腿中抗氧化肽的分离鉴定及抗氧化机理研究[D].南京:南京农业大学, 2019.XIN L J.Study on the identification and the antioxidant mechanism of antioxidant peptides in Xuanwei ham[D].Nanjing:Nanjing Agricultural University, 2019.
[16] 周泓妍, 郑怡, 王海东, 等.南、北五味子蛋白抗氧化活性和对HepG2细胞氧化应激损伤的修复作用[J].食品与发酵工业, 2024,50(7):51-60.ZHOU H Y, ZHENG Y, WANG H D, et al.Antioxidant activity of Schisandra sphenanthera and Schisandra chinensis protein on HepG2 cells[J].Food and Fermentation Industries, 2024,50(7):51-60.
[17] WANG Z J, XIE J H, SHEN M Y, et al.Sulfated modification of polysaccharides:Synthesis, characterization and bioactivities[J].Trends in Food Science &Technology, 2018, 74:147-157.
[18] YE S Y, GAO Y, HU X Y, et al.Research progress and future development potential of Flammulina velutipes polysaccharides in the preparation process, structure analysis, biology, and pharmacology:A review[J].International Journal of Biological Macromolecules, 2024, 267:131467.
[19] KIM M, KIM S R, PARK J, et al.Structure and antiviral activity of a pectic polysaccharide from the root of Sanguisorba officinalis against enterovirus 71 in vitro/vivo[J].Carbohydrate Polymers, 2022, 281:119057.
[20] 高涛, 罗黄洋, 吴韧, 等.川明参中葡聚糖的分离纯化、结构表征及抗氧化活性研究[J].食品与发酵工业, 2021,47(19):43-49.GAO T, LUO H Y, WU R, et al.Purification, structure identification and antioxidant activity of glucan from Chuanminshen violaceum[J].Food and Fermentation Industries, 2021,47(19):43-49.
[21] 何娅轲. 乳酸菌发酵胡柚皮饮料的工艺及其抗氧化活性研究[J].杭州:浙江大学, 2023.HE Y K.Preparation and antioxidant activity of Huyou peel beverage fermented by lactic acid bacteria[J].Hangzhou:Zhejiang University, 2023.
[22] 赵悦竹, 金鑫, 张屿楠, 等.芦荟多糖对D-半乳糖致HepG2细胞氧化损伤的保护作用[J].食品工业科技, 2023, 44(1):405-412.ZHAO Y Z, JIN X, ZHANG Y N, et al.Protective effect of Aloe polysaccharide on oxidative stress injury of HepG2 cells induced by D-galactose[J].Science and Technology of Food Industry, 2023, 44(1):405-412.
[23] BUSCH C J, BINDER C J.Malondialdehyde epitopes as mediators of sterile inflammation[J].Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids, 2017, 1862(4):398-406.
[24] CHU Q, JIA R Y, CHEN C W, et al.Apios americana Medik leaf extracts attenuate H2O2-induced hepatotoxicity[J].Food Bioscience, 2021, 41:100996.
[25] MENG F C, LI Q, QI Y N, et al.Characterization and immunoregulatory activity of two polysaccharides from the root of Ilex asprella[J].Carbohydrate Polymers, 2018, 197:9-16.
[26] ZHANG J X, ZHAO J Y, LIU G Y, et al.Advance in Morchella sp.polysaccharides:Isolation, structural characterization and structure-activity relationship:A review[J].International Journal of Biological Macromolecules, 2023, 247:125819.
[27] ZHANG Y S, ZHANG Z M, LIU H, et al.A natural selenium polysaccharide from Pleurotus ostreatus:Structural elucidation, anti-gastric cancer and anti-colon cancer activity in vitro[J].International Journal of Biological Macromolecules, 2022, 201:630-640.
[28] SONG J Y, ZHANG Y F, ZHU Y F, et al.Structural characterization and anti-osteoporosis effects of polysaccharide purified from Eucommia ulmoides Oliver cortex based on its modulation on bone metabolism[J].Carbohydrate Polymers, 2023, 306:120601.
[29] LI J W, AI L Z, YANG Q, et al.Isolation and structural characterization of a polysaccharide from fruits of Zizyphus jujuba cv.Junzao[J].International Journal of Biological Macromolecules, 2013, 55:83-87.
[30] ZHANG A Q, DENG J Y, LIU X Q, et al.Structure and conformation of α-glucan extracted from Agaricus blazei Murill by high-speed shearing homogenization[J].International Journal of Biological Macromolecules, 2018, 113:558-564.
[31] ZHANG Z, GUO L, YAN A P, et al.Fractionation, structure and conformation characterization of polysaccharides from Anoectochilus roxburghii[J].Carbohydrate Polymers, 2020, 231:115688.
[32] SHI X D, LI O Y, YIN J Y, et al.Structure identification of α-glucans from Dictyophora echinovolvata by methylation and 1D/2D NMR spectroscopy[J].Food Chemistry, 2019, 271:338-344.