非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)是一种高发的代谢性疾病,以肝细胞气泡形成和炎性脂肪性变性为主要特征[1],会导致肝硬化和肝细胞癌等疾病[2]。目前NASH主要通过调整饮食与辅助用药相结合的方式进行治疗[3],研究开发具有治疗和改善NASH作用的药物及保健食品成为一个亟需解决的问题。
菊苣一般指菊科植物毛菊苣(Cichorium glandulosum Boiss et Huet)或菊苣(Cichorium intybus L.),广泛分布于世界各地,是我国新疆地区药食两用型特色植物资源,全草及种子均可入药[4],在保健品开发、药物制剂及食品研究中广泛应用[5]。卡森露剂是中药菊苣子经蒸馏提取得到的一种液体制剂,收载于“新疆维吾尔自治区医疗机构制剂”目录,可以有效改善肝硬化、肝炎、肝纤维化患者的症状[6]。目前,关于其保肝作用及其药效物质基础的研究未见报道。
网络药理学作为一种整体性研究方法,可以开展药物多成分与多靶点的综合分析[7-8]。超高效液相色谱-质谱联用(ultra-high performance liquid chromatography-mass spectrometry,UPLC-MS)技术能够高效、快速地分离并鉴定中药制剂中的多种组分,成为筛选活性成分的关键技术手段。为了进一步研究卡森露剂治疗NASH的药效物质基础和作用机制,本文采用超高效液相色谱-四极杆轨道阱高分辨-质谱(ultra-high performance liquid chromatography-quadrupole exactive-mass spectrometry,UPLC-QE-MS)技术对卡森露剂进行成分分析,运用网络药理学及分子对接技术结合细胞验证实验,对卡森露剂干预NASH的作用靶点及其潜在的作用机制进行探究。
1 材料与方法
1.1 材料与试剂
菊苣子,新疆新维制药厂;甲醇、乙腈、甲酸,均为色谱纯,美国赛默飞世尔科技公司;HepG2细胞,中国科学院细胞库;Gibco胎牛血清、青链霉素双抗、杜氏改良伊格尔(Dulbecco’s modified eagle medium,DMEM)培养基、胰蛋白酶、甘油三酯(triglyceride,TG)试剂盒、总胆固醇(total cholesterol,TC)试剂盒、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)试剂盒、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)试剂盒、丙氨酸转氨酶(alanine aminotransferase,ALT)试剂盒、天冬氨酸转氨酶(aspartate aminotransferase,AST)试剂盒,南京建成科技有限公司;p-Akt1、Akt1、p-STAT3、STAT3、IL-1β、Bcl-2抗体,武汉三鹰生物技术有限公司。
1.2 仪器与设备
ACQUITY UPLC I-Class HF型超高效液相色谱仪、ACQUITY UPLC HSS T3型色谱柱(100 mm×2.1 mm,1.8 μm),美国沃特世公司;Thermo-Obritrap-QE型高分辨液质联用质谱仪,美国赛默飞世尔科技公司;Western Blot化学发光仪,美国Azure biosystems公司;Powerpack Western Blot电泳套装,美国BioRad公司。
1.3 实验方法
1.3.1 卡森露剂的成分鉴定
1.3.1.1 卡森露剂的制备
取200 g菊苣子置于容器中,加去离子水浸没。将容器放在蒸汽蒸馏装置上,启动蒸馏,100 ℃加热使菊苣子活性成分随蒸汽上升并冷凝成液体,待蒸馏1 L馏出液后停止加热,馏出液经0.22 μm滤膜过滤后分装至密封的灭菌瓶中。
1.3.1.2 样品制备
将卡森露剂混合均匀后取100 μL样本置于1.5 mL离心管中,加入20 μL内标,涡旋振荡1 min后冰水浴超声波提取60 min,在4 ℃ 14 000 r/min离心10 min,取500 μL上清液装入LC-MS进样小瓶中进行分析。
1.3.1.3 色谱条件
柱温45 ℃;流动相A为水(含0.1%甲酸,体积分数),B为乙腈;流速0.35 mL/min;进样体积5 μL,梯度洗脱设置为:0~2 min,5% B;2~4 min,5%~30% B;4~8 min,30%~50% B;8~10 min,50%~80% B;10~14 min,80%~100% B;14~15 min,100% B;15~15.1 min,100%~5% B;15.1~16 min,5% B。
1.3.1.4 质谱条件
采集1级和2级质谱数据,离子源为HESI,样品质谱信号采集分别采用正负离子扫描模式。数据采集模式:DDA。扫描方式:Full MS/dd-MS2,质谱参数如表1所示。
表1质谱参数信息
Table 1 Mass spectrometry parameter information
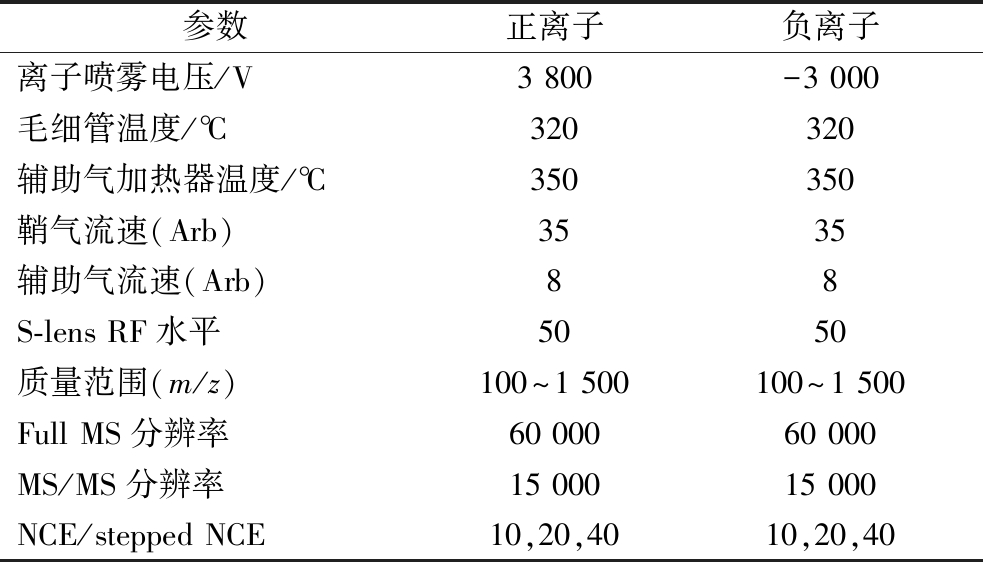
参数正离子负离子离子喷雾电压/V3 800-3 000毛细管温度/℃320320辅助气加热器温度/℃350350鞘气流速(Arb)3535辅助气流速(Arb)88S-lens RF水平5050质量范围(m/z)100~1 500100~1 500Full MS分辨率60 00060 000MS/MS分辨率15 00015 000NCE/stepped NCE10,20,4010,20,40
1.3.2 网络药理学预测卡森露剂成分与其作用靶点
1.3.2.1 卡森露剂活性成分类药性筛选
利用SwissADME数据库对卡森露剂中候选化合物的ADME(吸收、分布、代谢、排泄)参数进行预测,筛选标准为“胃肠吸收度较高”且药物相似度满足“Yes”标准(药物相似度>2项)。
1.3.2.2 预测卡森露剂活性成分的靶点
利用SwissTargetPrediction(http://swisstargetprediction.ch)数据库对卡森露剂活性成分进行靶点预测,筛选可能性>0的靶点,剔除重复。
1.3.2.3 NASH相关靶点筛选和卡森露剂潜在治疗靶点预测及构建“疾病-药物-化合物-靶点”网络以“Non alcoholic steatohepatitis”为关键词在GeneCards(https://www.genecards.org)、DrugBank(https://go.drugbank.com)、人类在线孟德尔遗传(Online Mendelian Inheritance in Man,OMIM)(https://www.Omim.org)、TCMSP(https://www.tcmsp-e.com)数据库中检索、汇总和去重,整理卡森露剂活性成分和NASH相关通路以及靶点,使用Cytoscape 3.7.2软件绘制卡森露剂活性成分与NASH潜在靶点的“卡森露剂-靶点”网络关系图,按Degree值筛选得到排名前10的主要活性化合物。
1.3.2.4 蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络的构建和核心靶点筛选将获得的卡森露剂成分治疗NASH的潜在靶点导入STRING(https://string-db.org)数据库,设置人源性物种来源,设置最小置信度(minimum required interaction score)为0.7,隐藏游离的节点,其余参数默认设置,构建PPI网络图,基于接近中心性(closeness centrality,CC)、介度中心性(betweenness centrality,BC)及度中心性(degree centrality,DC)值筛选核心靶点。
1.3.2.5 GO及KEGG功能富集分析
利用David数据库(https://david.ncifcrf.gov)对预测的NASH潜在治疗靶点进行GO和KEGG富集分析,根据P值按次序排列筛选排名前10的生物过程、细胞组分、分子功能及KEGG功能条目,采用R软件对结果进行可视化。
1.3.3 分子对接实验
通过PubChem数据库(https://pubchem.ncbi.nlm.nih.gov)下载关键活性成分的3D结构,使用RCSB PDB 数据库(https://www.rcsb.org)获得相关靶点蛋白结构,基于Auto Dock Tools软件进行分子对接,筛选出具有较低结合能(对接分数≤-5)的化合物和靶点,利用PyMOL软件进行可视化处理。
1.3.4 细胞实验
1.3.4.1 CCK-8实验检测卡森露剂对HepG2细胞增殖的影响
HepG2细胞以5×103/孔的密度接种至96孔板中,在37 ℃、5% CO2的恒温培养箱中孵育24 h,各孔加入200 μL以低糖DMEM完全培养基稀释的卡森露剂给药培养基(0、5、10、50、100、200、300、400 μg/mL),继续培养24 h,利用CCK-8实验评估卡森露剂对细胞增殖活力的影响。
1.3.4.2 细胞分组与处理
细胞以8×105密度接种至6孔板中贴壁24 h,根据文献[9]的方法,先以低糖DMEM基础培养基饥饿培养12 h,再更换高糖DMEM完全培养基并加入终浓度为0.25 mmol/L的棕榈酸培养24 h,建立NASH细胞模型。将细胞分为模型组、阳性对照组(1.0 mmol/L非诺贝特)、卡森露剂低、中、高剂量组(50、100、200 μg/mL),另设空白对照组(培养液中加入等体积PBS)。阳性对照组(1.0 mmol/L非诺贝特)和实验组细胞给药处理24 h。
1.3.4.3 生化实验检测卡森露剂对细胞TG、TC、LDL-C、HDL-C含量及AST、ALT活性的影响给药处理结束后,处理各组细胞并制备样品,按照试剂盒说明书分别检测细胞中TG、TC、LDL-C、HDL-C含量以及AST、ALT活性。
1.3.4.4 Western Blot法检测Akt1、p-Akt1、STAT3、p-STAT3、IL-1β和Bcl-2蛋白表达水平
给药处理结束后,各组取1×107个细胞并经裂解后提取蛋白质,BCA法进行蛋白质定量,经凝胶电泳分离、转膜及封闭后,依次加入一抗(1∶1 500)及二抗(1∶10 000)进行孵育,洗膜后用ECL发光显影,采用ImageJ软件分析条带灰度值。
1.4 统计学处理
采用GraphPad Prism 9软件进行统计学分析并绘制柱形图,数据结果以“平均值±标准差”表示,基于方差分析进行多组间数据比较,P<0.05表明差异具有统计学意义。
2 结果与分析
2.1 卡森露剂活性成分鉴定结果
UPLC-MS检测获得了卡森露剂总离子流图(图1),使用TCMSP数据库定性并与对照品的保留时间及二级质谱数据对比确认出了80个成分,将其导入SwissADME数据库中,根据筛选条件最终得到32个活性成分,结果如表2所示,32种活性成分均已实现靶点检索,且物质类药性指标均不低于0.18。
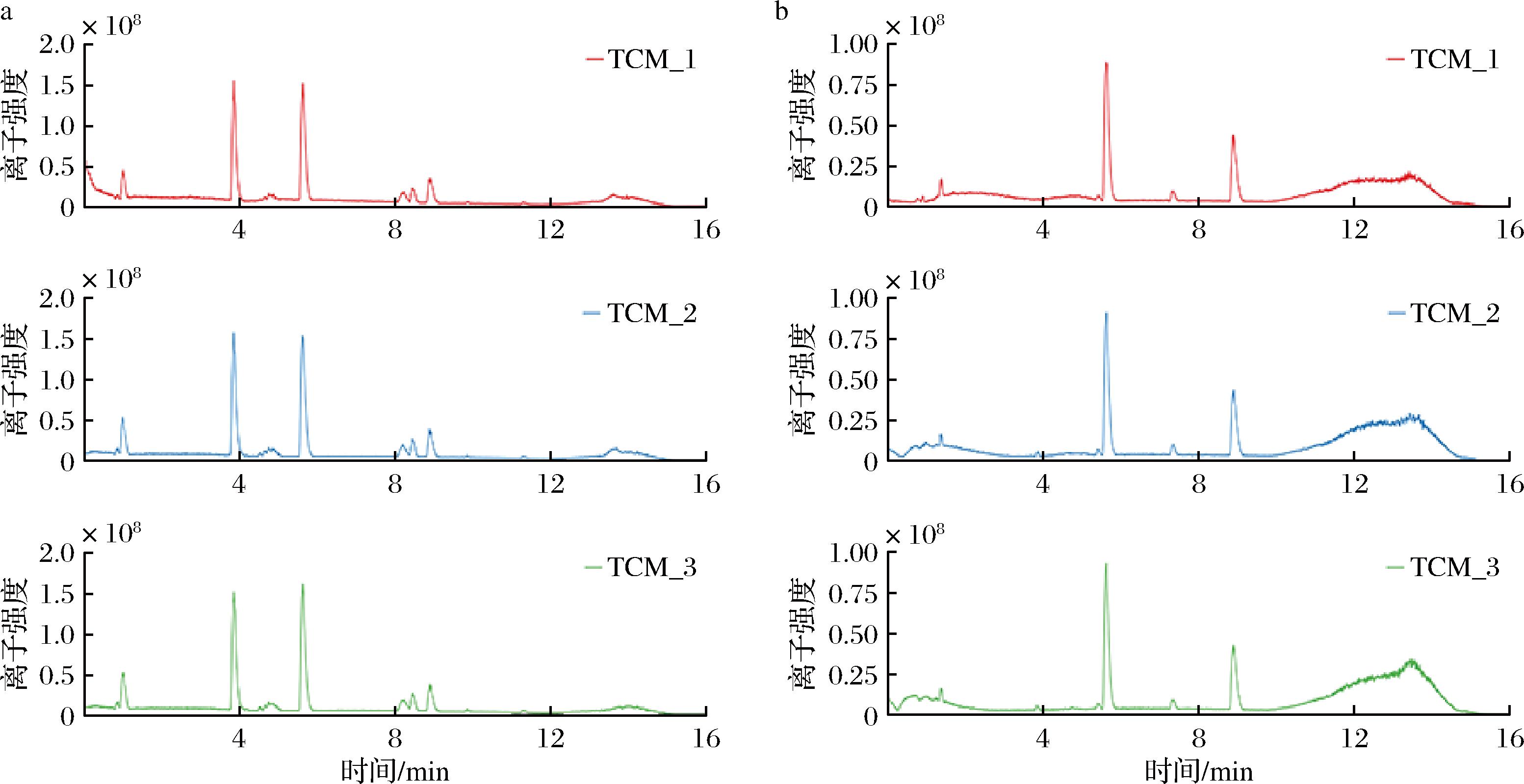
a-正离子模式;b-负离子模式
图1 卡森露剂总离子流图
Fig.1 Total ion current diagram of Kasen distillate
表2 卡森露剂活性成分信息
Table 2 Informations of active ingredients of Kasen distillate

编号活性物质名称分子式保留时间/min质量误差/ppm实测值(m/z)模式二级碎片离子1阿糖胞嘧啶C9H13N3O50.94-2.56244.09POS84.313 8, 107.907 2, 107.966 6, 112.050 8, 113.964 8, 136.843 1, 173.313 1, 198.284 1, 220.904 3, 226.146 72泽泻醇C15H24O11.19-1.13203.18POS153.680 0, 160.124 4, 161.132 0, 175.147 8, 185.136 7, 187.192 8, 203.053 0, 203.106 4, 203.145 4, 203.179 13原花青素B4C30H26O124.080.58577.14NEG425.086 4, 440.889 3, 451.101 9, 464.099 4, 473.947 8, 478.805 8, 508.801 5, 512.562 0, 547.441 7, 577.136 74隐绿原酸C16H18O94.21-0.22353.09NEG262.437 0, 273.837 2, 280.867 6, 284.693 1, 284.843 0, 284.921 0, 295.139 3, 299.707 6, 305.189 9, 353.089 35异绿原酸AC25H24O125.10-0.02515.12NEG343.546 9, 353.040 8, 353.087 1, 378.918 4, 385.694 2, 400.758 2, 514.251 8, 514.327 5, 515.034 1, 515.119 46几夫碱C8H12N2O65.42-4.10277.07NEG212.058 9, 212.995 8, 225.074 0, 233.004 5, 251.183 4, 257.867 8, 276.993 2, 277.009 8, 277.036 5, 277.067 07肌醇C6H12O60.840.45225.06NEG189.868 1, 196.925 2, 209.483 9, 212.876 6, 213.125 5, 215.984 3, 224.801 8, 225.006 0, 225.036 5, 225.060 88L-胱氨酸C6H12N2O4S20.85-2.46241.03POS195.025 6, 199.891 7, 199.999 0, 209.049 3, 209.886 9, 212.115 7, 218.053 8, 223.197 6, 224.004 1, 241.030 29葡萄糖酸C6H12O70.900.08195.05NEG177.040 0, 178.274 9, 184.895 4, 189.337 0, 194.850 6, 194.905 2, 194.929 4, 194.989 2, 195.030 5, 195.050 710吡哆醇C8H11NO30.91-1.26170.08POS146.994 9, 147.945 0, 151.949 6, 152.070 3, 152.106 6, 164.983 9, 169.961 2, 169.977 1, 169.991 4, 170.080 611鼠李糖C6H12O50.96-2.64187.06POS163.940 2, 163.963 7, 164.983 8, 169.047 3, 169.068 3, 169.096 8, 170.117 6, 181.950 2, 187.018 5, 187.057 112腺苷C10H13N5O41.37-3.15268.10POS211.579 3, 232.151 0, 234.250 8, 236.131 6, 245.045 5, 254.258 4, 255.786 2, 265.431 1, 267.882 6, 268.103 113油酰胺C18H35NO12.69-2.47282.28POS212.199 6, 216.027 8, 232.137 3, 247.241 4, 247.653 7, 265.251 2, 274.890 2, 282.136 7, 282.220 7, 282.278 314十二烷二酸C12H22O47.64-0.06229.14NEG209.053 9, 209.533 4, 211.133 6, 211.844 1, 214.738 9, 227.311 5, 228.988 9, 229.011 0, 229.071 6, 229.144 215蒜糖醇C6H14O60.86-2.35205.07POS205.067 816L-(-)-阿拉伯M-糖醇C5H12O50.88-2.81175.06POS139.039 0, 147.044 1, 151.937 5, 157.049 9, 158.001 4, 158.092 3, 169.94 0, 174.953 8, 174.984 5, 175.057 7
续表2
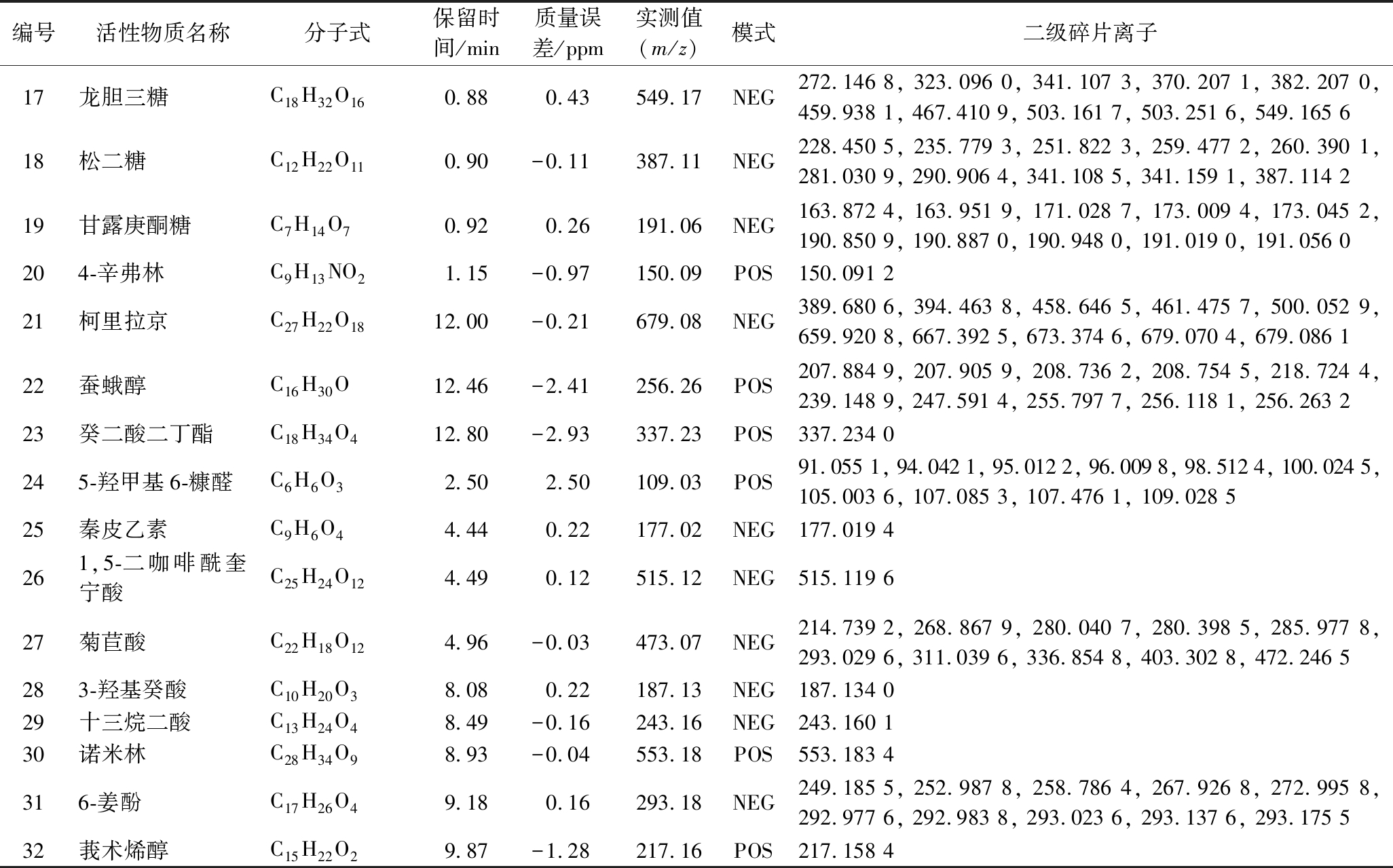
编号活性物质名称分子式保留时间/min质量误差/ppm实测值(m/z)模式二级碎片离子17龙胆三糖C18H32O160.880.43549.17NEG272.146 8, 323.096 0, 341.107 3, 370.207 1, 382.207 0, 459.938 1, 467.410 9, 503.161 7, 503.251 6, 549.165 618松二糖C12H22O110.90-0.11387.11NEG228.450 5, 235.779 3, 251.822 3, 259.477 2, 260.390 1, 281.030 9, 290.906 4, 341.108 5, 341.159 1, 387.114 219甘露庚酮糖C7H14O70.920.26191.06NEG163.872 4, 163.951 9, 171.028 7, 173.009 4, 173.045 2, 190.850 9, 190.887 0, 190.948 0, 191.019 0, 191.056 0204-辛弗林C9H13NO21.15-0.97150.09POS150.091 221柯里拉京C27H22O1812.00-0.21679.08NEG389.680 6, 394.463 8, 458.646 5, 461.475 7, 500.052 9, 659.920 8, 667.392 5, 673.374 6, 679.070 4, 679.086 122蚕蛾醇C16H30O12.46-2.41256.26POS207.884 9, 207.905 9, 208.736 2, 208.754 5, 218.724 4, 239.148 9, 247.591 4, 255.797 7, 256.118 1, 256.263 223癸二酸二丁酯C18H34O412.80-2.93337.23POS337.234 0245-羟甲基6-糠醛C6H6O32.502.50109.03POS91.055 1, 94.042 1, 95.012 2, 96.009 8, 98.512 4, 100.024 5, 105.003 6, 107.085 3, 107.476 1, 109.028 525秦皮乙素C9H6O44.440.22177.02NEG177.019 4261,5-二咖啡酰奎宁酸C25H24O124.490.12515.12NEG515.119 627菊苣酸C22H18O124.96-0.03473.07NEG214.739 2, 268.867 9, 280.040 7, 280.398 5, 285.977 8, 293.029 6, 311.039 6, 336.854 8, 403.302 8, 472.246 5283-羟基癸酸C10H20O38.080.22187.13NEG187.134 029十三烷二酸C13H24O48.49-0.16243.16NEG243.160 130诺米林C28H34O98.93-0.04553.18POS553.183 4316-姜酚C17H26O49.180.16293.18NEG249.185 5, 252.987 8, 258.786 4, 267.926 8, 272.995 8, 292.977 6, 292.983 8, 293.023 6, 293.137 6, 293.175 532莪术烯醇C15H22O29.87-1.28217.16POS217.158 4
2.2 网络药理分析结果
2.2.1 卡森露剂活性成分与NASH疾病共有靶点筛选及构建疾病-药物-化合物-靶点网络结果通过Swiss Target Prediction数据库对32个活性成分进行靶点预测,剔除重复,最终得到840个对应靶点。在GeneCards、DrugBank、OMIM、TCMSP数据库获得NASH疾病相关靶点2 212个。将疾病靶点与活性成分靶点取交集,获得卡森露剂治疗NASH的共有作用靶点181个,绘制的Venn图(图2-a)。将32个活性成分,181个疾病-成分共有靶点通过Cytoscape 3.7.2软件绘制“卡森露剂-靶点”网络关系图,如图2-b所示,按Degree值筛选得到排名前10的主要活性化合物依次为泽泻醇、油酰胺、十三烷二酸、葡萄糖酸、3-羟基癸酸、6-姜酚、蒜糖醇、十二烷二酸、诺米林、异绿原酸A。
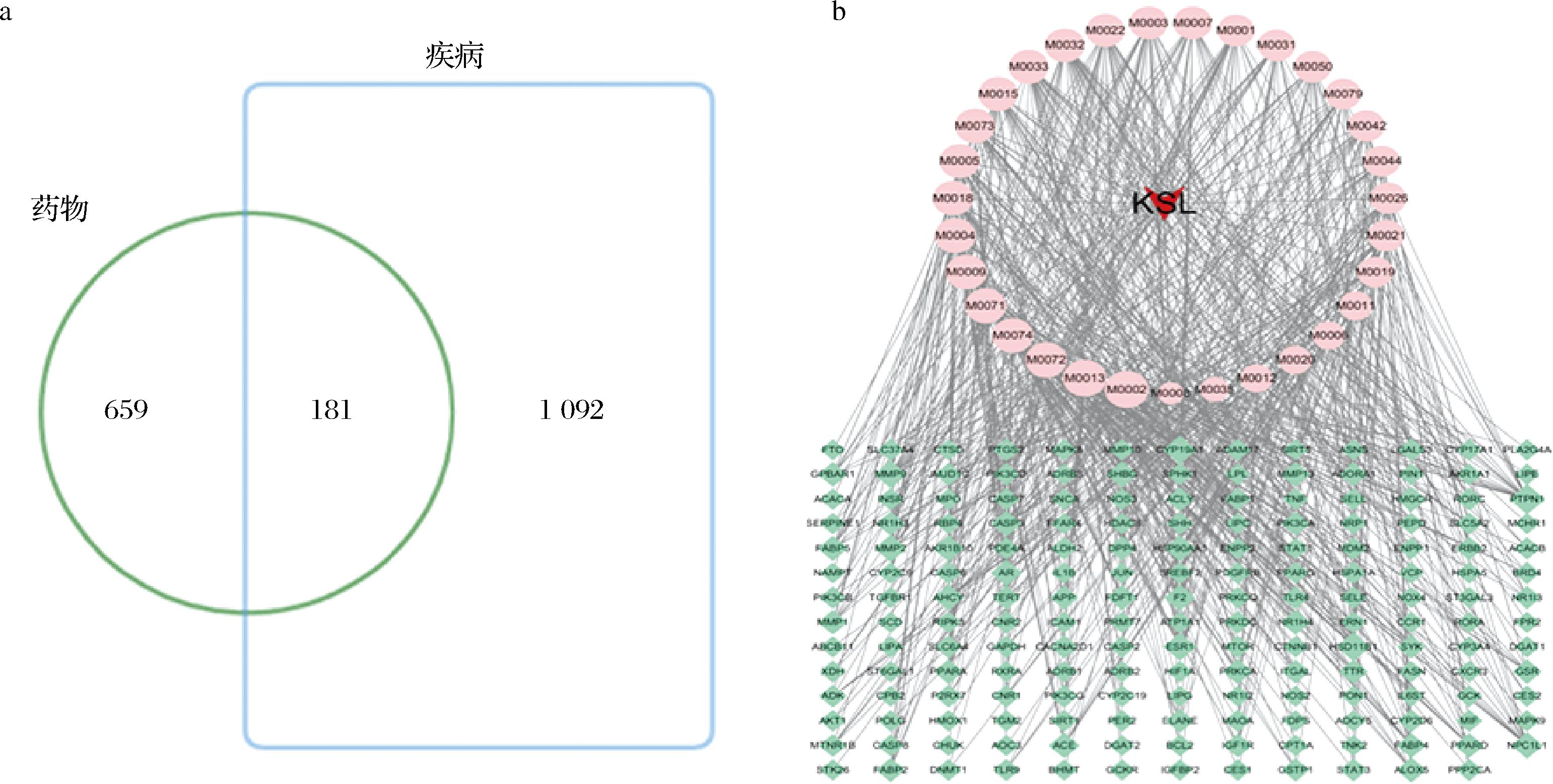
a-卡森露剂活性成分与NASH疾病共有靶点;b-疾病-药物-化合物-靶点网络图
图2 活性成分与NASH共有靶点Venn图及疾病-药物-化合物-靶点网络图
Fig.2 Venn diagram of crossover targets for components with NASH and network diagram of disease-drug-compound-target
2.2.2 PPI网络构建和核心靶点筛选结果
构建PPI网络图(图3-a),共获得181个节点、767条边,将结果导入Cytoscape 3.7.2软件进行分析,根据基因的BC、CC、DC的中位值评分进行2次筛选,最终得到17个核心靶点,按Degree值排名,前10位的潜在核心作用靶点为Akt1、IL-1β、STAT3、GAPDH、Bcl-2、TNF、CTNNB1、PTGS2、CASP3、SIRT1。如图3-b所示,上述靶点在网络分析中处于核心位置,可能为卡森露剂治疗NASH的核心靶点。

a-蛋白质相互作用网络;b-核心靶点网络
图3 蛋白质相互作用与核心靶点网络图
Fig.3 Diagram of protein interaction network and core target network
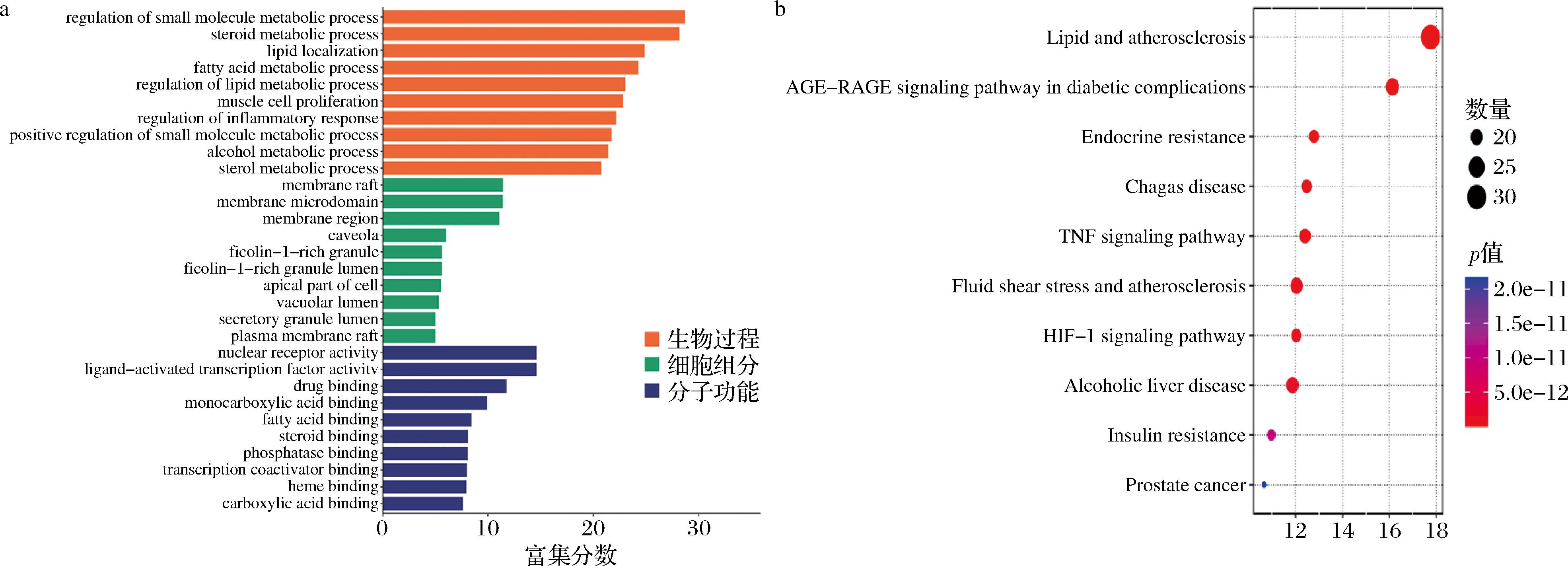
a-GO富集分析;b-KEGG富集
图4 GO富集及KEGG富集分析
Fig.4 GO enrichment analysis barplot and KEGG enrichment analysis bubble dotplot
2.2.3 GO、KEGG功能富集分析结果
对预测的181个NASH潜在治疗靶点进行GO富集分析,选取排名前10的功能绘制条形图,如图4-a所示,生物过程主要涉及到小分子代谢过程的调控、类固醇代谢过程、脂质定位、脂肪酸代谢过程及脂质代谢过程的调节等;细胞组分主要为膜筏、膜微域、膜区、小凹及富含纤胶凝蛋白-1的颗粒管腔等;分子功能主要体现在核受体活性、配体-激活转录因子活性、药物结合、单羧酸结合及脂肪酸结合等。对181个潜在靶点进行KEGG信号通路富集分析,共富集到172条信号通路(P<0.05),富集结果如图4-b所示。排名前5的通路分别为:脂质与动脉粥样硬化(lipid and atherosclerosis)、糖尿病并发症AGE-RAGE信号通路(AGE-RAGE signaling pathway in diabetic complications)、内分泌抵抗(endocrine resistance)、恰加斯氏病(Chagas disease)及TNF信号通路(TNF signaling pathway),可见卡森露剂可以通过多种信号通路对NASH产生影响。
2.3 分子对接实验结果
根据关键成分和核心靶点筛选结果,将关键活性成分(泽泻醇、油酰胺、十三烷二酸)以及核心靶点(Akt1、IL-1β、STAT3)导入Auto Dock Tools软件进行分子对接,分子对接结果如表3所示,结合分数<-5说明小分子与蛋白质之间的结合非常稳定,结果表明泽泻醇与Akt1、IL-1β、STAT3靶点均具有较低结合能,其对接可视化结果如图5所示。
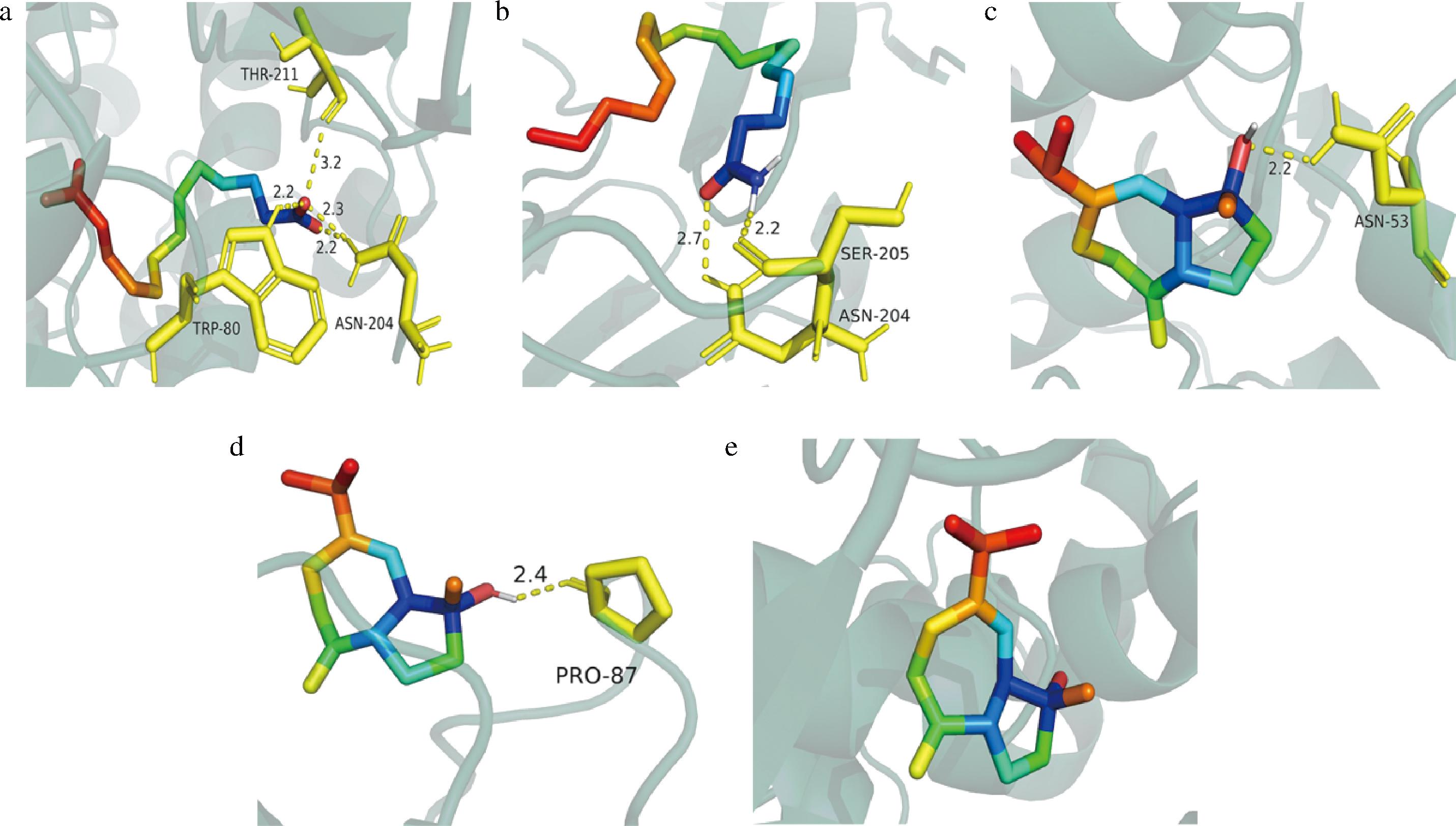
a-十三烷二酸-Akt1;b-油酰胺-Akt1;c-泽泻醇-Akt1;d-泽泻醇-IL-1β;e-泽泻醇-STAT3
图5 关键成分与核心靶点的分子对接可视化图
Fig.5 Visualization of moleculars docking map for key components to core targets
表3 关键成分与核心靶点的分子对接分数
Table 3 Molecular docking scores between key components and core targets
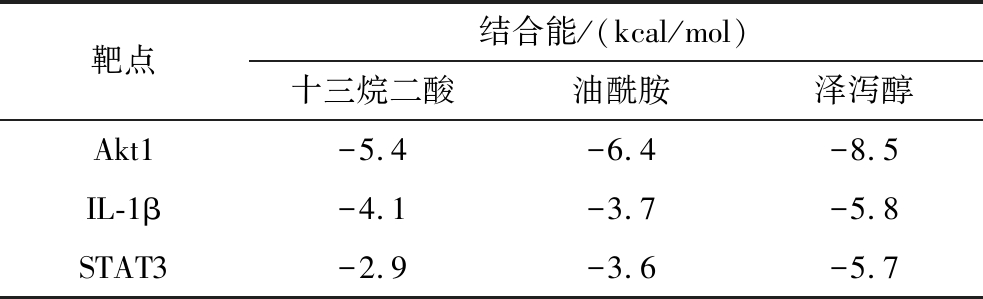
靶点结合能/(kcal/mol)十三烷二酸油酰胺泽泻醇Akt1-5.4-6.4-8.5IL-1β-4.1-3.7-5.8STAT3-2.9-3.6-5.7
2.4 细胞实验结果
2.4.1 CCK-8实验结果
如图6所示,5、10、50、100、200 μg/mL卡森露剂对细胞存活率无显著影响(P>0.05);300 μg/mL卡森露剂处理后细胞存活率下降(P<0.01),因此后续实验选择200 μg/mL作为最高给药剂量。
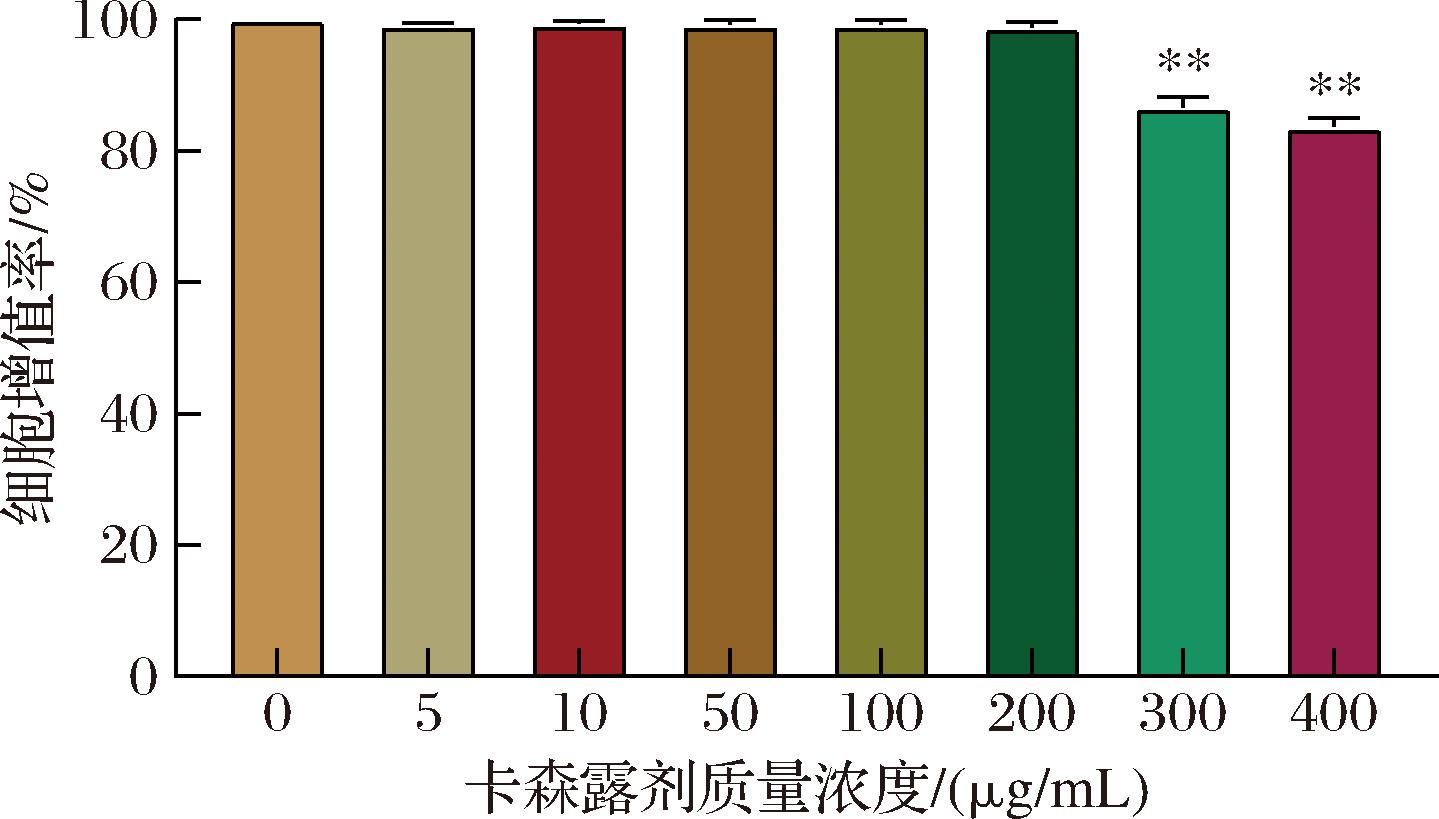
图6 卡森露剂对HepG2细胞存活率的影响
Fig.6 Effect of Kasen distillate on the survival rate of HepG2 cells
注:给药组与空白对照组(0 μg/mL)相比,**P<0.01。
2.4.2 生化实验结果
如图7所示,模型组TG、TC、LDL-C含量升高,HDL-C含量下降,ALT、AST活性显著升高(P<0.05),经非诺贝特(阳性对照组)及不同剂量卡森露剂作用后,细胞TG、TC、LDL-C含量下降,HDL-C含量升高,ALT、AST活性显著下降(P<0.05),说明卡森露剂具有调脂作用并能改善肝脏功能。

a-TG含量;b-TC-含量;c-LDL-C含量;d-HDL-C含量;e-ALT活性;f-AST活性
图7 卡森露剂对HepG2细胞生化指标的影响
Fig.7 Effects of Kasen distillate on biochemical indices of HepG2 cells
注:模型组与空白对照组相比,##P<0.01;实验组与模型组比,*P<0.05,**P<0.01。

a-空白对照组;b-模型组;c-阳性对照组;d-低剂量组;e-中剂量组;f-高剂量组
图8 卡森露剂对HepG2细胞蛋白表达的影响
Fig.8 Effects of Kasen distillate on protein expressions in HepG2 cells
2.4.3 Western Blot检测结果
如图8所示,模型组细胞中p-Akt1/Akt1(磷酸化水平)及Bcl-2蛋白表达水平降低,p-STAT3/STAT3(磷酸化水平)及IL-1β蛋白表达水平升高(P<0.05);与模型组比较,阳性对照组及卡森露剂不同剂量组细胞中p-Akt1/Akt1(磷酸化水平)及Bcl-2蛋白表达水平升高,p-STAT3/STAT3(磷酸化水平)及IL-1β蛋白表达水平降低(P<0.05)。
3 结论与讨论
NASH不仅涉及脂肪变性,还伴随炎症反应及肝细胞损伤[10]。因NASH的高发性及其对公共卫生的重大影响,研发具有防治NASH的药物研究已成为国内外学者关注的焦点。
本研究通过网络药理学分析,筛选出卡森露剂干预NASH的关键成分、核心靶点及作用通路,疾病-药物-化合物-靶点网络图显示,卡森露剂关键活性成分有:泽泻醇、油酰胺、十三烷二酸、葡萄糖酸、3-羟基癸酸、6-姜酚、蒜糖醇、十二烷二酸、诺米林、异绿原酸A等10种。已有研究表明,HepG2高脂细胞模型经过泽泻醇A的处理后,细胞内脂滴的形成呈显著减少趋势,细胞TC与TG含量出现了明显的下降[11]。
根据构建的PPI网络分析可知,Akt1、IL-1β、STAT3、GAPDH、Bcl-2、TNF、CTNNB1、PTGS2、CASP3、SIRT1等是卡森露剂干预NASH的关键靶点。研究表明,Akt1是PI3K/Akt信号通路的核心组件,Akt1的活性变化可能导致胰岛素抵抗、脂肪合成增加和脂肪酸氧化减少,从而加剧肝脏脂肪变性[12]。IL-1β的过度表达可诱导肝脏中的炎症反应,导致肝细胞损伤和纤维化[13]。信号转导和转录激活因子3(signal transducers and activators of transcription,STAT3)的激活可调控多个与糖脂代谢和炎症相关的基因表达,通过抑制STAT3的活性或表达,可以改善NASH患者的代谢状况并减轻炎症反应[14]。B细胞淋巴瘤-2蛋白(B-cell lymphoma-2,Bcl-2)是一种重要的抗凋亡蛋白,通过上调Bcl-2的表达或活性,可以抑制肝细胞的凋亡,从而减轻NASH患者的肝损伤[15]。分子对接结果表明卡森露剂关键活性成分泽泻醇、油酰胺、十三烷二酸与核心靶点Akt1、IL-1β、STAT3之间有良好的对接活性,提示这些靶点在卡森露剂改善NASH的过程中发挥着重要作用。
GO和KEGG通路富集分析结果表明,卡森露剂干预NASH的机制主要涉及脂质与动脉粥样硬化、糖尿病并发症AGE-RAGE信号通路、内分泌抵抗及TNF信号通路。NASH是动脉粥样硬化的诱发因素,对脂质与动脉粥样硬化通路的调控可以有效改善NASH引起的继发性疾病[16]。在糖尿病状态下,高血糖直接导致AGEs的形成增加,AGEs与RAGE的结合进一步加剧了机体的氧化应激和炎症反应[17]。在NASH患者中,内分泌抵抗,特别是胰岛素抵抗不仅会导致脂质代谢紊乱,还可能通过促进氧化应激和炎症反应加剧肝脏损伤[18]。在NASH患者TNF水平通常显著升高,TNF可能通过激活NF-κB等信号通路促进炎症反应并影响胰岛素信号传导和脂质代谢来加重NASH的病理改变[19]。
基于网络药理学预测结果,本研究开展了体外细胞验证实验,实验结果表明卡森露剂可以降低细胞内TG、TC、LDL-C水平及ALT、AST活性并升高HDL-C含量,可以升高p-Akt1/Akt1(磷酸化水平)及Bcl-2蛋白表达水平并降低p-STAT3/STAT3(磷酸化水平)及IL-1β蛋白表达水平(P<0.05),卡森露剂可能通过调控炎症通路抑制NASH的发生。
综上,本研究基于UPLC-MS对卡森露剂进行成分鉴定,并通过网络药理学及分子对接实验分析了卡森露剂干预NASH的作用机制,结合体外细胞验证实验,初步确证了卡森露剂通过调控炎症通路来改善NASH,系统阐述了卡森露剂具有多成分、多靶点的特点,为卡森露剂的深入研究提供了基础。
[1] 李凤, 李茂微, 王雨杉.非酒精性脂肪肝病的治疗模式和潜在疗法[J].临床肝胆病杂志, 2024, 40(10):2082-2086.LI F, LI M W, WANG Y S.Therapeutic paradigms and potential therapies for nonalcoholic steatohepatitis[J].Journal of Clinical Hepatology, 2024, 40(10):2082-2086.
[2] QU H D, ZHANG D, LIU J L, et al.Therapeutic targeting of PKM2 ameliorates NASH fibrosis progression in a macrophage-specific and liver-specific manner[J].Engineering, 2024, 41:189-203.
[3] 孙召珲, 杨臻峥, 郑晓南.非酒精性脂肪性肝病的靶点发现与药物研发进展[J].中国新药杂志, 2023, 32(23):2394-2402.SUN Z H, YANG Z Z, ZHENG X N.Progress in target discovery and drug development for non-alcohol fatty liver disease[J].Chinese Journal of New Drugs, 2023, 32(23):2394-2402.
[4] 凡杭, 陈剑, 梁呈元, 等.菊苣化学成分及其药理作用研究进展[J].中草药, 2016, 47(4):680-688.FAN H, CHEN J, LIANG C Y, et al.Advance in studies on chemical constituents of Cichorii Herba and their pharmacological effects[J].Chinese Traditional and Herbal Drugs, 2016, 47(4):680-688.
[5] 祁淑雯, 仲烨伟, 阿达来提·阿布都热西提, 等.基于靶向代谢组学技术研究毛菊苣对肥胖小鼠粪便胆汁酸谱的影响[J].中国实验动物学报, 2024, 32(9):1122-1138.QI S W, ZHONG Y W, ADALAITI A, et al.Effect of Cichorium glandulosum Boiss.et Huet.on fecal bile acid profile in obese mice based on targeted metabolomics technique[J].Acta Laboratorium Animalis Scientia Sinica, 2024, 32(9):1122-1138.
[6] 苏林洁, 吕博, 马斌, 等.毛菊苣正丁醇萃取物中母菊素含量测定及其对大鼠肝纤维化保护作用[J].中国药理学通报, 2023, 39(9):1731-1739.SU L J, LYU B, MA B, et al.Determination of content of matricin extracted from Cichorium glandulosum Boiss et Huet with n-butanol and its protective effect on hepatic fibrosis in rats[J].Chinese Pharmacological Bulletin, 2023, 39(9):1731-1739.
[7] 段贤春, 黄石, 彭代银, 等.网络药理学在中药复方研究中的应用[J].中国药理学通报, 2020, 36(3):303-308.DUAN X C, HUANG S, PENG D Y, et al.Application of network pharmacology in the study of traditional Chinese medicine formula[J].Chinese Pharmacological Bulletin, 2020, 36(3):303-308.
[8] 马嘉慕, 董英, 魏静, 等.基于网络药理学与分子对接技术的保健食品白及五味子颗粒保胃护肝作用机制和功效成分含量测定研究[J].食品与发酵工业, 2023, 49(11):131-139.MA J M, DONG Y, WEI J, et al.Study on gastric mucosa protection mechanism and content of functional component in Baji Wuweizi Granule based on network pharmacology and molecular docking[J].Food and Fermentation Industries, 2023, 49(11):131-139.
[9] 孙智珺, 叶阳梅, 王光新.白芍总苷体外抗非酒精性脂肪肝的作用机制研究[J].世界科学技术-中医药现代化, 2022, 24(7):2748-2754.SUN Z J, YE Y M, WANG G X.Study on the action mechanism of total glycosides of peony against non-alcoholic fatty liver in vitro[J].Modernization of Traditional Chinese Medicine and Materia Medica-World Science and Technology, 2022, 24(7):2748-2754.
[10] 李开楊, 郭震凡, 田新材, 等.祛脂愈肝汤对非酒精性脂肪性肝炎细胞脂质代谢及IL-17表达的影响[J].时珍国医国药, 2025, 36(10):1801-1806.LI K Y, GUO Z F, TIAN X C, et al.Effect of Quzhi Yugan Decoction on lipid metabolism and IL-17 expression in non-alcoholic steatohepatitis cells[J].Journal of Li-Shizhen Traditional Chinese Medicine, 2025, 36(10):1801-1806.
[11] 颜伟泓, 张鸿燕, 李玲燕, 等.泽泻醇A对HepG2细胞脂质沉积的影响及其降脂活性研究[J].上海中医药杂志, 2024, 58(10):63-70.YAN W H, ZHANG H Y, LI L Y, et al.Effect of alisol A on lipid deposition in HepG2 cells and its hypolipidemic activity research[J].Shanghai Journal of Traditional Chinese Medicine, 2024, 58(10):63-70.
[12] 张丽慧, 刘素彤, 张文娟, 等.基于ADPN/PI3K/AKT信号通路探讨化痰祛湿活血方改善非酒精性脂肪性肝炎大鼠炎症损伤的机制[J].中华中医药杂志, 2021, 36(10):5832-5837.ZHANG L H, LIU S T, ZHANG W J, et al.Mechanism of Huatan Qushi Huoxue Formula in improving the inflammatory injury of rats with nonalcoholic steatohepatitis based on ADPN/PI3K/AKT signal pathway[J].China Journal of Traditional Chinese Medicine and Pharmacy, 2021, 36(10):5832-5837.
[13] 尚东方, 赵文霞, 赵晨露, 等.基于NLRP3/Caspase-1/GSDMD焦亡通路探讨涤浊化瘀方对非酒精性脂肪性肝炎小鼠的影响[J].中华中医药杂志, 2024, 39(11):6061-6065.SHANG D F, ZHAO W X, ZHAO C L, et al.Mechanism of Dizhuo Huayu Decoction on nonalcoholic steatohepatitis mouse based on NLRP3/Caspase-1/GSDMD pyroptosis pathway[J].China Journal of Traditional Chinese Medicine and Pharmacy, 2024, 39(11):6061-6065.
[14] 祝娟娟, 程明亮, 赵雪珂, 等.蓝莓联合益生菌通过IL-22调控的JAK1/STAT3/BAX通路改善非酒精性脂肪性肝病的作用机制[J].临床肝胆病杂志, 2018, 34(9):1936-1944.ZHU J J, CHENG M L, ZHAO X K, et al.Mechanism of action of blueberry combined with probiotics in improving nonalcoholic fatty liver disease by affecting the JAK1/STAT3/BAX signaling pathway regulated by interleukin-22[J].Journal of Clinical Hepatology, 2018, 34(9):1936-1944.
[15] 徐文轩, 宋汶轩, 喇孝瑾, 等.脂肝清方对NAFLD小鼠肝损伤及肝细胞凋亡的影响[J].中成药, 2023, 45(11):3583-3591.XU W X, SONG W X, LA X J, et al.Effects of Zhiganqing Formula on liver injury and hepatocyte apoptosis in NAFLD mice[J].Chinese Traditional Patent Medicine, 2023, 45(11):3583-3591.
[16] 李越, 吴希泽, 潘嘉祥, 等.肝细胞脂肪变性影响巨噬细胞炎症反应加速动脉粥样硬化形成[J].浙江大学学报(医学版), 2023, 52(6):751-765.LI Y, WU X Z, PAN J X, et al.Hepatocyte steatosis activates macrophage inflammatory response accelerating atherosclerosis development[J].Journal of Zhejiang University (Medical Sciences), 2023, 52(6):751-765.
[17] 杨君茹, 何玲玲, 高美欣, 等.糖基化修饰在代谢相关脂肪性肝病中作用研究进展[J].中国肝脏病杂志(电子版), 2022, 14(4):20-27.YANG J R, HE L L, GAO M X, et al.Progress on glycosylation in metabolic dysfunction-associated fatty liver disease[J].Chinese Journal of Liver Diseases (Electronic Version), 2022, 14(4):20-27.
[18] 田晓玲, 蒋佳佳, 张彧, 等.中药多糖防治非酒精性脂肪性肝病作用机制研究进展[J].中草药, 2024, 55(17):6016-6025.TIAN X L, JIANG J J, ZHANG Y, et al.Research progress on mechanism of traditional Chinese medicine polysaccharide in prevention and treatment of non-alcoholic fatty liver disease[J].Chinese Traditional and Herbal Drugs, 2024, 55(17):6016-6025.
[19] 单杉, 陈婷婷, 李南, 等.两种非酒精性脂肪性肝病小鼠模型的比较[J].中国药理学通报, 2022, 38(3):470-476.SHAN S, CHEN T T, LI N, et al.Comparison of two methods for establishing non-alcoholic fatty liver disease model in mice[J].Chinese Pharmacological Bulletin, 2022, 38(3):470-476.