屎肠球菌(Enterococcus faecium)属乳酸菌,多源于人和动物肠道,是革兰氏阳性球菌,无芽孢、无鞭毛,呈单球或双球链状分布[1],可分泌有益产物,具有广谱抑菌性,可以抑制病原菌大量繁殖[2]。屎肠球菌是肠道内常见菌种,有多种益生功能,也常在饲料生产中用作发酵剂,早在2013年就已经成为《饲料添加剂品种目录》中的益生菌之一[3-4],还曾用于干酪中延长保质期[5],也可添加到其他产品中调节肠道菌群[6]。屎肠球菌是一种抗逆性较强的乳酸菌,在胃肠道的恶劣环境中也能有较高的存活率,不仅在饲料使用中能提高仔猪的免疫力和生长性能,还能减轻仔猪肝和肠道的损伤,对哺乳动物及家禽养殖方面有重要意义[7-9]。
为了更好地研究屎肠球菌的利用价值,通常将屎肠球菌分为致病菌类和益生菌类。屎肠球菌曾被有些国家禁止使用,但其本身的益生作用却不可忽视[10],屎肠球菌产自肠道,是肠道的天然共生体,可以代替一些抗生素来改善肠道内引起食源性疾病的菌株,如沙门氏菌、大肠杆菌等[11]。此外肠球菌分泌胆汁水解酶能耐受胆盐环境生存,这一特性已被应用于血液中降低固醇水平,对医疗等行业具有重要贡献[12-14]。
本研究从自然发酵的虾酱中筛选出一株产酸能力较好的屎肠球菌,并对其生长特性、体外益生功能和安全性等方面进行研究,旨在为其在食品或饲料中的应用开发提供参考依据。
1 材料与方法
1.1 材料与试剂
指示菌:埃希氏大肠杆菌、金黄色葡萄球菌、单增李斯特菌和沙门氏菌均为本实验室保藏。
试剂:胰蛋白酶、胃蛋白酶,上海麦克林生化科技股份有限公司;牛胆酸钠,北京瑞达恒辉科技有限公司;CaCO3,国药集团化学试剂有限公司;DPPH、DNA提取试剂盒、总抗氧化试剂盒、维生素C,北京索莱宝科技有限公司;组氨酸,上海源叶生物科技有限公司。
培养基:LB培养基、血琼脂培养基,青岛海博科技有限公司;TSB液体培养基、MRS固体培养基、MRS液体培养基,奥博星生物技术有限公司。
1.2 仪器与设备
YRH-100电热恒温培养箱、SW-CJ-2F超净工作台,苏州净化科技有限公司;TGL-16M高速冷冻离心机,湖南湘仪科技有限公司;STARK酶标,美国安捷伦科技有限公司;UV-1800PC-DS2紫外分光光度计,上海美普达仪器有限公司;LDZM-40KCS高压蒸汽灭菌锅,上海申安医疗器械有限公司;FE-28 pH计,梅特勒托利多科技(中国)有限公司;IX53光学显微镜,奥林巴斯(北京)科技有限公司。
1.3 实验方法
1.3.1 产酸菌分离纯化
将新鲜的小龙虾用破壁机搅碎至糊状,室温下自然发酵30 d,分别取3、6、9、12、15、18、24、30 d的样品稀释涂布于LB培养基,37 ℃培养24 h,将不同形态的菌落点接于添加质量分数2% CaCO3的MRS固体培养基,选取有钙溶圈的菌落进行划线纯化[15]。
将平板纯化4次以上的菌放入TSB液体培养基中扩大培养,18 h后接种到MRS液体培养基,置于摇床培养箱于180 r/min、37 ℃条件培养24 h备用[16-17]。
1.3.2 菌株鉴定
1.3.2.1 生理生化指标检测
将分离纯化后的菌株进行革兰氏镜检、H2O2还原试验、甲基红试验、淀粉酶试验、H2S试验、硝酸盐还原试验、V-P试验,根据结果进行初步鉴定。
1.3.2.2 16S rDNA序列分析
用DNA提取试剂盒提取总DNA,选取通用引物27 F(5’AGAGTTTGATCCTGGCTCAG-3’)和1492 R(5’-GGTTCACTTGTTACGACTT-3’)[18]进行PCR基因片段扩增,测序交由上海生工科技有限公司完成,测序结果在NCBI官网进行比对,用MEGA 11.0软件将原序列与数据库序列比对确定菌株类型,并绘制发育树。
1.3.3 生长曲线的测定
将活化好的菌株按2%的接种量接入TSB液体培养基中,每4 h测定OD600的值,绘制生长曲线。
1.3.4 产酸能力测定
取活化好的菌株先接入TSB液体培养基扩大培养24 h,再按2%的接种量接入MRS液体培养基中,每4 h测定一次pH,记录并绘制曲线。总产酸能力采用标准氢氧化钠滴定法[19],取1 mL菌液,加入9 mL蒸馏水,以1%的酚酞为指示剂,滴定至溶液刚好变为红色且30 s内不褪色,每4 h滴定一次,测定48 h,总酸质量浓度(g/L)的计算如公式(1)所述:
X=C×(V1-V2)×K×10×1 000
(1)
式中:C,NaOH标准溶液浓度,mol/L;V1,消耗的NaOH标液的体积,mL;V2,空白实验消耗的标准NaOH的体积,mL;K,换算系数0.090。
1.3.5 抗菌活性测定
采用牛津杯法[20]测定发酵上清液对金黄色葡萄球菌、单增李斯特菌、埃希氏大肠杆菌、沙门氏菌的抑菌能力,调节指示菌数目始终保持106 CFU/mL,测定培养24 h后的抑菌圈直径。
1.3.6 抗氧化能力测定
DPPH自由基清除率测定:配制0.2 mmol/L DPPH避光保存,将活化好的菌液4 ℃、4 000 r/min离心10 min,取50 μL上清液与150 μL DPPH于96孔板中混合,暗处反应30 min,517 nm检测吸光度(A1),用无水乙醇做空白对照(A0),用1 mmol/L维生素C溶液代替样品做阳性对照(A2),所有样品测定3次,DPPH自由基清除率[21]的计算如公式(2)所述:
DPPPH自由基清除率![]()
(2)
总抗氧化能力测定:根据试剂盒说明书进行操作。
1.3.7 耐酸、耐胆碱试验
耐酸试验参考Ronaldo等[22]的方法略作修改,取10 mL培养24 h的菌液并离心,收集菌体,将菌重悬到10 mL PBS(0.1%质量分数)中,调节溶液pH值分别为2.0、2.5和3.0,以pH值为7.2的PBS做对照,静置3 h后将溶液涂布于培养基中倒置培养24 h计算菌落总数,存活率的计算如公式(3)所述:
耐胆盐试验参考YOUNUS等[23]的方法略作修改,将含有质量分数为0.1%、0.2%、0.3%的牛胆酸盐溶液的MRS培养基中接种108CFU/mL的菌液,未添加的培养基做对照,静置3 h后将溶液涂布于培养基中倒置培养24 h计算菌落总数,存活率的计算如公式(3)所述:
菌株存活率![]()
(3)
式中:N1,用酸或胆酸盐处理后的活菌数,CFU/mL;N0,空白对照的活菌数,CFU/mL。
1.3.8 模拟胃肠液消化试验
参考罗强等[24]的方法进行。模拟胃液:取1 mol/L HCl溶液16.4 mL于800 mL蒸馏水中,加入10 g胃蛋白酶,摇匀后定容至1 000 mL,调节模拟胃液pH值为2.0,过0.22 μm滤膜备用;模拟肠液:取6.8 g KH2PO4于500 mL蒸馏水中,用NaOH溶液调节pH值为6.8,另取10 g胰蛋白酶加水溶解,两者混合后定容至1 000 mL,过0.22 μm滤膜备用。取活化好的菌液5 mL 6 000 r/min离心10 min,沉淀物用等量的模拟胃、肠液悬浮,37 ℃静置3 h(肠液4 h),用平板涂布法计数,计算菌体存活率。
1.3.9 安全性试验
生物胺检测试验:在MRS培养基中加入质量分数1%的组氨酸,将活化好的菌接种在此培养基上,37 ℃培养48 h,与大肠杆菌做对照,观察颜色变化,如果培养基变成紫红色,则可判定有组胺生成[25]。
溶血性试验:取活化好的菌液在哥伦比亚血平板上划线培养48 h,以金黄色葡萄球菌作为阳性对照,观察是否有溶血圈出现。
明胶液化试验:取活化好的菌穿刺接种于明胶液化生化管内,置于20 ℃下恒温培养7~14 d,观察是否有液化现象产生。
1.3.10 统计分析
采用EXCEL进行数据处理,Origin 2019 进行相关性和回归绘图分析。
2 结果与分析
2.1 产酸菌分离纯化
采用含有CaCO3的MRS培养基从龙虾头发酵酱中分离到8株有产酸能力的菌株,各菌株均呈单个或双球分布,形态无明显差异,革兰氏镜检均为阳性,分别命名为LX5-7、LX5-8、LX5-9、LX9-3、LX9-6、LX12-2、LX18-9和LX22-1,其中菌株LX18-9的产透明圈情况及革兰氏染色结果见图1。
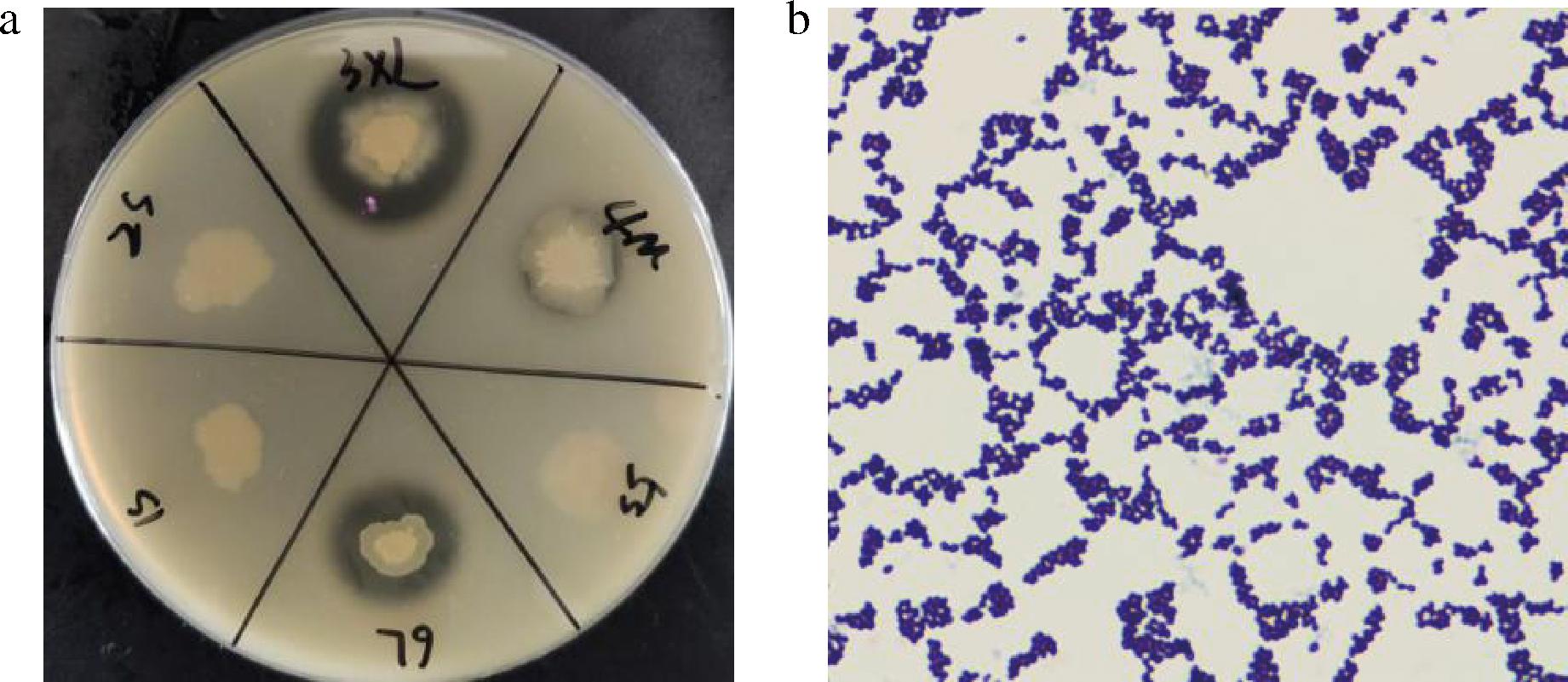
a-产酸菌产透明圈情况;b-革兰氏染色图
图1 外观及镜检图
Fig.1 Appearance and microscopic inspection drawing
2.2 菌株鉴定结果
2.2.1 生理生化鉴定
通过甲基红试验、淀粉水解、产H2S、明胶液化、葡萄糖产酸、接触酶等生理生化实验对分离出的8株菌进行初步鉴定。如表1所示,对照《伯杰氏系统细菌学手册》和《乳酸菌细菌分类鉴定及试验方法》[26]初步判断除LX22-1外的其余7株菌为乳酸菌。
表1 生理生化鉴定结果
Table 1 Physiological and biochemical identification results

编号H2O2甲基红淀粉酶H2S试验明胶液化V-P试验革兰氏染色形状LX5-7-+---++球形LX5-8-+---++球形LX5-9-+---++球形LX9-3-+---++球形LX9-6-+---++球形LX12-2-+---++球形LX18-9-+---++球形LX22-1++--+++球形
注:表中“+”表示阳性,“-”表示阴性。
2.2.2 16S rDNA序列分析结果
提取7株乳酸菌的DNA并进行PCR扩增,扩增产物的琼脂糖凝胶电泳结果见图2。
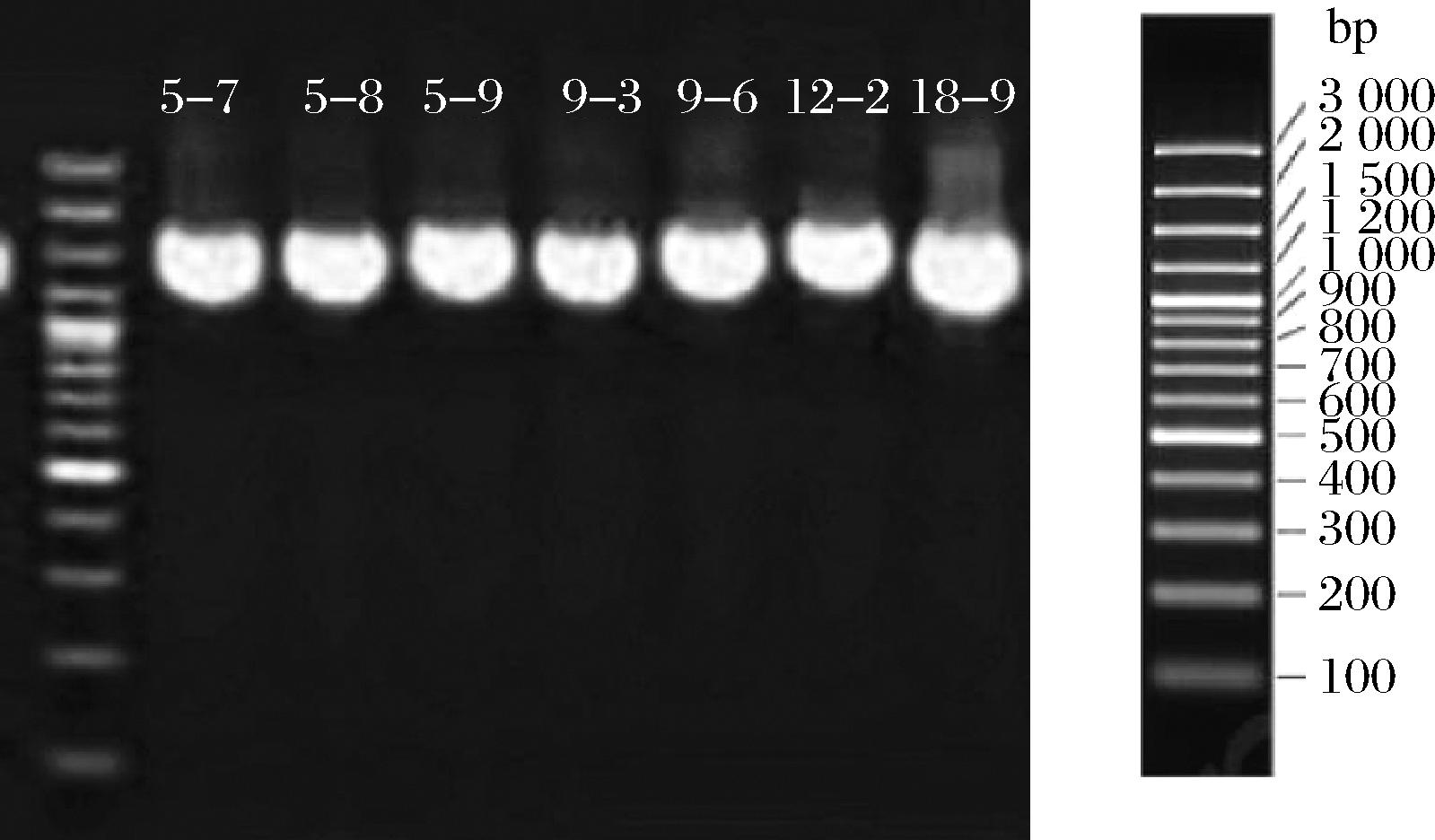
图2 琼脂糖凝胶电泳结果
Fig.2 Results of agarose gel electrophoresis
由图2可知,7株菌PCR扩增产物大小约为1 500 bp,符合细菌16S rDNA片段的大小。将16S rDNA基因序列结果在NCBI数据库进行BLAST比对,用MEGA 11软件采用邻近法绘制发育树,结果如图3所示。其中菌株LX5-7、LX5-8、LX5-9、LX9-3和LX9-6与粪肠球菌的相似度达100%,菌株LX12-2和LX18-9与屎肠球菌的相似性达100%。因此,鉴定7株菌隶属于肠球菌属,LX5-7、LX5-8、LX5-9、LX9-3和LX9-6为粪肠球菌,LX12-2和LX18-9为屎肠球菌。

图3 基于16S rDNA基因测序的邻接进化树位置
Fig.3 Location of adjacent evolutionary trees based on 16S rDNA gene sequencing
2.3 菌株生长曲线测定结果
对上述7株乳酸菌在MRS液体培养基中培养60 h内的生长曲线进行测定。如图4所示,4 h后各菌株开始快速生长,4~12 h内呈指数型增长,此时活菌数不断增加;12 h后大多数菌开始进入生长稳定期,但菌落总数仍在增大,此时培养基中菌株代谢产物增加,营养物质竞争激烈,待底物消耗殆尽后会进入衰亡期。
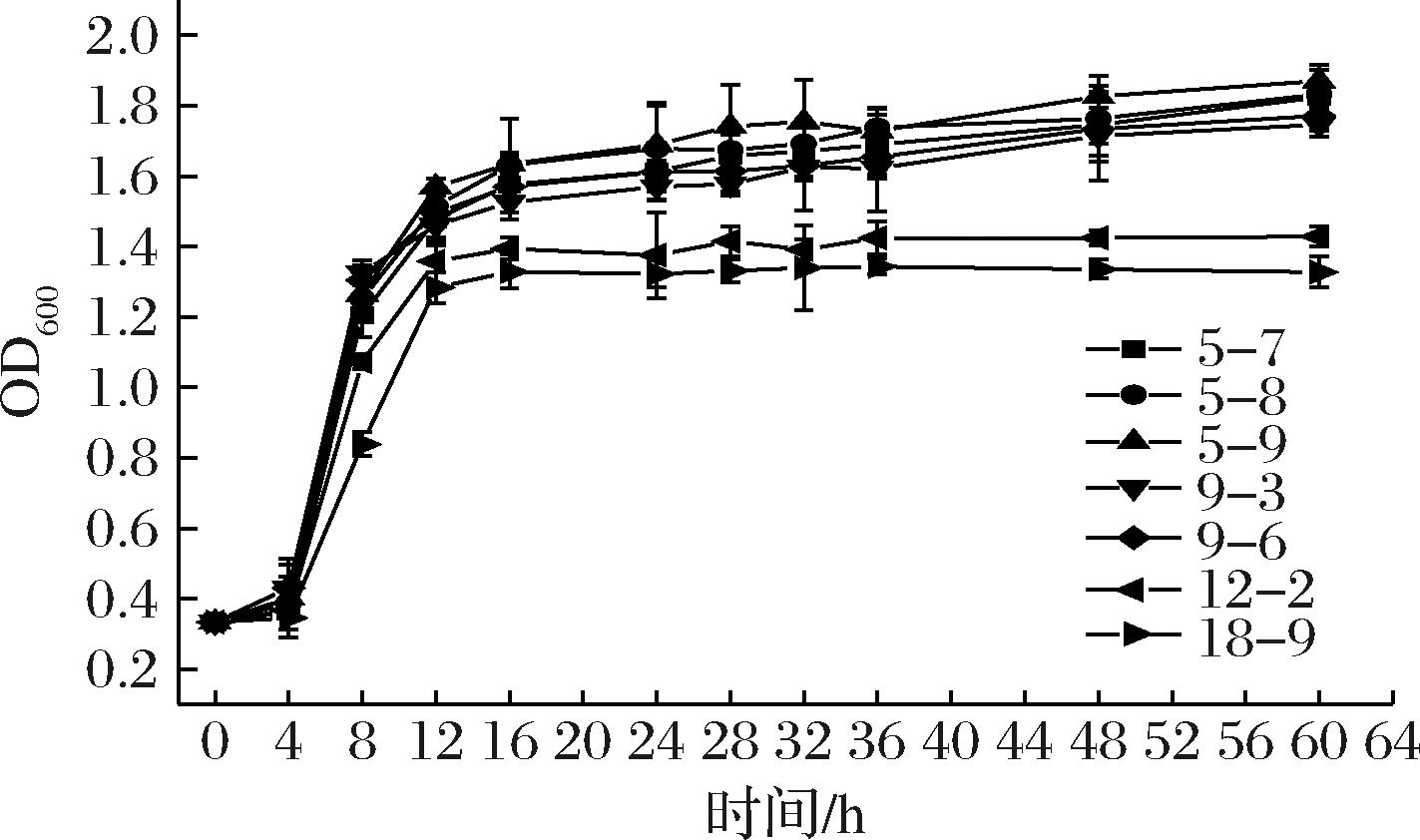
图4 各产酸菌生长曲线
Fig.4 Growth curves of each acid-producing bacteria
2.4 菌株总酸产生量测定结果
采用NaOH滴定法测定的各菌株产酸能力以及培养基内pH值变化如图5所示,总酸产生量随时间呈上升趋势,pH呈下降趋势,16 h内产酸能力迅速升高,平均在0.7 g/L左右,16 h后产酸速度平缓,菌株LX12-2和LX18-9在发酵48 h后产酸能力最高,分别为1.12 g/L和1.17 g/L;对比各株菌培养基内pH变化,考虑到生长后期活菌数太多导致营养物质不足或产生的有害代谢物干扰酸的生成,所有菌株生长末期培养基内的pH值趋于平缓,基本稳定在4.5左右,其中LX18-9和LX12-2的pH值最低,达到4.25和4.22,具有很强的产酸能力。
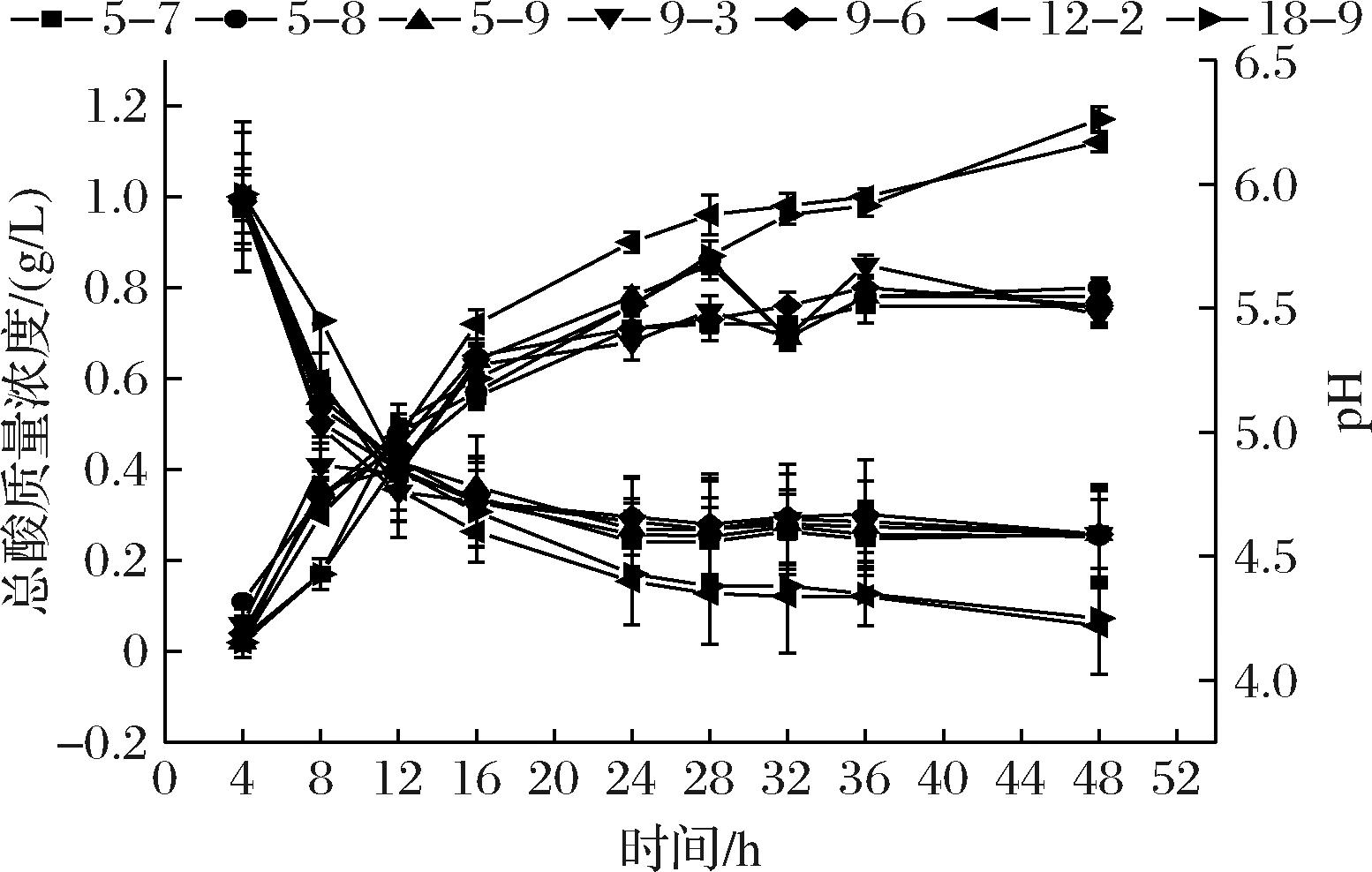
图5 各菌株培养基pH和总酸产生量变化
Fig.5 pH of medium for each strain
2.5 体外益生活性
采用牛津杯法检测屎肠球菌LX12-2和LX18-9的抑菌能力。由表2可知,2株菌的发酵上清液对指示菌埃希氏大肠杆菌、金黄色葡萄球菌、单增李斯特菌和沙门氏菌具有不同程度的抑菌效果,尤其对单增李斯特菌的增长抑制率最突出,其中LX18-9菌株对单增李斯特菌的抑菌圈直径达(20.85±0.61) mm,显著高于对其余3种指示菌的抑菌圈直径(P<0.05),可能由于屎肠球菌在发酵过程中产生了有益细菌素,与前人报道的结果一致,特别对革兰氏阳性菌的抑制作用显著[27]。
表2 屎肠球菌上清液抑菌活性
Table 2 Bacteriostatic activity of E. faecus supernatant

致病菌24 h抑菌圈直径/mmLX12-2LX18-9埃希氏大肠杆菌15.49±1.08b17.95±1.17b金黄色葡萄球菌12.81±1.20c14.57±0.61c单增李斯特菌18.18±0.97a20.85±0.61a沙门氏菌10.06±0.82d12.06±0.87d
注:同列肩标字母表示差异显著,P<0.05(下同)。
2.6 抗氧化能力测定结果
机体代谢通常伴随着氧化过程的发生,在这期间产生的活性氧自由基可以对细胞膜、蛋白质、核酸等生物大分子造成氧化损伤,从而导致人体细胞的生理机能受损,严重影响到生命健康[28]。通过考察菌体上清液对DPPH自由基的清除率和Fe3+还原能力来评价菌株LX12-2和LX18-9的抗氧化活性,如表3所示,2株菌菌具有一定的自由基清除活力。其中LX18-9菌株的DPPH自由基清除率和Fe3+还原能力显著高于LX12-2菌株(P<0.05),具有更高的抗氧化能力。由于微生物发酵产生的代谢产物具有比化学合成抗氧化剂更高的安全系数,因此LX18-9菌株具有成为良好抗氧化剂生产原料的潜力。
表3 屎肠球菌上清液抗氧化能力
Table 3 Antioxidant capacity of E. faecus supernatant

编号DPPH自由基清除率/%Fe3+还原能力/(mmol/mL)LX12-265.43±2.04a0.51±0.005aLX18-976.77±3.28b0.72±0.009b
2.7 耐酸耐胆盐试验
乳酸菌能否到达肠道且能否耐受胃液中的环境对其发挥益生功能至关重要。考察菌株LX12-2和LX18-9在pH 2.0、2.5和3.0环境下的存活情况,由表4可见,随着pH值升高2株菌存活率明显提高,在pH 2.0时,存活率仍能达到85%左右,表明两株菌具有很高的耐胃酸能力。
表4 菌株耐酸能力
Table 4 Acid resistance of strains
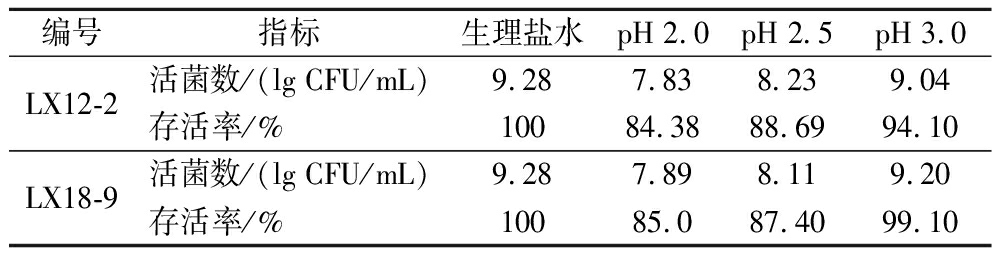
编号指标生理盐水pH 2.0pH 2.5pH 3.0LX12-2活菌数/(lg CFU/mL)9.287.838.239.04存活率/%10084.3888.6994.10LX18-9活菌数/(lg CFU/mL)9.287.898.119.20存活率/%10085.087.4099.10
胆盐耐受性是乳酸菌在胃肠环境中发挥正常功能的重要标志之一,在肠道防御机制中起主导作用。据报道,当胆盐质量分数为0.3%时会抑制微生物生长,但屎肠球菌大多能耐受0.1%~0.3%的胆盐溶液[29]。测定0.1%~0.3%质量分数梯度下菌株LX12-2和LX18-9的存活率情况,由表5所示,随着胆盐质量分数增高,菌落总数不断下降,可能由于胆盐质量分数过高,通过胆盐的清洁能力腐蚀细菌表面蛋白,破坏细胞结构,造成细菌计数减少。当胆盐质量分数为0.3%时菌株LX12-2和LX18-9在培养3 h后,存活率分别为88.90%和91.00%,表明2株菌具有良好的耐胆盐能力,其中菌株LX18-9的耐胆盐的能力更强。
表5 菌株耐胆盐能力
Table 5 Bacterial bile salt tolerance
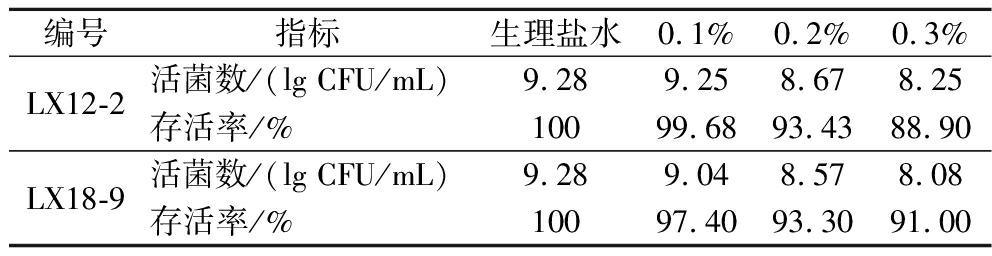
编号指标生理盐水0.1%0.2%0.3%LX12-2活菌数/(lg CFU/mL)9.289.258.678.25存活率/%10099.6893.4388.90LX18-9活菌数/(lg CFU/mL)9.289.048.578.08存活率/%10097.4093.3091.00
2.8 屎肠球菌LX18-9的模拟胃肠液消化试验
益生菌在胃肠道内有较高的存活率是保障它能到达目标器官发挥作用的重要指标之一。食物在胃液中大概存留1~3 h,在肠液中大概存留4 h,胃肠液环境受胃酸及各种蛋白酶的影响,可能造成部分菌株死亡。检测LX18-9菌株在模拟胃肠液中的消化特性,由图6可见,该菌株在胃液中培养3 h,在肠液中培养4 h后的存活率分别达到了74.83%和96.07%,表明菌株LX18-9在模拟胃肠液中有较高的耐受能力,具有在体内发挥益生功能的潜力。
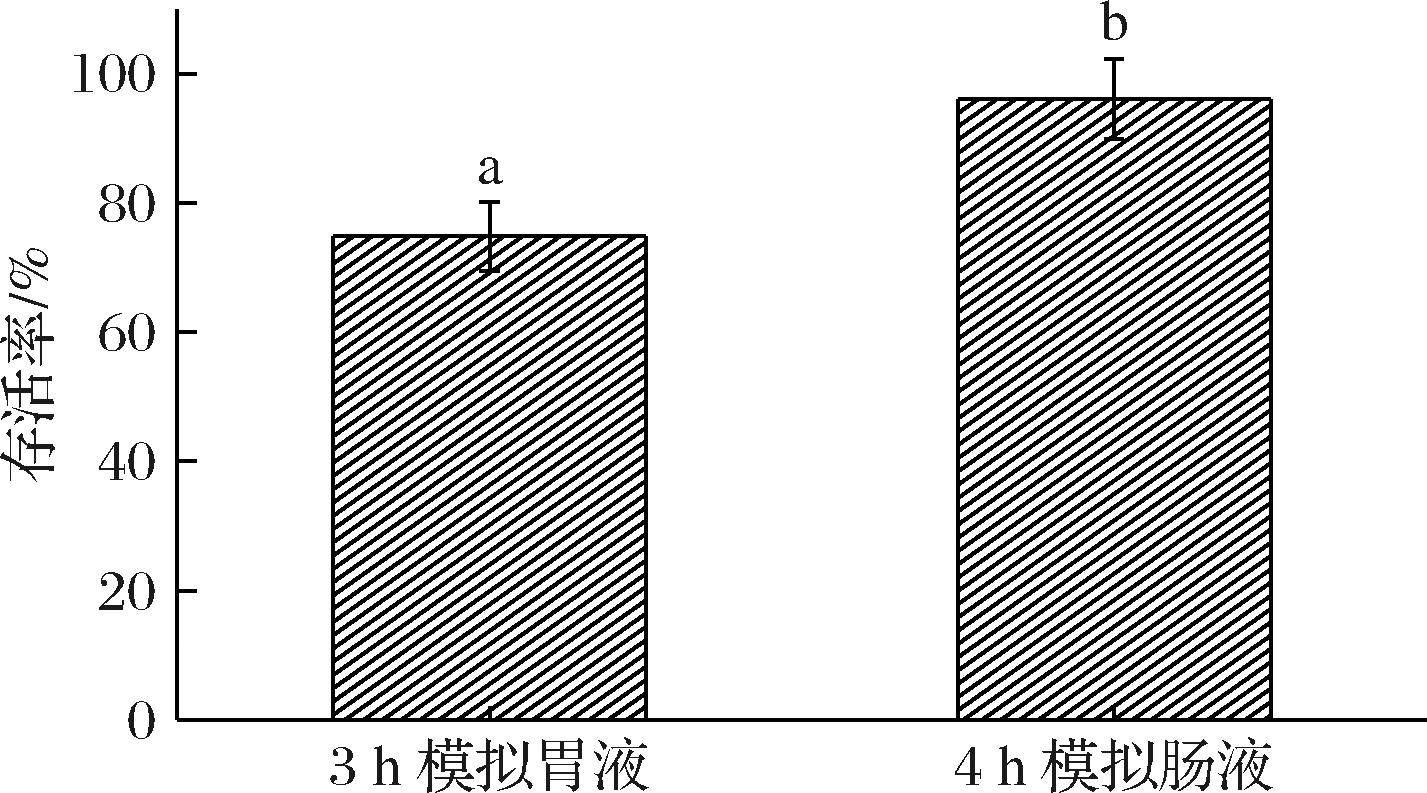
图6 屎肠球菌LX18-9模拟胃肠液消化吸收
Fig.6 E. faecus LX18-9 simulates digestion and absorption of gastrointestinal fluid
注:不同字母表示差异显著(P<0.05)(下同)。
2.9 屎肠球菌LX18-9的安全性试验
2.9.1 生物胺检测试验
组胺的产生与毒力基因没有直接关系,是体内正常的活性成分,但通过食物积累的量超过安全阈值时也会对机体造成毒害作用,而微生物发酵食品可能是生物胺的主要来源,需控制菌的添加量确保食品在安全标准内[30]。通过考察菌株LX18-9的产组胺能力,由图7-a所示,与大肠杆菌(图7-b)相比,接种屎肠球菌LX18-9的培养基中无组胺产生,其平板颜色无变化。可见LX18-9菌株相对安全,具有一定的应用潜力。
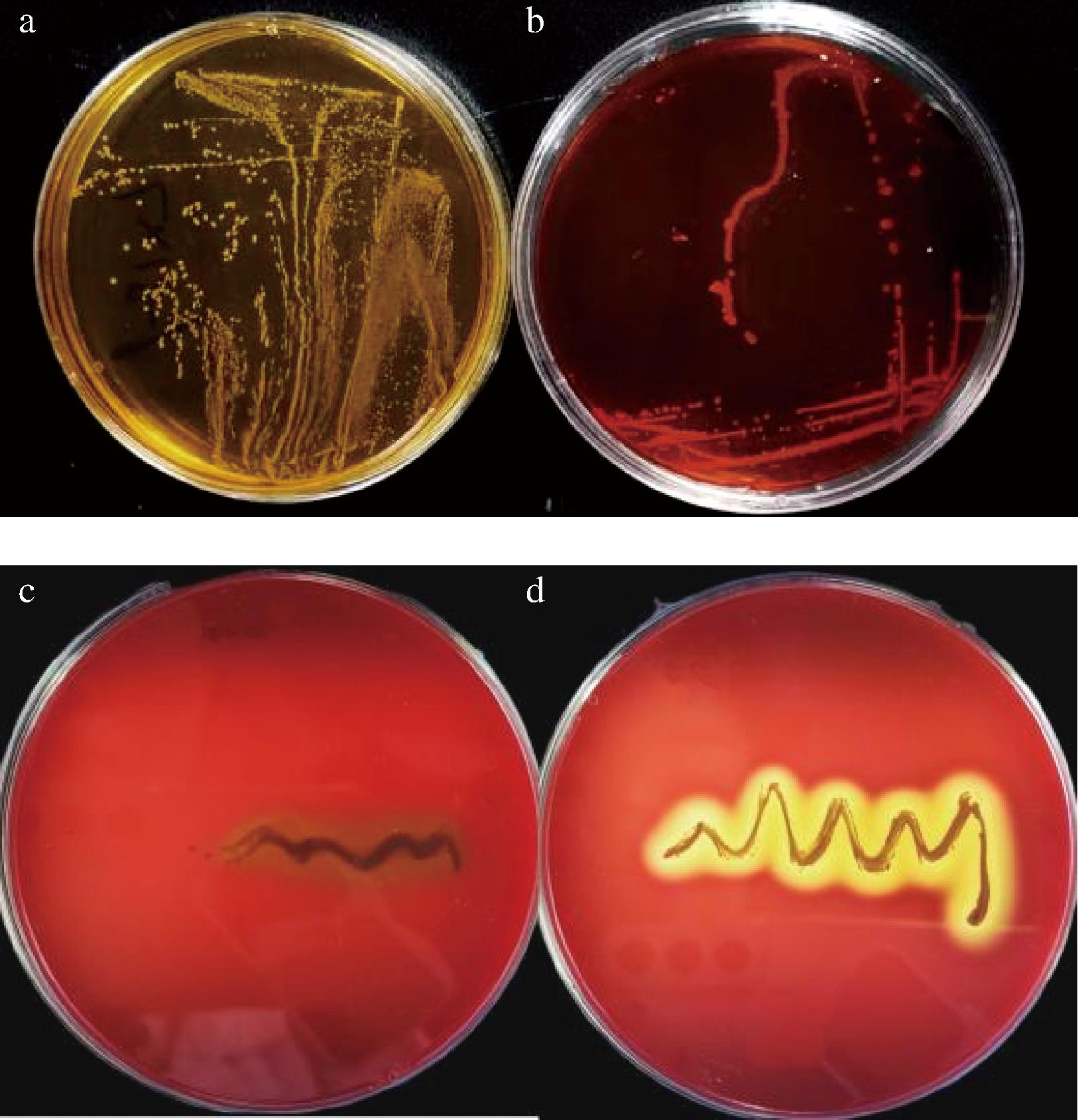
a-屎肠球菌LX18-9产生物胺结果;b-大肠杆菌产生物胺阳性对照;c-屎肠球菌LX18-9产溶血素结果;d-金黄色葡萄球菌产溶血素阳性对照
图7 屎肠球菌LX18-9 有毒代谢物检测结果
Fig.7 E. faecus LX18-9 toxic metabolite test results
2.9.2 溶血性试验
菌体的溶血性会增加患败血症的危险,小鼠试验中严重心内膜炎和皮肤坏死等与肠球菌产生的溶血素有重要关系[31],因此菌株是否有溶血活性是检测其安全性的另一重要指标。
由图7-c和图7-d可见,菌株LX18-9和金黄色葡萄球菌阳性对照在哥伦比亚血平板上划线培养48 h后,对照菌有明显的溶血透明圈产生,表现为β溶血,而LX18-9菌株无溶血圈出现,表明其无溶血毒性,不会引起溶血和红细胞聚集反应。
2.9.3 明胶液化试验
明胶酶是一种水解活性生物肽的酶,这些生物肽在人类感染疾病时发挥重要作用,明胶酶由毒力基因geIE编码,通过降解纤维蛋白等产生毒性[32]。因此对筛选出的菌进行明胶液化实验,由表1可见,LX18-9的结果呈阴性,表明该菌株不产生明胶酶。
3 结论
本文从自然发酵龙虾酱中使用特定培养基筛选产酸菌,通过益生试验表明屎肠球菌LX18-9有成为益生菌的潜力,可以对大肠杆菌、金黄色葡萄球菌、单增李斯特菌以及沙门氏菌都有抑制作用,同时具有较高的抗氧化活性,并能耐受胃肠液中的极端环境,经过安全性试验检测不产生生物胺、溶血素和明胶酶等有害物质,如需进一步验证安全性还应结合毒力基因检测确定安全属性。基于以上实验,屎肠球菌LX18-9可能应用于发酵食品中作为发酵剂使用,有望成为一种潜在益生功能的发酵剂。
[1] 曹海玲, 张澳晴, 王麒睿, 等.一株屎肠球菌烈性噬菌体的分离鉴定及基因组测序分析[J].微生物学通报, 2023, 50(11):5084-5096.
CAO H L, ZHANG A Q, WANG Q R, et al.Isolation, identification and genome sequencing of a virulent phage infecting Enterococcus faecium[J].Microbiology China, 2023, 50(11):5084-5096.
[2] LI K X, GU Q Y, YANG W H, et al.In vitro screening and probiotic evaluation of anti-obesity and antioxidant lactic acid bacteria[J].Food Bioscience, 2023, 54:102844.
[3] 王朝, 冉旋, 雷江英, 等.牦牛源产细菌素屎肠球菌的分离鉴定和益生特性[J].微生物学通报, 2023, 50(8):3454-3466.
WANG Z, RAN X, LEI J Y, et al.Isolation, identification, and probiotic properties of bacteriocin-producing Enterococcus faecium from yak[J].Microbiology China, 2023, 50(8):3454-3466.
[4] 汪仕爽, 罗凯, 王明阳, 等.屎肠球菌对凡纳滨对虾生长、非特异免疫及抗病力的影响[J].中国海洋大学学报(自然科学版), 2023, 53(1):42-52.
WANG S S, LUO K, WANG M Y, et al.Effect of Enterococcus faecium on growth performance, non-specific immunity and disease resistance of litopenaeus vannamei[J].Periodical of Ocean University of China, 2023, 53(1):42-52.
[5] SOLEIMANI H, SHOKRI R, NAMI Y, et al.Potential probiotic characterization of lactic acid bacteria isolated from Duimaj, an Iranian traditional snack food, using biochemical, molecular and computational approaches[J].LWT, 2023, 184:115091.
[6] 王春娥, 石继春, 徐潇, 等.不同来源屎肠球菌的全基因组序列分析[J].食品安全质量检测学报, 2022, 13(13):4250-4257.
WANG C E, SHI J C, XU X, et al.Whole genome sequence analysis of Enterococcus faecium from different sources[J].Journal of Food Safety &Quality, 2022, 13(13):4250-4257.
[7] 孙向阳, 汪杰, 姚红梅, 等.屎肠球菌与酿酒酵母共发酵产γ-氨基丁酸条件优化及机制研究[J].食品工业科技, 2022, 43(15):132-138.
SUN X Y, WANG J, YAO H M, et al.Optimization of conditions for γ-Aminobutyric acid yield by co-fermentation of Enterococcus faecium with Saccharomyces cerevisiae and mechanism research[J].Science and Technology of Food Industry, 2022, 43(15):132-138.
[8] 陈志娜, 沈业桥, 叶韬, 等.屎肠球菌R2培养条件优化及酸浆发酵剂的制备[J].食品研究与开发, 2021, 42(11):161-166.
CHEN Z N, SHEN Y Q, YE T, et al.Optimizing culture conditions of Enterococcus faecium R2 for preparation of acid pulp starters[J].Food Research and Development, 2021, 42(11):161-166.
[9] 王璐, 王伟伟, 王艳霞, 等.果蔬发酵乳酸菌的筛选、鉴定及发酵性能分析[J].食品科学, 2020, 41(10):166-171.
WANG L, WANG W W, WANG Y X, et al.Screening, identification and fermentation characteristics of lactic acid bacteria for fermentation of fruits and vegetables[J].Food Science, 2020, 41(10):166-171.
[10] 孙擎, 曾林, 谭霄, 等.一株产γ-氨基丁酸屎肠球菌的筛选和发酵条件优化及其益生特性分析[J].食品工业科技, 2020, 41(14):87-93;100.
SUN Q, ZENG L, TAN X, et al.Screening and optimization of fermentation conditions for γ-aminobutyric acid-producing Enterococcus faecium and analysis of probiotic properties[J].Science and Technology of Food Industry, 2020, 41(14):87-93;100.
[11] LOWRY O, ROSEBROUGH N, FARR A L, et al.Protein measurement with the folin phenol reagent[J].Journal of Biological Chemistry, 1951, 193(1):265-275.
[12] SLYVKA I, TSISARYK O, MUSII L, et al.Identification and Investigation of properties of strains Enterococcus spp.Isolated from artisanal Carpathian cheese[J].Biocatalysis and Agricultural Biotechnology, 2022, 39:102259.
[13] MADJIREBAYE P, XIAO M Y, MAHAMAT B, et al.In vitro characteristics of lactic acid bacteria probiotics performance and antioxidant effect of fermented soymilk[J].Food Bioscience, 2022, 49:101952.
[14] FUGABAN J I I, HOLZAPFEL W H, TODOROV S D.Probiotic potential and safety assessment of bacteriocinogenic Enterococcus faecium strains with antibacterial activity against Listeria and vancomycin-resistant enterococci[J].Current Research in Microbial Sciences, 2021, 2:100070.
[15] 刘玮, 曹威, 刘浩, 等.益生屎肠球菌RS3的分离鉴定及增殖条件的优化[J].食品研究与开发, 2022, 43(13):156-163.
LIU W, CAO W, LIU H, et al.Isolation and identification of probiotic Enterococcus faecium RS3 and optimization of its proliferation conditions[J].Food Research and Development, 2022, 43(13):156-163.
[16] PAUL C, MISHU I D, MIAH M I, et al.Isolation, identification and probiotic potential of lactic acid bacteria and yeasts from commercial yogurt and homemade non-dairy fermented food “KANJI”[J].International Journal of Gastronomy and Food Science, 2023, 34:100787.
[17] SRINIVASH M, KRISHNAMOORTHI R, MAHALINGAM P U, et al.Probiotic potential of exopolysaccharide producing lactic acid bacteria isolated from homemade fermented food products[J].Journal of Agriculture and Food Research, 2023, 11:100517.
[18] NEGM EL-DEIN A, DABA G, MOSTAFA F A, et al.Utilization of autochthonous lactic acid bacteria attaining safety attributes, probiotic properties, and hypocholesterolemic potential in the production of a functional set yogurt[J].Biocatalysis and Agricultural Biotechnology, 2022, 43:102448.
[19] SADEGHI M, PANAHI B, MAZLUMI A, et al.Screening of potential probiotic lactic acid bacteria with antimicrobial properties and selection of superior bacteria for application as biocontrol using machine learning models[J].LWT, 2022, 162:113471.
[20] GUO Z H, WANG Q, ZHAO J H, et al.Lactic acid bacteria with probiotic characteristics in fermented dairy products reduce cow milk allergy[J].Food Bioscience, 2023, 55:103055.
[21] FOSSI B T, EKABE D E, TOUKAM L L, et al.Probiotic lactic acid bacteria isolated from traditional Cameroonian palm wine and corn beer exhibiting cholesterol lowering activity[J].Heliyon, 2022, 8(11):e11708.
[22] RONALDO R, HAMIN K, WILHELM H H, et al. Beneficial, safety, and antioxidant properties of lactic acid bacteria: A next step in their evaluation as potential probiotics[J]. Heliyon, 2023, 9(4): e15610.
[23] YOUNUS M T, AVINASH K L, LATHA D, et al. Characterization of potential probiotic bacteria Enterococcus faecium MC-5 isolated from the gut content of Cyprinus carpio specularis[J]. Microbial Pathogenesis, 2022, 172: 105783.
[24] 罗强, 张明, 刘巧, 等.产细菌素屎肠球菌SC-Y112的体外益生性及安全性评价[J].食品科学, 2021, 42(11):154-160.
LUO Q, ZHANG M, LIU Q, et al.Evaluation of in vitro probiotic and safety properties of Enterococcus faecium SC-Y112 producing bacteriocin[J].Food Science, 2021, 42(11):154-160.
[25] LIN J X, XIONG T, PENG Z, et al.Novel lactic acid bacteria with anti-hyperuricemia ability:Screening and in vitro probiotic characteristics[J].Food Bioscience, 2022, 49:101840.
[26] 杨博, 柏吉, 靳亚梅, 等.新疆地区驴乳源优良乳酸菌发酵剂的筛选及菌株益生特性[J].食品科学, 2022, 43(2):224-232.
YANG B, BAI J, JIN Y M, et al.Screening of lactic acid bacteria from donkey milk in Xinjiang for use as starter culture and their probiotic characteristics[J].Food Science, 2022, 43(2):224-232.
[27] DE AMORIM TRINDADE D P, BARBOSA J P, MARTINS E M F, et al.Isolation and identification of lactic acid bacteria in fruit processing residues from the Brazilian Cerrado and its probiotic potential[J].Food Bioscience, 2022, 48:101739.
[28] ADUGNA M, ANDUALEM B.Isolation, characterization and safety assessment of probiotic lactic acid bacteria from metata ayib (Traditional spiced cottage cheese)[J].Food and Humanity, 2023, 1:85-91.
[29] NOROUZI S, DANESHYAR M, FARHOOMAND P, et al.In vitro evaluation of probiotic properties and selenium bioaccumulation of lactic acid bacteria isolated from poultry gastrointestinal, as an organic selenium source[J].Research in Veterinary Science, 2023, 162:104934.
[30] QAYYUM N, WANG S X, YANTIN Q, et al.Characterization of Short-chain fatty acid-producing and cholesterol assimilation potential probiotic Lactic acid bacteria from Chinese fermented rice[J].Food Bioscience, 2023, 52:102404.
[31] 秦雅莉, 赵笑颍, 沈圆圆, 等.酸笋中具有抗炎活性乳酸菌的筛选及鉴定[J].食品科学, 2022, 43(8):121-127.
QIN Y L, ZHAO X Y, SHEN Y Y, et al.Screening and identification of anti-inflammatory lactic acid bacteria from sour bamboo shoot[J].Food Science, 2022, 43(8):121-127.
[32] 丁丽丽, 吕欣然, 高永悦, 等.鱼肠道中抗氧化活性乳酸菌的筛选及鉴定[J].食品科学, 2021, 42(10):127-132.
DING L L, LÜ X R, GAO Y Y, et al.Screening for and identification of lactic acid bacteria with antioxidant activity from the intestinal tract of fish[J].Food Science, 2021, 42(10):127-132.