果菜类蔬菜是指以果实为主要食用部分的蔬菜,主要包括茄果类、豆类和瓜类等。以果菜类蔬菜为原料制成的发酵蔬菜产品深受消费者的喜爱,如剁辣椒、辣椒酱和酸豆角等。发酵蔬菜是我国传统的发酵食品之一,具有鲜嫩脆爽、香味宜人、风味独特和解腻开胃等特点。目前发酵蔬菜的生产主要以传统自然发酵为主,且生产规模较小,在生产过程中易受多种因素影响,导致其产品质量不稳,同时存在易被杂菌污染,发酵时间长、亚硝酸盐含量超标和生产效率低等不足,难以实现发酵蔬菜的规模化生产。目前,人为添加菌株进行蔬菜发酵被认为是可能实现发酵蔬菜规模化生产的方式之一[1]。为提高发酵蔬菜的产品品质常采用外源接菌的方法进行改善。前人研究表明,外源接菌可以缩短蔬菜发酵的时间[2],降低发酵蔬菜中的亚硝酸盐含量[3],同时抑制有害微生物的生长[4],增添发酵蔬菜的风味[5]。
微生物是影响发酵蔬菜产品品质的关键,不同种类的微生物对发酵蔬菜风味的影响不同。如乳酸菌可增加发酵蔬菜中有机酸的含量[6],酵母菌可增加发酵蔬菜中酯类的含量[7]。外源接菌的菌株常来自于发酵过程中的微生物筛选,包括细菌和真菌。其中,细菌优势菌属多为乳杆菌属[8-9],对于乳酸菌的应用研究以植物乳杆菌和短乳杆菌为主[10-11];真菌优势菌属为酵母属、链格孢菌属等[12-13],多集中于对酵母菌的应用研究[14]。现有研究多集中于同一类型菌株如乳酸菌或酵母菌接种对发酵蔬菜的影响,如田辉等[15]比较了植物乳杆菌和短乳杆菌的发酵特性,发现其生长性能、产酸性能和亚硝酸盐降解率有显著差异,植物乳杆菌的生长速度和产酸速度快,亚硝酸盐降解率显著高于短乳杆菌。缺乏不同类型菌株间发酵特性的研究,且同一发酵过程中筛选的细菌与真菌对发酵蔬菜的影响尚未阐明。研究表明,纯种发酵的蔬菜产品的风味不及自然发酵的蔬菜产品[16],混合发酵可改善纯种发酵风味不足的缺点[17]。混合发酵可改变蔬菜发酵过程中的微生物群落结构,调节发酵蔬菜中代谢产物的含量,有助于提升发酵蔬菜的风味[18-19]。
以果菜类蔬菜为原料制备发酵蔬菜的加工工艺较为简单,易操作[20-21],且经微生物发酵制成的发酵蔬菜产品营养丰富、风味独特[22],含有大量乳酸菌、酵母菌和其他优势微生物[23],可作为研究对象分离筛选不同类型发酵菌株,用于比较不同类型菌株的发酵特性差异。目前常利用生长能力、产酸能力、亚硝酸盐降解率以及菌株的耐受性等指标作为评价发酵蔬菜中菌株性能的依据[10, 24],对于菌株性能的评价主要是单纯比较不同菌株的某一项评价指标的差异,缺乏对不同菌株性能涉及的多项评价指标的综合比较。熵值法是一种客观赋权的方法,根据指标的相对变化程度对系统整体的影响来确定指标的权重,可用于多指标的综合评价[25]。熵值法可将多个指标的数据进行综合分析,得出一个综合评价的结果,广泛应用于各种领域。利用熵值法可将从果菜类蔬菜混合发酵样品中所筛选的菌株的不同发酵性能的指标值进行标准化,消除单位和纲量的影响,实现菌株发酵性能的可比性和可综合性。
本研究从果菜类蔬菜混合发酵的蔬菜样品中分离菌株,通过形态学观察与分子生物学鉴定菌株类型,运用生长曲线、产酸能力、耐盐性、耐酸性、耐亚硝酸盐能力和亚硝酸盐降解率等指标解析各菌株类型的发酵特性,采用熵值法综合评价筛选发酵性能最优菌株,对各菌株类型发酵蔬菜品质进行感官评价,为蔬菜发酵菌株进一步开发与利用提供理论基础与数据支撑。
1 材料与方法
1.1 材料与试剂
1.1.1 试验材料
辣椒与豇豆、刀豆混合发酵蔬菜样品,采用自然发酵。
1.1.2 主要试剂
MRS肉汤培养基,广东环凯微生物科技有限公司;琼脂粉,Biosharp公司;哥伦比亚血平板培养基,南京全隆生物技术有限公司;TSINGKE植物DNA提取试剂盒、TSINGKE 1×TSE101金牌mix PCR试剂盒,北京擎科生物科技有限公司;NaNO2、四硼酸钠、亚铁氰化钾、硼砂、乙酸锌、盐酸萘乙二胺、对氨基苯磺酸、NaCl、盐酸、NaOH,均为分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
SW-CJ-1FD超净工作台,苏净集团苏州安泰空气技术有限公司;DPH-500电热恒温培养箱,北京市永光明医疗仪器厂;SX-700高压灭菌锅,湖南仪修电子科技有限公司;SU8010扫描电镜,天美(中国)科学仪器有限公司;UV-2600紫外分光光度计,湖南中美科学仪器有限公司;Infinite M200 PRO酶标仪,长沙市鸿跃实验设备有限公司;2720 thermal cycler PCR仪,Applied Biosystems公司;JY04S-3C凝胶成像仪,君意东方;pH计,梅特勒-托利多仪器(上海)有限公司。
1.3 实验方法
1.3.1 发酵蔬菜样品制备
购买新鲜的辣椒、豇豆及刀豆,经清洗、沥干、切分后,称取豇豆900 g、辣椒50 g、刀豆50 g,食盐100 g,白酒10 mL,白糖10 g放入盆中,混匀后放入腌菜坛中,取发酵0、3、10、21、39 d的样品。
1.3.2 菌株分离纯化
参考孙盛等[26]的方法稍作修改。以无菌操作各取不同发酵时间的蔬菜样品10 g,放入90 mL无菌生理盐水中,按体积比1∶10进行梯度稀释。于MRS固体培养基中涂布,30 ℃厌氧培养48 h,挑选不同形态的单菌落进行划线培养,多次纯化,直至获取纯种菌株。共筛选出31株菌,甘油保存备用。
1.3.3 菌株鉴定
1.3.3.1 形态学鉴定
将分离纯化的31株菌株进行形态学观察。方法参考马蓓等[27]对菌株进行扫描电镜观察前处理,菌体经固定、脱水、干燥后并用扫描电镜观察菌株的形态。记录菌落特征,初步筛选菌株类型。
1.3.3.2 分子生物学鉴定
利用TSINGKE植物DNA提取试剂盒提取菌株的DNA,细菌用16SrDNA通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R (5′-GGTTACCTTGTTAGACTT-3′)对细菌的V3-V4区进行PCR的扩增;真菌用通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5-TCCTCCGCTTATTGATATGC-3′)对真菌的ITS1区进行PCR扩增。PCR扩增条件:35个循环(98 ℃预变性2 min,98 ℃变性10 s,56 ℃退火10 s,72 ℃延伸10 s),72 ℃末端延伸5 min,终止反应(4 ℃,∞)。将扩增好的PCR产物送至北京擎科生物科技有限公司测序,将测序所得序列在NCBI数据库中进行BLAST比对,利用MEGA 11软件分析序列,用N-J法构建发育进化树。
1.3.4 菌株溶血性测试
参考马文瑞等[28]的方法,将活化后的菌株接种于哥伦比亚血琼脂培养基上,培养一段时间后,观察平板上是否有溶血圈,若菌落周围无任何变化,为γ溶血,若菌落周围出现草绿色环,为α溶血,若菌落周围出现透明溶血环,为β溶血。
1.3.5 菌株发酵特性
1.3.5.1 菌株生长曲线
将活化菌株以体积分数为1%的接种量接种于MRS肉汤中,30 ℃培养24 h,每隔2 h取样,用酶标仪测量菌株OD600nm的值,测定前振荡5 s,使菌体悬浮。
1.3.5.2 菌株产酸能力
将活化菌株以体积分数为1%的接种量接种于MRS肉汤中,30 ℃培养24 h,用pH计测量发酵液的pH。
1.3.6 菌株耐受性实验
参考胡此海等[29]的方法,并稍作修改,实验结果以lg (OD24/OD0)表示:+++表示lg (OD24/OD0)>0.5为高速增长;++表示0.3 1.3.6.1 菌株耐盐能力 将活化菌株以体积分数为1%的接种量,分别接入含有质量分数4%、6%、8%、10%、12%、14% NaCl的MRS肉汤中,取200 μL加入到无菌微孔板中,以无菌MRS肉汤作为对照,用酶标仪测量菌株600 nm处的吸光度值(OD600nm值)。 1.3.6.2 菌株耐酸性 将活化菌株以体积分数为1%的接种量,分别接入pH 2、3、4、5、6、7、8的MRS培养基中,取200 μL加入到无菌微孔板中,以无菌MRS肉汤作为对照,用酶标仪测量菌株600 nm处的吸光度值(OD600nm值)。 1.3.6.3 菌株耐亚硝酸盐能力 将活化菌株以体积分数为1%的接种量,分别接入含有50、100、200、300、400 μg/mL NaNO2的MRS肉汤中,无菌MRS培养基作为对照,30 ℃恒温培养24 h后,将菌液放入无菌培养板中,用酶标仪检测600 nm处的吸光度值(OD600nm值)。 1.3.7 菌株降解亚硝酸盐能力 将活化菌株以体积分数为1%的接种量,接种到含有200 mg/L NaNO2的MRS肉汤中,在30 ℃下培养24 h后,发酵液待测。按照GB 5009.33—2016食品安全国家标准《食品中亚硝酸盐与硝酸盐的测定》中的分光光度计法测定亚硝酸盐含量。 亚硝酸盐降解率计算如公式(1)所示: (1) 式中:X,亚硝酸盐的降解率,%;M1,菌株发酵24 h后培养基中亚硝酸盐的质量,mg;M0,初始培养基中的亚硝酸盐的质量,mg。 1.3.8 菌株性能综合评价 采用熵值法[30-31]对菌株的生长能力、产酸能力、降解亚硝酸盐能力、耐盐性能、耐酸性能以及耐硝酸盐性能进行综合评价。 第1步:采用极值法将各项评价指标进行标准化处理,如公式(2)所示: 正向指标: (2) 式中:X′ij,数据标准化后的指标值;Xij,菌株i第j项的原始数据;Xmax和Xmin分别为第j项指标的最大值和最小值。 第2步:为消除0的影响,对标准化后的数据进行适当平移,如公式(3)所示: X″ij=X′ij+0.000 1 (3) 第3步:计算菌株i第j项指标的比重,如公式(4)所示: (4) 第4步:计算第j项指标的熵值,如公式(5)所示: (5) 第5步:计算第j项指标的差异性系数,如公式(6)所示: aj=1-ej (6) 第6步:计算第j项指标的权重,如公式(7)所示: (7) 最后,求出菌株发酵性能的综合得分,如公式(8)所示: (8) 1.3.9 菌株发酵蔬菜的感官评价 将5株菌分别以体积分数为1%的接种量接入MRS培养基中,在30 ℃的培养24 h后,将菌液在12 000 r/min离心3 min,并用无菌的0.85% NaCl溶液重复洗涤3次,然后再用无菌的0.85% NaCl溶液调节菌株的浓度至1×108 CFU/mL。分别将5株菌的菌液用于辣椒与豇豆混合的蔬菜发酵中,辣椒与豇豆的质量比为(1∶1.5),分别添加1%菌液,8%食盐,同时以不添加菌株的处理作为对照。参照陈功[32]感官评价标准,由10名接受过专业感官评价训练的评审人员对发酵7 d的辣椒与豇豆混合蔬菜样品品质进行评价。 实验重复测定3次,结果以“平均值±标准差”表示。通过统计软件SPSS 27中进行方差分析及显著性分析(置信区间为95%),利用Origin 2021软件绘图。 从辣椒、豇豆及刀豆混合发酵样品中共分离纯化出31株菌株,按照菌株在MRS培养基生长的形状、颜色、大小等挑选代表的菌株进行分类,初步分成5种类别(见表1、图1)。每种类别的菌株分别挑选1株代表性菌株进行形态学鉴定。 a-L1;b-L4;c-L5;d-L8;e-L10 图1 菌株形态观察 表1 发酵蔬菜样品中发酵菌株形态 菌株菌落特征菌株形态学观察L1圆形、米白色、边缘整齐、菌落较大椭圆形、中间凹陷L4圆形、乳白色、菌落较小、边缘整齐杆状L5圆形、米白色、菌落小、边缘整齐杆状L8圆形、乳白色、菌落较小、边缘整齐、表面光滑杆状L10圆形、米白色、菌落较大、中间微隆起椭圆形 将5株代表性菌株的部分基因序列提交至NCBI数据库进行BLAST同源性比对,选取相似性高于99%的菌株序列构建系统发育树(见图2),L1、L4、L5、L8和L10分别与链格孢菌(Alternaria alternata)、阿根廷乳酸杆菌(Lactiplantibacillus argentoratensis)、乳酸杆菌(Lactobacillus sp.)、短乳杆菌(Lactobacillus brevis)和假酵母菌(Pseudozyma sp.)的亲缘关系最近。 图2 菌株分子生物学鉴定 溶血性是评价菌株安全性的重要指标。将菌株分别划线接种于哥伦比亚血琼脂培养基上,培养后观察,如图3所示,5株菌在血平板上均不产生溶血圈,为γ溶血。 a-L1;b-L4;c-L5;d-L8;e-L10 图3 菌株溶血性测试结果 由图4-a可知,5种菌株的停滞期均较短,且较能在较短时间内进入对数期。L1的对数期为0~10 h,10 h后进入稳定期;L4的对数期是0~12 h,12 h后进入稳定期;L5、L8的对数期是0~20 h,20 h后进入稳定期;L10的对数期是0~16 h,16 h后进入稳定期。在到达稳定期后,5种菌株的OD600nm值均在1.5以上,说明各菌株均有较强的生长能力。其中L1、L4、L10的OD600nm值高达1.9以上。OD600nm值越高,说明菌株的浓度越高,菌株的生长能力越强。因此,菌株L1、L4、L10的生长能力强于菌株L5、L8。5种类型菌株均有明显的对数期和稳定期,生长能力性能良好。 a-生长曲线;b-菌株pH下降值 图4 菌株生长曲线和产酸能力 注:不同小写字母表示差异显著(P<0.05)(下同)。 发酵24 h后,5种菌株均可使发酵液的pH值降低(图4-b),其中,菌株L4、L8产酸能力较强,pH值分别由5.96和5.79显著降低至3.84和3.71(P<0.05);其次是菌株L5,pH值由5.79下降至4.28;菌株L1、L10产酸能力较弱,未能引起发酵液pH值的显著变化(P>0.05)。L4和L8的产酸能力强,可能是因为L4、L8的生长速度快,有利于乳酸等有机酸的累积,使发酵蔬菜的pH值迅速降低。刘娜[33]发现部分酵母菌有产酸能力,但产酸能力较弱。罗强等[34]对不同种的乳酸菌的产酸能力进行测定,发现不同种的乳酸菌产酸能力不同,其中短乳杆菌的产酸能力较强,与本研究结果一致。 2.5.1 菌株耐盐能力 蔬菜发酵需要食盐的参与,食盐的高渗透压作用可抑制有害微生物的生长,从而可以防止食品变质,有利于蔬菜的保存,因此发酵菌株的耐盐能力十分重要。各类菌株的生长速度随着盐浓度的升高而逐渐减缓,但不同类型菌株对盐的耐受性存在显著差异(表2)。其中,L4、L8在不同盐浓度的环境中都表现较好的耐受性,10%盐浓度时,L8的生长速度可达到中等增长,L4为低速增长,但在12%和14%盐浓度时,生长速度迅速降低,菌株耐受性显著降低。L1、L10的耐受性较差,在8%盐浓度时可以较好的生长,但在10%、12%和14%盐浓度时增长速度显著下降。L5在8%盐浓度时生长状态为低速增长,对盐浓度的耐受能力最差。L4、L8具有较强的耐盐能力,可能是因为乳酸菌相比其他类型菌株能更好地适应蔬菜发酵所需的高渗透压环境。周艺萍等[35]利用不同盐浓度(0%、2%、5%、10%)发酵酸腌菜,发现10%盐浓度的微生物生长较差且口感最差,与本研究结果一致。 表2 菌株耐受性实验结果 耐受性处理L1L4L5L8L10菌株耐盐性4% NaCl+++++++++++++++6% NaCl+++++++++++++++8% NaCl+++++++++++++10% NaCl-+-++-12% NaCl-----14% NaCl-----菌株耐酸性pH值为2--+--pH值为3+++++++-pH值为4+++++++++++++++pH值为5+++++++++++++++pH值为6+++++++++++++++pH值为7+++++++++++++++pH值为8+++++++++++++++菌株对亚硝酸盐耐受性50 μg/mLNaNO2+++++++++++++++100 μg/mLNaNO2+++++++++++++++200 μg/mLNaNO2+++++++++++++++300 μg/mLNaNO2+++++++++++++++400 μg/mLNaNO2+++++++++++++++ 注:耐受性实验结果以lg (OD24/OD0)表示:+++ 表示高速增长;++ 表示中速增长;+表示低速增长;-表示没有生长。 2.5.2 菌株耐酸能力 蔬菜在发酵过程中会产酸,酸性环境会抑制大部分微生物的活动,因此,菌株需要有一定的耐酸能力。由表2可知,随着pH值的升高,各菌株生长受到的抑制也逐渐减少,但不同类型的发酵菌株对酸性环境的耐受性有差异。L5的耐酸能力最强,可耐受pH值为2的酸性环境。L1、L4、L8的耐酸能力较强,可耐受pH值为3的酸性环境。菌株L10的耐酸能力最弱,最高只能耐受pH值为4的酸性环境。结果表明,在pH值为2时,对菌株生长的抑制作用最为明显,袁乐梅等[36]发现在pH值为2的条件下,菌株生长受到的抑制作用最强,与本研究结果一致。 2.5.3 菌株耐亚硝酸盐能力 蔬菜在发酵过程中会产生亚硝酸盐,因此,发酵菌株需要对亚硝酸盐有一定的耐受性。对不同菌株在50~400 μg/mL的亚硝酸盐耐受性进行研究,结果如表2所示。各菌株对亚硝酸盐均具有较好的耐受性。随着亚硝酸盐含量的逐渐增加,5种菌株的生长量均未受到抑制,各菌株生长情况均为高速增长。 亚硝酸盐是发酵蔬菜中容易存在的有害化合物[37],根据GB 2762—2022《食品安全国家标准食品中污染物限量》中的规定,蔬菜及其制品(酱腌菜类)亚硝酸盐含量不得超过20 mg/kg。因此,菌株具有降解亚硝酸盐的能力十分重要。由表3可知,各菌株均具有降解亚硝酸盐的能力,但不同类型的发酵菌株对亚硝酸盐的降解能力有差异。L1、L4、L5、L10均具有较强的亚硝酸盐能力,降解率都达到90%以上,其中乳酸杆菌L5的降解能力更强,降解率达到99%以上,与其他菌株存在显著性差异(P <0.05);但短乳杆菌L8降解亚硝酸盐的能力最低(P <0.05),培养24 h后的降解率只有35.85%。田辉[15]等发现短乳杆菌的亚硝酸盐降解率在30%~45%,与本研究结果一致。 表3 各菌株培养24 h后的亚硝酸盐降解率 菌株亚硝酸盐降解率/%L194.12±0.01cL497.87±0.02bL599.72±0.03aL835.85±0.01eL1090.25±0.02d 注:不同小写字母表示差异显著(P<0.05)(下同)。 采用熵值法对菌株的生长能力、产酸能力、耐盐能力、耐酸能力、耐亚硝酸盐能力和降解亚硝酸盐能力进行综合评价,结果如表4所示,L4的性能最优,L8的性能最差(P<0.05);L1、L5、L10的性能无显著差异(P>0.05)。 表4 菌株发酵性能的综合评价 菌株综合得分/分L10.553 8±0.01bL40.723 9±0.04aL50.564 3±0.03bL80.267 8±0.02cL100.493 3±0.01b 所有接菌发酵蔬菜的感官品质均显著高于未接菌发酵蔬菜(图5-a),其中,菌株L4发酵蔬菜的感官品质最高,总分高达92分,其中色泽及形态和香味达到27分,质地和滋味达到37分;菌株L1、L5、L8、L10发酵蔬菜的感官品质较高,总分均达到84分及以上,其中色泽及形态达到24分以上,香味达到25分以上,质地及滋味达到35分以上。未接菌发酵蔬菜的感官品质较差,总分不足84分,其中色泽及形态不足23分,香味不足25分,质地及滋味不足35分。唐鑫等[19]利用酵母菌发酵辣椒可提升发酵辣椒的感官品质,赵勇等[38]研究发现接种乳酸菌进行蔬菜发酵可提高蔬菜的感官评分,与本研究结果类似。 a-感官评分;b-理化指标 图5 菌株发酵蔬菜样品感官评分及理化指标结果 从pH和亚硝酸盐含量2个方面对发酵7 d的辣椒与豇豆混合蔬菜样品品质进行理化指标测定。所有处理的pH值在4.1~4.37,一般发酵蔬菜成熟时的pH <4.5[39]。所有处理的亚硝酸盐含量小于1 mg/kg(图5-b),远低于食品国家安全标准中规定的酱腌菜亚硝酸盐含量20 mg/kg。 自然发酵的辣椒和豆类混合发酵样品中可分离并筛选5种不同类型菌株,分别是链格孢菌(Alternaria alternata) L1、阿根廷乳酸杆菌(Lactiplantibacillus argentoratensis) L4、乳酸杆菌(Lactobacillus sp.) L5、短乳杆菌(Lactobacillus brevis) L8和假酵母菌(Pseudozyma sp.) L10。外源接种上述菌株均能提升发酵蔬菜的感官品质,口感脆爽、香味丰富、色泽鲜亮,但不同类型菌株在生长速度、产酸能力、耐盐性以及亚硝酸盐降解能力等方面存在显著差异。其中,链格孢菌(L1)、阿根廷乳酸杆菌(L4)、假酵母菌(L10)显示出较强的生长能力;阿根廷乳酸杆菌(L4)和短乳杆菌(L8)表现出较好的产酸能力及对盐的耐受性;乳酸杆菌(L5)在低pH值条件下仍能生长。所有菌株均展现出对亚硝酸盐的高度耐受性和降解能力。经熵值法综合评价显示,阿根廷乳酸杆菌(L4)性能最佳,短乳杆菌(L8)性能相对较弱。因此,所筛选的5株菌均可作为蔬菜发酵的优质菌种资源,可为进一步研究其在发酵蔬菜中的工业化应用奠定基础。 [1] 冯月玲. 现代生物制剂在四川泡菜工业化生产中的应用[J].中国调味品, 2011, 36(12):23-26. [2] 赵山山, 杨园园, 周玉岩, 等.贵州泡菜中乳酸菌的分离鉴定及其在泡菜发酵中的应用[J].中国酿造, 2020, 39(12):113-119. [3] YU Y Y, XU Y J, LI L, et al.Isolation of lactic acid bacteria from Chinese pickle and evaluation of fermentation characteristics[J].LWT, 2023, 180:114627. [4] 燕平梅, 宋敏丽, 赵文婧.东北泡菜中抑菌微生物的分离筛选及鉴定[J].中国调味品, 2020, 45(3):53-56. [5] LUO W S, WU W L, DU X Y, et al.Regulation of the nitrite, biogenic amine and flavor quality of Cantonese pickle by selected lactic acid bacteria[J].Food Bioscience, 2023, 53:102554. [6] 王芮东, 李楠, 卫博慧, 等.不同发酵方式萝卜泡菜中有机酸的变化分析[J].中国调味品, 2021, 46(5):139-43. [7] 张文娟, 陈安特, 韩宇琴, 等.酿酒酵母对萝卜泡菜发酵的影响[J].食品与发酵工业, 2017, 43(8):134-137. [8] KIM J Y, PARK S E, KIM E J, et al.Long-term population dynamics of viable microbes in a closed ecosystem of fermented vegetables[J].Food Research International, 2022, 154:111044. [9] RAO Y, QIAN Y, TAO Y F, et al.Characterization of the microbial communities and their correlations with chemical profiles in assorted vegetable Sichuan pickles[J].Food Control, 2020, 113:107174. [10] 忻晓庭, 刘大群, 张程程, 等.我国特色发酵蔬菜降解亚硝酸盐菌株的筛选鉴定及应用[J].浙江农业学报, 2021, 33(2):335-345. [11] ZHANG X R, LI Y X, ZHAO Y R, et al.Effect of Levilactobacillus brevis as a starter on the flavor quality of radish Paocai[J].Food Research International, 2023, 168:112780. [12] LI M L, XU X X, BI S, et al.Identification and validation of core microbes associated with key aroma formation in fermented pepper paste (Capsicum annuum L.)[J].Food Research International, 2023, 163:112194. [13] 唐垚. 不同发酵形态盐渍萝卜发酵过程中风味物质与微生物菌群的关联性分析[D].雅安:四川农业大学, 2020. [14] 宋新燕, 肖茜, 王蓉蓉, 等.自然发酵剁辣椒中优良酵母菌的筛选及鉴定[J].中国酿造, 2022, 41(6):69-73. [15] 田辉, 马卓, 陈嘉祎, 等.短乳杆菌与植物乳杆菌的发酵特性[J].微生物学通报, 2023, 50(2):802-814. [16] 王秋霞, 路建东, 金玲, 等.乳酸菌菌种差异对泡菜发酵风味的影响[J].粮食与食品工业, 2016, 23(1):41-46. [17] 云琳. 不同发酵方式的萝卜泡菜风味特征解析及发酵剂菌种的筛选[D].无锡:江南大学, 2020. [18] LUO Y L, LIU Y L, REN T, et al.Sichuan Paocai fermented by mixed-starter culture of lactic acid bacteria[J].Food Science &Nutrition, 2020, 8(10):5402-5409. [19] 唐鑫, 张艺馨, 刘卫红, 等.外源接菌对发酵辣椒微生物群落和挥发性风味化合物的影响[J].食品科学, 2023, 44(10):132-141. [20] 肖何, 王蓉蓉, 陈梦娟, 等.湖南不同地区农家剁辣椒风味成分比较分析[J].食品工业科技, 2022, 43(22):310-318. [21] 卜智斌, 唐道邦, 温靖, 等.干豇豆的腌渍工艺优化[J].现代食品科技, 2021, 37(3):212-219; 146. [22] CHEN Z A, GENG Y Y, WANG M, et al.Relationship between microbial community and flavor profile during the fermentation of chopped red chili (Capsicum annuum L.)[J].Food Bioscience, 2022, 50:102071. [23] LIU Z J, CAI S B, ZHANG S Y, et al.A systematic review on fermented chili pepper products:Sensorial quality, health benefits, fermentation microbiomes, and metabolic pathways[J].Trends in Food Science &Technology, 2023, 141:104189. [24] 姚蒋庞. 发酵芥菜乳酸菌的筛选及其应用性研究[D].贵阳:贵州大学, 2021. [25] 胡靖央, 袁林, 陈燕, 等.基于PSR模型的滴水湖及其引水河道生态安全评价[J].海洋湖沼通报, 2023, 45(6):133-141. [26] 孙盛, 陈作国, 俞赟霞, 等.贵州泡菜中润肠通便功能乳酸菌的筛选及其特性研究[J].中国酿造, 2021, 40(10):76-82. [27] 马蓓, 刘伟, 谢蓉蓉, 等.乳酸菌扫描电镜制样方法及观察条件探究[J].内蒙古科技与经济, 2012(2):116-9. [28] 马文瑞, 孙志伟, 石俊, 等.非酿酒酵母Nakazawaea ishiwadae GDMCC 60786产乙酸乙酯的诱变菌株筛选及其安全性评价[J].食品科学, 2023, 44(10):165-172. [29] 胡此海, 杨絮, 郭全友,等.萝卜泡菜母水中乳酸菌分离鉴定与发酵特性比较[J].食品与发酵工业:2023,49(23):111-118. [30] 张立, 朱娜.基于熵值法的中部地区制造业高质量发展评价研究[J].湘潭大学学报(哲学社会科学版), 2022, 46(5):46-51. [31] JI Y, SHENG Q, ZHU Z.Assessment of ecological benefits of urban green spaces in Nanjing city, China, based on the entropy method and the coupling harmonious degree model[J].Sustainability, 2023, 15(13):10516. [32] 陈功. 中国泡菜的品质评定与标准探讨[J].食品工业科技, 2009, 30(2):335-338. [33] 刘娜. 乳酸菌与酵母菌协同发酵米酸特征风味形成机理研究[D].贵阳:贵州大学, 2021. [34] 罗强, 李幸洋, 陈炼红, 等.传统发酵泡菜中乳酸菌种群组成及优良菌株产酸耐酸特性分析[J].食品科学, 2021, 42(2):158-163. [35] 周艺萍, 熊智, 李选文, 等.不同盐浓度对新平酸腌菜发酵过程的影响[J].中国调味品, 2021, 46(5):13-17. [36] 袁乐梅, 边名鸿, 李正涛, 等.川西彝族传统酸菜汁中乳酸菌的分离鉴定与特性分析[J].中国调味品, 2019, 44(2):24-28. [37] DING Z S, JOHANNINGSMEIER S D, PRICE R, et al.Evaluation of nitrate and nitrite contents in pickled fruit and vegetable products[J].Food Control, 2018, 90:304-311. [38] 赵勇, 刘毕琴, 陈骏飞, 等.明串珠菌与乳植杆菌复合发酵对低盐泡萝卜品质的影响[J].食品工业科技,2024,45(11):102-109. [39] 黄玉立, 赵楠, 黄庆, 等.发酵蔬菜风味物质形成机制及影响因素研究进展[J].食品与发酵工业, 2021, 47(24):279-285.![]()
![]()
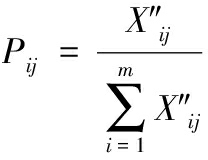
![]()
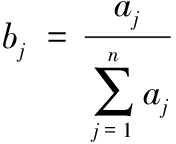
![]()
1.4 统计与分析
2 结果与分析
2.1 菌株分离纯化及形态学鉴定结果

Fig.1 Morphological observation of bacterial strains
Table 1 Morphology of fermenting strains in fermented vegetable samples
2.2 分子生物学鉴定
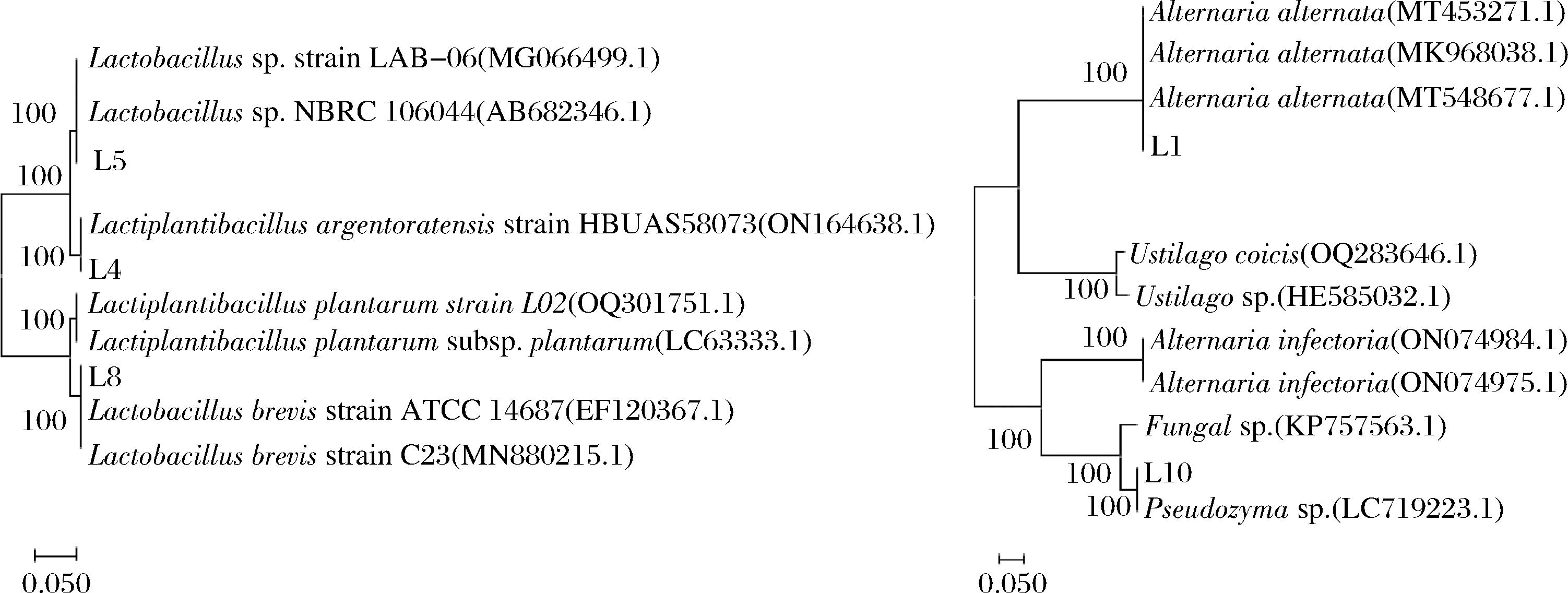
Fig.2 Molecular biological characterization of strains2.3 菌株溶血性试验
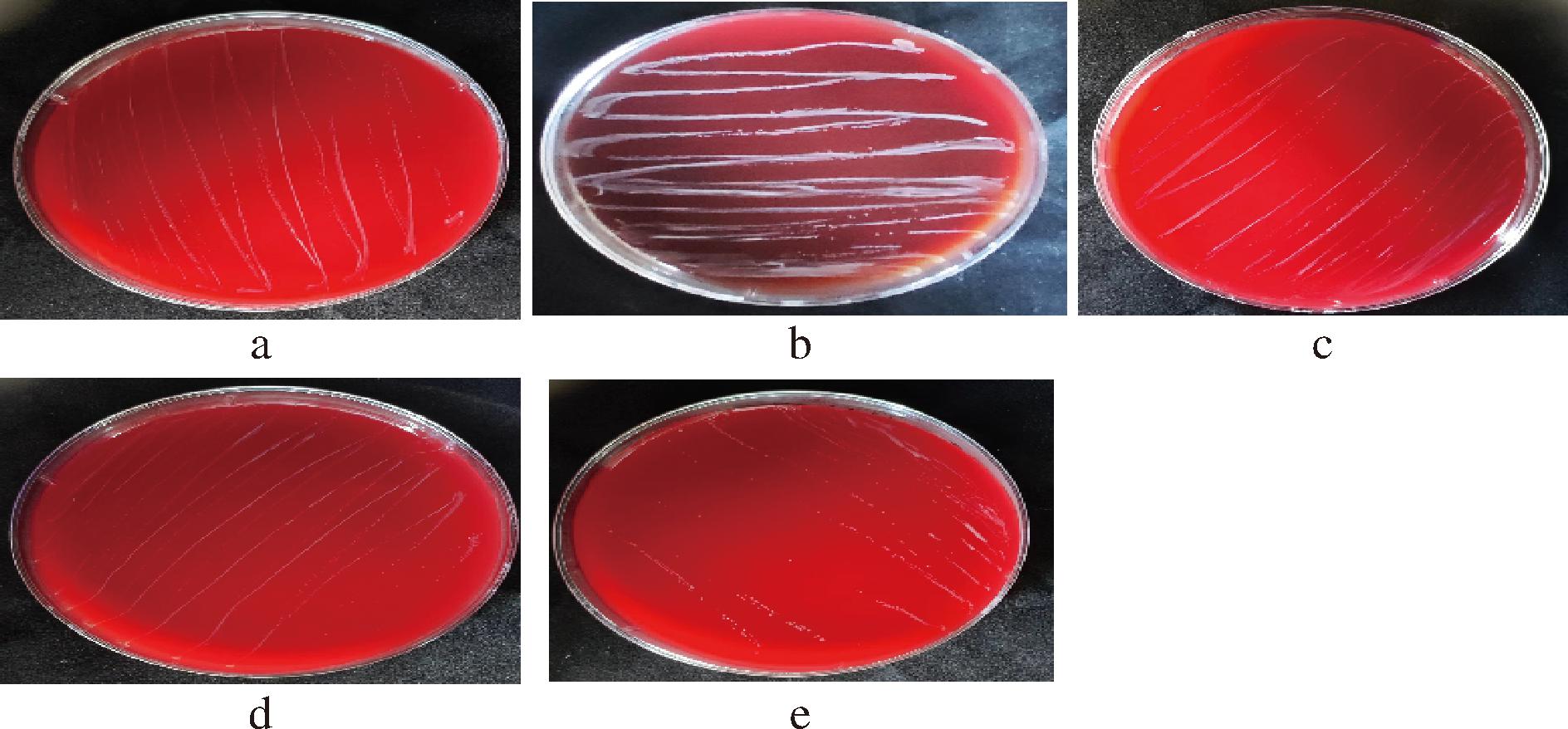
Fig.3 Results of hemolytic test of bacterial strains2.4 菌株生长能力与产酸能力
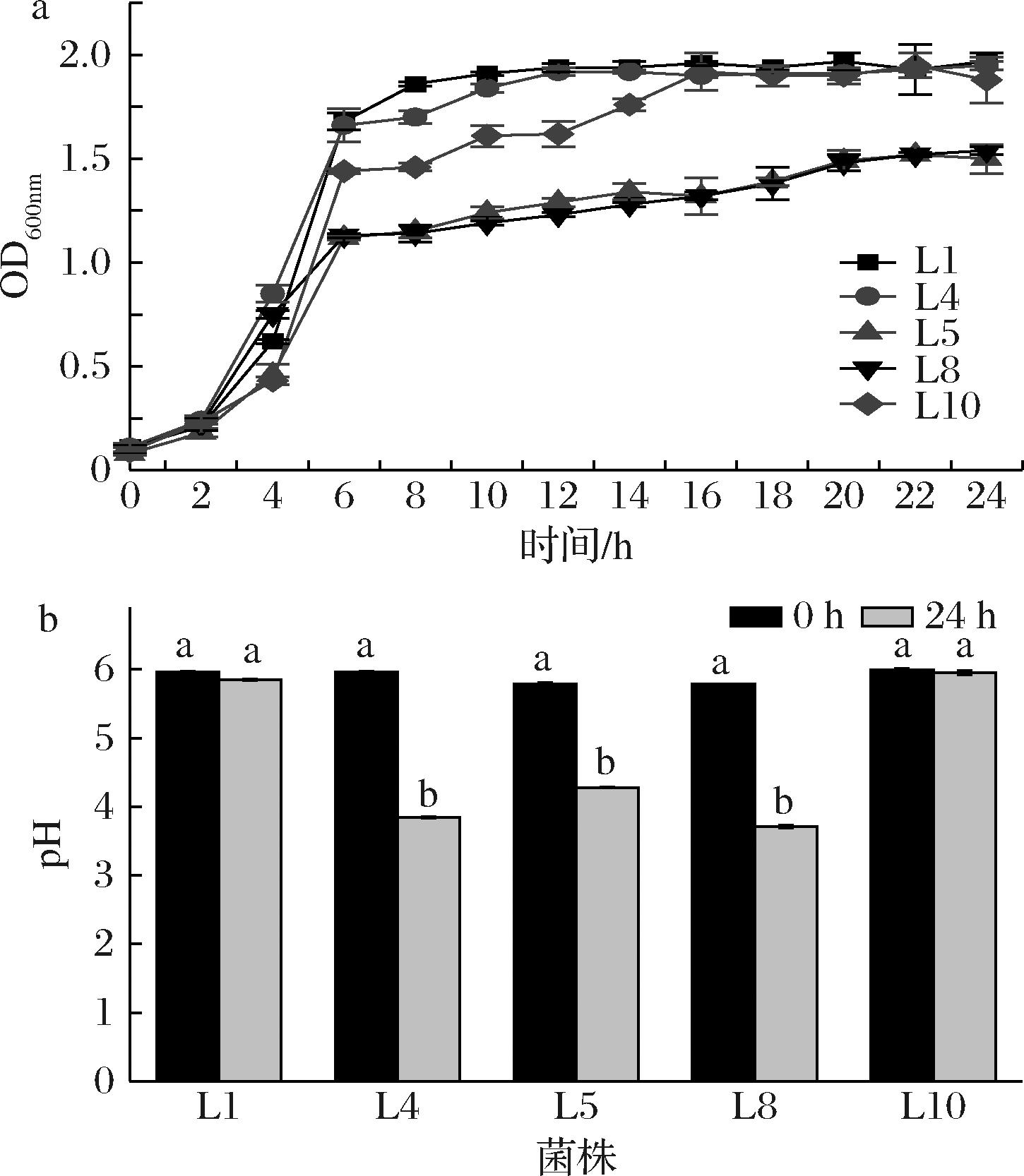
Fig.4 Growth curve and acid production capacity of the strain2.5 菌株耐受性实验
Table 2 Results of strain tolerance experiments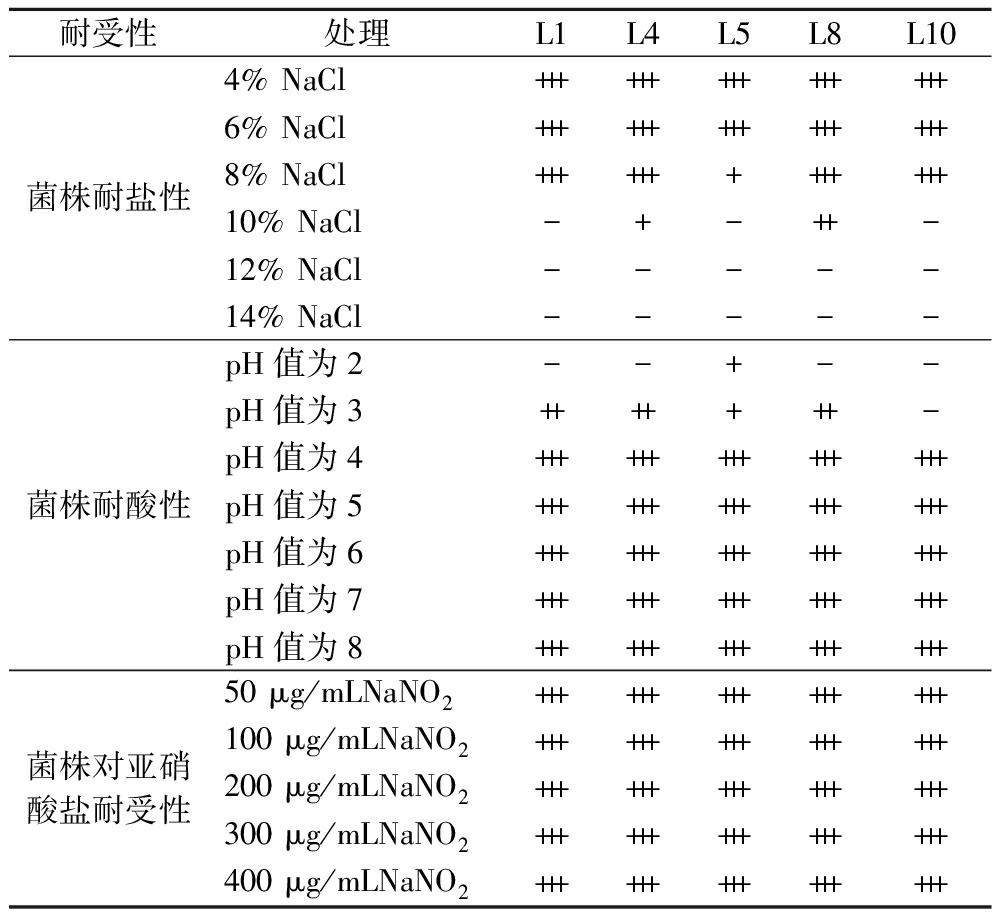
2.6 菌株亚硝酸盐降解能力
Table 3 Nitrite degradation rate of each strain after 24 h of incubation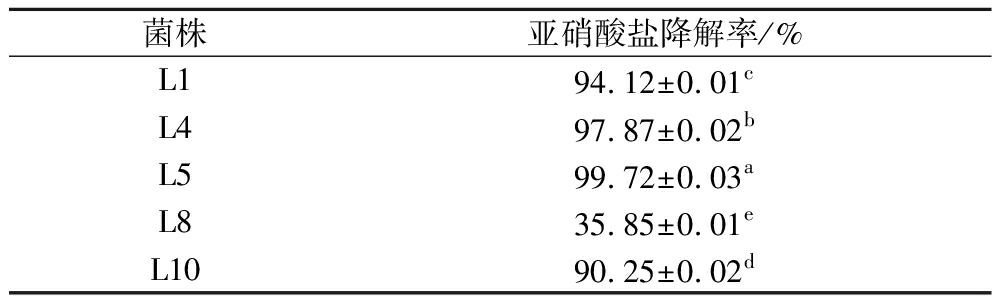
2.7 菌株发酵性能的综合评价
Table 4 Comprehensive evaluation of strain performance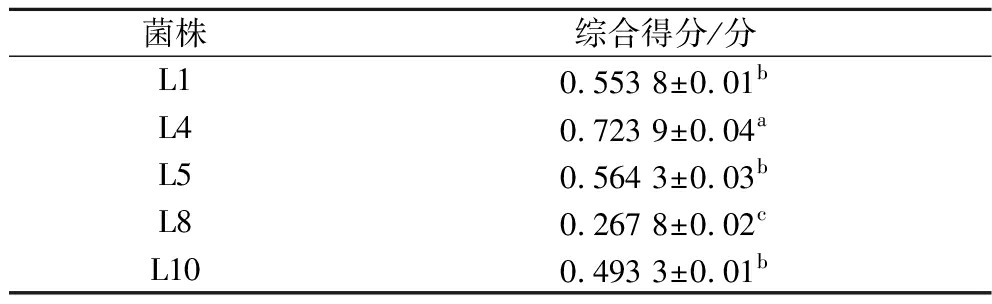
2.8 菌株发酵蔬菜品质的指标测定及感官评价
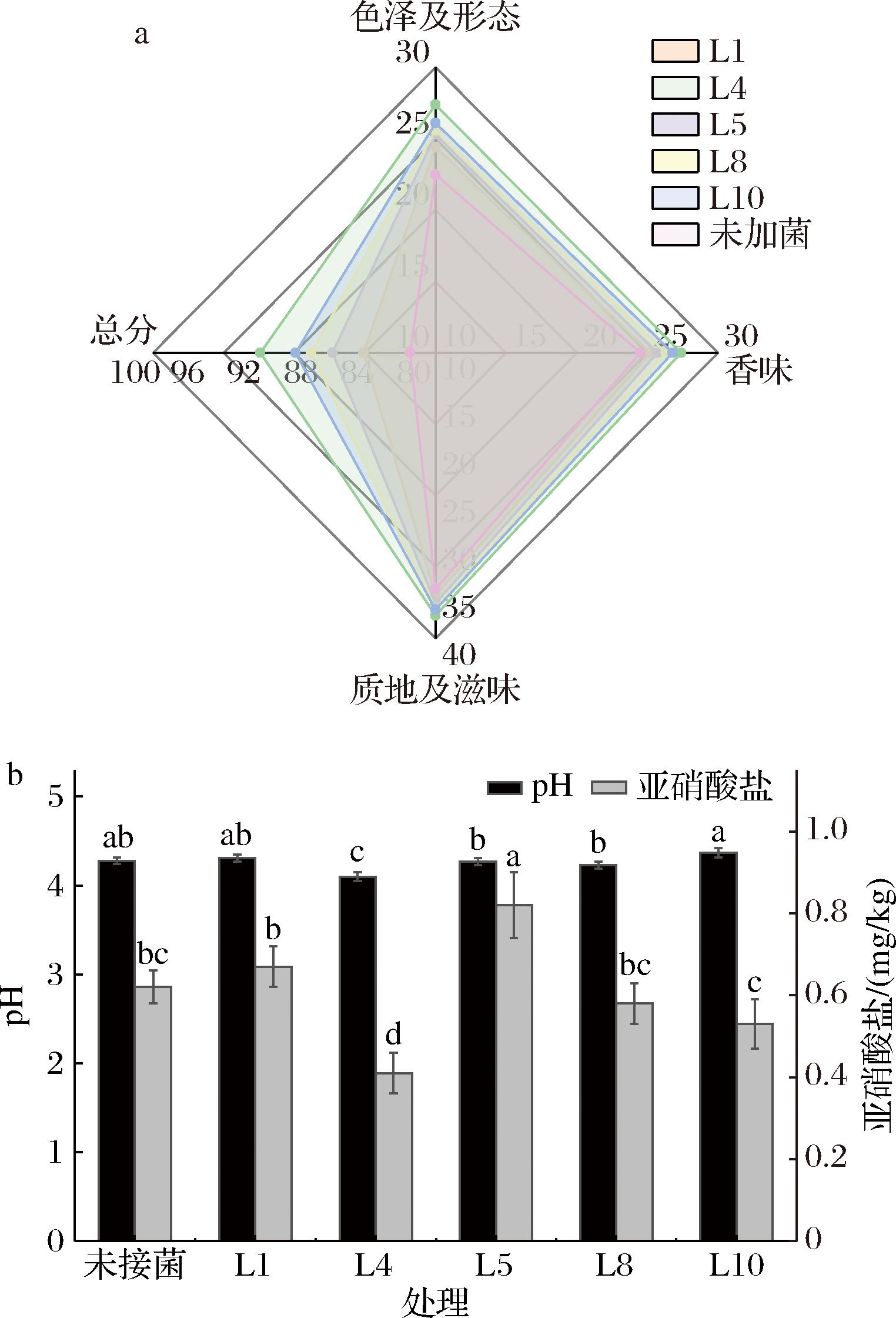
Fig.5 Results of sensory scores and physicochemical indexes of vegetable samples fermented with the strain3 结论
FENG Y L.Modern biological preparation in Sichuan pickle industrialized production application[J].China Condiment, 2011, 36(12):23-26.
ZHAO S S, YANG Y Y, ZHOU Y Y, et al.Isolation and identification of lactic acid bacteria from Guizhou pickles and its application in pickle fermentation[J].China Brewing, 2020, 39(12):113-119.
YAN P M, SONG M L, ZHAO W J.Isolation, screening and identification of bacteriostatic microorganisms in pickles of Northeast China[J].China Condiment, 2020, 45(3):53-56.
WANG R D, LI N, WEI B H, et al.Analysis of changes in organic acids in radish kimchi with different fermentation methods[J].China Seasoning, 2021, 46(5):139-43.
ZHANG W J, CHEN A T, HAN Y Q, et al.Effects of Saccharomyces cerevisiae on the fermentation of radish pickle[J].Food and Fermentation Industries, 2017, 43(8):134-137.
XIN X T, LIU D Q, ZHANG C C, et al.Screening, identification and application of high efficient nitrite degrading functional strains in Chinese characteristic fermented vegetables[J].Acta Agriculturae Zhejiangensis, 2021, 33(2):335-345.
Tang Y.Correlation analysis between flavor substances and microflora during fermentation of salted radish in different fermentation forms[D].Ya’an:Sichuan Agricultural University, 2020.
SONG X Y, XIAO Q, WANG R R, et al.Screening and identification of excellent yeasts in naturally fermented chopped chili[J].China Brewing, 2022, 41(6):69-73.
TIAN H, MA Z, CHEN J Y, et al.Fermentation characteristics of Lactobacillus brevis and Lactobacillus plantarum[J].Microbiology China, 2023, 50(2):802-814.
WANG Q X, LU J D, JIN L, et al.The influence of lactic acid bacteria strains on the flavor of pickles[J].Cereal &Food Industry, 2016, 23(1):41-46.
Yun L.Analysis of flavor characteristics of radish kimchi with different fermentation methods and screening of fermenter strains[D].Wuxi:Jiangnan University, 2020.
TANG X, ZHANG Y X, LIU W H, et al.Effects of exogenous inoculums on microbial community and volatile flavor compounds of fermented hot pepper[J].Food Science, 2023, 44(10):132-141.
XIAO H, WANG R R, CHEN M J, et al.Comparison and analysis of the flavor components of chopped peppers from farmhouses in different regions of Hunan[J].Science and Technology of Food Industry, 2022, 43(22):310-318.
BU Z B, TANG D B, WEN J, et al.Optimization of pickling processing of dried cowpea[J].Modern Food Science and Technology, 2021, 37(3):212-219; 146.
Yao J P.Screening and application of lactic acid bacteria in fermented mustard[D].Guiyang:Guizhou University, 2021.
HU J Y, YUAN L, CHEN Y, et al.Ecological safety assessment of Dishui Lake and its diversion channels based on PSR model[J].Transactions of Oceanology and Limnology, 2023, 45(6):133-141.
SUN S, CHEN Z G, YU Y X, et al.Screening and characteristics of lactic acid bacteria with laxative function from Guizhou Paocai[J].China Brewing, 2021, 40(10):76-82.
MA B, LIU W, XIE R R, et al.Investigation on the sampling method and observation conditions of lactic acid bacteria by scanning electron microscopy[J].Inner Mongolia Science and Economy, 2012(2):116-9.
MA W R, SUN Z W, SHI J, et al.Screening and safety evaluation of ethyl acetate-producing mutant of non-Saccharomyces yeast Nakazawaea ishiwadae GDMCC 60786[J].Food Science, 2023, 44(10):165-172.
HU C H, YANG X, GUO Q Y, et al.Comparison of lactic acid bacteria isolation and fermentation characteristics in radish kimchi mother water[J].Food and Fermentation Industries,2023,49(23):111-118.
ZHANG L, ZHU N.Research on evaluation of high-quality development of manufacturing industry in the central region of China based on entropy value method[J].Journal of Xiangtan University (Philosophy and Social Sciences), 2022, 46(5):46-51.
CHEN G.Quality evaluation and standard discussion of Chinese pickle[J].Science and Technology of Food Industry, 2009, 30(2):335-338.
Liu N.Research on the mechanism of flavor formation of rice sour characteristics in the co-fermentation of lactic acid bacteria and yeast[D].Guiyang:Guizhou University, 2021.
LUO Q, LI X Y, CHEN L H, et al.Composition of lactic acid bacteria in traditional Chinese pickles and analysis of acid production and acid tolerance characteristics of excellent strains[J].Food Science, 2021, 42(2):158-163.
ZHOU Y P, XIONG Z, LI X W, et al.Effects of different salt concentration on the fermentation of Xinping pickled mustard[J].China Condiment, 2021, 46(5):13-17.
YUAN L M, BIAN M H, LI Z T, et al.Isolation and identification of Lactobacillus of traditional yi sauerkraut juice in western Sichuan and analysis of its characteristics[J].China Condiment, 2019, 44(2):24-28.
ZHAO Y, LIU B Q, CHEN J F, et al.Effect of compound fermentation of Streptomyces sp.and Lactobacillus sp.on the quality of low-salt pickled radish[J].Science and Technology of Food Industry, 2024, 45(11):102-109.
HUANG Y L, ZHAO N, HUANG Q, et al.Research progress in formation mechanism and influencing factors of flavor compounds in fermented vegetables[J].Food and Fermentation Industries, 2021, 47(24):279-285.