随着人们生活水平和健康观念的提高,低热量甜味剂正在逐步取代传统甜味剂。糖醇是一类多元醇,通过将糖分子上的醛或酮基还原为羟基而成,在食品工业中常用作代糖、保湿剂和填充剂,山梨醇、甘露醇等常见糖醇具有调节肠胃功能、预防龋齿及增强机体免疫功能等作用[1]。然而,在实践过程中发现,山梨醇和甘氨酸的混合体系经过高温加工或长期储存后其表观色泽往往呈现褐变。这会影响浅色产品(如乳制品、糖果和饮料)的商业价值,导致消费者接受程度下降。因此,研究糖醇-氨基酸体系褐变反应的影响因素及机理具有重要意义。
前期研究发现,甘氨酸的存在可以促进山梨醇向葡萄糖的转化,并与其发生美拉德反应诱导体系的褐变[2]。美拉德反应是一种常见的羰氨反应,终产物为类黑素等棕色大分子物质[3]。氨基酸是美拉德反应的底物,其种类是影响美拉德反应的重要因素,这与氨基酸上携带的特定基团及氨基数目相关[4]。在美拉德反应的初始阶段,还原糖的羰基与氨基之间进行加成,加成物迅速失去一分子水转化为席夫碱,因而氨基酸上氨基数目的多寡与氨基位置会影响反应速率[5]。含有两个氨基的赖氨酸进行美拉德反应的活性高于甘氨酸[6]。而三甲基甘氨酸(甜菜碱)也被证明具有美拉德反应的潜力[7]。除氨基酸外,还原糖通常被认为是美拉德反应的另一种底物,提供美拉德反应必要的羰基。一般认为,几乎所有的糖醇都不易发生褐变反应,这是因为糖醇的结构中没有羰基来引发美拉德反应。食品级糖醇中含有的少量还原糖杂质,可能会作为美拉德反应的底物;糖醇也可能通过脱氢转化为还原糖,在无催化剂和非生物环境下发生糖醇逆向转化的报道仅限于甘氨酸-山梨醇的热反应体系[2]。然而,迄今为止,关于不同氨基酸与糖醇底物对褐变反应的影响及相应机制尚未明晰。
本文基于代表性的氨基酸/糖醇模拟体系,以类黑素形成的关键中间物为指标,借助液-质联用、荧光光谱、高压离子色谱等方法,考察在高温加速条件下,不同氨基酸(甘氨酸、赖氨酸、三甲基甘氨酸)与糖醇(甘露醇、山梨醇)体系中反应底物、中间产物和终产物积累量的差异,阐明氨基酸与糖醇的化学结构对该体系褐变的影响,以期为含糖醇和氨基酸产品的合理配方设计提供科学依据。
1 材料与方法
1.1 实验材料
山梨醇、甘露醇、三甲基甘氨酸(纯度99.8%)、3-脱氧葡萄糖醛酮(3-deoxyglucoaldehyde ketone,3-DG,分析纯),中国北京百灵威化工有限公司;乙二醛(glyoxal,GO,40%)、2, 3-丁二酮(2, 3-butanedione,2, 3-BD, 0.981 g/mL),美国Sigma-Aldrich公司;丙酮醛(methyl-glyoxal,MGO, 40%),日本TIC公司;甘氨酸、赖氨酸、葡萄糖、果糖(分析纯),国药集团化学试剂有限公司;N-(2-羟乙基)哌嗪-N-(2-乙磺酸)[N- (2-hydroxyethyl) piperazine-N-(2-ethanesulfonic acid),HEPES](分析纯),上海源叶生物科技有限公司;二乙烯三胺五乙酸(分析纯),上海阿拉丁生化科技有限公司;邻苯二胺(分析纯),上海亿恩化工科技有限公司。
1.2 仪器与设备
电子天平、pH计,梅特勒-托利多(上海)有限公司;SB-5200DTN型超声波清洗机,宁波新芝生物科技股份有限公司;UV-1600型紫外-可见光分光光度计,上海美谱达仪器有限公司;Fluoro Max4型荧光光谱仪,日本日立公司;UPLC-TQD型超高效液相色谱-质谱联用仪,美国沃特斯公司;DIONEXICS-5000+SP-5型高压离子色谱仪,美国赛默飞世尔科技有限公司。
1.3 实验方法
1.3.1 不同氨基酸与糖醇模拟体系的制备
在去离子水中分别配制含有0.25 mol/L氨基酸(甘氨酸、赖氨酸、三甲基甘氨酸)、1.25 mol/L糖醇(山梨醇、甘露醇)的溶液[3]。用HCl(2.00 mol/L)和NaOH(2.00 mol/L)溶液调节pH值至6.80。将溶液转移到耐压反应瓶中,在120 ℃油浴中加热2 h,随后取出样品,用冰水冷却停止反应,制得不同氨基酸与糖醇反应的模拟体系。
1.3.2 褐变指数的测定
取1.3.1节制备的样品溶液2 mL,置于比色皿中,用紫外-可见分光光度计在420 nm处测定吸光度,即得样品褐变指数。
1.3.3 无色中间产物积累量的测定
由于量程限制,将1.3.1节制备的样品溶液稀释至原有浓度的1/10,取2 mL,置于石英比色皿中,用紫外-可见分光光度计在294 nm处测定吸光度[8]。
1.3.4 荧光强度的测定
取1.3.1节制备的样品溶液2 mL,置于比色皿中,使用荧光光谱仪测定反应溶液中荧光物质的强度。激发波长为347 nm,发射范围为400~600 nm[9]。光电倍增管电压为650 V,扫描速度为240 nm/min,狭缝宽度为5 nm。
1.3.5 还原糖含量的测定
通过高压离子色谱法测定包括葡萄糖、果糖在内的还原糖含量,使用PA20柱进行梯度洗脱,流动相A与B分别为0.1 mol/L醋酸钠溶液和250 mmol/L NaOH溶液。色谱方法设置如下:在0~13 min为2%(体积分数)的NaOH溶液,在13~14 min从2%(体积分数)的NaOH到80%(体积分数)的NaOH的线性梯度,在14~23 min保持80%(体积分数)的NaOH至结束。流速为10.5 mL/min,进样量为10 μL。葡萄糖的标准曲线为y=0.617 9x+0.068 8(R2=0.999 6),果糖的标准曲线为y=0.875 9x+1.332 6(R2=0.999 5),其中x为还原糖浓度,y为峰面积,线性质量浓度范围为5~100 μg/mL。
1.3.6 α-二羰基化合物(α-dicarbonyl compounds,α-DCs)的鉴定与定量分析
为探索反应途径和过程,采用高效液相色谱-质谱联用法对二羰基衍生物GO、MGO、2, 3-BD及3-DG进行了检测。选择配备电喷雾电离(electrospray ionization,ESI)的超高效液相色谱和三重四极杆质谱仪测定。α-DCs的衍生参考文献[10],并稍作修改。将1 mol/L 邻苯二胺(O-phenylenediamine,OPD,4.6 mmol)和二乙烯三胺五乙酸(diethylenetriamine pentaacetic acid,DTPA,1.1 mmol)分别溶解于100 mL HEPES缓冲液中,在黑暗中制得衍生液。
色谱分析参照文献[11]进行,稍作修改。采用配备ESI并与三重四极杆质谱仪结合的超高效液相色谱法,质谱采用电喷雾正离子(ESI+)模式,采用多反应监测(multiple response monitoring,MRM)模式检测。采集ESI源参数:入口电位=30 V(3-DG);35 V(GO、2, 3-BD);45 V(MGO),碰撞能量=30 V(GO、MGO、2, 3-BD);25 V(3-DG),喷雾电压5 500 V,离子源温度600 ℃,源气流量15 L/min,辅助气流量18 L/min。用于分析4种α-DCs的MS/MS离子信息如下:GO:母离子m/z为131,其子离子包括m/z为92的定量离子、m/z为65的定性离子;MGO:母离子m/z为145,其子离子包括m/z为91.7的定量离子、m/z为65的定性离子;2, 3-BD:母离子m/z为159,其子离子包括m/z为117.5的定量离子、m/z为79的定性离子;3-DG:母离子m/z为235.1,其子离子包括m/z为217.1的定量离子、m/z为199.1的定性离子、m/z为181.1的定性离子。
配制GO、MGO、2,3-BD和3-DG标准储备液各2 mL,质量浓度均为100 mg/L。然后分别加入OPD溶液(1%,体积分数)并稀释至6 mL,避光衍生化处理4 h。配制浓度为2 mmol/L的3-DG衍生物、喹喔啉(GO衍生物)、2-甲基喹喔啉(MGO衍生物)和2, 3-BD衍生物标准储备液2 mL,分别稀释至0.05、0.1、0.5、1、2、5、10 mg/mL,涡旋混匀,过0.22 μm有机滤膜。采用超高效液相四级杆串联质谱仪(ultra high performance liquid chromatography tandem quadrupole mass spectrometer, UPLC-TQD-MS)进行定量检测,标准曲线确定为(GO:y=95.98x+194.5,R2=0.999 1;MGO:y=745.18x-2 071.7,R2=0.999 5;2, 3-BD:y=1 952.4x-4 303.7,R2=0.999 7,3-DG:y=10 116x-3 360.5,R2=0.999 3;其中x为浓度,y为峰面积)。将0.05 mmol/L的标准溶液逐级稀释并衍生化,得到了4种待测物质的检出限。
1.4 数据统计分析
实验数据至少重复3次,结果以“平均值±标准差”表示。采用SPSS 20.0软件(IBM Co.,Armonk, NY, USA)进行单因素方差分析和Tukey检验,分析样本间的差异,P<0.05为样本间差异有统计学意义。
2 结果与分析
2.1 氨基酸与糖醇结构对体系褐变指数及无色中间产物积累量的影响
氨基酸与糖醇体系的褐变主要是由糖醇的氧化以及美拉德反应引起[2]。在美拉德反应后期,中间体聚合并形成类黑素[12],导致反应体系褐变,这可以通过420 nm处的吸光度(褐变指数)来表示。反应产生的褐变产物越多,吸光值越高,褐变指数越高,表明褐变反应进行得越彻底。美拉德反应过程中会产生一些中间产物,一般为无色或浅色,通常伴随着294 nm处吸光度的线性增加。分别测定甘氨酸、赖氨酸、三甲基甘氨酸与甘露醇以及山梨醇加速反应后的褐变指数及无色中间产物的含量,结果如图1所示。
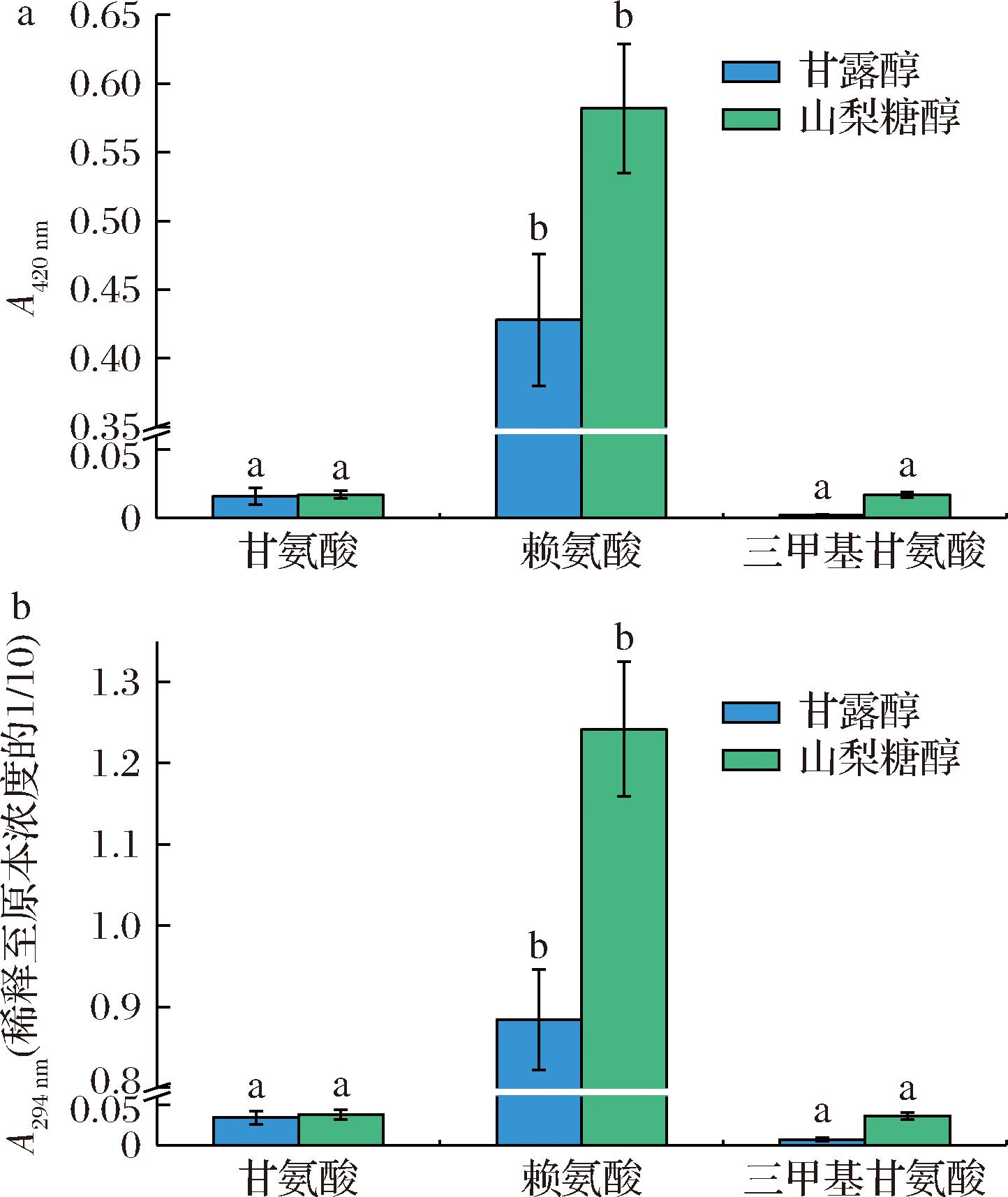
a-不同氨基酸-糖醇体系在420 nm下的吸光度;b-不同氨基酸-糖醇体系在294 nm下的吸光度
图1 不同氨基酸与糖醇体系经热处理后的褐变程度及无色中间产物积累量
Fig.1 Degree of browning and accumulation of colorless intermediates in different amino acid and sugar alcohol systems after heat treatment
注:上标小写字母不同表示同波长下差异显著(P<0.05)。
由图1-a可知,对于同一种糖醇,赖氨酸与其在120 ℃热处理2 h后,A420nm明显高于甘氨酸与三甲基甘氨酸,褐变反应较为显著,甘氨酸组褐变指数较为微弱,而三甲基甘氨酸组几乎没有产生任何褐变。以甘露醇与不同氨基酸组为例,甘露醇-赖氨酸的褐变指数(0.428)比甘露醇-三甲基甘氨酸高出200倍,而这种趋势在甘露醇与山梨醇组中表现一致。对于不同糖醇,山梨醇-赖氨酸的褐变指数(0.584)约是甘露醇-赖氨酸褐变指数的1.5倍,褐变指数均呈现出山梨醇>甘露醇的趋势;对于不同氨基酸,赖氨酸较甘氨酸与三甲基甘氨酸更能促进美拉德反应的进行,导致系统中形成更多的棕色物质。这可能与糖醇和氨基酸的结构差异有关。
通过比较图1-b中的A294nm的差异可见,体系无色中间产物整体变化趋势与褐变指数一致,呈现出赖氨酸组高于甘氨酸与三甲基甘氨酸组、山梨醇组高于甘露醇组的规律。其中,山梨醇-赖氨酸组加速反应后产物在294 nm处的吸光度为1.242,而甘露醇-赖氨酸组相应的吸光度为0.884,也呈现出近似1.5倍的关系。294 nm处的吸收峰代表了低分子质量杂环物的聚集[13],这些无色中间产物主要由糖基化反应产生的小分子醛类和酮类组成[14]。这进一步证明在氨基酸的存在下,糖醇可能发生了诸如脱水、氧化等反应转化为还原糖,还原糖与氨基酸不断参加美拉德反应,进一步促进了中间产物和终产物的积累。
2.2 氨基酸与糖醇结构对体系荧光强度的影响
美拉德反应的初始阶段在近紫外不会产生有色物质或荧光物质,长时间加热后,重排产物发生脱水和裂变,产生无色还原酮以及荧光物质。这些荧光物质是羰基化合物,是美拉德褐变最终产物的前体。研究发现,美拉德反应体系的荧光强度与体系褐变程度几乎成线性关系[15]。因此,为进一步明确不同氨基酸/糖醇对体系美拉德反应进程的影响,分别测定了各体系的荧光强度,结果如图2所示。
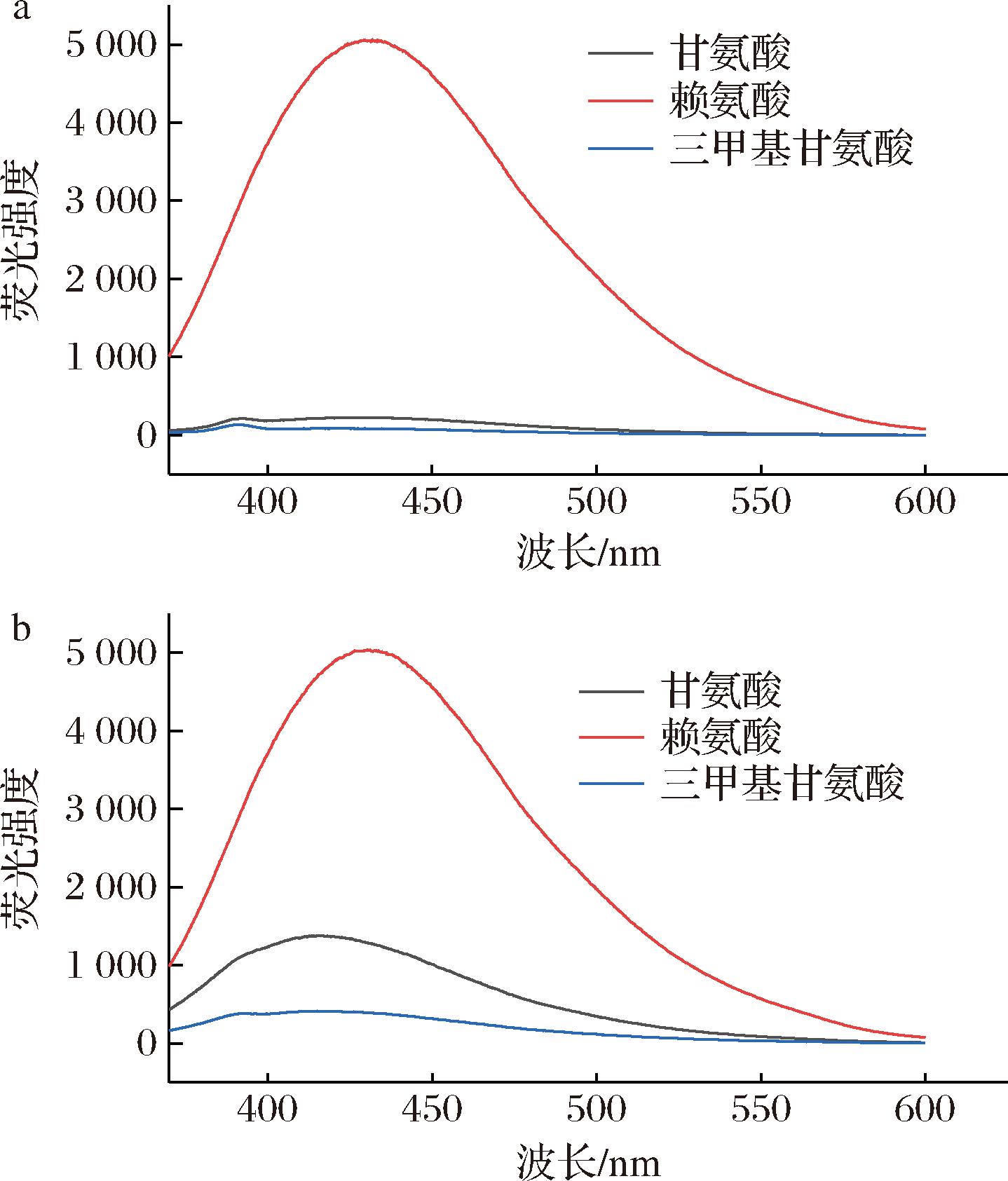
a-甘露醇与不同氨基酸;b-山梨醇与不同氨基酸
图2 不同氨基酸与糖醇体系经热处理后的荧光光谱
Fig.2 Fluorescence spectra of different amino acid and sugar alcohol systems after heat treatment
据报道,美拉德反应荧光产物的最大激发值在340~370 nm,最大发射波长在420~450 nm[14]。图2所示的荧光发光谱中,赖氨酸组皆符合这一特征。赖氨酸-糖醇组荧光强度的峰值在5 500左右。三甲基甘氨酸组的整体荧光物质含量较少,未呈现明显的荧光强度峰值,这与其褐变指数及无色中间产物的含量相符。其中,山梨醇-甘氨酸组有一定荧光物质积累,峰值在1 200左右,而甘露醇-甘氨酸组则没有明显的荧光物质积累,这证明糖醇对体系荧光物质积累有较显著的影响,整体依然呈现山梨醇>甘露醇的规律。美拉德反应的荧光产物由多种含氮化合物组成,其氮原子都来源于氨基反应物[16],在本体系中即氨基酸,因此,氨基酸中氨基的多寡与荧光物质的含量息息相关。甘氨酸中只含有一个氨基,赖氨酸中含有两个氨基,而三甲基甘氨酸则没有氨基,这可能是3种体系中荧光产物积累量出现显著差异的原因。
2.3 氨基酸与糖醇结构对体系还原糖转化的影响
为了证明糖醇的转化以及氨基酸对褐变反应途径的影响,采用高压离子色谱法分析了120 ℃加热2 h的模型体系中葡萄糖和果糖的含量,结果如图3所示。通过比较发现,甘露醇、山梨醇与氨基酸共混体系热处理后均有不同含量的还原糖,介于0.017~1.234 mg/L,而且赖氨酸组>甘氨酸组>三甲基甘氨酸组。山梨醇通常通过催化加氢或电解还原葡萄糖来生产,食品级山梨醇中含有少量还原糖杂质(≤0.21%),甘露醇的商业化生产主要依靠化学催化剂在高温高压下催化果糖或葡萄糖加氢来完成[17],食品级甘露醇中还原糖的含量≤0.3%。如果糖醇在系统中是稳定的,氨基酸会很快耗尽系统中现有的还原糖,并达到反应的终点,美拉德反应褐变最明显的赖氨酸组测得的还原糖含量应最少,但研究结果显示赖氨酸组的还原糖残留量最高,明显高于反应前,这表明在反应过程中糖醇发生了转化形成了还原糖。几乎没有褐变反应的三甲基甘氨酸组中极少有还原糖残留,说明糖醇与三甲基甘氨酸共存加热不会发生脱水转化反应,这可能源于氨基酸对糖醇转化的诱导作用[2]。
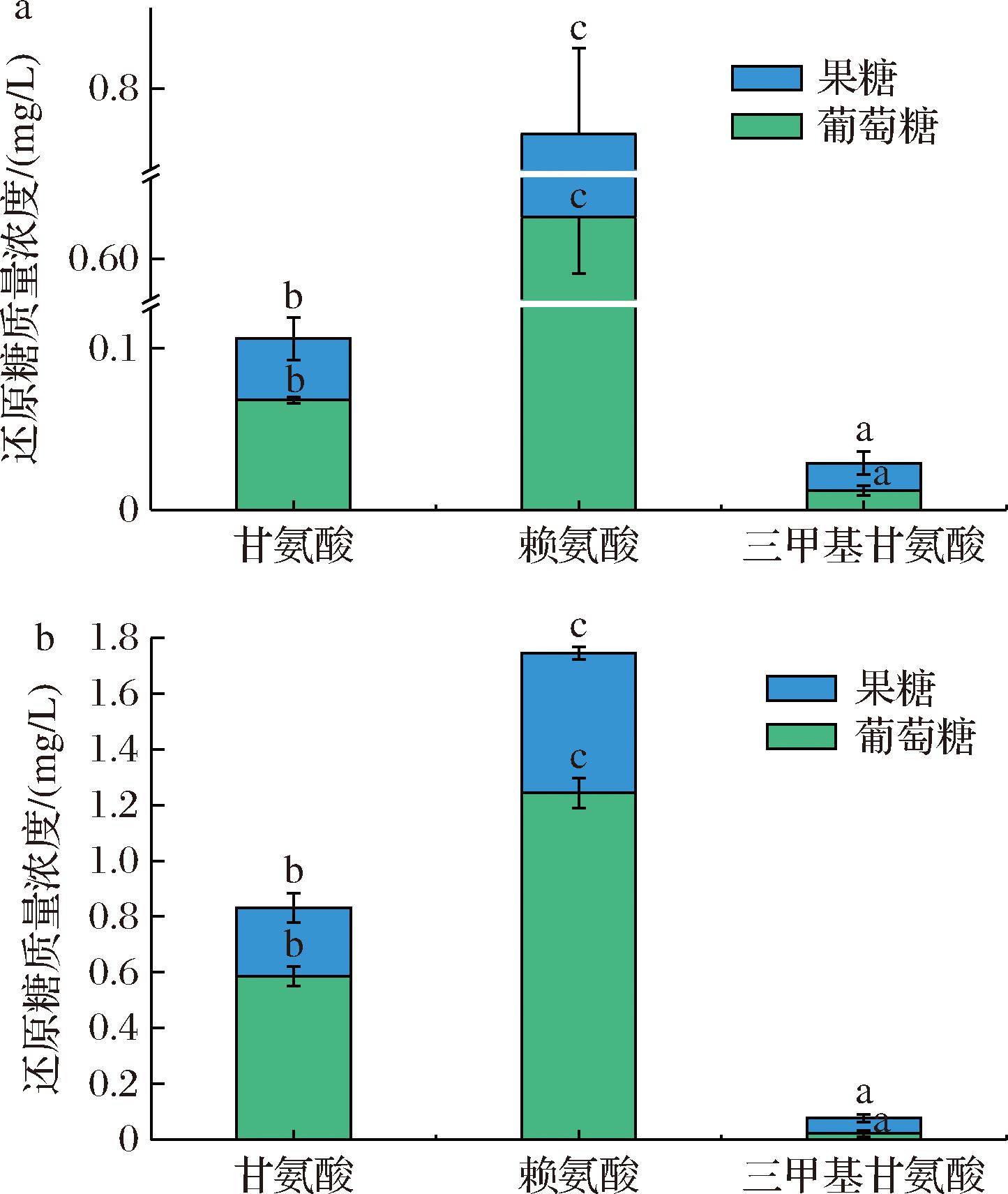
a-甘露醇与不同氨基酸;b-山梨醇与不同氨基酸
图3 不同氨基酸与糖醇体系经热处理后还原糖的含量
Fig.3 Reducing sugar content of different amino acid and sugar alcohol systems after heat treatment
注:上标小写字母不同表示同种测定物质(葡萄糖/果糖)差异显著(P<0.05)。
甘露醇在水热条件下的分解已经被广泛研究,在170 ℃的条件下,甘露醇的分解速度远高于葡萄糖,生成5-羟甲基糠醛等环状化合物[18]。而水热条件下山梨醇的分解是一个两步反应,脱水生成异山梨醇,随后氧化[13]。一些研究人员进一步阐明了山梨醇在高温下分解的途径,山梨醇首先脱水生成无水D-山梨醇(anhydrous D-sorbitol,AHSO),然后1, 4-AHSO逐渐转化为异山梨醇[19]。因此,当与氨基酸共存时,糖醇在水热条件下可能发生了环化,然后逐步水解或氧化为葡萄糖,使羰基暴露出来,并与甘氨酸、赖氨酸沿着传统的美拉德反应路径继续进行羰氨加成反应。
由图3可知,山梨醇转化为葡萄糖的效率明显高于甘露醇。以反应最明显的赖氨酸-糖醇组为例,赖氨酸-甘露醇的还原糖残留总量为0.772 mg/L,而赖氨酸-山梨醇的还原糖残留总量为1.744 mg/L,相差两倍以上,这可能与二者的空间结构相关。据文献报道,山梨醇分解的速率高于甘露醇[20],这与两种物质C2的取向有关;在水热条件下,水分子攻击碳原子激发糖醇的分解,山梨醇碳原子C3~C5上的羟基在分子的同一侧,因此允许水分子从另一侧进行攻击;相反,甘露醇中附着在C5上的羟基阻止了水分子的攻击,从而减慢了糖醇的分解速度[21]。
研究结果显示,糖醇与氨基酸共混体系热处理后积累的大部分还原糖为葡萄糖,同时也检测到部分果糖,这可能来自葡萄糖的异构化效应。葡萄糖和果糖是彼此的异构体。先前的研究表明,葡萄糖在偏酸性环境(pH<7)中异构化为果糖[22]。反应模型体系呈弱酸性,因此异构化是可能的。在典型美拉德反应中,葡萄糖的反应速度比果糖快,这是因为前者有更多开放形式的活性醛基团,但葡萄糖的美拉德反应有一个明显的诱导期[23]。果糖的初始褐变比葡萄糖发生得更快,这是由于果糖的羰基位于比葡萄糖更有利的位置,更容易形成1,2-烯二醇中间体。
2.4 氨基酸与糖醇结构与体系中α-二羰基化合物形成及积累的关系
美拉德反应的棕色终产物类黑素是通过α-DCs的环化和缩合形成。α-DCs是一类具有两个邻位羰基的化合物,性质活泼,可通过糖的热裂解和美拉德反应的中期阶段产生[23]。α-DCs的定性定量分析可以推测美拉德反应进行的阶段、强度和方向,选择4种特征性α-DCs包括GO、MGO、2,3- BD和3-DG进行分析。
由图4可知,α-DCs总含量呈现赖氨酸>甘氨酸>三甲基甘氨酸的规律,这可能与氨基酸中氨基的数量的多少密切相关。已有研究证实,氨基酸种类对美拉德反应的影响是显著的,这主要取决于氨基的位置及碳链的长短,通常氨基在ε位或碳链末端的氨基酸反应速率高于氨基在α位的氨基酸,短链氨基酸的反应速率大于长链氨基酸[24]。该规律在本文研究的糖醇体系中同样得到了体现,拥有两个氨基且有一个氨基位于ε位的赖氨酸反应程度明显高于甘氨酸,而三甲基甘氨酸则因为没有暴露在体系中的氨基,反应程度极其微弱。
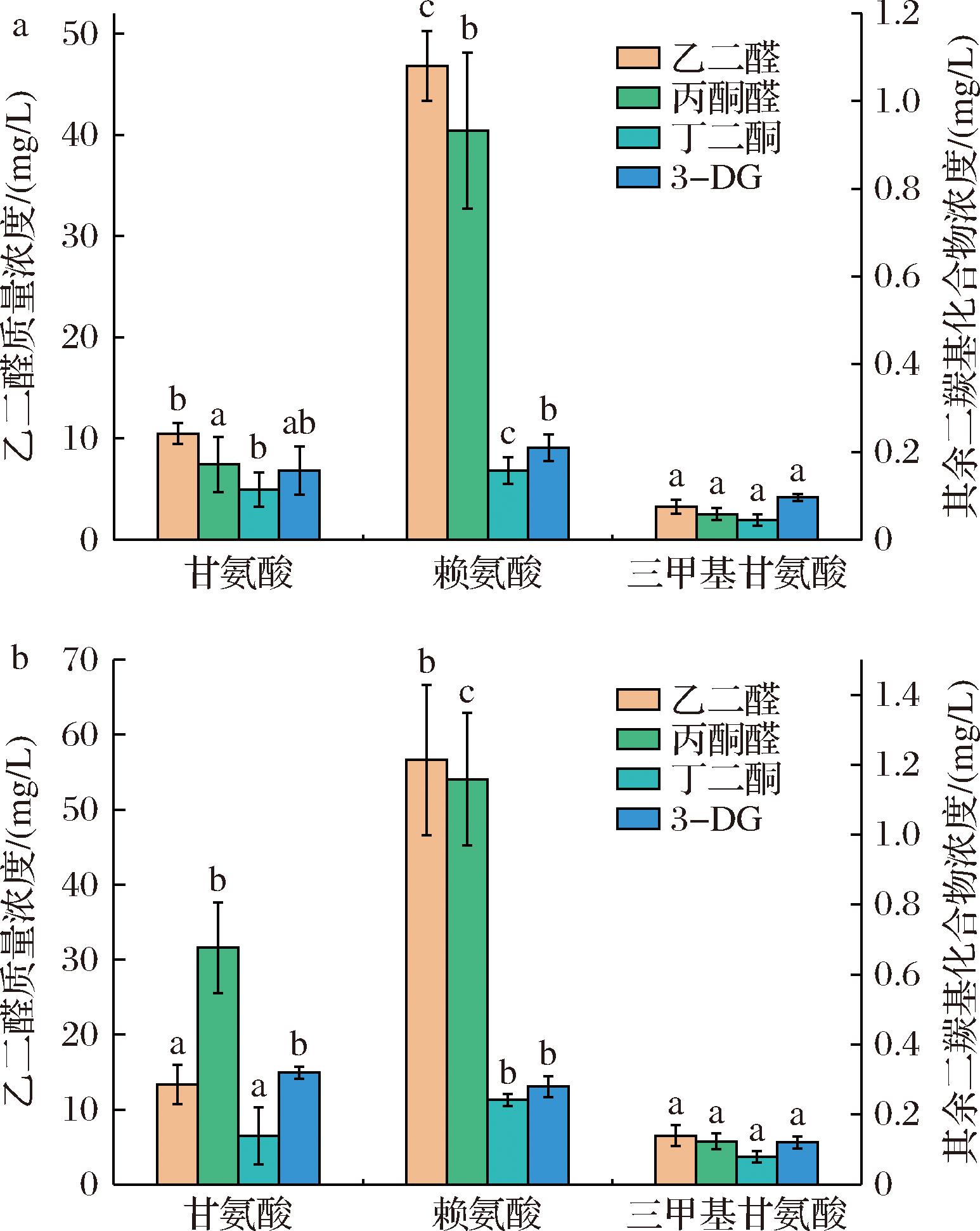
a-甘露醇与不同氨基酸;b-山梨醇与不同氨基酸
图4 不同氨基酸与糖醇经热处理后体系α-二羰基化合物含量
Fig.4 Content of α-dicarbonyl compounds in the system of different amino acids and sugar alcohols after heat treatment
注:上标小写字母不同表示同种测定物质(GO/MGO/2, 3-BD/3-DG)差异显著(P<0.05)。
由图4可知,每一组模拟体系中GO的含量均超过其余3种α-DCs。GO是由醛糖或相应的亚胺发生逆缩醛反应形成的,MGO来源于Amadori产物的反向羟基醇缩合,其含量在美拉德反应结束时趋于稳定,以上2种α-二羰基化合物的含量均与褐变趋势一致。而3-DG与2, 3-BD的含量差异并不大,这与二者生成与消耗的反应路径相关。3-DG是MGO形成的前体,也是一种敏感的特异性美拉德反应中间产物[25],在还原糖与赖氨酸反应的过程中,美拉德反应程度更高,促使3-DG更多向MGO转化。这在山梨醇体系中表现得更为明显(图4-b),其与甘氨酸热反应后积累的3-DG含量为0.32 mg/L,大于相应的赖氨酸体系,表明甘氨酸组中3-DG转化程度更低。氨基酸与糖醇体系中,还原糖以葡萄糖为主,一个葡萄糖分子更容易分裂成两个MGO分子,2, 3- BD的产生需要更苛刻的条件,因此在本研究中是最不丰富的。
3 结论
本文基于甘氨酸/赖氨酸/三甲基甘氨酸与甘露醇/山梨醇的模拟体系,明确了氨基酸与糖醇的化学结构对其褐变反应的影响及其原因。在甘氨酸/赖氨酸的作用下,糖醇脱水后转化生成还原糖(葡萄糖/果糖),暴露羰基与氨基酸发生美拉德反应生成α- DCs,如GO、MGO、2, 3-BD、3-DG等,随后形成深色类黑素,导致颜色褐变。而三甲基甘氨酸并不能诱导糖醇脱水转化为还原糖。通过对体系褐变指数、无色中间产物、荧光物质、还原糖残留量及二羰基化合物积累量的综合分析表明,山梨醇体系的褐变程度高于甘露醇,这与甘露醇与山梨醇C2取向及羟基分子排布有关。赖氨酸体系的褐变程度高于甘氨酸又远高于三甲基甘氨酸,这与赖氨酸含有更多氨基酸数量及氨基位于ε位有关。因此,在含糖醇和氨基酸产品的配方选择中,可基于体系色泽变化的接受性进行合理的配伍。
[1] 曹媛, 李瑛, 杜小霞, 等.功能糖和糖醇的特性与应用[J].饮料工业, 2022, 25(4):74-80.
CAO Y, LI Y, DU X X, et al.Characteristics and application of functional sugar &alditol[J].Beverage Industry, 2022, 25(4):74-80.
[2] HUANG X T, FENG T T, CUI H P, et al.Analysis of the browning reaction in a sorbitol/glycine model:Formation and degradation of precursors, glucose and α-dicarbonyl compounds during heating[J].Food Research International, 2024, 177:113870.
[3] 龚平, 阚建全.美拉德反应产物性质的研究进展[J].食品与发酵工业, 2009, 35(4):141-146.
GONG P, KAN J Q.Study on the progress of Maillard reaction products[J].Food and Fermentation Industries, 2009,35(4):141-146.
[4] XU H N, ZHANG X M, KARANGWA E, et al.Correlating enzymatic browning inhibition and antioxidant ability of Maillard reaction products derived from different amino acids[J].Journal of the Science of Food and Agriculture, 2017, 97(12):4210-4218.
[5] HAN Z S, ZHU M T, WAN X C, et al.Food polyphenols and Maillard reaction:Regulation effect and chemical mechanism[J].Critical Reviews in Food Science and Nutrition, 2024, 64(15):4904-4920.
[6] LEE M K, PARK I.Inhibition of potato polyphenol oxidase by Maillard reaction product[J].Food Chemistry, 2005, 91(1):57-61.
[7] BESSAIRE T, TARRES A, STADLER R H, et al.Role of choline and Glycine betaine in the formation of N, N-dimethylpiperidinium (mepiquat) under Maillard reaction conditions[J].Food Additives &Contaminants.Part A, Chemistry, Analysis, Control, Exposure &Risk Assessment, 2014, 31(12):1949-1958.
[8] MARTINS S I F S, VAN BOEKEL M A J S.Melanoidins extinction coefficient in the glucose/Glycine Maillard reaction[J].Food Chemistry, 2003, 83(1):135-142.
[9] BOSCH L, ALEGR A A, FARRÉ R, et al.Fluorescence and color as markers for the Maillard reaction in milk-cereal based infant foods during storage[J].Food Chemistry, 2007, 105(3):1135-1143.
A A, FARRÉ R, et al.Fluorescence and color as markers for the Maillard reaction in milk-cereal based infant foods during storage[J].Food Chemistry, 2007, 105(3):1135-1143.
[10] NASHALIAN O, YAYLAYAN V A.Thermally induced oxidative decarboxylation of copper complexes of amino acids and formation of strecker aldehyde[J].Journal of Agricultural and Food Chemistry, 2014, 62(33):8518-8523.
[11] JOST T, HENNING C, HEYMANN T, et al.Comprehensive analyses of carbohydrates, 1, 2-dicarbonyl compounds, and advanced glycation end products in industrial bread making[J].Journal of Agricultural and Food Chemistry, 2021, 69(12):3720-3731.
[12] STAROWICZ M, ZIELI SKI H.How Maillard reaction influences sensorial properties (color, flavor and texture) of food products?[J].Food Reviews International, 2019, 35(8):707-725.
SKI H.How Maillard reaction influences sensorial properties (color, flavor and texture) of food products?[J].Food Reviews International, 2019, 35(8):707-725.
[13] BIRTA N, DOCA N, VLASE G, et al.Kinetic of sorbitol decomposition under non-isothermal conditions[J].Journal of Thermal Analysis and Calorimetry, 2008, 92(2):635-638.
[14] DENG W J, LUO J W, YAN X M.Maillard reaction between chitosan and xylan in ionic liquids[J].Ferroelectrics, 2020, 562(1):39-45.
[15] ETXABIDE A, KILMARTIN P A, MATÉ J I, et al.Analysis of advanced glycation end products in ribose-, glucose- and lactose-crosslinked gelatin to correlate the physical changes induced by Maillard reaction in films[J].Food Hydrocolloids, 2021, 117:106736.
[16] SHIPANOVA I N, GLOMB M A, NAGARAJ R H.Protein modification by methylglyoxal:Chemical nature and synthetic mechanism of a major fluorescent adduct[J].Archives of Biochemistry and Biophysics, 1997, 344(1):29-36.
[17] CHEN M, ZHANG W L, WU H, et al.Mannitol:Physiological functionalities, determination methods, biotechnological production, and applications[J].Applied Microbiology and Biotechnology, 2020, 104(16):6941-6951.
[18] DUANGKAEW P, INOUE S, AKI T, et al.Quantitative in situ mass spectrometry analysis of mannitol decomposition products under hydrothermal conditions[J].Energy &Fuels, 2017, 31(10):10866-10873.
[19] MOHAMAD R, AKI T, NAKASHIMADA Y, et al.Kinetics of sorbitol decomposition under hydrothermal condition[J].Journal of the Japan Petroleum Institute, 2016, 59(4):149-154.
[20] YAMAGUCHI A, HIYOSHI N, SATO O, et al.Sorbitol dehydration in high temperature liquid water[J].Green Chemistry, 2011, 13(4):873-881.
[21] LIU H M, HAN Y F, WANG N N, et al.Formation and antioxidant activity of Maillard reaction products derived from different sugar-amino acid aqueous model systems of sesame roasting[J].Journal of Oleo Science, 2020, 69(4):391-401.
[22] MUNDT S, WEDZICHA B L.A kinetic model for the glucose-fructose-Glycine browning reaction[J].Journal of Agricultural and Food Chemistry, 2003, 51(12):3651-3655.
[23] CHA J, DEBNATH T, LEE K G.Analysis of α-dicarbonyl compounds and volatiles formed in Maillard reaction model systems[J].Scientific Reports, 2019, 9(1):5325.
[24] KWAK E J, LIM S I.The effect of sugar, amino acid, metal ion, and NaCl on model Maillard reaction under pH control[J].Amino Acids, 2004, 27(1):85-90.
[25] YAYLAYAN V A, KEYHANI A.Origin of carbohydrate degradation products in L-alanine/D-13C glucose model systems[J].Journal of Agricultural and Food Chemistry, 2000, 48(6):2415-2419.