在人体内,肝脏负责大约90%的酒精(乙醇)代谢。这个过程先后经过两种酶:乙醇脱氢酶(alcohol dehydrogenase,ADH)和乙醛脱氢酶(acetaldehyde dehydrogenase,ALDH)。首先乙醇在ADH的作用下被氧化为乙醛和活性氧(reactive oxygen species,ROS),然后乙醛在ALDH的作用下进一步被氧化为乙酸(醋酸)。随后参与三羧酸循环,进一步被氧化以生成CO2和水,同时也产生了对人体各种生命活动必需的能量。尽管这个过程能有效地清除体内的乙醇,但过度或频繁的饮酒会产生大量内源性醛类物质。这些高度反应性的化合物能与DNA反应,可能引发DNA损伤和突变,从而可能导致一系列肝脏疾病,如肝脏脂肪变性、肝炎、肝硬化和肝癌。因此,适量饮酒和保持健康的生活习惯至关重要。当DNA受到醛类物质的损伤时,细胞会启动DNA交联修复和同源重组修复两种机制。DNA交联修复作为一种生物防御机制,可以防止乙醛诱发的细胞损伤。然而,当这个修复机制受到破坏时,就可能导致范可尼贫血(fanconi anemia,FA)。FA途径与乙醛解毒功能的失活可能会诱导突变,从而加速恶性肿瘤的发展[1]。不过,同源重组修复能为FA的DNA交联修复提供额外的乙醛抵抗能力[2]。
白酒中含有多种活性成分,这些成分有助于减轻酒精带来的伤害、增强人体的防御能力,这些活性成分包括多酚、酸类、吡嗪类、含硫化合物、萜烯类、酯类、呋喃类以及肽类等[3]。这些成分具有多种生物活性功能,如促进乙醇的代谢、提高饮酒后的舒适感、具有抑菌和杀菌作用、抗氧化、抗炎、抗癌[4]、预防和治疗心血管疾病等。在这一系列的活性成分中,阿魏酸作为其中之一,在白酒中的含量在0.21~6.50 μg/L[5]。
QI等[6]研究了乙醇处理的LO2肝细胞模型,发现姜黄酚可以通过阻断是微管关联蛋白1轻链3B(Microtubule-Associated Protein 1 Light Chain 3B,LC3B)与层粘连蛋白B1的相互作用来抑制肝细胞衰老。XIE等[7]研究了旋覆花次内酯(1-O-Acetylbritannilactone,ABL)对酒精诱发的人类正常肝细胞(LO2细胞)损伤的保护效果,并探究了其潜在机制。研究发现ABL能够通过调节ROS/Akt/NF-κB信号通路,来减少炎症和细胞凋亡,从而改善酒精诱导的肝毒性。任思思等[8]研究了太白楤木总皂苷(total saponins of aralia taibaiensis,TSAT)能够有效修复H2O2引起的LO2肝细胞损伤。他们证实了TSAT通过提高抗氧化酶水平、降低细胞凋亡率,从而保护细胞免受氧化应激损害。王妍凌等[9]研究了新疆葡萄酒中的酚类物质可以促进LO2细胞的自噬活性。研究使用了免疫印迹和流式细胞术等方法,初步评估了橙皮苷和表儿茶素没食子酸酯对LO2细胞自噬的潜在促进作用。
阿魏酸是一种常见的高效抗氧化天然化合物,广泛存在于各类植物中。它能够中和体内有害的自由基,从而抵御由氧化应激引起的细胞损伤和多种健康问题[10]。除此之外,阿魏酸还展现出多种生理活性,包括但不限于抗炎、抗肿瘤、抗糖尿病以及抗菌作用[11]。阿魏酸的抗癌潜力也引人注目,特别是其可以通过激活细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)和应激活化蛋白激酶(c-Jun N-terminal kinase,JNK)的磷酸化,增强凋亡途径中的关键蛋白B淋巴细胞瘤-2蛋白(B-cell lymphoma-2,BCL-2)和Bcl-2相关X蛋白(BCL2-Associated X,BAX),抑制CT26细胞的增殖并诱导凋亡[12]。此外,阿魏酸还被认为有助于维护心血管系统健康,可能有助于预防和治疗诸如高血压和动脉粥样硬化等心血管疾病[13]。
流式细胞术是一种高效、快速且定量的技术,能实现对活细胞的精确分析,产生可靠且可重复的结果。在肝脏受损的情况下,活性氧的生成通常会增加,这种变化可以通过流式细胞术进行监测。利用特定的荧光探针,例如2′,7′-二氯二氢荧光素二乙酸酯(2,7-dichlorodihydrofluorescein diacetate dye,DCFDA),可以对细胞内ROS的生成进行定性和定量评估[14]。此外,流式细胞术也可用于评估受损肝细胞的细胞周期状态,以此来判断肝细胞的再生能力和损伤程度。通过使用DNA染料,可以对细胞在G1、S和G2期的分布进行深入研究[15]。不仅如此,流式细胞术还可以检测和定量肝损伤中的细胞凋亡和坏死。利用Annexin V和PI染料或Hoechst染料,可以同时检测早期和晚期(或坏死)的凋亡细胞[16]。这些优势使流式细胞术成为一种可靠的工具,有助于研究阿魏酸对肝损伤的影响,深化对肝细胞代谢调节、细胞器更新等生理过程的理解,以及这些过程在疾病发生和发展中的关键作用。
1 材料与方法
1.1 材料与试剂
阿魏酸,上海麦克林公司;RPMI-1640培养基,美国Gibco公司;胎牛血清、胰蛋白酶、链霉素、青霉素,美国Hyclone公司;DNA Labelling Solution、Cytognos、细胞周期试剂盒、ROS试剂盒、p-H2AX一抗蛋白、GAPDH蛋白,上海碧云天生物技术有限公司;LO2人源肝细胞,中国科学院上海细胞生物学研究所。
1.2 仪器与设备
YXQ-50G立式灭菌锅,上海博迅生物仪器股份有限公司;Spectra Max®i D3多功能酶标仪,美国Molecular Devices公司;MX-S可调式混匀仪、DLAB DM0506临床低速离心机,大龙兴创实验仪器(北京)股份公司;Chenmi Scope 6200 Touch化学发光成像系统,上海勤翔科学仪器有限公司;THUNDER Imager 3显微成像系统,德国Leica公司;LEGEND Micro 21R微量台式离心机,美国赛默飞公司;NovoCyte 2000R安捷伦流式细胞仪,安捷伦科技有限公司。
1.3 实验方法
1.3.1 细胞培养
LO2细胞被种植在RPMI-1640培养基中进行培养。为了创造最佳的生长条件,培养基中加入了10%(质量分数)胎牛血清,这是一种常见的细胞生长刺激剂。此外,为了防止可能的细胞污染,还加入了100 U/mL的青霉素和100 μg/mL的链霉素,这两种抗生素可以抑制不良微生物的生长。所有这些步骤都在一个特定的环境中进行,即在37 ℃的温度和5%(体积分数)的CO2下,以模拟细胞的自然生长环境。当细胞生长到60%~80%的融合度时,使用0.25%(质量分数)胰蛋白酶进行消化,并传代。
1.3.2 CCK-8法
将2.0×104个/孔的LO2细胞接种在96孔板中,贴壁后加入不同浓度的阿魏酸培养基。经过处理后的细胞在培养基中孵育24 h,以评估其增殖能力。随后,用RPMI-1640培养基稀释CCK-8,使其浓度达到每孔10 μL。继续孵育2~3 h后,使用酶标仪测定吸光度值,波长为450 nm,以计算细胞的存活率。
1.3.3 乙醇对肝细胞的DNA损伤模型构建
将1.0×105个/孔的LO2细胞在6孔板中培养24 h。同时,用RPMI-1640培养基稀释95%(质量分数)的食用酒精,制备400、600和800 mmol/L的溶液,并对细胞进行6 h处理。这些不同浓度的选择旨在研究酒精浓度对LO2细胞成长和生存的影响。
1.3.4 阿魏酸对乙醇诱导肝细胞损伤后细胞周期的影响
接种1.0×105个/孔的LO2细胞在6孔板中,培养24 h。然后用400 mmol/L酒精处理细胞6 h,更换液体后,用阿魏酸处理24 h。先PBS清洗3次,接着用0.25%(质量分数)胰蛋白酶消化并收集细胞,再用PBS洗1次,加入DNA染色剂染色避光孵育20~30 min后,上流式细胞仪分析。
1.3.5 Western blot 检测蛋白表达情况
接种1.0×105个/孔的LO2细胞在6孔板中,培养24 h。然后用400 mmol/L酒精处理细胞6 h,更换液体后,用阿魏酸处理24 h。接下来,用预冷的PBS清洗细胞3次,然后用含有磷酸蛋白酶抑制剂的裂解缓冲液裂解细胞。裂解后的细胞在4 ℃下,通过12 000×g的离心力离心15 min,然后取上清液。利用BCA蛋白质测定试剂盒测定蛋白质的浓度,并加入5×样品缓冲液稀释混匀。经过98 ℃的加热20 min后,在每块胶20 mA下进行SDS-PAGE电泳。电泳结束后,恒压120 V将蛋白质转移到PVDF膜上,然后在室温下使用配制好的封闭缓冲液摇晃封闭1 h。接着,在4 ℃下与抗兔p-H2AX一抗孵育过夜。第2天经过TBST清洗3次,每次5~10 min,再用辣根过氧化物酶标记的山羊抗兔二抗孵育40 min。再次经过TBST清洗3次,每次5~10 min后,加入显影液进行显色和拍照,使用Image J软件进行定量分析和比较。
1.3.6 阿魏酸对乙醇诱导ROS荧光强度变化的影响
接种1.0×105个/孔的LO2细胞在6孔板中,培养24 h。然后用400 mmol/L酒精处理细胞6 h,更换液体后,用阿魏酸处理24 h。再用探针标记20 min。先PBS清洗1次,接着用不含EDTA的0.25%(质量分数)胰蛋白酶消化并收集细胞,用PBS清洗3次,上流式细胞仪分析ROS荧光强度变化。
1.3.7 红绿双荧光蛋白检测阿魏酸对肝细胞细胞自噬的影响
先构建LO2细胞自噬通量探针模型。通过慢病毒介导的方法,将自噬荧光探针GFP-LC3-RFP-LC3ΔG转染至293T细胞,并收集病毒上清液。利用病毒感染LO2细胞,将荧光探针导入其中。该模型利用内源性蛋白酶(autophagy protein 4,ATG4)将自噬探针切割成等摩尔量的GFP-LC3和RFP-LC3ΔG。在自噬过程中,GFP-LC3与磷脂酰乙醇胺(phosphatidyl ethanolamine,PE)结合被自噬体溶解,而RFP-LC3ΔG不能被脂化,稳定保留在细胞质中,作为内对照。通过计算绿色蛋白(green fluorescent proteins,GFP)/红色蛋白(red fluorescent proteins,RFP)信号比值,可以估计细胞自噬通量。接种1.0×105个/孔的含荧光探针LO2细胞在6孔板中,并用不同浓度的阿魏酸处理24 h。接着用0.25%(质量分数)胰蛋白酶消化并收集细胞,用PBS清洗1次,上流式细胞仪分析。
1.4 数据分析
在用Graphpad Prism 9.0软件分析数据时,进行方差分析。实验数据,所有来自于3次重复试验的平均值,以“平均值±标准误差”呈现。图表均由Adobe Illustrator制作。
2 结果与分析
2.1 CCK8法测阿魏酸对肝细胞存活率的影响
为探究阿魏酸对LO2肝细胞的影响作用,将不同浓度的阿魏酸0、0.5、1、2、4、8、16 mmol/L作用于LO2肝细胞,继续培养24 h后,加入稀释后的CCK-8作用2 h,通过酶标仪检测细胞的增殖活性,结果如图1所示。与空白组相比,阿魏酸作用于细胞后,随浓度的升高,细胞存活率先升后降。阿魏酸在浓度0.5、1 mmol/L下,细胞的增殖活性增加(P<0.01),表明阿魏酸在该浓度下对LO2肝细胞有增殖作用。在8、16 mmol/L,细胞存活率低于50%,显著降低(P<0.01)。在接下来的实验中,选择0~8 mmol/L下进行研究,以便更好地分析并理解其中的规律和趋势。
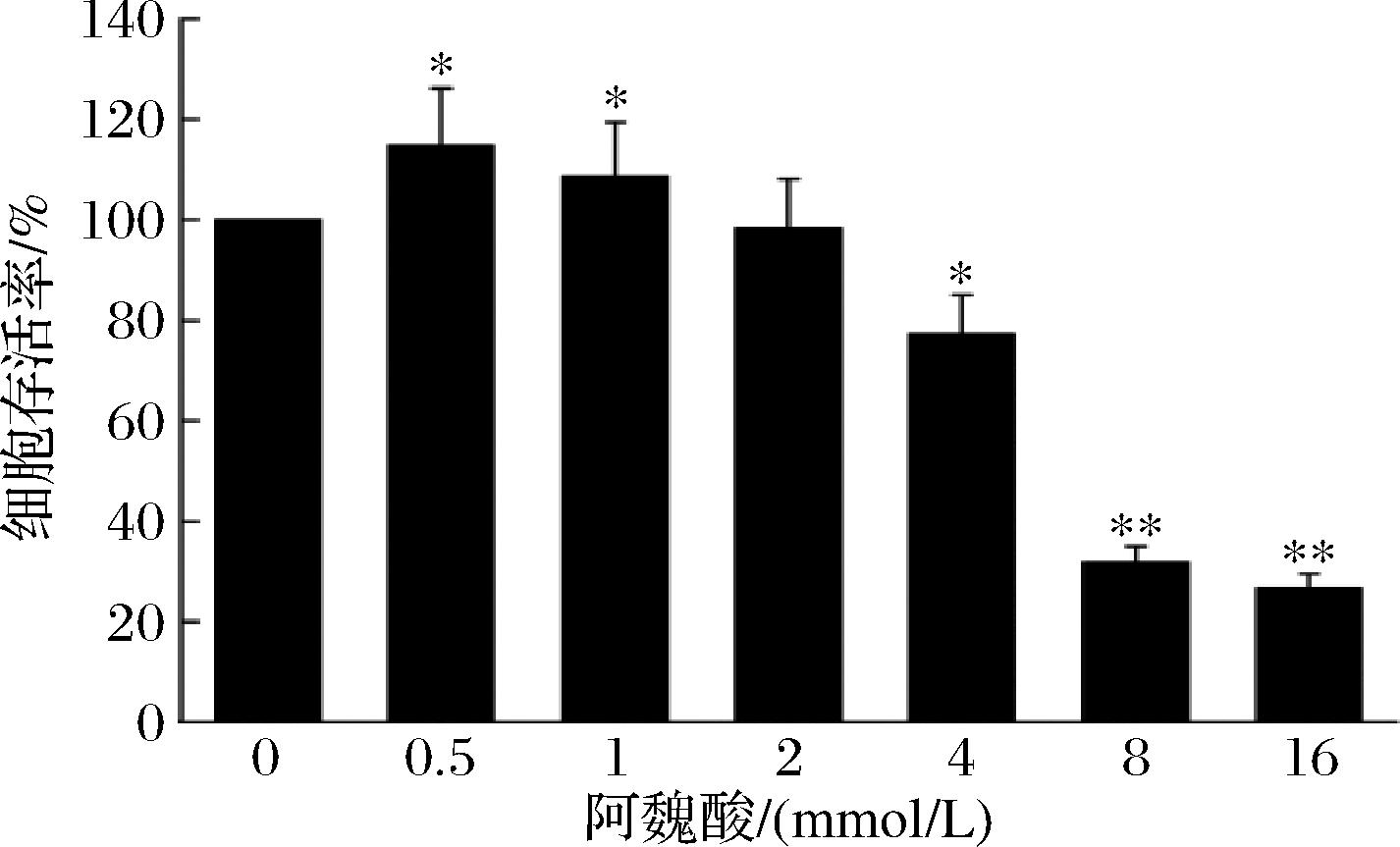
图1 不同浓度的阿魏酸对细胞活力的影响
Fig.1 Effects of ferulic acid at different concentrations on cell viability
注:与空白组比较,*P<0.05,**P<0.01(下同)。
2.2 乙醇对肝细胞的DNA损伤模型构建
细胞周期的运行遵循一套严谨的控制系统,确保每一步进程仅在前一步骤完成后启动。在G1期,细胞正在进行生长并准备进行DNA复制。细胞在S期和G2期进行DNA复制,并为接下来的分裂阶段做好准备。当细胞面临不利的环境条件,例如缺乏养分时,这套控制系统可以调节细胞周期的速度,甚至暂时停止细胞周期以赋予细胞应对挑战的时间和机会。特别是当细胞的DNA受到损伤时,这套控制机制的重要性更加突出,它会暂停细胞周期,允许DNA损伤修复系统介入,修复损坏的DNA,以确保细胞的正常运作和生存[17]。将LO2细胞经含不同浓度酒精(0、400、600、800 mmol/L)的培养基处理6 h。结果如图2所示。根据细胞周期图的研究结果,发现乙醇会导致LO2细胞在G1期的比例降低(P<0.05),而S期和G2期的比例则上升。这可能说明乙醇与DNA发生反应形成加合物,从而导致LO2细胞在S期和G2期产生阻滞。这种阻滞使细胞无法完成DNA的复制和分裂过程。这可能表明乙醇对细胞周期的影响可能是通过影响DNA的复制和分裂,从而改变细胞周期的分布。
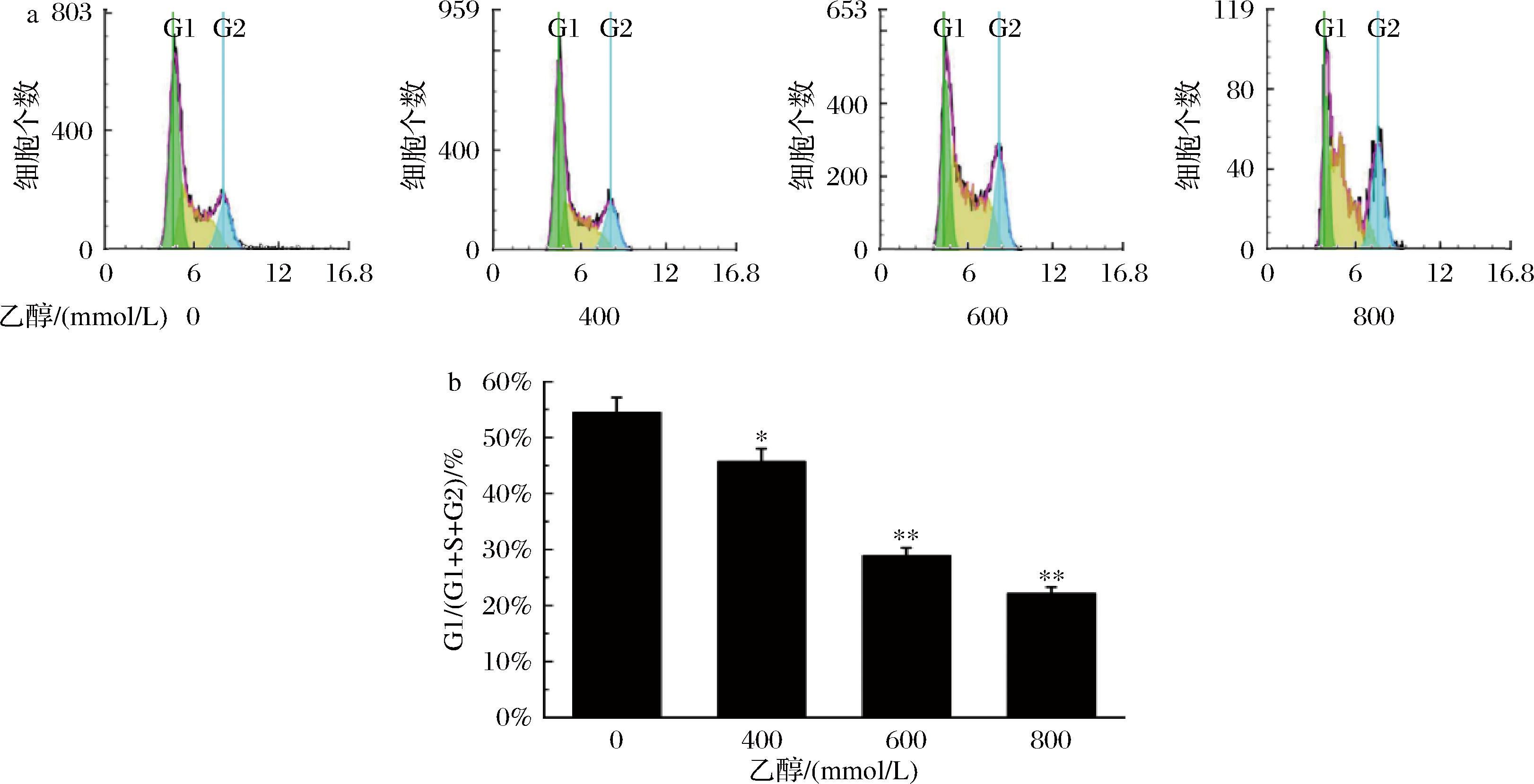
a-LO2细胞经含不同浓度乙醇(0、400、600、800 mmol/L)的培养基处理6 h后对细胞周期的影响;b-在乙醇的影响下LO2细胞G1/(G1+S+G2)比值
图2 乙醇对肝细胞周期的影响
Fig.2 Effects of ethanol on liver cell cycle
2.3 阿魏酸对乙醇诱导肝细胞损伤后细胞周期的影响
阿魏酸在人宫颈癌细胞中具有显著的抑制作用,可能通过抑制自噬和诱导细胞周期阻滞来发挥抗癌作用[18]。朱嘉欢等[19]对阿魏酸影响衰老造血干细胞增殖能力的研究,并通过观察细胞周期变化来探索阿魏酸的作用机制,发现阿魏酸能使G1期显著增加,S和G2期显著下降。将LO2细胞经浓度为400 mmol/L的酒精培养基处理6 h后,加入不同浓度(0、0.25、0.5、1、2、4 mmol/L)的阿魏酸培养基处理24 h。结果如图3所示,阿魏酸在浓度0.25 mmol/L下,G1期细胞比率上升不明显,在浓度为0.25、0.5、1、2 mmol/L的条件下,能够提高细胞G1期比率(P<0.01)。在4 mmol/L高浓度下,G1期显著降低(P<0.01),抑制DNA复制。

a-不同浓度的阿魏酸(0、0.25、0.5、1、2、4 mmol/L)对乙醇诱导肝细胞损伤后细胞周期的影响;b-阿魏酸对乙醇诱导肝细胞损伤的G1/(G1+S+G2)比值
图3 阿魏酸对乙醇诱导肝细胞损伤后细胞周期的影响
Fig.3 Effects of ferulic acid on cell cycle after ethanol-induced hepatocyte injury
注:与模型组比较,#P<0.05,##P<0.01(下同)。
2.4 Western blot检测蛋白表达情况
乙醇经过转化生成的乙醛能引发DNA的双链断裂,γH2AX蛋白在其Ser139位点会发生磷酸化反应。这种磷酸化反应被认为是DNA双链断裂的一个重要标志。因此,通过测量γH2AX在Ser139位点的磷酸化水平,可以间接评估DNA双链断裂的程度。这种有效的手段,可以更准确地量化乙醛对DNA的损伤程度,并有助于人们更全面地理解乙醛如何影响细胞的遗传物质[20]。将LO2细胞经浓度为400 mmol/L的酒精培养基处理6 h后,加入不同浓度为0、0.12、0.25、0.5、1、2、4 mmol/L的阿魏酸培养基处理24 h。Western blot检测结果如图4所示,发现在酒精理组,p-H2AX蛋白的表达显著增加(P<0.01),暗示DNA双链发生了断裂。然而,当细胞被阿魏酸处理后,在0.25、0.5、1、2 mmol/L的浓度下,p-H2AX蛋白的表达显著减少,这表明阿魏酸可能帮助细胞进行DNA的修复。值得注意的是,在4 mmol/L的阿魏酸浓度下,p-H2AX蛋白表达量相对于低浓度却上升,修复效率下降,与图3-b在相同浓度下抑制DNA复制的结果保持一致。
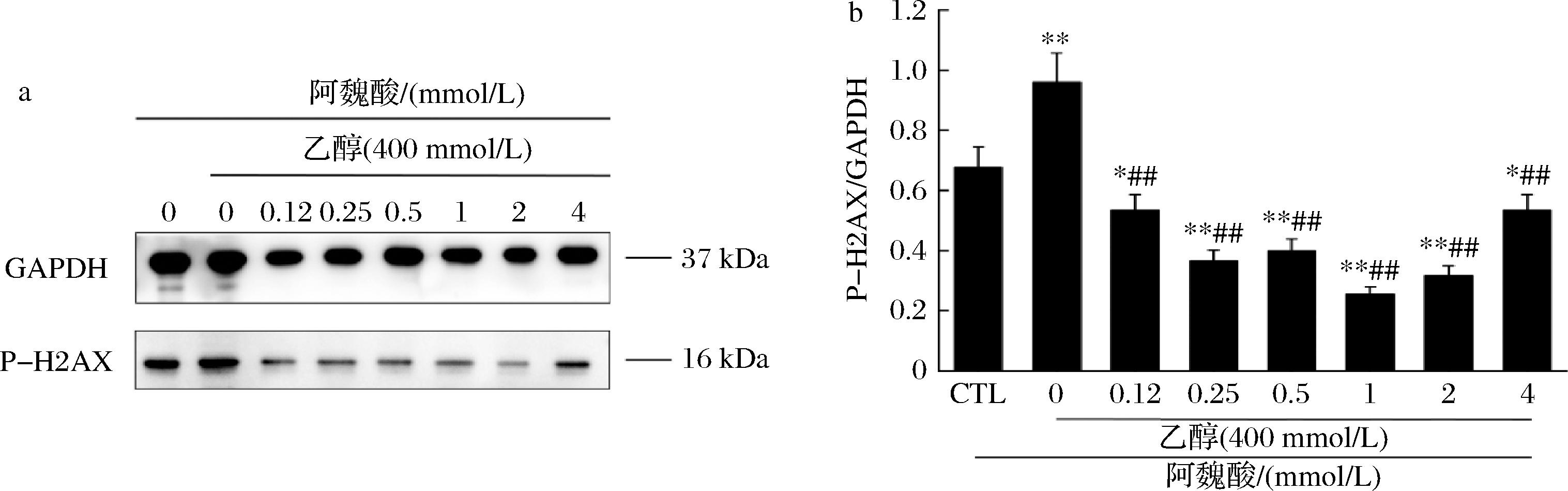
a-阿魏酸对乙醇诱导肝细胞损伤后p-H2AX蛋白的影响;b-阿魏酸对乙醇诱导肝细胞损伤的p-H2AX/GAPDH比值
图4 阿魏酸对乙醇诱导的p-H2AX蛋白表达的影响
Fig.4 Effects of ferulic acid on ethanol-induced p-H2AX protein expression
2.5 阿魏酸对乙醇诱导ROS荧光强度变化的影响
酒精摄入是慢性肝病的主要病因,其通过乙醇的氧化代谢产物,如ROS和乙醛,扰乱细胞内信号通路和基因转录控制,导致脂肪积累和纤维化,以及免疫系统的激活。特别是,ROS通过激活蛋白激酶(adenosine 5′-monophosphate-activated protein kinase,AMPK)调节自噬过程影响脂滴的去除,并与乙醛共同诱导胶原的合成,进一步推进纤维化过程。同时,这两种物质能损害肠道屏障,改变免疫响应,进而形成突变型DNA加合物以及干扰DNA的甲基化、合成和修复,提高肝细胞发生癌症的风险。这一系列复杂的生物学过程最终结果是引发各种肝病,包括脂肪肝、肝硬化、肝纤维化、酒精性肝炎和肝功能衰竭等[21]。将LO2细胞经浓度为400 mmol/L的酒精培养基处理6 h后,加入不同浓度为0、0.12、0.25、0.5、1、2、4 mmol/L的阿魏酸培养基处理24 h。流式细胞仪检测结果如图5所示,相较于空白组,模型组中的ROS相对荧光强度提高了19.34%(P<0.01),表明乙醇的存在能显著提高ROS的水平。随着阿魏酸浓度0.12~4 mmol/L的逐步提升,观察到ROS荧光强度明显降低(图5-c)(P<0.01)。特别是当阿魏酸浓度为4 mmol/L时,相对荧光强度由119.34%降至35.93%(P<0.01)。这一结果可能暗示阿魏酸具有降低ROS生成的潜力。总的来说,阿魏酸通过抑制乙醇摄入引发的ROS生成,为在酒精性肝病治疗中的应用提供了可能。

a-阿魏酸对乙醇诱导肝细胞损伤后活性氧的影响;b-阿魏酸对乙醇诱导肝细胞损伤后活性氧的荧光图;c-阿魏酸对乙醇诱导肝细胞损伤相对荧光比值
图5 阿魏酸对乙醇诱导的活性氧的影响
Fig.5 Effects of ferulic acid on ethanol-induced reactive oxygen species
2.6 红绿双荧光蛋白检测阿魏酸对肝细胞自噬的影响
在细胞遭受DNA损伤时,损伤的严重程度决定了细胞采取的反应策略。对于轻度且可修复的损伤,细胞会启动保护机制,包括DNA修复、暂停细胞周期和自噬,这些都有助于维持细胞功能并避免损伤的进一步扩大。ATM(ataxia-telangiectasia mutated proteins)蛋白质通过与AMPK和TSC1/2(tuberous sclerosis1/2)的相互作用,调控自噬的过程。此外,ATM和ATR(ataxia telangiectasia and Rad3-related)蛋白质也可以激活p53,从而增强自噬的活动。相应地,自噬过程能够提供DNA修复所需的代谢前体物质,如ATP和脱氧核苷酸(deoxynucleotide,dNTPs),这些物质支持DNA修复过程中的能量需求和DNA合成,保证了如核苷酸切除修复和DNA双链断裂修复等复杂过程的顺利进行[22]。
在自噬激活过程中,LO2细胞内P62蛋白表达降低,LC3蛋白表达升高,细胞组分降解,表明LO2细胞自噬活性增强[23]。其中LC3是ATG8蛋白在哺乳动物中的同源体,它是自噬过程的关键因素。LC3蛋白家族由多个亚家族构成,包括LC3A、B、C和GABARAP等,而LC3B的研究最为深入。根据现有的研究,LC3B被视为自噬信号通道中最重要的标志性蛋白质。在细胞中转导带有绿色荧光的pCMV-GFP-LC3B质粒后,在非自噬状态下,成功转导的细胞会散发出绿色的GFP-LC3B荧光,这种荧光会以分散的方式存在于细胞质中。然而,当细胞处于自噬状态时,GFP-LC3B会聚集在自噬体膜上,以斑点的形式显示。再次优化方案,将绿色荧光蛋白质(green fluorescent proteins,GFP)和红色荧光蛋白质(red fluorescent protein,RFP)融合到LC3上作为新的自噬活性测定探针:GFP-LC3-RFP-LC3ΔG。这种探针在细胞内形成后,比前述的类型更具特色,能够被ATG4蛋白质剪裁,这个过程会使GFP-LC3和RFP-LC3ΔG以1∶1的比例产生,即每个GFP-LC3的产生都伴随着1个RFP-LC3ΔG的生成。在细胞质中,GFP-LC3会散发绿色荧光。但是,当自噬体与溶酶体合并时,GFP-LC3的绿色荧光会消失,此时只能看到RFP-LC3ΔG的红色荧光,这是因为在酸性环境下,GFP的绿色荧光会减弱;另一方面,由于缺乏必要的末端甘氨酸,RFP-LC3ΔG不能进行脂化并停留在细胞内,因此发出红色荧光的RFP-LC3ΔG的数量基本保持不变,可以作为荧光反应的稳定标准[24]。因此,GFP和RFP的荧光强度之比是自噬活性的指标,GFP/RFP比值越低,表明自噬活性越高。
将红绿双荧光蛋白-LO2细胞经浓度为0、0.5、1、2、4、8 mmol/L的阿魏酸培养基处理24 h。流式细胞仪检测结果如图6所示,阿魏酸处理组的GFP荧光强度整体上都呈现下降的趋势,这可能意味着阿魏酸有促进细胞自噬的效果(如图6-a)。然而,这种效果并不呈线性,尤其在阿魏酸浓度为4 mmol/L时,GFP的荧光强度反而出现了上升。这可能表明,但在一定范围内,可能存在着一个最佳的浓度点。其次,通过观察GFP/RFP的荧光比值(如图6-b),可以看到,随着阿魏酸浓度的升高,荧光比值总体上呈现下降的趋势,这可能进一步证实了阿魏酸对细胞自噬具有一定的促进作用。然而,同样在4 mmol/L的阿魏酸浓度下,荧光比值反而上升,这可能是由于在某个浓度下,阿魏酸对细胞自噬的影响达到了一个平衡点。总的来说,阿魏酸对细胞自噬具有一定的影响,但这种影响可能是复杂的,存在着一个最佳浓度点,而且可能有其他未知的影响因素。因此,更深入的研究可能需要进一步探索阿魏酸对细胞自噬的具体机制,以及其在不同浓度下的作用差异。
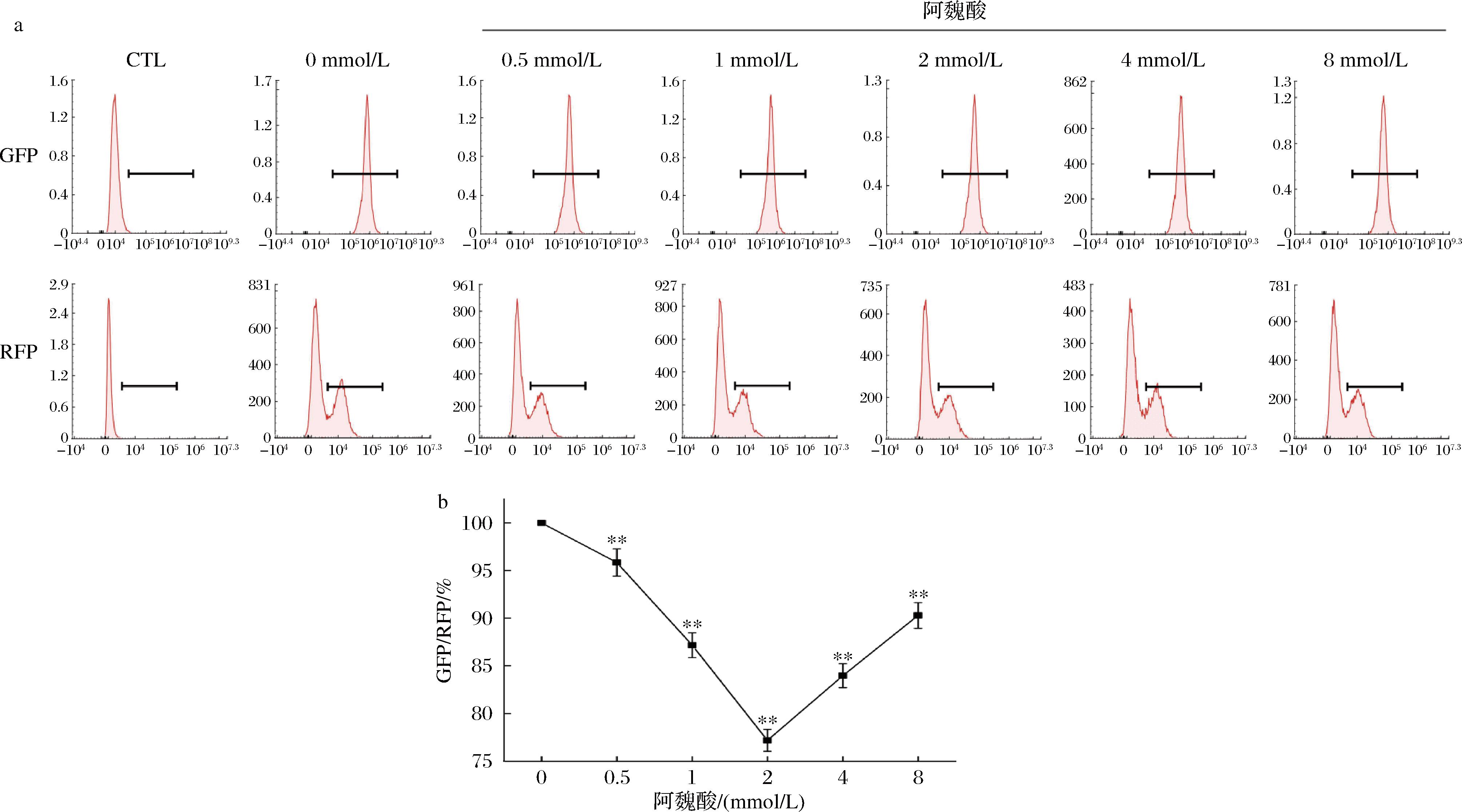
a-不同浓度阿魏酸对细胞自噬的影响;b-不同浓度阿魏酸的GFP/RFP的荧光比值
图6 阿魏酸对肝细胞自噬通量的影响
Fig.6 Effects of ferulic acid on autophagy flux in hepatocytes
3 结论与讨论
本项研究针对阿魏酸对乙醇诱导的LO2肝细胞DNA损伤修复作用进行了深入探讨,并发现其作用具有明显的浓度依赖性。低浓度阿魏酸(0.5 mmol/L和1 mmol/L)能促进LO2细胞的增殖,而在高浓度(8 mmol/L和16 mmol/L)下则显著降低了细胞的存活率,表现出明显的细胞毒性。进一步实验发现,乙醇能够扰乱细胞周期,尤其是降低G1期细胞比例,而提高S期和G2期的比例,这可能是由于乙醇与DNA形成加合物,导致DNA复制和细胞分裂过程受阻。在这一背景下,阿魏酸在0.25~2 mmol/L能够提升G1期细胞比例,说明能够改善因乙醇引起的细胞周期紊乱,并可能促进DNA的修复,减少乙醇引起的p-H2AX蛋白表达增加,这暗示阿魏酸在该浓度下能修复乙醇导致的DNA损伤。然而,阿魏酸在较高浓度下,细胞周期受阻,DNA复制受到抑制,p-H2AX蛋白表达量增加,表明阿魏酸可能开始产生负面作用。此外,乙醇处理同样引起了细胞内ROS水平的显著增加,而阿魏酸能有效降低ROS的生成,尤其是在4 mmol/L浓度下,这可能表明阿魏酸在减缓氧化应激方面具有潜在的保护作用,这对于酒精性肝病的治疗尤为重要。另一方面,阿魏酸对红绿双荧光蛋白-LO2肝细胞的自噬显示,GFP荧光强度和GFP/RFP荧光比值,整体呈下降趋势,表明阿魏酸可能促进细胞自噬,但在高浓度时,GFP荧光强度和GFP/RFP荧光比值的上升变化表明自噬作用可能受到抑制。综上所述,阿魏酸显示了其在适宜浓度下对乙醇诱导的肝细胞DNA损伤具有修复作用,但在高浓度下可能会导致细胞功能受损。
[1] GARAYCOECHEA J I, CROSSAN G P, LANGEVIN F, et al.Alcohol and endogenous aldehydes damage chromosomes and mutate stem cells[J].Nature, 2018, 553(7687):171-177.
[2] HODSKINSON M R, BOLNER A, SATO K, et al.Alcohol-derived DNA crosslinks are repaired by two distinct mechanisms[J].Nature, 2020, 579(7800):603-608.
[3] 孙宝国, 黄明泉, 王娟.白酒风味化学与健康功效研究进展[J].中国食品学报, 2021, 21(5):1-13.
SUN B G, HUANG M Q, WANG J.Research progress on flavor chemistry and healthy function of Baijiu[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(5):1-13.
[4] 陈杉彬, 赵东, 栾春光, 等.阿魏酸对CT-26的细胞凋亡和细胞自噬相关通路的影响[J].食品与发酵工业, 2024, 50(6):367-371.
CHEN S B, ZHAO D, LUAN C G, et al.The effects of ferulic acid on the apoptosis and autophagy-related pathways in CT-26 cells[J].Food and Fermentation Industries, 2024, 50(6):367-371.
[5] 赵巧珍. 芝麻香型白酒酿造过程中产阿魏酸功能细菌的筛选及应用研究[D].济南:齐鲁工业大学, 2023.
ZHAO Q Z.Screening and application of ferulic acid-producing functional bacteria in sesame-flavor liquor brewing[D].Jinan:Qilu University of Technology, 2023.
[6] QI X Y, ZHENG S G, MA M Y, et al.Curcumol suppresses CCF-mediated hepatocyte senescence through blocking LC3B-lamin B1 interaction in alcoholic fatty liver disease[J].Frontiers in Pharmacology, 2022, 13:912825.
[7] XIE L Y, YANG Z, WANG Y, et al.1- O-actylbritannilactone ameliorates alcohol-induced hepatotoxicity through regulation of ROS/Akt/NF-κB-mediated apoptosis and inflammation[J].ACS Omega, 2022, 7(21):18122-18130.
[8] 任思思, 李倩, 陶山, 等.太白楤木总皂苷对H2O2诱导LO2细胞损伤的修复作用及机制研究[J].中国新药与临床杂志, 2023, 42(9):593-600.
REN S S, LI Q, TAO S, et al.Repair effect and mechanism of total saponins of Aralia taibaiensis on LO2 cell injury induced by H2O2[J].Chinese Journal of New Drugs and Clinical Remedies, 2023, 42(9):593-600.
[9] 王妍凌, 陈杉彬, 赵文梅, 等.新疆葡萄酒中的酚类物质对LO2细胞自噬的影响[J].食品与发酵工业, 2024, 50(4):118-125.
WANG Y L, CHEN S B, ZHAO W M, et al.Effect of phenolic substances in Xinjiang wine on the activity of autophagy in LO2 cells[J].Food and Fermentation Industries, 2024, 50(4):118-125.
[10] NEOPANE D, ANSARI V A, SINGH A.Ferulic acid:Signaling pathways in aging[J].Drug Research, 2023, 73(6):318-324.
[11] SONG W, XIN J Y, YU C, et al.Alkyl ferulic acid esters:Evaluating their structure and antibacterial properties[J].Frontiers in Microbiology, 2023, 14:1135308.
[12] CHEN S B, ZHAO D, LUAN C G, et al.Ferulic acid induces autophagy and apoptosis in colon cancer CT26 cells via the MAPK pathway[J].Molecules, 2023, 28(16):6014.
[13] ZHANG X X, ZHAO D S, WANG J, et al.The treatment of cardiovascular diseases:A review of ferulic acid and its derivatives[J].Die Pharmazie, 2021, 76(2):55-60.
[14] DING L L, ZHU H L, WANG K, et al.Quercetin alleviates cadmium-induced BRL-3A cell apoptosis by inhibiting oxidative stress and the PERK/IRE1α/ATF6 signaling pathway[J].Environmental Science and Pollution Research International, 2023, 30(60):125790-125805.
[15] MAO J X, TAN L H, TIAN C, et al.Hepatoprotective effect of syringin combined with costunolide against LPS-induced acute liver injury in L-02 cells via Rac1/AKT/NF-κB signaling pathway[J].Aging, 2023, 15(21):11994-12020.
[16] LIU L Y, YU T H, LIAO T S, et al.Pomolic acid and its glucopyranose ester promote apoptosis through autophagy in HT-29 colon cancer cells[J].World Journal of Gastrointestinal Oncology, 2023, 15(10):1756-1770.
[17] CHATTERJEE A, RAJARSHI K, KHAN R, et al.An intimate alliance of DNA-damage response network with cell-cycle checkpoints amid events of uncontrolled cellular proliferation:A mini- review[J].Endocrine, Metabolic &Immune Disorders Drug Targets, 2021, 21(9):1537-1543.
[18] GAO J H, YU H, GUO W K, et al.The anticancer effects of ferulic acid is associated with induction of cell cycle arrest and autophagy in cervical cancer cells[J].Cancer Cell International, 2018, 18:102.
[19] 朱嘉欢, 黄小平, 邓常清.黄芪和当归的主要活性成分配伍促进衰老造血干细胞增殖作用的研究[J].中草药, 2019, 50(1):111-119.
ZHU J H, HUANG X P, DENG C Q.Main active components combination of Astragalus membranaceus and Angelica sinensis promotes proliferation of aging hematopoietic stem cells[J].Chinese Traditional and Herbal Drugs, 2019, 50(1):111-119.
[20] RUMGAY H, MURPHY N, FERRARI P, et al.Alcohol and cancer:Epidemiology and biological mechanisms[J].Nutrients, 2021, 13(9):3173.
[21] CENI E, MELLO T, GALLI A.Pathogenesis of alcoholic liver disease:Role of oxidative metabolism[J].World Journal of Gastroenterology, 2014, 20(47):17756-17772.
[22] ZHANG D, TANG B, XIE X, et al.The interplay between DNA repair and autophagy in cancer therapy[J].Cancer Biology &Therapy, 2015, 16(7):1005-1013.
[23] GLICK D, BARTH S, MACLEOD K F.Autophagy:Cellular and molecular mechanisms[J].Journal of Pathology, 2010, 221(1):3-12.
[24] 罗蕊琪, 钟恒, 韩兴林, 等.一种酒体微量成分对细胞自噬通量影响的检测方法:中国, CN116987756A[P].2023-11-03.
LUO R Q, ZHONG H, HAN X L, et al.A method for detecting the effect of trace components of wine body on autophagy flux:China,CN116987756A.[P].2023-11-03