杜氏盐藻(Dunaliella salina)是一种单细胞绿藻,因其含有丰富的β-胡萝卜素而闻名,在健康和营养产品中应用广泛[1-2]。从盐藻中提取β-胡萝卜素后,其残渣依然富含多糖,含量为盐藻质量的12%~40%[3],具有抗肿瘤、抗病毒和免疫调节等多种生物活性[4-5]。
多糖的生物活性与其结构特征和分子质量大小息息相关[6]。因此,筛选具有较高活性的多糖,提高其生物利用度具有重要意义。采用分级醇沉法可以制备不同分子质量的多糖组分,CHOU等[7]采用乙醇分级沉淀制备滑菇多糖(pholiota nameko polysaccharides,PNP),研究发现PNP-60具有较强保湿性;PNP-80具有最好的抗氧化和保护人成纤维细胞免受紫外线-A诱导的光老化;GAO等[8]使用乙醇分级沉淀法等4种不同的方法分离荔枝多糖,发现分子质量最高的荔枝多糖具有最强的抗氧化作用。近年来,越来越多的研究人员,通过乙醇分级沉淀制备并筛选出具有特定生物活性的不同分子质量多糖。目前,盐藻多糖(polysaccharide of Dunaliella salina,PD)主要集中在提取、分离纯化和生物活性研究等方面,得到的多糖大部分为单一多糖组分,不能确定主要发挥活性的组分,缺乏对PD组分的系统研究,进而限制了PD的应用。如徐锡莲[9]采用超滤浓缩结合无水乙醇沉淀PD,研究了多糖抗氧化活性;刘云鹤等[10]采用热水浸提法提取盐藻中的水溶性多糖,并采用体积分数为80%乙醇制备多糖;李秀霞等[11]采用超声辅助结合体积分数为95%乙醇沉淀多糖,优化其工艺条件;戴军[12]利用碱性条件下热水浸提PD,并用体积分数为95%乙醇醇沉多糖,分离获得了由1,4键连接的α-D-Galp构成主链的多糖,并研究了其抗病毒和抗肿瘤生物活性。截至目前,文献中报道了体积分数为80%~100%乙醇的醇沉PD结构与生物活性之间关系[13],鲜有80%以下醇沉多糖结构表征,尤其对涉及分级醇沉PD的系统研究还极为少见。
因此,本研究中采用不同体积分数乙醇分级沉淀PD,获得不同组分PD并对其理化性质和体外免疫活性进行评估,确定PD主要活性成分,为系统了解PD构效关系奠定基础,同时为其开发应用提供技术支撑。
1 材料与方法
1.1 材料与试剂
杜氏盐藻渣取自甘肃省微藻技术创新中心;无水乙醇、考马斯亮蓝G-250、D-葡萄糖醛酸、牛血清白蛋白、葡萄糖、间羟基二苯酯、四硼酸酯、过硫酸钾、KBr,所有化学品均为分析纯,上海源叶生物科技有限公司;RPMI-1640培养基(roswell park memorial institute,RPMI),上海远慕生物科技公司。
1.2 仪器和设备
Multidrop Combi SMART酶标仪、Thermo ICS 5 000+离子色谱系统,赛默飞世尔科技(中国)有限公司;VORTEX 22K离心机,湖南湘仪实验室仪器开发有限公司;iS50红外光谱仪,美国Thermo Scientific;STA 449 F3同步热分析仪,德国耐驰仪器制造有限公司;Quanta 450 场发射扫描电子显微镜(SEM),美国FEI公司;LAMBDA 465紫外-可见分光光度计,美国PerkinElme公司;CP-ST200A二氧化碳培养箱,长沙长锦科技有限公司;Agilent1260高效凝胶渗透色谱(high performance gel permeation chromatography,HPGPC)仪,美国Aglient公司;MixPlus漩涡振荡器,合肥艾本森科学仪器有限公司。
1.3 盐藻渣多糖制备
称取一定量盐藻渣(干重)按照料液比1∶20加入95%乙醇(体积分数,下同)浸泡24 h,以去除脂质和小分子杂质,以5 000 r/min离心5 min得预处理的盐藻,按照料液比1∶30加入蒸馏水,将提取液以5 000 r/min离心5 min,收集上清液,采用Sevag法除蛋白质后,在多糖粗提取液中加入无水乙醇至其体积分数为40%,4 ℃静置12 h,获得40%醇沉PD(PD-40);在40%醇沉多糖上清液中加入无水乙醇使其体积分数为60%,4 ℃静置12 h,离心、冻干,得60%醇沉PD(PD-60);用同样办法获得体积分数80%醇沉PD(PD-80),保存备用。
1.4 多糖成分分析
以葡萄糖为标准品,采用苯酚-硫酸法测量糖的总量[14]。以牛血清白蛋白为标准,考马斯亮蓝G-250染色法测定蛋白质含量[15]。以D-葡萄糖醛酸为标准,通过间羟基苯基比色法测定葡萄糖醛酸含量[16]。
1.5 多糖理化性质分析
1.5.1 分子质量测定
采用HPGPC测定梯度醇沉PD-40、PD-60和PD-80的分子质量。将样品制成5 mg/mL溶液,5 000 r/min离心10 min,上清液通过0.22 μm微孔滤膜过滤。然后将样品放入1.8 mL的注射管中。使用流动相为0.05 mol/L NaCl溶液,流速设定为0.6 mL/min。
1.5.2 单糖组成分析
将5 mg样品置于安瓿中,加入3 mol/L三氟乙酸(trifluoroacetic acid,TFA)2 mL,并在80 ℃下持续水解3 h。准确抽吸酸水解溶液,将其转移到N2吹扫管中干燥,加水溶解,涡旋混合,以5 000 r/min离心5 min后,上清液采用Thermo ICS 5 000+离子色谱系统,色谱柱为Dionex CarbopacTMPA20(150 mm×3 mm,10 μm)进行分析。流动相由3种成分组成:流动相A由H2O组成;流动相B由15 mmol/L NaOH组成;流动相C由15 mmol/L NaOH和100 mmol/L乙酸钠的混合物组成。流动相的流速设定为0.3 mL/min。
1.5.3 傅里叶变换红外光谱(Fourier transform infrared spectrometer,FT-IR)测定
称取分级醇沉多糖2 mg,分别与充分干燥的KBr以1∶100的质量比混合压缩成片,并在400~4 000 cm-1下进行傅里叶变换红外光谱测量。
1.5.4 SEM分析
将3种不同分子质量多糖干燥粉末均匀地附着在样品台上并喷金,比较其形态特征。采用SEM在15.0 kV的加速电压和20 000倍的放大倍率下观察其成像。
1.5.5 刚果红实验
将2.0 mL 80 μmol/L刚果红溶液与2.0 mg/mL多糖溶液2.0 mL混合,加入一定体积的1 mol/L NaOH溶液,使其最终浓度在0.0~0.5 mol/L。在室温下反应5 min,采用紫外-可见分光光度计测定其最大吸收峰。
1.6 体外免疫活性测定
1.6.1 细胞培养和处理
将生长良好的小鼠单核巨噬细胞RAW 264.7接种于含10%灭活胎牛血清的RPMI 1640培养基中,放置于饱和湿度、温度37 ℃、含5% CO2 条件下常规培养,1 d更换1次培养液,倒置显微镜随时观察细胞生长状况。将对数期细胞暴露于不同质量浓度(25~200 μg/mL)的PD(PD-40、PD-60和P-80)24 h,以脂多糖(lipopolysaccharide,LPS)(200 ng/mL)作为阳性对照,未经处理的细胞培养物作为阴性对照。
1.6.2 细胞增殖测定
采用细胞增殖与毒性检测试剂盒测定巨噬细胞增殖率。将RAW 264.7细胞以1×105个细胞/mL的密度接种到96孔板中12 h。用PBS洗涤细胞两次,然后如上所述与100 μL不同浓度的PD样品孵育24 h后,将20 μL四唑化合物溶液添加到每个孔中,并继续孵育3.5 h;用酶标仪测量其在492 nm处的吸光度,巨噬细胞细胞增殖率用PD处理的细胞相对于未处理的对照吸光度百分比表示。
1.6.3 细胞吞噬测定
通过测量中性红摄取来测定RAW264.7细胞的吞噬活性[17]。将100 μL密度为1×105个细胞/mL的RAW 264.7细胞接种到96孔板中并孵育12 h。用PBS洗涤细胞两次,每孔中加入100 μL不同浓度的PD组分。孵育24 h后,弃去上清液,向每孔中加入100 μL在生理盐水中的0.1 g/100 mL中性红并孵育4 h。用PBS洗涤细胞3次,向每孔中添加100 μL细胞溶解溶剂[V(乙醇)∶V(乙酸)=1∶1]。用酶标仪在540 nm处测量上清液细胞裂解物的吸光度。
1.6.4 NO和活性氧(reactive oxygen species,ROS)生成测定
用150 μL不同质量浓度(25~200 μg/mL)的PD样品处理细胞并孵育24 h,然后收集培养基上清液,并使用Griess试剂测量NO浓度。荧光探针2′,7′-二氯二氢荧光素二乙酸酯(Dichlorodihydrofluorescein diacetate, DCFH-DA)用于检测细胞内ROS水平。简言之,将100 μL密度为1×105个细胞/mL的RAW 264.7细胞接种到96孔板中并孵育12 h。用PBS洗涤细胞两次,然后向每孔中加入100 μL不同浓度的PD组分。孵育24 h后,每孔中加入DCFH-DA溶液(10 μmol/L)并孵育0.5 h。然后,洗涤细胞并用溶解溶剂(100 μL/孔)处理,以释放细胞内2′,7′-二氯荧光素(2′,7′-Dichlorofluorescein,DCF)。在488 nm激发和525 nm发射下条件下测定其荧光强度。
1.7 数据分析
每个试验均重复3次,结果显示为“平均值±标准差”,采用单向方差对数据进行分析。
2 结果与分析
2.1 分级沉淀法制备多糖得率和化学组成
乙醇分级沉淀法是一种简单快速纯化生物活性多糖的方法,天然多糖几乎是具有广泛的分子质量分布的复杂异构多糖,其在多糖单糖组成及比例、连接类型和分支排列等方面表现出明显差异。因此,将多糖分级制备成具有高均一性的组分具有重要意义[18]。采用乙醇分级沉淀法对PD进行分离,从PD分离出3个多糖组分(PD-40、PD-60和PD-80)。表1反映了3个多糖组分得率和化学组成,其中,PD-40具有最高的多糖得率,占所有多糖组分总质量的61.4%;随着乙醇体积分数逐渐增加,多糖含量逐渐下降;当乙醇体积分数增加到60%时,PD-60表现出更高的蛋白质含量(>3%),但随着乙醇体积分数进一步增加到80%,PD-80的多糖含量下降至38.18%,而蛋白质含量却增加至6.25%。
表1 PD-40、PD-60和 PD-80物理化学组成
Table 1 Physicochemical properties of PD-40, PD-60, and PD-80
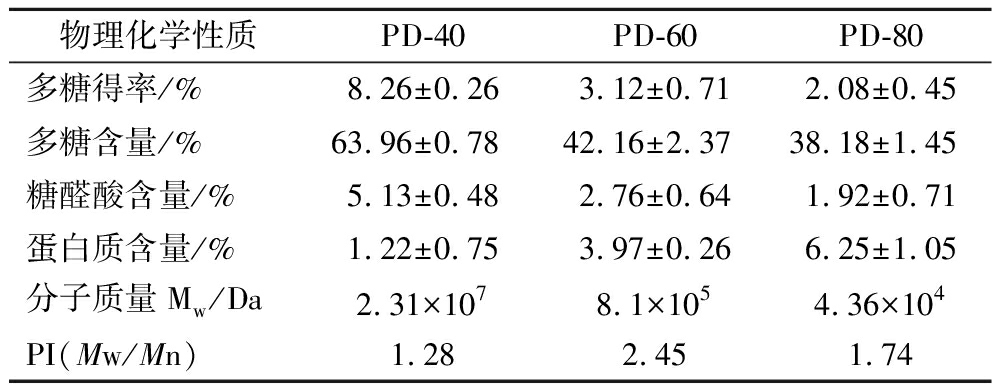
物理化学性质PD-40PD-60PD-80多糖得率/%8.26±0.263.12±0.712.08±0.45多糖含量/%63.96±0.7842.16±2.3738.18±1.45糖醛酸含量/%5.13±0.482.76±0.641.92±0.71蛋白质含量/%1.22±0.753.97±0.266.25±1.05分子质量Mw/Da2.31×1078.1×1054.36×104PI(Mw/Mn)1.282.451.74
2.2 PD组分的分子质量和单糖组成
分子质量对多糖的性质和功能有显著影响。如图1所示,随着乙醇体积分数的增加,3种盐藻多糖分子质量分布总体向右移动,表明多糖分子质量会随着乙醇体积分数增加而降低。PD-40和PD-60的分子质量(Mw)分别为2.31×107Da和8.1×105Da,远高于PD-80组分分子质量4.36×104Da。
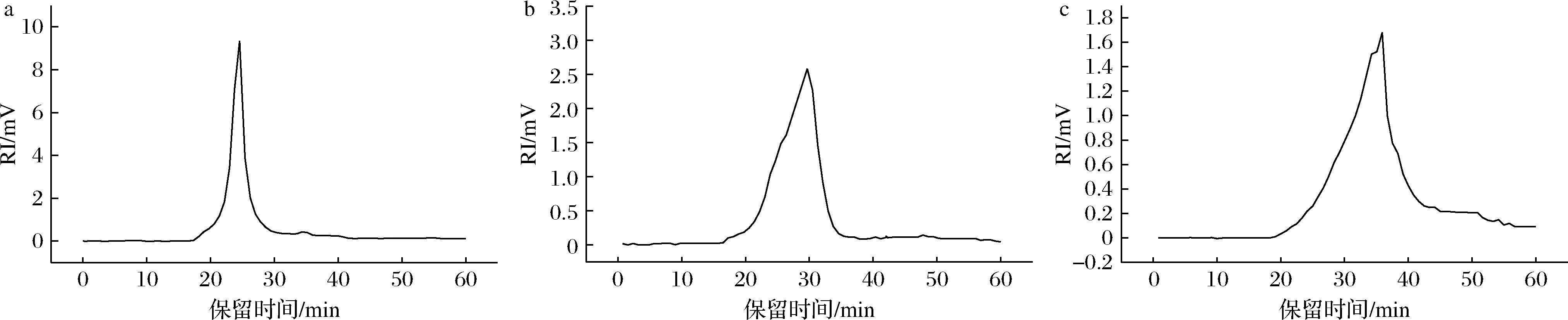
a-PD-40;b-PD-60;c-PD-80
图1 不同乙醇梯度沉淀PD组分的HPGPC谱图
Fig.1 HPGPC profiles of PD fractions precipitated at various ethanol volume ratios
2.3 PD组分单糖组成
如表2所示,3个PD组分均由不同摩尔比的岩藻糖、鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖、核糖、半乳糖醛酸和葡萄糖醛酸组成,与付海宁等[19]的研究结果一致,但摩尔比不同。PD-40在所有组分中呈现出最高的半乳糖比例和糖醛酸含量。此外,在PD-60和PD-80组分中,半乳糖的比例急剧下降。
表2 乙醇分级沉淀制备PD组分单糖组成
Table 2 Monosaccharide composition (molar ratio) of PD fractions precipitated at various ethanol volume ratios
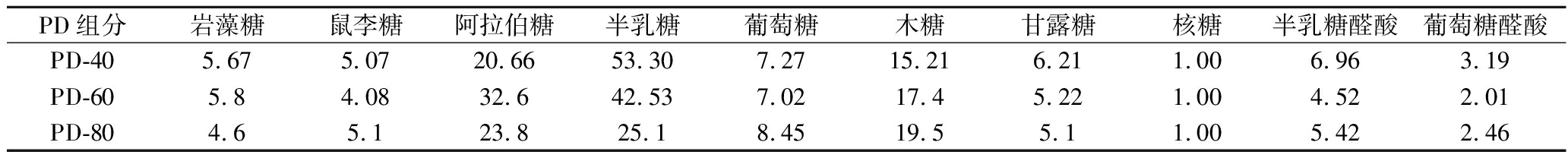
PD组分岩藻糖鼠李糖阿拉伯糖半乳糖葡萄糖木糖甘露糖核糖半乳糖醛酸葡萄糖醛酸PD-405.675.0720.6653.307.2715.216.211.006.963.19PD-605.84.0832.642.537.0217.45.221.004.522.01PD-804.65.123.825.18.4519.55.11.005.422.46
2.4 PD组分的FTIR测定
采用FTIR法对盐藻渣制备的3种多糖化学结构进行了表征,结果见图2。3个样品的FT-IR光谱相似,在4 000~500 cm-1处有典型的多糖特征吸收峰。在3 309.2 cm-1处有一个宽而钝的O—H拉伸振动的吸收峰;在2 929.4 cm-1处较弱的吸收信号是由多糖分子的C—H的拉伸振动引起的。同时,1 641.0 cm-1附近的吸收峰归因于C![]() O不对称拉伸振动的存在;1 355.6 cm-1处的吸收峰是C—H键的可变角度振动所致;在848.1 cm-1处为吡喃糖环的吸收峰,该类型的C—H振动产生的吸收峰值。PD-60和PD-80在1 145.5、1 077.8、1 085.3 cm-1处有特征吸收峰,3个多糖组分在1 200~1 000 cm-1均有特征吸收峰表明其含有吡喃环,PD-60和PD-80在850 cm-1附近是α-糖苷的特征吸收峰,表明通过乙醇分级沉淀获得的多糖的一级结构未受到破坏。
O不对称拉伸振动的存在;1 355.6 cm-1处的吸收峰是C—H键的可变角度振动所致;在848.1 cm-1处为吡喃糖环的吸收峰,该类型的C—H振动产生的吸收峰值。PD-60和PD-80在1 145.5、1 077.8、1 085.3 cm-1处有特征吸收峰,3个多糖组分在1 200~1 000 cm-1均有特征吸收峰表明其含有吡喃环,PD-60和PD-80在850 cm-1附近是α-糖苷的特征吸收峰,表明通过乙醇分级沉淀获得的多糖的一级结构未受到破坏。
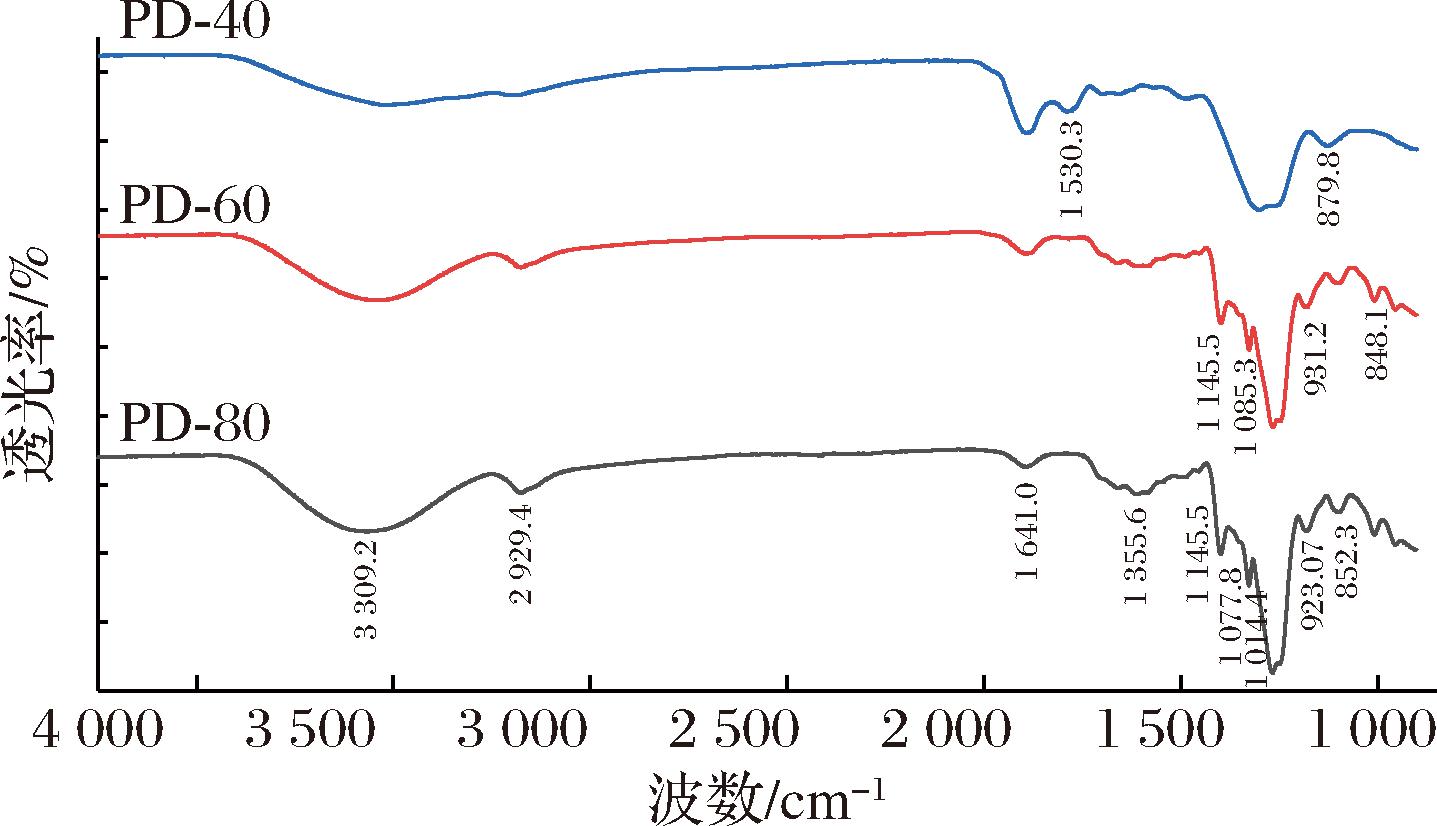
图2 PD-40、PD-60和 PD-80红外光谱
Fig.2 FT-IR images of PD-40, PD-60 and PD-80
2.5 PD组分的热重分析
采用热重分析(thermo-gravimetric analysis,TGA)对多糖的热性质进行了表征。如图3所示,3种多糖的质量变化趋势为30~800 ℃。多糖的质量损失有3个不同的阶段,第一阶段的质量损失发生在75~50 ℃,PD-40、PD-60和PD-80分别损失15.1%、14.1%和7.8%,主要是由于游离水和结合水的蒸发所致。第二阶段发生在150~400 ℃,是主要的减重阶段,PD-40、PD-60和PD-80分别损失49.8%、49.7%和46.5%。当温度超过400 ℃时,多糖损失速度减慢。PD-40、PD-60和PD-80在损失后的残余质量分别为34.1%、40.1%和44.2%。表明PD热稳定性较好。
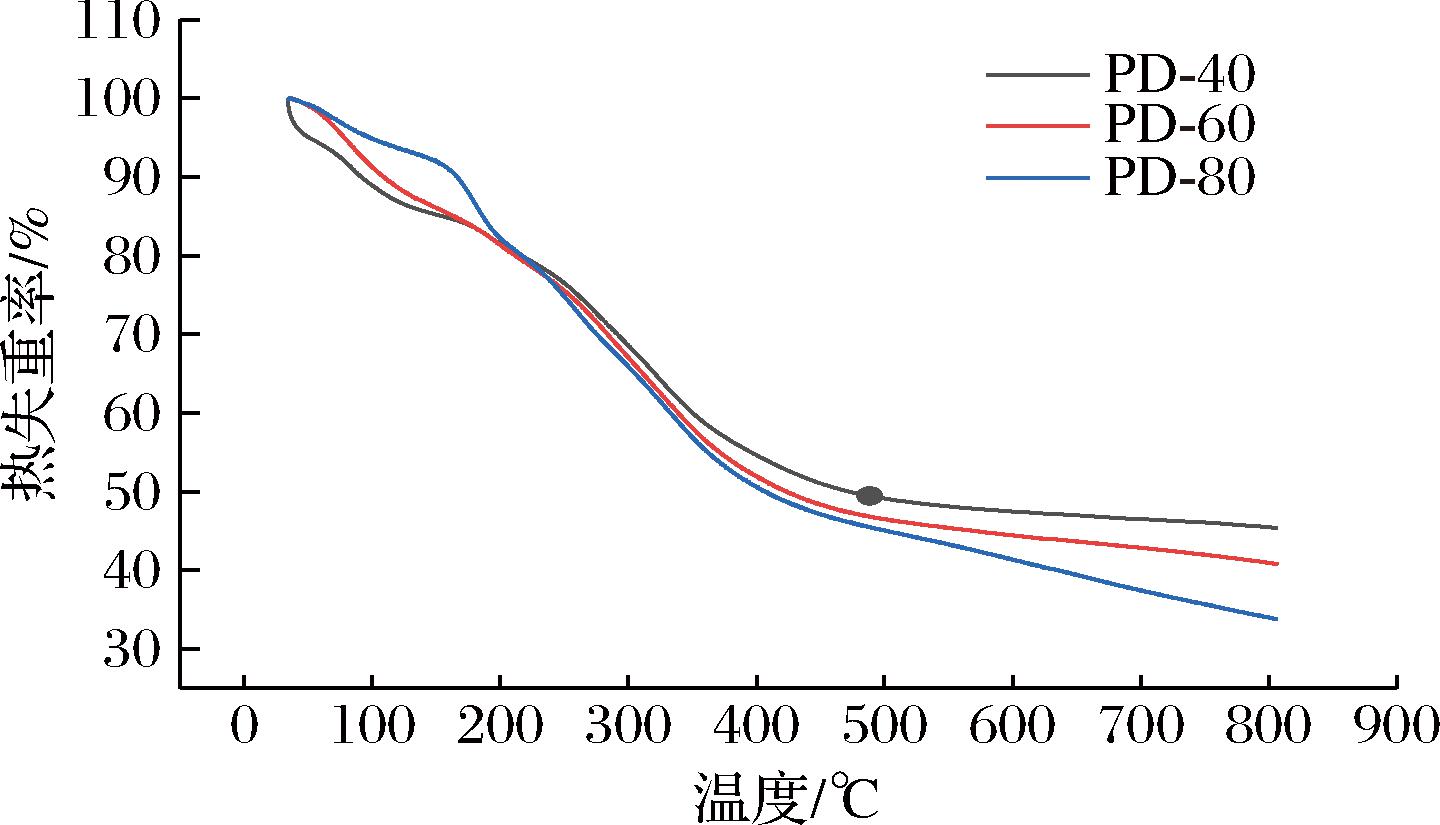
图3 PD-40、PD-60和PD-80热重曲线
Fig.3 TGA analysis images of PD-40, PD-60, and PD-80
2.6 SEM测定
SEM是观察包括多糖在内的反映聚合物表面形状的有效方法。PD-40、PD-60和PD-80在20 000倍电子显微镜图像如图4所示。图中显示,PD-40的表面较平整,边缘不规则;PD-60是一种表面粗糙不平整结构,具有细小微孔;PD-80具有由不规则颗粒组成粗糙的表面结构。由此可见,随着乙醇体积分数的增加,原来的表面结构有所破坏,这种破坏程度可能与分子质量的变化有关。

a-PD-40扫描电镜图;b-PD-60扫描电镜图;c-PD-80扫描电镜图
图4 PD-40、PD-60和PD-80扫描电镜图
Fig.4 SEM images of PD-40, PD-60, and PD-80
2.7 刚果红实验
刚果红是一种快速鉴定多糖构象的方法,在多糖中存在螺旋结构的情况下,它会改变其最大表观吸收峰。图5显示了3种PD组分的刚果红试验结果,与刚果红对照相比,PD-40、PD-60和PD-80的最大吸收峰显示出红移现象,表明3种多糖组分都存在三螺旋构象。3种多糖组分在不同浓度的NaOH溶液中最大吸收峰的不同趋势表明,构象的稳定性与单糖组成、分支排列、分子质量的大小有关[20],当NaOH浓度逐渐增加时,多糖的最大吸收峰逐渐减小,表明氢键被碱破坏。
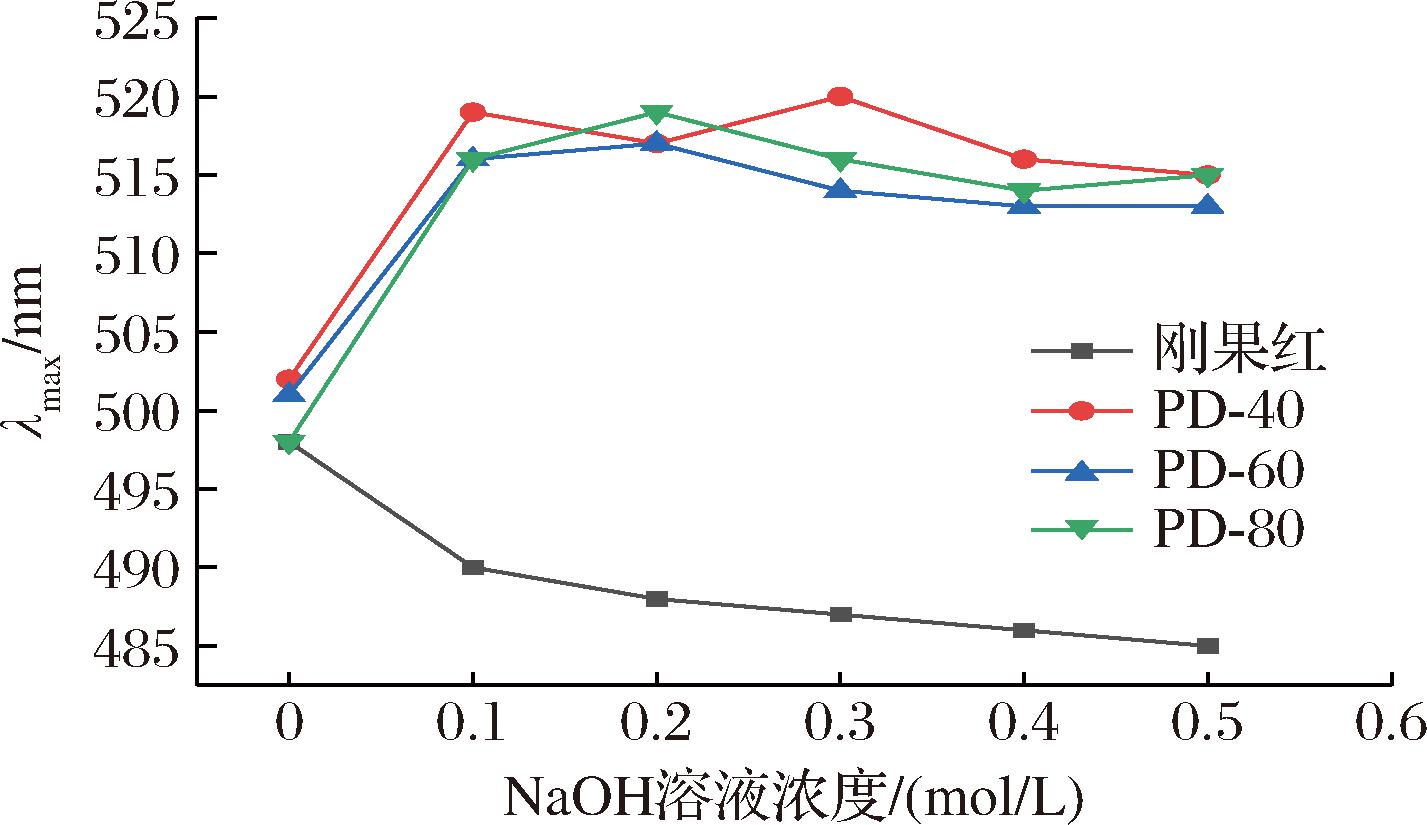
图5 不同NaOH浓度下刚果红及其多糖复合物最大吸收波长
Fig.5 Maximum absorption wavelength of Congo red-polysaccharide complex at various NaOH concentrations
2.8 PD组分的免疫活性
如图6-a所示,PD组分在25~200 μg/mL对RAW264.7细胞显示出无毒性。此外,在多糖质量浓度为200 μg/mL条件下,PD-40和PD-60组分均能显著促进RAW 264.7细胞的增殖,结果与阳性对照LPS组一致。此结果与戴军[12]研究离子交换分离组分PD1和PD4在质量浓度100 μg/mL时对正常小鼠脾淋巴细胞增殖作用的影响结果一致,巨噬细胞增殖的结果反映了其具有免疫活性。

a-MTS法测定巨噬细胞增殖活性;b-中性红摄取法测定吞噬活性;c-细胞内ROS生成;d-细胞内NO水平
图6 不同浓度多糖组分对RAW 264.7细胞的免疫刺激活性
Fig.6 Immunostimulatory activities of PS fractions from AUE at different concentrations on RAW 264.7 cells
巨噬细胞的吞噬特性是天然多糖免疫调节活性的衡量指标之一[21-22]。如图6-b所示,与对照组相比,所有PD组分都能以浓度依赖的方式显著增强RAW 264.7细胞吞饮活性,表明其对巨噬细胞吞噬作用具有刺激作用。在200 μg/mL下,PD-40、PD-60和PD-80诱导的RAW264.7细胞的吞饮活性分别比对照组高19%、17%和9%。在所有PD组分中,PD-40表现出最高的吞饮活性。在吞噬过程中,巨噬细胞可以产生ROS作为防御元件和信号化合物[23-24]。与吞噬活性类似,所有PD组分都增强了巨噬细胞中ROS的产生,其中PD-40对RAW 264.7细胞吞饮活性效果较佳(图6-c)。
NO的产生是免疫细胞的另一种常见反应,有助于激活免疫系统和防御病原体入侵。如图6-d所示,采用3种PD组分处理后,RAW264.7细胞中的NO水平以剂量依赖性方式显著增加。与吞饮活性相似,在3种PD组分中,PD-40对NO产生的促进作用最强,而PD-60组分对NO的促进作用最弱。在PD-60和PD-80之间的化学组成比较中,PD-80的更高活性可能归因于其更高的蛋白质含量。上述结果证实了PD组分的体外免疫活性,其相对显著性随化学成分和MW分布而变化。国内外研究结果表明[25-26],多糖可以与免疫细胞中的特定受体结合,如Dectin-1和Toll样受体免疫调节活性取决于多糖的结构。然而,PD-40的结构-活性关系和免疫调节活性的潜在机制仍有待进一步研究。
3 结论
采用乙醇分级沉淀制备3种PD(PD-40、PD-60、PD-80),并对其理化性质和体外免疫活性进行了研究,发现3种多糖的单糖组成种类相同但摩尔比不同,具有热稳定强和三螺旋构象;在3种盐藻多糖中PD-40分子质量最大且含量最多,具有较强的免疫调节活性,说明PD的免疫活性与化学成分和分子质量分布相关。因此,乙醇分级沉淀法是一种可应用于分离高免疫活性PD的方法。后续需进一步纯化PD-40片段并进行更系统的分析以阐明其特异性结构及其与免疫活性的关系。
[1] BOROWITZKA L J, BOROWITZKA M A, MOULTON T P.The mass culture of Dunaliella salina for fine chemicals:From laboratory to pilot plant[J].Hydrobiologia, 1984, 116(1):115-121.
[2] 庄坤.两种工业杜氏盐藻生长的优化和β-胡萝卜素积累机制的研究[D].沈阳:沈阳农业大学, 2020.
ZHUANG K.Growth optimization and β-carotene accumulation in two industrial strains of Dunaliella salina[D].Shenyang:Shenyang Agricultural University, 2020.
[3] BROWN M R.The amino-acid and sugar composition of 16 species of microalgae used in mariculture[J].Journal of Experimental Marine Biology and Ecology, 1991, 145(1):79-99.
[4] FABREGAS J, GARC A D, FERNANDEZ-ALONSO M, et al.In vitro inhibition of the replication of haemorrhagic septicaemia virus (VHSV) and African swine fever virus (ASFV) by extracts from marine microalgae[J].Antiviral Research, 1999, 44(1):67-73.
A D, FERNANDEZ-ALONSO M, et al.In vitro inhibition of the replication of haemorrhagic septicaemia virus (VHSV) and African swine fever virus (ASFV) by extracts from marine microalgae[J].Antiviral Research, 1999, 44(1):67-73.
[5] 郑维发, 王莉, 石枫, 等.盐藻水提物对小鼠细胞免疫功能的影响[J].中成药, 2004, 26(12):1031-1036.
ZHENG W F, WANG L, SHI F, et al.Effects on cell immunity in mice by water extract of Dunaliella salina[J].Chinese Traditional Patent Medicine, 2004, 26(12):1031-1036.
[6] CHEN H G, XIAO R X, ZHOU X.Study on the extraction, purification, partial chemical characterization and anti-alcohol liver injury activity of Mori Fructus polysaccharides[J].New Journal of Chemistry, 2020, 44(46):20060-20070.
[7] CHOU C H, SUNG T J, HU Y N, et al.Chemical analysis, moisture-preserving, and antioxidant activities of polysaccharides from Pholiota nameko by fractional precipitation[J].International Journal of Biological Macromolecules, 2019, 131:1021-1031.
[8] GAO W H, ZHANG P L, LIN P Z, et al.Comparison of Litchi polysaccharides extracted by four methods:Composition, structure and in vitro antioxidant activity[J].International Journal of Food Science &Technology, 2020, 55(3):1343-1350.
[9] 徐锡莲. 盐藻胞外多糖的分离与结构研究[D].杭州:浙江大学, 2007.
XU X L.Study on the separation and structure of extracellular polysaccharide from Dunaliella salina[D].Hangzhou:Zhejiang University, 2007.
[10] 刘云鹤, 周鸣谦, 朱蓓蕾.盐藻水溶性多糖的提取和纯化[J].淮海工学院学报(自然科学版), 2012, 21(1):88-91.
LIU Y H, ZHOU M Q, ZHU B L.Extraction and purification of polysaccharides from Duanaliella salina[J].Journal of Huaihai Institute of Technology (Natural Sciences Edition), 2012, 21(1):88-91.
[11] 李秀霞, 孙协军, 王珍, 等.盐藻多糖提取及初步纯化[J].渤海大学学报(自然科学版), 2012, 33(4):334-340;349.
LI X X, SUN X J, WANG Z, et al.Extraction and preliminary purification of polysaccharide from Dunaliella salina[J].Journal of Bohai University (Natural Science Edition), 2012, 33(4):334-340;349.
[12] 戴军. 杜氏盐藻多糖的提取、分离分析及其生物活性的研究[D].无锡:江南大学, 2007.
DAI J.Study on isolation, identification and bioactivity of polysaccharides from Duanaliella salina[D].Wuxi:Jiangnan University, 2007.
[13] 钟闰, 吴思伟, 何秀苗, 等.杜氏盐藻胞外多糖抗肿瘤活性及其机制研究[J].食品工业科技, 2020, 41(22):126-133.
ZHONG R, WU S W, HE X M, et al.Antitumor activity and mechanism of exopolysaccharide from Dunaliella salina[J].Science and Technology of Food Industry, 2020, 41(22):126-133.
[14] DUBOIS M, GILLES K A, HAMILTON J K, et al.Colorimetric method for determination of sugars and related substances[J].Analytical Chemistry, 1956, 28(3):350-356.
[15] BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry, 1976, 72(1-2):248-254.
[16] BITTER T, MUIR H M.A modified uronic acid carbazole reaction[J].Analytical Biochemistry, 1962, 4(4):330-334.
[17] LI L Q, SONG A X, YIN J Y, et al.Anti-inflammation activity of exopolysaccharides produced by a medicinal fungus Cordyceps sinensis Cs-HK1 in cell and animal models[J].International Journal of Biological Macromolecules, 2020, 149:1042-1050.
[18] HU X T, GOFF H D.Fractionation of polysaccharides by gradient non-solvent precipitation:A review[J].Trends in Food Science &Technology, 2018, 81:108-115.
[19] 付海宁, 赵峡, 于广利, 等.盐藻多糖单糖组成分析的四种色谱方法比较[J].中国海洋药物, 2008, 27(4):30-34.
FU H N, ZHAO X, YU G L, et al.Comparison of four chromatographic methods for monosaccharide composition analysis of Dunaliella salina polysaccharide[J].Chinese Journal of Marine Drugs, 2008, 27(4):30-34.
[20] GUO R, AI L Z, CAO N N, et al.Physicochemical properties and structural characterization of a galactomannan from Sophora alopecuroides L.seeds[J].Carbohydrate Polymers, 2016, 140:451-460.
[21] CHEN G J, BAI Y X, ZENG Z Q, et al.Structural characterization and immunostimulatory activity of heteropolysaccharides from fuzhuan brick tea[J].Journal of Agricultural and Food Chemistry, 2021, 69(4):1368-1378.
[22] 唐方媛, 张娅娣, 刘咏, 等.白玉菇多糖理化性质及免疫活性研究[J].合肥工业大学学报(自然科学版), 2024, 47(2):283-288.
TANG F Y, ZHANG Y D, LIU Y, et al.Physicochemical properties and immune activities of polysaccharides from white Hypsizygus marmoreus[J].Journal of Hefei University of Technology (Natural Science), 2024, 47(2):283-288.
[23] 贺妍, 戴阿利, 王怡, 等.北虫草多糖诱导巨噬细胞极化的机制研究[J].延安大学学报(自然科学版), 2024, 43(1):8-12.
HE Y, DAI A L, WANG Y, et al.Study on the mechanism of polarization of macrophages induced by Cordyceps militaris polysaccharides[J].Journal of Yan’an University (Natural Science Edition), 2024, 43(1):8-12.
[24] KOHCHI C, INAGAWA H, NISHIZAWA T, et al.ROS and innate immunity[J].Anticancer Research, 2009, 29(3):817-821.
[25] HUANG Q L, SIU K C, WANG W Q, et al.Fractionation, characterization and antioxidant activity of exopolysaccharides from fermentation broth of a Cordyceps sinensis fungus[J].Process Biochemistry, 2013, 48(2):380-386.
[26] 赵丽, 金周雨, 荆波, 等.多糖受体与巨噬细胞吞噬作用关系研究进展[J].食品科学, 2019, 40(21):311-316.
ZHAO L, JIN Z Y, JING B, et al.Recent progress in the relationship between polysaccharide receptor and macrophage phagocytosis[J].Food Science, 2019, 40(21):311-316.