食叶草(Rumex patientia L.× Rumex tianschanicus A.LOS)是用鲁梅克斯 K-1与巴天酸模杂交的植物新品种,多年生宿根草本植物,属于蓼科(Polygonaceae)酸模属(Rumex)[1]。食叶草的干基蛋白质含量高达 (32.50±0.14) g/100 g[2],故又称“蛋白草”,是一种潜在的植物蛋白质优质来源。食叶草在畜牧领域具有多年生、寿命长、产量高、适应性强等优点[3];在营养方面,食叶草蛋白质含量高,并且富含人体必需的氨基酸,如谷氨酸、亮氨酸、天门冬氨酸等;矿物质元素比较齐全,特别是钙、钾、镁、铁的含量较高,每1 kg食叶草粉中含有钙 21.8 g、钾 17.2 g;另外食叶草还含有丰富的超氧化物歧化酶、维生素C、维生素E、膳食纤维等营养物质。2021年,食叶草被我国卫生健康委员会列为新食品原料,其在食品、医药保健、饲料等领域的综合开发利用具有重大意义。
目前我国对食叶草的研究利用主要集中在农业领域和畜牧领域,而对于食叶草蛋白的提取工艺研究甚少。国内外关于叶蛋白提取工艺的研究原料以苜蓿为主,其他研究还包括桑叶、辣木叶、甘薯叶等[4-9]。HADIDI等[4]运用超声超滤辅助碱溶酸沉的方法提取苜蓿叶蛋白,得率为14.5%,纯度可达91.1%,该方法能够有效去除抗营养因子皂苷和酚类化合物;KOBBI等[5]使用氢氧化铵沉淀苜蓿叶蛋白,纯度高达90%,并认为叶蛋白可以作为生产新型工业肽的的替代来源;张有鑫[6]通过超声波辅助的碱溶酸沉法提取苜蓿叶蛋白,提取率为53.02%;邓翔等[7]通过响应面法优化微波辅助提取桑叶蛋白的工艺,提取率仅为35.84%;杨豪等[8]通过盐析法提取辣木叶蛋白,得率为1.35%;王世宽等[9]采用乳酸发酵法提取甘薯叶蛋白,提取率为52.57%,粗蛋白的纯度为63.28%。总体来说,现有的叶蛋白提取工艺存在蛋白质得率、纯度较低,叶蛋白颜色较深等问题,亟待开发一种能够提高叶蛋白得率、纯度,并改善颜色的新方法。
本研究开发了乙醇预处理结合碱溶酸沉提取食叶草蛋白的新工艺,采用响应面法对提取的工艺条件进行优化,以最大限度地提高食叶草蛋白的得率和纯度。同时将食叶草蛋白的理化性质和功能特性与大豆分离蛋白、乳清蛋白进行对比,为食叶草蛋白在后续食品工业生产中的应用提供数据支撑,实现食叶草的高值化利用。
1 材料与方法
1.1 材料与试剂
食叶草,由森源集团提供;大豆分离蛋白和乳清蛋白样品,亿宝莱食品配料有限公司;95%乙醇、NaOH、HCl、CuSO4·5H2O、K2SO4、H2SO4、硼酸、亚甲基红、溴甲酚绿、苯酚、葡萄糖、KBr、Na2HPO4、NaH2PO4、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、Folin-酚、牛血清蛋白、四水合酒石酸钾钠均为分析纯,国药集团化学试剂有限公司;大豆油,金龙鱼粮油食品股份有限公司。
1.2 仪器与设备
BL-1 8PP打浆机,多乐机械设备有限公司;SU8100冷场发射扫描电镜、F-7000荧光分光光度计、CR-30 NX高速冷冻离心机,日立有限公司;冷冻干燥机,美国 LABCONCO 公司;HH-6YJ恒温水浴磁力搅拌器,上海易友仪器有限公司;KDN-08A凯氏定氮仪,上海力辰邦西仪器科技有限公司;P7分光光度计,上海美谱达仪器有限公司;Agilent 1260高效液相色谱仪,美国安捷伦科技公司;JASCO-1700圆二色谱仪,日本分光株式会社;T25高速剪切分散机,德国 IKA 集团。
1.3 实验方法
1.3.1 食叶草蛋白的提取工艺
1.3.1.1 乙醇预处理
将新鲜的食叶草用清水洗净,除去杂物,沥干水分,切成 1~2 cm小段。将95%乙醇预冷至-20 ℃,再按照鲜叶∶95%乙醇=1∶4(质量比)的料液比在打浆机中进行打浆,打浆完成后冷却至 4 ℃。将冷却后的浆液过 100 目筛以去除粗纤维,得到食叶草蛋白-乙醇混合物,抽滤后取滤纸上的滤渣,将其反复醇洗至无绿色,低温烘干后过 100 目筛,即得食叶草粗蛋白粉。
1.3.1.2 食叶草蛋白的提取
将食叶草粗蛋白粉按照不同的料液比分散在蒸馏水中,加入不同量的 NaOH,在 40~90 ℃ 进行食叶草蛋白的提取。当提取完成后,7 000 r/min 离心 20 min。取上清液用 1 mol/L 的盐酸调节pH值至3~5。随后,上述混合物于7 000 r/min 条件下离心 20 min。取沉淀用蒸馏水洗涤两遍后冻干即得食叶草蛋白。
1.3.2 食叶草蛋白提取工艺的优化
1.3.2.1 单因素试验设计
碱溶部分以蛋白质提取率为指标,分别考察碱溶温度、加碱量、料液比、碱溶时间4个因素对食叶草蛋白提取效果的影响,每个因素各取6个梯度。碱溶温度为:40、50、60、70、80、90 ℃,加碱量为:3、6、9、12、15、18 g/L,食叶草粗蛋白粉与水的料液比为:1∶10、1∶20、1∶30、1∶40、1∶50、1∶60(g∶mL),碱溶时间为:0.5、1.0、1.5、2.0、2.5、3.0 h。本实验所涉及的液体的蛋白浓度和固体的蛋白含量均采用 GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》凯氏定氮法进行检测。蛋白质提取率计算见公式(1)。
蛋白质提取率![]()
(1)
式中:ρ,蛋白提取液的蛋白质量浓度,g/mL;V,蛋白提取液的体积,mL;PR,食叶草粗蛋白的蛋白含量,g/100 g;m,所用食叶草粗蛋白的质量,g。
酸沉部分以蛋白质沉淀率和蛋白质纯度为指标,考察 pH 对食叶草蛋白沉淀效果的影响,取 pH 2.5、3.0、3.5、4.0、4.5、5.0 六个梯度。蛋白质沉淀率计算见公式(2)。
蛋白质沉淀率![]()
(2)
式中:ρ1,蛋白提取液的蛋白质量浓度,g/mL;V1,蛋白提取液的体积,mL;ρ2,蛋白沉淀后上清液的蛋白质量浓度,g/mL;V2,蛋白沉淀后上清液的体积,mL。
1.3.2.2 响应面试验设计
根据单因素试验结果,选取碱溶温度、加碱量、料液比和 pH 较优的3个水平,以蛋白质得率和蛋白质纯度为响应变量,采用响应面法对提取工艺参数进行优化,并考察各因素之间的交互作用。蛋白质得率的计算见公式(3),蛋白质纯度为食叶草蛋白的蛋白含量,实验各因素与水平编码见表1。
蛋白质得率![]()
(3)
表1 食叶草蛋白提取工艺因素与水平编码
Table 1 Experimental factors and level coding of the extraction process of edible dock

水平编码X1碱溶温度/℃X2加碱量/(g/L)X3料液比(g∶mL)X4 pH-17061∶203.008091∶303.5190121∶404.0
式中:PR1,制备得到的食叶草蛋白的蛋白含量,g/100 g;m1,制备得到的食叶草蛋白的质量,g;PR2,食叶草粗蛋白的蛋白含量,g/100 g;m2,所用食叶草粗蛋白的质量,g。
使用 Design Expert 软件对结果进行分析,在两个变量的中心水平保持两个变量,并构建两个因素的三维图。对响应和自变量进行数据分析,得到二阶多项式模型见公式(4)。
(4)
式中:Y,预测响应值;Xi和Xj,自变量;b0,常数系数;bi,一次项系数;bii,二次项系数;bij,相互作用系数;n,自变量的个数。
1.3.3 食叶草蛋白结构表征
1.3.3.1 氨基酸组成的测定
采用邻苯二甲醛(O-phthalaldehyde,OPA)柱前衍生反相高效液相色谱-紫外检测法对蛋白试样的氨基酸含量进行测定。称取100 mg蛋白粉末样品放入水解管中,加入8 mL 6 mol/L 的HCl溶液,充N2后盖紧水解管管盖,于120 ℃下充分酸水解 24 h。水解后的样品加入 10 mL 10 mol/L 的 NaOH溶液中和,用蒸馏水定容至 25 mL,用双层滤纸过滤。取 1 mL 澄清滤液,在 10 000 r/min下离心 10 min。取 400 μL 上清液于样品瓶中用于氨基酸分析。用OPA柱前自动衍生,在 Agilent 1260 高效液相色谱仪上进行氨基酸组成分析测定。
1.3.3.2 圆二色性光谱(circular dichroism,CD)的测定
取适量的蛋白试样在磷酸盐缓冲液 (0.01 mol/L, pH 7.0) 中配制成 0.1 mg/mL 的蛋白溶液,使用圆二色光谱仪收集在 190~240 nm 的 CD 光谱,带宽为 0.5 nm,扫描速度为 0.8 nm/min,使用杨氏算法计算蛋白的二级结构。
1.3.3.3 荧光光谱的测定
取适量的蛋白试样在磷酸盐缓冲液 (0.01 mol/L pH 7.0) 中配制成 1 mg/mL 的蛋白溶液,将蛋白质溶液于 3 000 r/min下离心 10 min,对蛋白上清液进行测定。设置荧光分光光度计激发波长为 280 nm,扫描范围为 300~500 nm,激发狭缝和发射狭缝宽均为 5 nm。
1.3.3.4 扫描电镜(scanning electron microscope,SEM)的测定
在样品盘上贴上导电胶,将少量蛋白试样用牙签均匀地黏合在导电胶上,用洗耳球吹去未黏住的样品,然后放入真空蒸发器中镀上金属膜(2~5 次),在真空下将加速电压调至 5 kV,进行电镜扫描。放大倍数为 100、500、1 000倍。
1.3.4 食叶草蛋白功能性质
参考 LI 等[10]和刘静等[11]的方法进行蛋白质功能性质测定。
1.3.4.1 溶解性
将100 mg蛋白试样溶于10 mL纯净水中,用1 mol/L 的HCl或NaOH溶液分别调节蛋白溶液pH值至4.5、6.5、8.5。在 25 ℃下,水浴振荡 30 min,于8 000 r/min下离心 10 min,取上清液测定蛋白含量。蛋白试样溶解度的计算见公式(5)。
蛋白溶解度![]()
(5)
1.3.4.2 起泡性
将10 mg蛋白试样溶于10 mL纯净水中,用1 mol/L 的HCl或NaOH溶液分别调节蛋白溶液pH值至4.5、6.5、8.5,定容至 20 mL,于高速剪切分散机 5 000 r/min 下均质 2 min。分别在静置 0 min 和 30 min 时测定溶液和泡沫的总体积。蛋白试样起泡能力和泡沫稳定性的计算分别见公式(6)和公式(7)。
起泡能力![]()
(6)
泡沫稳定性![]()
(7)
式中:V0,搅拌后静置 0 min 时的总体积,mL;V30,搅拌后静置 30 min 时的总体积,mL;V,搅拌前的体积,mL。
1.3.4.3 乳化性
将50 mg 蛋白试样溶于 10 mL 纯净水中,用1 mol/L的HCl或NaOH溶液分别调节蛋白溶液 pH 至 4.5、6.5、8.5。取 6 mL 蛋白溶液,加入 2 mL 大豆油,于高速剪切分散机 5 000 r/min 下均质 2 min。分别在静置 0 min 和 10 min 时取底部乳化液 50 μL 与 5 mL 1 mg/mL 的 SDS 溶液混匀,以 SDS 溶液为空白对照测定 500 nm 下的吸光度。蛋白试样乳化活性指数(emulsification activity index,EAI)和乳化稳定性指数(emulsification activity index,ESI)的计算公式见公式(8)和公式(9)。
(8)
(9)
式中:φ,油相体积分数,%;ρ,水相中的蛋白质量浓度,g/mL;A0,0 min 时 500 nm 处的吸光度;A10,10 min 时 500 nm 处的吸光度。
1.3.5 数据处理
所有实验均重复3次,数据表示为“平均值±标准差”的形式。使用 SPSS 20.0 对数据进行方差分析,P<0.05 为显著性差异。图表使用 Origin Pro 2023 及 Excel 进行绘制。
2 结果与分析
2.1 乙醇预处理的影响
乙醇预处理的蛋白质损失率仅为(10.35±0.61)%,主要是由于在切割、打浆等过程中损失了一部分原料。并且经过预处理,多酚的去除率为(86.14±3.29)%,粗纤维的去除率为(24.49±1.95)%。这是由于多酚、色素等杂质溶于乙醇,经过醇洗去除了大部分醇溶性物质,而保留了蛋白质,打浆过筛可以去除部分粗纤维。乙醇预处理为后续提取浅色、纯度高的食叶草蛋白创造了先决条件。
2.2 食叶草蛋白的提取工艺优化
2.2.1 不同提取条件对食叶草提取率的影响
2.2.1.1 碱溶温度对食叶草蛋白提取率的影响
如图1-a所示,当碱溶温度在80 ℃以下时,蛋白提取率与温度呈正相关,这是由于随着温度升高,分子间运动加剧,细胞壁的渗透性提高,更加有利于蛋白质的溶解;当温度上升至 80 ℃ 时,蛋白提取率达到峰值,为 (94.07±2.91)%;继续提高温度,蛋白提取率降低,可能过高的温度会导致蛋白质失活从而产生沉淀,导致提取率降低。所以碱溶温度选择 80 ℃ 为宜。
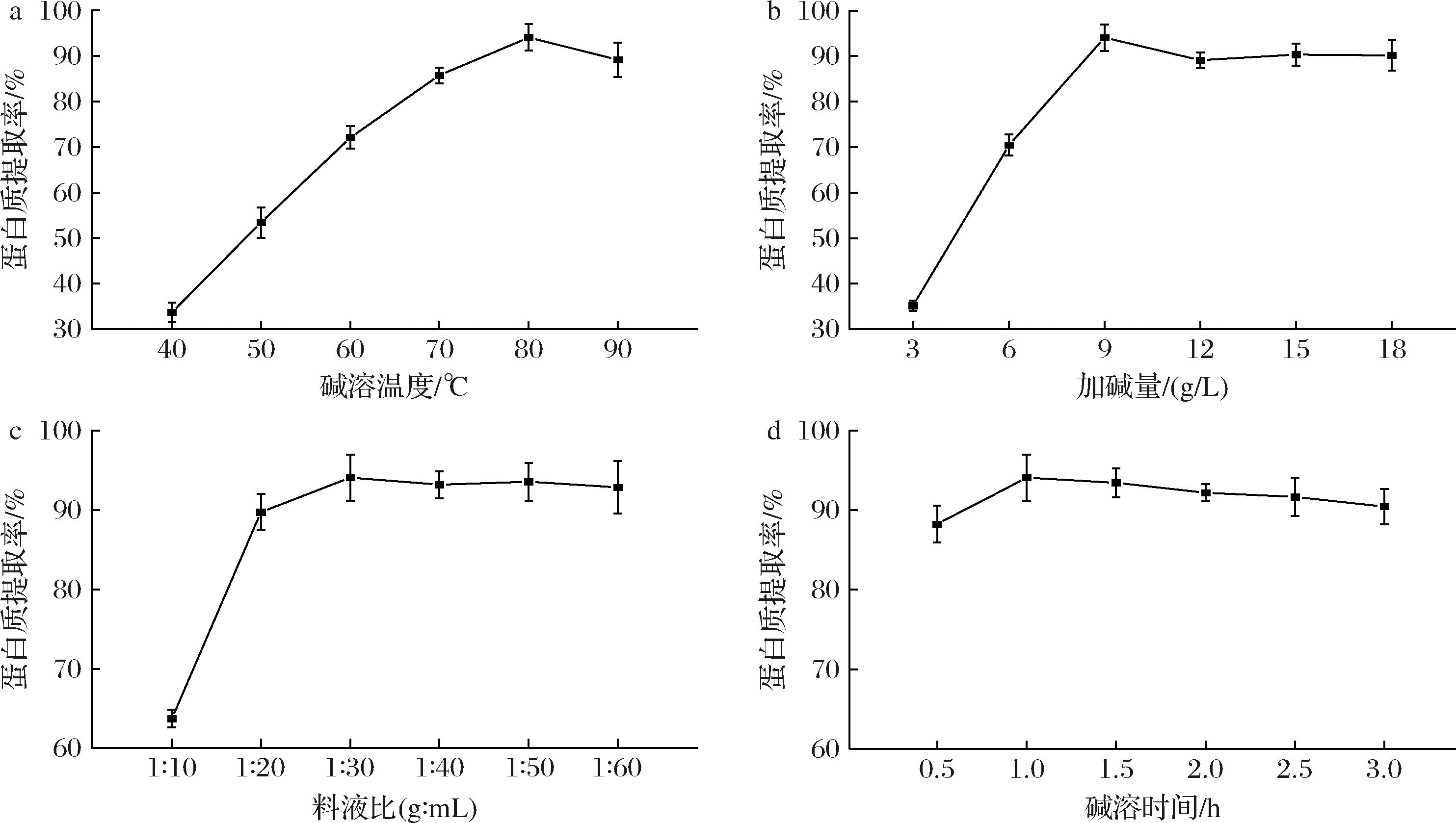
a-碱溶温度;b-加碱量;c-料液比;d-碱溶时间
图1 各因素对食叶草蛋白提取率的影响
Fig.1 The influence of various factors on the extraction ratio of protein from edible dock
2.2.1.2 加碱量对食叶草蛋白提取率的影响
如图1-b所示,加碱量为 9 g/L 以下时,蛋白提取率随着加碱量增大显著升高,加碱量从 3 g/L 增加至 9 g/L,蛋白提取率增大 2.68 倍;而继续增大加碱量,蛋白提取率几乎持平并有下降趋势。这可能是由于碱液浓度过高时,溶液的黏度变大,不易产生空化所致,并且过高碱液浓度会加剧蛋白氧化反应,生成赖氨酸、丙氨酸等有毒物质[12]。所以加碱量选择9 g/L为宜。
2.2.1.3 料液比对食叶草蛋白提取率的影响
如图1-c所示,料液比为 1∶30(g∶mL)时蛋白提取率最高,当料液比为 1∶10(g∶mL)时提取率偏低,这是由于较大的料液比有利于食叶草中的纤维结构充分舒展,从而释放和溶解内部的蛋白质分子;而继续加大料液比,蛋白提取率趋于稳定,且更大的料液比会加大工作量和成本,故选择 1∶30(g∶mL)为食叶草蛋白提取的最佳料液比。
2.2.1.4 碱溶时间对食叶草蛋白提取率的影响
如图1-d所示,在满足其他3个因素的条件下,碱溶时间对蛋白提取率的影响较小,在 1.0 h 时即可达到较好的溶出效果。故选择 1 h 为食叶草蛋白提取的最佳碱溶时间。
2.2.1.5 pH对食叶草沉淀率和纯度的影响
考察了不同pH条件下,对食叶草蛋白沉淀率和纯度的影响,如图2所示。pH 3.5 时蛋白沉淀率最高,为 (68.32±2.33)%,蛋白纯度为 (79.625±3.75)%;pH 4.0 时蛋白纯度最高,为 (83.12±4.51)%,蛋白沉淀率为 (59.53±3.48)%。综合考虑蛋白沉淀率和纯度,选择 pH 3.5 为食叶草蛋白沉淀的最佳条件。
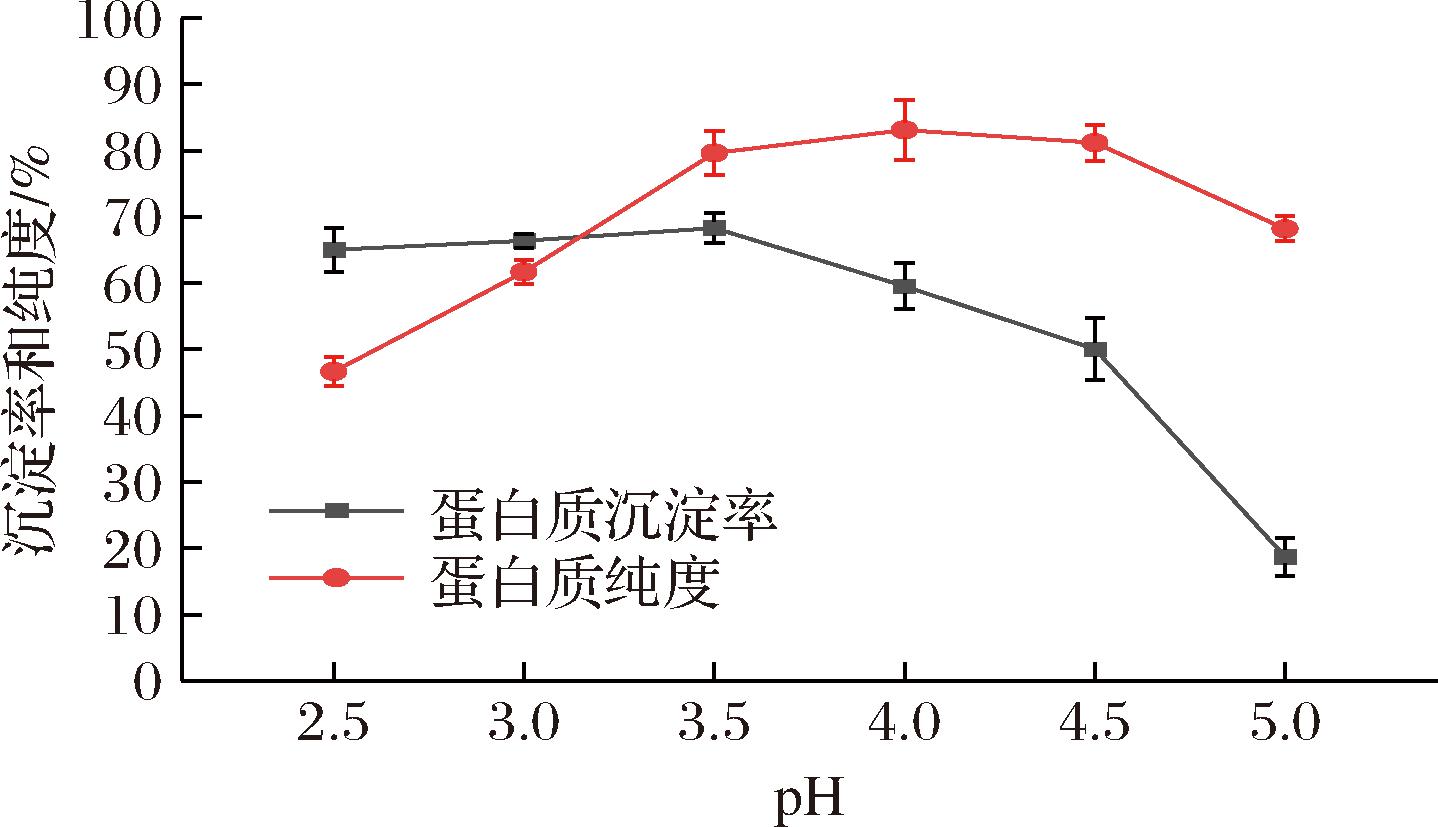
图2 pH 对食叶草蛋白沉淀率和纯度的影响
Fig.2 The influence of pH on the precipitation ratio and purity of protein from edible dock
2.2.2 响应面试验优化工艺条件
2.2.2.1 响应面试验方案设计及结果分析
以碱溶温度(A)、加碱量(B)、料液比(C)和pH(D)为因素,蛋白质得率(Y1)和蛋白质纯度(Y2)为指标,响应面 Box-Behnken 设计矩阵见表2。
表2 响应面 Box-Behnken 设计矩阵
Table 2 Response surface Box-Behnken design matrix
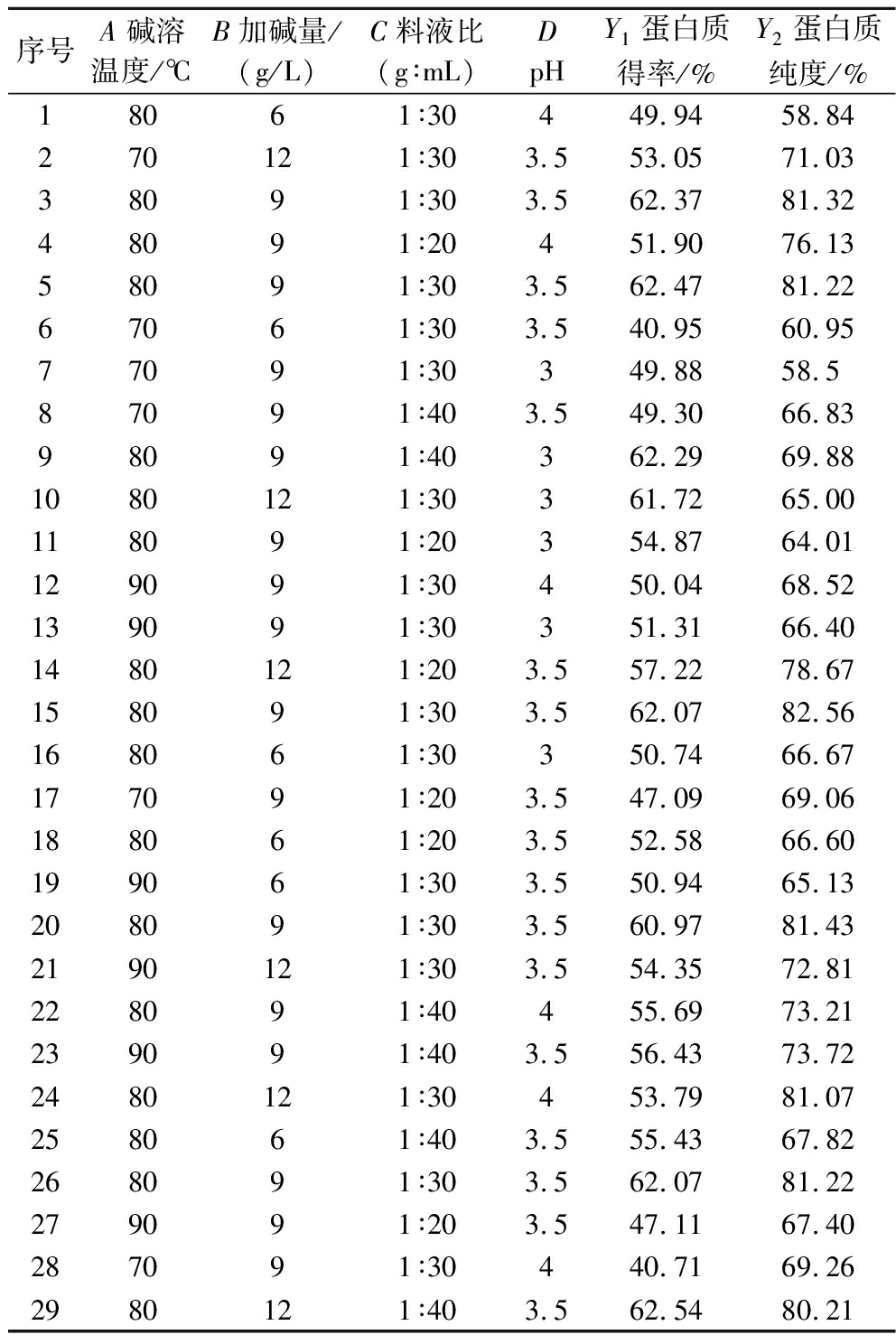
序号A 碱溶温度/℃B加碱量/(g/L)C料液比(g∶mL)DpHY1蛋白质得率/%Y2蛋白质纯度/%18061∶30449.9458.84270121∶303.553.0571.0338091∶303.562.3781.3248091∶20451.9076.1358091∶303.562.4781.2267061∶303.540.9560.9577091∶30349.8858.587091∶403.549.3066.8398091∶40362.2969.881080121∶30361.7265.00118091∶20354.8764.01129091∶30450.0468.52139091∶30351.3166.401480121∶203.557.2278.67158091∶303.562.0782.56168061∶30350.7466.67177091∶203.547.0969.06188061∶203.552.5866.60199061∶303.550.9465.13208091∶303.560.9781.432190121∶303.554.3572.81228091∶40455.6973.21239091∶403.556.4373.722480121∶30453.7981.07258061∶403.555.4367.82268091∶303.562.0781.22279091∶203.547.1167.40287091∶30440.7169.262980121∶403.562.5480.21
采用Box-Behnken设计的实验方案,研究4个工艺因素(碱溶温度、加碱量、料液比和pH)对蛋白质得率和纯度的影响,用方差分析对所建立的回归模型方程进行评价,回归模型与方差分析结果如表3所示。由方差分析可知,两种响应的模型F值分别为89.97和81.80,P值均<0.000 1,说明模型拟合极显著,实验设计方案可靠,具有统计学意义。失拟项P值分别为0.153 6 和 0.066 2,均 >0.05,表明其对于纯误差不显著。Y1和 Y2模型的相关系数R2分别为 0.989 0和0.987 9,说明响应值的变化有98.9%和98.79%来源于所选变量,并且 Adj-R2分别为 0.978 0 和 0.975 8,说明预测值与实际值的关联度较高,可用于分析预测食叶草蛋白提取的最佳工艺及蛋白质得率和纯度。此外,Y1和 Y2 的变异系数(1.71和1.59)均不显著,说明预测值与实际值比较接近。经回归拟合后得到 Y1 和 Y2 的二阶多项式方程,以确定工艺因素与响应值之间的关系:
表3 回归模型与方差分析结果
Table 3 Regression model and analysis of variance results

来源蛋白质得率(Y1)/%蛋白质纯度(Y2)/%系数F值P值系数F值P值模型61.9989.97 <0.000 11461.91 81.80 <0.000 1A2.4382.99 <0.000 127.84 21.81 0.000 4B3.51172.25 <0.000 1328.53 257.35 <0.000 1C2.5892.95 <0.000 18.00 6.27 0.025 3D-2.3980.32 <0.000 1111.02 86.97 <0.000 1AB-2.1722.03 0.000 3 1.44 1.13 0.306 5AC1.7814.780.001 818.2614.300.002AD1.9718.190.000 818.3414.360.002BC0.621.780.203 20.020.020.891 3BD-1.7814.850.001 8142.87111.91<0.000 1CD-0.913.830.070 619.3215.140.001 6A2-9.59696.65<0.000 1484.03379.16<0.000 1B2-3.0871.94<0.000 1196.08153.60<0.000 1C2-1.9328.230.000 164.6850.66<0.000 1D2-4.38145.11<0.000 1389.97297.65<0.000 1失拟项2.960.153 65.050.066 2变异系数1.711.59R20.989 00.987 9Adj-R20.978 00.975 8
Y1=61.99+2.43A+3.51B+2.58C-2.39D-2.17AB+1.78AC+1.97AD+0.62BC-1.78BD-0.91CD-9.59A2-3.08B2-1.93C2-4.38D2
Y2=81.55+1.52A+5.23B+0.82C+3.04D-0.60AB+2.14AC-2.14AD+0.08BC+5.98BD-2.20CD-8.64A2-5.50B2-3.16C2-7.65D2
2.2.2.2 各工艺因素对食叶草蛋白提取工艺的影响
由表3可知,Y1各线性项的P值均<0.01,这表明碱溶温度、加碱量、料液比和 pH 对蛋白质得率的影响是极显著的。由F值可以看出各因素影响蛋白得率的主次顺序为:B(加碱量)>C(料液比)>A(碱溶温度)>D(pH)。对于Y2,因素 A、B、D的P<0.01,说明碱溶温度、加碱量和 pH 对蛋白质纯度的影响是极显著的,因素C的P值<0.05,说明料液比对蛋白质纯度的影响是显著的。各因素影响蛋白得率的主次顺序为:B(加碱量)>D(pH)>A(碱溶温度)>C(料液比)。
此外,Y1的交互项AB、AC、AD、BD呈极显著的二次效应(P<0.01),根据方差分析计算出的实际方程式绘制三维响应面图,各工艺因素对食叶草蛋白得率的交互影响如图3-a~图3-d所示,交互作用显著性程度为:AB>AD>AC>BD。Y2的交互项 AC、AD、BD、CD呈极显著的二次效应(P<0.01),其三维响应面图如图3-e~图3-h所示,交互作用显著性程度为:BD>CD>AC>AD。

a-碱溶温度和加碱量对食叶草蛋白得率的影响;b-碱溶温度和料液比对食叶草蛋白得率的影响;c-碱溶温度和pH对食叶草蛋白得率的影响;d-加碱量和pH对食叶草蛋白得率的影响;e-碱溶温度和料液比对食叶草蛋白纯度的影响;f-碱溶温度和pH对食叶草蛋白纯度的影响;g-加碱量和pH对食叶草蛋白纯度的影响;h-料液 比和pH对食叶草蛋白纯度的影响
图3 各工艺因素对食叶草蛋白得率和纯度的交互影响的三维响应面图
Fig.3 Three dimensional response surface graph of the interactive effects of various process factors on the yield and purity of edible dock protein
图4 食叶草蛋白的外观图
Fig.4 Appearance image of edible dock protein
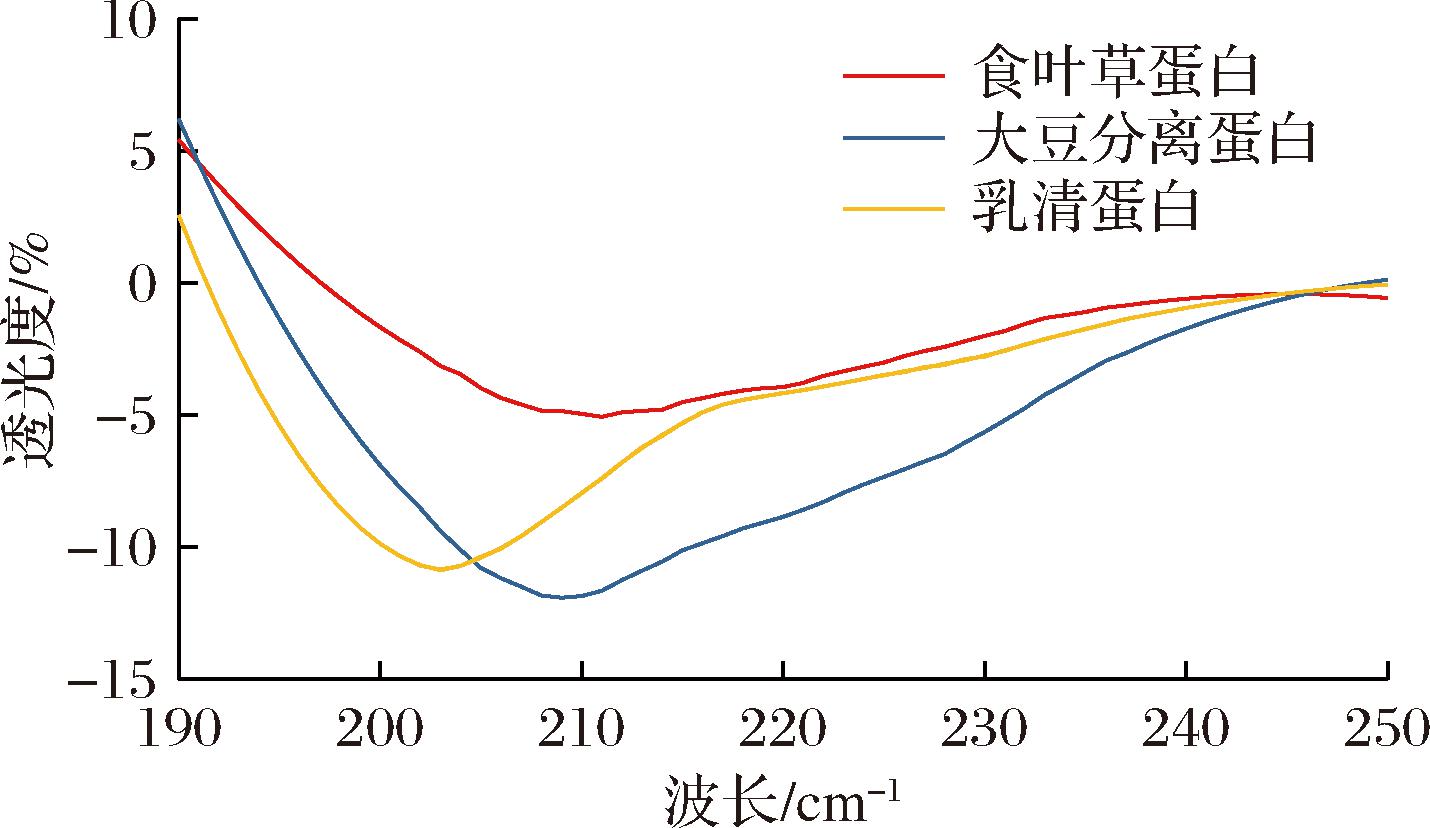
图5 三种蛋白质的 CD 光谱图
Fig.5 CD spectrogram of three proteins
2.2.2.3 最佳工艺条件验证
通过响应面分析法对食叶草蛋白提取工艺进行优化,优化出的最佳工艺条件为:碱溶温度81.12 ℃,加碱量10.57 g/L,料液比 1∶34.04(g∶mL),pH 3.53,在此条件下预测蛋白质得率最高为 63.73%,蛋白质纯度最高为 82.99%。按照该工艺条件提取出的蛋白质呈米黄色,实际蛋白质得率为 (63.26±1.01)%,蛋白质纯度为 (81.63±2.35)%,与理论预测值相近,说明该模型与实际情况拟合良好。
2.3 食叶草蛋白的结构表征
2.3.1 氨基酸组成分析
实验发现,食叶草蛋白由天冬氨酸、谷氨酸、甘氨酸、苯丙氨酸等氨基酸组成,其含量如表4 所示。食叶草蛋白半胱氨酸和甲硫氨酸的含量较低,为第一限制氨基酸。在食叶草蛋白中,赖氨酸、苯丙氨酸、甲硫氨酸、苏氨酸等 8 种必需氨基酸含量为42.49%,高于世界卫生组织(World Health Organization,WHO)/联合国粮食及农业组织(Food and Agriculture Organization of the United Nations,FAO)的规定值(40%),高于大豆分离蛋白 (34.77%),但略低于乳清蛋白 (49.53%),是优良的蛋白质来源[2]。
表4 三种蛋白质的氨基酸组成 单位:g/100 g蛋白质
Table 4 Amino acid composition of three proteins
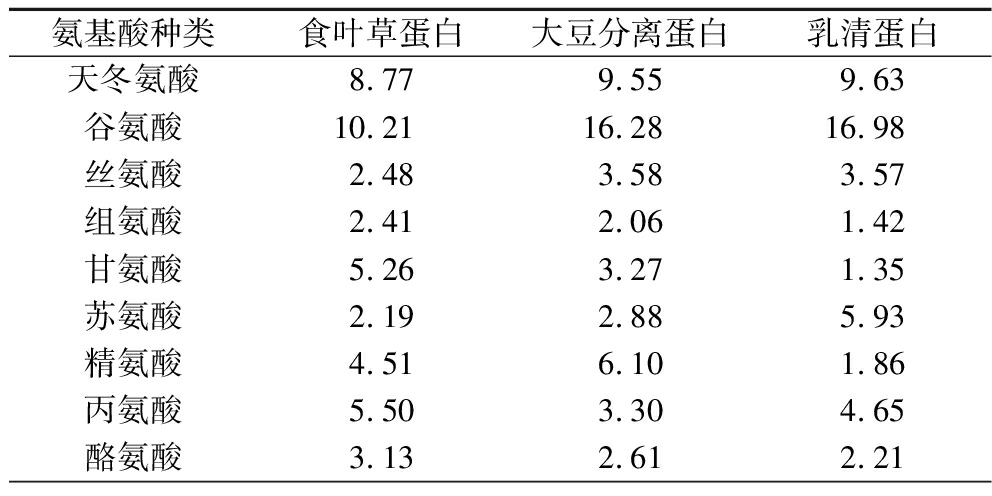
氨基酸种类食叶草蛋白大豆分离蛋白乳清蛋白天冬氨酸8.779.559.63谷氨酸10.2116.2816.98丝氨酸2.483.583.57组氨酸2.412.061.42甘氨酸5.263.271.35苏氨酸2.192.885.93精氨酸4.516.101.86丙氨酸5.503.304.65酪氨酸3.132.612.21
续表4

氨基酸种类食叶草蛋白大豆分离蛋白乳清蛋白半胱氨酸0.040.451.04缬氨酸6.054.245.40甲硫氨酸1.941.202.03苯丙氨酸5.694.202.48异亮氨酸5.113.995.99亮氨酸8.856.409.45赖氨酸4.244.978.43脯氨酸3.814.135.16氨基酸总量80.1879.2287.59
2.3.2 CD光谱分析
CD 光谱可以反映蛋白质主链肽键的构象,用于评估不同蛋白的二级结构,包括 α-螺旋、β-折叠、β-转角和无规卷曲的相对含量。蛋白质的稳定性随 α-螺旋含量的增加而增强[13],而β-折叠结构含量的减少,可能意味着蛋白质的疏水位点暴露,使表面疏水性增加[14]。同时,无规卷曲的比例增加,可以形成更致密、更均匀的蛋白质凝胶网络[15]。
使用杨氏算法计算出的蛋白的二级结构如表5 所示。可以看出,食叶草蛋白与大豆分离蛋白的二级结构具有相似性,无规卷曲含量较高,分别为52.5% 和 52.2%,这表明两者都有可能形成致密蛋白质凝胶网络;食叶草蛋白和乳清蛋白的β-折叠含量分别为3.8% 和 4.0%,而大豆分离蛋白的β-折叠含量仅为 0.9%,食叶草蛋白和乳清蛋白的β-折叠含量较高,可能意味着食叶草蛋白和乳清蛋白的亲水性高于大豆分离蛋白;乳清蛋白的α-螺旋含量为56.9%,远高于食叶草蛋白和大豆分离蛋白,可能说明食叶草蛋白的稳定性低于乳清蛋白。
表5 三种蛋白质的二级结构 单位:%
Table 5 The secondary structure of three proteins

试样α-螺旋β-折叠β-转角无规卷曲食叶草蛋白36.1±0.04a3.8±0.03b11.2±0.11b52.5±0.04b大豆分离蛋白37.0±0.02a0.9±0.00a9.9±0.02a52.2±0.06b乳清蛋白56.9±0.17b4.0±0.08b20.6±0.09c21.8±0.12a
注:不同字母表示同个指标之间的差异显著(P<0.05)。
2.3.3 荧光光谱分析
荧光光谱主要取决于色氨酸残基周围环境的极性,可用于检测蛋白质的三级结构变化[16]。由图6 可知,食叶草蛋白、大豆分离蛋白和乳清蛋白的最大荧光峰位分别为 345、342、332 nm,这说明相比其他两种蛋白,食叶草蛋白分子在溶液中的暴露程度更大,色氨酸残基更趋向于从蛋白质分子内部的疏水环境向表面极性较强的环境移动;食叶草蛋白的荧光强度与大豆分离蛋白相近,低于乳清蛋白,这可能是由于食叶草蛋白和大豆分离蛋白的去折叠程度较高,从而无规卷曲含量较高,更多的疏水基团暴露于溶剂中,导致荧光强度较低[17]。
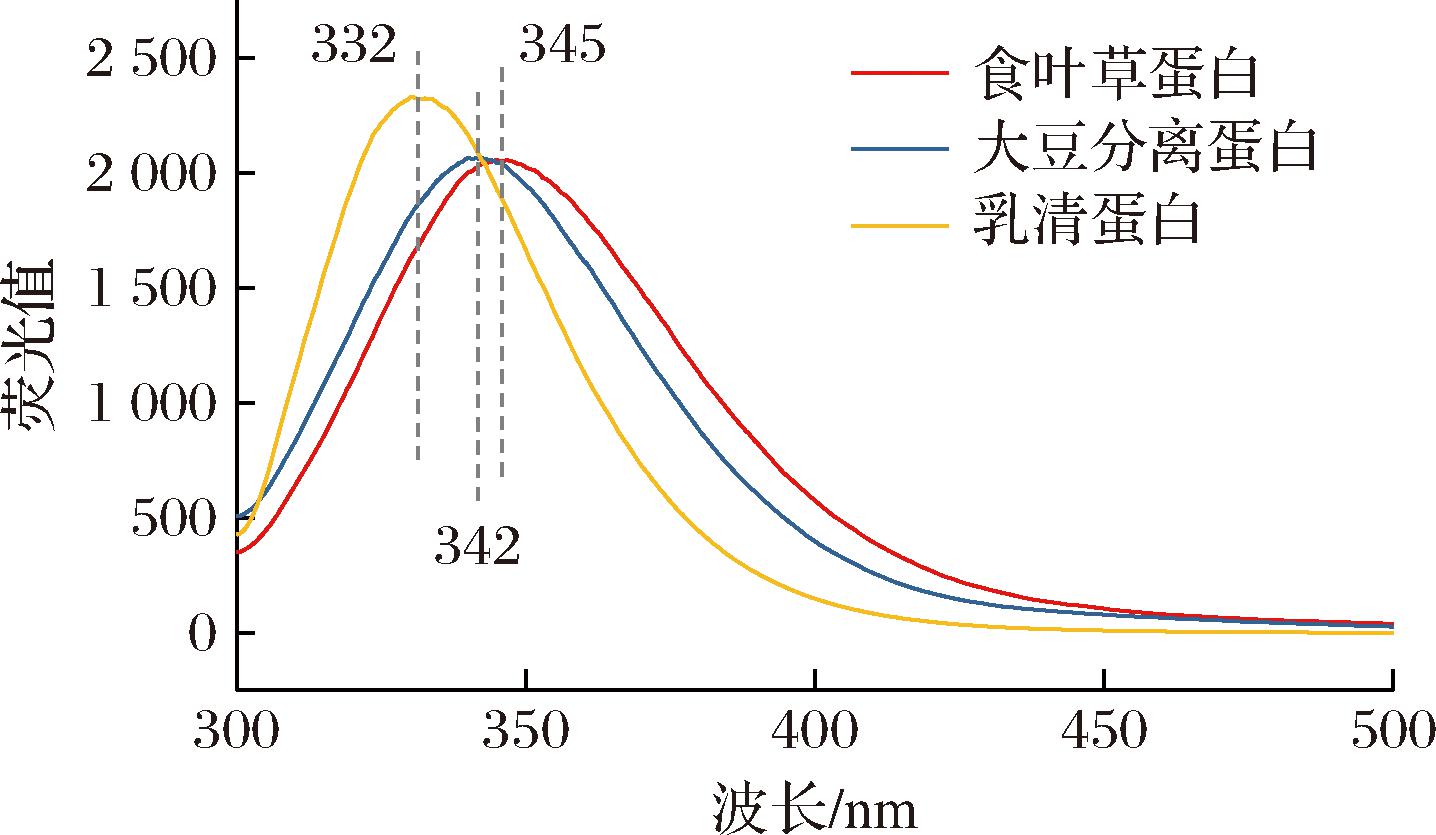
图6 三种蛋白质的本征荧光光谱图
Fig.6 Intrinsic fluorescence spectra of three proteins
2.3.4 SEM 分析
3种蛋白质的SEM图如图7所示。

a-放大100倍的食叶草蛋白;b-放大500倍的食叶草蛋白;c-放大1 000倍的食叶草蛋白;d-放大100倍的大豆分离蛋白;e-放大500倍的大豆分离蛋白;f-放大1 000倍的大豆分离蛋白;g-放大100倍的乳清蛋白;h-放大500倍的乳清蛋白;i-放大1 000倍的 乳清蛋白
图7 三种蛋白质的 SEM 图
Fig.7 SEM images of three proteins
食叶草蛋白颗粒较为聚集,呈堆积状;大豆分离蛋白主要呈球状,表面凹凸不平;乳清蛋白呈均一球状,表面有空穴。这可能是由于在预处理过程中加入乙醇使得食叶草蛋白失水塌陷,形成高聚合形态[18]。
2.4 食叶草蛋白的功能性质
2.4.1 溶解性
由图8可知,食叶草蛋白的溶解性优于大豆分离蛋白而低于乳清蛋白。食叶草蛋白的溶解度随 pH 增加而增大,pH 8.5 时,食叶草蛋白溶解度达到(90.42±1.44)%,这与PREVOT-D’ALVISE等[19]的研究结果类似:紫花苜蓿叶中的 RuBisCO 在pH 为 12 时,溶解度能够达到 90%。这是因为食叶草蛋白的等电点为 pH 3.5 左右,在中性和碱性条件下,pH 偏离等电点,蛋白质带同种正电荷,离子斥力和水合作用增强,促进了蛋白质的溶解。
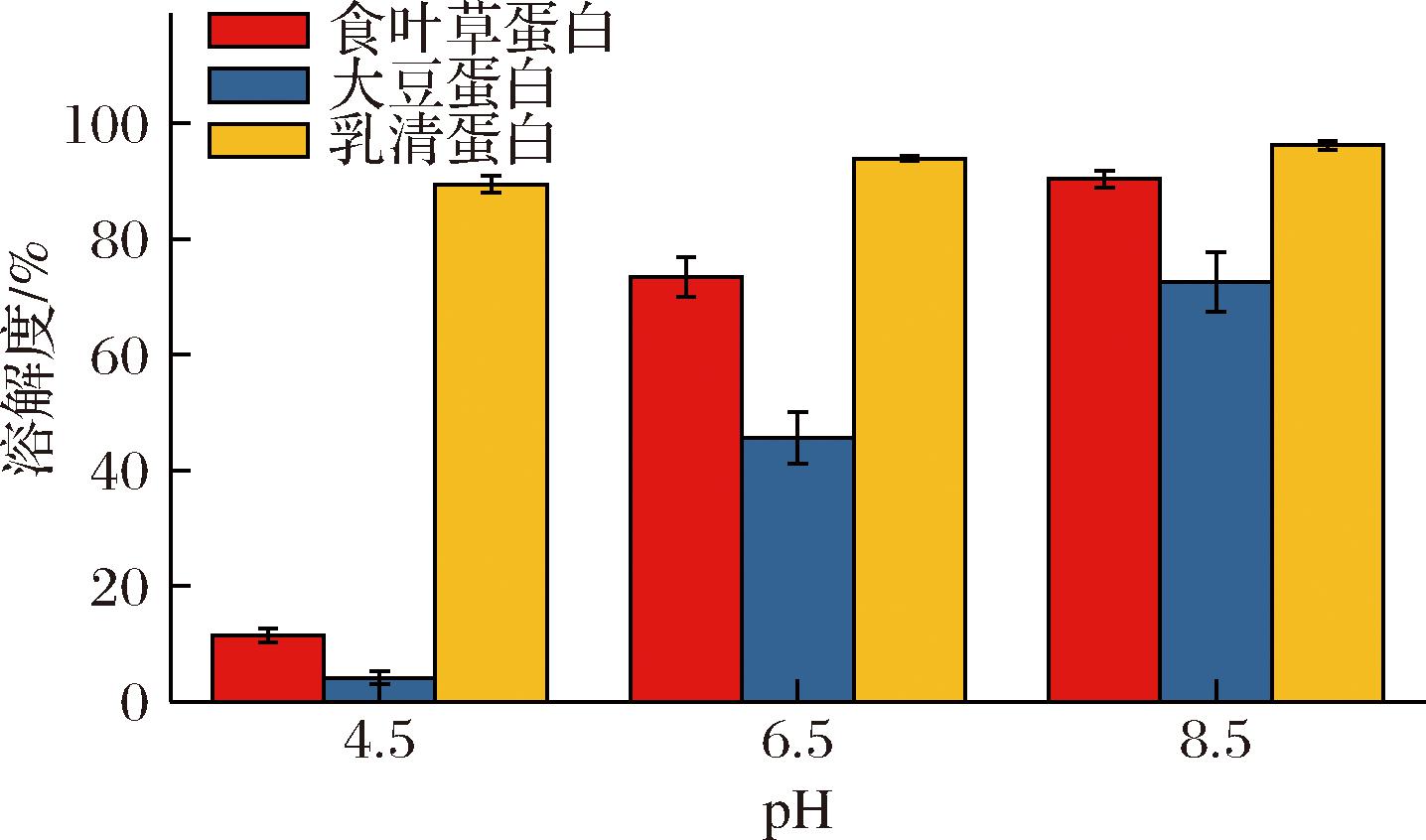
图8 三种蛋白在不同 pH 下的溶解性
Fig.8 The solubility of three proteins at different pH levels
2.4.2 起泡性
蛋白质的起泡性取决于蛋白质在气-液界面形成薄膜的能力,蛋白质在搅打过程中能够快速在气-液界面形成薄膜,使气泡进入并稳定[20]。如图9所示,食叶草蛋白的起泡能力和起泡稳定性随 pH 的升高而增大,在 pH 8.5 时,食叶草蛋白的起泡能力为(12.5±0.94)%,起泡稳定性为(13.25±2.31)%;食叶草蛋白的起泡性略高于大豆分离蛋白,但是远低于乳清蛋白,这可能是由于食叶草蛋白的去折叠程度较高,二级结构中无规卷曲含量较高,而乳清蛋白的二级结构中 α-螺旋含量较高,β-折叠含量较低,同时具有良好的灵活性和稳定性,从而决定了其具有优异的起泡特性[21]。
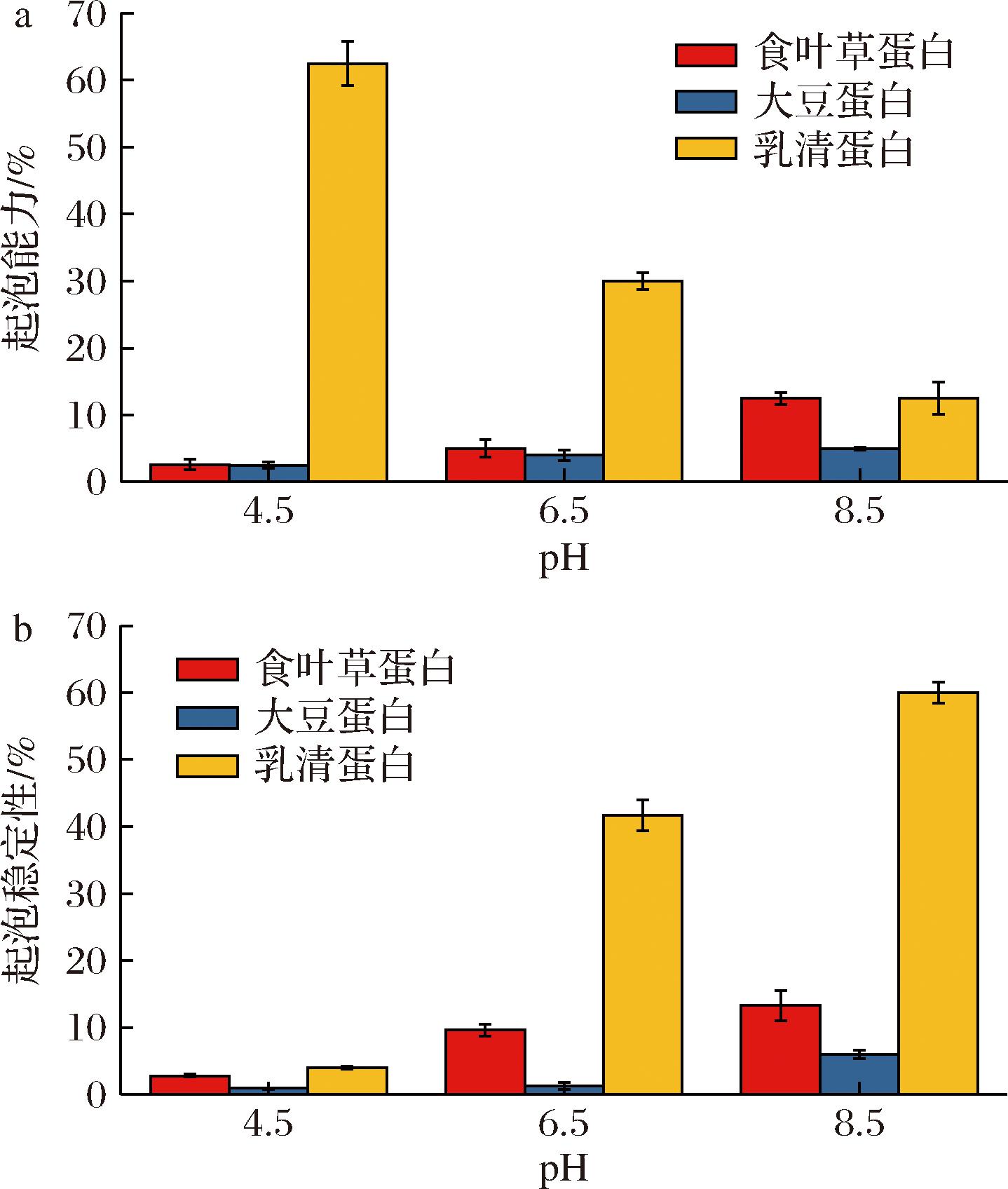
a-起泡能力;b-起泡稳定性
图9 三种蛋白在不同 pH 下的起泡能力和起泡稳定性
Fig.9 The foaming ability and foaming stability of three proteins at different pH levels
2.4.3 乳化性
EAI 表示蛋白质作为表面活性剂可以覆盖的界面区域,ESI 表示乳液在规定时间段内的稳定性[22]。观察图10 可以发现,食叶草蛋白在中性和碱性条件下的乳化性优于大豆分离蛋白和乳清蛋白,食叶草蛋白在酸性条件下的乳化性较差,随着pH升高,食叶草蛋白表现出更好的乳化性质,当 pH 8.5 时,EAI 和 ESI 分别达到 (9.26±0.21) m2/g和 (98.34±2.32)%。这可能是因为随着 pH 增大,食叶草蛋白的溶解性增大,蛋白结构由聚集转变为舒展状态,包裹在蛋白分子内部的疏水基团暴露出来,蛋白可覆盖的界面区域增大且稳定性升高,使得蛋白乳化能力增强[23]。
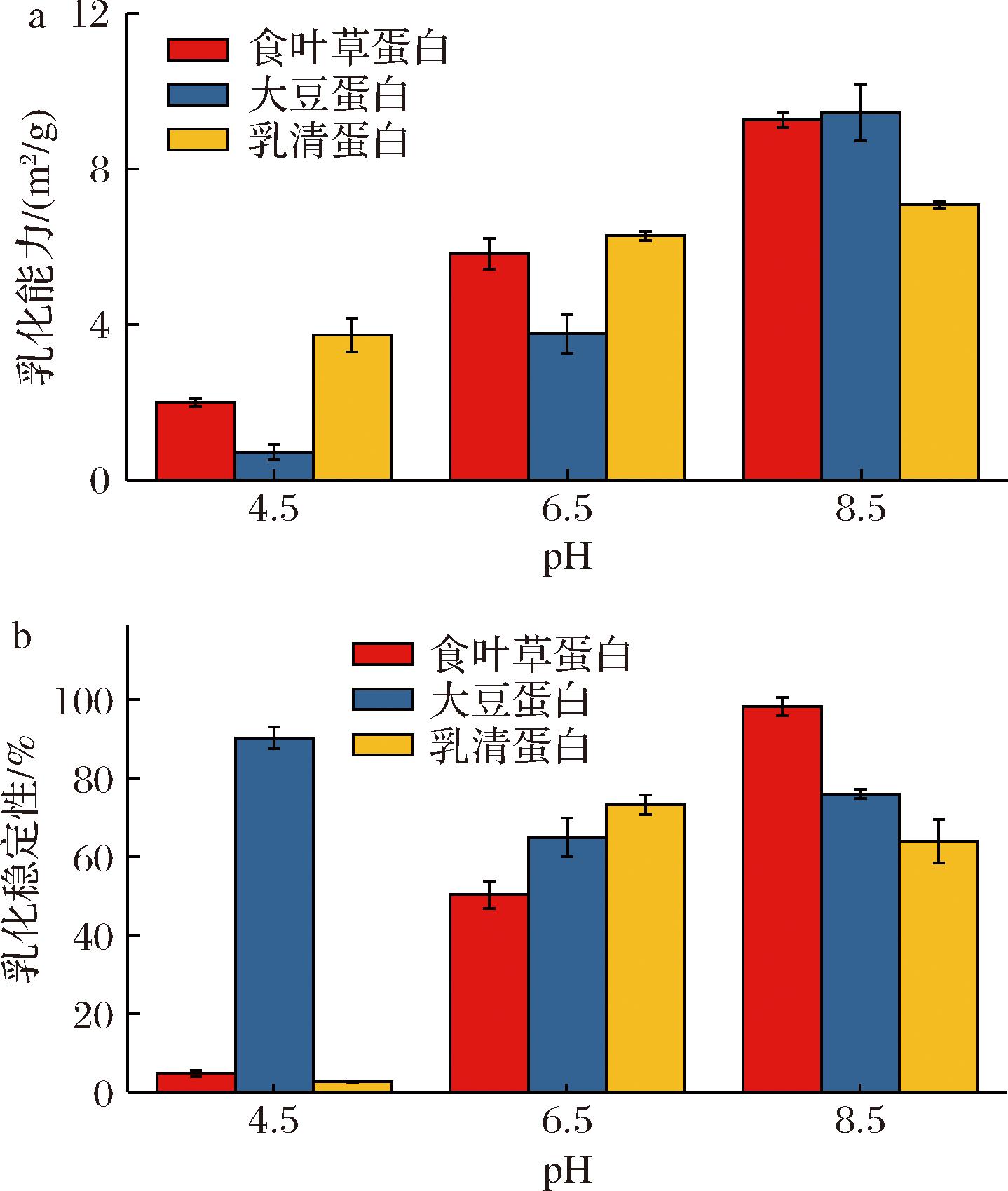
a-乳化能力;b-乳化稳定性
图10 三种蛋白在不同 pH 下的乳化能力和乳化稳定性
Fig.10 The emulsifying ability and stability of three proteins at different pH levels
3 结论与讨论
本文采用乙醇预处理结合碱溶酸沉法提取食叶草蛋白,并采用响应面试验对提取工艺进行优化。优化后的最佳工艺条件为:碱溶温度 81.12 ℃,加碱量 10.57 g/L,料液比 1∶34.04(g∶mL),pH 3.53。在此条件下,食叶草蛋白得率为 (63.26±1.01)%,纯度为 (81.63±2.35)%,所得食叶草蛋白呈米黄色,必需氨基酸含量为 42.49%。对食叶草蛋白结构特征进行分析,圆二色谱结果显示食叶草蛋白的 α-螺旋和无规卷曲的含量分别为36.1%和52.5%,与大豆分离蛋白相似,而 β-折叠的含量为3.8%,与乳清蛋白类似;本征荧光光谱显示食叶草蛋白的内源最大荧光峰位为 345 nm,荧光强度低于乳清蛋白,去折叠程度较高;扫描电镜结果发现,提取得到的食叶草蛋白不同于大豆分离蛋白和乳清蛋白,并非呈球状而是呈堆积状。通过考察食叶草蛋白的功能性质,发现其在碱性条件下具有良好的溶解性,溶解度为(90.42±1.44)%;乳化性较好,EAI 和 ESI 分别为(9.26±0.21)m2/g 和(98.34±0.32)%,但起泡性较差。
[1] 刘白玉, 陈增鑫, 潘芸芸, 等.食叶草的应用价值及安全性研究进展[J].中国食品添加剂, 2022, 33(9):252-257.
LIU B Y, CHEN Z X, PAN Y Y, et al.Research progress on the application value and safety of edible grass[J].China Food Additives, 2022, 33(9):252-257.
[2] 李宪秀, 何涛, 杨帆, 等.食叶草的营养活性成分含量及生物活性分析[J].食品工业科技, 2023, 44(3):307-315.
LI X X, HE T, YANG F, et al.Analysis of nutritional components, functional components and bioactivity of edible dock[J].Science and Technology of Food Industry, 2023, 44(3):307-315.
[3] 袁雨菲, 李研东, 叶超, 等.食叶草在畜牧领域应用的研究进展[J].今日畜牧兽医, 2021, 37(9):69-70.
YUAN Y F, LI Y D, YE C, et al.Research progress on the application of leaf-eating grass in animal husbandry[J].Today Animal Husbandry and Veterinary Medicine, 2021, 37(9):69-70.
[4] HADIDI M, KHAKSAR F B, PAGAN J, et al.Application of ultrasound-ultrafiltration-assisted alkaline isoelectric precipitation (UUAAIP) technique for producing alfalfa protein isolate for human consumption:Optimization, comparison, physicochemical, and functional properties[J].Food Research International, 2020, 130:108907.
[5] KOBBI S, BOUGATEF A, LE FLEM G, et al.Purification and recovery of RuBisCO protein from alfalfa green juice:Antioxidative properties of generated protein hydrolysate[J].Waste and Biomass Valorization, 2017, 8(2):493-504.
[6] 张有鑫. 苜蓿叶蛋白产量季节变化动态和提取工艺的研究[D].扬州:扬州大学, 2023.
ZHANG Y X.Study on seasonal variation dynamics and extraction technology of alfalfa leaf protein yield[D].Yangzhou:Yangzhou University, 2023.
[7] 邓翔, 李祥, 唐奔, 等.响应面优化微波辅助提取桑叶蛋白工艺研究[J].广东农业科学, 2021, 48(5):141-148.
DENG X, LI X, TANG B, et al.Response surface optimization of microwave-assisted extraction of mulberry leaf protein[J].Guangdong Agricultural Sciences, 2021, 48(5):141-148.
[8] 杨豪, 刘晓雪, 苏海冉, 等.响应面法优化辣木叶蛋白提取工艺及凝集活性研究[J].食品工业科技, 2022, 43(6):150-157.
YANG H, LIU X X, SU H R, et al.Optimization of extraction process and agglutination activity of Moringa oleifera leaf protein by response surface methodology[J].Science and Technology of Food Industry, 2022, 43(6):150-157.
[9] 王世宽, 于海光, 许艳丽.乳酸发酵酸法提取甘薯叶蛋白研究[J].安徽农业科学, 2010, 38(12):6517-6518;6556.
WANG S K, YU H G, XU Y L.Extraction of sweat potato leaf protein concentrates by fermentation acid method[J].Journal of Anhui Agricultural Sciences, 2010, 38(12):6517-6518;6556.
[10] LI X, SHEN S A, DENG J L, et al.Antioxidant activities and functional properties of tea seed protein hydrolysates (Camellia oleifera Abel.) influenced by the degree of enzymatic hydrolysis[J].Food Science and Biotechnology, 2014, 23(6):2075-2082.
[11] 刘静, 李旭, 向春蓉, 等.油茶籽粕蛋白功能特性及其酶解产物抗氧化活性研究[J].中国粮油学报, 2017, 32(1):40-46.
LIU J, LI X, XIANG C R, et al.Functional properties of Camellia oleifera seed-cake protein and antioxidant activity of its enzymatic hydrolysate[J].Journal of the Chinese Cereals and Oils Association, 2017, 32(1):40-46.
[12] PÉREZ-VILA S, FENELON M A, O’MAHONY J A, et al.Extraction of plant protein from green leaves:Biomass composition and processing considerations[J].Food Hydrocolloids, 2022, 133:107902.
[13] WANG K Q, LUO S Z, CAI J, et al.Effects of partial hydrolysis and subsequent cross-linking on wheat gluten physicochemical properties and structure[J].Food Chemistry, 2016, 197:168-174.
[14] WANG Z J, LI Y, JIANG L Z, et al.Relationship between secondary structure and surface hydrophobicity of soybean protein isolate subjected to heat treatment[J].Journal of Chemistry, 2014, 2014(1):475389.
[15] ORTEGA M L S, ORELLANA-PALACIOS J C, GARCIA S R, et al.Olive leaf protein:Extraction optimization, in vitro digestibility, structural and techno-functional properties[J].International Journal of Biological Macromolecules, 2024, 256:128273.
[16] AHMAD MALIK M, SAINI C S.Rheological and structural properties of protein isolates extracted from dephenolized sunflower meal:Effect of high intensity ultrasound[J].Food Hydrocolloids, 2018, 81:229-241.
[17] QI P X, REN D X, XIAO Y P, et al.Effect of homogenization and pasteurization on the structure and stability of whey protein in milk 1[J].Journal of Dairy Science, 2015, 98(5):2884-2897.
[18] 李强. 牡丹籽盐溶蛋白提取分离、结构表征及乳化性质研究[D].雅安:四川农业大学, 2018.
LI Q.Extraction, separation, structural characterization and emulsifying properties of salt-soluble protein from peony seeds[D].Yaan:Sichuan Agricultural University, 2018.
[19] PREVOT-D’ALVISE N, LESUEUR-LAMBERT C, FERTIN-BAZUS A, et al.Continuous enzymatic solubilization of alfalfa proteins in an ultrafiltration reactor[J].Enzyme and Microbial Technology, 2004, 34(5):380-391.
[20] ZHANG S Y, HAO J L, XIE Q G, et al.pH-induced physiochemical and structural changes of milk proteins mixtures and its effect on foaming behavior[J].International Journal of Biological Macromolecules, 2024, 254:127838.
[21] 陈美如. 生物酶解对蛋清粉起泡特性及理化结构性质的影响[D].长春:吉林大学, 2022.
CHEN M R.Effects of enzymatic hydrolysis on foaming characteristics and physicochemical structure properties of egg white powder[D].Changchun:Jilin University, 2022.
[22] ZHANG X Y, WANG Q, LIU Z, et al.Plant protein-based emulsifiers:Mechanisms, techniques for emulsification enhancement and applications[J].Food Hydrocolloids, 2023, 144:109008.
[23] LIMA R R, STEPHANI R, PERRONE  T, et al.Plant-based proteins:A review of factors modifying the protein structure and affecting emulsifying properties[J].Food Chemistry Advances, 2023, 3:100397.
T, et al.Plant-based proteins:A review of factors modifying the protein structure and affecting emulsifying properties[J].Food Chemistry Advances, 2023, 3:100397.