小麦粉是传统面制品的主要原料[1],是膳食蛋白质的主要来源。小麦蛋白的组成与面团流变学特性密切相关,其中麦醇溶蛋白在面团中起到“增塑剂”的作用,赋予面团黏性和延展性[2]。麦醇溶蛋白占小麦总储存蛋白的40%~50%,分为α-,β-,γ-和ω-醇溶蛋白4种组分[3]。醇溶蛋白呈单肽链状,不同醇溶蛋白的作用不同:α-麦醇溶蛋白参与面团的延展性[4];β-醇溶蛋白与熟面条的质构特性有很强的相关性[5];γ-醇溶蛋白与面团的形成时间和最大拉伸阻力呈负相关[6];ω-麦醇溶蛋白主要通过非共价键和疏水相互作用与其他蛋白质聚集[7-8]。
小麦蛋白质的必需氨基酸不平衡,尤其缺乏赖氨酸和苏氨酸。大豆蛋白富含赖氨酸,将其添加到小麦粉可有效提升面制品的营养价值,但大豆蛋白的加入会使面团中蛋白组成和结构发生变化,同时也会影响面团的流变学特性[9]。不同加工工艺或不同组分的大豆蛋白对面团流变学特性和大豆蛋白与小麦蛋白的相互作用的影响机制不同[10-11],大豆分离蛋白(soy protein isolate,SPI)通过二硫键和其他共价键与小麦蛋白交联,生成大的聚合体,增大面团拉伸阻力[12];添加大豆浓缩蛋白(soy protein concentrate,SPC)使面团中蛋白质的β-转角含量降低,延展度下降[13];大豆蛋白水解物能通过二硫键与小麦蛋白连接,破坏了谷蛋白聚合,从而阻碍了面筋网络的形成[14];将质构化大豆蛋白(texturized soy protein,TSP)和水解大豆蛋白复配能有效降低这种破坏作用[15]。目前相关研究主要集中在大豆蛋白对面团中面筋蛋白及面团特性的影响,极少关注大豆蛋白对面团中醇溶蛋白的组成和结构的影响。
本文将SPI、SPC和TSP以不同添加量与小麦粉混合后制成面团,分离其中的醇溶蛋白,探究大豆蛋白对面团中醇溶蛋白组成和结构的影响,为大豆蛋白在面制品中的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
金苑特一粉:郑州金苑面业有限公司(蛋白含量11.09%,N×5.70);SPI:山东谷神生物科技集团有限公司(蛋白含量91.35%,N×6.25)。其他试剂均为分析纯。
1.2 仪器与设备
722 S可见分光度计,上海精密科学有限公司;LGJ-25 C冷冻干燥机,北京四环科学仪器有限公司;AY 120分析天平,日本岛津公司;TA-XT Plus物性仪,英国 Stable Micro System 公司;CLEXTRAL Ev025双螺杆挤压机,法国Clextralgrop公司。TU-1900双光束紫外可见分光光度计,北京普析通用仪器有限责任公司;Cary Eelipse荧光分光光度计,美国Agilent公司;MOS-450 圆二色谱仪,法国Bio-logic公司。
1.3 方法
1.3.1 SPC和TSP的制备
SPC的制备方法:以低温脱脂豆粕为原料,按料液比1∶7与乙醇溶液混合,在50 ℃下搅拌浸提1 h,抽滤后再按料液比1∶5与体积分数为95%的乙醇溶液混合浸提30 min,再次抽滤将所得滤饼放置通风橱进行自然干燥,所得样品粉碎后过80目筛即为SPC(蛋白含量66.21%,N×6.25)。
以SPI为原料制备TSP,参考张莹莹等[15]使用的方法,略有改动。以30 g/min的进料速度将SPI送入双螺杆挤压机,进料水分为50%,螺杆转速160 r/min,机筒温度保持160 ℃。挤出的物料在55 ℃的烘箱中干燥,粉碎过100目筛即为TSP(蛋白含量87.96%,N×6.25)。
1.3.2 混合粉面团的制备
将大豆蛋白按照质量分数2%、4%、6%、8%(以蛋白质计)加入到小麦粉中混匀。称取100 g上述混合粉放置和面机内加入45 mL水和面8 min制成面团,调节压片机压辊间距从3.5 mm到2 mm依次压片。将面片冷冻干燥后粉碎过80目筛,4 ℃保存备用。分别用W、W-SPI、W-SPC、W-TSP表示小麦粉面团、添加SPI面团、添加SPC面团和添加TSP面团。
1.3.3 面团中醇溶蛋白相对含量的测定
参考石长硕等[16]使用的方法略有改动,取2.0 g冻干面团加入20 mL质量分数3%的NaCl溶液磁力搅拌30 min,然后在5 000 r/min离心10 min,弃去上清液,沉淀用25 mL的3 g/100 mL NaCl溶液重复上述步骤提取3次后,再用70%乙醇(体积分数,下同)按照上述步骤提取醇溶蛋白,共提取3次,合并提取液,用70%乙醇定容至100 mL,即为醇溶蛋白提取液。提取液中醇溶蛋白含量测定采用考马斯亮蓝比色法,牛血清白蛋白为标准蛋白绘制标准曲线。醇溶蛋白的相对含量以其占面团总蛋白的百分比表示。
1.3.4 紫外光谱的测定
按1.3.3节步骤提取面团中醇溶蛋白,将其质量浓度稀释至0.5 mg/mL,扫描范围为200~400 nm。
1.3.5 荧光光谱的测定
按1.3.3节步骤提取面团中醇溶蛋白,将其质量浓度稀释至0.5 mg/mL,激发波长280 nm,发射波长300~450 nm,激发波长和发射波长狭缝宽度均为5 nm。
1.3.6 圆二色谱的测定
按1.3.3节步骤提取面团中醇溶蛋白,将其质量浓度稀释至0.3 mg/mL,扫描范围为180~260 nm,步长0.5 nm,扫描速度30 nm/min,图谱经本底消除及溶液空白差减。利用CD pro软件分析α-螺旋、β-折叠、β-转角、无规则卷曲相对含量。
1.3.7 醇溶蛋白的A-PAGE
按照1.3.3节方法提取醇溶蛋白,将蛋白提取液旋蒸脱除溶剂,冷冻干燥得醇溶蛋白。蛋白上样量为2 mg/mL,参考WATRY等[17]的方法进行A-PAGE分析。凝胶成像仪采集图像,并用Image软件进行分析。各蛋白组分占醇溶蛋白的比例以其灰度值占所在泳道所有组分总灰度值百分比计。
1.3.8 面团拉伸特性的测定
采用TA-XT Plus物性仪对面团拉伸特性进行测定,使用A/KIE探头自带的模具,将面团制成长条。测定条件:测前速度2.0 mm/s,测试速度2.0 mm/s,测后速度10 mm/s[18]。
1.4 数据统计与分析
拉伸特性中每个样品重复测试6次,其他指标测试每个样品重复测试3次。使用Origin软件作图,利用SPSS 22.0软件对实验数据进行分析,结果以“平均值±标准偏差”表示,单因素方差分析采用Duncan法,差异显著水平P<0.05。
2 结果与分析
2.1 醇溶蛋白相对含量变化
由图1可以看出,随着添加量的增加,添加3种大豆蛋白的面团醇溶蛋白相对含量均逐渐降低,大豆蛋白添加量为8%时,添加SPI、SPC、TSP的面团醇溶蛋白相对含量分别较纯小麦面团下降9.65%、9.85%、5.97%。加入大豆蛋白后面团醇溶蛋白相对含量均显著下降的最主要原因是由于大豆蛋白与面团中蛋白组分发生相互作用,使醇溶蛋白和醇不溶性蛋白间相互转换,醇溶蛋白相对含量的变化程度不同与大豆蛋白性质和大豆蛋白与小麦蛋白作用机制不同有关。SPI与面筋蛋白之间通过共价键和非共价键产生交联作用,形成蛋白复合体,阻碍面团的面筋结构形成[12];SPC含有较多的非蛋白组分(纤维素、糖等)[19];TSP的蛋白质分子之间排列整齐且具有同方向的组织结构[20],能通过二硫键与麦谷蛋白相互作用形成高分子聚合物[21]。据此推测,SPI、SPC和TSP对面团中醇溶蛋白相对含量影响机制不同,SPI能通过二硫键和非共价键与面筋蛋白交联,形成蛋白复合体,进而将部分醇溶性蛋白转换成醇不溶性蛋白;SPC的蛋白含量较低,相同蛋白质添加量所需更多的SPC,因此其对面筋蛋白的稀释作用更大;TSP能与醇溶蛋白结合,部分醇溶蛋白聚集,使更多醇溶蛋白黏附在麦谷蛋白骨架,因此,添加TSP相较添加其他两种大豆蛋白使面团中醇溶蛋白相对含量下降较少。为验证以上推测,探究大豆蛋白对面团中醇溶蛋白影响机制,接下来对醇溶蛋白进行A-PAGE分析。
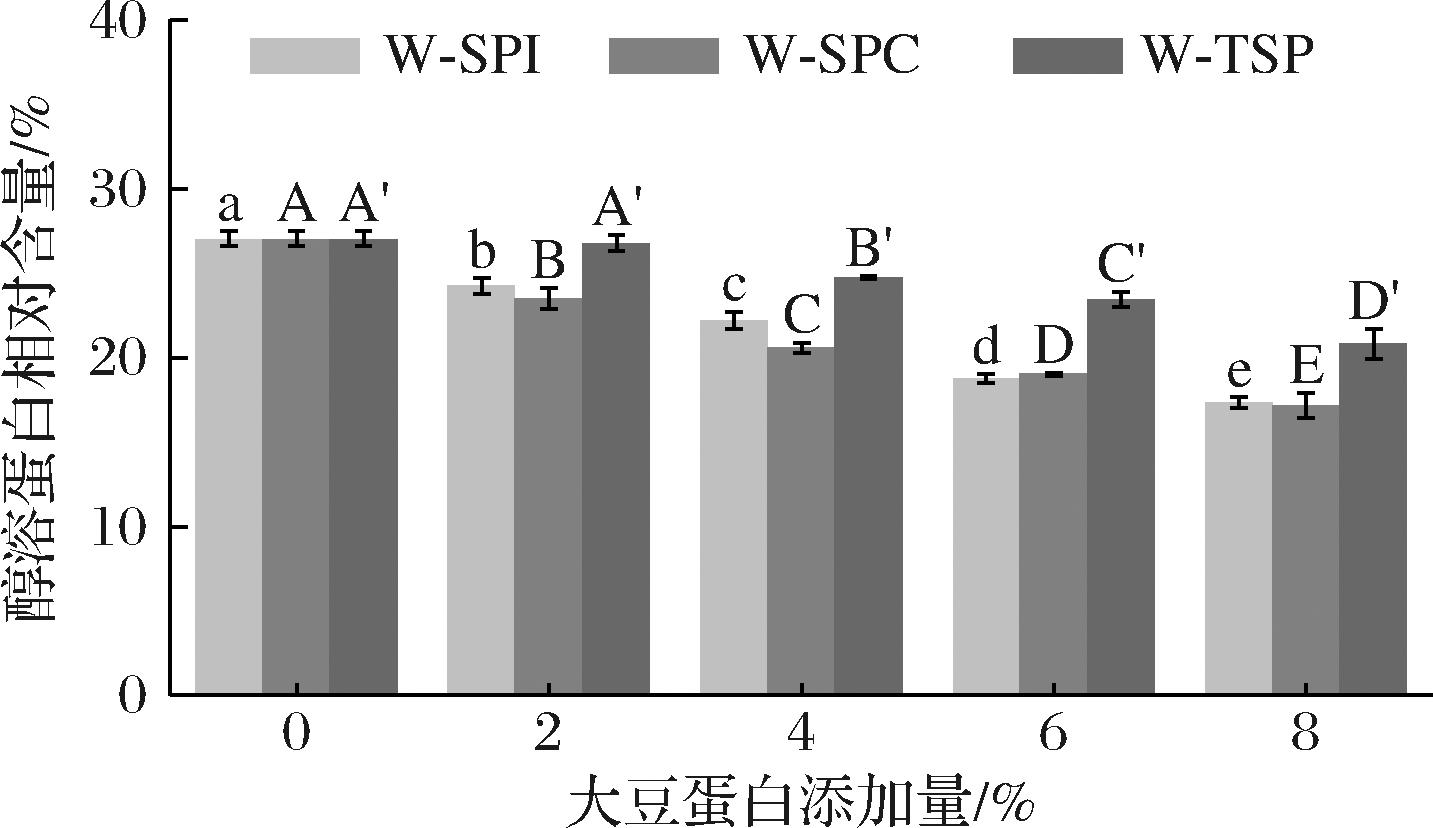
图1 添加大豆蛋白对面团中醇溶蛋白相对含量的影响
Fig.1 Effect of adding soybean protein on the relative content of gliadin in the dough
注:图中不同字母表示差异显著(P<0.05)(下同)。
2.2 A-PAGE
A-PAGE是表征麦醇溶蛋白的重要手段,醇溶蛋白在A-PAGE凝胶上进一步分离为ω-醇溶蛋白、γ-醇溶蛋白、β-醇溶蛋白和α-醇溶蛋白[3]。由图2可以看出,添加3种大豆蛋白后面团中醇溶蛋白组分发生了不同变化。对其图谱进行灰度分析见表1,当大豆蛋白添加量为8%时,W-SPI的α-醇溶蛋白比例增加0.79%,β-醇溶蛋白和γ-醇溶蛋白比例无显著性变化,ω-醇溶蛋白比例下降2.27%;W-SPC的α-醇溶蛋白比例下降1.42%,β-醇溶蛋白比例下降1.59%,γ-醇溶蛋白无显著性变化,ω-醇溶蛋白比例增加3.25%;W-TSP的α-醇溶蛋白比例下降1.47%,β-醇溶蛋白和γ-醇溶蛋白比例无显著性变化,ω-醇溶蛋白比例增加1.12%。加入大豆蛋白后面团的醇溶蛋白组分变化是由于醇溶蛋白/大豆蛋白交联聚集或转录因子插入调节序列所致[22]。在面团形成过程中,ω-醇溶蛋白是数量减少的主要单体蛋白,由于ω-麦醇溶蛋白不具有半胱氨酸并且不能形成二硫键,因此它们主要通过非共价键结合到麦谷蛋白大聚体上[7]。相较于纯小麦面团,W-SPI的ω-醇溶蛋白的比例明显下降,且在较低的ω-醇溶蛋白区域缺失一条微弱条带,这说明SPI使面团中更多的ω-醇溶蛋白结合到麦谷蛋白大聚体上。W-SPC的ω-醇溶蛋白的比例显著增加,α-醇溶蛋白比例显著下降,这说明在面团形成过程中,SPC能阻碍面团中ω-醇溶蛋白和麦谷蛋白的结合,从而使更多的ω-醇溶蛋白被保留。相比其他两种大豆蛋白,TSP对面团醇溶蛋白各组分的影响较小,随着TSP添加量的增加,W-TSP的醇溶蛋白各条带迁移率逐渐降低,这说明TSP使面团中醇溶蛋白部分聚集。为进一步分析大豆蛋白对面团中醇溶蛋白影响机制,接下来对面团中醇溶蛋白提取液进行紫外、荧光光谱分析以探究添加大豆蛋白后面团中醇溶蛋白结构的变化。
表1 添加大豆蛋白对面团醇溶蛋白各组分含量影响
Table 1 Effect of adding soybean protein on the content of each component of dough gliadin

面团α-醇溶蛋白/%β-醇溶蛋白/%γ-醇溶蛋白/%ω-醇溶蛋白/%W20.90±0.40b26.05±0.47a20.91±0.67a32.13±0.20aW-SPI 2%21.86±0.37a26.35±0.41a21.20±0.70a30.60±0.13bW-SPI 4%21.72±0.45a26.74±0.47a21.19±0.69a30.36±0.22bW-SPI 6%22.18±0.43a27.02±0.47a21.22±0.73a29.57±0.17cW-SPI 8%21.69±0.47a26.36±0.53a22.09±0.76a29.86±0.25cW20.90±0.40a26.05±0.47a20.91±0.67a32.13±0.20eW-SPC 2%21.02±0.18a25.63±0.10a20.40±0.09ab32.94±0.20dW-SPC 4%20.40±0.17b25.87±0.14a20.12±0.11b33.61±0.22cW-SPC 6%19.86±0.17c25.13±0.16b20.10±0.09b34.91±0.24bW-SPC 8%19.48±0.16c24.46±0.16c20.68±0.08ab35.38±0.28aW20.90±0.40a26.05±0.47a20.91±0.67a32.13±0.20cW-TSP 2%20.92±0.42a26.32±0.51a21.94±0.72a30.82±0.22dW-TSP 4%19.79±0.42b25.60±0.53a21.93±0.68a32.68±0.26bW-TSP 6%19.33±0.40b25.63±0.50a22.09±0.70a32.95±0.19abW-TSP 8%19.43±0.42b25.21±0.50a22.11±0.74a33.25±0.16a
注:图中不同字母表示差异显著(P<0.05)(下同)。
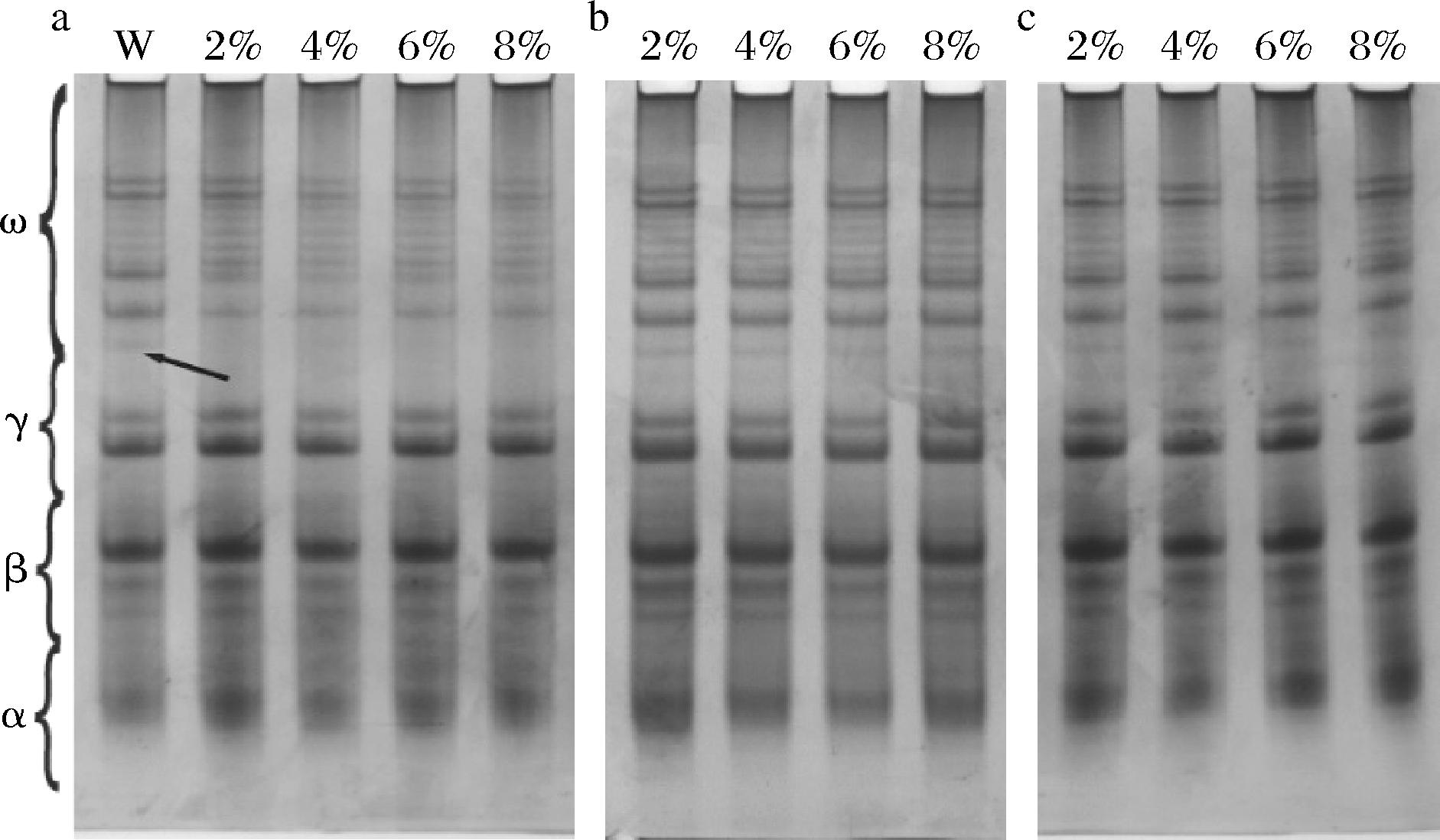
a-不同SPI添加量的面团醇溶蛋白;b-不同SPC添加量的面团醇溶蛋白;c-不同TSP添加量的面团醇溶蛋白
图2 添加SPI、SPC、TSP的面团中醇溶蛋白的A-PAGE
Fig.2 A-PAGE of gliadins in flour dough added SPI, SPC, and TSP respectively
2.3 紫外和荧光光谱
如图3所示,纯小麦面团醇溶蛋白在277 nm处有紫外吸收峰,随着大豆蛋白添加量的增加,W-SPI、W-TSP紫外吸收峰均有所蓝移,且峰形发生变化,W-SPC中醇溶蛋白的紫外吸收峰变化不大。

a-不同SPI添加量的面团醇溶蛋白;b-不同SPC添加量的面团醇溶蛋白;c-不同TSP添加量的面团醇溶蛋白
图3 添加大豆蛋白的面团中醇溶蛋白紫外吸收光谱图
Fig.3 UV absorption spectrum of gliadin in dough with soybean protein added
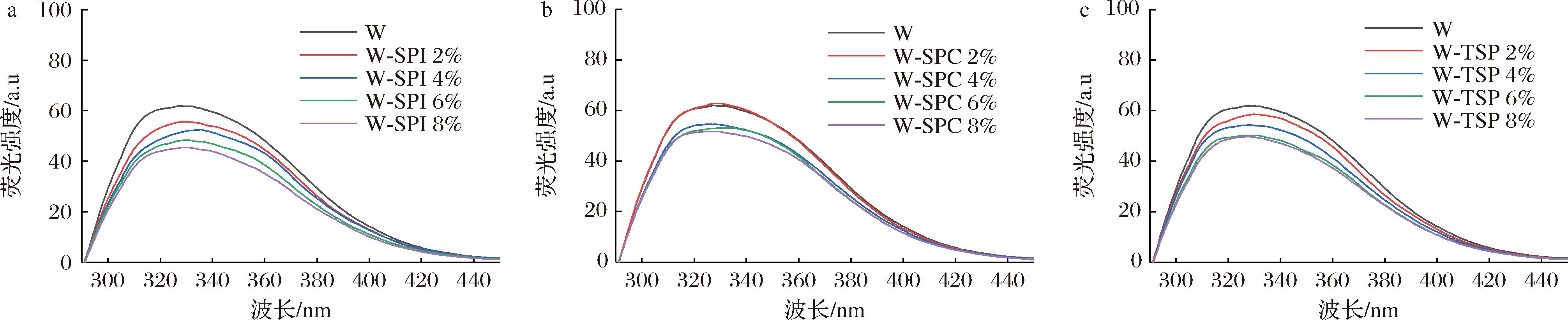
a-不同SPI添加量的面团醇溶蛋白;b-不同SPC添加量的面团醇溶蛋白;c-不同TSP添加量的面团醇溶蛋白
图4 添加大豆蛋白的面团中醇溶蛋白的荧光吸收光谱图
Fig.4 Fluorescence absorption spectrum of gliadin in dough with soybean protein added
大豆蛋白添加量为8%时,W-SPI、W-SPC、W-TSP中醇溶蛋白的紫外吸收峰分别为268、277、268 nm。紫外吸收光谱中280 nm左右的吸收峰主要是由于芳香族氨基酸残基的苯杂环结构的π→π*跃迁形成的B吸收带,蛋白质分子构象的变化会改变蛋白质表面生色基团的暴露程度,进而使紫外吸收峰发生位移或峰形发生改变[23]。W-SPI、W-TSP中醇溶蛋白紫外吸收峰峰形发生变化,表明SPI、TSP能与面团结合导致醇溶蛋白三级结构展开,芳香杂环疏水基团周边的微环境极性增大,肽链伸展,醇溶蛋白作为面筋网络的交联剂,其结构伸展会导致面筋网络结构骨架松散。W-SPC中醇溶蛋白紫外吸收峰峰形较纯小麦面团几乎没有变化,说明SPC对面团醇溶蛋白三级结构影响不大。
由图4可以看出,与原面团相比,加入3种大豆蛋白的面团荧光强度均随蛋白添加量的增加逐渐下降,但其峰值并未发生明显偏移。荧光分析方法是研究溶液中分子构象的一种重要手段,一般发荧光的蛋白质分子含有色氨酸、酪氨酸和苯丙氨酸,它们荧光强度的波长分别为348、303和282 nm,以280 nm为激发波长,蛋白质的全部荧光主要来源于色氨酸,其次还有酪氨酸[24]。所有面团醇溶蛋白提取液蛋白浓度均相同,荧光强度逐渐减弱说明蛋白内部色氨酸残基减少,这可能是大豆蛋白与麦醇溶蛋白发生相互作用改变了蛋白的空间构象,使色氨酸残基周围环境疏水性增强,色氨酸包埋更深。与W-SPI、W-TSP相比,W-SPC荧光强度下降幅度较小,说明SPC对面团醇溶蛋白的结构影响较小,这与紫外光谱分析结果一致。
2.4 圆二色谱(circular dichroism,CD)
CD被广泛用于蛋白质二级结构的分析,基于蛋白质的远紫外区CD光谱的变化,可以获得蛋白质主链二级结构的构象信息[25]。由图5可以看出,所有样品在220~240 nm范围内均具有宽的负带,且添加3种大豆蛋白的面团相较原面团醇溶蛋白的CD峰均有所蓝移,这表明加入大豆蛋白能改变面团中醇溶蛋白的二级结构。W-SPC的CD峰随大豆蛋白添加量的增加没有显著变化,这意味着SPC对面团中醇溶蛋白二级结构影响较小。通过CD谱图计算得到各面团中醇溶蛋白二级结构相对含量如表2所示,相较原小麦面团,W-SPI的醇溶蛋白α-螺旋降低最多,这说明SPI对面团中醇溶蛋白的有序螺旋结构影响最大,W-SPI的醇溶蛋白β-转角有所下降,综合A-PAGE分析,这可能是由W-SPI中ω-醇溶蛋白结构改变所致,TATHAM等[26]用CD光谱发现70%乙醇水溶液中ω-醇溶蛋白富含β-转角;W-TSP的醇溶蛋白β-折叠增加最明显,β-折叠是一种较稳定结构,造成此现象原因是由于TSP能使面团中醇溶蛋白聚集,从而使醇溶蛋白主链成周期性折叠构象;W-SPC的醇溶蛋白各二级结构相对含量相比其他两种面团变化较小。
表2 添加大豆蛋白对面团醇溶蛋白二级结构的影响
Table 2 Effect of adding soy protein on the secondary structure of dough soluble proteins
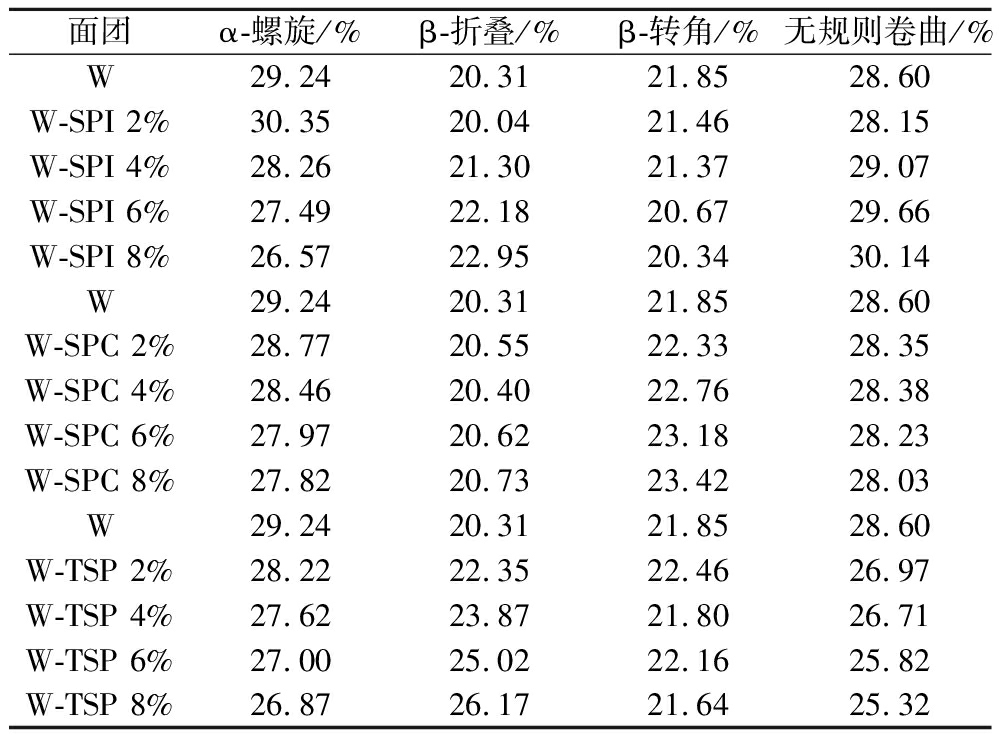
面团α-螺旋/%β-折叠/%β-转角/%无规则卷曲/%W29.2420.3121.8528.60W-SPI 2%30.3520.0421.4628.15W-SPI 4%28.2621.3021.3729.07W-SPI 6%27.4922.1820.6729.66W-SPI 8%26.5722.9520.3430.14W29.2420.3121.8528.60W-SPC 2%28.7720.5522.3328.35W-SPC 4%28.4620.4022.7628.38W-SPC 6%27.9720.6223.1828.23W-SPC 8%27.8220.7323.4228.03W29.2420.3121.8528.60W-TSP 2%28.2222.3522.4626.97W-TSP 4%27.6223.8721.8026.71W-TSP 6%27.0025.0222.1625.82W-TSP 8%26.8726.1721.6425.32
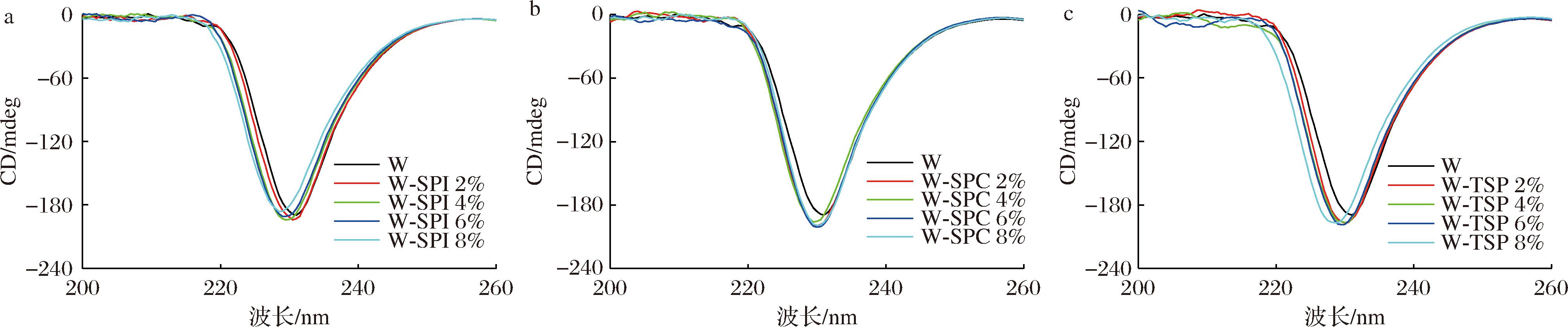
a-不同SPI添加量的面团醇溶蛋白;b-不同SPC添加量的面团醇溶蛋白;c-不同TSP添加量的面团醇溶蛋白
图5 添加大豆蛋白的面团中醇溶蛋白的圆二色谱图
Fig.5 Circular dichroism of gliadin in dough with soybean protein added
2.5 面团拉伸特性分析
面团的拉伸特性和面团中醇溶蛋白联系紧密[27],添加大豆蛋白的面团中醇溶蛋白的各种变化会对面团拉伸特性产生不同影响。拉断力在一定程度上可以反映面团的面筋强度[28],醇溶蛋白有助于提高面筋蛋白的黏度,塑化和改善谷蛋白的流动性[27]。由图6可知,添加3种大豆蛋白后,面团的拉断力均随着大豆蛋白添加量增加逐渐增加,一方面是由于添加大豆蛋白后面团吸水率增加影响面筋网络和淀粉间相互作用,另一方面是由于醇溶蛋白组成和结构发生变化导致面筋网络结构发生变化。W-SPI的拉断力相较W-SPC、W-TSP变化更为显著,这是由于SPI使面团中更多的ω-醇溶蛋白结合到麦谷蛋白大聚体上,从而影响醇溶蛋白附着在麦谷蛋白骨架上的状态,增塑效果减弱,面团表现出更大的拉断力。面团的拉伸距离可以反应面团的延展性[29],谷蛋白含量高的面团由于内聚力产生大团块,而高麦醇溶蛋白比例有利于谷蛋白的分散,促进面筋网络的形成,增加面团延展性[30]。随着大豆蛋白添加量增加,W-SPI、W-SPC的醇溶蛋白相对含量下降较W-TSP更为显著,W-SPI、W-SPC的拉伸距离逐渐缩短,W-TSP拉伸距离变化不显著,说明大豆蛋白主要通过影响面团中醇溶蛋白含量从而影响面团延展性。此外,由于SPC的蛋白质含量相较SPI、TSP低很多,SPC中糖和纤维组分也会对面团拉伸特性产生影响。
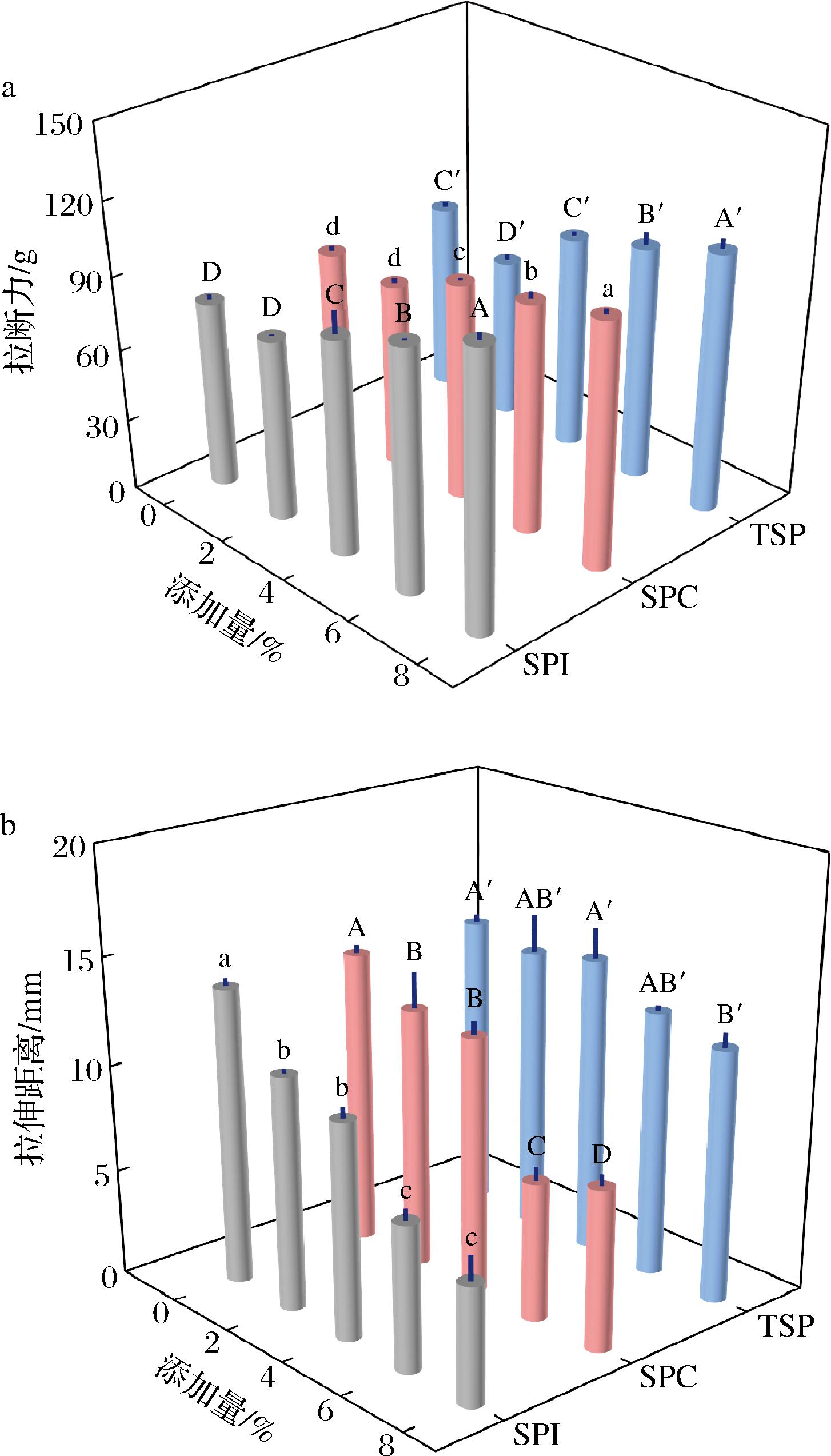
a-面团拉断力;b-面团拉伸距离
图6 添加大豆蛋白对面团中拉伸性质影响
Fig.6 The effect of adding soybean protein on the tensile properties of dough
面团的延展性表示面团的可塑性,与面团流变学特性及面制品品质息息相关。一般来说,延展性小代表面团筋力强,不易流变。研究表明,面包品质与面团延展性呈负相关[31],醇溶蛋白含量高对面包品质有不利影响[32];拉伸所需要的能量与馒头品质呈显著正相关[33];抗延展性高的面团更适用于冷冻面团的生产[34]。结合面团醇溶蛋白和拉伸特性的变化综合评价,添加适量大豆蛋白的面团更适合于馒头、面包和冷冻饺子皮等产品的生产,SPI和SPC相比TSP对上述产品的品质作用效果更强,而添加TSP制成的面团对面团中醇溶蛋白和延展性影响相对较小,更适合面条等产品的营养改善。
3 结论
本文研究了3种大豆蛋白加入面团后醇溶蛋白组成和结构的变化,通过对醇溶蛋白相对含量和组分测定得出:与添加SPI和SPC相比,添加TSP对面团醇溶蛋白相对含量影响较小;添加SPI的面团中α-醇溶蛋白比例显著增加,ω-醇溶蛋白比例显著下降;添加SPC的面团中α-,β-醇溶蛋白比例显著下降,ω-醇溶蛋白比例显著增加;添加TSP的面团中α-醇溶蛋白比例显著下降,ω-醇溶蛋白比例显著增加。通过内源荧光光谱和紫外光谱发现W-SPI、W-TSP较W-SPC的醇溶蛋白结构变化大。结合面团拉伸特性变化综合推测,SPI能使面团中醇溶蛋白肽链展开,ω-醇溶蛋白结构部分破坏,一定程度上影响醇溶蛋白在麦谷蛋白骨架上的附着;SPC对面团中醇溶蛋白结构影响不大,但其较多的非蛋白组分会影响醇溶蛋白组分;TSP使面团中醇蛋白肽链展开的同时也会和醇溶蛋白结合,使醇溶蛋白聚集,对面团延展性影响较小。SPI和SPC与小麦粉混合制成的面团更适合于馒头、面包和冷冻饺子皮等产品的生产,TSP与小麦粉混合制成的面团更适合面条等产品的营养改善。
[1] MASOOD S, REHMAN A U, BASHIR S, et al.Proximate and sensory analysis of wheat bread supplemented with onion powder and onion peel extract[J].Bioscience Research, 2020 17(4):4071-4078.
[2] CHAUDHARY N, VIRDI A S, DANGI P, et al.Protein, thermal and functional properties of α-, γ- and ω-gliadins of wheat and their effect on bread making characteristics[J].Food Hydrocolloids, 2022, 124:107212.
[3] BARAK S, MUDGIL D, KHATKAR B S.Biochemical and functional properties of wheat gliadins:A review[J].Critical Reviews in Food Science and Nutrition, 2015, 55(3):357-368.
[4] NOMA S, YAMAGISHI M, OGIHARA Y, et al.Characterization of α-gliadin alleles of Japanese wheat cultivars in relation to flour dough extensibility and celiac disease epitopes[J].Journal of Cereal Science, 2023, 109:103591.
[5] HOU G G, SAINI R, NG P K W.Relationship between physicochemical properties of wheat flour, wheat protein composition, and textural properties of cooked Chinese white salted noodles[J].Cereal Chemistry, 2013, 90(5):419-429.
[6] UTHAYAKUMARAN S, TÖMÖSKÖZI S, TATHAM A S, et al.Effects of gliadin fractions on functional properties of wheat dough depending on molecular size and hydrophobicity[J].Cereal Chemistry, 2001, 78(2):138-141.
[7] IWAKI S, AONO S, HAYAKAWA K, et al.Changes in protein non-covalent bonds and aggregate size during dough formation[J].Foods, 2020, 9(11):1643.
[8] IWAKI S, HAYAKAWA K, FU B X, et al.Changes in hydrophobic interactions among gluten proteins during dough formation[J].Processes, 2021, 9(7):1244.
[9] LIU M L, LIU X Q, LI Y.Soybean peptides’ cryoprotective effects on Saccharomyces cerevisiae fermenting power in frozen dough and maintenance of the Chinese steamed bread qualities[J].Journal of Food Processing and Preservation, 2020, 44(8):e14572.
[10] RIBOTTA P D, LE N A E, PÉREZ G T, et al.Electrophoresis studies for determining wheat-soy protein interactions in dough and bread[J].European Food Research and Technology, 2005, 221(1):48-53.
N A E, PÉREZ G T, et al.Electrophoresis studies for determining wheat-soy protein interactions in dough and bread[J].European Food Research and Technology, 2005, 221(1):48-53.
[11] ZHANG Y Y, GUO X F, SHI C S, et al.Effect of soy proteins on characteristics of dough and gluten[J].Food Chemistry, 2020, 318:126494.
[12] 高雪丽, 陈复生, 张丽芬, 等.大豆分离蛋白影响面团特性的作用机制研究[J].现代食品科技, 2015, 31(12):177-184.
GAO X L, CHEN F S, ZHANG L F, et al.Study on the mechanism underlying the impact of soy protein isolate on dough properties[J].Modern Food Science and Technology, 2015, 31(12):177-184.
[13] YOON S, YANG G, KWON H, et al.Effects of wheat flour supplemented with soy protein concentrate on the rheology, microstructure and water mobility of protein-fortified precooked noodles[J].International Journal of Food Science &Technology, 2022, 57(7):4107-4118.
[14] GUO X F, SUN X H, ZHANG Y Y, et al.Interactions between soy protein hydrolyzates and wheat proteins in noodle making dough[J].Food Chemistry, 2018, 245:500-507.
[15] 张莹莹, 郭兴凤, 王瑞红, 等.TSP与SPH复合物对面团特性及面条品质的影响机制[J].食品科学, 2020, 41(2):37-42.
ZHANG Y Y, GUO X F, WANG R H, et al.Effect of a blend of texturized soy protein and soy protein hydrolyzate on dough properties and noodle quality[J].Food Science, 2020, 41(2):37-42.
[16] 石长硕, 张明, 赵方圆, 等.大豆蛋白对小麦面筋蛋白特性的影响[J].食品与发酵工业, 2021, 47(19):174-179.
SHI C S, ZHANG M, ZHAO F Y, et al.Effects of soybean proteins on the properties of wheat gluten[J].Food and Fermentation Industries, 2021, 47(19):174-179.
[17] WATRY H, ZERKLE A, LAUDENCIA-CHINGCUANCO D.Modified acid-PAGE method for rapid screening and phenotyping of wheat gliadin mutant lines[J].MethodsX, 2020, 7:100858.
[18] YANG Y L, GUAN E Q, ZHANG T J, et al.Behavior of wheat flour dough at different pretreated temperatures through rheological characteristics and molecular interactions of proteins[J].Food Chemistry, 2023, 404:134188.
[19] 赵方园, 郭兴凤, 赵树超, 等.加工条件对醇法大豆浓缩蛋白溶解性及结构的影响[J].中国油脂, 2023, 48(10):57-63;70.
ZHAO F Y, GUO X F, ZHAO S C, et al.Effects of processing conditions on the solubility and structure of alcohol leached soybean protein concentrate[J].China Oils and Fats, 2023, 48(10):57-63;70.
[20] YANG L Y, YING Z W, LI H, et al.Extrusion production of textured soybean protein:The effect of energy input on structure and volatile beany flavor substances[J].Food Chemistry, 2023, 405:134728.
[21] ZHANG Y Y, GUO X F, XIONG H R, et al.Effect of modified soy protein isolate on dough rheological properties and noodle qualities[J].Journal of Food Processing and Preservation, 2022, 46(3):e16371.
[22] MAR N-SANZ M, BARRO F.RNAi silencing of wheat gliadins alters the network of transcription factors that regulate the synthesis of seed storage proteins toward maintaining grain protein levels[J].Frontiers in Plant Science, 2022, 13:935851.
N-SANZ M, BARRO F.RNAi silencing of wheat gliadins alters the network of transcription factors that regulate the synthesis of seed storage proteins toward maintaining grain protein levels[J].Frontiers in Plant Science, 2022, 13:935851.
[23] 王岸娜, 楚雯文, 吴立根.光谱法研究小麦蛋白与直链淀粉的相互作用[J].河南工业大学学报(自然科学版), 2022, 43(6):80-86; 94.
WANG A N, CHU W W, WU L G.Interaction between wheat protein and starch investigated by spectroscopy[J].Journal of Henan University of Technology (Natural Science Edition), 2022, 43(6):80-86; 94.
[24] 王启明, 唐瑜婉, 李春翼, 等.NaCl浓度对麦醇溶蛋白与槲皮素相互作用的影响[J].食品科学, 2021, 42(8):29-39.
WANG Q M, TANG Y W, LI C Y, et al.Spectroscopic analysis of interaction between gliadin and quercetin under different NaC1 concentrations[J].Food Science, 2021, 42(8):29-39.
[25] KWAAMBWA H M, MAIKOKERA R.Infrared and circular dichroism spectroscopic characterisation of secondary structure components of a water treatment coagulant protein extracted from Moringa oleifera seeds[J].Colloids and Surfaces B:Biointerfaces, 2008, 64(1):118-125.
[26] TATHAM A S, FIELD J M, SMITH S J, et al.The conformations of wheat gluten proteins, II, aggregated gliadins and low molecular weight subunits of glutenin[J].Journal of Cereal Science, 1987, 5(3):203-214.
[27] ANSARI S, BOZKURT F, YAZAR G, et al.Probing the distribution of gliadin proteins in dough and baked bread using conjugated quantum dots as a labeling tool[J].Journal of Cereal Science, 2015, 63:41-48.
[28] TIAN S Q, WANG F, LUO M Y, et al.Effect of Chlorella pyrenoidosa powder on rheological properties and fermentation characteristics of dough[J].Journal of Food Processing and Preservation, 2022, 46(4):e16446.
[29] ABANG ZAIDEL D N, CHIN N L, ABDUL RAHMAN R, et al.Rheological characterisation of gluten from extensibility measurement[J].Journal of Food Engineering, 2008, 86(4):549-556.
[30] LI M F, YUE Q H, LIU C, et al.Interaction between gliadin/glutenin and starch granules in dough during mixing[J].LWT, 2021, 148:111624.
[31] 班进福, 刘彦军, 郭家宝, 等.河北省主要推广强筋小麦的面包加工品质[J].麦类作物学报, 2017, 37(1):102-107.
BAN J F, LIU Y J, GUO J B, et al.Bread-making quality of strong gluten wheat cultivars in Hebei Province[J].Journal of Triticeae Crops, 2017, 37(1):102-107.
[32] 王美芳, 赵石磊, 雷振生, 等.小麦蛋白淀粉品质指标与面包品质关系的研究[J].核农学报, 2013, 27(6):792-799.
WANG M F, ZHAO S L, LEI Z S, et al.The relationship between protein quality and starch pasting parameters and bread baking quality in common wheat[J].Journal of Nuclear Agricultural Sciences, 2013, 27(6):792-799.
[33] 孙辉, 姜薇莉, 林家永.小麦粉理化品质指标与食品加工品质的关系研究[J].中国粮油学报, 2009, 24(3):12-16.
SUN H, JIANG W L, LIN J Y.Relationship between end-use quality and property indexes of wheat flour[J].Journal of the Chinese Cereals and Oils Association, 2009, 24(3):12-16.
[34] FRAUENLOB J, MORIANO M E, INNERKOFLER U, et al.Effect of physicochemical and empirical rheological wheat flour properties on quality parameters of bread made from pre-fermented frozen dough[J].Journal of Cereal Science, 2017, 77:58-65.