芸豆又名菜豆,豆科菜豆属(Phaseolus vulgaris L),是我国食用豆中出口量最大的特色杂豆作物。红芸豆是芸豆中最常见的品种之一,产量高,价格便宜,在世界各地广泛种植。红芸豆富含多种营养成分,如蛋白质、膳食纤维、酚类、碳水化合物、矿物质和维生素等[1],是一种高钾、镁、钙,低钠的豆类,适宜高血脂和心脏病等患者食用[2]。红芸豆蛋白为全价蛋白,富含人体必需的8种必需氨基酸,且所含必需氨基酸的比例显著优于大豆蛋白,是人类膳食中优质、廉价的蛋白质来源[3-4]。红芸豆皮是包围在红芸豆胚和胚乳外部的保护组织,膳食纤维含量高于胚乳,是制备膳食纤维的优质原料。红芸豆膳食纤维可以促进人体肠道蠕动,增加饱腹感,降低血糖和胆固醇水平,调节肠道菌群结构,起到预防肥胖和2型糖尿病的作用[5-6]。
目前国内外关于膳食纤维的提取方法,主要包括水提、酸碱提取、酶提取、微波辅助提取和高压辅助提取等[7]。热水浸提法主要是利用高温破坏细胞壁,使膳食纤维溶出[8]。其反应条件温和,但需要消耗大量成本和时间,提取效率不高。微波辅助提取利用频率不同的电磁波辐射,引起水分子内的分子振动蓄积热能,导致细胞膨胀和破裂,膳食纤维溶解析出[9]。与传统热水提取相比,微波辅助提取时间短,溶剂消耗少,效率高。其他辅助提取各自具有不同的优缺点,如酶法提取成本高,反应条件需要严格控制。不同的提取方法对膳食纤维的得率、理化性质、结构特征和生物活性有一定的影响,但是关于不同提取方法所得红芸豆皮膳食纤维得率、结构、理化性质和降血糖活性的影响尚不明确。因此,本研究以红芸豆皮为原料,采用水法、高压辅助水法、微波辅助水法和酶法制备红芸豆皮膳食纤维,并对不同方法制备的红芸豆皮膳食纤维得率、结构、理化性质和降血糖活性进行比较,以期改善红芸豆皮膳食纤维的功能特性,为推动红芸豆资源的开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
红芸豆:芸选二号,产自山西省岢岚县。
主要试剂:单糖标准品(阿拉伯糖、木糖、葡萄糖、鼠李糖、半乳糖、甘露糖、半乳糖醛酸、葡萄糖醛酸)、牛血清蛋白,Sigma公司;α-葡萄糖苷酶(84 U/mg)、耐高温α-淀粉酶(30 U/mg)、对硝基苯基-α-D-吡喃葡萄糖苷、阿卡波糖、纤维素酶(30 000 U/g),合肥博美生物科技有限责任公司;三氟乙酸、四硼酸钠、浓硫酸、NaOH等均为分析纯。
1.2 仪器与设备
TENSOR27型傅立叶变换红外光谱仪,德国Bruker公司;ICS 1100型离子色谱仪,美国DIONEX公司;MCR102 型流变仪,奥地利安东帕有限公司;Waters 2690型高效液相色谱仪,美国Waters公司;FreeZone 2.5型冷冻干燥机,美国Labconco公司;BIOTEK多功能酶标仪,美国BIOTEK公司。
1.3 试验方法
1.3.1 原料预处理
将红芸豆除杂,选取没有破损、颗粒大小基本相同、成熟饱满的籽粒。红芸豆浸泡蒸馏水中6 h,剥皮,55 ℃干燥6 h,将红芸豆皮粉碎,过40目筛,准确称重。
红芸豆皮粉以料液比1∶8 (g∶mL)加入75%(体积分数)乙醇脱色,封口膜裹上,70 ℃水浴搅拌1 h,抽滤,滤渣自然风干,称重备用[10]。
1.3.2 水法提取工艺
将预处理的原料以料液比1∶10(g∶mL)加水混匀,95 ℃热水提取1 h,4 000 r/min离心15 min,沉淀再次加水提取1 h,离心,合并上清液,浓缩,4倍体积95%(体积分数)乙醇沉淀,4 ℃静置过夜,离心,沉淀复溶,透析48 h,冷冻干燥,得到水提膳食纤维(water extraction of dietary fiber, WDF)[10]。
1.3.3 高压辅助水法提取工艺
将预处理的原料以料液比1∶10(g∶mL)加水混匀,121 ℃高压处理1 h,4 000 r/min离心15 min,沉淀再次加水提取1 h,离心,合并上清液,浓缩,4倍体积95%(体积分数)乙醇沉淀,4 ℃静置过夜,离心,沉淀复溶,透析48 h,冷冻干燥,得到高压水提膳食纤维(high pressure water extraction of dietary fiber, HWDF)[10]。
1.3.4 微波辅助水法提取工艺
将预处理的原料以料液比1∶10(g∶mL)加水混匀,微波功率为500 W,微波10 min,4 000 r/min离心15 min,滤渣二次微波,合并上清液,浓缩,4倍体积95%(体积分数)乙醇沉淀,4 ℃静置过夜,离心,沉淀复溶,透析48 h,冷冻干燥,得到微波水提膳食纤维(microwave water extraction of dietary fiber, MWDF)。
1.3.5 酶法提取工艺
将预处理的原料以料液比1∶10(g∶mL)加水混匀,调节pH为4.5,加入原料质量1%的纤维素酶,50 ℃反应2 h,100 ℃灭酶10 min,离心(4 000 r/min,15 min),合并上清液,浓缩,4倍体积95%(体积分数)乙醇沉淀,4 ℃静置过夜,离心,沉淀复溶,透析48 h,冷冻干燥,得到酶提膳食纤维(enzyme extraction of dietary fiber, EDF)。
1.3.6 膳食纤维得率计算
膳食纤维得率计算如公式(1)所示:
膳食纤维得率![]()
(1)
式中:m1,膳食纤维质量,g;m2,红芸豆皮质量,g。
1.3.7 糖醛酸含量测定
采用间羟联苯法[11],以半乳糖醛酸为标准绘制标准曲线。
1.3.8 多糖和中性糖含量测定
采用苯酚-硫酸法[12],以一定比例的阿拉伯糖和木糖为标准品绘制标准曲线。同时以半乳糖醛酸(D-galacturonic acid,GalA)为标准品绘制标准曲线,用于校正样品中糖醛酸对测定中性糖含量时产生的干扰[13]。
1.3.9 蛋白质含量测定
采用考马斯亮蓝法[14],以牛血清蛋白为标准品绘制标准曲线。
1.3.10 单糖组成测定
称取膳食纤维样品约3 mg于具塞管中,加入2 mol/L 的TFA溶液2 mL,121 ℃水解1 h,旋转蒸发至除尽过量的TFA,进样离子色谱,分析单糖组成[15]。
检测条件:Carbopac PA 20色谱柱,检测器为电化学检测器,柱温30 ℃,流速为0.4 mL/min,10 mmol/L KOH溶液进行横梯度洗脱,进样体积25 μL,样品与标准品进样前用0.45 μm微孔滤膜过滤。
1.3.11 相对分子质量测定
将膳食纤维样品加水溶解成均一溶液,采用高效色谱仪检测相对分子质量。
高效液相色谱条件:检测器为示差折光检测器,色谱柱为Waters Ultrahydrogel TM Linear (7.8 mm×300 mm,5 μm),流动相为0.1 mol /L NaNO3溶液,流速0.9 mL/min,柱温45 ℃,进样量为20 μL。
1.3.12 红外光谱测定
称取约3 mg样品,与KBr粉末混匀、研磨、压片,于红外光谱仪中进行扫描。扫描范围4 000~400 cm-1,扫描次数为32次,分辨率为4 cm-1。
1.3.13 黏度测定
以去离子水作为溶剂,分别将不同膳食纤维样品配制成含量为9%的溶液。设定测试温度为20 ℃切速率为0~300 s-1,扫描时间为60 s,扫描模式为线性扫描。测定剪切速率变化时,膳食纤维溶液的黏度曲线。
1.3.14 体外降血糖活性测定
以阿卡波糖为阳性对照,参照ZHENG等[16]的方法,测定不同提取方法红芸豆皮膳食纤维对α-葡萄糖苷酶活性抑制效果。参照SUN等[17]的方法,测定膳食纤维对α-淀粉酶活性抑制效果。
1.4 数据分析
所有实验重复3次,结果表示为“平均值±标准差”,运用SPSS 25.0软件进行显著性分析,采用Origin 8.6软件进行绘图。
2 结果与分析
2.1 红芸豆皮膳食纤维得率分析
图1显示,4种膳食纤维组分的得率分别为(3.42±0.14)%、(12.20±0.25)%、(3.85±0.19)%和(1.52±0.12)%。与WDF相比较,HWDF得率显著提高,是水提组分的3.57倍;MWDF得率略有增加,提取效率高效提升;EDF得率最低,表明单一酶法提取并不能有效提高得率。而高温(121 ℃)、高压作用破坏了红芸豆皮细胞壁组织,促使水不溶性多糖与纤维素、蛋白的链接键断裂,转化为可溶性多糖[10]。微波辅助是利用“内加热”方法促使细胞内多糖扩散,细胞内水等极性介质受热膨胀破裂,多糖溶出[18]。
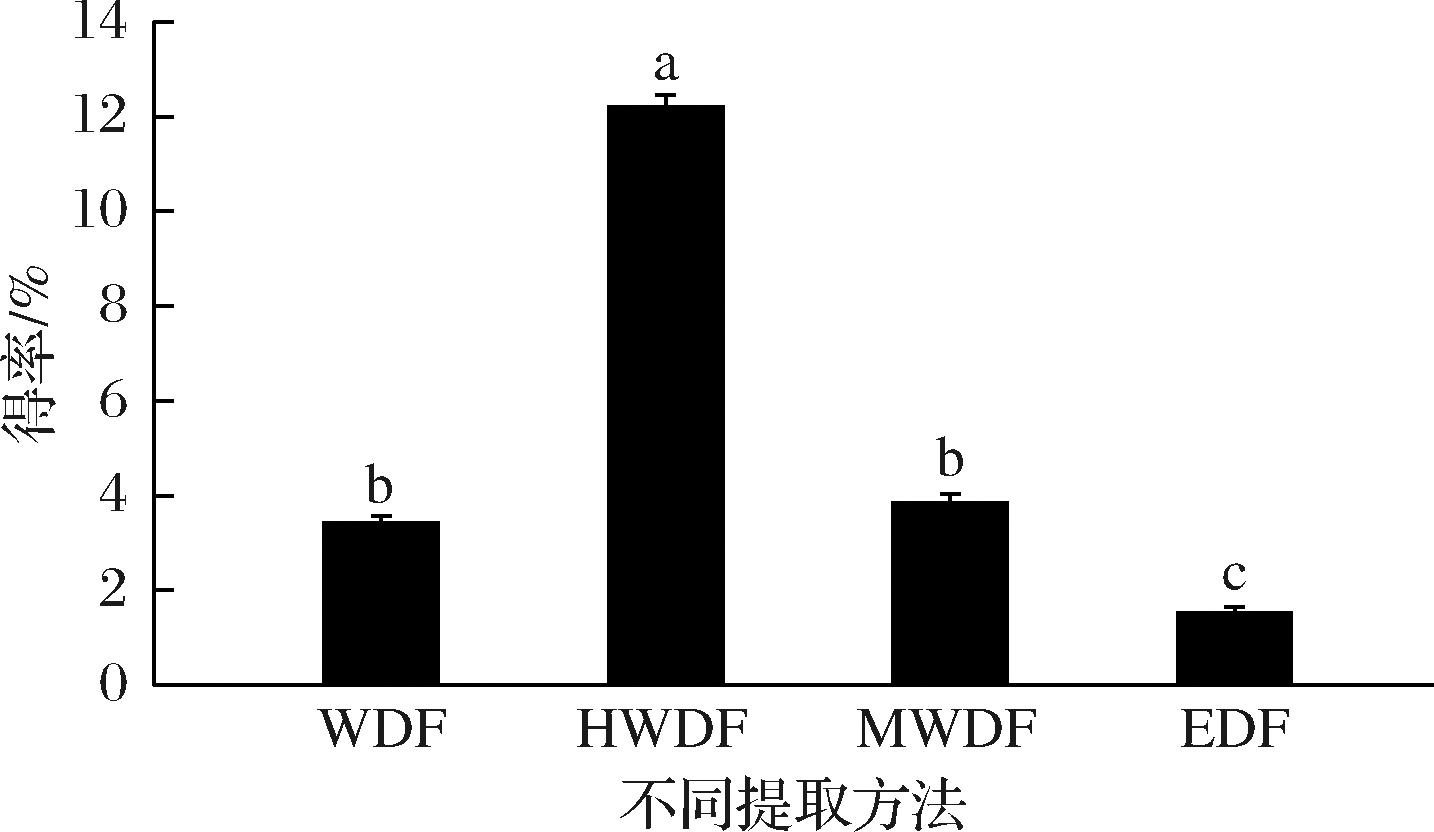
图1 不同提取方法红芸豆皮膳食纤维的得率比较
Fig.1 Comparison of yields of dietary fiber from red kidney bean skin by different extraction methods
注:字母不同表示差异显著(P<0.05)(下同)。
2.2 红芸豆皮膳食纤维的化学组成分析
由表1可知,不同提取方法对红芸豆膳食纤维多糖和中性糖含量具有显著性差异(P<0.05)。与WDF相比,HWDF的纯度较高,其多糖含量为95.29%;EDF的纯度较低,其多糖含量为62.85%。4种膳食纤维的化学组成有一定的差别,其中HWDF和WDF的中性糖含量较高,EDF中性糖含量最低为39.41%;HWDF的糖醛酸含量最高为36.04%,EDF的糖醛酸含量最低为23.43%。
表1 不同提取方法红芸豆皮膳食纤维的化学组成
Table 1 Chemical composition of dietary fiber from red kidney bean skin by different extraction methods
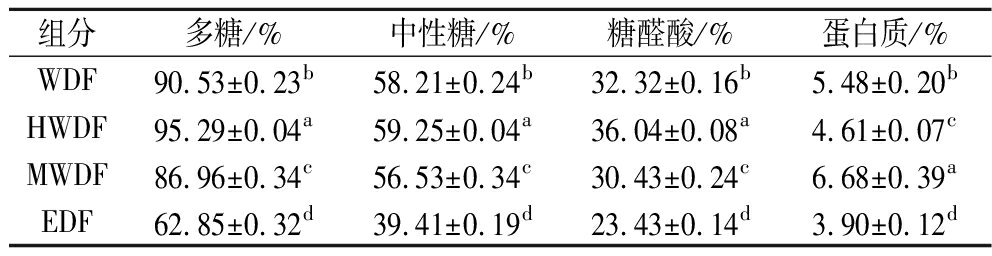
组分多糖/%中性糖/%糖醛酸/%蛋白质/%WDF90.53±0.23b58.21±0.24b32.32±0.16b5.48±0.20bHWDF95.29±0.04a59.25±0.04a36.04±0.08a4.61±0.07cMWDF86.96±0.34c56.53±0.34c30.43±0.24c6.68±0.39aEDF62.85±0.32d39.41±0.19d23.43±0.14d3.90±0.12d
注:同列数据字母不同表示差异显著(P<0.05)。
不同膳食纤维组分均含有一定含量的蛋白,其中MWDF的蛋白含量最高为6.68%,EDF的蛋白含量最低为3.90%,这表明微波辅助提取在机械效应和热效应的共同作用下更容易破坏次级键的结合力,由于蛋白质与半纤维素之间的共价键结合紧密,在多糖提取的过程中被一并溶出[10,19]。
2.3 单糖组成分析
从表2中可以看出,4种膳食纤维组分均主要由Ara、Gal、Xyl、GalA、Rha、Glc和GlcA组成。这说明红芸豆皮膳食纤维组成比较复杂,是一种由不同糖残基构成的杂多糖,可能含有果胶和半纤维素,与李安琪等[20]研究结果一致。
表2 不同提取方法红芸豆皮膳食纤维组分的单糖组成
Table 2 Monosaccharide composition of dietary fiber components from red kidney bean skin by different extraction methods
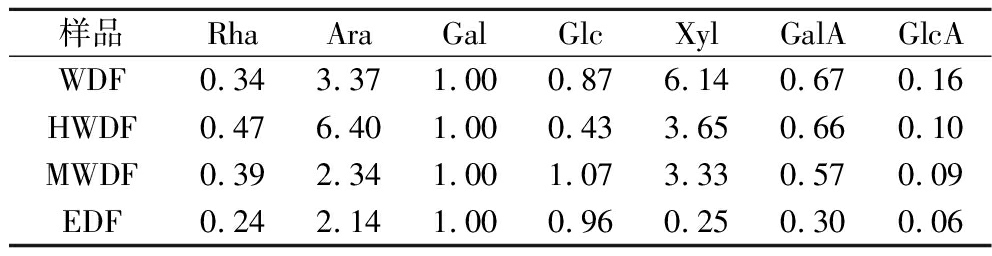
样品RhaAraGalGlcXylGalAGlcAWDF0.34 3.37 1.00 0.87 6.14 0.67 0.16 HWDF0.47 6.40 1.00 0.43 3.65 0.66 0.10 MWDF0.39 2.34 1.00 1.07 3.33 0.57 0.09 EDF0.24 2.14 1.00 0.96 0.25 0.30 0.06
注:表中数据表示各组成单糖的摩尔比。
WDF主要单糖的摩尔比为Ara∶Xyl∶Gal∶Glc∶GalA=3.37∶6.14∶1.00∶0.87∶0.67,其中Xyl的摩尔比较高。与WDF相比,HWDF促使Ara和Rha摩尔比升高、Glc和Xyl的摩尔比降低;MWDF Rha和Glc摩尔比升高、Ara、Xyl和GalA摩尔比下降;EDF Ara、Rha、Xyl和GalA的摩尔比都有所下降,Glc摩尔比升高,由此可见,不同提取方法对红芸豆皮膳食纤维的单糖组成种类没有差异,但单糖含量有所不同。
2.4 相对分子质量分布分析
图2显示,WDF、MWDF和EDF的相对分子质量分布比较均一,分别为1.32×105、1.64×105和4.67×105 Da。HWDF凝胶柱洗脱曲线有2个洗脱峰,相对分子质量由1.13×106和3.97×104 Da两部分组成。与WDF相比,其他3种红芸豆皮膳食纤维组分的相对分子质量均有一定程度的提高,且EDF相对分子质量是WDF的3.54倍,这可能是由于酶提取过程中破坏细胞结构,增加多糖溶出;HWDF相对分子质量显著提高,其原因可能是在高温、高压作用下,迅速破坏组织结构,促使高分子质量组分的释放和溶出。由此可知,不同提取方法会对红芸豆皮膳食纤维的相对分子质量产生较大的影响。
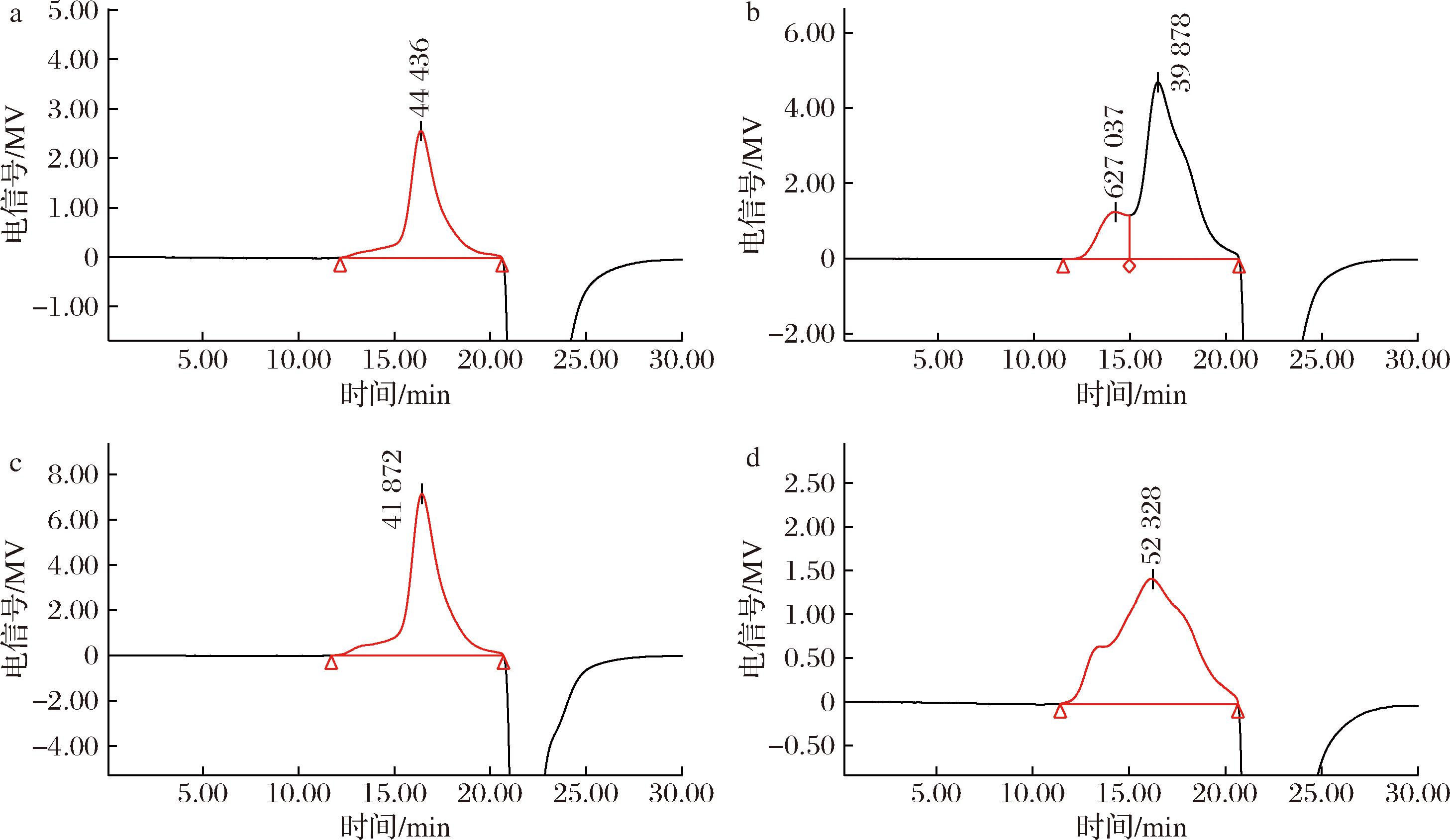
a-WDF;b-HWDF;c-MWDF;d-EDF
图2 不同提取方法红芸豆皮膳食纤维的凝胶色谱图
Fig.2 Gel chromatograms of dietary fiber from red kidney bean skin by different extraction methods
2.5 红外光谱分析
由图3可知,WDF、HWDF、MWDF和EDF组分在4 000~500 cm-1范围均具有糖类的特征吸收峰。4种组分在3 700~3 000 cm-1范围内,有明显宽大的吸收峰,为分子内或分子间氢键O—H伸缩振动所致,2 927 cm-1处有较弱的吸收峰,是C—H(CH、CH2和CH3)伸缩振动引起的[21]。1 741 cm-1和1 620 cm-1 是COOR和COO—的C![]() O的伸缩振动吸收峰,结合单糖组成分析结果表明,其含有糖醛酸,这是由于果胶中半乳糖醛酸作用所致[22]。与WDF相比,HWDF和MWDF的A1741/A1620的值增大,表明HWDF和MWDF具有较高的果胶酯化度。1 051 cm-1指纹区附近的强吸收峰是糖苷键C—O—C中的C—O伸缩振动引起的。1 400 cm-1和1 245 cm-1附近的吸收峰属C—H的弯曲振动,892 cm-1处的弱吸收,是吡喃β型C—H弯曲振动的特征吸收峰[23]。不同提取方法所得膳食纤维组分的酯化度存在一定差异。
O的伸缩振动吸收峰,结合单糖组成分析结果表明,其含有糖醛酸,这是由于果胶中半乳糖醛酸作用所致[22]。与WDF相比,HWDF和MWDF的A1741/A1620的值增大,表明HWDF和MWDF具有较高的果胶酯化度。1 051 cm-1指纹区附近的强吸收峰是糖苷键C—O—C中的C—O伸缩振动引起的。1 400 cm-1和1 245 cm-1附近的吸收峰属C—H的弯曲振动,892 cm-1处的弱吸收,是吡喃β型C—H弯曲振动的特征吸收峰[23]。不同提取方法所得膳食纤维组分的酯化度存在一定差异。
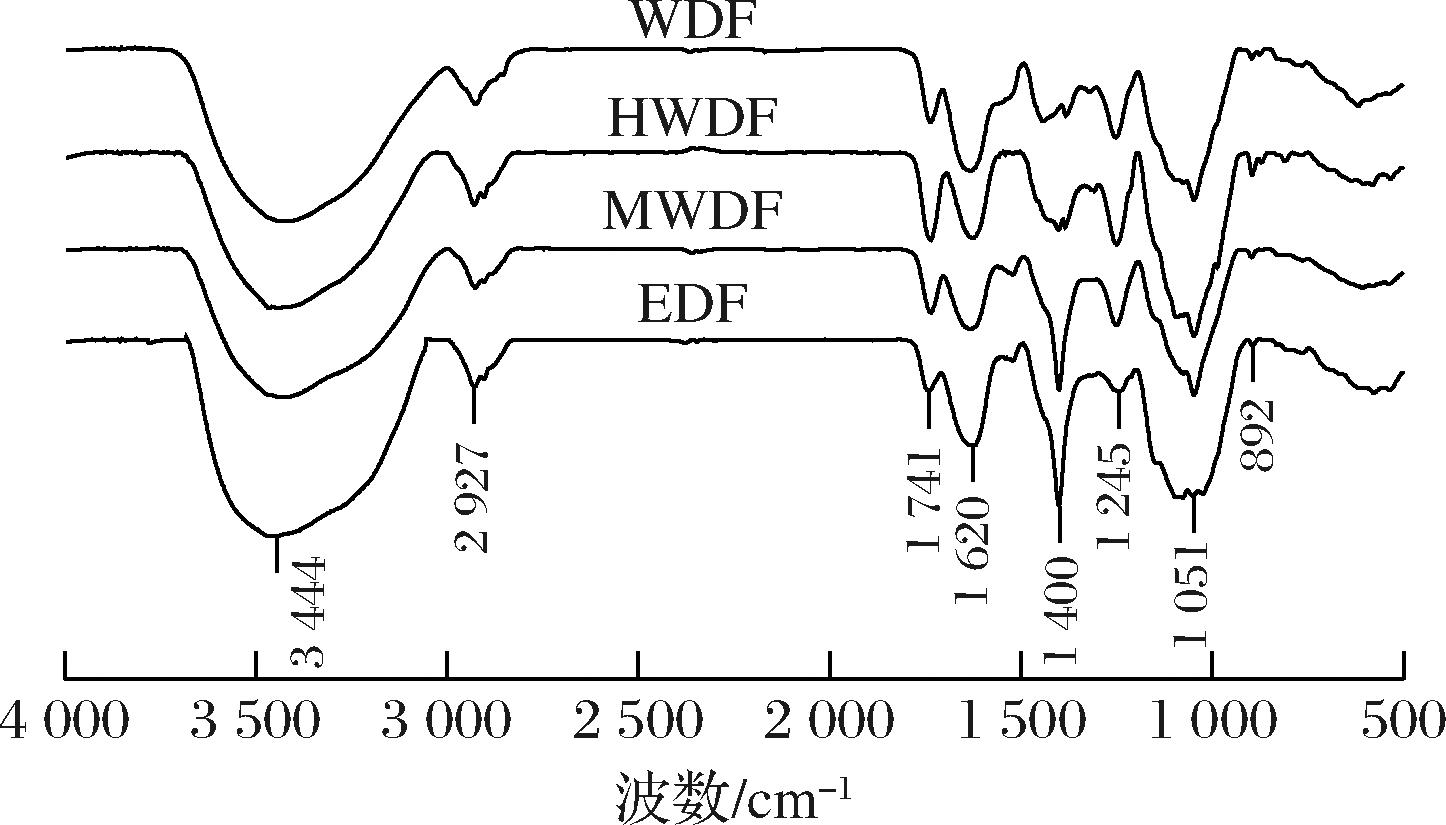
图3 不同提取方法红芸豆皮膳食纤维的红外光谱图
Fig.3 Infrared spectra of dietary fiber from red kidney bean skin by different extraction methods
2.6 黏度分析
如图4所示,同一浓度和相同剪切速率下,提取方法对红芸豆皮膳食纤维溶液的黏度影响很大,EDF、MWDF和WDF的黏度随剪切速率的增加而降低,表现为剪切稀化的假塑性流体行为[24]。与WDF相比,EDF具有更高的表观黏度,这与其相对分子质量含量较高有关;其次是MWDF,HWDF黏度最低。这可能是高温、高压作用下对红芸豆皮细胞壁破坏更大,导致部分多糖组分迅速降解,高分子质量组分下降,低分子质量组分大幅增加,黏度也随之下降。
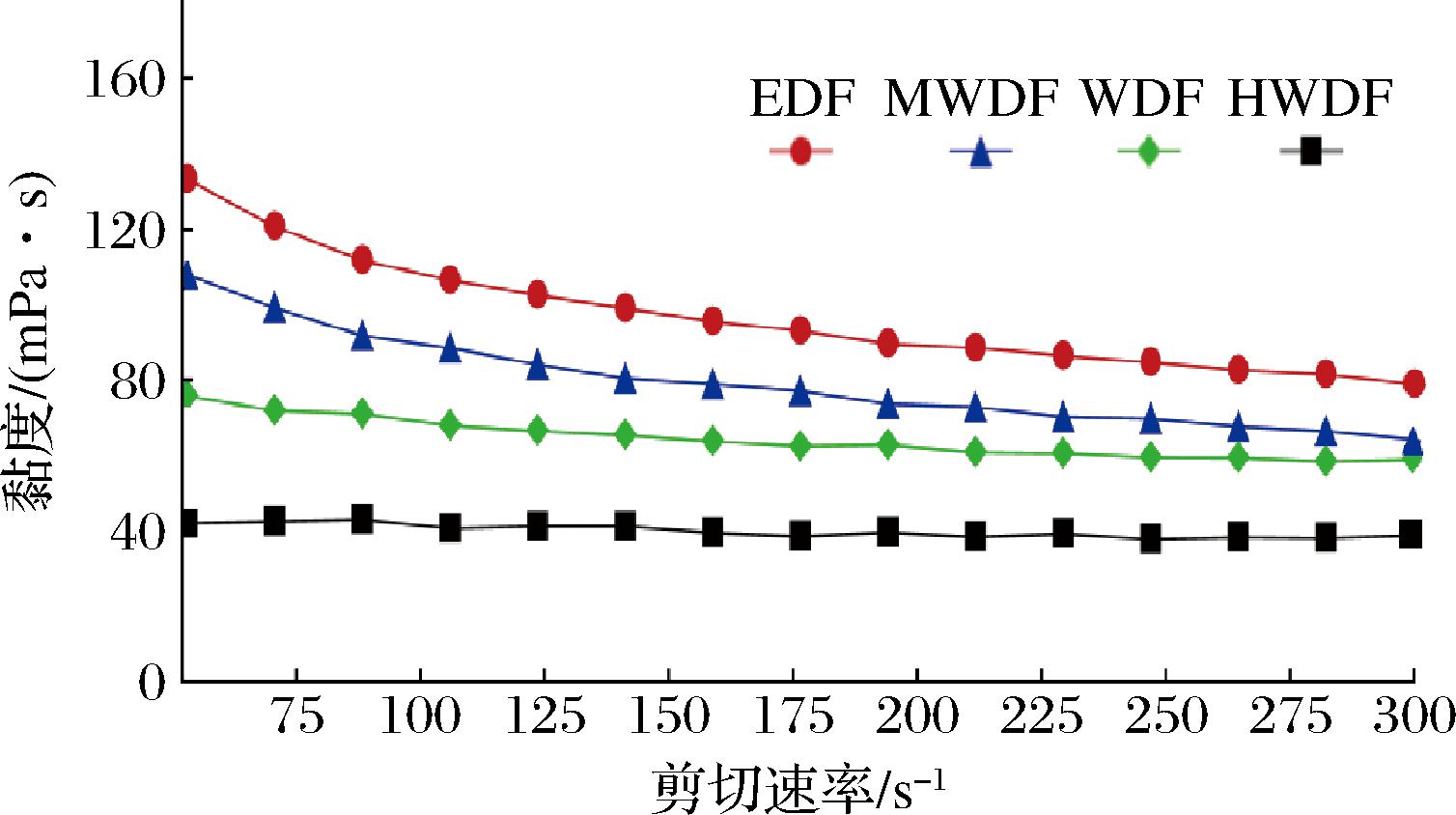
图4 不同提取方法红芸豆皮膳食纤维组分溶液的黏度
Fig.4 Viscosity of dietary fiber component solution of red kidney bean skin by different extraction methods
2.7 体外降血糖活性分析
由图5可知,在0.05~6.4 mg/mL,4种膳食纤维组分均具有较强的α-葡萄糖苷酶抑制活性,且随着膳食纤维质量浓度的增加,抑制能力逐渐增强。当质量浓度为6.4 mg/mL时,MWDF对α-葡萄糖苷酶抑制能力最强为(82.86±0.98)%,EDF对α-葡萄糖苷酶抑制能力最弱为(78.69±0.89)%(6.4 mg/mL)。4种膳食纤维组分对α-葡萄糖苷酶抑制能力强弱顺序为MWDF>HWDF>WDF>EDF,且均弱于阿卡波糖。从图6可以看出,在0.1 mg/mL时,WDF、HWDF、MWDF和EDF对α-淀粉酶活性抑制能力为(28.71±1.78)%、(35.04±3.32)%、(30.27±0.96)%和(17.43±1.10)%。其中,HWDF对α-淀粉酶活性抑制最强。研究发现[25],具有降血糖活性的多糖大都含有较高含量的半乳糖、半乳糖醛酸残基和阿拉伯糖等。HWDF和MWDF具有较强的降血糖活性,这可能是与其含有较高的糖醛酸含量有关。

图5 不同提取方法红芸豆皮膳食纤维对α-葡萄糖苷酶的抑制率
Fig.5 Inhibition rate of dietary fiber from different red kidney bean skins on α-glucosidase
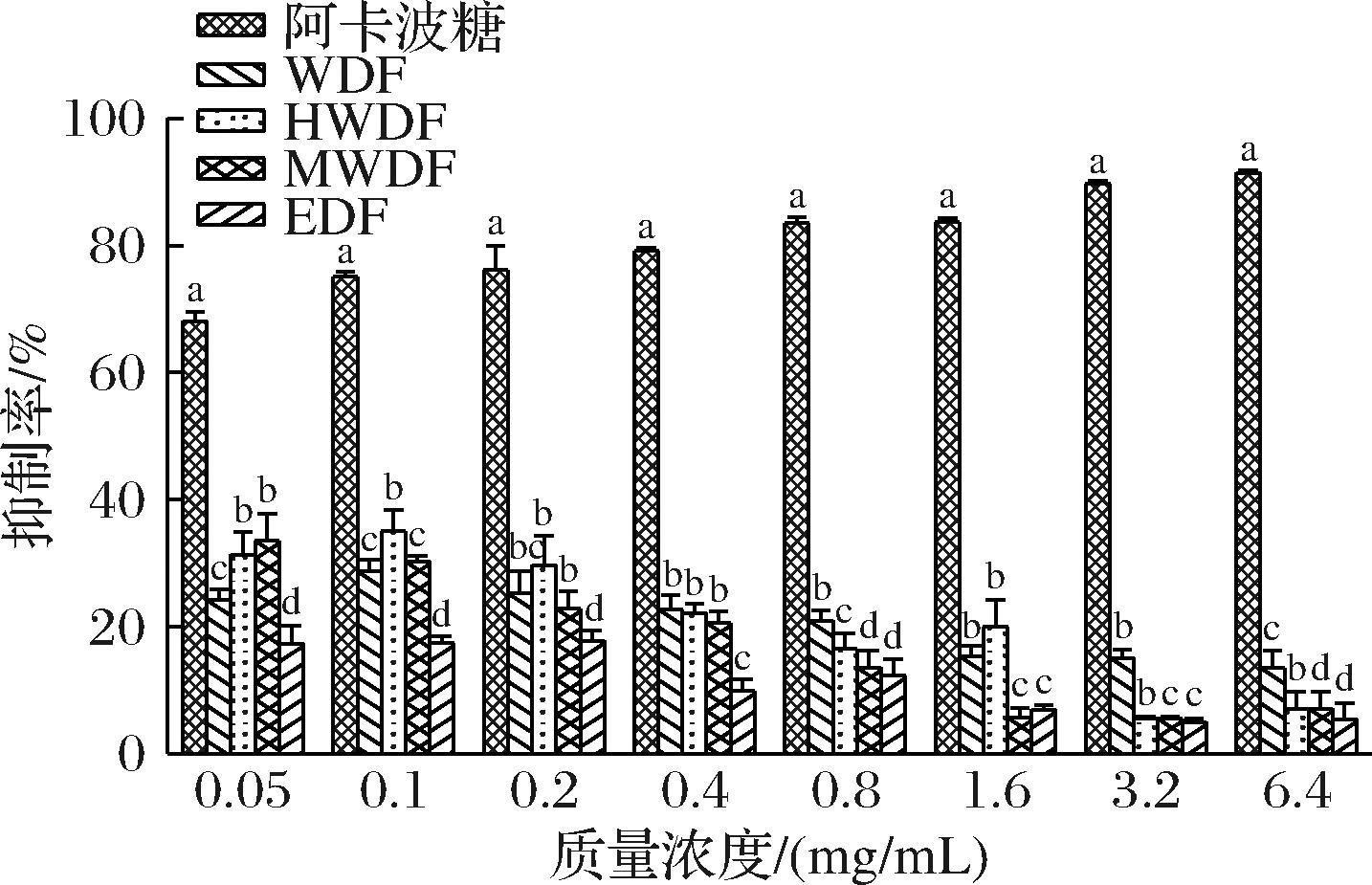
图6 不同提取方法红芸豆皮膳食纤维对α-淀粉酶的抑制率
Fig.6 Inhibition rate of dietary fiber from different red kidney bean skins on α-amylase
3 结论
不同提取方法制备所得红芸豆皮膳食纤维的得率和化学组成存在一定的差异。与WDF相比,HWDF得率显著提高(12.20%),是WDF的3.57倍;MWDF得率有所增加,且提取效率高效提升。HWDF具有更高的多糖纯度和糖醛酸含量(95.29%、36.04%)。
结合单糖组成和红外光谱可知,4种膳食纤维组分主要由Ara、Gal、Xyl、GalA、Rha、Glc和GlcA组成,含有果胶和半纤维素,且每种单糖的摩尔比存在明显差异,是一种由不同糖残基构成的杂多糖。相比于热水浸提,其他3种提取方法所得相对分子质量均有所提高,且HWDF相对分子质量最高为1.13×106,其次为酶提组分4.67×105。黏度分析可知,EDF表观黏度最高,MWDF黏度次之,均高于水提组分。MWDF和HWDF表现出相对较强的降血糖活性。本研究为红芸豆皮膳食纤维的高效制备及开发应用提供理论依据。
[1] 董良利, 田森林.山西发展芸豆生产的优势与对策[J].杂粮作物, 2006, 26(1):54-55.
DONG L L, TIAN S L.Production superiority and countermeasure of kidney bean in Shanxi Province[J].Rain Fed Crops, 2006, 26(1):54-55.
[2] 王何柱, 朱勇, 朱怡, 等.基于主成分分析法的贵州芸豆品质评价[J].食品与机械, 2020, 36(3):48-53.
WANG H Z, ZHU Y, ZHU Y, et al.Quality evaluation of Guizhou kidney beans based on principal component analysis[J].Food &Machinery, 2020, 36(3):48-53.
[3] 郭增旺, 陆涛, 瞿东杨, 等.四种芸豆蛋白的理化与功能特性分析[J].中国食品添加剂, 2016, 27(8):199-204.
GUO Z W, LU T, QU D Y, et al.Analysis of physicochemical and functional properties of four kinds of kidney bean protein[J].China Food Additives, 2016, 27(8):199-204.
[4] HAN F, MOUGHAN P J, LI J T, et al.Digestible indispensable amino acid scores (DIAAS) of six cooked Chinese pulses[J].Nutrients, 2020, 12(12):3831.
[5] BAI Z Y, MENG J X, HUANG X J, et al.Comparative study on antidiabetic function of six legume crude polysaccharides[J].International Journal of Biological Macromolecules, 2020, 154:25-30.
[6] BAI Z Y, HUANG X J, WU G J, et al.Hepatic metabolism-related effects of polysaccharides from red kidney bean and small black soybean on type 2 diabetes[J].Food Chemistry, 2023, 403:134334.
[7] 李凤伟, 彭梦黎, 朱袁平, 等.提取方法对手掌参多糖理化性质及抗氧化活性的影响[J].食品与发酵工业, 2021, 47(24):150-155.
LI F W, PENG M L, ZHU Y P, et al.Effect of extraction method on the physicochemical properties and antioxidant activity of polysaccharides from Gymnadenia conopsea R.Br[J].Food and Fermentation Industries, 2021, 47(24):150-155.
[8] YUN L Y, LI D Z, YANG L, et al.Hot water extraction and artificial simulated gastrointestinal digestion of wheat germ polysaccharide[J].International Journal of Biological Macromolecules, 2019, 123:174-181.
[9] 娜日苏. 天然植物多糖提取工艺及研究进展[J].赤峰学院学报(自然科学版), 2022, 38(9):29-34.
NA R S.Extraction technology and research progress of natural plant polysaccharides[J].Journal of Chifeng University (Natural Science Edition), 2022, 38(9):29-34.
[10] 孙元琳, 张生万, 康雪芬.不同提取方法制备大豆皮多糖的对比分析[J].中国粮油学报, 2010, 25(7):30-33;38.
SUN Y L, ZHANG S W, KANG X F.A comparative analysis of polysaccharides prepared from soybean hull by different extraction methods[J].Journal of the Chinese Cereals and Oils Association, 2010, 25(7):30-33;38.
[11] 赵鹤鹏, 许秋达, 周鸿立.玉米须多糖中糖醛酸含量的测定及抗氧化作用的研究[J].河南工业大学学报(自然科学版), 2017, 38(4):81-85.
ZHAO H P, XU Q D, ZHOU H L.Determination of uronic acid in corn silk polysaccharides and its antioxidation activity[J].Journal of Henan University of Technology (Natural Science Edition), 2017, 38(4):81-85.
[12] YANG Q, GU W C, Z N, et al.Comparison of phenol-sulfuric acid and anthrone-sulfuric methods for determination of polysaccharide in Lycopus Lucidus Tilrcz.Var.Hirtus Regel[J].Food Science and Technology, 2020, 45(1):343-350.
[13] 孙元琳, 申瑞玲, 蔡宝玉, 等.当归多糖的分级制备及组成分析[J].河南工业大学学报(自然科学版), 2005, 26(2):40-43;47.
SUN Y L, SHEN R L, CAI B Y, et al.The preparation, purification and composition analysis of Angelica sinensis polysaccharides[J].Journal of Zhengzhou Institute of Technology, 2005, 26(2):40-43;47.
[14] 王振强, 贾俊伟, 王浩.燕麦麸皮中燕麦胶的提取纯化工艺优化及纯度测定[J].食品研究与开发, 2019, 40(3):125-130.
WANG Z Q, JIA J W, WANG H.Optimization and purification of oat gum extracted from oat bran and purity determination[J].Food Research and Development, 2019, 40(3):125-130.
[15] 孙元琳, 田玉荣, 刘瑞, 等.加工工艺对黑小麦麸皮戊聚糖组成与理化性质的影响[J].食品科学技术学报, 2021, 39(5):56-62.
SUN Y L, TIAN Y R, LIU R, et al.Effect of processing technology on composition and physicochemical properties of pentosans from black-grained wheat bran[J].Journal of Food Science and Technology, 2021, 39(5):56-62.
[16] ZHENG Q W, JIA R B, LUO D H, et al.The effect of extraction solution pH level on the physicochemical properties and α-glucosidase inhibitory potential of Fucus vesiculosus polysaccharide[J].LWT, 2022, 169:114028.
[17] SUN L J, CHEN W Q, MENG Y H, et al.Interactions between polyphenols in thinned young apples and porcine pancreatic α-amylase:Inhibition, detailed kinetics and fluorescence quenching[J].Food Chemistry, 2016, 208:51-60.
[18] 方嘉沁, 郑青松, 文雨欣, 等.不同提取方法的莲子心多糖结构与理化性质比较[J].现代食品科技, 2023, 39(1):92-103.
FANG J Q, ZHENG Q S, WEN Y X, et al.Comparison of the structures and physiochemical properties of polysaccharides extracted from Plumula nelumbinis by different methods[J].Modern Food Science and Technology, 2023, 39(1):92-103.
[19] 卢忠英, 鲁道旺, 陈仕学, 等.微波辅助提取竹荪中膳食纤维的工艺优化[J].河南农业科学, 2017, 46(7):137-141.
LU Z Y, LU D W, CHEN S X, et al.Optimization for microwave-assisted extraction of dietary fiber from Dictyophora[J].Journal of Henan Agricultural Sciences, 2017, 46(7):137-141.
[20] 李安琪, 黄晓君, 聂少平, 等.动态高压微射流处理对红芸豆多糖基本结构特征、流变性质和固体形貌的影响[J].食品科学, 2020, 41(11):97-103.
LI A Q, HUANG X J, NIE S P, et al.Effects of dynamic high pressure microfluidization treatment on basic structural characteristics, rheological properties and solid morphology of red kidney bean polysaccharide[J].Food Science, 2020, 41(11):97-103.
[21] 孙元琳, 仪鑫, 李云龙, 等.黑小麦不溶性膳食纤维酶解产物组成分析及其对全谷物挤压膨化产品品质的影响[J].食品工业科技, 2019, 40(2):8-12.
SUN Y L, YI X, LI Y L, et al.Composition analysis of enzymatic hydrolysates of insoluble dietary fiber black-grained wheat and its effects on quality of whole grain extruded products[J].Science and Technology of Food Industry, 2019, 40(2):8-12.
[22] CHAHARBAGHI E, KHODAIYAN F, HOSSEINI S S.Optimization of pectin extraction from pistachio green hull as a new source[J].Carbohydrate Polymers, 2017, 173:107-113.
[23] LIU Y, ZHANG B, IBRAHIM S A, et al.Purification, characterization and antioxidant activity of polysaccharides from Flammulina velutipes residue[J].Carbohydrate Polymers, 2016, 145:71-77.
[24] 李梦钰, 刘会平, 贾琦, 等.天冬多糖理化性质和流变学特性研究[J].食品与发酵工业, 2021, 47(5):48-56.
LI M Y, LIU H P, JIA Q, et al.Physicochemical properties and rheological properties of asparagi Radix polysaccharide[J].Food and Fermentation Industries, 2021, 47(5):48-56.
[25] JI X L, GUO J H, CAO T Z, et al.Review on mechanisms and structure-activity relationship of hypoglycemic effects of polysaccharides from natural resources[J].Food Science and Human Wellness, 2023, 12(6):1969-1980.