核桃(Juglans regia L.)与扁桃、腰果、板栗并称为世界四大干果。干核桃是核桃最为常见的贮藏和消费形式,近年来鲜核桃因其独特的口感和风味受到广大消费者喜爱,消费市场迅速扩张[1]。作为目前核桃消费的新形式,鲜核桃富含蛋白质、维生素E、氨基酸等营养物质[2]和更高的抗氧化能力[3-4],贮藏形式主要包括青皮核桃果实和鲜核桃坚果2种。然而,由于鲜核桃坚果采后水分和不饱和脂肪酸含量较高,采后极易出现发霉、酸败和发芽等问题,严重影响其市场供应[5-6]。
鲜核桃采后品质变化是反映其贮藏效果的重要方面。鲜核桃坚果外壳湿度较大,极易为霉菌生长提供有利条件,发霉情况是评估鲜核桃品质最直观的反映。鲜核桃种仁品质主要包括粗脂肪、可溶性糖和可溶性蛋白质含量等营养品质指标和酸价(acid value,AV)、过氧化值(peroxide value,PV)等油脂品质指标。鲜核桃种仁中含有约70%的多不饱和脂肪酸,容易发生油脂氧化酸败而产生难闻的气味[7]。其种仁品质劣变通常是由多不饱和脂肪酸氧化引起的。AV和PV分别代表了游离脂肪酸和过氧化物的水平,可以反映油脂的质量[8]。多酚氧化酶(polyphenol oxidase,PPO)和过氧化物酶(peroxidase,POD)是鲜核桃中的重要抗氧化酶,较高的POD活性和较低的PPO活性提高了种仁的抗氧化能力进而保持了坚果的品质[9]。在核桃产业化加工中,坚果常以带壳坚果和种仁的形式进行贮藏和销售。坚果外壳的保护以及脱壳过程中的损伤对种仁品质都有着较大的影响。
目前,有关鲜核桃坚果采后贮藏技术及生理研究较多,但有关鲜核桃仁作为一种新型商品贮藏的报道较少[10],尤其对于不同状态鲜核桃贮藏期间种仁品质差异的研究未见报道。本文以‘清香’鲜核桃为试材,测定分析带壳坚果、整仁、碎仁3种状态鲜核桃(0±0.5) ℃冷藏期间品质相关指标的变化与差异,为各状态鲜核桃的贮藏品质的保持提供理论依据。
1 材料与方法
1.1 材料
试材为‘清香’青皮核桃果实,自然成熟时采收自陕西省铜川市宜君县核桃示范园。采收后挑选无机械损伤、无病虫害且大小一致的果实,置于垫有泡沫网的塑料筐中运回西北农林科技大学实验室。核桃人工脱去青皮后经流动自来水快速清洗,晾干表面水分后待用。
1.2 仪器与设备
A11 型研磨分析仪,德国 IKA 公司;AG 22331 型低温离心机,德国 Eppendorf 公司;UV-3100 型紫外可见分光光度计,中国上海美谱达仪器有限公司;NAI-ZFCDY-6Z 脂肪测定仪,上海那艾精密仪器有限公司;TRACE1310-ISQLT 气相色谱-质谱联用仪,美国Thermo Fisher公司。
1.3 样品处理与取样
将鲜核桃坚果随机分为3组,2组采用人工剥取整仁和大小均一的碎仁。然后将坚果、整仁和碎仁均放入塑料小筐(25 cm×17.5 cm×6 cm)后转入(0±0.5) ℃冷库中预冷24 h,然后采用0.03 mm厚聚乙烯(polyethene,PE30)袋(规格25 cm × 35 cm)包装后继续于该条件下封口贮藏。每组样品24筐,每筐10个坚果或其种仁(1个重复)。样品于0、6、12、18、30、42、54、66 d时进行取样,取样时每种状态随机取3筐作为3个重复,统计发霉情况后将坚果样品去种壳和内种皮、整仁和碎仁去内种皮,然后将种仁分别投于液氮中速冻,再采用研磨分析仪充分粉碎后置于-80 ℃超低温冰箱保存备用。
1.4 测定指标与方法
1.4.1 发霉指数
鲜核桃发霉情况统计参考陈柏等[11]的方法,共分4个等级。0 级:种壳表面无发霉;1 级:种壳表面霉点分布面积<1/3;2 级:1/3≤种壳表面霉点分布面积≤2/3;3 级:种壳表面霉点分布面积>2/3。发霉指数=Σ(发霉级别×发霉果实个数)/(总果数×最高发霉级数)。
1.4.2 营养品质指标
可溶性糖含量采用蒽酮法进行测定。称取0.1 g鲜核桃粉末加入1 mL H2O,沸水浴提取40 min后快速冷却,离心15 min(4 ℃,12 000 r/min),收集上清液即为糖提取液。吸取0.05 mL上清液,加入1.95 mL H2O、0.5 mL蒽酮-乙酸乙酯溶液和5 mL浓硫酸混合,于波长630 nm处测定吸光值。用1 μg/mL的葡萄糖标准液制作标准曲线,可溶性糖含量根据所得吸光度值计算得出,最终以质量分数(%)表示。
可溶性蛋白含量采用考马斯亮蓝法测定。称取0.3 g鲜核桃粉末加入1.5 mL蒸馏水提取,用冷冻离心机于低温(4 ℃,12 000 r/min)下离心20 min,收集上清液。反应体系:0.1 mL上清液,0.9 mL蒸馏水,加入5 mL考马斯亮蓝G-250溶液充分混合,用牛血清白蛋白制作标准曲线,在波长595 nm处测定OD值。
粗脂肪含量采用索氏提取法测定,称取8 g鲜核桃粉样,于30~60 ℃沸程的石油醚中浸提5 h,50 ℃水浴中去除溶剂中的石油醚,收集剩余液体即为提取的油样,然后滤纸包于80 ℃烘箱中烘至恒重,用干基来表示粗脂肪含量。脂肪酸组分及含量参照 QIAN 等[12]的方法,略有修改。先将脂肪酸甲基化,然后采用气相色谱质谱联用仪进行测定。具体如下:称取0.1 g鲜核桃粉末加入3 mL提取缓冲液(氯仿∶甲醇=2∶1,体积比),超声波振荡5 min,6 000 r/min离心5 min,取上清液;重复3次上述的操作,将获得的上清液混匀备用。取0.5 mL上清液加入2 mL体积分数为1%的硫酸-甲醇溶液,在70 ℃水浴30 min,然后加入2 mL十七烷酸甲酯标准品溶液混匀,静置分层,收集上清液,向下层溶液中加入2 mL正己烷混匀后静置分层,取上清液待测。使用气相色谱-质谱联用仪测定,色谱柱为TG-5MS毛细管柱(30 m×0.25 mm,0.25 μm);N2作为载气,流速为1.2 mL/min;升温程序为初始柱温80 ℃保持1 min,以10 ℃/min升温至200 ℃,再以5 ℃/min升温至225 ℃,最后以2 ℃/min升温至250 ℃并保持5 min;进样量为1 μL。离子源温度为280 ℃;MS传输杆温度为240 ℃;质量扫描范围为45~460 amu。
1.4.3 油脂品质指标
参照GB 5009.229—2016《食品安全国家标准食品中酸价的测定》,采用热乙醇指示剂滴定法测定酸价;参照GB 5009.227—2016《食品安全国家标准食品中过氧化值的测定》,采用滴定法测定过氧化值。
1.4.4 POD、PPO活性
粗酶液提取:称取0.4 g鲜核桃粉末置于2 mL离心管中,加入1.5 mL磷酸钠缓冲液(4 ℃预冷,0.1 mol/L,含4% PVP,质量分数)摇匀后,于4 ℃、12 000 r/min离心30 min,上清液用于POD和PPO活性测定。
活性测定:参考 LI 等[13]的方法,略有修改。POD反应体系含有0.3 mL粗酶液,2.5 mL 25 mmol/L愈创木酚溶液,加入0.2 mL 0.5 mol/L H2O2溶液迅速混合启动反应,以每分钟OD470值变化0.001为1个POD活力单位(U),单位为U/mg蛋白质。PPO反应体系含有0.2 mL粗酶液,2.3 mL磷酸钠缓冲液(0.1 mol/L,pH值为7.0)和0.5 mL邻苯二酚溶液(50 mmol/L),以每分钟OD420值变化0.001为一个PPO活力单位(U),单位为U/mg蛋白质。
1.5 数据处理与分析
采用Excel和Origin 2023软件分别进行数据处理与作图,利用SPSS 23.0 中的Duncan方差分析法进行显著性分析。
2 结果与分析
2.1 不同状态鲜核桃冷藏期含水率和发霉指数的变化
随着贮藏时间的延长,鲜核桃坚果、整仁和碎仁的含水率逐渐下降(图1-a),以碎仁下降最多,整仁次之,坚果下降最少。3种状态鲜核桃的发霉指数随贮藏时间逐渐升高(图1-b)。贮藏42 d时,各状态鲜核桃表面均开始出现发霉现象,且以坚果表面的发霉指数显著高于整仁和碎仁(P<0.05)。这应该是由于坚果种壳相比于种仁更为湿润的表面环境为霉菌生长提供了良好的条件所引起[14]。
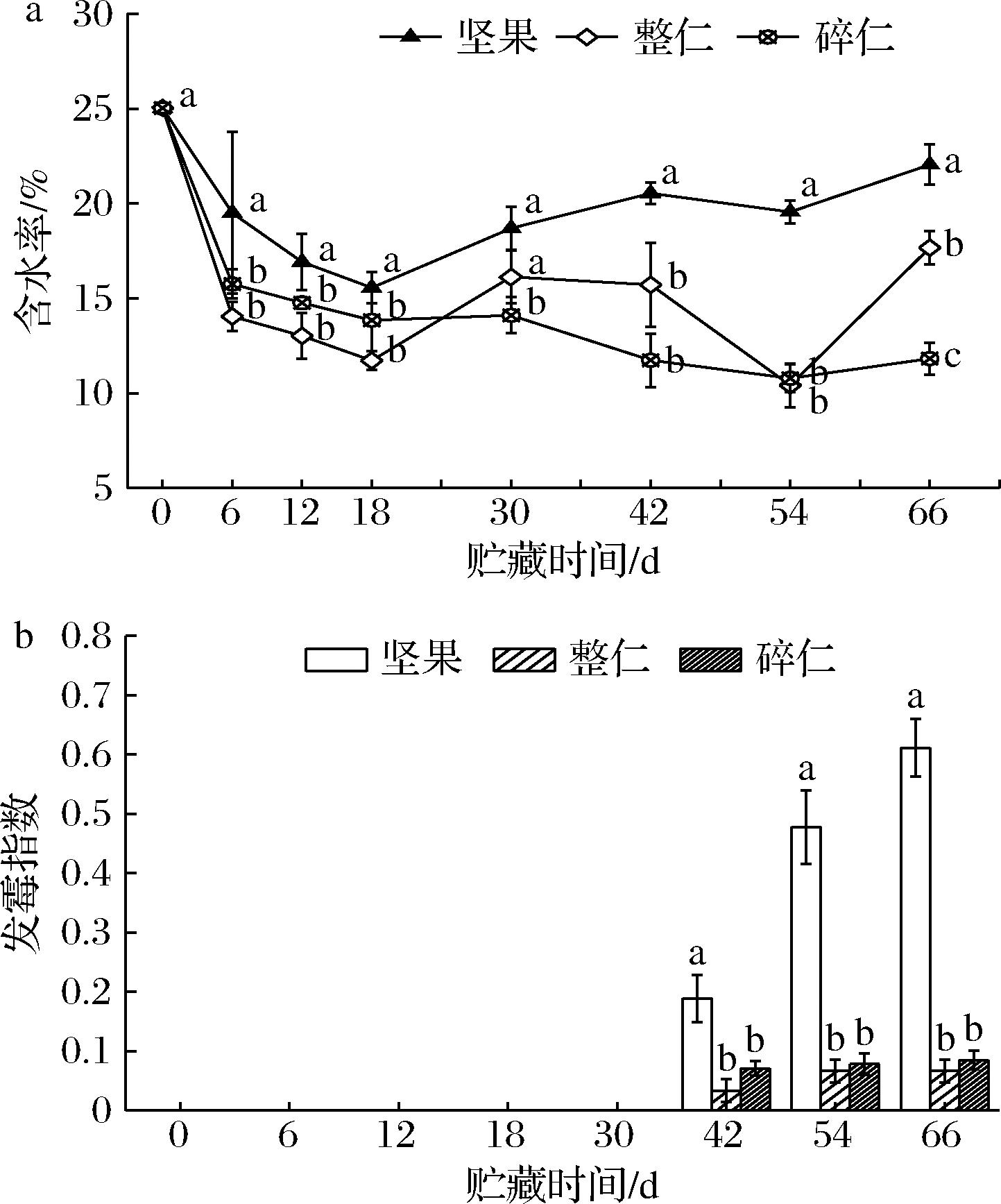
a-含水率;b-发霉指数
图1 不同状态鲜核桃在冷藏期间含水率和发霉指数的变化
Fig.1 Changes of moisture content and mold index of different-states fresh walnuts during cold storage
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.2 不同状态鲜核桃冷藏期可溶性蛋白质、可溶性糖和粗脂肪含量的变化
可溶性蛋白质多为植物体内参与代谢的酶类,其含量与植物体的生命活动密切相关。贮藏期间,鲜核桃坚果、整仁和碎仁的可溶性蛋白质含量变化趋势各不相同(图2-a)。坚果的可溶性蛋白质含量呈波动变化且保持相对较高的水平;整仁的除在6 d和54 d下降外,总体呈逐渐上升趋势;然而碎仁的可溶性蛋白质含量则呈现总体下降的趋势。贮藏期间,3种状态鲜核桃种仁的可溶性蛋白质含量均值分别为10.77、10.22和9.74 mg/g,以坚果的含量最高,表明坚果能够较好地保持种仁中可溶性蛋白质含量的稳定。
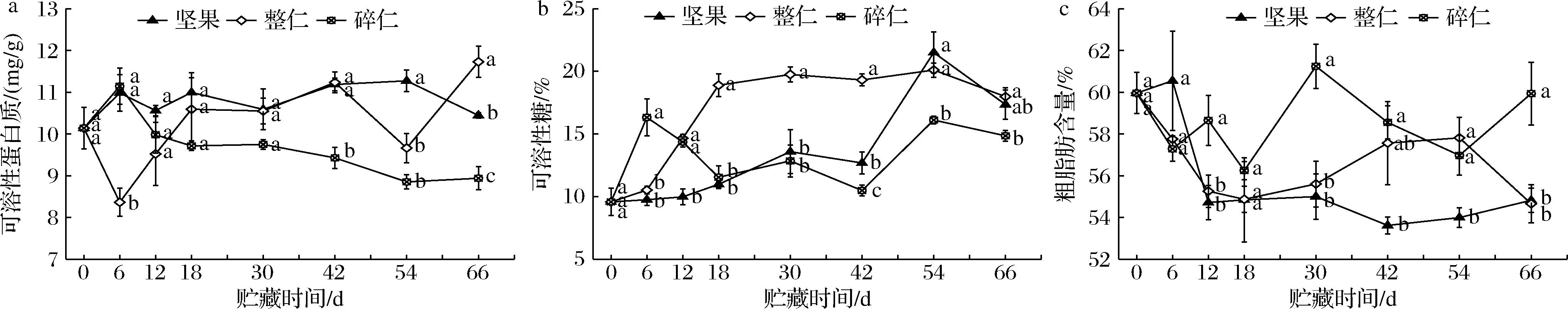
a-可溶性蛋白质;b-可溶性糖;c-粗脂肪含量
图2 不同状态鲜核桃在冷藏期间可溶性蛋白质、可溶性糖和粗脂肪含量的变化
Fig.2 Changes of soluble protein, soluble sugar and crude fat contents of different-states fresh walnuts during cold storage
鲜核桃坚果、整仁和碎仁在冷藏期间的可溶性糖含量总体呈现上升趋势(图2-b)。碎仁的可溶性糖含量6 d内显著升高,6 d时高于其他2种状态,30 d之后却低于其他状态;整仁的可溶性糖含量6~18 d迅速升高后维持在17.98%~20.1%,之后至54 d持续高于坚果和碎仁,坚果的可溶性糖含量在54 d时达到最高,且和碎仁的可溶性糖含量均出现了明显的高峰波动。贮藏期间,三者的可溶性糖平均含量分别为13.17 %、16.35%和12.65%,表明整仁能够很好地保持可溶性糖含量的高水平与稳定性。
鲜核桃坚果、整仁和碎仁的粗脂肪含量在贮藏期间逐渐下降(图2-c)。贮藏18 d期间,三者的粗脂肪含量均迅速下降,之后坚果和整仁的粗脂肪含量呈波动变化,碎仁则呈现缓慢回升趋势。贮藏末期与0 d相比,坚果、整仁和碎仁的粗脂肪含量分别减少了8.57%、8.85%和0.04%,贮藏期间,以碎仁的脂肪平均含量(58.61%)高于坚果(55.94%)和整仁(56.69%),且在12、30、66 d时显著高于其他两者(P<0.05),表明坚果和整仁的脂肪降解速度相对较快。
2.3 不同状态鲜核桃冷藏期脂肪酸组分及含量的变化
鲜核桃中的脂肪酸以亚油酸(65.75%)为主,其次是油酸(16.20%)和亚麻酸(9.15%),还有少量棕榈酸(6.36%)和硬脂酸(2.53%)(图3-a),这种趋势与鲜核桃其他研究中的表现一致[15]。0 d时,鲜核桃脂肪酸中不饱和脂肪酸 (unsaturat-ed fatty acid,UFA)的占比为91.1%(图3-b)。鲜核桃坚果、整仁和碎仁贮藏期间,种仁的脂肪酸组分没有明显变化,UFA相对含量减少,饱和脂肪酸 (satu-rated fatty acid,SFA)相对含量则增加,三者中以坚果的UFA和单不饱和脂肪酸(monounsaturated fatty acid,MUFA)相对含量保持最高,且主要以油酸含量为主(图3-c)。
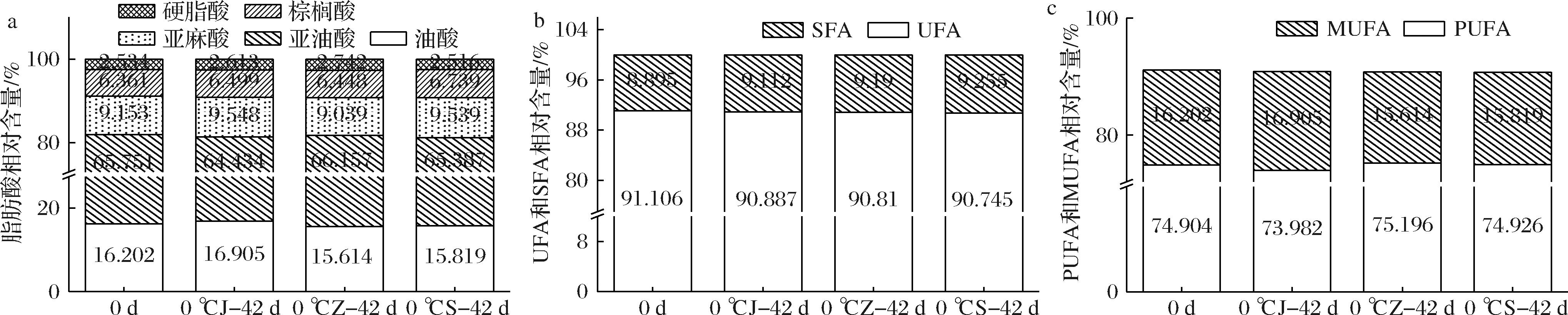
a-脂肪酸相对含量;b-UFA和SFA相对含量;c-PUFA和MUFA相对含量
图3 不同状态鲜核桃在冷藏期间脂肪酸组分及含量的变化
Fig.3 Changes of fatty acid composition and content of different-states fresh walnuts during cold storage
注:0 ℃ J-42 d:0 ℃贮藏坚果42 d;0 ℃ Z-42 d:0 ℃贮藏整仁42 d;0 ℃ S-42 d:0 ℃贮藏碎仁42 d;不同小写字母表示差异显著(P<0.05)。
2.4 不同状态鲜核桃冷藏期AV和PV的变化
鲜核桃坚果、整仁和碎仁的AV随贮藏时间延长而升高(图4-a)。贮藏30 d期间,坚果、整仁和碎仁的AV逐渐升高,之后整仁和碎仁的AV缓慢下降,而坚果的AV却持续升高,在42 d出现明显高峰。整个贮藏期间,以坚果的AV上升速度最快,其在12、42和66 d时的AV显著高于其他两者(P<0.05),表明坚果贮藏期间的脂质水解程度较高。

a-AV;b-PV
图4 不同状态鲜核桃在冷藏期间AV和PV的变化
Fig.4 Changes of AV and PV of different-states fresh walnuts during cold storage
PV是指油脂氧化初级阶段形成的脂质过氧化物和氢过氧化物的含量,可以用来评价油脂一级氧化过程的程度[16]。鲜核桃整仁和碎仁的PV除初始点较高外,均呈现下降趋势(图4-b)。贮藏期间,坚果的PV除30和66 d外均显著高于其余2种状态(P<0.05),整仁和碎仁的PV在贮藏前18 d迅速下降后缓慢上升,且整仁在30~42 d的PV值高于碎仁,但66 d时却低于其他2种状态。整个贮藏期间,坚果的PV保持在相对较高水平,表明其脂质氧化程度相对其他两者较高。
2.5 不同状态鲜核桃冷藏期PPO和POD活性的变化
PPO是存在于植物体内与抵抗病原微生物浸染有关的酶。鲜核桃坚果和整仁在贮藏期间的PPO活性呈双峰变化,峰值分别出现在12和54 d,碎仁的PPO活性呈现先降低后升高趋势(图5-a)。贮藏18 d期间,除12 d坚果的活性与整仁之间无显著差异外,其他时间均以坚果的PPO活性显著高于其他两者,碎仁的最低;之后碎仁的PPO活性迅速升高,54 d时达到高峰(46.07 U/mg蛋白质),显著高于坚果(33.36 U/mg蛋白质)和整仁(28.69 U/mg蛋白质)(P<0.05),66 d时三者之间无显著性差异。
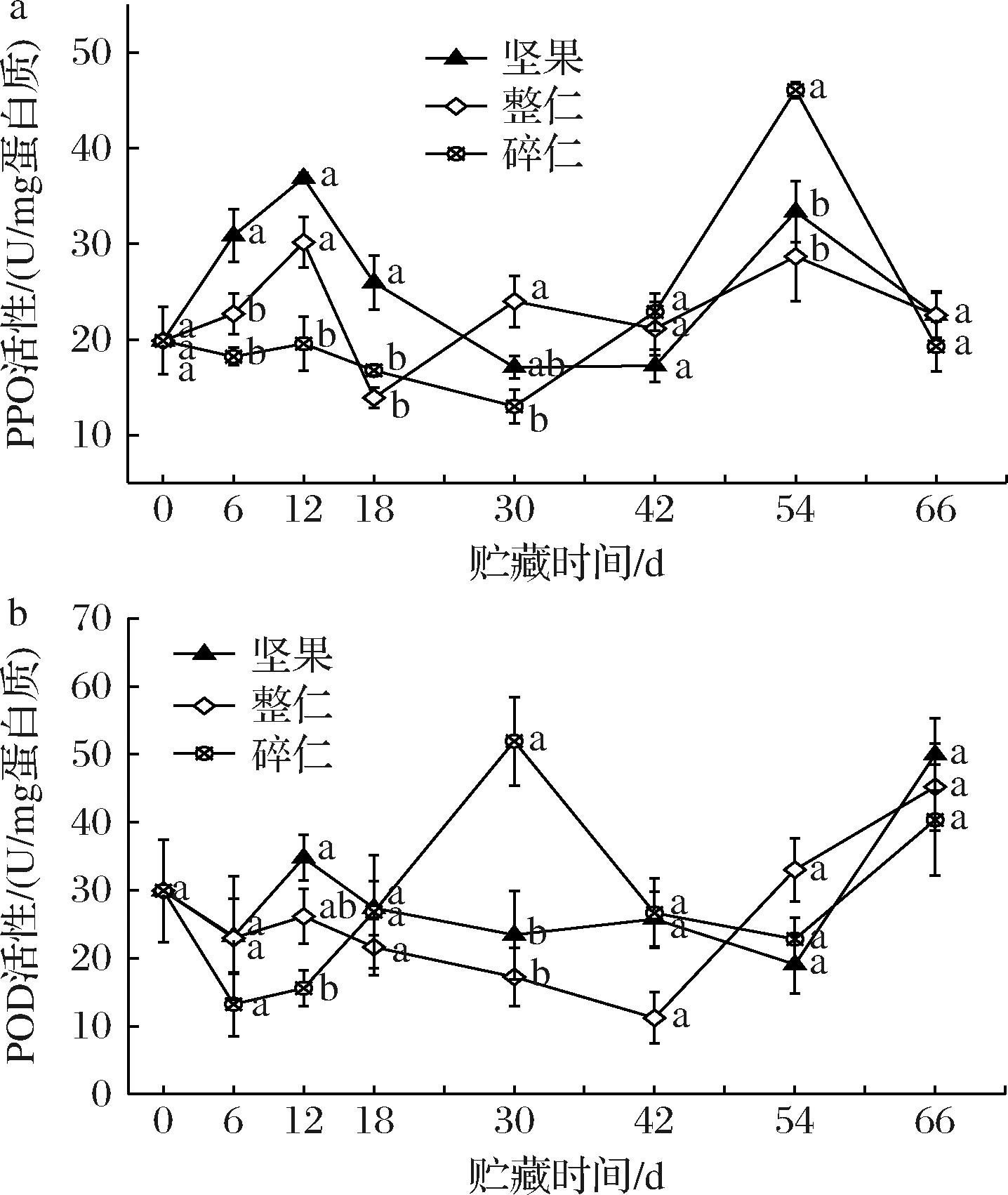
a-PPO;b-POD
图5 不同状态鲜核桃在冷藏期间PPO和POD活性的变化
Fig.5 Changes of PPO and POD activities of different-states fresh walnuts during cold storage
贮藏期间,鲜核桃坚果和整仁的POD活性先降低后升高,但三者的POD活性均呈整体上升趋势(图5-b)。贮藏42 d期间,坚果的POD活性高于整仁,之后后者的POD活性则超过前者;碎仁的POD活性在12 d期间保持最低,之后则迅速升高,至30 d时达到一个活性高峰且此时显著高于其余两种状态(P<0.05),之后3种状态之间无显著性差异。
3 结论与讨论
霉菌易在多孔的鲜核桃外壳生长繁殖造成污染,从而影响其感官品质[17]。高含水率可以促进鲜核桃贮藏过程中的真菌孢子萌发率[14]。本研究发现,‘清香’鲜核桃整仁、碎仁与坚果相比,贮藏时表面发霉指数显著降低,这可能是由于整仁和碎仁核仁暴露,含水率较低而更利于控制其表面霉变。
可溶性蛋白质、可溶性糖和粗脂肪是鲜核桃中的重要营养成分。可溶性蛋白质大多数是植物体内参与代谢的酶类。贮藏期间脂质劣变过程涉及脂质水解、去饱和、氧化等一系列复杂变化,中间需要多种酶类参与催化反应[18]。本研究中,鲜核桃坚果贮藏期间其较高的可溶性蛋白质含量表明,物质代谢较为活跃,同时表明其营养更为丰富。三种状态鲜核桃的粗脂肪含量以碎仁的最高,然后依次为整仁和坚果,碎仁在脱种皮过程中细胞薄膜受损最严重,这可能会增加其出油率,提高粗脂肪含量。有研究表明,榛子仁的粗脂肪含量(62.58%)高于带壳坚果(60.05%)的粗脂肪含量[19]。此外,鲜核桃坚果、整仁的可溶性糖含量均随着贮藏时间的延长而增加,而2种状态的可溶性糖与脂肪含量之间呈显著负相关(R2=-0.47,R2=-0.45,P<0.05),表明其可溶性糖含量的增加是由于脂肪的降解转化所致。然而,碎仁的粗脂肪含量变化极小且与可溶性糖含量无显著相关性,表明不同状态2个指标之间的相关性存在差异。
鲜核桃采后贮藏期间的AV和PV水平反映了脂质的水解和氧化程度,两者的高低反映了其油脂品质的优劣。本研究3种状态鲜核桃贮藏期间,以坚果的AV和PV水平较高,整仁和碎仁的较低,可能是坚果外壳限制了外界O2的进入,而呼吸作用消耗了壳内的O2而形成了超低氧的密闭环境,导致其代谢紊乱。而新陈代谢可以反映氧化应激等生理变化,进而反映了较高的脂质氧化程度[20]。然而,尽管坚果的AV和PV在贮藏过程中分别达到最大值0.23 mg/g和0.04 g/100 g,但仍远低于林业行业标准LY/T 3004.8—2018《核桃 第8部分:核桃坚果质量及检测》中2.0和0.38 g/mg的规定要求。此外,核桃仁的细胞膜是一种很好的保护屏障,含有抗氧化剂[21]。与整仁相比,碎仁贮藏结束时的PV显著高于整仁且呈现上升的趋势,这可能是因为碎仁在剥除种皮的过程中,薄膜受损更严重使得抗氧化剂损失较多,进而脂质氧化加快[22]。
果蔬中PPO活性的增加能够分解酚类物质,降低抗氧化的能力[23-24]。贮藏18 d期间,3个状态中鲜核桃坚果的PPO活性较高,而碎仁PPO活性升高较为缓慢。有研究表明,PPO活性在水分活度低的环境中的催化活性要远低于在完全水合的果实组织中[25]。因此推测,鲜核桃坚果贮藏前期更高的PPO活性,应该是因为其外壳的存在使得壳内形成了一个微气调环境,而呼吸产生的水分更易积聚在壳内的高水分环境所致。此外,碎仁在贮藏30 d期间较低的PPO活性可能导致了PPO底物的积累,进而促进了之后PPO活性的迅速升高[26]。
综合各指标变化表明,鲜核桃坚果、整仁和碎仁贮藏过程中,整仁和碎仁的发霉指数显著较低;脂肪酸组分无显著变化,不饱和脂肪酸含量下降,饱和脂肪酸含量上升;AV和PV均符合林业标准。以碎仁的脂肪平均含量最高,为58.61%,其在贮藏30 d期间PPO活性较低,POD活性显著升高,然而贮藏30 d后其可溶性糖和可溶性蛋白含量却低于坚果和整仁。总体上看,贮藏过程中整仁保持了较好的品质,碎仁油脂品质相对稳定,但因其破碎程度高,营养成分含量损失较多较早失去商品价值,而坚果在保持较高的营养品质方面具有更大潜力。
[1] CHATRABNOUS N, YAZDANI N, TAVALLALI V, et al.Preserving quality of fresh walnuts using plant extracts[J].LWT, 2018, 91:1-7.
[2] 马艳萍, 马惠玲, 刘兴华, 等.鲜食核桃和干核桃贮藏生理及营养品质变化比较[J].食品与发酵工业, 2011, 37(3):235-238.
MA Y P, MA H L, LIU X H, et al.Comparison of physiology and nutrition in dry and fresh walnut during the storage[J].Food and Fermentation Industries, 2011, 37(3):235-238.
[3] CHRISTOPOULOS M V, TSANTILI E.Storage of fresh walnuts (Juglans regia L.)-Low temperature and phenolic compounds[J].Postharvest Biology and Technology, 2012, 73:80-88.
[4] 尚艳姣, 夏永秀, 田世平, 等.鲜食和干食核桃采后低温贮藏过程中抗氧化能力的比较分析[J].保鲜与加工, 2014, 14(1):5-10.
SHANG Y J, XIA Y X, TIAN S P, et al.Comparative analysis of antioxidant capacity in fresh and dry walnut during low temperature storage[J].Storage &Process, 2014, 14(1):5-10.
[5] HU H C, JING N N, PENG Y H, et al.60Coγ-ray irradiation inhibits germination of fresh walnuts by modulating respiratory metabolism and reducing energy status during storage[J].Postharvest Biology and Technology, 2021, 182:111694.
[6] LIU H, LI H Z, YANG G Y, et al.Mechanism of early germination inhibition of fresh walnuts (Juglans regia) with gamma radiation uncovered by transcriptomic profiling of embryos during storage[J].Postharvest Biology and Technology, 2021, 172:111380.
[7] FERREIRA A R V, BANDARRA N M, MOLD O-MARTINS M, et al.FucoPol and chitosan bilayer films for walnut kernels and oil preservation[J].LWT, 2018, 91:34-39.
O-MARTINS M, et al.FucoPol and chitosan bilayer films for walnut kernels and oil preservation[J].LWT, 2018, 91:34-39.
[8] XIAO H M, ZHANG S Q, XI F, et al.Preservation effect of plasma-activated water (PAW) treatment on fresh walnut kernels[J].Innovative Food Science &Emerging Technologies, 2023, 85:103304.
[9] MA Y P, LI P, WATKINS C B, et al.Chlorine dioxide and sodium diacetate treatments in controlled atmospheres retard mold incidence and maintain quality of fresh walnuts during cold storage[J].Postharvest Biology and Technology, 2020, 161:111063.
[10] HABIBI A, YAZDANI N, CHATRABNOUS N, et al.Inhibition of browning via aqueous gel solution of Aloe vera:A new method for preserving fresh fruits as a case study on fresh kernels of Persian walnut[J].Journal of Food Science and Technology, 2022, 59(7):2784-2793.
[11] 陈柏, 颉敏华, 吴小华, 等.不同冷冻温度对‘清香’去青皮鲜核桃冻藏期间品质的影响[J].经济林研究, 2019, 37(3):65-72.
CHEN B, XIE M H, WU X H, et al.Effects of different freezing temperatures on quality of peeled fresh ‘Qingxiang’ walnut during freezing storage[J].Non-wood Forest Research, 2019, 37(3):65-72.
[12] QIAN J Q, ZHAO C Y, ZHU H X, et al.NMR detection of fatty acids content in walnut oil and compared with liquid chromatography[J].Journal of Food Measurement and Characterization, 2021, 15(3):2716-2726.
[13] LI W J, WANG C Z, YE J Z.Decolorizing shellac incorporated with natural antibacterial juglone from walnut green husk extract for preserving the postharvest quality of Wichita pecans (Carya illinoinensis[Wangenh.]K.Koch) during storage[J].Scientia Horticulturae, 2022, 304:111313.
[14] WEI L, FU H, LIN M, et al.Identification of dominant fungal contamination of walnut in NorthWestern China and effects of storage conditions on walnut kernels[J].Scientia Horticulturae, 2020, 264:109141.
[15] MA Y P, LU X G, LIU X H, et al.Effect of 60Coγ-irradiation doses on nutrients and sensory quality of fresh walnuts during storage[J].Postharvest Biology and Technology, 2013, 84:36-42.
[16] RAISI M, GHORBANI M, SADEGHI MAHOONAK A, et al.Effect of storage atmosphere and temperature on the oxidative stability of almond kernels during long term storage[J].Journal of Stored Products Research, 2015, 62:16-21.
[17] AMINI M, GHORANNEVISS M.Effects of cold plasma treatment on antioxidants activity, phenolic contents and shelf life of fresh and dried walnut (Juglans regia L.) cultivars during storage[J].LWT, 2016, 73:178-184.
[18] CAPRIOTTI A L, CERRATO A, AITA S E, et al.Degradation of the polar lipid and fatty acid molecular species in extra virgin olive oil during storage based on shotgun lipidomics[J].Journal of Chromatography A, 2021, 1639:461881.
[19] ALI KOYUNCU M.Change of fat content and fatty acid composition of Turkish hazelnuts (Corylus avellana L.) during storage[J].Journal of Food Quality, 2004, 27(4):304-309.
[20] MATTHEIS J P, FELICETTI D A, RUDELL D R.‘d’Anjou’ pear metabolism during ultra-low O2, low CO2 controlled atmosphere storage reflects disorder outcome[J].Postharvest Biology and Technology, 2022, 185:111781.
[21] KADER A A.Impact of Nut Postharvest Handling, De-Shelling, Drying and Storage on Quality[M].Amsterdam:Elsevier, 2013:22-34.
[22] ORTIZ C M, VICENTE A R, FIELDS R P, et al.Walnut (Juglans regia L.) kernel postharvest deterioration as affected by pellicle integrity, cultivar and oxygen concentration[J].Postharvest Biology and Technology, 2019, 156:110948.
[23] LIU H, LI J M, JIANG Y M, et al.Identification and stability evaluation of polyphenol oxidase substrates of pineapple fruit[J].Food Chemistry, 2024, 430:137021.
[24] SHI J K, XIE W X, LI S N, et al.Prohibitin StPHB3 affects the browning of fresh-cut potatoes via influencing antioxidant capacity and polyphenol oxidase activation[J].Postharvest Biology and Technology, 2024, 207:112598.
[25] KORBEL E, ATTAL E H, GRABULOS J, et al.Impact of temperature and water activity on enzymatic and non-enzymatic reactions in reconstituted dried mango model system[J].European Food Research and Technology, 2013, 237(1):39-46.
[26] ZHANG D D, XU X F, ZHANG Z K, et al.6-Benzylaminopurine improves the quality of harvested Litchi fruit[J].Postharvest Biology and Technology, 2018, 143:137-142.