虫草素(cordycepin,COR),又名3′-脱氧腺苷(3′-deoxyadenosine,3′-dA),是一种核苷类抗生素。早在1950年,CUNNINGHAM等[1]首次从药食同源的蛹虫草(Cordyceps militaris)培养液中分离得到。后续的研究指出虫草素具有抗氧化[2]、调节人体免疫[3]、抗皮肤光老化[4]以及治疗抑郁性睡眠障碍[5-6]等生理活性。基于此,市面上出现了含有虫草素成分的保健品、食品以及护肤品,这增加了市场对虫草素的需求。现如今,已知的产虫草素微生物主要集中在虫草属(Cordyceps Fr)和线虫草属(Ophiocordyceps Petch),以及少部分霉菌中[7]。自然条件下蛹虫草合成虫草素的能力最佳,常用于工业化发酵生产虫草素。然而单纯依靠蛹虫草固体、液体发酵获得虫草素,产量有限,成本高,价格昂贵。随着合成生物学与代谢工程的飞速发展,利用微生物异源高效生产虫草素不失为解决上述问题的又一选择。研究人员以酿酒酵母(Saccharomyces cerevisiae)[8]、大肠杆菌(Escherichia coli)[9]、米曲霉(Aspergillus oryzae)[10]、法夫驹形氏酵母(Komagataella phaffii)[11]以及解脂耶氏酵母(Yarrowia lipolytica)[12]作为异源虫草素生物合成的底盘细胞做了初步探究,发现相比于S. cerevisiae 与E. coli,以Y. lipolytica为代表的非常规酵母无论是在合成虫草素的产量或发酵所需时间成本上都极具优势,有望扩展到工业化生产当中。
然而,在构建生产高附加值化合物重组菌株以及不断提升产量的同时,对成本的控制也尤为重要。本实验室前期探究了利用甘蔗糖蜜、废酵母和磷酸氢二铵为碳氮源代替传统发酵培养基对重组Y. lipolytica合成虫草素的影响,在发酵120 h时虫草素的产量能达到2 286.04 mg/L[13]。在工业生产中,除了控制发酵成本外,降低产品在分离纯化工艺中的损失率也极为重要。目前,报道最多的虫草素分离方法主要有超声波提取法[14]、离子交换树脂法[15]、硅胶柱色谱法[16]、大孔树脂吸附法[17]以及高速逆流色谱[18]等。其中大孔吸附树脂作为一种可再生吸附材料,其吸附量大、解吸条件温和、使用周期长,是目前研究最为广泛的虫草素分离纯化方法[19]。
本研究以实验室前期构建的一株成功合成虫草素的重组Y. lipolytica YL-C19为发酵菌株,按照本实验室已有的发酵条件进行培养,收集甘蔗糖蜜发酵液利用大孔吸附树脂结合静态吸附与解吸附、动态吸附与解吸附对发酵液中的虫草素进行分离纯化,以期为重组Y. lipolytica生产虫草素的下游分离纯化工艺提供数据参考。
1 材料与方法
1.1 实验材料
1.1.1 供试菌株
Y.lipolytica YL-C19, Po1f-ΔKu70, SUC2, URA3, rDNA::FBAp-Cns2-XPR2t, TEFp-Cns1-LIP2t, LEU2, rDNA::TEFp-Cns3 NK-XPR2t, FBAp-ADE4-LIP2t,本实验室保存。
1.1.2 培养基
YNB固体培养基(g/L):YNB 6.7、琼脂20、葡萄糖20。115 ℃高压蒸汽灭菌30 min后倒平板,置于4 ℃冰箱备用。
YPD液体培养基(g/L):胰蛋白胨20、酵母提取物10、无水葡萄糖20。115 ℃高压蒸汽灭菌30 min。
糖蜜发酵培养基(g/L):酵母提取物9,YNB 8,总糖浓度的硫酸水解糖蜜70。115 ℃高压灭菌30 min后备用。
1.1.3 仪器与设备
SHHW21.420AⅡ型三用电热恒温水箱,天津市泰斯特仪器有限公司;层析柱(20 mm×300 mm),建湖县明特玻璃仪器厂;FB-2型恒流泵,上海金达生化仪器有限公司;ZQLY-180 N型恒温振荡培养箱,上海知楚仪器有限公司;LC-20AD型高效液相色谱仪,岛津中国。
1.2 虫草素检测方法
发酵液12 000 r/min离心10 min后取1 mL上清液,经0.22 μm水膜过滤后稀释20倍并转移至液相瓶中,经HPLC检测虫草素的含量。色谱条件:Inertsil ODS-3(4.6 mm×250 mm×5 μm);检测器:紫外;流动相为V(水)∶V(甲醇)=80∶20;流速为0.8 mL/min;波长为260 nm,柱温箱保持恒温30 ℃,进样体积为10 μL。
1.3 实验方法
1.3.1 发酵
a)菌种活化:将-80 ℃保藏的酵母甘油菌在YNB固体平板上进行划线,置于30 ℃培养箱培养2~3 d。
b)种子液培养:挑取a)中的单菌落,在10/50 mL工作体积的YPD液体培养基中,30 ℃、200 r/min培养24 h。
c)发酵培养:将b)中的菌液按20∶1接种量(初始OD600约0.2)转接至50/250 mL工作体积的糖蜜发酵培养基中,28 ℃、200 r/min培养72 h。
1.3.2 静态吸附与解吸附
大孔吸附树脂按使用说明书进行预处理,称取1.0 g置于100 mL锥形瓶,加入离心后的发酵培养基上清液在110 r/min摇床振荡12 h,取上清液经0.22 μm滤膜处理后测定虫草素含量,不同大孔吸附树脂对虫草素的吸附量及吸附率计算如公式(1)所示:
A=(CO-Ce)CO×100
(1)
式中:qe,大孔树脂吸附平衡后吸附虫草素的量,mg/g;CO,吸附初始原液中虫草素的浓度,mg/mL;Ce,吸附平衡时原液中虫草素的浓度,mg/mL;Vi,加入吸附原液的体积,mL;W,大孔树脂干重,g;A,大孔树脂吸附率,%。
将吸附了虫草素的树脂用蒸馏水洗涤3次后,加入25 mL洗脱液,于25 ℃摇床110 r/min振荡12 h解吸附。之后,取上清液,0.22 μm水膜过膜处理,测定虫草素含量,计算大孔树脂对虫草素的解吸附率。大孔树脂对虫草素解吸附量及解吸附率的计算如公式(2)所示:
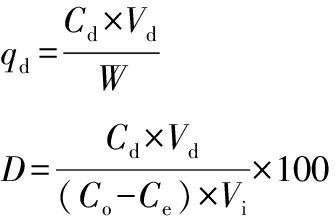
(2)
式中:qd,大孔树脂解吸附平衡后解吸附虫草素的量,mg/g;Cd,解吸附平衡时溶液中虫草素的质量浓度,mg/mL;Vd,加入解吸附溶液的体积,mL;D,大孔树脂解吸附率,%。
1.3.3 动态吸附与解吸附
称取10.0 g已处理好的大孔吸附树脂,以湿法装柱法将其装入20 mm×300 mm规格的层析柱中,探究上样流速与上液量对NKA-Ⅱ的动态吸附影响。检测虫草素浓度并计算出泄漏点(流出液中虫草素浓度达到上样液浓度的10%时,即为泄漏点[20])。
对吸附虫草素的大孔树脂用洗脱剂进行洗脱,探究纯水洗杂速度与体积、洗脱剂速度与体积等因素对NKA-Ⅱ的动态解吸附影响。
2 结果与分析
2.1 大孔吸附树脂分离纯化甘蔗糖蜜发酵液中的虫草素
2.1.1 大孔吸附树脂的筛选
首先,选择了粒径为0.3~1.25 mm的3种不同类型的大孔吸附树脂:ADS-7(孔径:25~30 nm,强极性)、D101(孔径:9~10 nm,非极性)、NKA-Ⅱ(孔径:85~105 nm,非极性)。对不同温度下酸水解甘蔗糖蜜发酵液中的虫草素进行吸附与解吸附实验。结果显示,所设温度变量对大孔吸附树脂的吸附效果影响不大(图1-a)。相较于其他两种类型的大孔吸附树脂,NKA-Ⅱ对虫草素的吸附效果尤为显著,解吸附率可达到97.79%(图1-b)。基于此,选择NKA-Ⅱ在25 ℃(常温)下进行后续的优化试验。
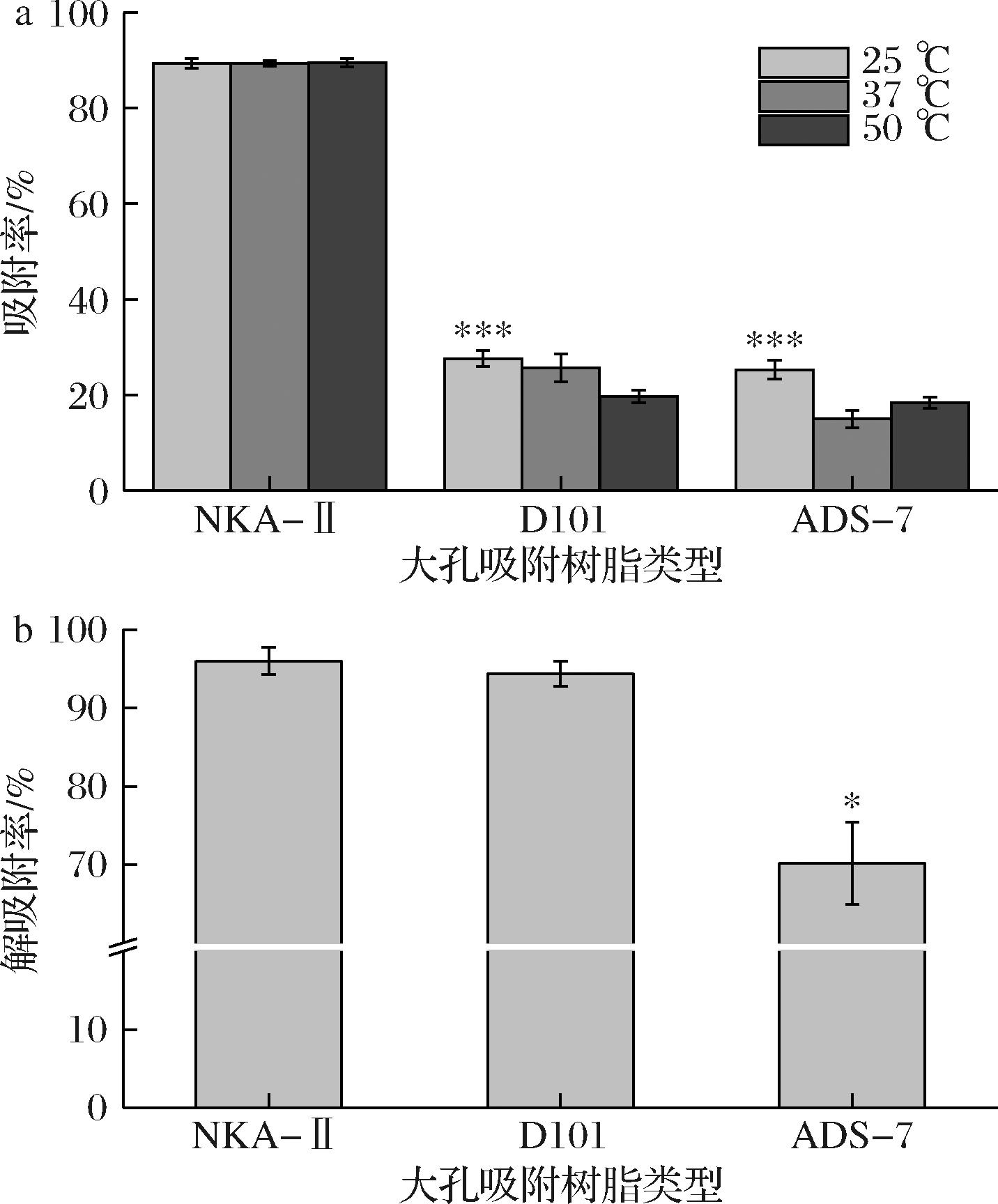
a-吸附;b-解吸附
图1 3种大孔吸附树脂的吸附与解吸附性能
Fig.1 Adsorption and desorption properties of three types of macroporous adsorption resins
注:*表示大孔吸附树脂D101、ADS-7与NKA-Ⅱ之间差异的统计学
显著性,*代表P<0.05,***代表P<0.001(下同)。
2.1.2 NKA-Ⅱ大孔吸附树脂对虫草素的静态吸附与解吸附
如图2-a所示,当上样液pH不同时,NKA-Ⅱ的吸附效果有显著差异。pH值为9.0时,吸附率与吸附量最大,强碱环境下,大孔吸附树脂的吸附效率略有下降。接着对上样液中虫草素质量浓度进行优化,如图2-b所示,随着上样液中虫草素质量浓度的增加,吸附量也随之增大。当虫草素质量浓度为1~3 mg/mL时,吸附率约稳定在94.34%。然而,虫草素质量浓度提升到4~6 mg/mL时,吸附率逐步下降。综合考虑NKA-Ⅱ对上样液中虫草素的吸附量和吸附率,选择了3 mg/mL的上样质量浓度,进行NKA-Ⅱ静态吸附动力学实验。如图2-c所示,1~8 h时,大孔吸附树脂对虫草素的吸附效率稳步提升,直至8 h后达到吸附平衡,饱和值为94.18%。NKA-Ⅱ大孔吸附树脂静态吸附虫草素的最佳吸附时间要控制在8 h之内。
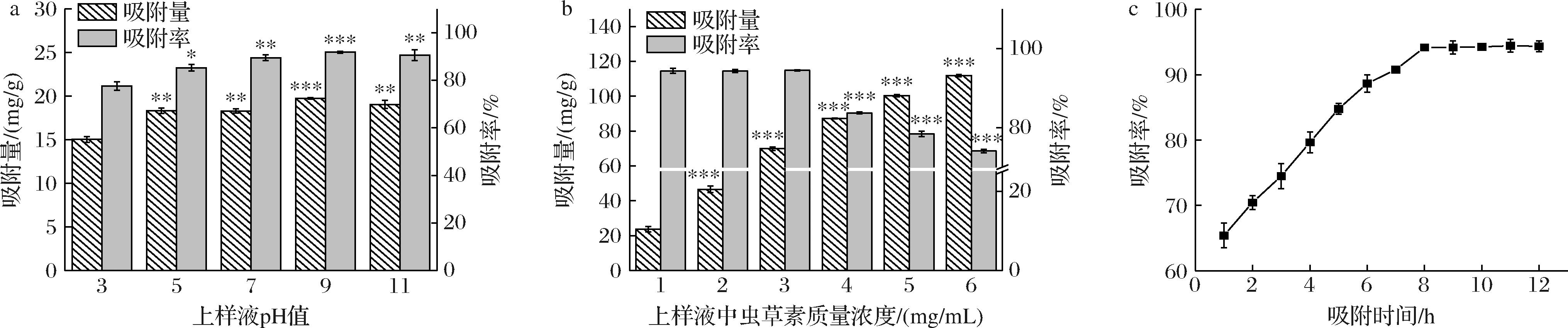
a-上样液pH优化;b-上样液中虫草素质量浓度优化;c-静态吸附曲线
图2 NKA-Ⅱ对虫草素静态吸附条件的优化以及静态吸附动力学曲线
Fig.2 Optimization of static adsorption conditions and static adsorption kinetics curves of cordycepin by NKA-Ⅱ
注:*表示不同试验条件之间差异的统计学显著性,分别以pH值为3和虫草素质量浓度1.0 mg/mL为对照组。
以不同体积分数的乙醇作为洗脱剂进行解吸附。当乙醇体积分数控制在30%时,解吸附量与解吸附率均达到最高,之后不断提高乙醇体积分数,解吸附率与解吸附量趋于不变(图3-a)。此条件下NKA-Ⅱ的静态解吸附动力学曲线如图3-b所示,在1~6 h内静态解吸附率持续增大,6 h时静态解吸附率为93.43%,6 h后达到解吸附平衡。
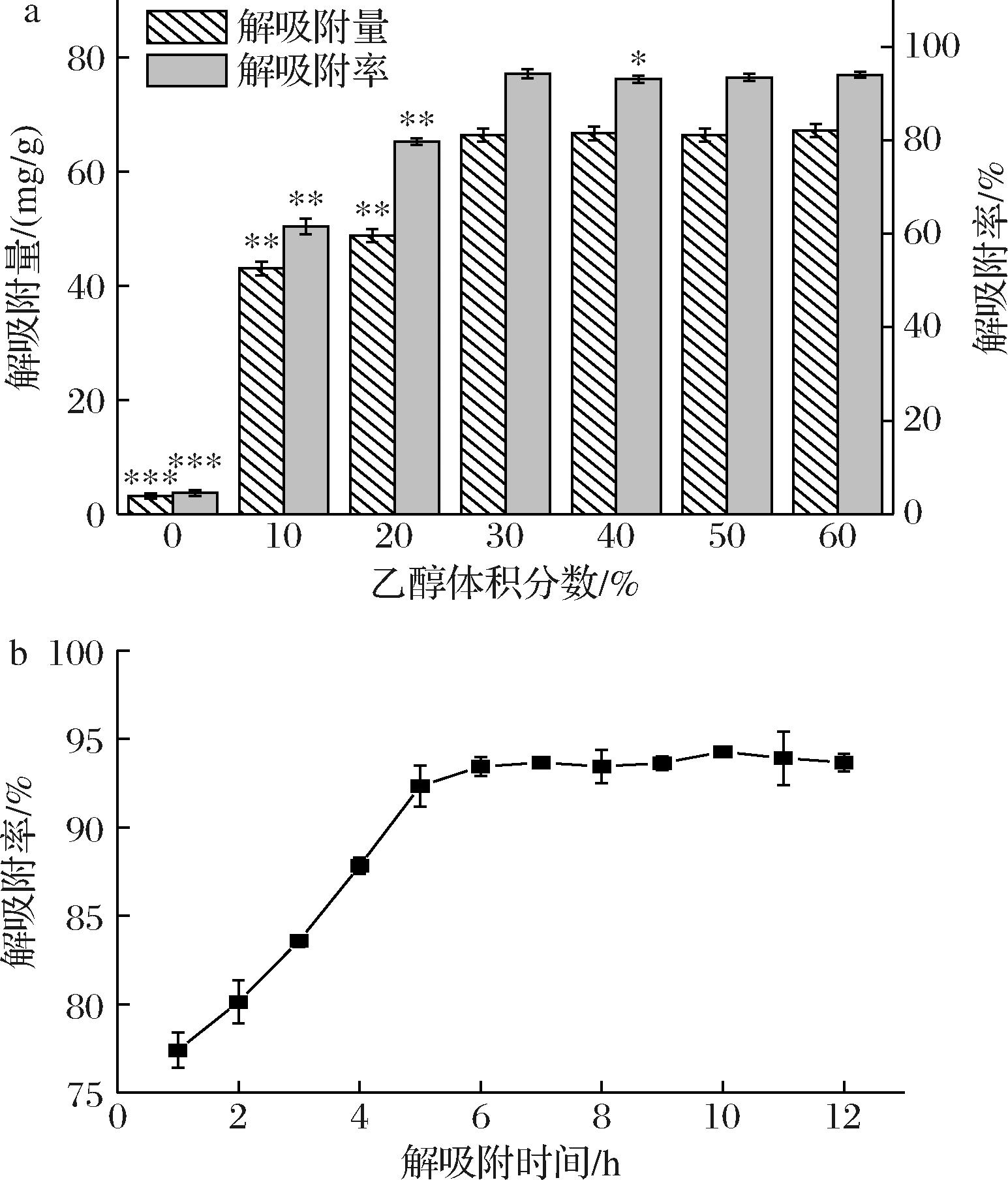
a-洗脱液乙醇体积分数优化;b-静态解吸附曲线
图3 NKA-Ⅱ对虫草素静态解吸附条件的优化及
静态解吸附动力学曲线
Fig.3 Optimization of static desorption conditions and kinetic curves of cordycepin by NKA-Ⅱ
注:*表示乙醇体积分数0~50%与乙醇体积分数60%之间
差异的统计学显著性。
2.1.3 NKA-Ⅱ大孔吸附树脂对虫草素的动态吸附与解吸附
分别以2、3、4 BV/h的流速对同质量浓度(3 mg/mL)且pH值为9.0的同体积(18 BV)甘蔗糖蜜发酵液进行分离纯化。以流出液中虫草素浓度达到上样液浓度的10%为泄漏点,2、3、4 BV/h上样流速对应虫草素的泄漏点分别为15、11、9 BV(图4)。尽管上样速度为2 BV/h时虫草素泄漏点出现最晚,但耗时长、效率太低。因此,最佳上样流速为3 BV/h、最佳上样量为10 BV。
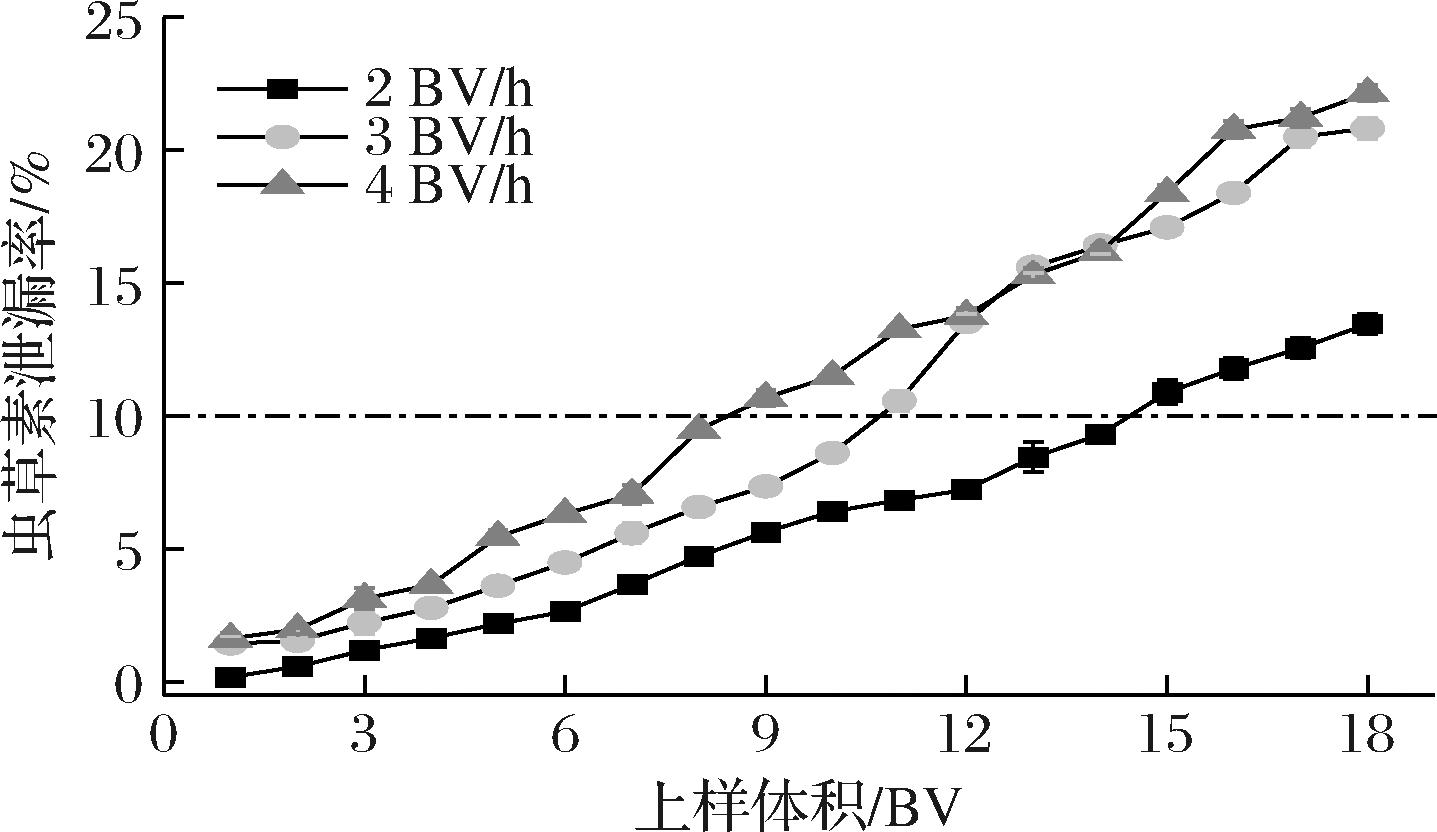
图4 不同上样流速下虫草素的泄漏率
Fig.4 Leakage rate of cordycepin at different loading flow rates
同样,对NKA-Ⅱ大孔树脂进行动态解吸附。由于上样液中存在色素、无机盐、腺苷等多种杂质,为了获得高纯度的虫草素,在解吸附之前需要先洗脱杂质。如图5-a所示,纯水洗脱流速>3 BV/h时,虫草素泄露严重;当洗脱流速为2 BV/h时,3 BV的洗脱体积就可以除去大部分的杂质,且虫草素泄露率仅为1.06%。综合考虑,最佳的纯水洗脱杂质的条件为2 BV/h的流速、3 BV的洗脱体积。
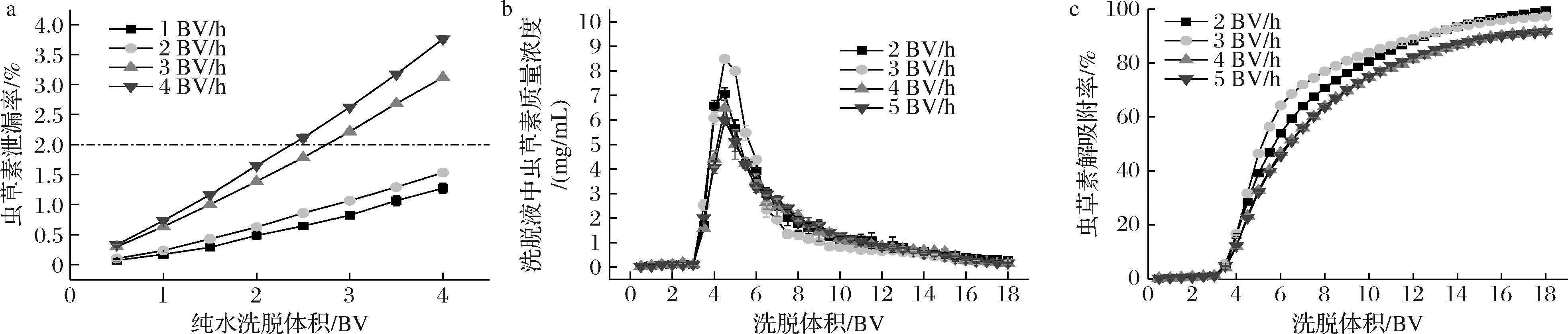
a-不同洗脱速度下纯水洗脱时虫草素的泄露曲线;b-不同洗脱速度下洗脱液中虫草素的质量浓度;c-不同洗脱速度下的解吸附率
图5 NKA-Ⅱ对虫草素动态解吸附条件的优化
Fig.5 Optimization of dynamic desorption conditions for cordycepin by NKA-Ⅱ
纯水洗杂后用体积分数30%的乙醇进行解吸附。当洗脱速度为4 BV/h和5 BV/h,洗脱至18 BV(3BV纯水+15 BV体积分数30%乙醇)时,对虫草素的解吸附率分别为91.80%和91.67%;在3 BV/h的洗脱速度下,峰型窄,峰值最高,对虫草素的解吸附率可以达到97.36%;而当洗脱速度为2 BV/时,虽然虫草素的解吸附率可以达到99.54%,但耗时也是最长的。因此,综合考虑3 BV/h为最佳洗脱速度。
2.2 最佳纯化工艺
将10.0 g经过预处理的NKA-Ⅱ大孔吸附树脂装填至20×300 mm层析柱中,虫草素质量浓度约为3.0 mg/mL、pH值为9.0的甘蔗糖蜜发酵滤液以上柱速度分别为3 BV/h上样10 BV(虫草素总含量约591.93 mg),用纯水2 BV/h洗杂3 BV后,换成体积分数30%乙醇3 BV/h洗脱15 BV,收集洗脱液。将洗脱液冷冻干燥后得到黄棕色粉末。经计算,该工艺对虫草素的回收率为87.67%,虫草素纯度为65.82%,纯化倍数为48.48。
3 结论与讨论
目前市场上的虫草素供应主要是依赖于蛹虫草通过固体发酵体系获得含有虫草素的蛹虫草菌丝体、子实体对其进行粉碎,利用有机溶液从中提取到虫草素;或是液体发酵蛹虫草从培养基中分离纯化得到。大孔树脂吸附法以其操作简便、吸附效率高、化学性质稳定、材料廉价、可回收再利用的优势成为目前工业上应用的最为广泛的虫草素纯化方法。而以Y. lipolytica作为异源合成虫草素的细胞工厂极具开发潜力。基于此,本研究利用大孔吸附树脂对重组Y. lipolytica生产虫草素的下游分离纯化阶段进行了探索。实验表明大孔吸附树脂NKA-Ⅱ纯化发酵液中的虫草素时效果最佳。刘艳芳等[21]比较了6种不同的大孔吸附树脂对虫草素的吸附效果,同样表明NKA-Ⅱ的吸附能力最好。这可能是由于NKA-Ⅱ树脂具有超高比表面积,孔径大,含有疏水性的苯环,能够与虫草素发生疏水作用而导致的。此外,周靖等[22]利用聚苯乙烯聚合物KB-2微球与大孔树脂XDA-8D联用,将虫草素纯度从10.53%提升至66.94%。张虎成等[23]在利用大孔吸附树脂将发酵液中的虫草素纯化至40%后,又采用十八烷基键合硅胶色谱二次纯化将虫草素纯化提至90%。而本研究利用大孔吸附树脂NKA-Ⅱ有效的将重组Y. lipolytica YL-C19甘蔗糖蜜发酵液中的虫草素纯度从1.33%提升至65.82%,该方法操作简单,获得的虫草素纯度较高,这将为今后利用重组Y. lipolytica生产制备高纯度虫草素提供研究思路。
[1] CUNNINGHAM K G, MANSON W, SPRING F S, et al.Cordycepin, a metabolic product isolated from cultures of Cordyceps militaris (Linn.) Link[J].Nature, 1950, 166(4231):949.
[2] EIAMTHAWORN K, KAEWKOD T, BOVONSOMBUT S, et al.Efficacy of Cordyceps militaris extracts against some skin pathogenic bacteria and antioxidant activity[J].Journal of Fungi, 2022, 8(4):327.
[3] DAS G, SHIN H S, LEYVA-G MEZ G, et al.Cordyceps spp.:A review on its immune-stimulatory and other biological potentials[J].Frontiers in Pharmacology, 2021, 11:602364.
MEZ G, et al.Cordyceps spp.:A review on its immune-stimulatory and other biological potentials[J].Frontiers in Pharmacology, 2021, 11:602364.
[4] KUNHORM P, CHAICHAROENAUDOMRUNG N, NOISA P.Enrichment of cordycepin for cosmeceutical applications:Culture systems and strategies[J].Applied Microbiology and Biotechnology, 2019, 103(4):1681-1691.
[5] ZHANG T Z, YANG S H, DU J.Antidepressant-like effects of cordycepin in a mice model of chronic unpredictable mild stress[J].Evidence-Based Complementary and Alternative Medicine, 2014, 2014(1):438506.
[6] FENG L, CHEN X, ZHANG X L, et al.Cordyceps sinensis combined with duloxetine improves sleep symptoms in patients with depression:A randomized, double-blind, placebo-controlled study[J].Asia Pacific Journal of Clinical Trials:Nervous System Diseases, 2018, 3(4):136.
[7] SUNG G H, HYWEL-JONES N L, SUNG J M, et al.Phylogenetic classification of Cordyceps and the clavicipitaceous fungi[J].Studies in Mycology, 2007, 57:5-59.
[8] 刘文静. 虫草素生物合成关键酶基因克隆与分析[D].大连:大连工业大学, 2018.
LIU W J.Cloning and analysis of key enzyme genes of cordycepin biosynthesis[D].Dalian:Dalian Polytechnic University, 2018.
[9] XIA Y L, LUO F F, SHANG Y F, et al.Fungal cordycepin biosynthesis is coupled with the production of the safeguard molecule pentostatin[J].Cell Chemical Biology, 2017, 24(12):1479-1489.
[10] JEENNOR S, ANANTAYANON J, PANCHANAWAPORN S, et al.Efficient de novo production of bioactive cordycepin by Aspergillus oryzae using a food-grade expression platform[J].Microbial Cell Factories, 2023, 22(1):253.
[11] TAN H P, WANG L, WANG H G, et al.Engineering Komagataella phaffii to biosynthesize cordycepin from methanol which drives global metabolic alterations at the transcription level[J].Synthetic and Systems Biotechnology, 2023, 8(2):242-252.
[12] DUAN X Y, TIAN Y, SONG Z Q, et al.High-level de novo biosynthesis of cordycepin by systems metabolic engineering in Yarrowia lipolytica[J].Bioresource Technology, 2022, 363:127862.
[13] DUAN X Y, LIU H H, SONG L P, et al.Efficient production of cordycepin by engineered Yarrowia lipolytica from agro-industrial residues[J].Bioresource Technology, 2023, 377:128964.
[14] WANG H J, PAN M C, CHANG C K, et al.Optimization of ultrasonic-assisted extraction of cordycepin from Cordyceps militaris using orthogonal experimental design[J].Molecules, 2014, 19(12):20808-20820.
[15] 毛宁, 张丽艳, 张凤梅, 等.离子交换树脂分离纯化虫草素的工艺条件研究[J].药物生物技术, 2010, 17(5):400-403.
MAO N, ZHANG L Y, ZHANG F M, et al.Study on the technical parameters for extracting and purifying cordycepin with ion exchange resin[J].Pharmaceutical Biotechnology, 2010, 17(5):400-403.
[16] 张莉莉, 梁国强, 陈伟.大孔树脂联用硅胶柱色谱法富集制备人工蛹虫草中虫草素的工艺研究[J].现代医药卫生, 2015, 31(3):343-345.
ZHANG L L, LIANG G Q, CHEN W.Macroporous resin combined silicagel column in preparation of cordycepin in the made-up Cordyceps militaris[J].Journal of Modern Medicine &Health, 2015, 31(3):343-345.
[17] 周精卫, 王松涛, 沈才洪, 等.吸附树脂分离蛹虫草发酵液中虫草素[J].生物加工过程, 2021, 19(3):274-279;305.
ZHOU J W, WANG S T, SHEN C H, et al.Separation of cordycepin from fermentation broth by adsorption resins[J].Chinese Journal of Bioprocess Engineering, 2021, 19(3):274-279;305.
[18] 张忠, 周帅, 刘艳芳, 等.高速逆流色谱分离制备蛹虫草中虫草素和N6-(2-羟乙基)-腺苷[J].菌物学报, 2016, 35(6):742-749.
ZHANG Z, ZHOU S, LIU Y F, et al.Isolation and purification of cordycepin and N6-(2-hydroxyethyl)-adenosine from Cordyceps militaris fruit bodies by high speed counter-current chromatography[J].Mycosystema, 2016, 35(6):742-749.
[19] 周啟林, 孙永健.虫草素的分离纯化研究进展[J].食用菌, 2020, 42(4):9-12.
ZHOU Q L, SUN Y J.Research progress on isolation and purification of cordycepin[J].Edible Fungi, 2020, 42(4):9-12.
[20] LIU W, ZHANG S, ZU Y G, et al.Preliminary enrichment and separation of genistein and apigenin from extracts of pigeon pea roots by macroporous resins[J].Bioresource Technology, 2010, 101(12):4667-4675.
[21] 刘艳芳, 唐庆九, 杨焱, 等.大孔树脂分离纯化发酵液中虫草素的研究[J].食品与生物技术学报, 2011, 30(4):627-631.
LIU Y F, TANG Q J, YANG Y, et al.Studies on purification of cordycepin from fermented broth by macroporous resin[J].Journal of Food Science and Biotechnology, 2011, 30(4):627-631.
[22] 周靖, 吐尔尼散·吐地, 张忠, 等.大孔吸附树脂联用KB-2微球柱层析法分离纯化虫草素的工艺优化[J].食用菌学报, 2019, 26(2):65-71.
ZHOU J, TUDI TUERNISAN, ZHANG Z, et al.Process optimization for the separation and purification of cordycepin by KB-2 microsphere column chromatography coupled with macroporous adsorbent resin[J].Acta Edulis Fungi, 2019, 26(2):65-71.
[23] 张虎成, 范海涛, 王晓杰, 等.大孔吸附树脂AB-8和十八烷基硅胶色谱分离纯化蛹虫草发酵液中虫草素工艺研究[J].菌物学报, 2015, 34(3):490-498.
ZHANG H C, FAN H T, WANG X J, et al.Purification of cordycepin from fermentation broth of Cordyceps militaris by use of macroporous resin AB-8 and octadecyl bonded silica chromatography[J].Mycosystema, 2015, 34(3):490-498.