桑椹是一种“药食同源”植物,具有很高的营养和药用价值[1]。成熟桑椹富含维生素、氨基酸、矿物质等多种营养物质以及花色苷、多糖等功能性成分,具有消炎、降血糖、解酒抑菌、抗肿瘤、增强免疫力等药理功效[2]。其中,桑椹果实中富含花色苷,对人体健康有益,因此具有较高的食用与开发价值。花色苷是花青素和糖以糖苷键的形式结合成的水溶性类黄酮化合物,具有广泛的生物活性,如抗氧化、降血糖、降血脂、预防癌变、改善视觉功能、抗肿瘤及保护心脑血管等功能[3]。然而,花色苷易受到外界因素(温度、酶、金属离子、光照)的影响,且其自身结构稳定性差,易降解,从而导致其抗氧化活性和生物利用受到一定限制[4]。
脂质体是由磷脂等两亲性物质自组装形成的具有类细胞膜结构的囊泡,可携带疏水和亲水化合物,具有良好的生物安全性、生物相容性和提高药物稳定性等优势[5]。利用脂质体作为载体包埋桑椹花色苷,通过脂质体的缓释效果,能有效延缓花色苷的释放,提高桑椹花色苷的稳定性。在制备脂质体的过程中通常会添加一定比例的胆固醇来改善膜的流动性,以提高脂质体双分子层的通透性和稳定性[6]。但胆固醇过多摄入易引起动脉粥样硬化等疾病,这可能会限制脂质体在食品和医药领域中的进一步应用[7]。
植物甾醇又被称为植物固醇,是一类结构与胆固醇类似的三萜烯类天然活性物质[8]。植物甾醇具有抗氧化、清除自由基、抗癌、抗炎等生理功能。植物甾醇可以调节膜的通透性,以及降低胆固醇水平,影响胆固醇在人体内的代谢,避免胆固醇摄入的负面影响[9]。利用植物甾醇代替胆固醇构建脂质体来实现药物的递送具有重要意义。现有研究表明,植物甾醇可调节脂质体双分子膜的结构性能和稳定性。邓莉梅等[10]发现,β-谷甾醇和豆甾醇可通过减小脂质体膜的流动性、疏水性和微极性使得脂质体膜的结构更致密。黎雨浩等[11]研究发现,火龙果茎植物甾醇制备的姜黄素脂质体具有更高的缓释特性和理化稳定性。近年来对植物甾醇的研究主要集中在其对脂质体膜结构(流动性、疏水性、微极性)的影响及对药物的控释上,但其对药物活性影响的研究较少。
因此,为提高桑椹花色苷脂质体中花色苷的稳定性、生物利用率及抗氧化活性,本试验制备了含不同植物甾醇类型和浓度的植物甾醇桑椹花色苷脂质体,分析其包封率、粒径、电位、微观结构等理化性质,并对其pH稳定性和体外抗氧化活性进行评价,旨在为制备稳定的负载生物活性物质的植物甾醇修饰脂质体以及开发无胆固醇脂质体提供理论和实践基础。
1 材料与方法
1.1 材料与试剂
桑椹干,广东省广州市;AB-8大孔树脂,郑州和成新材料科技有限公司;大豆卵磷脂(含磷脂酰胆碱≥90%)、植物甾醇(β-谷甾醇、菜油甾醇、豆甾醇、菜籽甾醇)、DPPH、ABTS,上海源叶生物科技有限公司;β-谷甾醇,合肥千盛生物科技;2,2′-偶氮二(2-甲基丙基咪)二盐酸盐(2,2′-azobis (2-methylpropionamidine) dihydrochloride,AAPH),上海麦克林生化科技股份有限公司;荧光素钠,上海阿拉丁生化科技股份有限公司;维生素E衍生物(Trolox),美国Sigma公司;无水乙醇、NaOH、K2S2O8、KH2PO4、K2HPO4,国产分析纯,天津大茂化学试剂公司;盐酸,国药集团化学试剂有限公司。
1.2 仪器与设备
FSJ-A03E1粉碎机,小熊电器股份有限公司;GJJ1000型电子天平,常熟市双杰测试仪器厂;DL-800B智能超声波清洗器,上海之信仪器有限公司;PB-10 pH计,梅特勒-托利多仪器(上海)有限公司;JW-1042离心机,安徽嘉文仪器装备有限公司;D3024R台式高速冷冻离心机,美国赛洛捷克SCILOGEX公司;FDU-2110型冷冻干燥机,上海爱朗仪器有限公司;EYELAN-1100旋转蒸发仪,东京理化器械株式会社;JY88-Ⅱ型超声波细胞粉碎机,宁波新芝生物科技股份有限公司;Infinite M200pro型酶标仪,奥地利TECAN公司;HH-2型数显恒温水浴锅,常州金坛精达仪器制造有限公司;Malvern Zetasizer Nano ZSP纳米粒度仪,英国Malvern仪器有限公司;日立HT7700透射电子显微镜,日立高新技术公司。
1.3 实验方法
1.3.1 桑椹花色苷的提取纯化
桑椹干在室温(25 ℃)避光条件下充分研磨。将100 g桑椹干粉末加入2 000 mL酸性乙醇溶液(0.1%盐酸和95%乙醇溶液(均为体积分数)的体积比为4∶6)中,使用超声波清洗仪在功率为150 W,温度30 ℃的条件下超声120 min得到桑椹提取液。将桑椹提取液在温度4 ℃,8 000 r/min下离心10 min,收集上清液并过滤清除悬浮颗粒,滤液用旋转蒸发仪在40 ℃下浓缩,得到桑椹花色苷浓缩提取物[12]。
收集到的桑椹花色苷提取物浓缩液被吸附到25 mm×100 mm AB-8大孔树脂上,静置30 min。用HCl溶液(pH值为3)洗涤色谱柱,去除糖和极性成分,再用体积分数20%、40%和60%乙醇洗脱色谱柱。将这些乙醇洗脱液混合并浓缩,最后将水相冻干并标记为ACN(即非包封形式)。4 ℃保存,用于脂质体包封实验[13]。
1.3.2 植物甾醇桑椹花色苷脂质体的制备
参照郭嘉斌等[14]的方法并稍做修改,采用薄膜分散-超声法制备甾醇桑椹花色苷脂质体。取0.1 g大豆卵磷脂,10 mg花色苷,分别加入磷脂质量0%、5%、15%、26%的甾醇(胆固醇、β-谷甾醇、植物混合甾醇),溶于10 mL 95%乙醇溶液中,40 ℃、40 r/min旋转蒸发至瓶内壁形成一层薄膜,用10 mL超纯水水合30 min。然后用细胞破碎仪冰水浴超声波3 min,超声波功率为150 W,工作5 s,停5 s,用0.22 μm的滤膜过滤,4 ℃保存。将胆固醇桑椹花色苷脂质体、β-谷甾醇桑椹花色苷脂质体、植物混合甾醇桑椹花色苷脂质体分别记为CLP(5CLP、15CLP、26CLP)、BLP(5BLP、15BLP、26BLP)、SLP(5SLP、15SLP、26SLP),未添加甾醇的桑椹花色苷脂质体记为0LP。
1.3.3 包封率的测定
1.3.3.1 花色苷吸收度及标准曲线的确定
称取桑椹花色苷冻干样品溶解于蒸馏水中,逐级稀释成不同浓度的花色苷溶液,扫描不同浓度花色苷溶液在200~900 nm波长范围内的吸收度,确定花色苷的最大吸收波长;用pH示差法分别测定花色苷的含量,且测定其在最大吸收波长处(521 nm)的吸光值。以桑椹花色苷溶液的质量浓度(mg/mL)为横坐标,521 nm下的吸光值为纵坐标建立标准曲线,得到回归方程为y=116.82x+0.0421,R2=0.999 8。由此可知,桑椹花色苷溶液于521 nm波长处的吸光值线性关系良好,可用于本实验样品中花色苷浓度的测定[15]。
1.3.3.2 包封率的测定
取0.5 mL花色苷脂质体于离心管中,加入两倍体积的超纯水,在4 ℃、12 000 r/min条件下离心30 min,取上清液,于521 nm处测定吸光值,代入回归方程,算出游离花色苷的浓度(C1)。另取0.5 mL花色苷脂质体于离心管中,加入两倍体积的乙醇,超声波15 min,在4 ℃、12 000 r/min条件下离心30 min,取上清液,于521 nm处测定吸光值,代入回归方程,算出总花色苷的浓度(C2)[16]。包封率的计算如公式(1)所示:
包封率![]()
(1)
式中:C1,游离花色苷质量浓度,ng/mL;C2,总花色苷质量浓度,ng/mL。
1.3.4 粒径、多分散系数测定
脂质体样品用超纯水稀释15倍,采用Zetasizer Nano ZSP测定平均粒径、多分散系数(polydispersity index,PDI)以及zeta电位。样品测定前于25 ℃下平衡120 s,每个样品重复测定3次[17]。
1.3.5 透射电子显微镜测定
将脂质体用超纯水稀释10倍,滴在铜网上,自然风干后,采用2%的磷钨酸染液进行染色,待铜网室温干燥后,置于透射电镜中观察脂质体形态[18]。
1.3.6 pH稳定性
脂质体溶液的pH值分别用0.1 mol/L HCl溶液或0.1 mol/L NaOH溶液调节至2.0、4.0、6.0、8.0、10.0,测定花色苷保留率,每组3个平行实验[19]。
1.3.7 DPPH自由基清除能力的测定
DPPH自由基清除能力的测定参考BARRECA等[20]的方法,结果以Trolox当量(mmol TE/mL)表示。
1.3.8 ABTS阳离子自由基清除能力的测定
ABTS阳离子自由基清除能力参考鞠葛金悦等[21]的方法进行测定,结果以Trolox当量(mmol TE/mL)表示。
1.3.9 氧自由基吸收能力的测定
氧自由基吸收能力(oxygen radical absorbance capacity,ORAC)参照邹波等[22]的方法进行测定。荧光测定条件:激发波长485 nm;发射波长520 nm,循环35次,每个循环2.5 min。以Trolox为标准品,样品的ORAC值以Trolox当量(mmol TE/mL)表示。
1.4 数据分析
试验数据用“平均值±标准差”表示,应用SPSS 26.0进行数据分析,以P<0.05表示差异有统计学意义。
2 结果与分析
2.1 甾醇种类及浓度对桑椹花色苷脂质包封率及物理特性体的影响
由表1可知,甾醇种类及浓度对桑椹花色苷脂质体的包封率有一定的影响。胆固醇与植物甾醇的加入能提高脂质体的包封率,当加入15%的甾醇时能得到具有较高包封率的桑椹花色苷脂质体。15CLP、15BLP、15SLP的包封率分别为50.79%、47.29%和49.58%,说明添加适宜浓度的植物甾醇也可以得到较高包封率的桑椹花色苷脂质体。甾醇的加入能够增加脂质体膜的刚性,含有26%甾醇的桑椹花色苷脂质体的包封率较低,可能是因为膜刚性太强,无法形成稳定的囊泡,从而导致花色苷泄露。如果从包封率来看,适宜浓度的植物甾醇能替代胆固醇制备包封率较高的脂质体。
表1 不同甾醇桑椹花色苷脂质体的包封率、粒径、zeta电位以及PDI的变化
Table 1 Changes of encapsulation rate, particle size, zeta potential, and PDI of different sterol mulberry anthocyanin liposomes
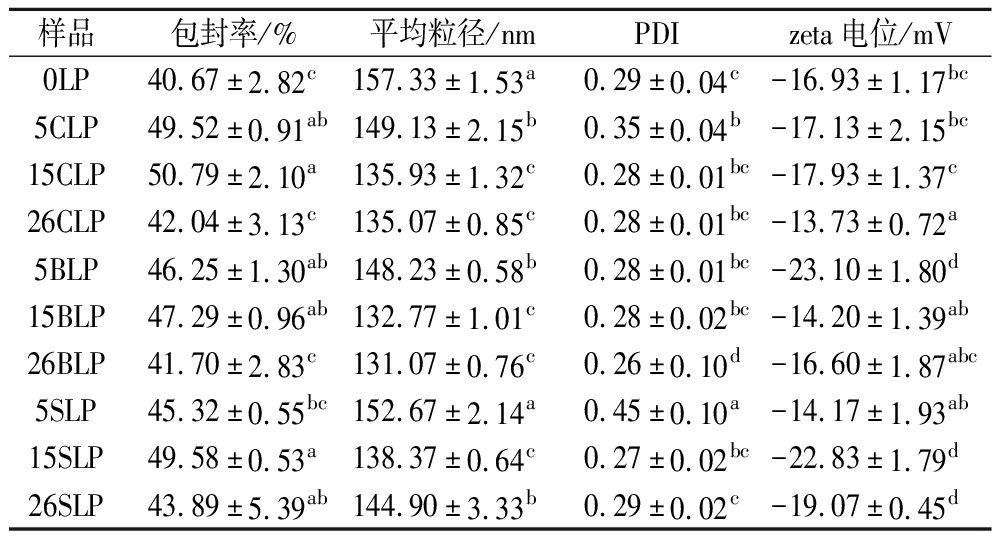
样品包封率/%平均粒径/nmPDIzeta电位/mV0LP40.67±2.82c157.33±1.53a0.29±0.04c-16.93±1.17bc5CLP49.52±0.91ab149.13±2.15b0.35±0.04b-17.13±2.15bc15CLP50.79±2.10a135.93±1.32c0.28±0.01bc-17.93±1.37c26CLP42.04±3.13c135.07±0.85c0.28±0.01bc-13.73±0.72a5BLP46.25±1.30ab148.23±0.58b0.28±0.01bc-23.10±1.80d15BLP47.29±0.96ab132.77±1.01c0.28±0.02bc-14.20±1.39ab26BLP41.70±2.83c131.07±0.76c0.26±0.10d-16.60±1.87abc5SLP45.32±0.55bc152.67±2.14a0.45±0.10a-14.17±1.93ab15SLP49.58±0.53a138.37±0.64c0.27±0.02bc-22.83±1.79d26SLP43.89±5.39ab144.90±3.33b0.29±0.02c-19.07±0.45d
注:不同小写字母代表差异显著,P<0.05。
桑椹花色苷脂质体粒径均在纳米级范围,与没有添加甾醇的脂质体(0LP)相比,脂质体中添加甾醇能减小桑椹花色苷脂质体的平均粒径,这可能是由于甾醇加入后,在探头超声过程中形成的膜结构更加紧密,说明甾醇能提高膜的弯曲性能。DECKER等[23]发现,粒径较小的脂质体的脂质双分子层具有更强的弯曲性能,甾醇、助表面活性剂等物质的添加会影响脂质双分子层对弯曲变形的抵抗。TAI等[24]研究不同含量的β-谷甾醇对脂质体粒径的影响时,发现添加了β-谷甾醇的脂质体粒径均明显小于未添加甾醇的脂质体,且β-谷甾醇浓度对脂质体粒径的影响不大,这与本实验结果一致。添加了5%(质量分数,下同)的β-谷甾醇或植物混合甾醇的脂质体粒径与添加了5%胆固醇脂质体类似,均有最大的粒径分布。
甾醇的加入对脂质体的PDI的影响不显著,β-谷甾醇的浓度对脂质体的PDI影响不显著,BLPs的PDI值为0.28,与0LP、15CLP、26CLP的PDI结果相似,而当胆固醇或植物混合甾醇的浓度为5%时,PDI值较大,分散性较差。合适甾醇浓度可以增加zeta电位值,5BLP、15SLP的电位值分别为-23.1 mV和-22.83 mV,比0LP和CLP的电位值高,说明适宜浓度的β-谷甾醇和植物混合甾醇的加入可以增强脂质体间的双电层作用和脂质体胶体稳定性。
2.2 甾醇种类及浓度对桑椹花色苷脂质体微观结构的影响
通过透射电子显微镜(transmission electron microscope,TEM)观察了0LP与CLP、BLP和SLP的形貌(图1)。与传统胆固醇脂质体CLPs相似,BLPs和SLPs几乎呈椭圆或球状分布,具有囊泡结构,而在不添加胆固醇或植物甾醇的情况下,0LP囊泡尺寸分布显著增大,并且可明显看到囊泡融合。0LP存在较大的囊泡可能是由于膜具有高流动性,导致了膜融合,说明胆固醇和植物甾醇的加入可以一定程度上调节膜的流动性,促进稳定的囊泡的形成。综上,植物甾醇可以像胆固醇一样作为一种膜稳定剂加入脂质体的形成中。

a-0LP;b-CLPs;c-BLPs;d-SLPs
图1 不同甾醇桑椹花色苷脂质体透射电镜图
Fig.1 The TEM images of different sterol mulberry anthocyanin liposomes
2.3 甾醇种类及浓度对桑椹花色苷脂质体pH稳定性的影响
作为包埋载体,脂质体在应用时都会不可避免的面临不同的pH条件,不论是在体外加工应用(如食品、药品加工中)还是体内胃肠道消化吸收过程中,继而影响对包埋物的保护效果,因此探究脂质体在不同pH条件下的稳定性十分重要。从图2可以看到,ACN在碱性条件下较不稳定,pH 10.0时ACN的花色苷保留率只有87.34%;而BLPs、SLPs与CLPs相似,比未经包埋的花色苷更耐pH变化的影响,在酸碱条件下都相对稳定,花色苷保留率均>90%。这说明甾醇的存在可能使得脂质体的膜结构变得更加稳定,能提高桑椹花色苷的pH稳定性。
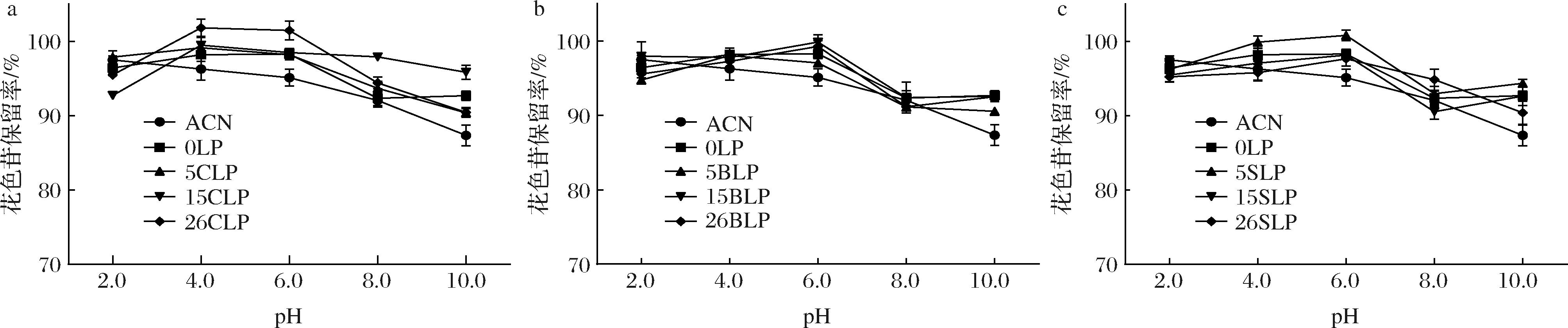
a-CLPs;b-BLPs;c-SLPs
图2 pH对不同甾醇桑椹花色苷脂质体的稳定性影响
Fig.2 Effect of pH on the different sterol mulberry anthocyanin liposomes
2.4 甾醇种类及浓度对桑椹花色苷脂质体抗氧化活性的影响
2.4.1 DPPH自由基清除能力
由图3可知,CLPs(图3-a)贮藏前的DPPH自由基清除能力范围为19.07~22.72 mmol TE/mL,贮藏7 d后变化为24.51~26.30 mmol TE/mL,均比ACN和0LP的DPPH自由基清除能力强,但胆固醇的浓度对脂质体的DPPH自由基清除能力影响不显著。与传统胆固醇脂质体CLPs相似,贮藏7 d后,在ACN的DPPH自由基清除能力下降时;BLPs(图3-b)的DPPH自由基清除能力有所提高,虽然BLPs的DPPH自由基清除能力稍微弱于CLPs,但可以看到,5CLP、26CLP经贮藏后DPPH自由基清除能力分别提高了13.42%、15.46%,而5BLP、26BLP经贮藏后其DPPH自由基清除能力分别提高了19.47%、24.81%。SLPs(图3-c)中只有低浓度植物混合甾醇脂质体5SLP的DPPH自由基清除能力经贮藏后提高了(17.92%)。说明,与胆固醇相似,添加适宜浓度的植物甾醇可以一定程度上提高桑椹花色苷的稳定性,延长其DPPH自由基清除能力,可用于替代胆固醇参与到脂质体膜的形成中,从而制备得到稳定的无胆固醇脂质体。

a-CLPs;b-BLPs;c-SLPs
图3 不同甾醇桑椹花色苷脂质体的DPPH自由基清除能力
Fig.3 DPPH scavenging capacity of different sterol mulberry anthocyanin liposomes
注:不同小写字母代表贮藏前各组差异显著,不同大写字母代表贮藏后各组差异显著,P<0.05(下同)。
2.4.2 ABTS阳离子自由基清除能力
从图4可以看到,CLPs(图4-a)贮藏前的ABTS阳离子自由基清除能力显著低于ACN的ABTS阳离子自由基清除能力,经贮藏后的ABTS阳离子自由基清除能力略低于ACN的,而与0LP的ABTS阳离子自由基清除能力无显著差异;但不同浓度CLPs的ABTS阳离子自由基自由基清除能力分别提高了26.49%、42.48%、48.78%,均比ACN贮藏后ABTS阳离子自由基清除能力提高率(20.60%)高;BLPs(图4-b)贮藏前后的ABTS阳离子自由基范围分别为53.80~88.21 mmol TE/mL和67.54~92.06 mmol TE/mL;SLPs(图4-c)贮藏前后的ABTS阳离子自由基清除能力范围分别为65.78~83.80 mmol TE/mL和63.53~82.33 mmol TE/mL,BLPs、SLPs经贮藏后的ABTS阳离子自由基清除能力变化不大。图4的结果显示,桑椹花色苷脂质体的ABTS阳离子自由基清除能力低于ACN。
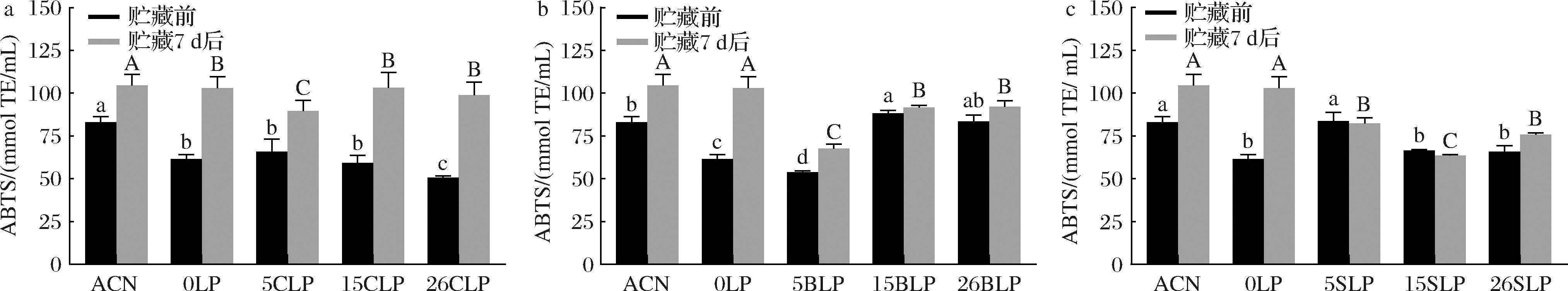
a-CLPs;b-BLPs;c-SLPs
图4 不同甾醇桑椹花色苷脂质体的ABTS阳离子自由基清除能力
Fig.4 ABTS scavenging capacity of different sterol mulberry anthocyanin liposomes
图4的结果显示,桑椹花色苷脂质体的ABTS阳离子自由基清除能力并没有得到提高。DPPH自由基和ABTS阳离子自由基清除能力之间分析的结果不同,可能是由于2种方法中使用的自由基不同,因为ABTS阳离子自由基是水溶性阳离子自由基,该方法比较适用于测试水溶性成分的抗氧化剂活性[25]。ACN是水溶性化合物,而ACN脂质体是脂溶性物质,所以游离ACN表现出更强的ABTS阳离子自由基清除能力。贮藏前,0LP、CLPs的ABTS阳离子自由基清除能力均低于ACN,经贮藏7 d后的ABTS阳离子自由基清除能力均有所提高,且与贮藏后与ACN的ABTS阳离子自由基清除能力差不多,说明只含卵磷脂或添加了胆固醇制备的脂质体不稳定,经贮藏后桑椹花色苷泄露到外相水系中,从而使其ABTS阳离子自由基清除能力提高。BLPs和SLPs贮藏前后的ABTS阳离子自由基清除能力变化不大,所以从另一方面来说,β-谷甾醇和植物混合甾醇的添加使得脂质体更稳定,减少了桑椹花色苷的泄露。
2.4.3 ORAC
图5的结果显示,与ACN相比,经脂质体包埋后的桑椹花色ORAC值都有所提高。ACN和0LP经贮藏后的ORAC吸收能力显著降低,ACN由400.69 mmol TE/mL下降了64.05%至144.04 mmol TE/mL,0LP则由626.45 mmol TE/mL下降了38.77%至383.60mmol TE/mL。CLPs(图5-a)贮藏前的ORAC随着胆固醇浓度的增加而增强;而贮藏7 d后其ORAC值与ACN无显著差异。BLPs(图5-b)贮藏前后的ORAC均分别高于CLPs贮藏前后的ORAC,但β-谷甾醇的添加浓度对桑椹花色苷脂质体的ORAC值无显著影响;贮藏前BLPs(图5-b)的ORAC值均为600 mmol TE/mL左右,贮藏后为190 mmol TE/mL左右;SLPs(图5-c)贮藏前的ORAC与CLPs一样,都随着甾醇浓度的增加而提高。结果表明,SLPs的ORAC值与贮藏前变化不大,均高于ACN和CLPs的ORAC值,说明植物混合甾醇的加入能有效提高桑椹花色苷脂质体的氧自由基吸收能力和稳定性。
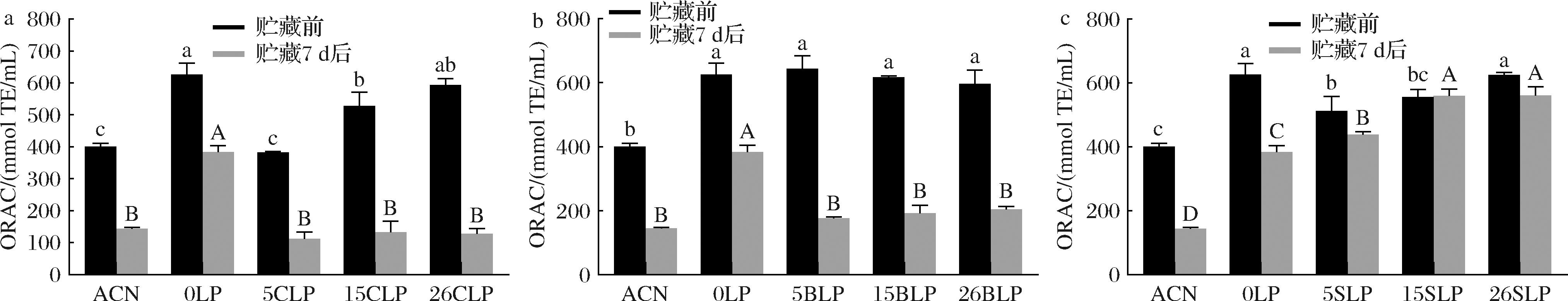
a-CLPs;b-BLPs;c-SLPs
图5 不同甾醇桑椹花色苷脂质体的ORAC
Fig.5 ORAC of different sterol mulberry anthocyanin liposomes
3 结论
本研究采用薄膜分散-超声法制备负载桑椹花色苷的植物甾醇脂质体,探究了甾醇种类及浓度对脂质体包封率、粒径、电位和微观结构的影响,评价了pH稳定性和抗氧化活性。结果表明,添加β-谷甾醇和植物混合甾醇制备的桑椹花色苷脂质体具有良好的pH稳定性,包封率、粒径和表观等理化性质和传统胆固醇制备脂质体无显著变化。体外抗氧化实验结果表明,与胆固醇脂质体相比,桑椹花色苷经脂质体包封后的抗氧化能力提高,且与胆固醇脂质体相比,植物甾醇桑椹花色苷脂质体的抗氧化能力比传统胆固醇桑椹花色苷脂质更强、更稳定。综上,使用植物甾醇替代胆固醇制备脂质体是可行的,且能够在一定程度上保护生物活性物质的抗氧化能力。
[1] CHEN Y, ZHANG W J, ZHAO T, et al.Adsorption properties of macroporous adsorbent resins for separation of anthocyanins from mulberry[J].Food Chemistry, 2016, 194:712-722.
[2] 张文娜, 魏萌, 韩爱云, 等.桑葚果实、桑葚干酒和桑葚利口酒中酚类化合物的高效液相色谱串联电喷雾二级质谱分析及其抗氧化活性比较[J].食品与发酵工业, 2024, 50(14):246-252.
ZHANG W N, WEI M, HAN A Y, et al.High performance liquid chromatography-electron spray ionization-mass spectrometry/mass spectrometry analysis of phenolic compounds in berry, dry wine, liqueur of mulberry and comparison of the antioxidant activities[J].Food and Fermentation Industries, 2024, 50(14):246-252.
[3] MA T, HU N, DING C X, et al.In vitro and in vivo biological activities of anthocyanins from Nitraria tangutorun Bobr.fruits[J].Food Chemistry, 2016, 194:296-303.
[4] CHENG Y, CHEN X, YANG T, et al.Enhancing the storage stability of mulberry anthocyanin extract through ternary complex with whey protein isolate and ferulic acid at neutral pH:Investigation of binding mechanisms[J].Food Hydrocolloids, 2024, 149:109560.
[5] 郑玉婷, 洪涛, 徐柯卉, 等.类紫杉醇脂质体体外释放的桨膜结合分析法研究[J].中国药科大学学报, 2023, 54(6):743-748.
ZHENG Y T, HONG T, XU K H, et al.In vitro release of paclitaxel derivative liposome by paddle membrane binding assay[J].Journal of China Pharmaceutical University, 2023, 54(6):743-748.
[6] SMITH E A, WANG W D, DEA P K.Effects of cholesterol on phospholipid membranes:Inhibition of the interdigitated gel phase of F-DPPC and F-DPPC/DPPC[J].Chemistry and Physics of Lipids, 2012, 165(2):151-159.
[7] WU Q Q, WANG Q T, FU J F, et al.Polysaccharides derived from natural sources regulate triglyceride and cholesterol metabolism:A review of the mechanisms[J].Food &Function, 2019, 10(5):2330-2339.
[8] DU X J, HUANG X, WANG L, et al.Nanosized niosomes as effective delivery device to improve the stability and bioaccessibility of goat milk whey protein peptide[J].Food Research International, 2022, 161:111729.
[9] PRUCHNIK H, W OCH A, G
OCH A, G ADKOWSKI W, et al.Effect of distigmasterol-modified acylglycerols on the fluidity and phase transition of lipid model membranes[J].Membranes, 2022, 12(11):1054.
ADKOWSKI W, et al.Effect of distigmasterol-modified acylglycerols on the fluidity and phase transition of lipid model membranes[J].Membranes, 2022, 12(11):1054.
[10] 邓莉梅, 刘宇佳, 朱杰, 等.甾醇分子差异对脂质体结构稳定性的影响[J].轻工学报, 2023, 38(2):33-40.
DENG L M, LIU Y J, ZHU J, et al.Effect of sterol molecular difference on the structural stability of liposomes[J].Journal of Light Industry, 2023, 38(2):33-40.
[11] 黎雨浩, 李照莹, 周伟, 等.火龙果茎植物甾醇对姜黄素纳米脂质体稳定性以及释放性能的影响[J].食品科学, 2020, 41(16):68-76.
LI Y H, LI Z Y, ZHOU W, et al.Effects of pitaya stem phytosterol on stability and release properties of curcumin nanoliposomes[J].Food Science, 2020, 41(16):68-76.
[12] 张新灿, 郭浩然, 张静, 等.桑葚干和桑葚酒中花青素稳定性分析[J].食品研究与开发, 2022, 43(24):51-57.
ZHANG X C, GUO H R, ZHANG J, et al.Stability analysis of anthocyanins in dried mulberry and mulberry wine[J].Food Research and Development, 2022, 43(24):51-57.
[13] 赖俊余, 赵镕, 温燕梅, 等.桑葚花青素的提取及其脂质体的制备[J].广东化工, 2023, 50(4):75-80.
LAI J Y, ZHAO R, WEN Y M, et al.Extraction of anthocyanin from mulberry and preparation of liposome[J].Guangdong Chemical Industry, 2023, 50(4):75-80.
[14] 郭嘉斌, 徐文霞, 李红莲, 等.香叶木素脂质体的处方优化及其体外释放[J].中国医药工业杂志, 2022, 53(2):225-232.
GUO J B, XU W X, LI H L, et al.Formulation optimization and in vitro release of diosmetin liposomes[J].Chinese Journal of Pharmaceuticals, 2022, 53(2):225-232.
[15] 常影, 杨晓雪, 焦岩, 等.桑葚花色苷纳米脂质体的修饰及稳定性研究[J].食品科技, 2020, 45(12):251-257.
CHANG Y, YANG X X, JIAO Y, et al.Study on the modification and stability of mulberry anthocyanin nanoliposomes[J].Food Science and Technology, 2020, 45(12):251-257.
[16] 陶庆丰. 花色苷纳米脂质体对胃肠细胞抗氧化作用的研究[D].杭州:中国计量大学, 2019.
TAO Q F.Study on antioxidant effect of anthocyanin nanoliposomes on gastrointestinal cells[D].Hangzhou:China University of Metrology, 2019.
[17] 陈玉洁, 关荣发, 黄海智, 等.越橘花青素脂质体对Caco-2细胞的抗氧化作用[J].中国食品学报, 2023, 23(6):56-63.
CHEN Y J, GUAN R F, HUANG H Z, et al.The antioxidative activity of lingonberry anthocyanin liposomes on caco-2 cells[J].Journal of Chinese Institute of Food Science and Technology, 2023, 23(6):56-63.
[18] 魏琼. 雷公藤有效部位脂质体的处方工艺筛选研究[J].湖北中医药大学学报, 2023, 25(5):46-50.
WEI Q.Prescription and technology screening of Tripterygium wilfordii liposomes[J].Journal of Hubei University of Chinese Medicine, 2023, 25(5):46-50.
[19] LIU W L, LIU J H, LIU W, et al.Improved physical and in vitro digestion stability of a polyelectrolyte delivery system based on layer-by-layer self-assembly alginate-chitosan-coated nanoliposomes[J].Journal of Agricultural and Food Chemistry, 2013, 61(17):4133-4144.
[20] BARRECA D, BISIGNANO C, GINESTRA G, et al.Polymethoxylated, C- and O-glycosyl flavonoids in tangelo (Citrus reticulata × Citrus paradisi) juice and their influence on antioxidant properties[J].Food Chemistry, 2013, 141(2):1481-1488.
[21] 鞠葛金悦, 徐红雨, 温靖, 等.毛酸浆乳酸菌发酵果汁的体外消化耐受性及抗氧化活性变化[J].现代食品科技, 2021, 37(7):108-114;56.
JU G, XU H Y, WEN J, et al.In vitro assessment of the digestive tolerance and antioxidation of juice from Physalis pubescens L.fermented by lactic acid bacteria[J].Modern Food Science and Technology, 2021, 37(7):108-114;56.
[22] 邹波, 曾丹, 吴继军, 等.不同品种紫肉甘薯抗氧化能力及花色苷成分分析[J].食品科学, 2018, 39(2):38-44.
ZOU B, ZENG D, WU J J, et al.Antioxidant capacity and anthocyanins of purple-fleshed sweet potato cultivars[J].Food Science, 2018, 39(2):38-44.
[23] DECKER C, FAHR A, KUNTSCHE J, et al.Selective partitioning of cholesterol and a model drug into liposomes of varying size[J].Chemistry and Physics of Lipids, 2012, 165(5):520-529.
[24] TAI K D, RAPPOLT M, HE X Y, et al.Effect of β-sitosterol on the curcumin-loaded liposomes:Vesicle characteristics, physicochemical stability, in vitro release and bioavailability[J].Food Chemistry, 2019, 293:92-102.
[25] 权召. 杨梅花色苷纳米脂质体对胃细胞抗氧化活性的机制研究[D].杭州:中国计量大学, 2020.
QUAN Z.Research on the mechanisms of antioxidative activity of Myrica rubra anthocyanin nanoliposomes on gastric cells[D].Hangzhou:China Jiliang University, 2020.