维生素K2(Vitamin K2,MK)是一种由2-甲基-1,4-萘醌环与C3位置上的异戊二烯侧链组成的天然脂溶性化合物[1],在预防骨质疏松、减轻炎症、治疗心血管疾病甚至是抑制肿瘤的形成方面都发挥着不可或缺的作用[2]。根据异戊二烯侧链数目的不同,可以将维生素K2命名为MK-1~MK-14[3],其中,MK-4主要来源于动物,可以由摄入的维生素K1在某些组织中特异性转化而来[4],而MK-7~MK-11则主要是由细菌产生。其中,侧链数目为7的MK-7在人体中拥有着较长的半衰期与生物相容性,与人体的生物亲缘度高,能够被人体直接吸收[5],是维生素K最有效的亚型[6]。维生素K2是人体健康必不可少的补充剂,但是人体本身无法合成维生素K2[7],主要是从食物[8]中获取或者来源于肠道微生物[9]的合成。维生素K2在医药以及功能食品领域都有着重要的意义[10],但是由于化学法合成容易造成高污染与高损耗[11],同时合成的原材料与中间产物容易造成环境污染,因此目前普遍采用微生物发酵的方式生产维生素K2。
枯草芽孢杆菌中维生素K2的生物合成途径可以分为3个模块:莽草酸(shikimate, SA)途径、甲萘醌(menaquinone,MK)途径和甲基赤藓糖醇-4-焦磷酸(2-C-methyl-D-erythritol 4-phosphate, MEP)途径(图1)。以甘油为底物发酵时,甘油在甘油激酶的作用下形成3-甘油磷酸,进而形成4-磷酸赤糖醇,经过SA途径形成的分支酸(chorismic acid,CHA)进入甲萘醌途径,形成1,4-二羟基-2-萘甲酸(1, 4-dihydroxy-2-naphthoic acid,DHNA),完成甲萘醌母环的合成。在这个过程中,会形成莽草酸、2-琥珀酰基苯甲酸酯、DHNA-CoA等中间代谢物质,其中,MenD(2-succinyl-5-enopyruvyl-6-hyolroxy-3-cyclohexdaiene-1-carboxylate synthase)作为2-琥珀酰基-5-烯醇丙酮基-6-烃基-3-环己烯-1-羧酸酯(SEPHCHC)合成酶,在萘醌环的形成过程中催化异分支酸(isochorismate,ICHA)合成SEPHCHC,是甲萘醌母环合成的重要途径,因此,menD的表达水平是MK-7合成的重要影响因素。
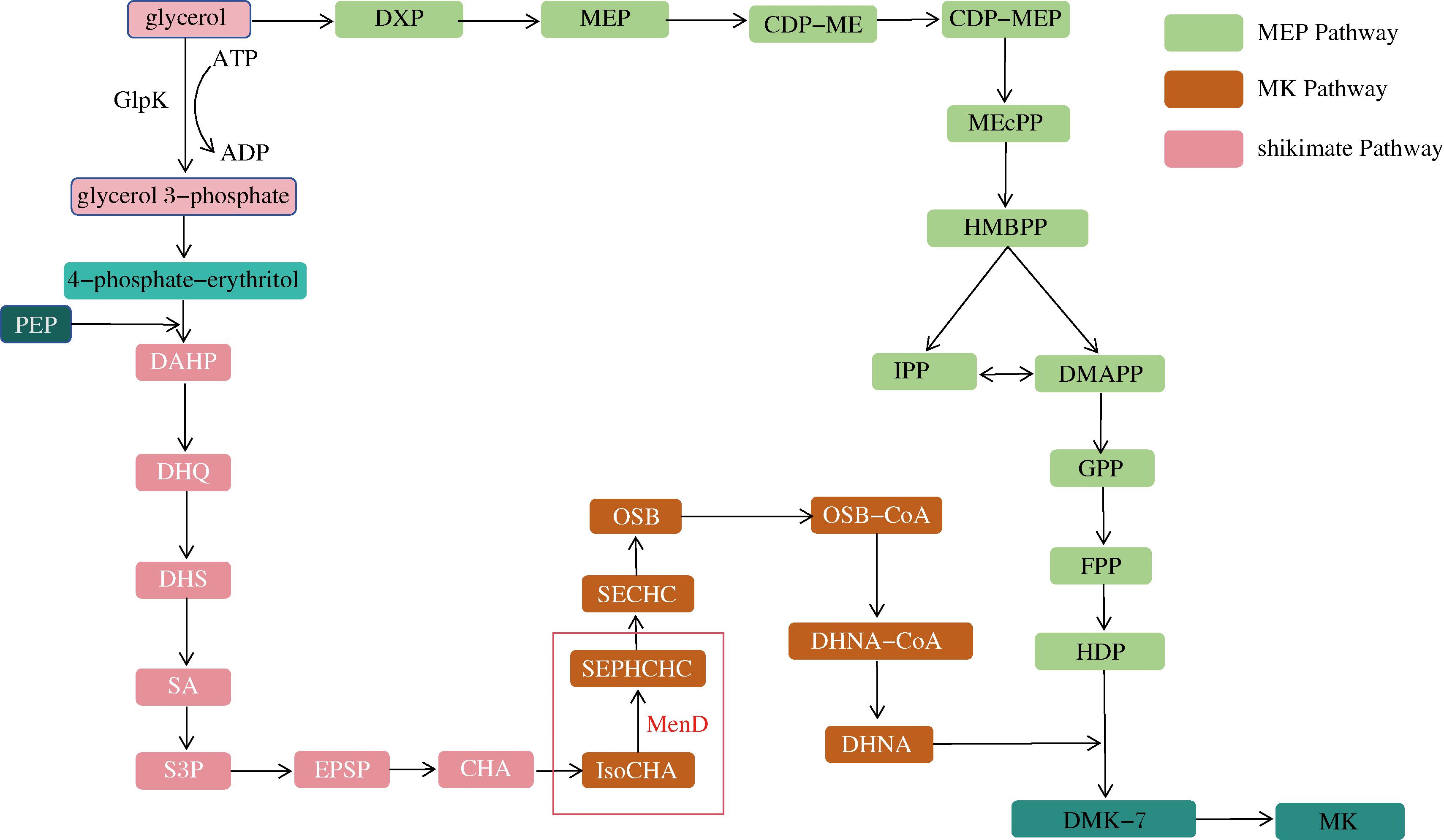
图1 枯草芽孢杆菌中维生素K2的代谢合成途径
Fig.1 Biosynthesis pathway of vitamin K2 in Bacillus subtilis
注:glycerol,甘油;GlpK,甘油激酶;glycerol 3-phosphate,甘油 3-磷酸酯;phosphate-erythritol,磷酸赤藓糖醇;PEP,磷酸烯醇丙酮酸;DAHP,3-脱氧阿拉伯庚酮酸 7-磷酸;DHQ,3-脱氢奎酸;DHS,3-脱氢莽草酸;SA,莽草酸;S3P,莽草酸 3-磷酸酯;EPSP,5-O-(1-羧乙烯基)-3-磷酸莽草酸酯;CHA,分支酸酯;IsoCHA,异分支酸酯;MenD,2-琥珀酰-5-烯醇丙酮酰-6-羟基-3-环己烯-1-羧酸合酶;SEPHCHC,2-丁二酰基-5-烯醇丙酮基-6-烃基-3-环己烯-1-羧酸酯;SECHC,2-丁二酰基-6-烃基-2;4-环己二烯-1-羧酸酯;OSB,2-琥珀酰苯甲酸酯;OSB-CoA,2-琥珀酰苯甲酸酯-CoA;DHNA-CoA,1,4-二羟基-2-萘甲酰-CoA;DHNA,1,4-二羟基-2-萘甲酸酯;DXP,1-脱氧木酮糖-5-磷酸酯;MEP,甲基-赤藓糖醇-4-二磷酸酯;CDP-ME,4-(胞苷 5′-二磷酸)-2-C-甲基赤藓糖醇;CDP-MEP,2-磷酸-4-(胞苷 5′-二磷酸) Ho)-2-C-甲基赤藓醇;MEcPP,2-C-甲基D-赤藓糖醇 2,4-环二磷酸;HMBPP,1-羟基-2-甲基-2-丁烯基4-二磷酸酯;IPP,异戊烯基二磷酸酯;DMAPP,二甲基烯丙基二磷酸酯;GPP,香叶基二磷酸酯;FPP,法尼基 二磷酸酯;HDP,七戊烯基二磷酸酯;DMK-7,去甲基甲萘醌;MK,甲萘醌。
枯草芽孢杆菌的启动子可以分为诱导型的启动子和组成型的启动子[8]。其中,组成型启动子的调控效果不会受到外界环境的影响,基因的表达也具有连续性,如常见的P43、PspovG和Pveg,但是组成型启动子诱导基因表达时可调控性较差[8]。诱导型启动子只有在某种特定的情况下才会开始诱导基因的表达[9],受到菌体生长状态的影响较小,可以减小目标产物对于菌体生长的影响,一般可用于工业化外源蛋白的生产,如常用的Pxyl、PgroE和Pvgb[10]。通过控制启动子的表达强度,可以借此控制细胞内的碳代谢流向,减少支路的消耗,促进目标产物的合成。在本次实验使用木糖诱导型启动子PxylA,该启动子具有较强的表达活性与调控灵敏度,调控甲萘醌合成途径的关键酶MenD,观察枯草芽孢杆菌中MK-7合成、生物膜与细菌生长的状况。本工作从枯草芽孢杆菌中MK-7合成途径中的关键酶MenD出发,研究甲萘醌合成途径中关键基因menD表达强度的改变对MK-7的生物合成、菌体生长和生物膜形态的影响,明确关键酶MenD对于枯草芽孢杆菌维生素K2合成的作用,为从代谢工程水平实现MK-7高产工程菌株的构建提供了实验基础与理论依据。
1 材料与方法
1.1 菌株、质粒和仪器
Bacillus subtilis 168、质粒p7C6P43[11]均为本实验室保存。
T100~Thermal cycler PCR仪,伯乐生命医学产品(上海)有限公司;1510型酶标仪,赛默飞世尔科技(中国)有限公司;振荡培养箱、恒温培养箱,上海知楚仪器有限公司;自动凝胶成像系统,伯乐生命医学产品(上海)有限公司;紫外可见分光光度计,上海元析仪器有限公司。
1.2 培养基的配制
种子培养基(g/L):胰蛋白胨10,酵母提取物5,NaCl 10,木糖5,pH 7.0,121 ℃灭菌20 min,固体培养基加入20 g/L琼脂糖。
SYg发酵培养基(g/L):大豆蛋白胨50,甘油50,酵母提取物20,KH2PO4 1.62,K2HPO4 3.86,木糖5,121 ℃灭菌20 min。微量元素2 mL/L(过滤除菌,发酵时加入灭菌的发酵培养基)。
Sipizizen感受态培养基:
SPⅠ培养基、SPⅡ培养基、50 mmol/L CaCl2、250 mmol/L MgCl2,121 ℃灭菌20 min。
SPI-A盐溶液:0.4 g (NH4)2SO4,2.14 g K2HPO4,1.2 g KH2PO4,0.2 g柠檬酸三钠二水合物,蒸馏水定容到100 mL,121 ℃灭菌20 min。
SPI-B盐溶液:0.04 g MgSO4·7H2O,蒸馏水定容到100 mL,121 ℃灭菌20 min。
100×CAYE溶液:2 g酪蛋白水解物,10 g酵母提取物,蒸馏水定容到100 mL,121 ℃灭菌20 min。
100×EGTA溶液:0.380 35 g EGTA溶液(溶解时加入少量NaOH至pH=8.0),蒸馏水定容到100 mL,121 ℃灭菌20 min。
SPⅠ培养基:0.98 mL SPI-A盐溶液,0.98 mL SPI-B 盐溶液,20 μL 50%葡萄糖,20 μL 100×CAYE溶液。
SPⅡ培养基:1.96 mL SPI溶液,20 μL 50 mmol/L CaCl2,20 μL 250 mmol/L MgCl2。
1.3 酶类与试剂
Prime STAR Max Premix(2×)来自TAKARA Bio Inc,6×Loading Buffer、5 000 marker、质粒提取试剂盒、胶回收试剂盒等,生工生物(上海)股份有限公司,其余药品和试剂均来自国药集团。
1.4 菌株的活化与培养
菌株存储于-80 ℃冰箱中,将其接种到LB固体培养基上活化14 h,挑取单菌落到LB液体培养基中,37 ℃,220 r/min培养12~16 h至对数期,将其分别以5%和2%(体积分数,下同)的比例接种到含有3 mL发酵培养基的孔板和50 mL发酵培养基的锥形瓶中,分别加入2‰的微量元素,用于观察与检测生物膜的状态与MK-7的形成。
1.5 细菌生物膜形成能力的检测
生物膜的测定参照文献[12],在孔板中每孔加入SYg发酵培养基3 mL,按照5%的接种量接种活化的菌液,对照组选用空白的SYg发酵培养基,在37 ℃时静置培养72 h定量测定生物膜。培养结束后,首先缓慢吸除孔板中的培养物,用无菌的PBS缓冲液冲洗2~3次,洗去多余的菌体,干燥后加入2 mL的0.1%(体积分数)结晶紫染料染色20 min,再用PBS缓冲液缓慢冲洗,直至流出液体为无色。室温静置干燥,去除多余水分,随后加入2 mL 33%(体积分数)的乙酸脱色15 min,混匀后使用酶标仪测定OD570处的值来衡定生物膜的形成量。
1.6 菌株生长曲线的绘制
将BS168、BS168-ΔmenD、BS168-P43-menD与BS168-PxylA-menD在LB固体培养基活化后,将菌体接入LB液体培养基过夜培养。将过夜培养液转入盛有50 mL液体LB培养基的250 mL锥形瓶中,混合均匀,37 ℃,220 r/min条件下开始培养,每隔2 h取样,样品放在冰箱贮存,最后统一采用酶标仪测定600 nm处的吸光度。
1.7 维生素K2标准曲线的绘制
称取0.1 g的维生素K2标准品,用流动相(甲醇∶二氯甲烷=9∶1,体积比,下同)定容到1 mL,配制成100 mg/mL的母液,存贮在棕色EP管中,低温避光保存。将母液稀释成不同质量浓度梯度的维生素K2溶液,通过高效液相色谱检测峰面积。测量得到标准方程为Y=14 368x+1 272.3,R2=0.999 6,表明两者之间的线性关系良好。
1.8 维生素K2的提取与检测
采用HPLC法检测发酵液中维生素K2的含量。取2 mL混匀的发酵液于5 mL的棕色离心管中,10 000 r/min,离心5 min,将上清液吸入5 mL棕色离心管中,按照菌体∶萃取剂=1∶4(上清液∶萃取剂=1∶4)的比例加入萃取剂,振荡培养箱振荡20 min,将离心管避光静置30 min,12 000 r/min离心5 min,取上清液,0.22 μm滤膜过滤,加入进样瓶中。色谱柱为赛默飞5 μm C18(4.6 mm×250 mm,序列号:20187996),萃取剂为正己烷∶异丙醇=2∶1,流速1.0 mL/min,进样量10 μL,温度35 ℃,紫外检测波长254 nm。
1.9 menD基因缺失菌株的构建
本实验采用的是同源重组[11]的方式改造目标菌株。利用snapgene设计相关引物,引物由南京金斯瑞生物科技有限公司合成。将扩增获得的menD-L、P7C6与menD-R片段通过重叠延伸PCR技术融合获得重组片段,将重组片段转化入枯草芽孢杆菌感受态细胞中,涂布于氯霉素抗性平板。挑取合适的单菌落进行菌液PCR验证,将验证成功的菌株送至广州金唯智科技有限公司测序,最终获得一株重组菌株BS168-ΔmenD。
1.10 menD基因过表达菌株的构建
菌株构建方法参照1.9节,将menD-L、P7C6-P43与menD片段通过重叠延伸PCR技术融合获得的重组片段导入枯草芽孢感受态细胞中,其余操作相似。
1.11 BS168-PxylA-menD菌株的构建
以BS168为模板,扩增得到PxylA,同menD-L、P7C6与menD片段融合,得到重组片段menD-L-P7C6-PxylA-menD,将其导入枯草芽孢杆菌感受态细胞中,其余操作与1.9节相同。所用引物如表1所示。
表1 本研究所用引物
Table 1 Primers used in this study
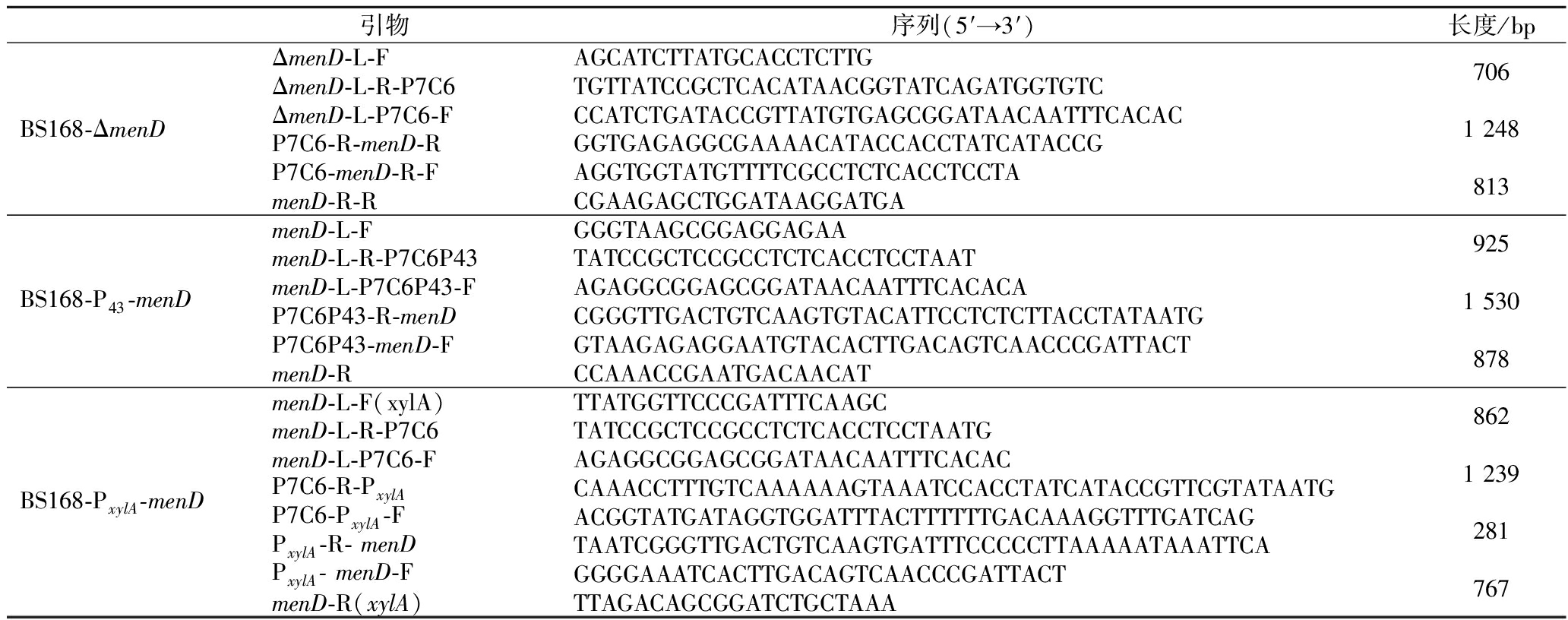
引物序列(5′→3′)长度/bpBS168-ΔmenDΔmenD-L-FAGCATCTTATGCACCTCTTGΔmenD-L-R-P7C6TGTTATCCGCTCACATAACGGTATCAGATGGTGTCΔmenD-L-P7C6-FCCATCTGATACCGTTATGTGAGCGGATAACAATTTCACACP7C6-R-menD-RGGTGAGAGGCGAAAACATACCACCTATCATACCGP7C6-menD-R-FAGGTGGTATGTTTTCGCCTCTCACCTCCTAmenD-R-RCGAAGAGCTGGATAAGGATGA706 1 248 813 BS168-P43-menDmenD-L-FGGGTAAGCGGAGGAGAAmenD-L-R-P7C6P43TATCCGCTCCGCCTCTCACCTCCTAATmenD-L-P7C6P43-FAGAGGCGGAGCGGATAACAATTTCACACAP7C6P43-R-menDCGGGTTGACTGTCAAGTGTACATTCCTCTCTTACCTATAATGP7C6P43-menD-FGTAAGAGAGGAATGTACACTTGACAGTCAACCCGATTACTmenD-RCCAAACCGAATGACAACAT925 1 530 878 BS168-PxylA-menDmenD-L-F(xylA)TTATGGTTCCCGATTTCAAGCmenD-L-R-P7C6TATCCGCTCCGCCTCTCACCTCCTAATGmenD-L-P7C6-FAGAGGCGGAGCGGATAACAATTTCACACP7C6-R-PxylACAAACCTTTGTCAAAAAAGTAAATCCACCTATCATACCGTTCGTATAATGP7C6-PxylA-FACGGTATGATAGGTGGATTTACTTTTTTGACAAAGGTTTGATCAGPxylA-R- menDTAATCGGGTTGACTGTCAAGTGATTTCCCCCTTAAAAATAAATTCAPxylA- menD-FGGGGAAATCACTTGACAGTCAACCCGATTACTmenD-R(xylA)TTAGACAGCGGATCTGCTAAA862 1 239 281 767
1.12 western-blot 分析
细胞裂解和蛋白质分离参考文献[13]。Anti-MenD稀释度为1∶1 000。Anti-dnak抗体稀释1∶5 000。
1.13 数据处理
所有实验进行3次重复,实验数据取平均值。
2 结果与分析
2.1 重组菌株的构建与鉴定
参考文献[11],利用同源重组的方式进行目标菌株的构建,图2-a为重组菌株的单片段扩增,其中1~3为BS168-ΔmenD的左同源臂、氯霉素抗性片段与右同源臂,4~6为BS168-P43-menD的左同源臂、氯霉素抗性片段与右同源臂,7~10为BS168-PxylA-menD的左同源臂、氯霉素抗性片段、PxylA与右同源臂;图2-b为利用重叠延伸PCR(overlop PCR)的方法将目标扩增片段融合成menD-L-P7C6-menD-R(图2-b 1,2)、menD-L-P7C6P43-menD(图2-b 3,4)与menD-L-P7C6-PxylA-menD(图2-b 5,6);图2-c为重组菌株的菌液PCR鉴定,分别为BS168-ΔmenD(图2-c 1)、BS168-P43-menD(图2-c 2)与BS168-PxylA-menD(图2-c 3)。其中,BS168-ΔmenD的menD片段被抗性基因所替代,BS168-P43-menD的menD片段前插入抗性片段和启动子P43,BS168-PxylA-menD的menD片段前插入抗性片段和启动子PxylA。所有抗性平板生长出来的阳性克隆都需要经过菌液PCR验证与测序比对,验证成功后得到目标重组菌株BS168-ΔmenD、BS168-P43-menD与BS168-PxylA-menD(图2)。结果表明重组菌株成功构建。
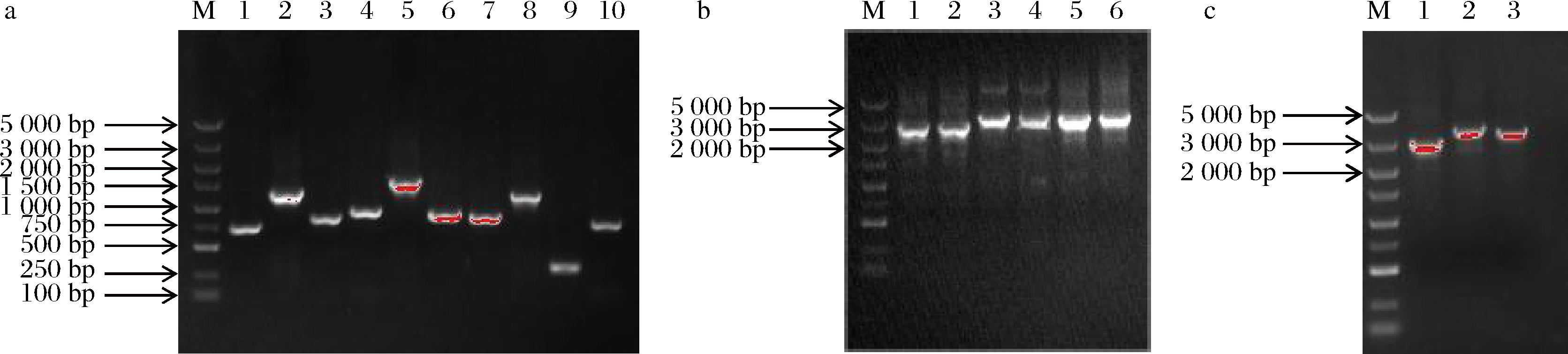
图2 重组菌株的鉴定
Fig.2 Identification of recombinant strain
注:M-5 000碱基DNA对照;a:1-BS168-ΔmenD上游片段,2-P7C6,3-BS168-ΔmenD下游片段,4-BS168-P43-menD上游片段,5-P7C6P43,6-BS168-P43-menD下游片段,7-BS168-PxylA-menD上游片段,8-P7C6,9-PxylA,10-BS168-PxylA-menD下游片段;b:1,2-BS168-ΔmenD融合片段,3,4-BS168-P43-menD融合片段,5,6-BS168-PxylA-menD融合片段;c:1-BS168-ΔmenD菌液PCR验证,2-BS168-P43-menD菌液PCR验证,3-BS168- PxylA-menD菌液PCR验证。
2.2 menD表达强度的结果分析
为探究menD基因表达强度对于MK-7合成的影响,本文尝试通过改变menD基因启动子来改变menD基因的表达强度。western-blot结果(图3)显示,BS168-P43-menD的menD基因表达量比原始菌株高,BS168-PxylA-menD中menD基因表达量要高于原始菌株和BS168-P43-menD。这表明,将menD基因的启动子变为强启动子P43与PxylA时,menD基因的表达强度有所增加。启动子是RNA聚合酶的结合位点,是转录开始的关键,也是基因转录强度的决定性因素。为了弥补原始启动子转录强度的不足,将menD基因更换转录强度较强的启动子,增加menD基因的表达强度。
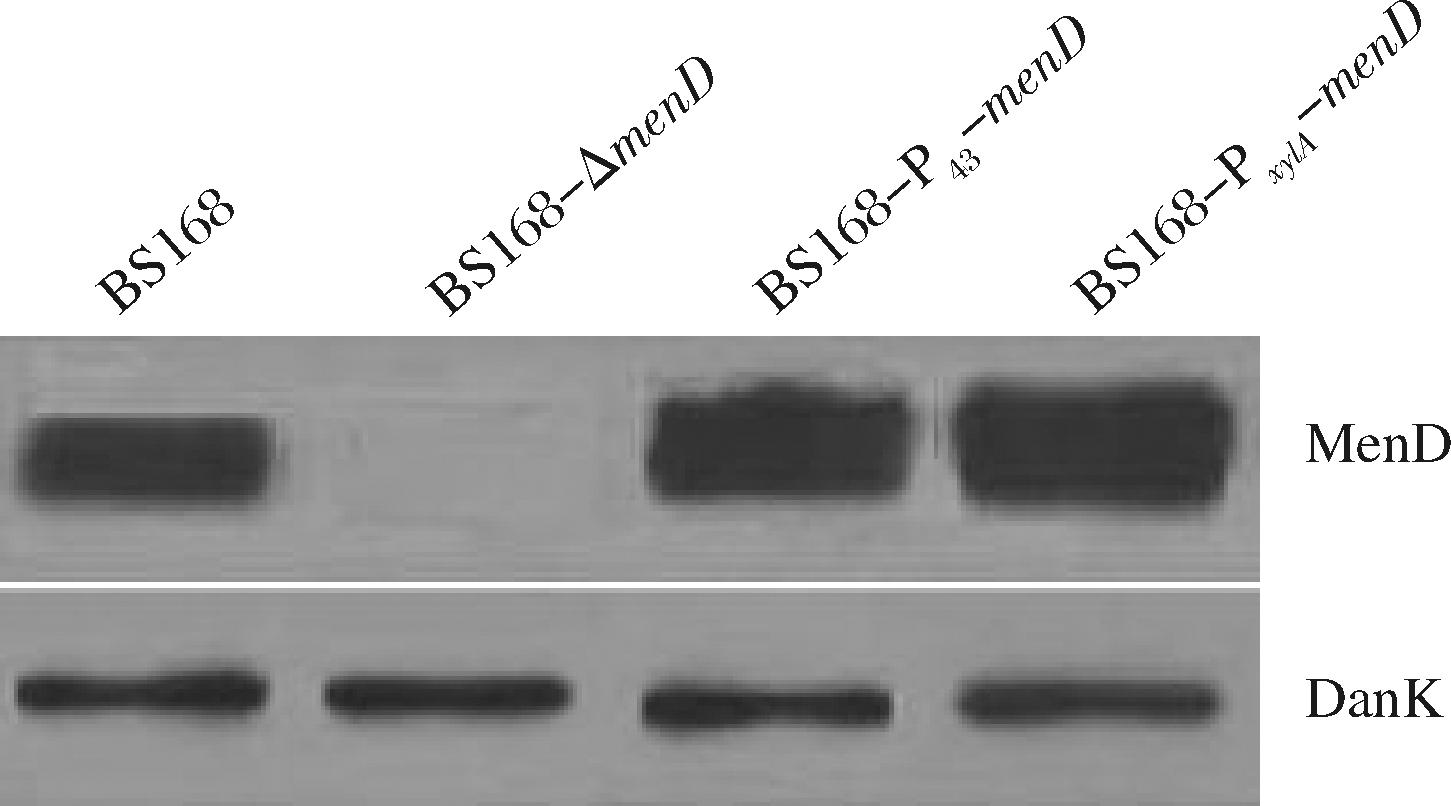
图3 Western-blot分析BS168、S168-ΔmenD、BS168-P43-menD和BS168-PxylA-menD中menD基因的表达强度
Fig.3 The expression levels of menD in BS168, BS168-ΔmenD, BS168-P43-menD and BS168-PxylA-menD analyzed by western-blot
2.3 生长曲线的测定
为避免分开培养时不同试管中细菌生长速率不一样而造成的实验误差,将菌液接到含有50 mL液体LB的培养基中,采用统一培养的方式,细菌整个生长过程都是在同一个反应器中进行。每隔2 h进行取样,测量时适当稀释进而保持细胞光密度的数值在0.2~0.8。如图4所示,在液体培养基中,BS168-ΔmenD的生长被严重抑制,几乎不生长;BS168-P43-menD的生长曲线与BS168的较为相似,细胞生长没有受到过多的影响,但最大细胞密度高于原始菌株;BS168-PxylA-menD的细胞密度普遍高于BS168,这表明menD基因的表达量增加有助于菌株的生长,menD的缺失则会导致细菌生长受到抑制。menD表达强度的改变对于细胞生长产生的影响,是因为MenD催化着甲萘醌途径中的物质转化,menD基因表达强度的增加,会使得萘醌环的合成得到增强,促进甲萘醌的合成,甲萘醌作为细胞呼吸链的中间载体,其合成的增强促进了细胞的呼吸作用,细胞生长得到促进。而menD基因的缺失则会导致甲萘醌途径发生断裂,细胞无法顺利产生甲萘醌,细胞的呼吸作用受阻,影响细胞的正常生长。
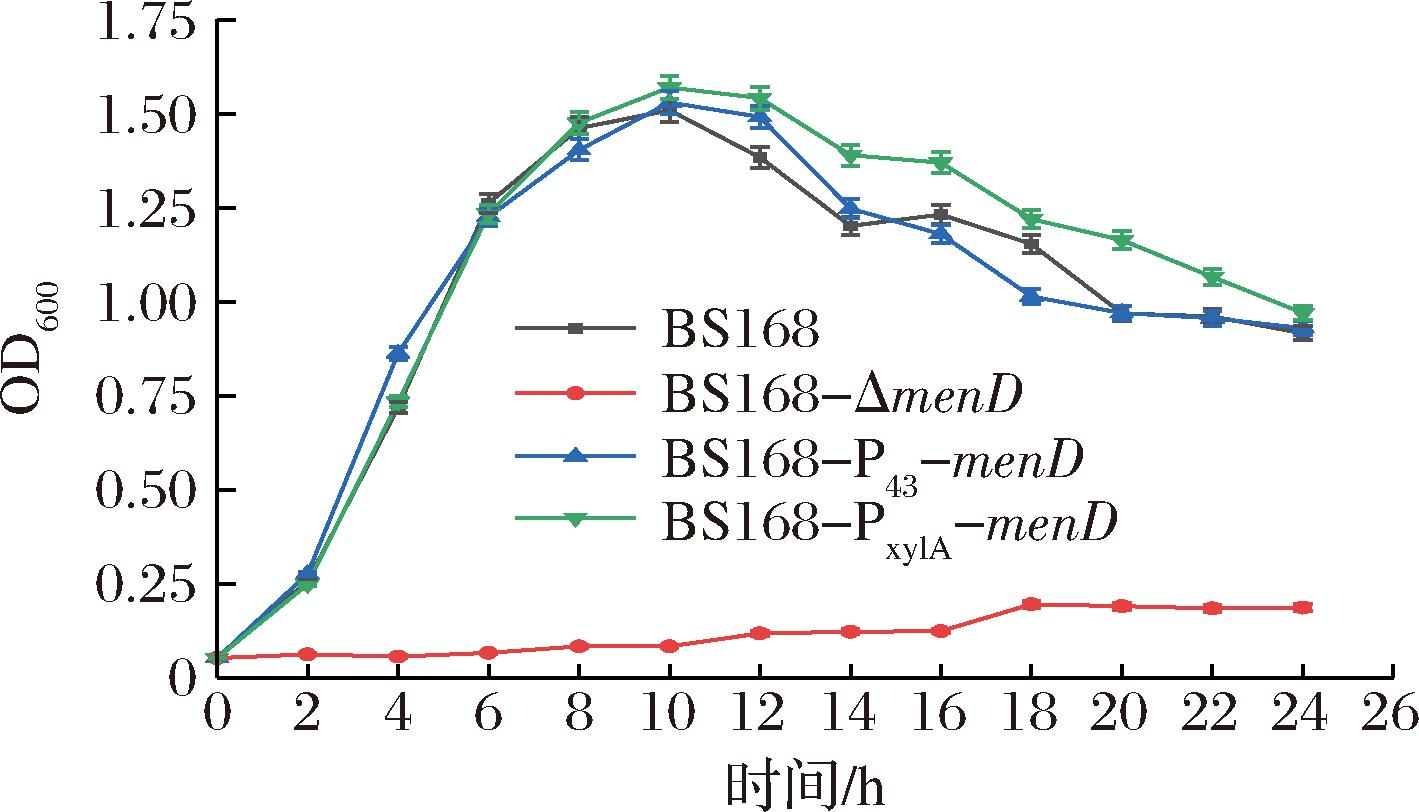
图4 生长曲线的测定
Fig.4 Determination of cell growth
2.4 重组菌株生物膜形态的差异
生物膜是微生物聚合过程中形成的集合体[14],除了微生物细胞外,生物膜中还含有大量的胞外蛋白、矿物质堆积物与eDNA,生物膜的存在对于微生物群体稳态的维护至关重要。通过孔板法静置培养一段时间后,可以发现生物膜的状态之间存在着较大的差异(图5)。与原始菌株B.subtilis 168相比,重组菌株BS168-ΔmenD生物膜形成受到明显抑制,无法形成完整的生物膜,这表明menD基因的缺失会影响枯草芽孢杆菌生物膜的形成。相较于BS168-ΔmenD,BS168-P43-menD与BS168-PxylA-menD则是能够形成正常状态的生物膜,且与B.subtilis 168相比,重组菌株BS168-P43-menD与BS168-PxylA-menD的生物膜形成量都高,生物膜褶皱程度和表面粗糙程度都有较大提升,并且生物膜边缘呈现不规则性。对生物膜进行干燥脱色处理,检测OD570发现(图6),BS168-ΔmenD的生物膜含量极低,BS168-PxylA-menD的生物膜量最高,与观察到生物膜的形成状况一致。
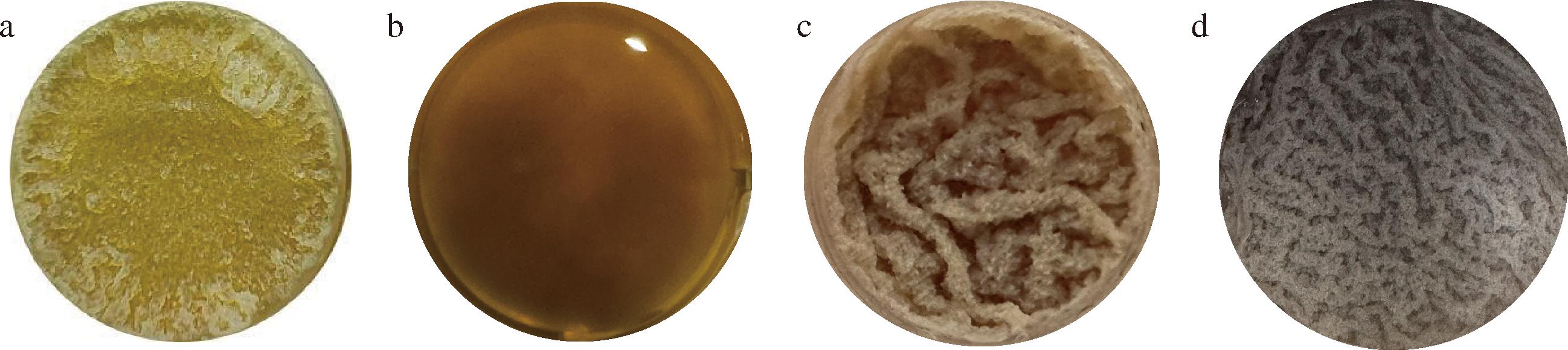
a-B.subtilis 168;b-BS168-ΔmenD;c-BS168-P43-menD;d-BS168-PxylA-menD
图5 重组菌株的生物膜形态变化
Fig.5 The morphological changes of biofilm of recombinant strain

图6 重组菌株生物膜生物量的差异
Fig.6 The differences of biofilm biomass between B.subtilis 168, BS168-ΔmenD, BS168-P43-menD and BS168-PxylA-menD
2.5 menD基因表达强度对于MK-7产量的影响
为检验基因menD表达强度对于MK-7合成的影响,以原始菌株BS168为对照组,摇瓶发酵。通过6 d的静置培养后,重组菌株BS168-ΔmenD 中没有检测到MK-7,这是因为menD缺失后,枯草芽孢杆菌中甲萘醌途径被阻断,萘醌环无法合成,MK-7的生物合成受到严重影响。在替换menD基因的启动子后,目的基因menD的表达强度得到增加,MK-7的合成得到增强,通过图7可以发现,BS168-P43-menD与BS168-PxylA-menD的产量也分别提升到34.38 mg/L和39.27 mg/L,与野生型相比,突变株分别提升了64%和87%,这表明提高代谢途径中关键基因menD的表达强度是提高发酵菌株中MK-7合成的有效手段。同时通过图8得知,菌株的单位细胞产量也存在一定差异,菌株BS168的单位细胞产量最低,只有0.696,而BS168-PxylA-menD的单位细胞产量最高,达到1.098,较原始菌株提高了57.6%,这表明,重组菌株MK-7产量的变化是由菌株生物量改变和单位细胞产量变化共同作用的结果。
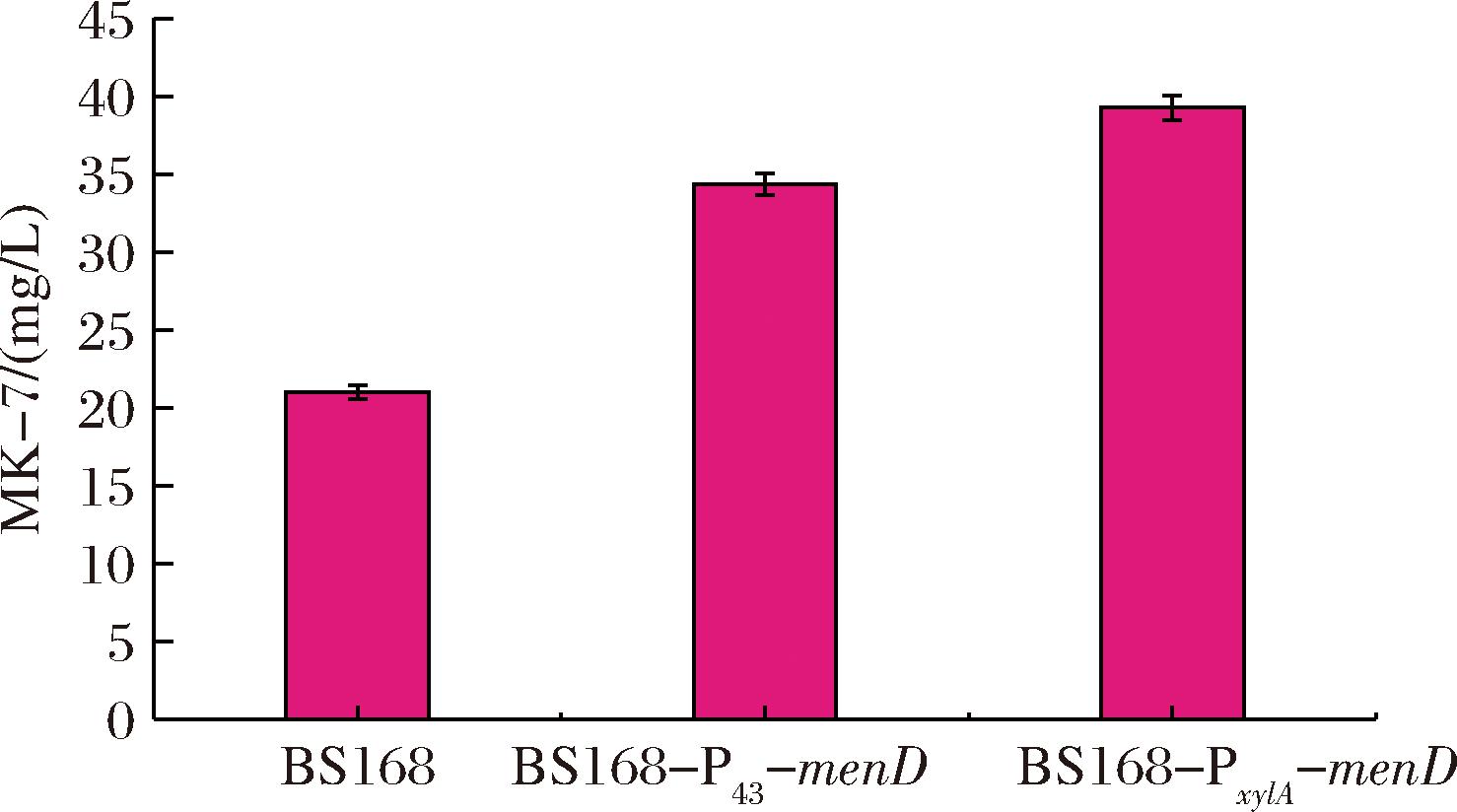
图7 不同菌株中MK-7的产量
Fig.7 The MK-7 production in different strains
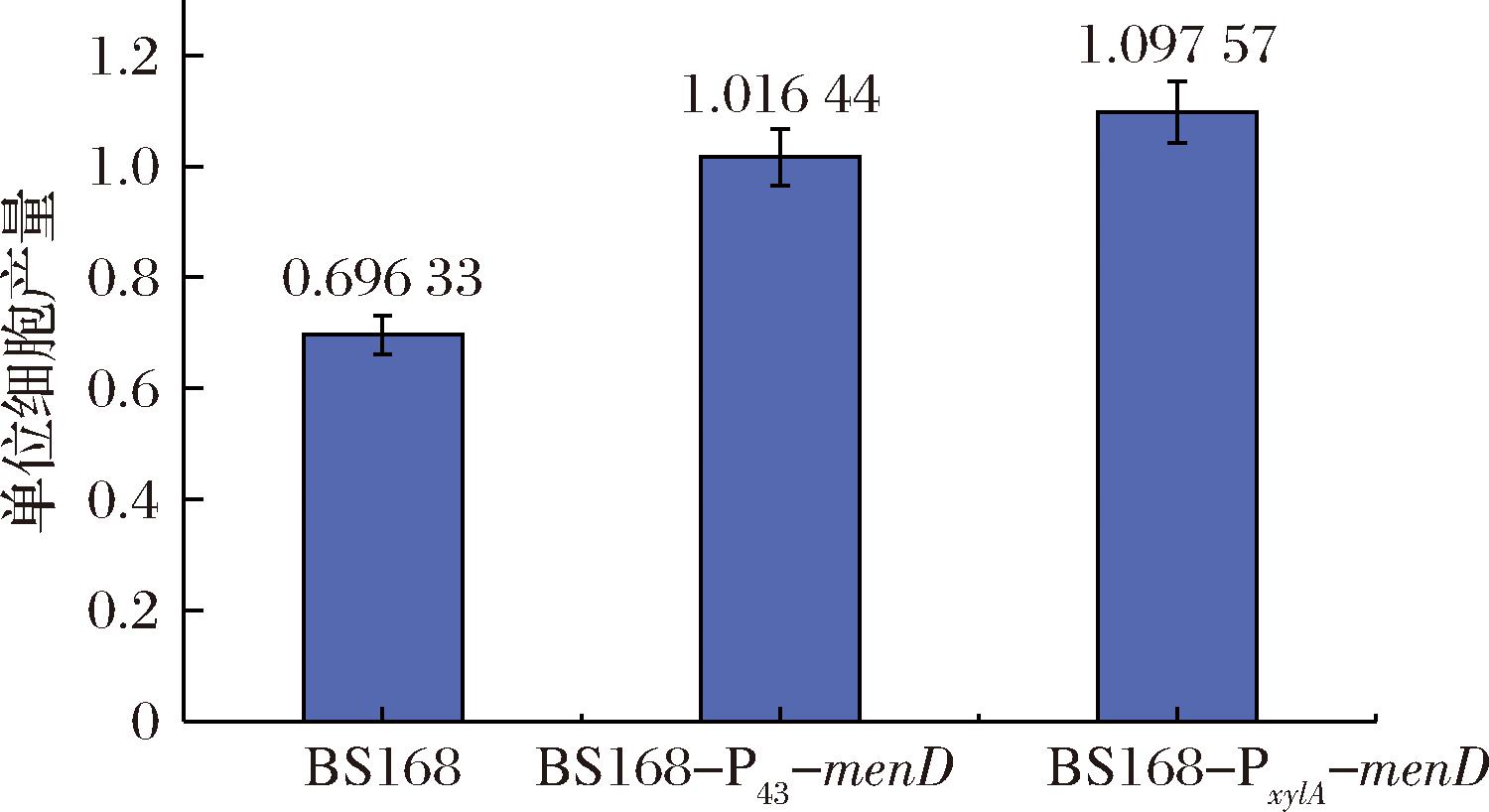
图8 单位细胞产量的测定
Fig.8 Determination of unit cell yield
3 结论与讨论
相较于化学法,微生物发酵具备条件简单、环境友好等诸多优势,备受关注。发酵条件的优化、优势菌株的筛选、代谢途径改造都是目前的主要研究方向,SINGH等[15]使用枯草芽孢杆菌NCIM 2708作为出发菌株,优化了大豆培养基的成分,在固体培养基组分中发酵24 h后,将每克培养基中的MK-7含量提升到39.039 μg。MA等[16]增强MEP途径中关键基因的表达,在枯草芽孢杆菌中组合性过表达Dxs、Dxr、Idi和MenA等途径限速酶,最高MK-7的产量可以达到50 mg/L。微生物发酵可以获得生物活性与纯度都较高的维生素K2,能够产生维生素K2的菌株很多,如表2所示。虽然目前相关的研究很多,但是针对menD表达强度改变的研究较少,本研究注重于探究menD表达强度的变化对于MK-7产量、生物膜形态和菌株生长的影响,确认其在枯草芽孢杆菌维生素K2合成中的作用,为后续从全局层面进行调控、实现维生素K2高产菌株的构建提供一个理论基础与实验依据。
表2 用于发酵生产维生素K2的不同菌株和处理方法
Table 2 Vitamin K2 production by various microorganisms with different process

菌株类别策略产量参考文献Elizabethkingia menin-gosepticaMK定点突变抑制UbiA活性,阻断UQ的形成,并使UbiA 14个保守残基突变16.8 mg/L[13]B. subtilis (natto)MK-7酸加热法、提高转速和优化生长培养基0.6 mg/L/h[17]B. subtilisMK-7优化生长培养基和溶氧控制91.3 mg/L[18]B. velezensis NDMK-7固态发酵(150.0±4.9)mg/kg[19]E. coli JM109MK-8过表达ispA,dxr,idi和敲除ubiCA来阻断竞争对手泛醌-8的形成290 μg/g DCW[20]
menD基因编码的2-琥珀酰基-5-烯醇丙酮基-6-羟基-3-环己二烯-1-羧酸合酶(MenD)是一种金属离子依赖酶,能够与二磷酸硫酸铵一起,共同催化α-酮戊二酸酯与异氯酸酯的共轭加成,是维生素K2经典生物合成途径的第一步[21]。同时,MenD在SEPHCHC的合成中也发挥着催化作用[21],该物质是甲萘醌途径中的重要中间化合物。在本实验中,为了验证甲萘醌途径中的关键基因menD的表达强度对于MK-7合成的影响,通过构建重组菌株BS168-ΔmenD、BS168-P43-menD和BS168-PxylA-menD,通过静态发酵检测重组菌株MK-7的合成状况,以探究发酵途径中关键基因表达强度的变化对于MK-7合成的影响。结果证明,基因menD的表达强度是影响目标产物合成的重要因素,在BS168-P43-menD和BS168-PxylA-menD中,随着基因menD表达强度的增加,MK-7的产量也在逐渐增加,两者在一定范围中呈现正相关,这表明MenD对于萘醌母环合成的重要性。除了枯草芽孢杆菌,XU等[2]发现过表达解淀粉芽孢杆菌中menD基因, MK-7的产量提高了80%;李楚等[22]也在纳豆芽孢杆菌中过表达menD基因,使MK-7的产量提高14.7%,这些都表明MenD在MK-7合成过程中的重要性与必需性。MenD催化SEPHCHC的合成在生物合成途径中不可逆且是不可或缺的,MenD的缺失会导致1,4-二羟基-2-苯甲酸(1,4-dihydroxy-2-naphthoate, DHNA)的合成受损,DHNA是甲萘醌生物合成的中间体,对于细胞的存活与MK-7的合成都至关重要,因此,理论上MenD的缺失会导致细胞的存活受到影响,DHNA无法合成,MK-7也无法合成。但是本文发现,通过在培养基中添加甲萘醌标准品,菌株的生长活性可以恢复(图9)。甲萘醌在细胞呼吸的电子传递中发挥着中间载体的作用[23]。menD基因的缺失,使得枯草芽孢杆菌中甲萘醌途径断裂,DHNA的合成受阻,甲萘醌无法顺利合成,细胞有氧呼吸的电子传递链受到影响,细菌无法顺利生存。当往培养基中添加甲萘醌标准品的时候,虽然细菌依然无法通过自身合成甲萘醌,但却可以从周围环境中摄取,弥补自身的缺失,保证细胞有氧呼吸的顺利进行,但是菌体生长没有恢复到原始菌株的水平。
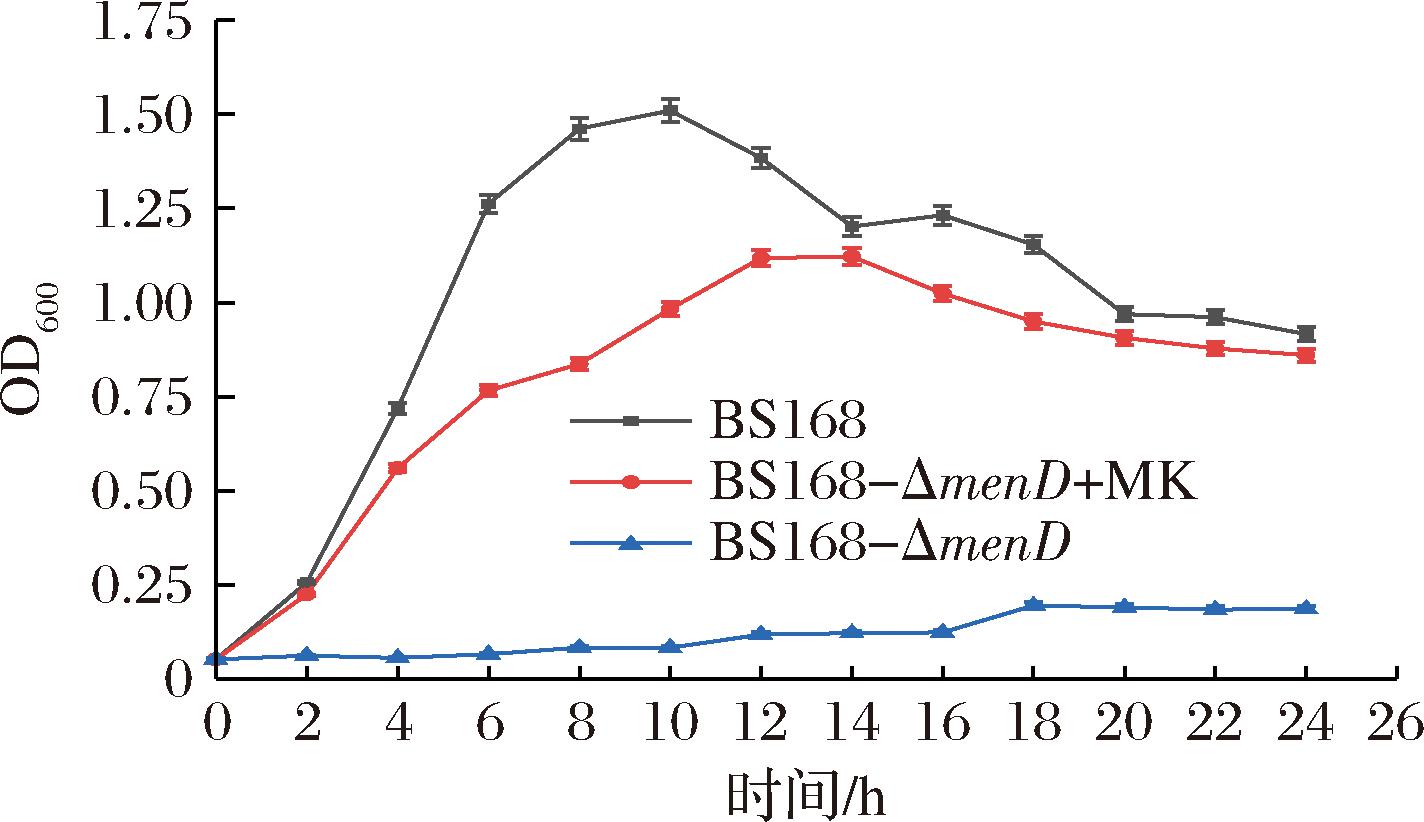
图9 BS168-ΔmenD在LB培养基和LB+MK培养基中生长过程
Fig.9 The cell growth of BS168- ΔmenD in LB medium and LB+MK medium
除MK-7产量外,menD基因表达量的不同对枯草芽孢杆菌菌体生长、生物膜形态也有一定的影响,在重组菌株BS168-P43-menD与BS168-PxylA-menD中,随着menD基因表达量的增加,生物膜的形成与褶皱程度相较于原始菌株都有较大程度的提升,这也证明了menD基因在生物膜形成中的关键作用。关于menD基因与生物膜的形成之间的具体作用关系,其中的原因目前尚不清楚。推测menD基因可能是tapA-sipW-tasA操纵子的调控因子,当menD基因的表达受到影响时,由tapA-sipW-tasA操纵子编码的TasA蛋白纤维受到影响,进而影响生物膜的状态。
生物膜是维持细菌生态稳定的重要基石,是微生物抵御外界环境侵扰的重要条件[24],生物膜的形成也是MK-7合成的重要条件[25],同时,MK-7也是生物质膜的重要组成成分,是特定膜蛋白的糖基化与孢子形成的早期阶段所必须的。实验结果表明,生物膜的状态与MK-7的合成存在一定的正向关联,CUI等[26]发现epsA-C和yqxM-tasA基因的组合性缺失会显著影响生物膜的形成,进而导致MK-7的合成下降,这也证明猜想的正确性。为平衡生产时生物膜与MK-7之间的关系,最近学者提出一种MK-7发酵方式—生物膜反应器[27]。不同于传统的培养方式,生物膜反应器一般是由塑料复合载体组成,浮游微生物可以固定在生物膜反应器的表面,形成生物膜与细胞外基质。生物膜反应器能够在其表面形成成熟且稳定的生物膜,这可以为微生物提供一个稳定环境,同时也可以解决固态发酵和液态发酵在放大培养方面的困难。生物膜可以通过调节细胞膜的组成成分和电子传递,提高MK-7的合成[26],生物膜形态的稳定还可以为MK-7的合成与储存提供一个稳定的平台;生物膜褶皱程度的增加,同样也可以提高生物膜的比表面积,提高微生物与氧气、水分还有营养物质的接触[28];细胞膜上的脂质代谢酶参与维生素K2的合成过程,影响维生素K2的合成效率;维生素K2的合成同样也会对细胞膜的信号转导途径产生影响,从而影响生物膜的合成。
在本实验中,主要是通过启动子的变化来调控原始菌株与BS168-P43-menD和BS168-PxylA-menD之间的基因强度变化差异。启动子是微生物代谢工程中的一个重要组成部分,可以利用启动子特性的不同,定向改造目标菌株,调整目标菌株碳代谢的流向,减少分支代谢途径的消耗,促进产物的合成。目前对于启动子的研究较多,例如受到温度调控的温敏性启动子,受到特定产物诱导的途径特异性启动子,受到细胞密度调控的启动子,CUI等[29]就曾研发出一组受到细胞密度调控的启动子,可以根据细胞密度的变化自发调节调控强度,用以调控MK-7发酵途径中关键基因的表达,最终MK-7产量达到360 mg/L。该方法可以使得微生物根据自身需要自主调控代谢途径的流向,避免因人为干预而造成的代谢失衡。虽然menD基因对于MK-7的生物合成至关重要,但是这并不意味着menD基因的表达强度越高越好,一般来说,基因表达强度过高会导致代谢途径的失衡、功能失调、资源浪费等问题,对菌株的生长和产物合成造成一定程度的负担。因此,在增强menD基因的表达强度以提高MK-7的产量的同时,也应避免对菌株产生的负担;同时,menD基因的表达强度也不应该是固定不变的,应实现对menD基因表达强度的动态调控,以满足不同阶段的需求,实现代谢网络的平衡,这也是本研究后续的研究方向。
枯草芽孢杆菌作为国际公认的食品级安全菌株,不仅具有较快的生长速度,能够进行高密度发酵,同时也具备较强的胞外蛋白分泌能力,最高能达到20 g/L。在枯草芽孢杆菌中可以生产MK-4到MK-8,其中,MK-7的比例可以达到96%。作为MK-7的发酵菌株,枯草芽孢杆菌不仅发酵条件简单,不会产生有毒物质,同时,由于枯草芽孢杆菌无密码子偏好性,因此常常被用来作为异源表达的宿主菌。枯草芽孢杆菌的遗传背景清晰,分子实验操作成熟,是良好的模式菌株[30],存在许多枯草芽孢杆菌数据库如基因数据库SubtuWik(http://subtiwiki.uni-goettingen.de/)、代谢数据库MetaCyc(https://metacyc.org/)、转录调控数据库DBTBS(http://dbtbs.hgc.jp)与BinBrick Box。本实验采用枯草芽孢杆菌作为出发菌株,探究甲萘醌途径中关键基因menD表达强度的差异对维生素K2的影响,这为理解枯草芽孢杆菌代谢途径、实现高产MK-7菌株的构建提供了理论基础与实验依据。
[1] 杨学颖, 赵培佐, 陈杰鹏, 等.维生素K2对心血管疾病作用的研究进展[J].中国微生态学杂志, 2019, 31(9):1110-1116.
YANG X Y, ZHAO P Z, CHEN J P, et al.Progress in research on the effect of vitamin K2 on cardiovascular diseases[J].Chinese Journal of Microecology, 2019, 31(9):1110-1116.
[2] XU J Z, YAN W L, ZHANG W G.Enhancing menaquinone-7 production in recombinant Bacillus amyloliquefaciens by metabolic pathway engineering[J].RSC Advances, 2017, 7(45):28527-28534.
[3] OKANO T, SHIMOMURA Y, YAMANE M, et al.Conversion of phylloquinone (vitamin K1) into menaquinone-4 (vitamin K2) in mice:Two possible routes for menaquinone-4 accumulation in cerebra of mice[J].Journal of Biological Chemistry, 2008, 283(17):11270-11279.
[4] PUCAJ K, RASMUSSEN H, MØLLER M, et al.Safety and toxicological evaluation of a synthetic vitamin K2, menaquinone-7[J].Toxicology Mechanisms and Methods, 2011, 21(7):520-532.
[5] GAO Q X, CHEN H, WANG G Y, et al.Highly efficient production of menaquinone-7 from glucose by metabolically engineered Escherichia coli[J].ACS Synthetic Biology, 2021, 10(4):756-765.
[6] 朱杰, 储岳峰, 李小溪, 等.维生素K摄入对心血管健康作用的研究进展[J].中华老年心脑血管病杂志, 2022, 24(6):664-666.
ZHU J, CHU Y F, LI X X, et al.Research progress on the effect of vitamin K intake on cardiovascular health[J].Chinese Journal of Geriatric Heart Brain and Vessel Diseases, 2022, 24(6):664-666.
[7] SZTERK A, ZMYS OWSKI A, BUS K.Identification of cis/trans isomers of menaquinone-7 in food as exemplified by dietary supplements[J].Food Chemistry, 2018, 243:403-409.
OWSKI A, BUS K.Identification of cis/trans isomers of menaquinone-7 in food as exemplified by dietary supplements[J].Food Chemistry, 2018, 243:403-409.
[8] 熊海涛. 芽孢杆菌启动子的筛选及功能分析[D].南宁:广西大学, 2018.
XIONG H T.Study on the select and functional analysis of Bacillus promoter[D].Nanning:Guangxi University, 2018.
[9] 杨明明. 枯草芽孢杆菌关键遗传调控元件及表达系统的研究[D].杨凌:西北农林科技大学, 2013.
YANG M M.Study on key expression elements and expression system in Bacillus subtilis[D].Yangling:Northwest A&F University, 2013.
[10] 周大袁, 林佳辉, 李霜.利用溶氧调控型启动子Pvgb构建产surfactin的重组枯草芽孢杆菌[J].生物加工过程, 2020, 18(6):690-695.
ZHOU D Y, LIN J H, LI S.Constructing recombinant Bacillus subtilis producing surfactin using aeration-inducible promoter Pvgb[J].Chinese Journal of Bioprocess Engineering, 2020, 18(6):690-695.
[11] YAN X, YU H J, HONG Q, et al.Cre/lox system and PCR-based genome engineering in Bacillus subtilis[J].Applied and Environmental Microbiology, 2008, 74(17):5556-5562.
[12] CHOPRA L, SINGH G, JENA K K, et al.Sonorensin:A new bacteriocin with potential of an anti-biofilm agent and a food biopreservative[J].Scientific Reports, 2015, 5:13412.
[13] LIU Y, DING X M, XUE Z L, et al.Site-directed mutagenesis of UbiA to promote menaquinone biosynthesis in Elizabethkingia meningoseptica[J].Process Biochemistry, 2017, 58:186-192.
[14] WANG X L, MENG S, HAN J S.Morphologies and phenotypes in Bacillus subtilis biofilms[J].Journal of Microbiology, 2017, 55(8):619-627.
[15] SINGH R, PURI A, PANDA B P.Development of menaquinone-7 enriched nutraceutical:Inside into medium engineering and process modeling[J].Journal of Food Science and Technology, 2015, 52(8):5212-5219.
[16] MA Y W, MCCLURE D D, SOMERVILLE M V, et al.Metabolic engineering of the MEP pathway in Bacillus subtilis for increased biosynthesis of menaquinone-7[J].ACS Synthetic Biology, 2019, 8(7):1620-1630.
[17] LUO M M, REN L J, CHEN S L, et al.Effect of media components and morphology of Bacillus natto on menaquinone-7 synthesis in submerged fermentation[J].Biotechnology and Bioprocess Engineering, 2016, 21(6):777-786.
[18] WANG H, SUN X J, WANG L, et al.Coproduction of menaquinone-7 and nattokinase by Bacillus subtilis using soybean curd residue as a renewable substrate combined with a dissolved oxygen control strategy[J].Annals of Microbiology, 2018, 68(10):655-665.
[19] ZHAO C L, WAN Y P, TANG G X, et al.Comparison of different fermentation processes for the vitamin K2 (Menaquinone-7) production by a novel Bacillus velezensis ND strain[J].Process Biochemistry, 2021, 102:33-41.
[20] KONG M K, LEE P C.Metabolic engineering of menaquinone-8 pathway of Escherichia coli as a microbial platform for vitamin K production[J].Biotechnology and Bioengineering, 2011, 108(8):1997-2002.
[21] DAWSON A, CHEN M J, FYFE P K, et al.Structure and reactivity of Bacillus subtilis MenD catalyzing the first committed step in menaquinone biosynthesis[J].Journal of Molecular Biology, 2010, 401(2):253-264.
[22] 李楚, 王晗, 王丽, 等.纳豆芽孢杆菌men基因过表达菌株的构建及提高溶氧强化MK-7合成[J].应用与环境生物学报, 2022, 28(6):1393-1399.
LI C, WANG H, WANG L, et al.Enhancement of MK-7 synthesis by engineered strains of Bacillus subtilis natto that overexpress men genes and by increasing available dissolved oxygen[J].Chinese Journal of Applied and Environmental Biology, 2022, 28(6):1393-1399.
[23] STANBOROUGH T, HO N A T, BULLOCH E M M, et al.Allosteric inhibition of Staphylococcus aureus MenD by 1, 4-dihydroxy naphthoic acid:A feedback inhibition mechanism of the menaquinone biosynthesis pathway[J].Philosophical Transactions of the Royal Society of London.Series B, Biological Sciences, 2023, 378(1871):20220035.
[24] HAN N, MIZAN M F R, JAHID I K, et al.Biofilm formation by Vibrio parahaemolyticus on food and food contact surfaces increases with rise in temperature[J].Food Control, 2016, 70:161-166.
[25] BERENJIAN A, CHAN N L C, MAHANAMA R, et al.Effect of biofilm formation by Bacillus subtilis natto on menaquinone-7 biosynthesis[J].Molecular Biotechnology, 2013, 54(2):371-378.
[26] CUI S X, XIA H Z, CHEN T C, et al.Cell membrane and electron transfer engineering for improved synthesis of menaquinone-7 in Bacillus subtilis[J].iScience, 2020, 23(3):100918.
[27] MAHDINIA E, DEMIRCI A, BERENJIAN A.Implementation of fed-batch strategies for vitamin K (menaquinone-7) production by Bacillus subtilis natto in biofilm reactors[J].Applied Microbiology and Biotechnology, 2018, 102(21):9147-9157.
[28] 周梦洁, 胡汶松, 胡刘秀, 等.枯草芽孢杆菌聚谷氨酸合成途径相关基因功能研究[J].微生物学报, 2023, 63(1):387-402.
ZHOU M J, HU W S, HU L X, et al.Functions of genes involved in polyglutamic acid synthesis in Bacillus subtilis[J].Acta Microbiologica Sinica, 2023, 63(1):387-402.
[29] CUI S X, LYU X Q, WU Y K, et al.Engineering a bifunctional Phr60-Rap60-Spo0A quorum-sensing molecular switch for dynamic fine-tuning of menaquinone-7 synthesis in Bacillus subtilis[J].ACS Synthetic Biology, 2019, 8(8):1826-1837.
[30] 王培立, 王平, 田健, 等.芽胞杆菌高效分泌表达异源蛋白的研究进展[J].生物技术进展, 2015, 5(2):95-102.
WANG P L, WANG P, TIAN J, et al.Advances of efficient secretory expression for heterologous proteins from Bacillus species[J].Current Biotechnology, 2015, 5(2):95-102.