枣(ZiZiphus jujuba)原产自我国,栽培历史悠久,目前已被引入约50个国家,受到人们的广泛喜爱。枣皮薄肉脆,滋味甜美,富含多种维生素和必需氨基酸[1],既可以作为鲜食水果,也可经过加工处理长期保存,具有很高的经济价值和营养价值[2]。但由于枣果实皮薄且含水量较高,在采摘和运输过程易出现机械伤,采后极易发生真菌侵染性病害而造成经济损失。由链格孢菌(Alternaria alternata)引起的黑斑病是枣的主要病害之一,枣果实发病后会在果实赤道部位或果肩处形成黑褐色圆形病斑,病斑皮下组织呈棕褐色软木状并产生凹陷,导致枣果实腐败溃烂,严重影响了枣的经济效益和果实品质。而氨基酸处理枣果实不仅可以有效抑制采后黑斑病的发生,还可以提高果实品质[3-4],并且对人体和环境更加安全环保。
转录因子又称反式作用因子,是一类通过识别并结合基因启动子的顺式作用元件来调控基因表达的蛋白质。APETALA2/乙烯响应因子(APETALA2/ethylene-responsive factor, AP2/ERF)转录因子家族是植物中最大的转录因子家族之一,具有保守的AP2结构域[5],能够特异性识别并结合GCC-box等顺式作用元件,参与对植物胁迫应答反应的调控。如CsERF1B能够积极响应病原菌的侵染并增强柑橘对绿霉病的抗性[6];ZmERF061能够激活防御相关基因表达,提高玉米对玉米大斑病的抗病性[7];水稻中的OsERF83可以增强水稻对稻瘟病菌的抗病性[8]。但是目前关于枣果实中转录因子的研究还比较少,且已有研究集中在果实的成熟着色机制上[9],关于AP2/ERF转录因子调控果实抗病性方面的研究还存在一定的空白,需要进一步的探索。
前期研究发现,蛋氨酸处理枣果实可以增强枣果实对黑斑病的抗病性。转录组学测序(RNA-seq)分析发现,包括ZjERF098在内的19个转录因子显著上调表达[3],这些转录因子可能与枣果实对黑斑病的抗病性增强有关。
因此,本研究基于前期的RNA-seq分析和已有研究基础,筛选到转录因子ZjERF098。对其氨基酸序列、保守结构域、亲缘关系、蛋白质结构、启动子顺式作用元件等进行分析,克隆冬枣基因ZjERF098并构建pN2300-ZjERF098-eGFP、pEAQ-ZjERF098等重组载体,通过亚细胞定位和转录活性分析进一步明确其分子特性,并验证了ZjERF098瞬时过表达对枣黑斑病的抑制效果。为进一步研究冬枣ZjERF098的生物学功能以及枣果实中的AP2/ERF转录因子对生物胁迫的响应机制奠定理论基础。
1 材料与方法
1.1 实验材料
1.1.1 果实材料
采摘自山西太原的冬枣(Ziziphus jujuba Mill.cv.Dongzao)作为果实材料,采摘后直接运输到实验室。挑选无机械伤、大小颜色相近的果实用于后续实验。用2%(体积分数)的NaClO对果实表面消毒后用纯水洗净,晾干后待用。
1.1.2 病原菌
A.alternata为实验室-80 ℃甘油管保藏菌株。活化后在马铃薯葡萄糖(potato dextrose agar, PDA)固体培养基上25 ℃培养7 d,用无菌水洗涤培养基后使用纱布过滤得到A.alternata孢子悬浮液。使用血细胞计数板测定孢子悬浮液的浓度,并稀释至1×104 CFU/mL,作为最终使用浓度。
1.1.3 烟草
本氏烟草种植在西南大学食品科学学院,25 ℃环境条件下培养4~6周,挑选生长状态良好、叶片大小相近的烟草植株用于后续的亚细胞定位实验和转录激活活性验证实验。
1.1.4 载体和感受态细胞
实验所使用的pCAMBIA2300-eGFP(PN2300-eGFP)、pEAQ-BD(pBD)、pEAQ-BD-VP16(pBD-VP16)、pEAQ和TATA-box载体,实验室前期保存;大肠杆菌DH5α感受态细胞,北京擎科生物科技有限公司;农杆菌EHA105感受态细胞,重庆拓世众和生物技术有限公司。
1.2 主要试剂
无水乙醇(分析纯),重庆川东化工(集团)有限公司;NaClO(分析纯)、葡萄糖(分析纯)、牛肉膏,重庆市钛新化工有限公司;酵母浸膏,北京奥博星生物技术有限责任公司;琼脂粉(生物级)、硫酸卡那霉素、利福平,北京索莱宝科技有限公司;MgCl2(分析纯),重庆跃翔化工有限公司;MES monohydrate(分析纯),德国BioFroxx;Age Ⅰ内切酶、BamH Ⅰ内切酶,美国NEB生物科技公司;植物RNA提取试剂盒,湖南艾科瑞生物工程有限公司;琼脂糖、乙酰丁香酮(分析纯)、SanPrep柱式DNA胶回收试剂盒、SanPrep柱式质粒DNA小量抽提试剂盒,生工生物工程(上海)股份有限公司;PrimeScriptTM RT reagent Kit with gDNA Eraser (Perfect Real Time),日本Takara生物科技公司;Phanta® Max Super-Fidelity DNA Polymerase、2×Taq Msster Mix,南京诺唯赞生物科技股份有限公司;双荧光素酶报告基因检测试剂盒,上海翌圣生物科技股份有限公司;Trans2K® DNA Marker,北京全式金生物技术股份有限公司。
1.3 仪器与设备
BXM-30R高压蒸汽灭菌锅,上海博迅仪器有限公司;SW-CJ-1F超净工作台,苏净集团安泰有限公司;Synergy H1全自动酶标仪,美国BioTek仪器有限公司;Tanon 4100凝胶成像仪,上海天能科技有限公司;Min-Sub cell GT电泳仪,美国Bio-Rad公司;WH-2涡旋振荡仪,上海沪西分析仪器厂有限公司;血细胞计数板,上海求精生化试剂有限公司;Tone96G梯度PCR仪,德国耶拿公司;UV-2450紫外分光光度计,海仪电物理光学仪器有限公司;B203生物显微镜,重庆奥特光学仪器有限公司;DHP-9082电热恒温培养箱,上海齐欣科学仪器有限公司;LSM780激光共聚焦显微镜,德国卡尔蔡司公司。
1.4 生物信息学分析
在NCBI(https://www.ncbi.nlm.nih.gov/)中根据Gene ID(LOC107425913)找到ZjERF098的编码区(coding sequence, CDS)序列与氨基酸序列,并从PlantTFDB(http://planttfdb.gao-lab.org/index.php)中下载拟南芥ERF转录因子家族的氨基酸序列,利用MEGA7.0构建系统发育树,分析ZjERF098与拟南芥中ERF转录因子的进化关系。利用DNAMAN6.0对ZjERF098与拟南芥(Arabidopsis thaliana)中进化关系较近的转录因子进行多重序列比对。
在SMART(https://smart.embl-heidelberg.de/)中导入ZjERF098的氨基酸序列在线分析结构域。利用Expasy(https://web.expasy.org/compute_pi/)对蛋白的大小及等电点进行预测。通过PSIPRED(http://bioinf.cs.ucl.ac.uk/psipred/)在线预测ZjERF098蛋白二级结构。通过SWISS-MODEL(https://swissmodel.expasy.org/)对ZjERF098蛋白三级结构进行预测。
启动子一般位于转录起始位点的上游,在NCBI中下载ZjERF098起始密码子前2 000 bp的启动子序列,利用PlantCARE(https://bioinformatics.psb.ugent.be/webtools/plantcare/html/)对启动子区域的顺式作用元件进行分析。
1.5 冬枣果实RNA的提取和cDNA的合成
称取0.25 g蛋氨酸处理48 h后的冬枣果实冻存样品,在液氮中充分研磨。使用RNA提取试剂盒提取冬枣果实总RNA。使用1%的琼脂糖凝胶电泳检测样品RNA的完整性。酶标仪测定RNA浓度,OD260/280在1.8~2.2之间,浓度>200 ng/μL的RNA用于后续互补DNA(complementary DNA, cDNA)的合成。使用日本Takara反转录试剂盒进行反转录,合成cDNA。
1.6 ZjERF098基因的扩增与克隆
根据ZjERF098 CDS区序列设计特异性引物并提交上海生工合成,引物序列见表1。以冬枣果实cDNA为模板,进行PCR扩增,扩增程序见表2。根据DNA Marker比对目的条带,利用SanPrep柱式DNA胶回收试剂盒进行DNA回收纯化,用于后续实验重组载体构建。
表1 本研究所有引物及序列
Table 1 Primers and sequence used in the study

引物名称引物序列(5′-3′)ERF098-FATGGAGGGGAAGAGACAGGGGATERF098-RTTATTGGGTGTTGTTTCCCTGTCCERF098-pBD-FTCGCCGACCGGTAGGCCTATGGAGGG-GAAGAGACAGGGGATERF098-pBD-RAACCAGAGTTAAAGGCCTTTGGGTGT-TGTTTCCCTGTCCpBD-CX-FTATGCCTCTAACATTGAGACpBD-CX-RCTGCTAAACAGGAGCTCACAERF098-PEAQ-FCAAATTCGCGACCGGTATGGAGGGG-AAGAGACAGGGGATERF098-PEAQ-RAGTTAAAGGCCTCGAGTTGGGTGTTG-TTTCCCTGTCCPEAQ-CX-FCTTGACGAGGTATTGTTGCCPEAQ-CX-RCTGCTAAACAGGAGCTCACAERF098-PN2300-eGFP-FATTTACTATTCTAGGGTACCATGGAG-GGGAAGAGACAGGGGATERF098-PN2300-eGFP-RCCATTCTAGACTGCAGTTGGGTGTTG-TTTCCCTGTCCPN2300-eGFP-CX-FCTTGACGAGGTATTGTTGCCPN2300-eGFP-CX-RCCCTCTCCACTGACAGAAAAT
表2 PCR扩增反应体系及程序
Table 2 PCR amplification reaction system and procedure
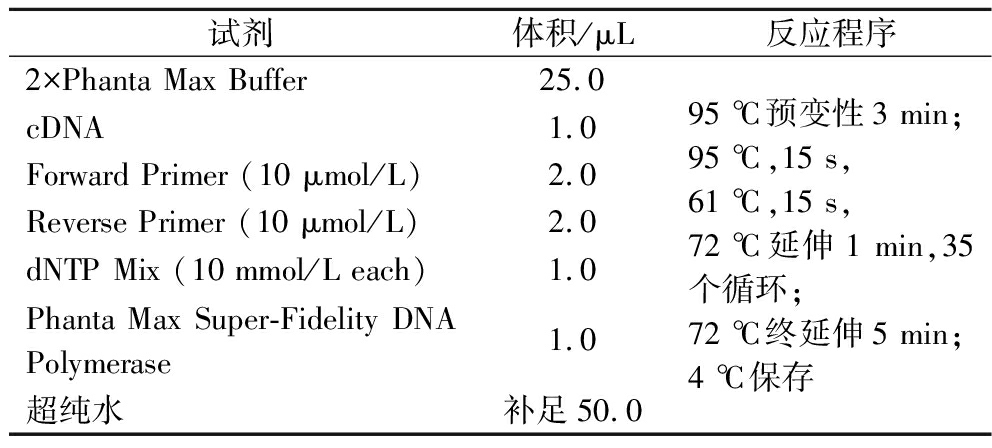
试剂体积/μL反应程序2×Phanta Max Buffer25.0cDNA1.0Forward Primer (10 μmol/L)2.0Reverse Primer (10 μmol/L)2.0dNTP Mix (10 mmol/L each)1.0Phanta Max Super-Fidelity DNA Polymerase1.0超纯水补足50.095 ℃预变性3 min;95 ℃,15 s,61 ℃,15 s,72 ℃延伸1 min,35个循环;72 ℃终延伸5 min;4 ℃保存
1.7 ZjERF098的亚细胞定位
将ZjERF098无终止密码子的CDS区序列构建至携带绿色荧光蛋白的PN2300-eGFP载体,接头引物及测序引物见表1。按照说明书将重组载体转入农杆菌EHA105感受态细胞中作为实验组,PN2300-eGFP空载转入感受态细胞中作为对照组。挑取单菌落通过PCR验证阳性克隆,将正确的农杆菌菌株在28 ℃的条件下振荡培养。过夜振荡后离心收集菌体,使用渗透液(10 mmol/L MgCl2,10 mmol/L MES,0.1 mmol/L乙酰丁香酮)将菌液OD600调至0.5~0.8后避光重悬2 h。使用注射器(无针头)将重悬后的菌液从叶片背面注射进入烟草,培养48~72 h后,利用激光共聚焦显微镜观察荧光信号。
1.8 转录激活活性分析
将不含终止密码子的ZjERF098 CDS区序列构建至pBD载体,所需引物见表1。将含有35S启动子(CaMV35S)的重组质粒作为效应子,带有TATA-box的GAL4-LUC和GAL4-REN双报告基因载体作为报告子,效应子和报告子按照9∶1的比例混合,转化烟草方法同1.7节。阴性对照为pBD空载载体,阳性对照组为VP16植物载体。使用打孔器打取烟草叶片,每个处理组6个平行。试剂盒测定萤火虫荧光素酶(firefly luciferase, LUC)与海肾荧光素酶(renilla luciferase, REN)的比值,以比值表征ZjERF098的转录激活能力。
1.9 ZjERF098瞬时过表达后冬枣果实的发病率及病斑直径测定
果实瞬时过表达方法参考魏邻郦[10]并作修改。将ZjERF098 CDS区序列构建至pEAQ载体,所需引物见表1,农杆菌EHA105转化方法及菌液重悬方法同1.7节,pEAQ空载质粒作为对照组。在冬枣果实果腰处用灭菌后的蓝色枪头均匀地打2个宽3 mm深3 mm的孔,使用无针头的注射器将10 μL重悬菌液注射进果实中。2 h后在旧孔的右边再各打一个新孔,接种10 μL浓度为1×104 CFU/mL的A.alternata孢子悬浮液。每个处理3组平行,每组10个果实,每个果实处理完成后使用PE保鲜袋单独包装,在25 ℃环境下保藏,观察并记录果实的发病率及病斑直径。
2 结果与分析
2.1 ZjERF098转录因子的筛选
蛋氨酸处理枣果实后,RNA-seq分析发现多个转录因子与防御相关基因显著上调表达,枣果实对黑斑病的抗病性增强[3]。AP2/ERF转录因子可以调控防御相关基因的转录表达[5],为了明确AP2/ERF转录因子对果实抗病性的作用,根据基因表达量(图1),筛选到了转录因子ZjERF098。
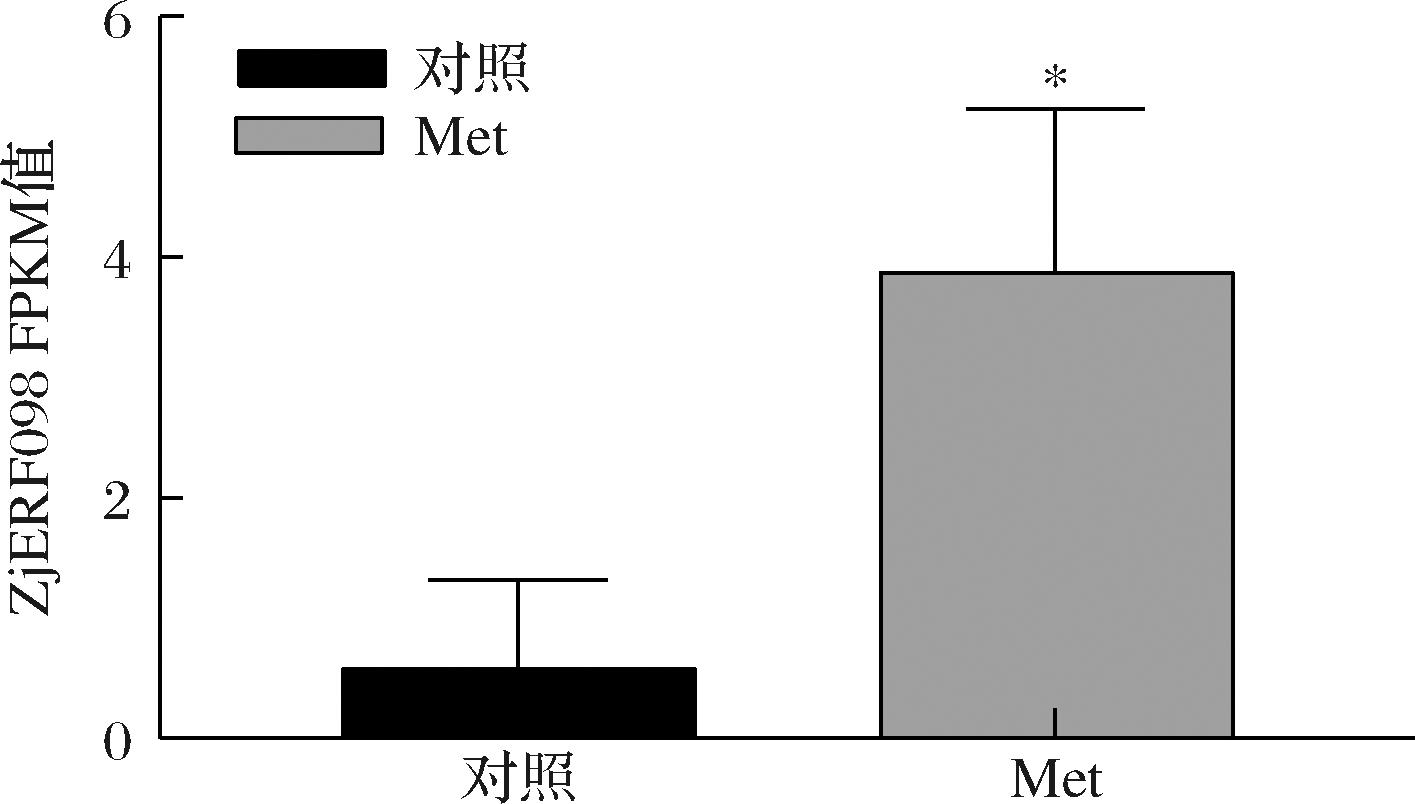
图1 转录组中ZjERF098表达量
Fig.1 Expression of ZjERF098 in RNA-seq
2.2 系统发育树构建与多重序列比对
ZjERF098开放阅读框包含426个碱基对,能够编码141个氨基酸,蛋白分子质量预测为16.1 kDa,理论等电点5.36。ZjERF098与拟南芥中的AtERF098(At3G23230)的序列相似度最高,其次是AtERF097(AT1G04370)、AtERF096(AT3G23220)和AtERF095(AT5G43410)(图2)。

图2 ZjERF098与拟南芥ERF转录因子家族的系统发育树聚类分析
Fig.2 Phylogenetic analysis of ZjERF098 and A.thaliana ERF transcription factors
AP2/ERF转录因子家族根据保守结构域的数量或结构不同,可分为ERF、AP2、DREB、RAV以及Soloist 5个亚族[11]。多序列比对结果表明,ZjERF098与AtERF098和AtERF097具有高度相似性,均只具有1个AP2/ERF转录因子家族保守的AP2结构域(图3-b),属于ERF转录因子亚家族。亲缘关系相近,结构域相似的转录因子往往具有相似的生物学功能,已有研究表明,AtERF098、AtERF096正向调控拟南芥的耐盐性[12-13],AtERF095与AtERF097相互作用正向调控拟南芥的热应激响应过程[14]。因此推测,ZjERF098可能也正向调控宿主对胁迫反应包括病害胁迫的应答过程。

图3 ZjERF098与AtERF098、AtERF097的氨基酸序列比对
Fig.3 Comparison of animo acid sequences of ZjERF098 with AtERF098、AtERF097
2.3 ZjERF098蛋白结构预测
ZjERF098二级结构预测结果显示,占比最高的是无规则卷曲的多肽区段(56.73%),其次是α-螺旋(24.11%)和延伸链(19.14%),ZjERF098编码的蛋白中不存在信号肽与跨膜结构域(图4-a)。保守结构域预测的结果与氨基酸序列比对的结果相同,ZjERF098只含有一个AP2保守结构域(图4-b)。蛋白三级结构预测结果如图4-c所示,全球模型质量估算(global model quality estimate, GMQE)值为0.60,GMQE值一般在0~1,越接近1建模准确度越高,说明结果具有一定的准确性。ZjERF098蛋白三级结构与拟南芥转录因子AtERF096已知的蛋白结构相似,序列同源性为47.62%,这与系统发育树的比对结果一致。
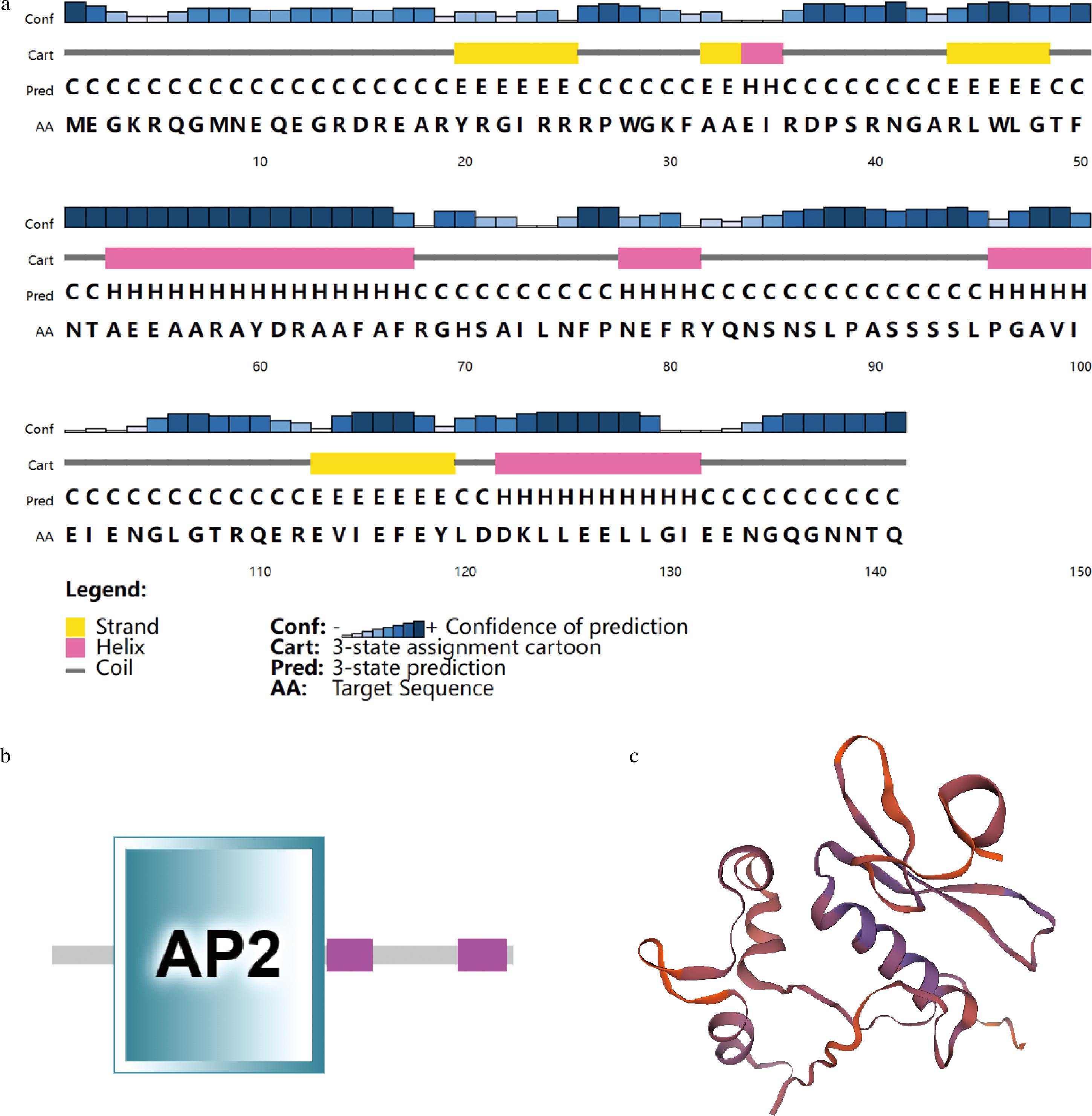
a-ZjERF098蛋白质质二级结构预测;b-ZjERF098保守结构域预测;c-ZjERF098蛋白质三级结构预测
图4 ZjERF098结构分析
Fig.4 Structural analysis of ZjERF098
2.4 ZjERF098启动子顺式作用元件分析
AP2/ERF可作为反应因子响应植物激素信号或通过调控下游靶基因的转录激活来参与植物激素介导的胁迫应答反应[15]。利用PlantCARE对ZjERF098的启动子区域进行分析,顺式作用元件预测结果显示,ZjERF098的启动子区域含有多种植物激素响应顺式元件、光响应元件及富含TC序列的胁迫反应响应元件。
ZjERF098启动子区域含有脱落酸响应元件(abscisic acid responsive elements, ABRE)(表3),ABRE顺式作用元件能够被植物激素脱落酸(abscisic acid, ABA)识别结合,从而参与ABA调控的基因表达。而与ZjERF098亲缘关系相近的AtERF096同样含有ABRE顺式作用元件,正向参与调节拟南芥中的ABA反应[16]。ZjERF098可能在冬枣中同样参与调节ABA反应。
表3 ZjERF098启动子顺式作用元件
Table 3 The cis-acting regulatory elements in the promoter of ZjERF098
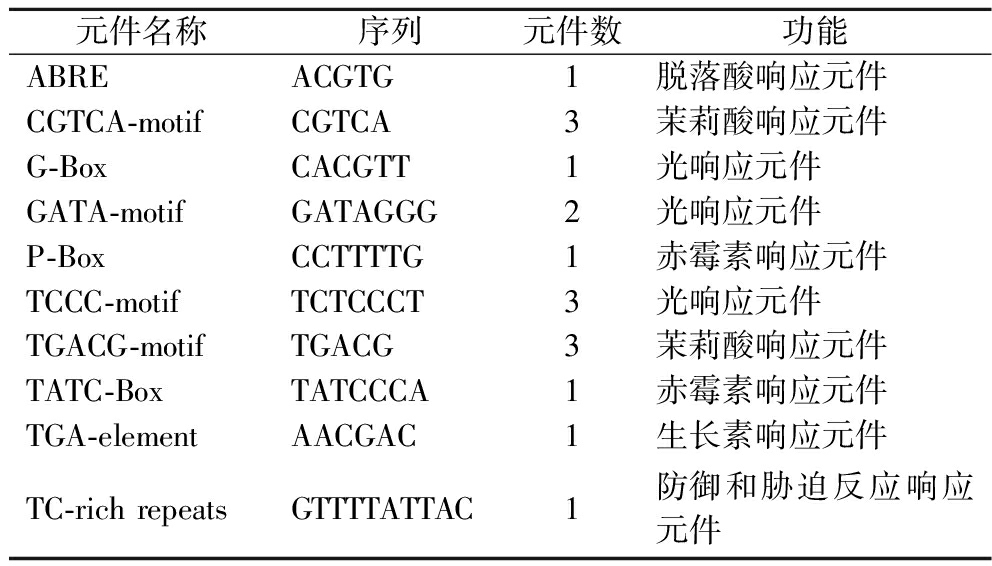
元件名称序列元件数功能ABREACGTG1脱落酸响应元件CGTCA-motifCGTCA3茉莉酸响应元件G-BoxCACGTT1光响应元件GATA-motifGATAGGG2光响应元件P-BoxCCTTTTG1赤霉素响应元件TCCC-motifTCTCCCT3光响应元件TGACG-motifTGACG3茉莉酸响应元件TATC-BoxTATCCCA1赤霉素响应元件TGA-elementAACGAC1生长素响应元件TC-rich repeatsGTTTTATTAC1防御和胁迫反应响应元件
研究表明,一般启动子区域内含有植物激素响应元件的基因均参与或受到该植物激素信号通路的调节。如SIERF.B8是番茄中茉莉酸生物合成途径的重要调节因子[17],VqERF112、VqERF114介导了葡萄中的水杨酸和茉莉酸信号途径,增强了果实对葡萄灰霉病的抗病性[18]。ZjERF098的启动子区域中同样含有茉莉酸响应元件(表3),因此推测ZjERF098可能参与枣果实中茉莉酸信号转导通路。
除此之外,ZjERF098还含有TC-rich repeats,能够响应防御和胁迫应答,这可能是ZjERF098能够参与冬枣对A.alternata的胁迫应答的原因之一。这与宋娜[19]的研究相似,当细菌侵染木薯时,MeERF08等多个ERF转录因子均可响应病原菌的侵染,这些ERF转录因子的启动子区域与ZjERF098的启动子区域相似,均含有胁迫响应元件(表3)。
2.5 ZjERF098基因克隆
以冬枣果实的cDNA为模板,对ZjERF098进行PCR扩增。获得1条在DNA Marker 500 bp左右的条带,与ZjERF098的理论值大小基本一致(图5-a)。DNA回收后送往生工测序,序列与目的基因一致。将ZjERF098基因片段加上特异性黏性末端后,与pEAQ、pBD、PN2300-eGFP线性化载体进行连接转化、并挑选阳性克隆菌(图5-b和图5-c)。测序正确后用于后续实验。
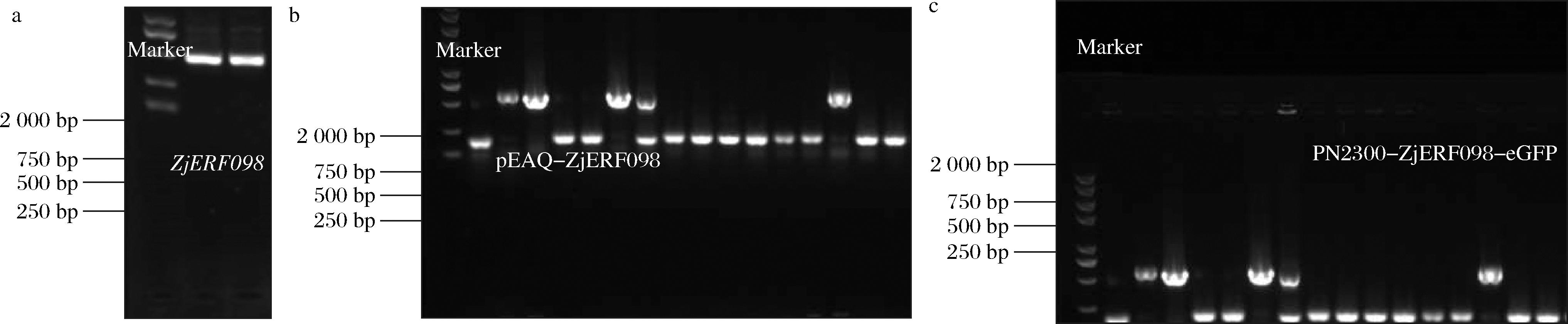
a-ZjERF098基因克隆;b-PN2300-ZjERF098-eGFP阳性克隆菌PCR;c-pEAQ-ZjERF098、pBD-ZjEF098阳性克隆菌PCR
图5 ZjERF098的克隆与载体构建
Fig.5 Cloning and vector construction of ZjERF098
2.6 ZjERF098的亚细胞定位结果
农杆菌转染烟草48 h后进行切片观察。结果发现,转染了PN2300-eGFP的烟草细胞中,在细胞核和细胞膜处均检测到绿色荧光信号,这表明PN2300-eGFP载体在烟草中能够清晰表达,而PN2300-ZjERF098-eGFP融合蛋白在细胞核内可以观察到明显的绿色荧光信号,在细胞质膜可以观察到较弱的荧光信号,由此说明ZjERF098主要定位在细胞核上(图6)。
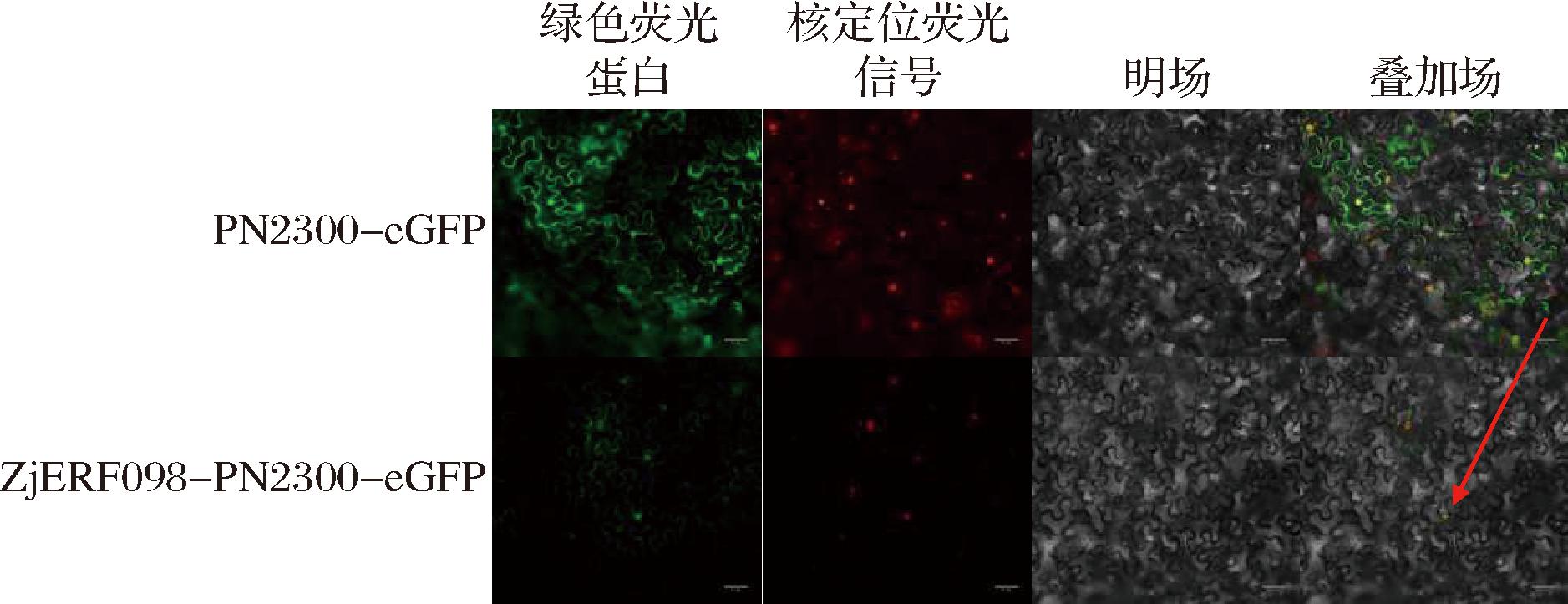
图6 ZjERF098蛋白亚细胞定位
Fig.6 Subcellular localization assay of ZjERF098
2.7 ZjERF098的转录激活能力分析
AP2/ERF转录因子能够通过激活下游靶基因的转录表达从而参与植物的抗病途径。为了验证ZjERF098是否具有转录激活活性,进行了烟草转录激活分析实验。结果如图7所示,VP16组作为阳性对照,pBD组作为阴性对照(图7-a),pBD-ZjERF098和pBD-VP16的LUC/REN的比值显著高于阴性对照组(P<0.01)(图7-b),说明ZjERF098在烟草中具有转录激活活性,在果实中可以通过调控防御相关基因的转录从而参与抗病信号通路。
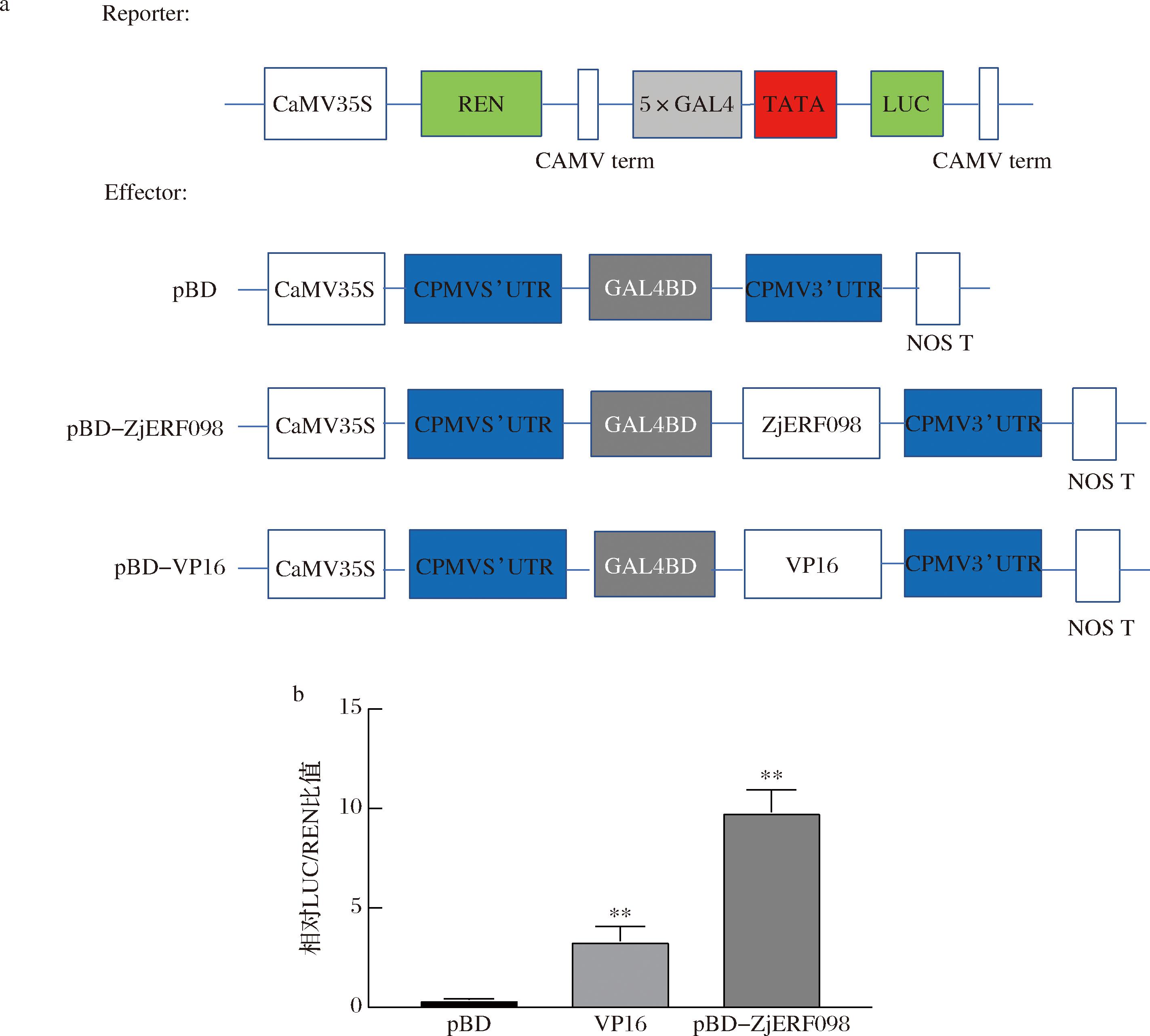
a-报告子与效应子的载体构建;b-ZjERF098在烟草中的转录激活分析(以相对LUC/REN的比值代表ZjERF098的转录激活能力)
图7 ZjERF098在烟草中的转录激活活性分析
Fig.7 Analysis of transcriptional activation of ZjERF098 in toccbo
注:*代表有显著差异,**代表P<0.01。
转录因子一般定位在细胞核来调控靶基因的转录,ZANG等[20]的研究表明,玉米中的ERF转录因子ZmERF105定位在细胞核,是一种转录激活因子,YU等[21]研究发现,小麦基因TaERF-6-3A同样定位在细胞核,具有转录激活活性,这与本研究的结果相似,ZjERF098是主要定位在细胞核上的转录激活因子。菊花中的CmERF4同样属于ERF亚家族,定位于细胞核,但是是一种转录抑制因子[22],推测这可能是不同基因之间的差异导致了转录因子的激活作用和抑制作用不同。
2.8 ZjERF098瞬时过表达对冬枣果实黑斑病抗病性的影响
由于在冬枣果实上难以像烟草或拟南芥等模式植物上进行稳定遗传,所以将ZjERF098 CDS区序列构建至pEAQ载体上并转入农杆菌,利用农杆菌介导瞬时转化实验,以探究ZjERF098在冬枣果实抗黑斑病反应过程中的作用。如图8-c所示,枣果实接种了A.alternata孢子悬浮液出现了黑褐色的圆形或椭圆形病斑,对照组的部分果实病部皮下组织呈凹陷状。如图8-b所示,除了第2天,ZjERF098组果实的病斑直径都显著低于对照组(P<0.01),并且在第7天后,ZjERF098组果实的病斑直径几乎不再扩大。在第2天和第3天,ZjERF098组果实的发病率与对照组相比降低了30%左右,在第4~6天,ZjERF098组果实的发病率都显著(P<0.01)低于对照组(图8-a)。以上结果表明,ZjERF098在冬枣上的过表达后能够显著降低果实的发病率与病斑直径,增强果实对A.alternata的抗病性,延缓果实发病的过程。
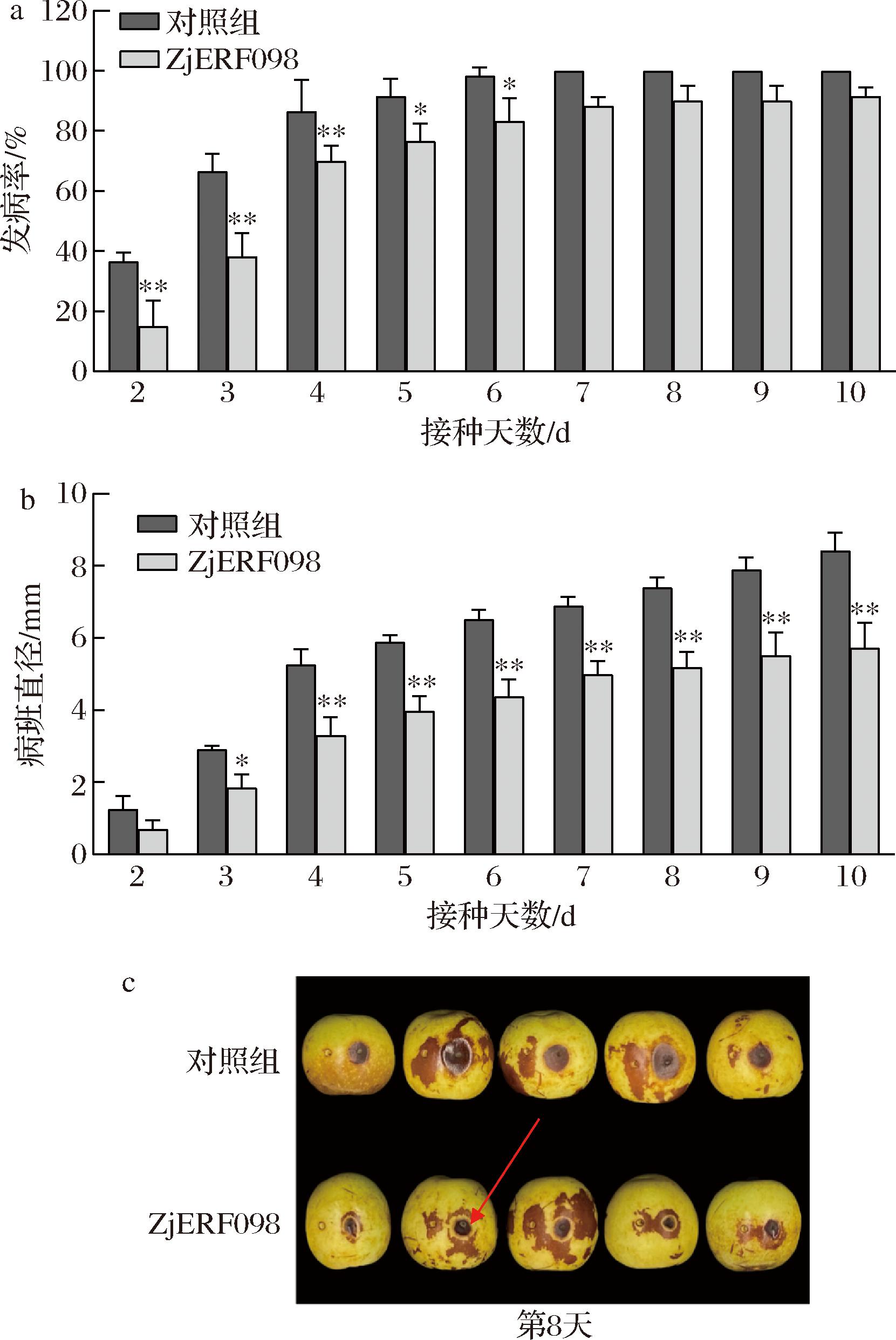
a-ZjERF098瞬时过表达后果实发病率统计;b-ZjERF098瞬时过表达后果实的病斑直径统计;c-发病第8天对照组与实验组果实对比
图8 ZjERF098瞬时过表达对冬枣果实黑斑病发病率与病斑直径的影响
Fig.8 Effect of transient overexpression of ZjERF098 on the incidence and spot diameter of black spot rot of jujube fruit
注:*代表有显著差异,**表示P<0.01;红色箭头标注部分为发病孔与转色果皮之间的“绿环”。
研究发现,果实发病的同时伴随着果皮的转色,ZjERF098瞬时过表达后的冬枣果实在注射过孢子悬浮液的发病孔周围形成了“绿环”与“红环”,“绿环”的出现限制了病斑直径的进一步扩大(图8-c)。而对照组的冬枣果实并没有“绿环”与“红环”交替出现的现象。YUAN等[23]研究表明,水杨酸作为诱导子处理枣果实可以激活果实苯丙烷类生物合成途径,提高了“绿环”中总酚类化合物的积累,以防御A.alternata的侵染,从而限制了黑斑病病斑直径的扩大,这种现象说明,ZjERF098可能激活了苯丙烷类生物合成途径,促进了防御相关化合物的积累。而实验组果实自第5天后,病斑直径不再迅速扩大,发病率几乎不再变化,说明很可能在2~4 d,防御相关的化合物在枣果实中积累,起到抑菌的作用。
AP2/ERF转录因子往往可以激活下游防御相关基因表达,促进防御相关化合物的积累,增强植物对病原菌的抗病性。棉花中的GauERF105过表达能够促进木质素的积累,增强对大丽轮枝菌的抗病性[24]。苹果中的MdERF100通过调控茉莉酸和水杨酸的信号通路的相关基因,提高了拟南芥对白粉病的抗病性[25]。ZjERF098可能通过调控苯丙烷类生物合成途径相关基因的转录表达,促进防御相关化合物的积累,从而增强冬枣对黑斑病的抗病性。
3 结论
ZjERF098属于ERF亚家族,具有AP2保守结构域,无信号肽和跨膜结构域,与参与拟南芥胁迫应答的AtERF098、AtERF096具有相似的生物学功能,是主要定位在细胞核的转录激活因子,具有调控基因转录激活的能力。ZjERF098的启动子区域含有与植物防御反应相关的脱落酸响应元件、茉莉酸响应元件及赤霉素响应元件等多个响应元件,能够响应这些植物激素的信号传导。ZjERF098瞬时过表达能够显著降低果实的发病率与病斑直径,增强果实对A.alternata的抗病性,延缓了果实发病的进程。说明ZjERF098是在枣果实对黑斑病抗病性中起到重要作用的转录因子,为进一步研究枣果实中的AP2/ERF转录因子对生物胁迫的响应机制提供参考。
[1] ZHAO X, ZHANG B B, LUO Z, et al.Composition analysis and nutritional value evaluation of amino acids in the fruit of 161 jujube cultivars[J].Plants, 2023, 12(9):1744.
[2] SOBHANI Z, NIKOOFAL-SAHLABADI S, AMIRI M S, et al.Therapeutic effects of Ziziphus jujuba mill.fruit in traditional and modern medicine:A review[J].Medicinal Chemistry[Shariqah (United Arab Emirates)], 2020, 16(8):1069-1088.
[3] LIU Y, LEI X M, DENG B, et al.Methionine enhances disease resistance of jujube fruit against postharvest black spot rot by activating lignin biosynthesis[J].Postharvest Biology and Technology, 2022, 190:111935.
[4] 常璐璐. 精氨酸处理对采后冬枣黑斑病的抗病作用及其机制研究[D].太原:山西师范大学, 2021.
CHANG L L.Study on arginine treament against Alternaria rot of postharvest jujube and the possible mechanism of diease-resistance[D].Taiyuan:Shanxi Normal University, 2021.
[5] 兰孟焦, 后猛, 肖满秋, 等.AP2/ERF转录因子参与植物次生代谢和逆境胁迫响应的研究进展[J].植物遗传资源学报, 2023, 24(5):1223-1235.
LAN M J, HOU M, XIAO M Q, et al.Research progress of AP2/ERF transcription factors participating in plant secondary metabolism and stress response[J].Journal of Plant Genetic Resources, 2023, 24(5):1223-1235.
[6] LI T, WANG W J, CHEN Q, et al.Transcription factor CsERF1B regulates postharvest Citrus fruit resistance to Penicillium digitatum[J].Postharvest Biology and Technology, 2023, 198:112260.
[7] JIANG L Y, LI M R, LIU X Y, et al.ZmMPK6-1 positively regulates maize resistance to E.turcicum through enhancing ZmERF061 activity[J].Journal of Plant Interactions, 2023, 18(1):2261772.
[8] TEZUKA D, KAWAMATA A, KATO H, et al.The rice ethylene response factor OsERF83 positively regulates disease resistance to Magnaporthe oryzae[J].Plant Physiology and Biochemistry, 2019, 135:263-271.
[9] MUHAMMAD N, LUO Z, ZHAO X, et al.Transcriptome-wide expression analysis of MYB gene family leads to functional characterization of flavonoid biosynthesis in fruit coloration of Ziziphus Mill[J].Frontiers in Plant Science, 2023, 14:1171288.
[10] 魏邻郦. 柑橘果实PAL基因家族的鉴定及其调控绿霉病抗病性的机理[D].重庆:西南大学, 2023.
WEI L L.Genome-wide identification of the CsPAL gene family and their mechanism of regulating resistance to green mold in citrus fruits[D].Chongqing:Southwest University, 2023.
[11] 董晓旭, 贾红卫, 谢世兴, 等.植物AP2/EREBP转录因子及其生物学功能[J/OL].分子植物育种, 2024.https://kns.cnki.net/kcms2/detail/46.1068.S.20230608.1300.002.html.
DONG X X, JIA H W, XIE S X, et al.Plant AP2/EREBP transcription factors and their biological functions[J/OL].Molecular Plant Breeding, 2024.https://kns.cnki.net/kcms2/detail/46.1068.S.20230608.1300.002.html.
[12] WANG X, HOU C, ZHENG K, et al.Overexpression of ERF96, a small ethylene response factor gene, enhances salt tolerance in Arabidopsis[J].Biologia Plantarum, 2017, 61(4):693-701.
[13] ZHANG Z J, WANG J, ZHANG R X, et al.The ethylene response factor AtERF98 enhances tolerance to salt through the transcriptional activation of ascorbic acid synthesis in Arabidopsis[J].The Plant Journal, 2012, 71(2):273-287.
[14] HUANG J Y, ZHAO X B, BÜRGER M, et al.Two interacting ethylene response factors regulate heat stress response[J].Plant Cell, 2021, 33(2):338-357.
[15] 李皎琪, 李美琪, 王玉婷, 等.果蔬逆境胁迫应答中AP2/ERF转录因子的激素调控研究进展[J/OL].食品科学, 2024.https://link.cnki.net/urlid/11.2206.TS.20231010.0834.002.
LI J Q, LI M Q, WANG Y T, et al.Research process on hormone regulation of AP2/ERF transcription factors in response to stress in fruit and vegetables[J/OL].Food Science, 2024.https://link.cnki.net/urlid/11.2206.TS.20231010.0834.002.
[16] WANG X P, LIU S D, TIAN H N, et al.The small ethylene response factor ERF96 is involved in the regulation of the abscisic acid response in Arabidopsis[J].Frontiers in Plant Science, 2015, 6:1064.
[17] DING F, WANG C, XU N, et al.The ethylene response factor SlERF.B8 triggers jasmonate biosynthesis to promote cold tolerance in tomato[J].Environmental and Experimental Botany, 2022, 203:105073.
[18] 王岚. 中国野生毛葡萄转录因子ERF调控抗病相关基因的研究[D].杨凌:西北农林科技大学, 2019.
WANG L.ERF transcription factors regulate the expression of the disease resistance genes in Chinese wild Vitis quinquangularis[D].Yangling:Northwest A&F University, 2019.
[19] 宋娜. 木薯MeERFs转录因子调控的抗病通路初步分析[D].海口:海南大学, 2020.
SONG N.Preliminary analysis of disease resistance pathway regulated by MeERFs transcription factors in cassava[D].Haikou:Hainan University, 2020.
[20] ZANG Z Y, LV Y, LIU S, et al.A novel ERF transcription factor, ZmERF105, positively regulates maize resistance to Exserohilum turcicum[J].Frontiers in Plant Science, 2020, 11:850.
[21] YU Y, YU M, ZHANG S X, et al.Transcriptomic identification of wheat AP2/ERF transcription factors and functional characterization of TaERF-6-3A in response to drought and salinity stresses[J].International Journal of Molecular Sciences, 2022, 23(6):3272.
[22] LI C W, WANG L K, SU J S, et al.A group VIIIa ethylene-responsive factor, CmERF4, negatively regulates waterlogging tolerance in Chrysanthemum[J].Journal of Experimental Botany, 2024, 75(5):1479-1492.
[23] YUAN S Z, DING X Y, ZHANG Y N, et al.Characterization of defense responses in the ‘green ring’ and ‘red ring’ on jujube fruit upon postharvest infection by Alternaria alternata and the activation by the elicitor treatment[J].Postharvest Biology and Technology, 2019, 149:166-176.
[24] WANG Y Q, UMER M J, CAI X Y, et al.Dynamic characteristics and functional analysis provide new insights into the role of GauERF105 for resistance against Verticillium dahliae in cotton[J].BMC Plant Biology, 2023, 23(1):501.
[25] ZHANG Y P, ZHANG L, MA H, et al.Overexpression of the apple (Malus × domestica) MdERF100 in Arabidopsis increases resistance to powdery mildew[J].International Journal of Molecular Sciences, 2021, 22(11):5713.