啤酒是一种受大众欢迎的低酒精饮料,其营养物质丰富。啤酒以麦芽和水为主要原料,经过糖化后加入酒花或者酒花制品进行煮沸,再经酵母发酵而制成,是一种含CO2、易起泡的发酵酒。啤酒中的多酚类物质对啤酒的非生物稳定性、风味稳定性、色泽和口感等均有影响。此外,多酚作为一类抗氧化物质,可以清除体内自由基,对人体组织细胞起保护作用[1]。糖化是啤酒生产中的重要环节,通过调节温度至内源酶的最适温度并保温一定时间,促进麦芽粉碎后的不溶物转变为水溶性物质,使羟基肉桂酸(hydroxycinnamic acid, HCA)类物质分解溶出[2],对麦汁的物质组成及色泽产生直接影响,进而影响啤酒品质。
阿魏酸、咖啡酸、对香豆酸是啤酒中代表性的HCA类成分,是啤酒中重要的抗氧化物质及风味前体。HCA类成分可以通过清除自由基和金属鳌合机制来延迟氧化。例如,阿魏酸可以有力清除过氧化氢、超氧自由基、羟自由基等,从而提高啤酒的内源性抗氧化力而防止啤酒氧化变质[3]。另外,HCA类成分与啤酒的感官特性密切相关。一些HCA类成分在麦汁糖化过程中,随着温度的升高脱羧转化成4-乙烯基苯酚、4-乙烯基愈创木酚等乙烯基化合物,从而产生小麦啤酒独特香气[2]。三环和四环异-α-酸降解产物是造成啤酒苦味的主要因素,而阿魏酸衍生物的抗氧化性能可以减缓异-α-酸的降解[4]。
在啤酒酿造的关键工艺糖化过程中,酚类物质不断溶出,连续发生美拉德反应,抗氧化能力有所提升[5],但麦汁糖化过程中HCA衍生物的动态变化规律研究尚不充分。因此,本研究通过分析麦汁糖化过程中不同存在形式的多酚含量、抗氧化能力、HCA类衍生物组分及含量的变化,探究HCA衍生物在麦汁糖化过程中的变化规律,以期为高品质啤酒开发及工艺优化提供参考依据。
1 材料与方法
1.1 实验材料
1.1.1 材料与试剂
大麦芽(pilsner,500 g)、小麦芽(wheat pale,500 g),德国维耶曼公司;DPPH、ABTS,上海阿拉丁生化科技股份有限公司;甲醇、乙酸乙酯、浓盐酸、福林酚、过硫酸钾、没食子酸、奎诺二甲基丙烯酸酯(Trolox),国药集团化学试剂有限公司。
1.1.2 仪器与设备
AB204-N电子天平,Mettler Toledo仪器(上海)有限公司产品;5804R台式高速冷冻离心机、5430R台式冷冻离心机,德国Eppendorf公司;R-205旋转蒸发仪,上海申顺生物科技有限公司;HH-3A恒温水浴锅,常州国华电器有限公司;Synergy H4多功能酶标仪,美国Biotek公司;XH-C旋涡混合器,无锡沃信仪器制造有限公司。
1.2 实验方法
1.2.1 游离型多酚的提取
参考金舟等[6]的方法稍作改动,具体方法如下:准确称取粉碎后的1.00 g大麦芽(或小麦芽),按照1∶20的料液比加入20.0 mL的80%(体积分数,下同)的丙酮溶液,在室温下,利用超声提取15 min。4 ℃下离心10 min(3 500 r/min),分离上清液,重复操作2次。利用0.22 μm微孔膜过滤收集的全部上清液,50 ℃下减压旋转蒸发至干,然后用10.0 mL甲醇复溶后,放在4 ℃的冰箱中保存待用。
1.2.2 结合型多酚的提取
参考OKARTER等[7]的方法,从游离型酚类化合物提取后的残余物中提取结合型酚类化合物。具体方法如下:在上述残余物中再加30.0 mL 2.0 mol/L的NaOH溶液,避光条件下消化3 h,用盐酸调pH值为1.5~2.0。加入10.0 mL正己烷避光摇动30 min后,在4 ℃下3 500 r/min离心10 min,弃去上清液。然后加20.0 mL乙酸乙酯至剩余沉淀中,避光摇动15 min后,于4 ℃下3 500 r/min离心10 min,取上清液,重复2次。利用0.22 μm微孔膜过滤全部上清液后,在40 ℃下减压蒸发至干,再利用10.0 mL甲醇复溶后,放在4 ℃的冰箱中保存待用。
1.2.3 麦汁的制备
参考韩治磊[8]的方法制备麦汁。将大麦芽用粉碎机粉碎,密封后储存在室温下,待用。量取700 mL去离子水于烧杯中,恒温水浴加热至48 ℃后保温,再准确称取大麦芽粉末70 g,加入其中进行糖化,糖化工艺条件为:45 ℃(30 min)→52 ℃(40 min)→62 ℃(30 min)→72 ℃(20 min)→80 ℃(5 min)。第一次取样在投料结束后立即进行,之后的取样在每个温度保温结束后进行,每次取样量不少于60 mL,取样后,在4 ℃下3 500 r/min离心30 min,取上清液,每个样品分装成10 mL和50 mL两份,储存在4 ℃的冰箱中待用。取样点的设置见图1,即A、B、C、D、E、F 6个取样点。
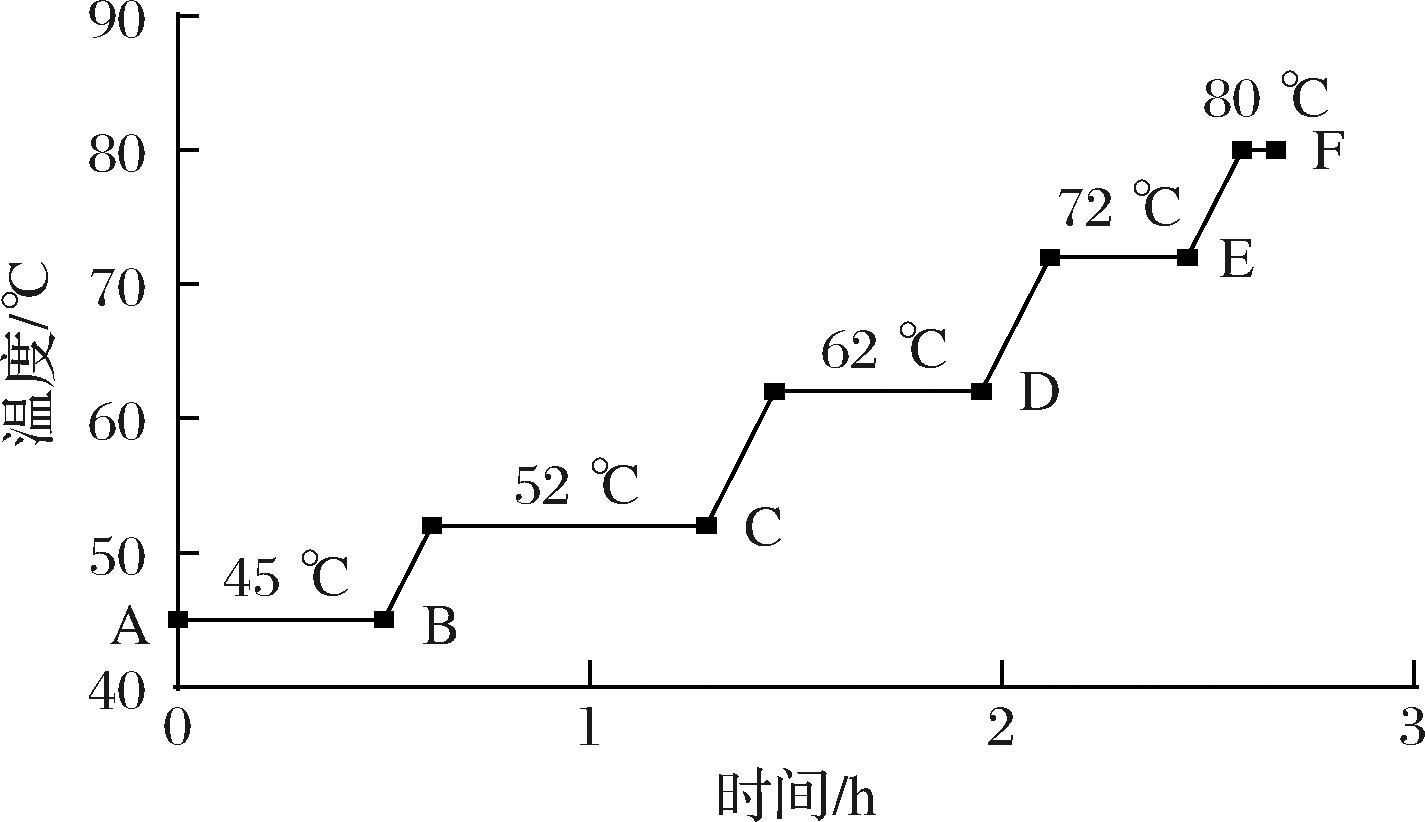
图1 糖化阶段温度-时间曲线和取样点
Fig.1 Temperature-time curve and sampling point during saccharification process
1.2.4 麦汁样品的提取
参考董文乐等[9]的方法。用量筒分别量取50.0 mL的麦汁和50.0 mL的乙酸乙酯,依次加入分液漏斗中避光摇晃提取,然后静置20 min,取乙酸乙酯层。重复2次,将全部乙酸乙酯层少量多次地移至100 mL心形瓶中,利用旋转蒸发仪,在40 ℃恒温水浴中减压旋转蒸发至干。用2 mL甲醇将干物质复溶后用旋转蒸发仪减压浓缩至蒸干,避光保存在-18 ℃冰箱待测。
1.2.5 总酚含量的测定
采用Folin-Ciocalteu法测定样品中的总酚含量[10]。取0.5 mL稀释后的麦汁样品,加入2.5 mL的10倍稀释的福林酚溶液,旋涡混匀后避光反应5 min,再加入2 mL 7.5% Na2CO3溶液,混匀后避光静置反应60 min后取200 μL于96孔板中,于765 nm波长下测吸光度。以0.5 mL甲醇作为对照。以没食子酸制定标准曲线,为y=5.510 1x+0.012 3(R2=0.998 3)。总酚含量以每毫升麦汁所含的没食子酸当量表示,单位为mg/mL。
1.2.6 抗氧化能力测定
DPPH自由基清除活性的测定参考SZWAJGIER[11]的方法。取100.0 μL稀释后的麦汁样品,加入2.9 mL 0.06 mmol/L的DPPH自由基甲醇溶液,混匀后避光反应60 min,取200 μL于96孔板中,于517 nm波长下测吸光度。以甲醇作为对照,Trolox为标样制定标准曲线,抗氧化能力用抗氧化指标(trolox equivalent antioxidant capacity,TEAC)表示,单位为每克麦汁所含Trolox当量(TE),即μmol TE/g。
ABTS阳离子自由基清除活性的测定参考张江涛等[12]的方法。配制7 mmol/L ABTS和2.45 mmol/L K2S2O8水溶液,用去离子水混合定容至10 mL后避光放置16 h。使用时,用去离子水作对照,在734 nm波长下,稀释该溶液至吸光度值在0.70±0.02。取70 μL稀释后的麦汁样品,加入2.93 mL ABTS溶液,混匀后避光反应6 min,取200 μL 于96孔板中,于734 nm波长下测定。以去离子水作为对照,Trolox为标样制定标准曲线,抗氧化能力用TEAC表示,单位为μmol TE/g。
1.2.7 麦汁样品的超高效液相色谱-四极杆-飞行时间质谱(ultra-high performance liquid chromatography-quadrupole-time-of-flight mass spectrometry,UPLC-Q-TOF MS)分析
将1.2.3节中制备的样品,用甲醇配制成1.0 mg/mL进样分析,每组3个重复样品。色谱条件:色谱柱为Agilent Zorbax Eclipse Plus C18 (2.1 mm×150 mm,1.8 μm),柱温35 ℃。流动相(A):含0.1%(体积分数)甲酸水溶液,流动相(B):乙腈,流速0.3 mL/min,经优化后的梯度洗脱程序为:0~20 min,5%~100% B;20~23 min,100% B;23~23.01 min,100%~5% B;23.01~27 min,5%。
质谱检测在Waters SYNAPT G2-Si HDMS飞行时间质谱检测器上进行,采用电喷雾离子源。数据采集通过fast-DDA采集模式在正离子模式下进行。质谱条件为:干燥气流量800 L/h;干燥气温度400 ℃;离子源温度120 ℃;毛细管电压,正离子模式为3.0 kV,负离子模式为2.5 kV;锥体电压40 V;源偏移量80 V;锥孔气流量50 L/h。Fast-DDA模式下的参数设置如下:质量扫描范围,m/z 50~1 500 Da;MS和MS/MS扫描速率0.2 s;单次MS扫描中MS/MS扫描的数量5个;动态排除时间6 s;碰撞能设置,低质量碰撞能为10~40 V,高质量碰撞能为40~120 V。质谱数据使用LockSprayTM,通过不断注入外部参照物亮氨酸-脑啡肽溶液进行校准,流速设置为7 μL/min,正离子模式下的质量为m/z 556.277 1。
1.2.8 全球天然产物(global natural products social,GNPS)分子网络构建
质谱数据的原始文件通过FileZilla软件转换为mzXML格式文件,再将mzXML格式的文件导入到MZmine2.39,得到各个样品的总离子流图。将转换为mzXML格式的文件上传至GNPS网站,进一步构建分子网络,设置的参数如下:前体离子容差为0.2 Da,碎片离子容差为0.02 Da,检索分子质量差异为100以内的同系物,其他参数均采用网站上的默认值。将分子网络结果导出为Cytoscape数据,用Cytoscapev.3.8.2软件对结果进行可视化分析处理。
1.3 数据统计分析
用SPSS 23.0软件进行数据统计分析,Graphpad Prism 8.0软件作图,实验数据至少重复3次,以“平均值±标准差”来表示,采用Dunca多重比较检验,以P<0.05表示显著性差异,P>0.05表示无显著性差异。
2 结果与分析
2.1 原料大麦芽和小麦芽中多酚含量及抗氧化能力评价
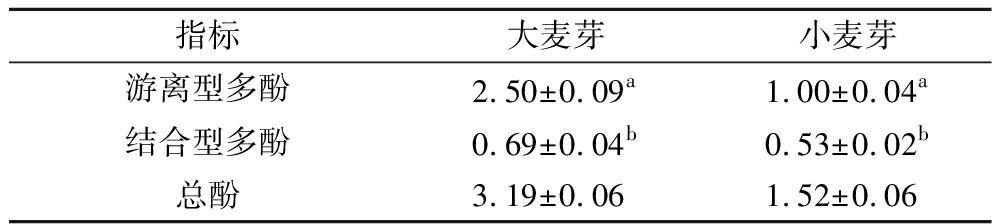
大麦芽和小麦芽中多酚的含量受麦芽品种和提取工艺的影响。本研究中使用的麦芽多酚含量如表1所示。大麦芽和小麦芽中游离型多酚都显著高于结合型多酚(P<0.05),这与李苇舟等[13]的研究结果一致。大麦芽中游离型多酚的含量是小麦芽的1.5倍,而两者结合型多酚的含量相差不多。该结果比陆健等[3]所测得的大麦芽中游离型多酚含量高,这可能是由于文献方法直接利用80%丙酮进行单次超声辅助提取1 h,而本实验利用80%丙酮分3次进行超声辅助提取,每次20 min,使得多酚的浸出效果更好。
表1 啤酒原料中多酚含量 单位:mg/g
Table 1 Polyphenol contents in raw materials of beer
指标大麦芽小麦芽游离型多酚2.50±0.09a1.00±0.04a结合型多酚0.69±0.04b0.53±0.02b总酚3.19±0.061.52±0.06
注:同列肩标不同的小写字母表示具有显著性差异(P<0.05)(下同)。
采用DPPH自由基和ABTS阳离子自由基清除活性方法评价大麦芽和小麦芽中游离型和结合型多酚的抗氧化能力,结果见表2。与多酚的含量一致,两种评价方法均显示大麦芽中游离型多酚的抗氧化能力大于结合型多酚(P<0.05);而小麦芽中DPPH自由基清除活性与ABTS阳离子自由基清除活性相反,小麦芽结合型多酚表现出更强的ABTS阳离子自由基清除活性。此外,与结合型多酚的含量一致,大麦芽、小麦芽中结合型多酚的抗氧化能力相差不多。上述结果也与陆健等[3]研究结果一致。需要注意的是,DPPH自由基和ABTS阳离子自由基清除活性机制存在差异,分别适用于醇溶性成分、水溶性成分的抗氧化能力评价。
表2 啤酒原料中多酚抗氧化能力 单位:μmol TE/g
Table 2 Antioxidant capacity of polyphenols in raw materials of beer
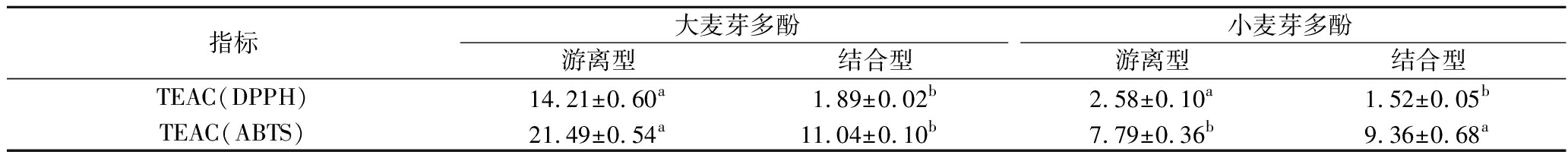
指标大麦芽多酚小麦芽多酚游离型结合型游离型结合型TEAC(DPPH)14.21±0.60a1.89±0.02b2.58±0.10a1.52±0.05bTEAC(ABTS)21.49±0.54a11.04±0.10b7.79±0.36b9.36±0.68a
2.2 糖化阶段麦汁总酚含量变化和抗氧化能力评价
麦汁在糖化过程中多酚含量变化见图2。在糖化开始阶段,从开始保温(A点)到52 ℃保温结束(C点),随着时间的增加,麦汁中多酚的含量显著性增加(P<0.05),这可能是由于麦芽中多酚从结合酯转化为游离态。在52 ℃到80 ℃这段时间(C点至F点),麦汁中多酚的含量变化不明显(P>0.05),这与陈晓梦[5]的研究结果基本一致。麦汁总酚含量的动态变化可能与糖化过程中内源性酶系、温度及氧化作用相关。例如,酯结合的HCA释放到麦芽汁中主要发生在糖化过程中。在肉桂酰酯酶作用下,HCA从木聚糖亚基中被释放,使其可用于进一步代谢[14]。
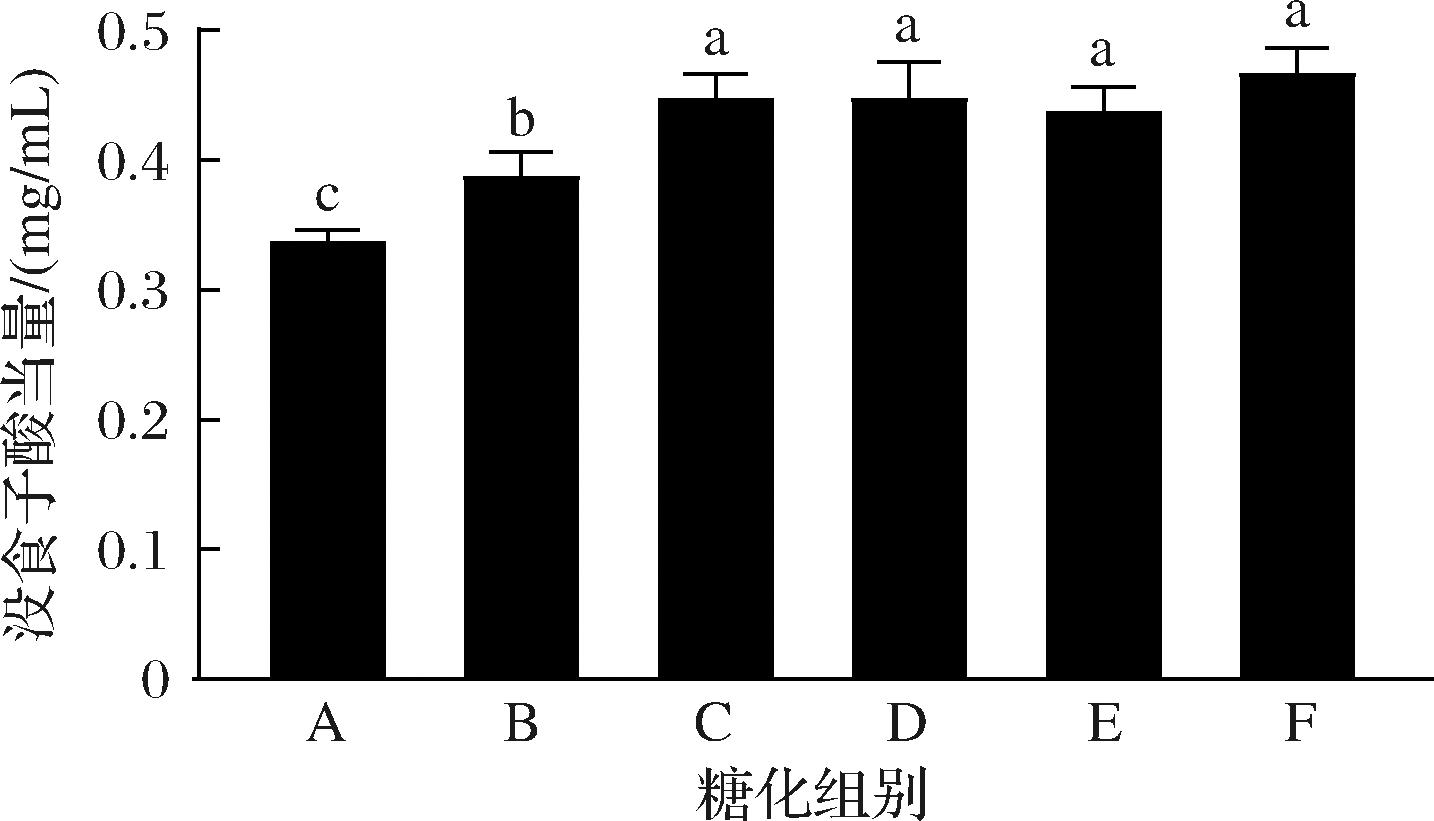
图2 糖化阶段麦汁样品多酚含量
Fig.2 Polyphenol content in wort during saccharification process
注:不同小写字母表示数据之间具有显著性差异(P<0.05)(下同)。
对糖化各个阶段的麦汁进行DPPH自由基、ABTS阳离子自由基清除活性评价,结果如图3所示。糖化过程中,麦汁自由基清除活性呈现先升高后降低的趋势。其中,从45 ℃保温开始(A点)到52 ℃保温结束(C点),为DPPH自由基清除活性的上升阶段;从45 ℃保温开始(A点)到62 ℃保温结束(D点),为ABTS阳离子自由基清除能力的上升阶段。该趋势与图2麦汁样品中酚类化合物含量的变化趋势一致,表明DPPH自由基、ABTS阳离子自由基清除活性与麦汁中多酚的含量存在相关性。在麦汁糖化的后半阶段(E、F点),麦汁DPPH自由基、ABTS阳离子自由基清除活性与D点相比稍有下降,但不存在显著差异(P>0.05),这与相应阶段麦汁中多酚水平存在一致性,也与李崎等[15]的研究结果基本一致。
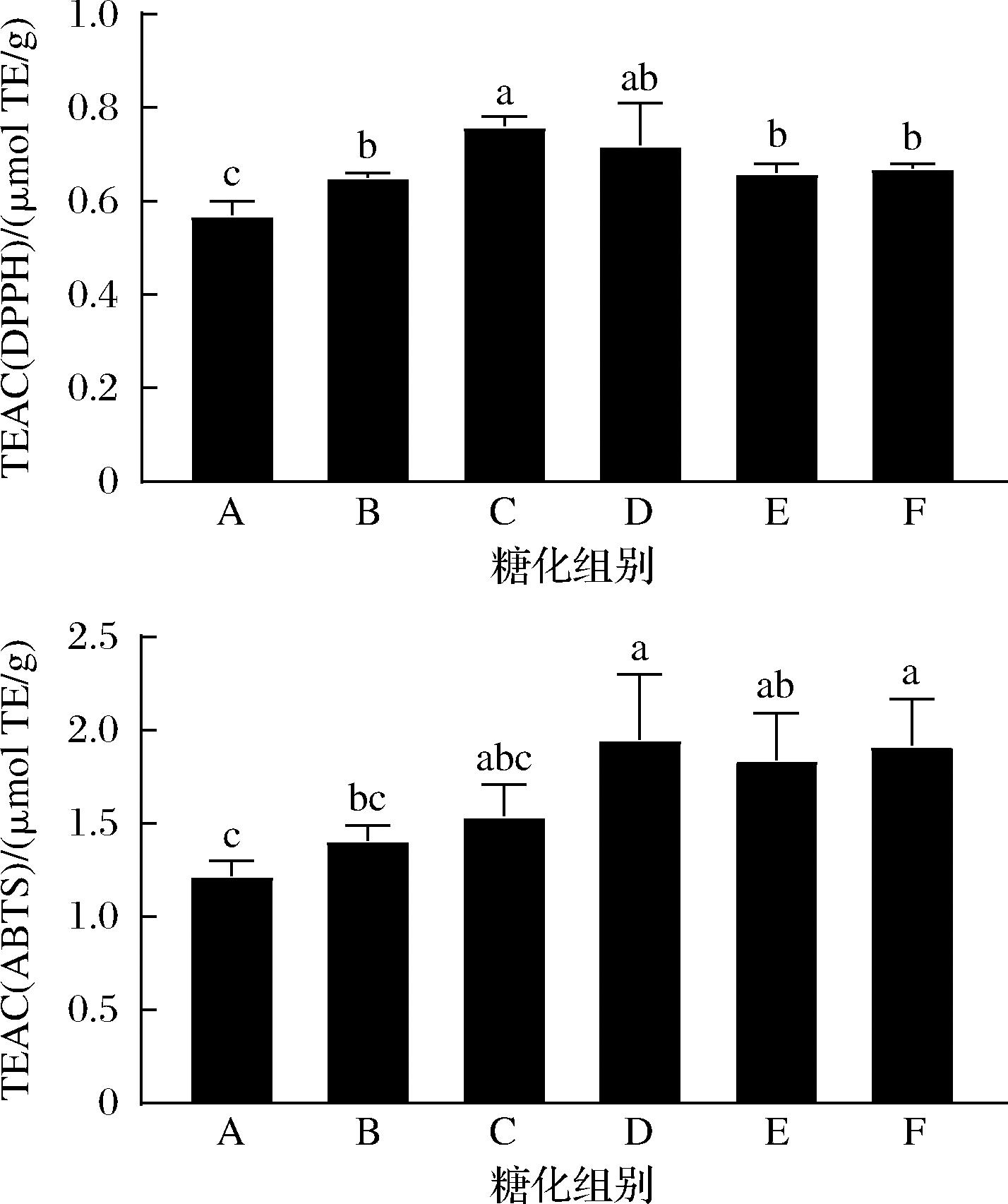
图3 糖化阶段麦汁抗氧化活性
Fig.3 Antioxidant activities of wort during saccharification process
2.3 麦汁全球天然产物社交分子网络的构建与分析
GNPS分子网络是基于串联质谱数据的化学可视化技术,可以显示质谱准分子离子之间的化学关系[16]。分子网络技术的一个显著性优点是可以在不知道样品化学物质组成的前提下探索大量的MS/MS质谱,且其是通过将质谱与GNPS数据库进行比对鉴定,方便快速。通过分析各糖化阶段样品的超高效飞行时间串联质谱数据的相似性,构建了GNPS分子网络(图4),并与GNPS网站数据库标准物质图谱进行匹配,其中准确匹配到化合物87个,包括N-脯氨酰苯丙氨酸、N-脯氨酰色胺酸等氨基酸、肽类,亚油酸、9,12-十八碳二烯酸等脂肪酸类,水苏糖、麦芽三糖等糖类,吲哚乙酰胺、3-吲哚甲醛等吲哚类,PE(22∶4/0∶0)、PC(20∶5/0∶0)等磷脂类,小麦黄素(5)、羟基芫花素(6)、5,7,2′-三羟基黄酮(7)、异牡荆苷(8)、表儿茶素(9)、宝藿苷I(10)、异鼠李素(11)等黄酮和黄酮苷类,阿魏酸(1)、咖啡酸(2)、对香豆酸(3)、芥子酸(4)等HCA等不同结构类别。虽然黄酮类成分具有共同的2-苯基色原酮母核结构,但在分子网络中各黄酮化合物(5~11)普遍以单点的形式存在,没有聚合成簇,这与前期对植物提取物中黄酮类成分的分子网络分析结果类似[17],推测黄酮类成分的二级质谱裂解容易受取代基团影响,呈现多样化的裂解形式。在分子网络中,HCA类成分主要集中在3个簇中(图4蓝色方框),表明该类成分的二级质谱裂解具有较强的相似性。此外,分子网络还匹配到832条类似物信息,其中包括27个HCA类衍生物(图5)。这些衍生物(13~39)的基本结构包括阿魏酸、咖啡酸、对香豆酸,以阿魏酸衍生物为主,包括阿魏酸缀合物(13~21)、阿魏酰胺缀合物(22~26)、阿魏酸酯缀合物(27~31),这也进一步说明麦汁糖化过程中阿魏酸类成分的化学多样性。郝建秦等[18]和QUIFER-RADA等[19]研究表明,麦汁糖化过程中产生丰富、多样的阿魏酸类成分。阿魏酸、咖啡酸、对香豆酸、芥子酸、表儿茶素、小麦黄素、5,7,2′-三羟基黄酮、宝藿苷I、异鼠李素、异牡荆苷与文献报道一致[20],羟基芫花素则是首次从麦汁中检测到。
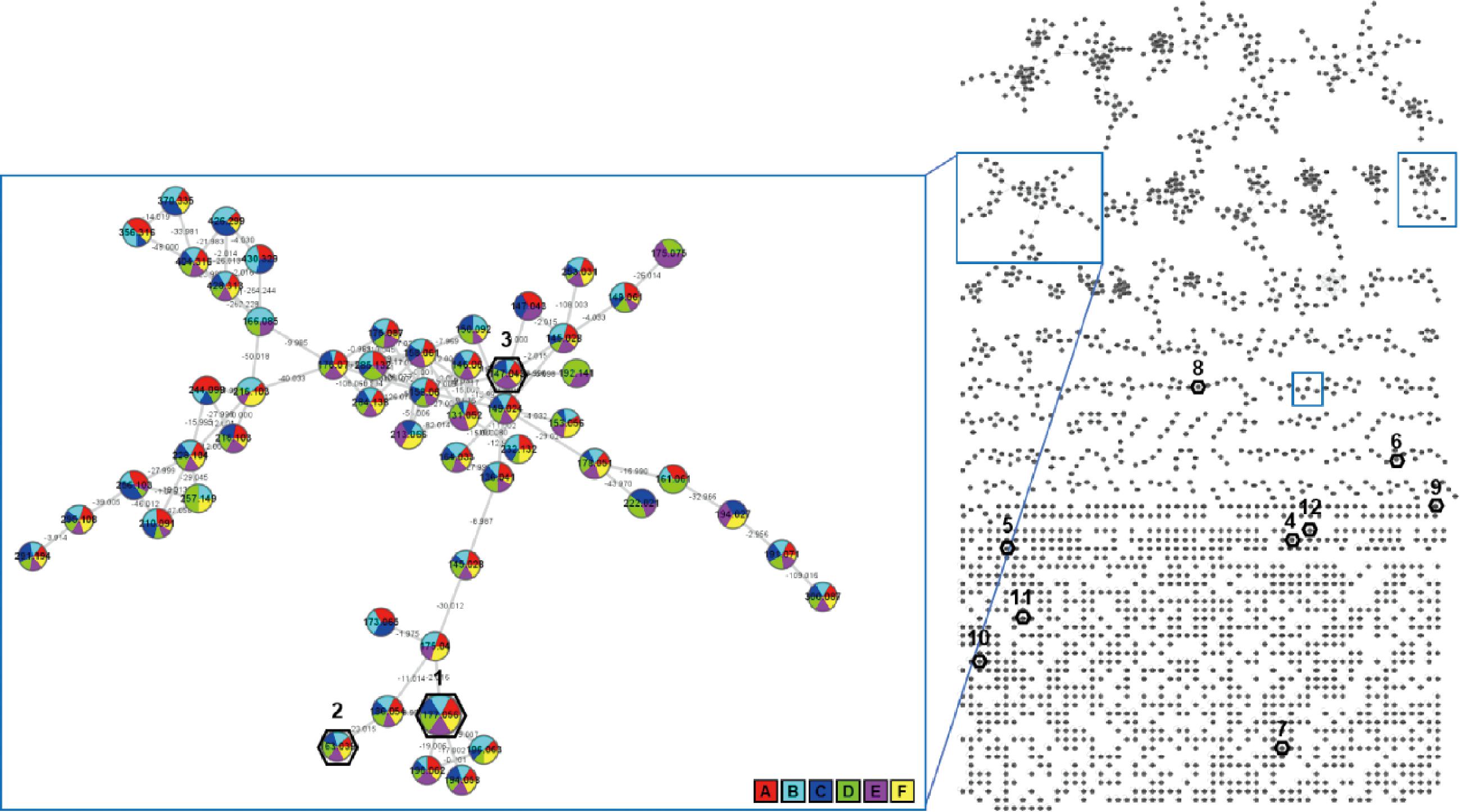
图4 麦汁糖化阶段的质谱分子网络
Fig.4 MS molecular networking of wort during saccharification process
注:图中编号1~12为准确鉴定的多酚类化合物,蓝色方框为HCA类成分信号簇。

图5 糖化阶段4种准确鉴定的HCA(1~4)及27种HCA衍生物(13~39)的基本化学结构
Fig.5 Basic chemical structures of four accurate HCA (1-4) and 27 HCA derivatives (13-39) during saccharification process
2.4 麦汁糖化过程中HCA衍生物含量的变化
对糖化过程各阶段(A~F)麦汁中HCA衍生物的含量变化进行分析(图6),发现不同衍生物的含量表现出各异性的动态变化趋势。大部分HCA衍生物在A→B阶段表现出明显的含量变化,例如阿魏酸(1)、芥子酸(4)、化合物35的含量出现明显的升高,而咖啡酸(2)、对香豆酸(3)、化合物18~20则表现出较明显的下降,提示该阶段HCA衍生物可能存在丰富的化学释放、成分变迁行为。值得注意的是,在A→B阶段糖化温度为45 ℃,SCHWARZ等[21]的研究认为此温度下阿魏酸酯酶促进阿魏酸的释放,然而该机制并不能解释咖啡酸(2)、对香豆酸(3)的含量下降。在KALB等[2]的研究中也发现对香豆酸(3)的含量有所下降。在B→C阶段,随着糖化温度的升高,大部分HCA衍生物表现出含量下降的趋势,代表性的有阿魏酸(1)、化合物24、30,其含量均出现显著下降(P<0.05);化合物34的含量却表现出显著升高(P<0.05),并且在后续的D→F阶段表现出持续升高的趋势。根据化合物34的质荷比(m/z 136.041),计算其分子式为C7H5NO2,推测其为HCA类成分的降解产物,其保留时间为6.20 min,二级质谱碎片及相对丰度为119 (16), 108 (100),80 (63), 65 (4)。在糖化阶段末期(F点),HCA类成分的降解产物16、17、34表现出相对较高的含量,结合化合物34在糖化过程中的含量变化趋势,该化合物或许可以作为表征糖化过程中HCA类成分裂解的标志物,而这要求对其化学结构进行更为细致的表征和解析。此外,分析糖化过程中HCA糖苷衍生物(28~31)的含量变化,发现化合物30、31含量逐渐下降,而化合物28、29含量逐渐升高,表明随着糖化的进行,HCA糖苷衍生物的酯键逐步水解。

图6 糖化阶段31种HCA衍生物的含量变化情况
Fig.6 Content change of 31 HCA derivatives during saccharification process
注:*表示当前数据与前一阶段相比具有显著性差异(P<0.05)。
3 结论
研究发现,大麦芽和小麦芽中的多酚化合物以游离型为主,结合型较少。两种麦芽中的多酚化合物含量与其抗氧化能力存在着一致性。糖化阶段,随着温度和时间的增加,麦汁中多酚化合物含量在糖化开始至52 ℃保温结束呈现显著上升的趋势,后期多酚的含量趋于平稳,变化不大。麦汁抗氧化能力总体上的变化趋势同多酚的含量变化一致。利用UPLC-Q-TOF MS分析和GNPS分子网络分析,准确鉴定出87个化合物,包括阿魏酸(1)、咖啡酸(2)、对香豆酸(3)、芥子酸(4)等HCA成分,以及27种HCA衍生物,而黄酮类物质羟基芫花素为首次检测到。分析发现麦汁糖化过程中不同HCA衍生物表现出各异性的动态变化,大部分呈现先升高后下降的趋势,化合物34(C7H5NO2)在糖化过程中表现出持续升高的趋势,有望作为糖化过程中HCA类成分分解的标志物,但其精细结构有待进一步研究。
[1] 陆健, 樊伟, 孔维宝, 等.大麦总多酚不同溶剂提取物对DPPH自由基清除能力的影响[J].食品与生物技术学报, 2008, 27(1):57-61.
LU J, FAN W, KONG W B, et al.Study on the extraction of total polyphenol in barley (Hordeum vulgare L.) and its ability on scavenging DPPH free radical[J].Journal of Food Science and Biotechnology, 2008, 27(1):57-61.
[2] KALB V, SEEWALD T, HOFMANN T, et al.Studies on the impact of malting and mashing on the free, soluble ester-bound, and insoluble ester-bound forms of desired and undesired phenolic acids aiming at styrene mitigation during wheat beer brewing[J].Journal of Agricultural and Food Chemistry, 2020, 68(44):12421-12432.
[3] 陆健, 赵海锋, 樊伟, 等.啤酒大麦抗氧化力评介的研究[J].啤酒科技, 2008(2):19-29;32.
LU J, ZHAO H F, FAN W, et al.Studies on evaluation of antioxidant activity of malting barley[J].Beer Science and Technology, 2008(2):19-29;32.
[4] 郝俊光, 周月南, 尹花, 等.啤酒中源自酒花α-酸的苦味物质研究进展[J].食品与发酵工业, 2017, 43(12):232-240.
HAO J G, ZHOU Y N, YIN H, et al.Study on bitter compounds in beer originated from hop α acid[J].Food and Fermentation Industries, 2017, 43(12):232-240.
[5] 陈晓梦. 啤酒中游离酚酸介导的抗氧化活性研究[D].扬州:扬州大学, 2016.
CHEN X M.Study on antioxidant activity of free phenolic acids in beer[D].Yangzhou:Yangzhou University, 2016.
[6] 金舟, 徐颖, 王敏, 等.小麦发芽过程中酚类物质及其抗氧化活性的变化[J].食品与发酵工业, 2019, 45(5):199-202.
JIN Z, XU Y, WANG M, et al.Changes of phenolic compounds and their antioxidant activities during wheat germination[J].Food and Fermentation Industries, 2019, 45(5):199-202.
[7] OKARTER N, LIU C S, SORRELLS M E, et al.Phytochemical content and antioxidant activity of six diverse varieties of whole wheat[J].Food Chemistry, 2010, 119(1):249-257.
[8] 韩治磊. 比利时小麦啤酒工艺研究[D].济南:齐鲁工业大学, 2017.
HAN Z L.Study on the belgian style wheat beer process[D].Jinan:Qilu University of Technology, 2017.
[9] 董文乐, 蒋羽鸽, 夏淑芳, 等.小黑药亲电成分干预混合游离脂肪酸诱导的人肝癌细胞株HepG2脂肪变性研究[J].食品与机械, 2020, 36(3):24-33.
DONG W L, JIANG Y G, XIA S F, et al.Study on intervention effects of electrophilic components from Xiaoheiyao against free fatty acid-induced steatosis in HepG2 cells[J].Food &Machinery, 2020, 36(3):24-33.
[10] FLORIDI S, MONTANARI L, MARCONI O, et al.Determination of free phenolic acids in wort and beer by coulometric array detection[J].Journal of Agricultural and Food Chemistry, 2003, 51(6):1548-1554.
[11] SZWAJGIER D.Content of individual phenolic acids in worts and beers and their possible contribution to the antiradical activity of beer[J].Journal of the Institute of Brewing, 2009, 115(3):243-252.
[12] 张江涛,张铭皓,高丽辉, 等.模拟胃肠道消化对玉米低聚肽抗氧化作用的影响[J].食品与生物技术学报,2021,40(11):54-61.
ZHANG J T, ZHANG M H, GAO L H, et al.Effect of simulated gastrointestinal digestion on antioxidant activity of corn oligopeptides[J].Journal of Food Science and Biotechnology, 2021, 40(11):54-61.
[13] 李苇舟, 李福香, 何晓琴, 等.酿造啤酒大麦发芽前后多酚组分变化及抗氧化活性[J].食品科学, 2019, 40(18):15-21.
LI W Z, LI F X, HE X Q, et al.Changes in phenloic components and antioxidant activity of barley before and after malting[J].Food Science, 2019, 40(18):15-21.
[14] JAMAR, DU JARDIN, FAUCONNIER.Cell wall polysaccharides hydrolysis of malting barley (Hordeum vulgare L.):A review[J].Biotechnologie, Agronomie, Société et Environnement, 2011, 15(2):301-313.
[15] 李崎, 李永仙, 郑飞云, 等.啤酒多酚物质对啤酒风味稳定性的影响[J].食品与生物技术学报, 2007, 26(2):102-106.
LI Q, LI Y X, ZHENG F Y, et al.Influence of beer polyphenol on beer flavor stability[J].Journal of Food Science and Biotechnology, 2007, 26(2):102-106.
[16] WANG M X, CARVER J J, PHELAN V V, et al.Sharing and community curation of mass spectrometry data with Global Natural Products Social Molecular Networking[J].Nature Biotechnology, 2016, 34(8):828-837.
[17] CHENG X R, ZHAO W, DONG W L, et al.Chemical space charting of different parts of Inula nervosa wall.:Upregulation of expression of Nrf2 and correlated antioxidants enzymes[J].Molecules, 2020, 25(20):4789.
[18] 郝建秦, 林盛恒, 陈明, 等.啤酒酿造过程中多酚类化合物变化规律的研究[J].中外酒业, 2022(21):20-27.
HAO J Q, LIN S H, CHEN M, et al.Study on the change law of polyphenols in beer brewing process[J].Global Alcinfo, 2022(21):20-27.
[19] QUIFER-RADA P, VALLVERD -QUERALT A, MART
-QUERALT A, MART NEZ-HUÉLAMO M, et al.A comprehensive characterisation of beer polyphenols by high resolution mass spectrometry (LC-ESI-LTQ-Orbitrap-MS)[J].Food Chemistry, 2015, 169:336-343.
NEZ-HUÉLAMO M, et al.A comprehensive characterisation of beer polyphenols by high resolution mass spectrometry (LC-ESI-LTQ-Orbitrap-MS)[J].Food Chemistry, 2015, 169:336-343.
[20] WANNENMACHER J, GASTL M, BECKER T.Phenolic substances in beer:Structural diversity, reactive potential and relevance for brewing process and beer quality[J].Comprehensive Reviews in Food Science and Food Safety,2018, 17(4):953-988.
[21] SCHWARZ K J, BOITZ L I, METHNER F J.Influence of mashing parameters on release of precursors of phenolic wheat beer aroma[J].Brauwelt International, 2015, 33(5):298-303.