枸杞(Lycium barbarum L.)是我国传统的药食同源植物,具有抗氧化[1]、抗炎[2]、降脂[3]等多种药理作用。我国是枸杞的发源地,产量大,2021年产量达到42万t多,但市场上多为其干制品,深加工产品不多。发酵枸杞酒是近年来兴起的产品,随着人们对枸杞酒接受度的提高,枸杞发酵果酒也越来越受大众欢迎。然而,目前生产枸杞果酒使用的酵母菌多为葡萄酒专用的酿酒酵母,该类酵母具有较强的发酵能力,但产生香气的能力不足。随着非酿酒酵母被广泛用于葡萄酒的研究,发现非酿酒酵母和酿酒酵母混合接种的方式比单菌发酵更能提升酒体香气。HU等[4]利用酿酒酵母与非酿酒酵母共同发酵,与酿酒酵母单独发酵进行对比,结果表明共同发酵有助于提升柑桔酒的感官质量,尤其有助于提高挥发性物质的含量。LAI等[5]探究了非酿酒酵母菌对香气化合物复杂性的影响,结果发现非酿酒酵母有利于酯类的产生。
为了解决商业酿酒酵母发酵枸杞酒中挥发性物质单一的问题,从枸杞鲜果、枸杞叶和枸杞园的土壤中进行采样,筛选出非酿酒酵母,借鉴改善葡萄酒香气等综合品质的方法,采用商业酿酒酵母与非酿酒酵母混合发酵方式来提升枸杞酒的品质,为枸杞酒发酵过程中更好地利用非酿酒酵母提供参考价值,并为枸杞相关产品的开发提供理论指导。
1 材料与方法
1.1 样品采集
从宁夏中宁枸杞基地的枸杞园中采集枸杞、枸杞叶和土壤样品,无菌采样后送至实验室进行筛菌。
1.2 材料与试剂
酿酒用宁杞7号枸杞鲜果,宁夏中卫市海原县三河镇六窑村枸杞基地。
酵母浸出粉胨葡萄糖琼脂培养基(yeast peptone dextrose agar medium, YPD)、WL鉴别培养基(WL differential agar, WL)、赖氨酸培养基(lysine medium, LYS),均为商业培养基,青岛海博生物技术有限公司;无水乙醇,天津市致远化学试剂有限公司;商业酿酒酵母STR、果胶酶,法国LAMOTHE-ABTET公司。
1.3 仪器与设备
AXTG16G高速离心机,盐城市安信实验仪器有限公司;Leica DM750光学显微镜,奥林巴斯有限公司;759S紫外可见分光光度计,上海棱光技术有限公司;8860-5977B气相色谱质谱联用仪、DB-WAX色谱柱,美国安捷伦公司;BSP-150培养箱,上海博讯实业有限公司。
1.4 实验方法
1.4.1 非酿酒酵母菌的筛选
1.4.1.1 非酿酒酵母菌的分离与纯化
分别取枸杞鲜果、枸杞叶和枸杞园的土壤10 g,加入90 mL无菌水,在常温下自然发酵12~48 h,即为菌悬液。稀释后均匀涂于已灭菌的YPD固体培养基上,于28 ℃恒温培养箱中培养1~3 d,观察其菌落形态与颜色,将具有典型酵母菌特征的菌落进行标记,并以J开头命名。
1.4.1.2 非酿酒酵母菌的初步鉴定
结合WL培养基和LYS培养基初步筛选非酿酒酵母,将得到的酵母菌在WL培养基上划线培养,观察菌落形态及颜色;采用酿酒酵母不可利用赖氨酸作为氮源的特性在LYS培养基上培养,进一步筛选非酿酒酵母。5 d后能在LYS培养基上长出菌落即为非酿酒酵母,15 d后不能在LYS培养基上长出菌落的可确定为酿酒酵母[6]。
1.4.1.3 生理生化鉴定
参照文献[7]对筛出的非酿酒酵母菌进行碳源、氮源等生理生化鉴定。
1.4.1.4 非酿酒酵母的耐受性检测
制备不同初始葡萄糖浓度、pH、温度和乙醇体积分数的YPD液体培养基,按1×106 CFU/mL的量接种非酿酒酵母于YPD液体培养基中,于28 ℃恒温培养箱中培养48 h,取样测OD600值。
1.4.1.5 菌株鉴定
利用26S rDNA D1/D2区域的序列分析鉴定方法,对经过分离纯化和特性实验所得到的优良非酿酒酵母菌株进行鉴定。参考周桂珍[8]的方法对非酿酒酵母进行DNA提取、26S rDNA PCR扩增及测序与序列分析方法。PCR反应体系稍作修改。
1.4.2 混合菌株发酵枸杞酒
将优良的非酿酒酵母活化后接种于液体培养基中,于28 ℃、160 r/min条件下培养至对数期,按一定比例接入枸杞汁中。商业酵母STR按照说明进行活化。
1.4.2.1 接种方式
将商业酿酒酵母STR与优良的非酿酒酵母以同时和顺序接种(先接非酿酒酵母,48 h后接种商业酿酒酵母)的方式加入枸杞汁中进行混合发酵,分别记作XT和XS;用单独添加商业酿酒酵母STR作为对照组,记作XD。
1.4.2.2 接种比例
根据文献[8-9]将非酿酒酵母与商业酿酒酵母接种比例设置为10∶1和1∶1,按照1.4.2.1节中的接种方式,将已筛选的优良非酿酒酵母与商业酿酒酵母STR进行同时和顺序接种,分别记作XT 1∶1和XS 1∶1、XT 10∶1和XS 10∶1;用单独添加商业酿酒酵母STR作为对照组,记作XD。
通过测定CO2质量损失记录发酵过程,发酵结束后测定枸杞酒的基本理化指标、色泽、澄清度和挥发性物质。
1.4.3 发酵枸杞酒的测定
1.4.3.1 枸杞酒基本理化指标的测定
总酸、酒精度参照GB/T 15038—2006《葡萄酒、果酒通用分析方法(含第1号修改单)》测定,pH值使用pH计测定,总糖含量的测定使用苯酚硫酸法[10]。
1.4.3.2 枸杞酒色泽与澄清度的测定
采用CIELAB色差仪测定枸杞酒的色泽;采用紫外可见分光光度计在波长680 nm处测定枸杞酒的透光率,作为评价枸杞酒澄清度的指标。
1.4.3.3 挥发性物质的测定
采用GC-MS,根据ZHANG等[11]的方法对挥发性化合物进行测定。
1.4.4 枸杞酒的感官评定
1.4.4.1 感官评价方法
选择不同年龄阶段、身体健康、无感知缺陷、食品科学与工程专业的学生和老师10位,组成评价小组,分别对枸杞酒的各项指标进行等级评定,并记录结果。
1.4.4.2 模糊数学模型的建立
评价因素集Un={u1,u2,…un},u1,u2,u3,u4,u5分别表示为香气、口感、色泽、澄清度、风格。根据表2得到枸杞酒的评价集为Vm={v1,v2,v3,v4,v5},设定特定的分值区域,与评价集之间相对应,将结果量化为具体评分,根据清晰质量等级边界模糊化法将分值域清晰化,即取区域中心值得出对应的分值,计为Sm。本实验参照GB/T 15038—2006《葡萄酒、果酒通用分析方法(含第1号修改单)》确定评价指标集系数,采用1~5分标度法,运用问卷调查方法确定香气、口感、色泽、澄清度、风格的权重,对枸杞酒参评因素进行一致性(consistency ratio,CR)检验,判断矩阵标度定义与平均随机一致性指标,结合特征向量可计算出最大特征根,利用最大特征值计算得到CI值和权重值W。根据各因素所占权重值确定权重集,W=(a1,a2,a3,a4,a5),且满足a1+a2+a3+a4+a5=1,结果见表3,计算可得W=(0.14,0.16,0.20,0.23,0.27),即Sm={极好,好,较好,差,极差}={90,70,50,30,10}。确定模糊矩阵R,即R=(rij)5×5,rij表示枸杞酒的各项评价指标到该指标评价结果的隶属程度。模糊综合评价结果Yi=W×R,感官评分(T),即T=Y×Sm。
1.5 数据处理
实验数据利用Excel 2019软件处理,用“平均值±标准差”表示。利用SPSS 26.0软件进行显著差异分析,Origin制作相关图。
2 结果与分析
2.1 非酿酒酵母菌的筛选结果
2.1.1 非酿酒酵母菌的分离纯化
将筛选出的酵母菌菌株进行分离纯化,观察其菌落形态及颜色。如图1-a菌落形状呈现球形,光滑,边缘整齐;图1-b菌落底部有红色分泌物质堆积;图1-c使用美蓝染色酵母,进行光学显微镜观察,形态多为圆形;将分离纯化得到的酵母菌分别在WL培养基和LYS培养基上培养,如图1-d,酵母菌在WL培养基上菌落颜色为奶油色中带绿色,表面为球形,光滑不透明;图1-e可看出LYS培养基中无菌落,可确定为该菌为酿酒酵母;图1-f可看出LYS培养基中有菌落生成,且球形突起、光滑。因此,由WL培养基与赖氨酸培养基结合筛选非酿酒酵母,得到在LYS培养基中可以生长的酵母菌有6株,确定这6株酵母菌为非酿酒酵母,分别命名为JHQ1、JRQ1、JMJ、JPT、JHQ2、JHJ。

a,b-酵母菌的菌落形态;c-酵母菌在光学显微镜下微观形态;d-酵母菌在WL培养基上的菌落形态;e,f-酵母菌在LYS培养基上的形态
图1 酵母菌的菌落形态及微观形态
Fig.1 The colony morphology and microscopic morphology of yeast
2.1.2 生理生化鉴定
对6株菌株进行生理生化实验,结果见表4。
由表4可知,对于不同的碳源和氮源,非酿酒酵母都能同化。但菌株JPT和JHJ对乙醇的同化能力较低,以上同化结果与菌株鉴定手册中的结果一致。
2.1.3 非酿酒酵母的耐受性
由图2-a可知,在耐酸性方面,相比于其他菌株,JMJ的耐受性最好。图2-b中葡萄糖质量浓度在250 g/L时,所有菌株的耐受性最强(除JHJ以外),随着葡萄糖浓度的增大,菌株活性降低,其中菌株JMJ比其他菌株的耐受性都好。从图2-c看出,在小于25 ℃的低温情况下,菌株JMJ、JHQ1和JHQ2都有较好的耐受性。董建方[12]的研究表明,18~22 ℃对于发酵枸杞酒有着很大的优势,尤其有利于枸杞酒挥发性成分的形成与积累。图2-d中当乙醇体积分数为9%时,6株非酿酒酵母均受到明显抑制,但对JMJ的影响最小。综合所有耐受性结果,菌株JMJ的耐受性最强,因此将该菌株进行分子学鉴定。

a-不同pH下菌株吸光度值;b-不同葡萄糖浓度下菌株吸光度值;c-不同温度下菌株吸光度值;d-不同乙醇体积分数下菌株吸光度值
图2 六株非酿酒酵母在不同pH、葡萄糖浓度、温度、乙醇体积分数下的生长情况
Fig.2 The growth of six strains of non-Saccharomyces cerevisiae at different pH, glucose concentration, temperature and ethanol volume fraction
2.1.4 非酿酒酵母JMJ分子生物学鉴定结果
菌株JMJ的26S rDNA序列结果在NCBI网站上进行序列同源性比对,与测序结果进行对比,并用MEGA 7.0构建系统发育树,如图3所示。结合菌落形态特征、培养基鉴定以及系统发育树的分析结果,最终确定该株非酿酒酵母菌JMJ为美极梅奇酵母(Metschnikowia pulcherrima,Mp)。

图3 菌株JMJ系统发育树
Fig.3 Phylogenetic tree of JMJ strains
2.2 发酵速率的测定
发酵过程中,由于酵母菌发酵枸杞汁释放CO2气体,随着发酵的进行,CO2排放越旺盛。酵母菌生存时间的长短,决定着果酒最终产品的品质,也影响着挥发性物质的产生与积累。每天根据CO2失重量监测发酵进程,当CO2的失重量小于0.2 g/100 mL时,认为主发酵阶段完成[13]。测定单菌发酵和不同比例接种时混合发酵枸杞酒中CO2的质量,结果如图4所示。以单菌发酵作为对照,同时接种发酵实验中,CO2最大失重量产生在第2天,接种比例10∶1的发酵力高于1∶1,且也高于单菌发酵。顺序接种发酵实验中,CO2最大失重量产生在第3天,接种比例10∶1的发酵力高于接种比例为1∶1和单菌发酵。混合发酵整体的发酵强度显著高于STR单独菌株的发酵强度(除第1天以外),且在第5天后所有的枸杞酒处于缓慢发酵的状态,到第8天单菌发酵结束,而混菌发酵尚未结束。
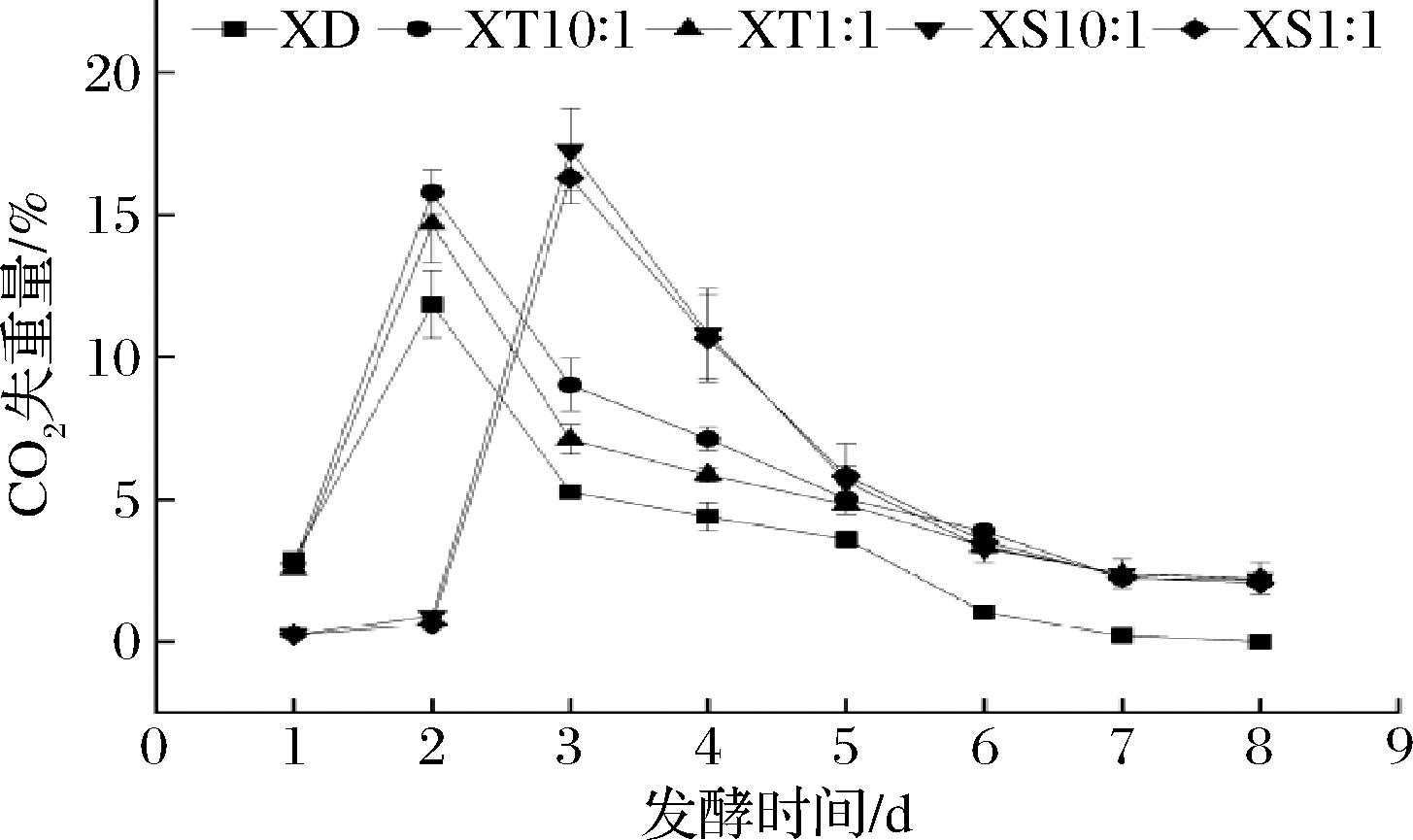
图4 发酵速率曲线
Fig.4 Fermentation rate curve
2.3 混合发酵过程中酵母细胞计数
在发酵过程中,分别使用WL培养基和LYS培养基对商业酿酒酵母STR和美极梅奇酵母JMJ菌株生长的情况进行平板计数。两类酵母在WL培养基上的菌落形态与颜色差异较大,因而利用WL培养基对酿酒酵母STR进行计数。而酿酒酵母在LYS培养基上不能生长,因此可以利用LYS培养基对非酿酒酵母JMJ进行计数,结果见图5。
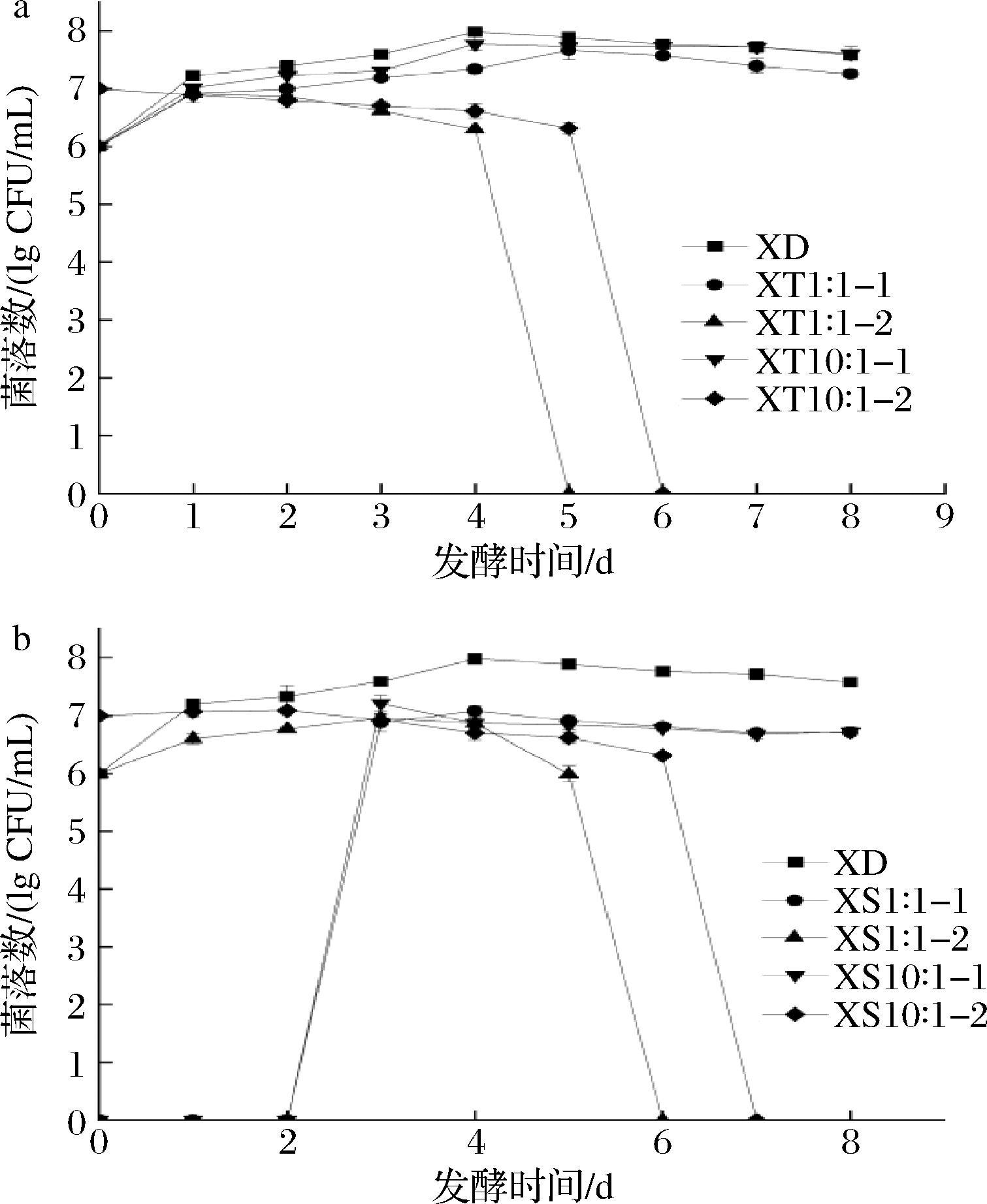
a-同时发酵;b-顺序发酵
图5 发酵过程酵母菌的活菌数
Fig.5 The number of viable yeast in the fermentation process
注:-1表示在WL培养基上接种,-2表示在LYS培养基上接种。
不同微生物之间会因为自身生长代谢所需营养物质不同而发生争夺现象,可能会产生具有抗性、抑制或杀害非同类微生物的某些代谢物,因此,将商业酿酒酵母STR与美极梅奇酵母JMJ用2种不同方式和比例接种于枸杞汁中发酵枸杞酒,每隔24 h取样,观察酵母菌生长情况。由图5-a可知,将商业酿酒酵母STR与菌株JMJ按照1∶1的比例接种,在发酵第3天时,商业酿酒酵母STR生长速度显著高于菌株JMJ,但随着发酵时间的进行,第5天未能检测到菌株JMJ。而按照10∶1的比例接种发酵时,发酵2 d后,随发酵时间的递进,虽然菌株JMJ的接种量是酵母STR的10倍,但酵母STR生物量仍高于菌株JMJ的数量,这充分说明酒精发酵过程是由商业酿酒酵母主导的。在发酵第6天菌株JMJ未被检测到。吴尧等[14]的研究中,对于非酿酒酵母与酿酒酵母的生长特征也做出同样的结果。
由图5-b可知,在接种比例为1∶1顺序发酵的酒样中,发酵第6天时未检测到菌株JMJ。当发酵48 h后接种商业酿酒酵母STR,该酵母可耐受菌株JMJ的竞争性抑制。在10∶1顺序发酵酒样中,在发酵第7天时未检测到菌株JMJ。总之,不管是同时发酵还是顺序发酵,菌株JMJ的菌体数始终低于商业酿酒酵母STR的菌体数。与同时接种相比,顺序接种中的非酿酒酵母的发酵周期延长,有利于菌株JMJ在发酵前期产生更高的代谢表达量[15],对香气代谢相关酶的积累做出了相应的贡献,与刘瑶等[16]的研究结果一致。因此,提前接种非酿酒酵母是一种比较常见且对果酒酿造有利的方式。
2.4 发酵枸杞酒质量评价
2.4.1 基本理化指标分析
测定宁杞7号枸杞鲜果打浆为枸杞汁与发酵枸杞酒的基本理化指标,如表5所示。
混合发酵酒的pH都小于4;顺序发酵的枸杞酒可溶性固形物含量最低,可能先接菌株JMJ有助于可溶性固形物的分解,再添加商业酿酒酵母STR使得糖分转化更完全;总酸的范围为3.89~4.29 mg/mL;酒精度范围为13.85%~14.23%(体积分数);总糖的范围在2.16~2.51 g/mL。因此,所酿枸杞酒符合国标GB/T 41405.1—2022《果酒质量要求 第1部分:枸杞酒》。
2.4.2 枸杞酒色泽与澄清度分析
测定枸杞酒的色泽与透光率,结果见表6,混合发酵得到的枸杞酒明度都较高,尤其是同时和顺序接种(10∶1)的枸杞酒。a*值为负值,说明枸杞酒偏向绿色;而b*为正值,说明枸杞酒偏向黄色。从枸杞酒的饱和度(C)得知,以接种比例为1∶1的顺序发酵(XS 1∶1)得到枸杞酒饱和度最大,h*的范围在71.79~76.12,根据h*的范围可知,枸杞酒由橙黄到黄色。综上所述,混合发酵的枸杞酒明度最大。再以单菌发酵为对照,得出混合发酵的枸杞酒透光率高于单菌发酵,其中透光率最高的发酵酒是XS 10∶1,达到95.93%。相关文献报道[17]美极梅奇酵母具有多种水解酶的活性,所以利用此酵母混合发酵对于果酒的澄清有着重要的影响,这与测定的透光率结果一致。
2.4.3 枸杞酒模糊感官评价
混合发酵枸杞酒感官评定结果见表7,通过模糊评判计算得到最终感官评分。
由表7可知,由10名品评人员对发酵枸杞酒的香气、口感、色泽、澄清度、风格的评价结果得到评价矩阵R1、R2、R3、R4、R5。综合评定结果,Y1=W×R1,以此类推得到所有发酵枸杞酒的综合判定结果如下:
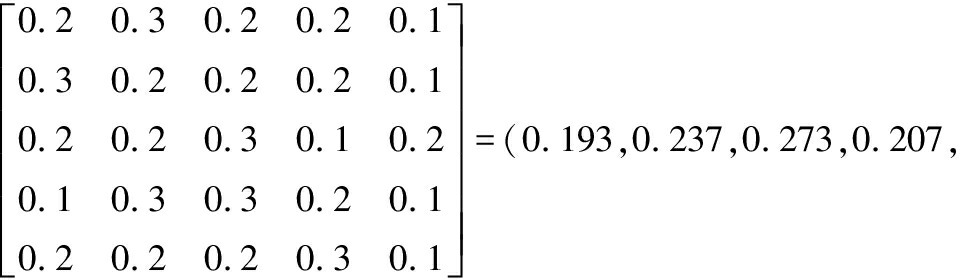
同理:
Y2=(0.261,0.167,0.247,0.213,0.209)
Y3=(0.331,0.223,0.176,0.150,0.120)
Y4=(0.347,0.276,0.210,0.184,0.163)
Y5=(0.204,0.236,0.196,0.177,0.187)
由上述数据计算出评价结果,可以得出混合发酵和单菌发酵模糊综合评判的峰值为0.273、0.261、0.331、0.347、0.236,根据最大隶属度原则可以看出等级为极好的有3种,编号为2、3和4号;等级为好的有一种,编号为5;一般等级的有一种,编号为1。
模糊综合评价得分计算:
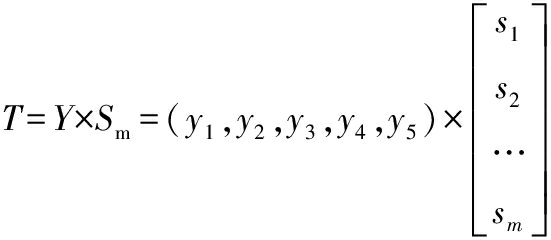
即:![]()

同理,T2=59.9,T3=56.01,T4=68.2,T5=51.86。
综上,通过计算得出不同酵母酿造枸杞酒的模糊数学综合得分为:T1=55.02,T2=59.9,T3=56.01,T4=68.2,T5=51.86,得到评分最高的为由商业酵母STR与菌株JMJ顺序接种(10∶1)发酵的枸杞酒,且都高于其他接种方式发酵的枸杞酒。结合2.4.1节和2.4.2节的结果,得到接种比例10∶1优于1∶1的枸杞酒。因此,选择以10∶1的接种比例顺序和同时发酵枸杞酒,测定其挥发性物质。
2.4.4 枸杞酒挥发性物质分析
经GC-MS检测,分析不同酒样中挥发性物质,详见电子版增强出版附表1(https://doi.org/10.13995/j.cnki.11-1802/ts.037762)。
表1 PCR反应体系
Table 1 List of composition of the PCR mixture

试剂体积/μLTemplate(基因组DNA 20~50 ng/μL)0.510×Buffer(含Mg2+)2.5dNTP(各2.5 mmol/L)1酶0.2F(10 μmol/L)0.5R(10 μmol/L)0.5加双蒸水至25
表2 枸杞酒感官评定标准
Table 2 Sensory evaluation standard of L.barbarum wine

等级指标香气(25%)口感(50%)色泽(5%)澄清度(5%)风格(15%)极好具有枸杞酒特有的酒香,醇香浓郁苦味、涩味淡,柔和浓郁色泽明亮有光泽,黄色甚至接近金黄色澄清透明整体柔和,优雅独特,酒体协调好有枸杞酒香气,有醇香涩味较淡,伴有苦味整体柔和色泽明亮,黄色澄清整体较好一般有醇香,但不浓郁苦味、涩味适中黄红接近浅褐色较澄清整体适中差缺乏枸杞酒应有的香气有苦味且持久,涩味过浓且伴有酸味淡褐色澄清度低整体缺乏独特的优雅度,入口不协调极差有不愉快的异味苦味、涩味过重甚至酸涩,难以入口出现深褐色能见度低,出现悬浮颗粒整体不协调,无酒的独特性
表3 AHP层次分析结果
Table 3 AHP analysis hierarchical results
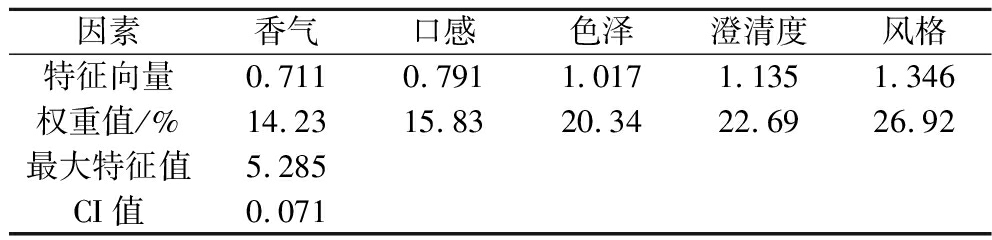
因素香气口感色泽澄清度风格特征向量0.7110.7911.0171.1351.346权重值/%14.2315.8320.3422.6926.92最大特征值5.285CI值0.071
表4 生理生化鉴定结果
Table 4 Physiological and biochemical experiments
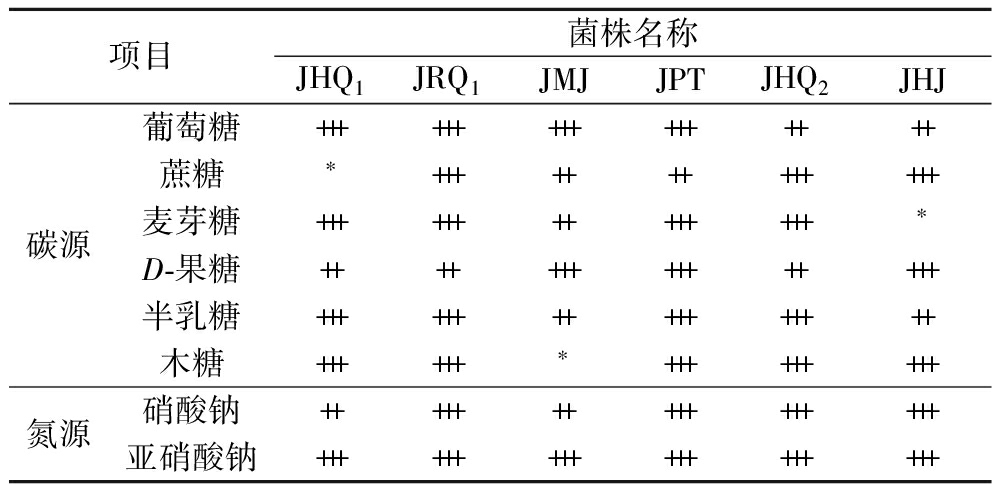
项目菌株名称JHQ1JRQ1JMJJPTJHQ2JHJ碳源葡萄糖++++++++++++++++蔗糖∗+++++++++++++麦芽糖++++++++++++++∗D-果糖+++++++++++++++半乳糖++++++++++++++++木糖++++++∗+++++++++氮源硝酸钠++++++++++++++++亚硝酸钠++++++++++++++++++
注:*表示微量生长(OD600<0.3);+表示生长(0.3
表5 发酵枸杞酒的基本理化指标
Table 5 Basic physicochemical indexes of fermented L.barbarum wine
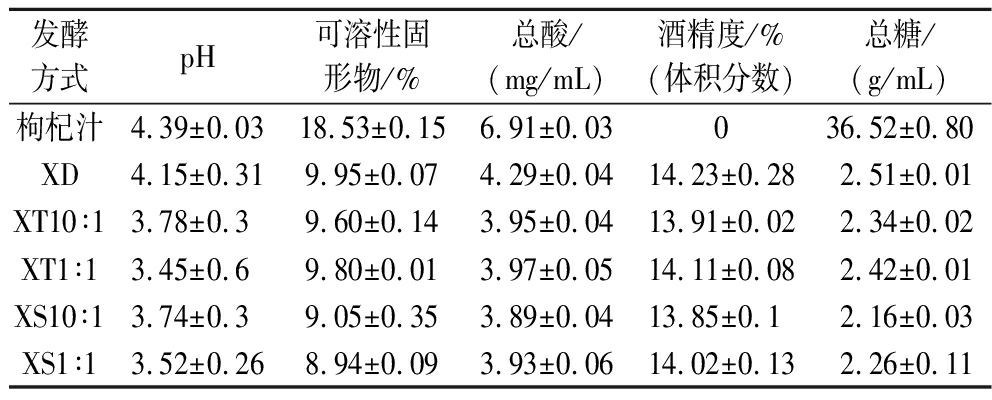
发酵方式pH可溶性固形物/%总酸/(mg/mL)酒精度/%(体积分数)总糖/(g/mL)枸杞汁4.39±0.0318.53±0.156.91±0.03036.52±0.80XD4.15±0.319.95±0.074.29±0.0414.23±0.282.51±0.01XT10∶13.78±0.39.60±0.143.95±0.0413.91±0.022.34±0.02XT1∶13.45±0.69.80±0.013.97±0.0514.11±0.082.42±0.01XS10∶13.74±0.39.05±0.353.89±0.0413.85±0.12.16±0.03XS1∶13.52±0.268.94±0.093.93±0.0614.02±0.132.26±0.11
表6 枸杞酒的色泽与透光率
Table 6 Color and light transmittance of L.barbarum wine

发酵方式L∗b∗Ch∗透光率XD98.63±0.12ab25.33±0.31ab26.18±0.04ab75.31±0.43ab86.90±0.10eXT1∶198.10±0.03c20.67±0.16c21.76±0.05c71.79±0.03d89.60±0.10dXT10∶198.93±0.01a21.77±0.41bc22.74±0.02bc72.87±0.32c92.70±0.44bXS1∶198.50±0.24b26.99±0.04a27.85±0.51a76.12±0.41a90.60±0.55cXS10∶198.84±0.03ab22.48±0.02bc23.38±0.03b73.95±0.01bc95.93±0.15a
注:同一列不同字母表示差异显著(P<0.05)。
表7 发酵枸杞酒感官评定结果
Table 7 Sensory evaluation results of the fermented L.barbarum wine
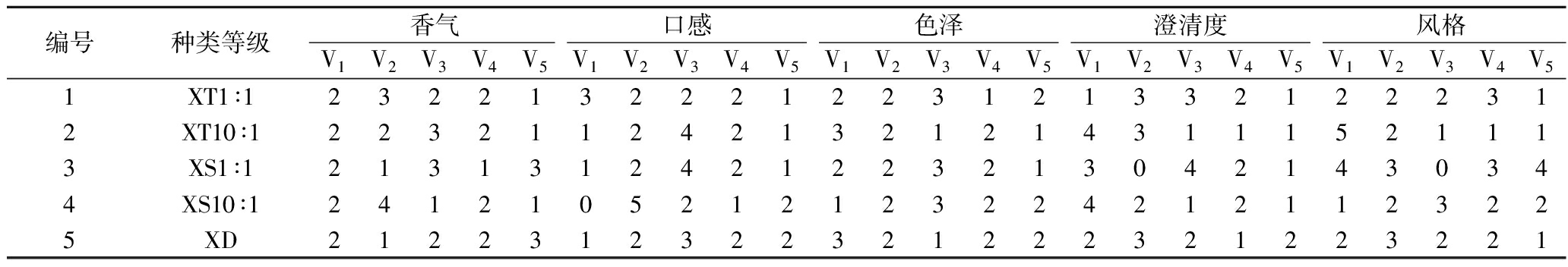
编号种类等级香气口感色泽澄清度风格V1V2V3V4V5V1V2V3V4V5V1V2V3V4V5V1V2V3V4V5V1V2V3V4V51XT1∶123221322212231213321222312XT10∶122321124213212143111521113XS1∶121313124212232130421430344XS10∶124121052121232242121123225XD2122312322321222321223221
在XS 10∶1和XT 10∶1的混合发酵中,分别检测出挥发性物质65种和64种,而单菌发酵检测出54种。为了可视化枸杞酒样中的挥发性物质,绘制聚类热图,如图6-a所示。其中,酯类物质在挥发性物质中占比最高,酯类化合物大多数来自于微生物的初级代谢,例如发酵过程中酵母菌群的脂质代谢等,是由酶系催化产生的一系列物质,对葡萄酒的香气复杂性起着主要的作用[18]。顺序发酵的枸杞酒中酯类物质有26种,总含量为45 792.83 μg/L;同时发酵的枸杞酒中酯类物质有27种,总含量为32 715.53 μg/L;单菌发酵的枸杞酒中酯类物质有19种,总含量为31 841.29 μg/L。总体而言,混合发酵的酯类物质种类以及含量上都远高于单菌发酵,这与一些研究中关于酯类的增加是一致的[19-21]。且在本次试验中,将商业酿酒酵母STR与非酿酒酵母JMJ混合发酵,检测到酯类物质的含量要显著高于单菌发酵枸杞酒中酯类含量,这与上述研究结果相符。
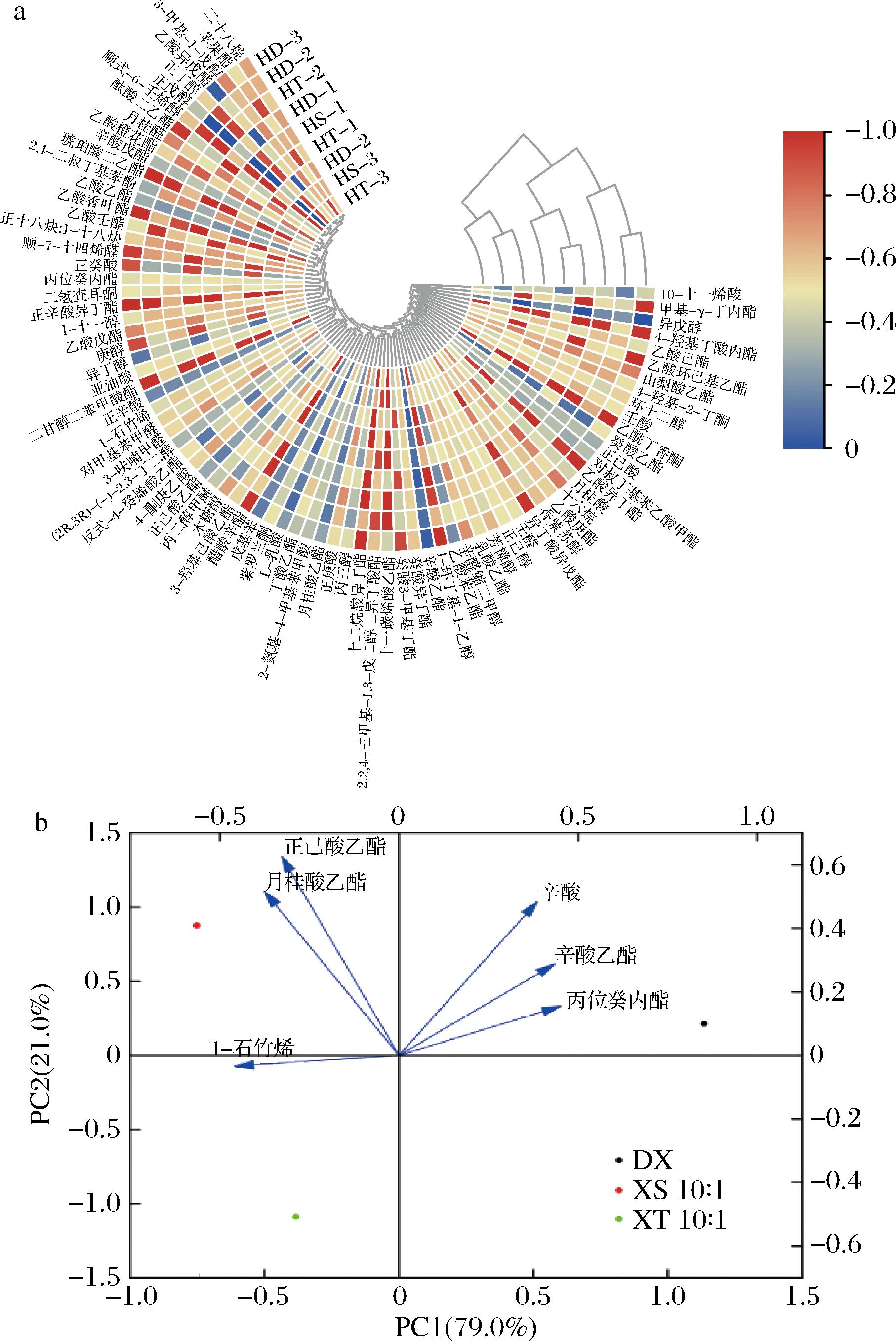
a-挥发性物质聚类热图;b-关键香气物质主成分分析图
图6 枸杞酒中挥发性物质的聚类热图和关键香气物质的主成分分析图
Fig.6 Clustering heatmap of volatile substances and PCA analysis diagram of key aroma substances in L.barbarum wine
挥发性物质含量的高低并不能作为判断枸杞酒风味特征的依据,一般赋予枸杞酒风味特征的是具有较高OAV的香气成分[22]。通过计算枸杞酒中挥发性物质的OAV值,得到34种关键挥发性物质。因目前枸杞酒中香气阈值文献报道较少,故参考与枸杞酒酒精度相近的果酒阈值。一般认为,OAV≥1.0时,该风味物质是关键的风味化合物,对其风味具有重要的贡献作用,0.1≤OAV<1.0对香气有重要修饰作用[23]。本次混合发酵试验所得OAV见表8。赵苗苗[9]对市售上2种发酵枸杞酒(“健康快车”、“金色传杞”)的风味物质进行定性和定量分析,并利用OAV明确了枸杞酒中的7种关键风味物,分别为乙酸异戊酯、乙酸乙酯、丁酸乙酯、己酸乙酯、丙醇、异戊醇和苯乙醇,而本文所研究的枸杞酒中关键风味物质同时也检测出乙酸乙酯、正己酸乙酯、丁酸乙酯、乙酸异戊酯、异戊醇,与赵苗苗[9]结论相似,具有典型性特征。且本文利用非酿酒酵母JMJ与商业酿酒酵母STR混合发酵枸杞酒,同时检测出辛酸乙酯(果香)、丙位癸内酯(椰子和桃子果香)、月桂酸乙酯(果香气味)、辛酸(奶酪香、油香)和1-石竹烯(木香、柑橘香、丁香),两种菌混合发酵增加了枸杞酒中关键风味物质,赋予了枸杞酒更丰富的香气。
表8 顺序和同时(10∶1)混合发酵枸杞酒中的关键挥发性物质
Table 8 Key volatile compounds in L.barbarum wine fermented by sequential and simultaneous (10∶1) co-fermentation
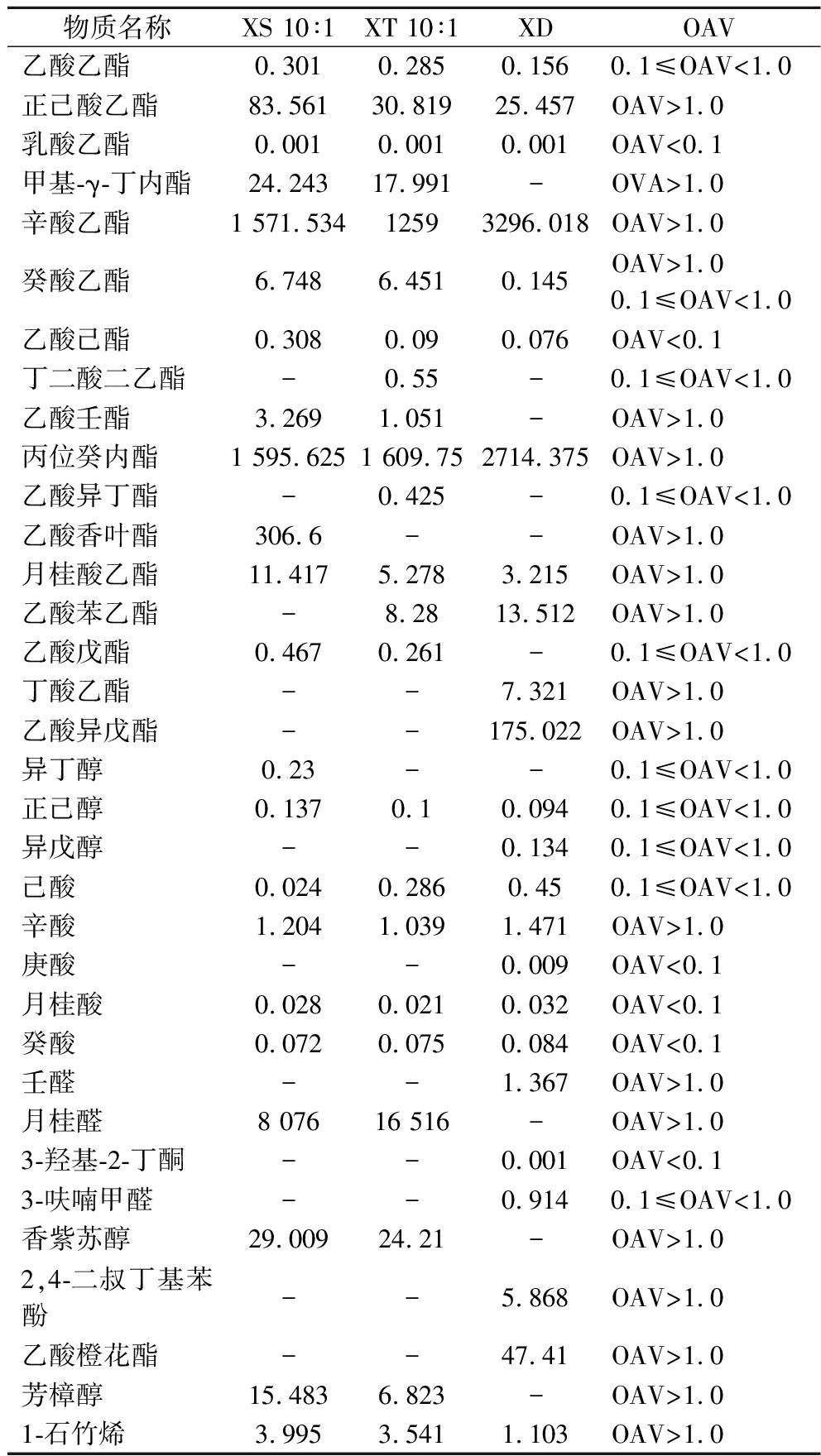
物质名称XS 10∶1XT 10∶1XDOAV乙酸乙酯0.3010.2850.1560.1≤OAV<1.0正己酸乙酯83.56130.81925.457OAV>1.0乳酸乙酯0.0010.0010.001OAV<0.1甲基-γ-丁内酯24.24317.991-OVA>1.0辛酸乙酯1 571.53412593296.018OAV>1.0癸酸乙酯6.7486.4510.145OAV>1.00.1≤OAV<1.0乙酸己酯0.3080.090.076OAV<0.1丁二酸二乙酯-0.55-0.1≤OAV<1.0乙酸壬酯3.2691.051-OAV>1.0丙位癸内酯1 595.6251 609.752714.375OAV>1.0乙酸异丁酯-0.425-0.1≤OAV<1.0乙酸香叶酯306.6--OAV>1.0月桂酸乙酯11.4175.2783.215OAV>1.0乙酸苯乙酯-8.2813.512OAV>1.0乙酸戊酯0.4670.261-0.1≤OAV<1.0丁酸乙酯--7.321OAV>1.0乙酸异戊酯--175.022OAV>1.0异丁醇0.23--0.1≤OAV<1.0正己醇0.1370.10.0940.1≤OAV<1.0异戊醇--0.1340.1≤OAV<1.0己酸0.0240.2860.450.1≤OAV<1.0辛酸1.2041.0391.471OAV>1.0庚酸--0.009OAV<0.1月桂酸0.0280.0210.032OAV<0.1癸酸0.0720.0750.084OAV<0.1壬醛--1.367OAV>1.0月桂醛8 07616 516-OAV>1.03-羟基-2-丁酮--0.001OAV<0.13-呋喃甲醛--0.9140.1≤OAV<1.0香紫苏醇29.00924.21-OAV>1.02,4-二叔丁基苯酚--5.868OAV>1.0乙酸橙花酯--47.41OAV>1.0芳樟醇15.4836.823-OAV>1.01-石竹烯3.9953.5411.103OAV>1.0
注:-表示OAV<0.000 1的值。
从表8可以得出,3个酒样中同时满足OAV>1.0的有6种物质,分别为正己酸乙酯、辛酸乙酯、丙位癸内酯、月桂酸乙酯、辛酸和1-石竹烯。在10∶1顺序发酵枸杞酒中OAV>0.1的有13种物质,10∶1同时发酵枸杞酒中OAV>1.0的有12种物质,而单菌发酵枸杞酒中OVA>1.0的有12种物质。总之,混合顺序发酵比单菌发酵更有利于关键挥发性物质的形成,这些物质赋予枸杞酒更丰富的香气。
对单菌发酵和混合发酵枸杞酒中同时满足OAV>1.0的挥发性物质进行主成分分析,结果如图6-b所示。主成分1、主成分2分别代表了原始变量79.0%、21.0%的信息,累计贡献率为100%。根据OAV>1.0进行主成分分析,3种枸杞酒样中关键挥发性物质明显分散,混合发酵中1-石竹烯、月桂酸乙酯、正己酸乙酯为关键风味物质,在单菌发酵枸杞酒中辛酸、丙位癸内酯和辛酸乙酯为3个关键风味物质。
3 结论
本研究从枸杞、枸杞叶和枸杞园的土壤中筛选出6株非酿酒酵母,经过葡萄糖耐受性、pH耐受性、乙醇耐受性、温度耐受性实验,筛选出1株各方面性能较好的非酿酒酵母,经26S rDNA序列分析,确定为美极梅奇酵母。并对该菌株与商业酿酒酵母STR进行混合发酵,结果表明,在接种比例为10∶1的顺序发酵中,挥发性物质的种类高于同时发酵,且显著高于单菌发酵。根据OAV>1.0得到酯类(正己酸乙酯、辛酸乙酯、丙位癸内酯、月桂酸乙酯)、酸类(辛酸)和双环倍半萜类(1-石竹烯)是枸杞酒样中关键挥发性物质,且2种菌混合发酵增加了枸杞酒中关键风味物质。因此,筛选的美极梅奇酵母与商业酿酒酵母混合发酵有利于增加枸杞酒中香气物质的种类与含量。
[1] BUCHELI P, VIDAL K, SHEN L S, et al.Goji berry effects on macular characteristics and plasma antioxidant levels[J].Optometry and Vision Science, 2011, 88(2):257-262.
[2] MAGALH ES V, SILVA A R, SILVA B, et al.Comparative studies on the anti-neuroinflammatory and antioxidant activities of black and red goji berries[J].Journal of Functional Foods, 2022, 92:105038.
ES V, SILVA A R, SILVA B, et al.Comparative studies on the anti-neuroinflammatory and antioxidant activities of black and red goji berries[J].Journal of Functional Foods, 2022, 92:105038.
[3] DE SOUZA ZANCHET M Z, NARDI G M, DE OLIVEIRA SOUZA BRATTI L, et al.Lycium barbarum reduces abdominal fat and improves lipid profile and antioxidant status in patients with metabolic syndrome[J].Oxidative Medicine and Cellular Longevity, 2017, 2017:9763210.
[4] HU L L, LIU R, WANG X H, et al.The sensory quality improvement of Citrus wine through co-fermentations with selected non- Saccharomyces yeast strains and Saccharomyces cerevisiae[J].Microorganisms, 2020, 8(3):323.
[5] LAI Y T, HSIEH C W, LO Y C, et al.Isolation and identification of aroma-producing non-Saccharomyces yeast strains and the enological characteristic comparison in wine making[J].LWT, 2022, 154:112653.
[6] 何曼, 刘畅, 朱凤妹, 等.昌黎产区产酶酵母多样性及其应用潜力分析[J].食品与发酵工业, 2020, 46(5):59-67.
HE M, LIU C, ZHU F M, et al.Diversity and application potential of enzyme producing yeasts in Changli[J].Food and Fermentation Industries, 2020, 46(5):59-67.
[7] 吕枫, 赵兴秀, 李仕鲁, 等.酱香型白酒窖醅中耐高温产香酵母的筛选及性能研究[J].中国酿造, 2020, 39(11):43-47.
LYU F, ZHAO X X, LI S L, et al.Screening of thermotolerant aroma-producing yeast from fermented grains of sauce-flavor Baijiu and its fermentation performance[J].China Brewing, 2020, 39(11):43-47.
[8] 周桂珍. 宁夏贺兰山东麓葡萄酒酵母菌的筛选及混菌发酵研究[D].银川:宁夏大学, 2022.
ZHOU G Z.Screening and mixed fermentation of wine yeast at the eastern foot of Helan Mountain in Ningxia[D].Yinchuan:Ningxia University, 2022.
[9] 赵苗苗. 枸杞发酵酒优良酵母的选育及其应用[D].无锡:江南大学, 2022.
ZHAO M M.Breeding and application of excellent yeast strains for wolfberry wine brewing[D].Wuxi:Jiangnan University, 2022.
[10] 蔡红梅, 田子玉.苯酚-硫酸法测定草莓中总糖含量[J].吉林农业, 2019(4):46.
CAI H M, TIAN Z Y.Determination of total sugar content in strawberry by phenol-sulfuric acid method[J].Agriculture of Jilin, 2019(4):46.
[11] ZHANG X, WANG K Q, GU X B, et al.Flavor chemical profiles of cabernet sauvignon wines:Six vintages from 2013 to 2018 from the eastern foothills of the Ningxia Helan Mountains in China[J].Foods, 2021, 11(1):22.
[12] 董建方. 枸杞果酒低温发酵工艺技术对比传统技术的优势[J].酿酒, 2016, 43(6):78-80.
DONG J F.Advantages of low temperature fermentation technology for Chinese wolfberry wine compared with traditional technology[J].Liquor Making, 2016, 43(6):78-80.
[13] DOMIZIO P, ROMANI C, LENCIONI L, et al.Outlining a future for non-Saccharomyces yeasts: Selection of putative spoilage wine strains to be used in association with Saccharomyces cerevisiae for grape juice fermentation[J].International Journal of Food Microbiology, 2011, 147(3):170-180.
[14] 吴尧, 邓杰, 张芮, 等.异常威克汉逊酵母与酿酒酵母不同接种方式对鸭梨酒品质的影响[J].食品与发酵工业, 2023, 49(15):69-76.
WU Y, DENG J, ZHANG R, et al.Effects of different inoculation methods of Wickerhamomyces anomalus and Saccharomyces cerevisiae on the quality of Yali wine[J].Food and Fermentation Industries, 2023, 49(15):69-76.
[15] WANG C X, MAS A, ESTEVE-ZARZOSO B.Interaction between Hanseniaspora uvarum and Saccharomyces cerevisiae during alcoholic fermentation[J].International Journal of Food Microbiology, 2015, 206:67-74.
[16] 刘瑶, 卢浩成, 胡丽, 等.混菌发酵对葡萄酒成分的影响机制[J].中外葡萄与葡萄酒, 2021(3):66-75.
LIU Y, LU H C, HU L, et al.Influence mechanism of mixed fermentation on wine components[J].Sino-Overseas Grapevine &Wine, 2021(3):66-75.
[17] BELDA I, CONCHILLO L B, RUIZ J, et al.Selection and use of pectinolytic yeasts for improving clarification and phenolic extraction in winemaking[J].International Journal of Food Microbiology, 2016, 223:1-8.
[18] CHEN H, LIU Y Q, CHEN J W, et al.Effects of spontaneous fermentation on microbial succession and its correlation with volatile compounds during fermentation of Petit Verdot wine[J].LWT, 2022, 168:113890.
[19] PEINADO R A, MORENO J, BUENO J E, et al.Comparative study of aromatic compounds in two young white wines subjected to pre-fermentative cryomaceration[J].Food Chemistry, 2004, 84(4):585-590.
[20] ABRAHAMSE C E, BARTOWSKY E J.Timing of malolactic fermentation inoculation in Shiraz grape must and wine:Influence on chemical composition[J].World Journal of Microbiology &Biotechnology, 2012, 28(1):255-265.
[21] 邵淑贤, 徐梦婷, 林燕萍, 等.基于电子鼻与HS-SPME-GC-MS技术对不同产地黄观音乌龙茶香气差异分析[J].食品科学, 2023, 44(4):232-239.
SHAO S X, XU M T, LIN Y P, et al.Differential analysis of aroma components of Huangguanyin oolong tea from different geographical origins using electronic nose and headspace solid-phase microextraction-gas chromatography-mass spectrometry[J].Food Science, 2023, 44(4):232-239.
[22] 郭志君, 杨磊, 骆红霞, 等.苹果酸-乳酸发酵对刺梨酒香气的影响[J].食品与机械, 2022, 38(3):197-204;233.
GUO Z J, YANG L, LUO H X, et al.Effect of malolactic fermentation on volatile compounds of Rosa roxburghii Tratt wine[J].Food &Machinery, 2022, 38(3):197-204;233.
[23] 赵美, 田秀, 李敏, 等.粟酒裂殖酵母与酿酒酵母共同接种发酵对‘黑比诺’干红葡萄酒品质的影响[J].食品科学, 2021, 42(24):108-116.
ZHAO M, TIAN X, LI M, et al.Effect of mixed culture fermentation with Schizosaccharomyces pombe and Saccharomyces cerevisiae on the quality of ‘pinot noir’ dry red wine[J].Food Science, 2021, 42(24):108-116.