米香型白酒是以大米为原料,小曲为糖化发酵剂,采用先固态培菌后发酵的方法,后经蒸馏、陈酿、勾兑而成[1]。其主要的呈香物质是乳酸乙酯、乙酸乙酯和β-苯乙醇[2],现行GB/T 10781.3—2006 《米香型白酒》中对3种关键风味物质的含量有具体的要求,其含量的高低决定了酒品质的级别。其次,酯类物质的含量和组成是决定白酒风格与品质的关键因素之一[3]。米香型白酒是我国白酒四大基本香型之一,风味独特,口感柔和,但目前发展与推广却受到一定限制。主要是由于米香型白酒酿造原料相对单一,导致风味相对单一,且酿造工艺相对简单,发酵周期短,导致香味组分少,醇厚不足。为增加米香型白酒中的独特香气,在生产之后会放置较长一段时间,但酒体香气仍然单薄,口味较淡[4]。在白酒发酵过程中,酒曲中的产酯酵母以糖类、有机酸等为营养成分,通过自身代谢合成多种酯类物质[5],促进白酒特征性风味物质的形成[6]。关于白酒酒曲的产酯酵母筛选已有较多的报道[7-9],添加产酯酵母强化发酵以提高白酒中酯类物质含量是目前可行有效的方法。蒲春等[10]在大曲中筛选出一株产酯酵母并确定其为异常毕赤酵母,试验表明该酵母麸曲的酯化力可达到19.36 mg/100 mL。董士伟等[11]在豉香型白酒发酵环境中分离得到一株优良产酯酵母,将其强化应用于豉香型白酒中,其产乙酸乙酯含量提高了49%,且酒体的香气更为突出。刘小改等[12]将一株高产乙酸乙酯的产酯酵母J-4用于清香型麸曲白酒酿造,其产乙酸乙酯含量高达1.07 g/L,总酯含量提高了50.7%,改善了原酒的口感,提升了原酒的品质。FAN等[13]研究了异常威克汉姆酵母和酿酒酵母共同作用对乙酸乙酯产量的影响,发现2种酵母的使用比率为3∶1时,产生的乙酸乙酯高达6.41 g/L。2种酵母的协同发酵不仅提高了乙酸乙酯的产量,而且增加了其他风味化合物的含量,如β-苯乙醇和苯乙酸乙酯等。
不同来源的产酯酵母对白酒强化发酵的性能有不同程度的影响。本团队前期从广东地区多个米香型白酒酒曲中筛选了多株产酯酵母,并对菌株进行了鉴定与产酯性能测定。本研究以5株前期得到的产酯能力较好的产酯酵母和目前已报道的2株产酯酵母作为初筛菌株,通过前体物添加培养,比较菌株合成米香型白酒关键酯——乙酸乙酯和乳酸乙酯的能力。另外,受限于野生型产酯酵母本身的代谢,菌种难以达到生产需求的性能。诱变育种可有效提高菌种的生产能力[14-16]。鲁云风等[17]将一株野生型酵母常压室温等离子体诱变选育,诱变后的菌株发酵猕猴桃果酒产香力得到提高,发酵力、酒精度等均优于野生型。陆振群等[18]通过紫外诱变原始菌株,诱变后的菌株产酯总量提高了58%左右。张彬等[19]经航空诱变筛选出一株产酯能力提高70%的菌株。因此,本文还对初筛得到的产乙酸乙酯和乳酸乙酯能力较强的菌株进行紫外诱变筛选,以期获得产关键酯能力有所提升,并能在米香型白酒发酵环境中有效提升酒体关键酯的突变菌株,为米香型白酒生香发酵提供优质种子资源,推动米香型白酒酿造工业的发展。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
实验室保存的产酯酵母菌株信息如表1所示。
表1 实验室保存的产酯酵母菌株
Table 1 Ester-producing yeast preserved in the laboratory

编号菌种信息保藏号YJ26葡萄牙棒孢酵母(Clavispora lusitaniae)GDMCC 62906CM15酿酒酵母(Saccharomyces cerevisiae)GDMCC 61757YJ18葡萄牙棒孢酵母(Clavispora lusitaniae)GDMCC 61758JX14酿酒酵母(Saccharomyces cerevisiae)GDMCC 63610HJ31费比恩塞伯林德纳氏酵母(Cyberlindnera fabianii)GDMCC 63611CICC-1651异常汉逊酵母(Hansenula anomala)CICC-1651CICC-1716异常毕赤酵母(Pichia anomala)CICC-1716
实验室保存的突变菌株信息如表2所示。
表2 实验室保存的突变菌株
Table 2 Mutant strain preserved in the laboratory
编号菌种信息保藏号J-5酿酒酵母(Saccharomyces cerevisiae)GDMCC 63613H-8费比恩塞伯林德纳氏酵母(Cyberlindnera fabianii)GDMCC 63612
酒曲,来源于某广东地区的酒厂。
1.1.2 试剂
乙酸,西陇科学股份有限公司;L-乳酸,上海麦克林生化科技有限公司;酵母浸膏、蛋白胨、麦芽汁培养基,广东环凯微生物科技有限公司;葡萄糖,天津市大茂化学试剂厂;甘油,天津市永大化学试剂有限公司;麦芽提取物,北京索莱宝科技有限公司;无水乙醇,天津市科密欧化学试剂有限公司;乙酸乙酯、乳酸乙酯,阿拉丁生化科技股份有限公司;3,5-二硝基水杨酸显色剂,广州和为医药科技有限公司;大米,华润五丰米业(中国)有限公司。
1.1.3 培养基
YPD(yeast extract peptone dextrose medium)液体培养基:蛋白胨20 g/L,葡萄糖20 g/L,酵母提取粉10 g/L。
YPD固体培养基:蛋白胨20 g/L,葡萄糖20 g/L,酵母提取粉10 g/L,琼脂粉20 g/L。
1.2 仪器与设备
LDZX-50FBS立式压力蒸汽灭菌锅,上海申安医疗器械厂;SHA-BAB数显冷冻水浴恒温振荡器,常州荣华仪器制造有限公司;SW-CJ-1F超净工作台,苏州安泰空气技术有限公司;SPL-150生化培养箱,天津市莱玻特瑞仪器设备有限公司;YP502 N电子天平,上海舜宇恒平科学仪器有限公司;Agilent-7860气相色谱仪,美国安捷伦公司;RX-50显微镜,宁波舜宇仪器有限公司;MIS-25旋涡混匀仪,杭州米欧仪器有限公司;TU-1901双光束紫外可见分光光度计,北京普析通用仪器有限责任公司;HH-2数显恒温水浴锅,常州澳华仪器有限公司;MZ-SY280-JB5A蒸酒(馏)式提纯机,中山市奥尼亚电器有限公司。
1.3 实验方法
1.3.1 诱变出发菌株的确定
1.3.1.1 产酯酵母菌种子液的制备
将7株产酯酵母菌株分别在YPD固体培养基上平板划线,28 ℃恒温培养条件下倒置培养48 h,挑取单菌落接种装有10 mL的YPD液体培养基中,150 r/min、28 ℃、活化培养24 h。将活化后的培养液转接到装有100 mL的YPD液体培养基中,150 r/min、28 ℃、活化培养24 h。将扩培后的菌液倒入50 mL无菌离心管中,10 000 r/min离心10 min,去上清液,加入30 mL无菌水反复重悬菌体,离心洗涤2次,以除去残留的培养基。在弃去上清液后的菌体中加入适量的无菌水,充分振荡混匀,使其浓度稀释至OD600值为0.6~0.8,即成酵母菌种子液。
1.3.1.2 菌株合成乙酸乙酯能力的比较
在250 mL锥形瓶中配制90 mL的麦芽汁培养基,添加0.2%(体积分数)的乙酸,接种10 mL酵母菌种子液,150 r/min、30 ℃摇床发酵7 d。发酵结束后采用气相色谱法技术测定发酵液中乙酸乙酯的含量。
1.3.1.3 菌株合成乳酸乙酯能力的比较
在250 mL锥形瓶中配制90 mL的麦芽汁培养基,添加0.3%(体积分数)的L-乳酸,接种10 mL酵母菌种子液,150 r/min、30 ℃摇床发酵7 d。发酵结束后采用气相色谱法技术测定发酵液中乳酸乙酯的含量。
1.3.1.4 发酵液乙酸乙酯和乳酸乙酯的测定
气相色谱条件:采用DB-WAX UI色谱柱(30 m×0.25 mm×0.25 μm),进样口温度220 ℃,进样体积为1 μL,FID检测器温度230 ℃,氮气(N2)∶氢气(H2)∶空气(O2)=20∶40∶400,分流比20∶1。
升温程序:起始温度40 ℃,以3 ℃/min升温到70 ℃,保持3 min,以10 ℃/min升温到180 ℃,保持2 min。其中,乙酸乙酯的标准曲线方程为y=1.184 64x+20.307 24(R2=0.999 4),乳酸乙酯的标准曲线方程为y=3.012 61x-13.058 49(R2=0.999 5)。
1.3.2 菌株的诱变筛选
1.3.2.1 出发菌株生长曲线的测定
挑选分别产乙酸乙酯、乳酸乙酯产量最高的菌株,确定2株出发菌株的生长曲线。将2株酵母菌接种到装有YPD液体培养基的试管中,150 r/min、28 ℃活化培养至试管底部出现大量沉淀,调整菌液OD600值为0.6~0.8,制备成酵母菌种子液,种子液以2%(体积分数)的接种量接入YPD液体培养基中,在150 r/min、28 ℃条件下培养,每隔2 h定时取样。采用分光光度计法在波长600 nm处测定酵母菌液的吸光度值,以灭菌的YPD液体培养基为对照,记录数据绘制生长曲线。以上试验取3次平行结果。
1.3.2.2 乙酸和L-乳酸对出发菌株致死浓度的测定
按照1.3.1.1节制备HJ31的种子液,在15 mL YPD液体培养基中接入2%(体积分数)酵母菌种子液,分别加入0.1%、0.2%、0.3%、0.4%、0.5%、0.6%、1.5%和2%(体积分数)的乙酸,150 r/min、28 ℃摇床培养48 h,以不加入乙酸的菌液作为对照,观察培养基沉淀情况。
按照1.3.1.1节制备JX14的种子液,在15 mL YPD液体培养基中接入2%(体积分数)酵母菌种子液,分别加入0.7%、1%、2%、3%、3.5%、4%、4.5%、5%、5.5%和6%(体积分数)的L-乳酸,150 r/min、28 ℃摇床培养48 h,以不加入L-乳酸的菌液作为对照,观察培养基沉淀情况。
1.3.3 菌株的紫外诱变
将活化后的出发菌株培养液转接到装有100 mL的YPD液体培养基中,150 r/min、28 ℃、培养至对数中后期,取适量菌液均匀涂布于YPD固体平板培养基中,开启已预热的紫外灯(30 W),在距离紫外灯垂直30 cm处分别照射30、60、90、120、150、180、210 s。以不照射的菌液作为对照。照射结束后,在避光条件下28 ℃培养48 h,避免光复对诱变的影响。致死率计算如公式(1)所示:
致死率![]()
(1)
1.3.4 诱变菌株的筛选
1.3.4.1 诱变菌株初筛
从HJ31紫外诱变平板中选取所有单菌落到含有0.3%乙酸(该浓度为1.3.2.2节中确定的致死浓度)的YPD液体培养基中,48孔板培养,150 r/min、28 ℃培养24 h,观察沉淀状况。挑取沉淀量明显多于原始菌株的诱变菌株,划线活化后用于甘油管保存。
从JX14紫外诱变平板中选取所有单菌落到含有0.5% L-乳酸(该浓度为1.3.2.2节中确定的致死浓度)的YPD液体培养基中,48孔板培养,150 r/min、28 ℃培养24 h,观察沉淀状况。挑取沉淀量明显多于原始菌株的诱变菌株,划线活化后用于甘油管保存。
1.3.4.2 诱变菌株复筛
将初筛得到的酵母菌按照1.3.1节的方法进行培养和产酯能力的测定。
1.3.5 诱变菌株强化发酵米香型白酒提升乙酸乙酯和乳酸乙酯能力的测定
1.3.5.1 菌种强化半固态发酵米香型白酒
酿造工艺在文献[20]的基础上进行调整:a)淘米:称取250 g大米,反复淘洗2遍。b)蒸饭:将洗干净的大米装入盆中,加入190 mL水,使用高压灭菌锅115 ℃蒸煮15 min,将米饭彻底蒸熟。c)拌曲搭窝:将蒸熟的米饭均匀摊开,待米饭晾凉至30 ℃以下,加入老八尺酒曲(拌曲量为大米质量的0.4%),用灭菌的勺子充分搅拌均匀,让酒曲尽可能布满米饭当中,将拌好的米饭装入发酵罐中,在米饭中间留一个口,俗称搭窝,用纱布封住瓶口。d)糖化:将装好的米饭放入34 ℃恒温培养箱中,固态糖化40 h。e)发酵:固态糖化结束后,加入已灭菌的纯净水(加水量为大米质量的120%)和产酯酵母菌种子液(加菌量为大米质量的10%),搅拌均匀,改用保鲜膜封口,28 ℃恒温培养15 d。f)蒸馏:发酵结束后,在蒸馏前向酒醪中加入纯净水250 mL(加水量与大米质量体积相等),蒸馏出250 mL酒液。g)制备醪液:取适量米香型白酒混合物置于干净的离心管中,10 000 r/min离心10 min,取上清液作为待测醪液,保存于棕色广口瓶中,放置冰箱4 ℃备用。
1.3.5.2 发酵米香型白酒中乙酸、乳酸、乙酸乙酯和乳酸乙酯的测定
取待测醪液于0.22 μm有机滤膜过滤,装入液相小瓶备用,通过液相色谱对乙酸、乳酸含量进行测定。液相色谱条件:色谱柱为ZORBAX SB-Aq(4.6 mm×250 mm, 5-Micron);紫外检测波长为214 nm;进样体积为10 μL;流动相A为甲醇;流动相B为0.01 mol/L KH2PO4溶液(pH=2.83);两者流动相比例为3∶97;流速为0.8 mL/min;柱温为30 ℃。
醪液中的乙酸乙酯和乳酸乙酯测定方法1.3.1.4节按照进行。
2 结果与分析
2.1 诱变出发菌株的确定
2.1.1 菌株合成乙酸乙酯能力的比较
挥发性化合物对白酒质量有重要作用,乙酸乙酯在白酒中是一种重要的酯类化合物,具有水果香味,影响着白酒的风格和感官品质,是米香型白酒中的关键酯之一。考虑菌株在白酒酿造应用中大多在含一定量乙酸的条件下进行生长繁殖,因此,7株产酯酵母菌接种在含0.2%(体积分数)乙酸的麦芽汁发酵培养基中培养,通过气相色谱检测比较每株菌合成乙酸乙酯的能力。如图1所示,菌株HJ31产乙酸乙酯量为2 398.16 mg/L,合成能力显著高于其他菌株,比2株已报道的产酯酵母合成能力更强,因此HJ31作为后续诱变选育的出发菌之一。
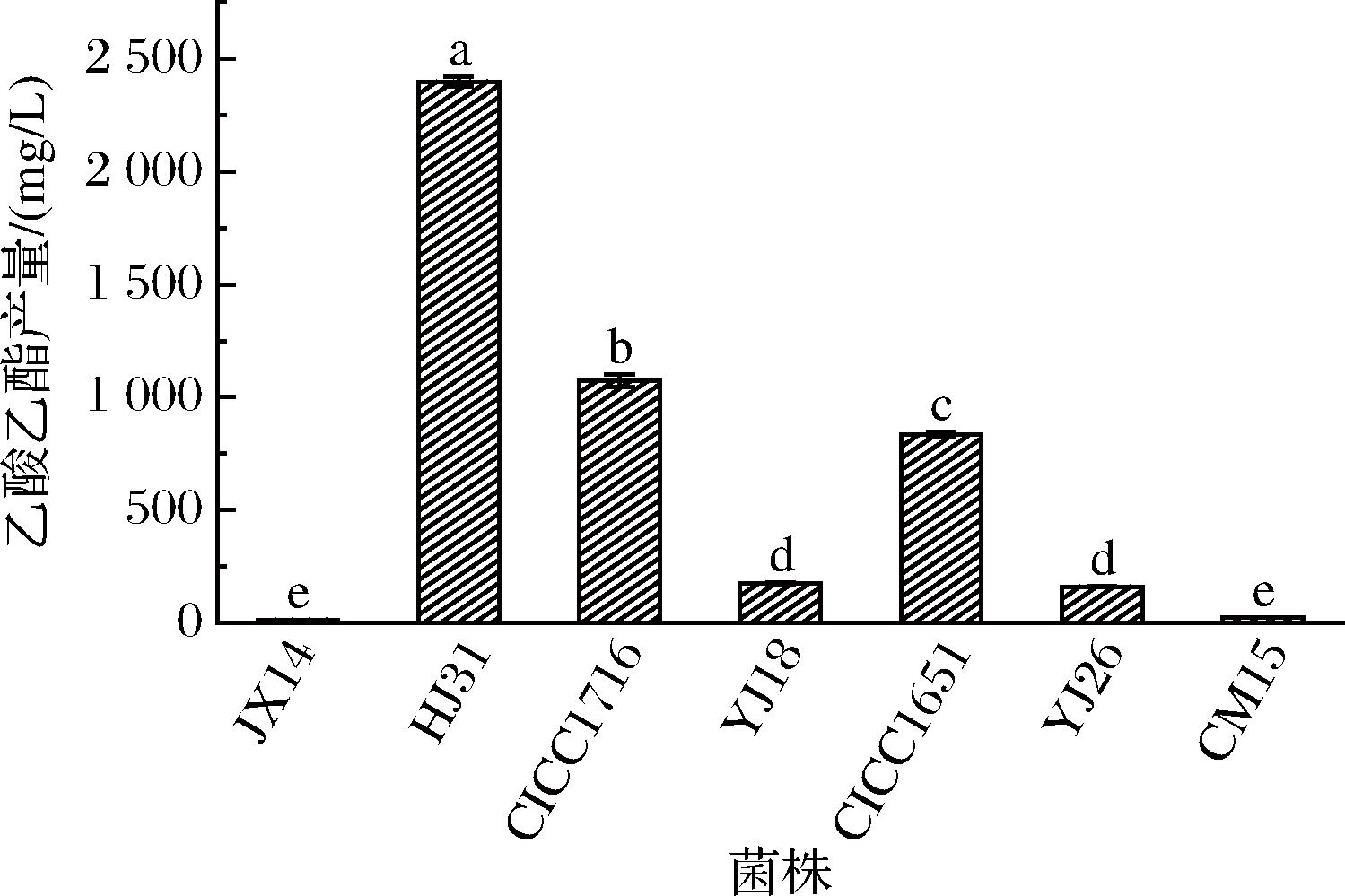
图1 添加乙酸对菌株发酵产乙酸乙酯的影响
Fig.1 Effect of adding acetic acid on the fermentation production of ethyl acetate by strains
注:不同字母表示差异显著(P<0.05)(下同)。
2.1.2 菌株合成乳酸乙酯能力的比较
乳酸乙酯具有水果味和奶油香味,且具有香不露头的性质,赋予了白酒香醇浓厚的风味,并且对白酒的口感起着重要作用,是米香型白酒中的关键酯之一。考虑菌株在白酒酿造应用中大多在含一定量乳酸的条件下进行生长繁殖,因此,7株产酯酵母菌接种在含0.3%(体积分数)乳酸的麦芽汁发酵培养基中培养,通过气相色谱检测比较每株菌合成乳酸乙酯的能力。如图2所示,菌株JX14产乳酸乙酯量为86.64 mg/L,合成能力显著高于其他菌株,比2株已报道的产酯酵母合成能力更强,因此JX14作为后续诱变选育的出发菌之一。
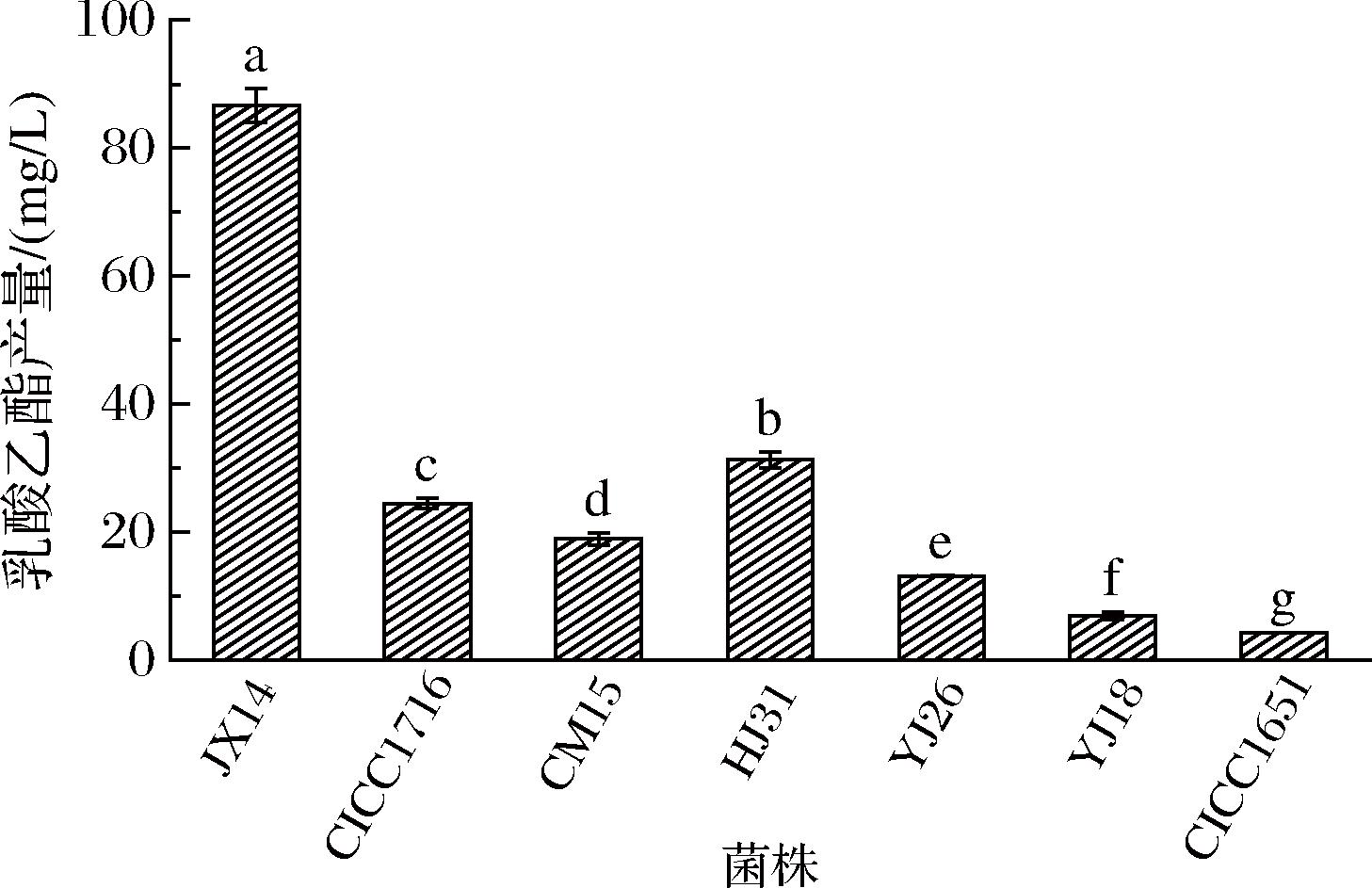
图2 添加L-乳酸对菌株发酵产乙酸乙酯的影响
Fig.2 Effect of adding L-lactic acid on the fermentation production of ethyl lactate by strains
2.2 菌株诱变筛选的条件
2.2.1 出发菌株的生长曲线
由图3可知,在22 h培养期内,2株酵母菌株均经历了延滞期、对数生长期和稳定期。酵母菌株HJ31从2 h后缓慢生长,6 h进入对数生长期,14 h进入稳定期;菌株JX14从2 h后开始缓慢生长,8 h进入对数生长期,16 h进入稳定期;处于对数生长期时,对环境因素的作用特别敏感[21-22],菌体生长繁殖速度加快,酶系活跃,代谢旺盛,菌株HJ31的吸光度值高于菌株JX14。菌株的生长情况为后续诱变方法的确定提供参考。
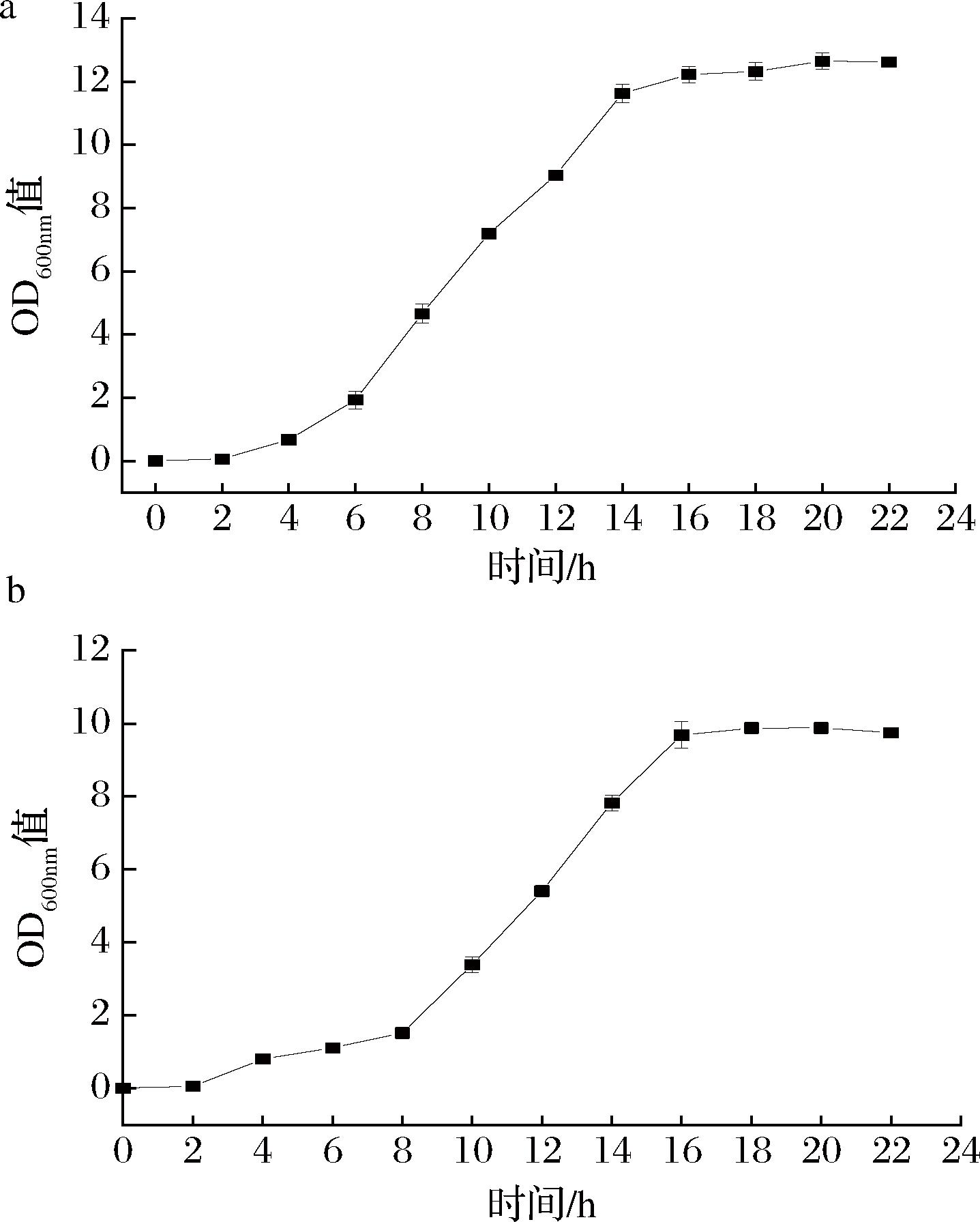
a-HJ31;b-JX14
图3 两株酵母菌的生长曲线
Fig.3 The growth curves of two yeast strains
2.2.2 乙酸和L-乳酸对出发菌株的致死浓度
菌株催化前体物乙酸和L-乳酸合成为酯的能力提高后,会消耗更多环境中对其生长抑制的乙酸和L-乳酸,从而其耐受乙酸和L-乳酸的能力得到提高。根据以上推测,选择使用高浓度酸作为诱变菌株筛选条件,因此需要先对菌株对乙酸和L-乳酸的耐受情况进行测定。由表3可知,随着酸浓度增加,沉淀逐渐减少,乙酸在0.3%(体积分数)时有少量沉淀生成,而在乙酸达到0.4%(体积分数)时,菌株HJ31无沉淀生成,表明此时菌株不生长。如表4所示,当L-乳酸在5%(体积分数)时有少量沉淀生成,在L-乳酸达到5.5%(体积分数)时,菌株JX14无沉淀生成,表明此时菌株不生长。因此确定乙酸为0.3%(体积分数)、L-乳酸为5%(体积分数),为紫外诱变菌株的筛选条件。
表3 HJ31对乙酸的耐受性
Table 3 Tolerance of HJ31 to acetic acid

乙酸/%(体积分数)00.10.20.30.40.50.611.52沉淀情况++++++++++------
注:“++++”表示沉淀最多;“+++”表示沉淀较多;“++”表示沉淀较少;“+”表示沉淀很少;“-”表示无沉淀(下同)。
表4 JX14对L-乳酸的耐受性
Table 4 Tolerance of JX14 to L-lactic acid

L-乳酸/%(体积分数)00.71233.544.555.56沉淀情况+++++++++++++++++++++++++--
2.3 菌株紫外诱变与筛选
2.3.1 紫外诱变致死率的测定
菌株致死率曲线如图4所示,菌株的致死率随着紫外灯照射时间的延长而急速上升,这表明照射时间对酵母菌株的致死率有重要影响。当照射时间为120 s时,菌株HJ31的致死率为83.36%,150~240 s时,致死率均在90%以上;当照射时间为150 s时,菌株JX14的致死率为85.45%,180~240 s时,致死率均在90%以上。据报道,采用致死率80%~90%的诱变剂量有利于正向突变[23],所以菌株HJ31选择120 s作为紫外诱变照射时间;菌株JX14选择150 s作为紫外诱变照射时间。
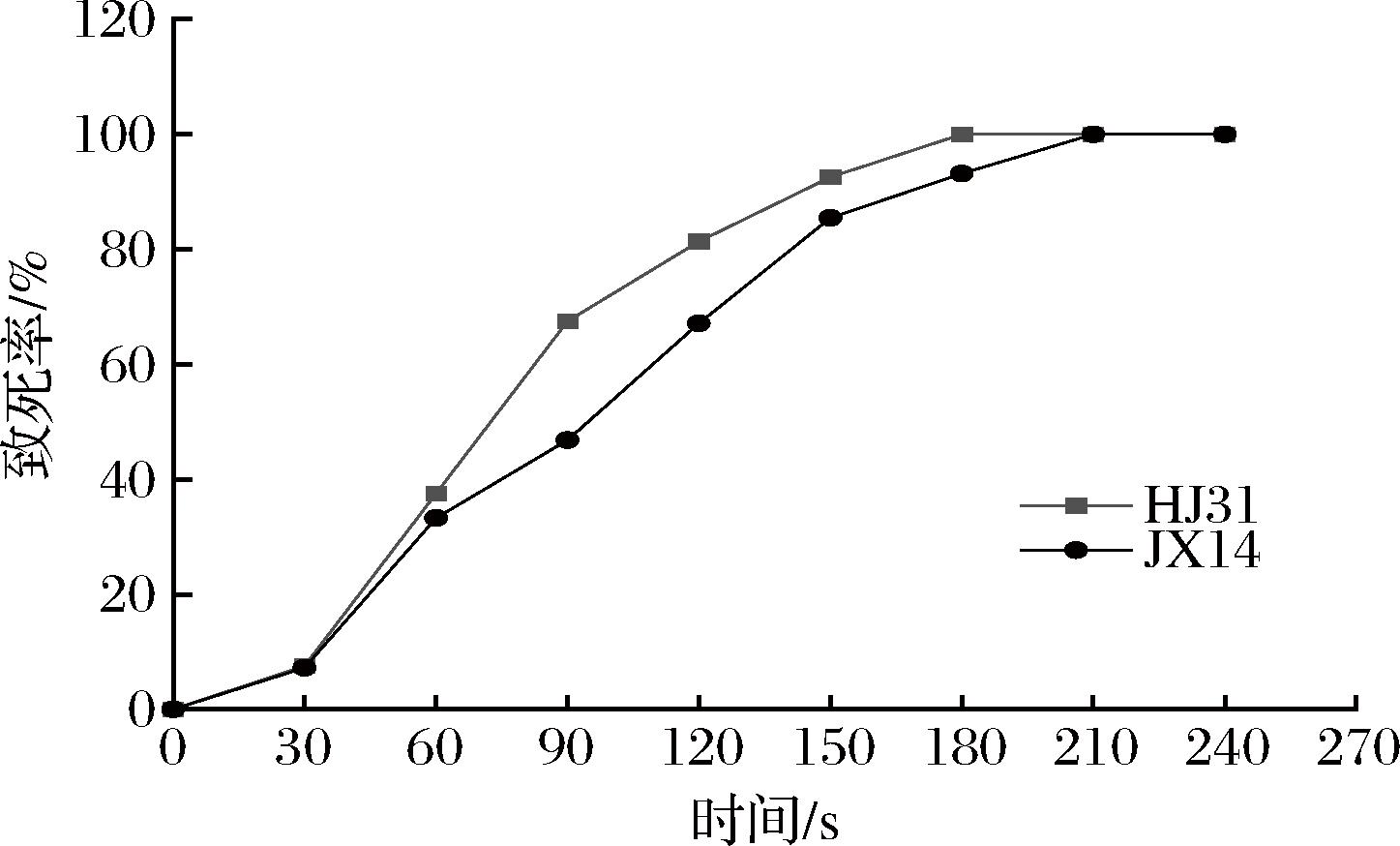
图4 紫外照射时间对菌株致死率的影响
Fig.4 Effect of ultraviolet irradiation time on strain lethality
2.3.2 诱变菌株初筛
经过多批紫外诱变试验,挑取菌落较大、生长较快的诱变菌株进行酸耐受性测定。观察诱变菌株沉淀情况,挑取沉淀量明显多于原始菌株的诱变菌株。菌株HJ31经紫外诱变后,从168株突变菌株中初筛出17株可耐受0.3%(体积分数)乙酸的诱变菌株;菌株JX14经紫外诱变后从144株突变菌株中初筛出25株可耐受5%(体积分数)L-乳酸的诱变菌株。
2.3.3 诱变菌株复筛
将出发菌株和初筛的诱变菌株分别进行添加前体物发酵培养,测定乙酸乙酯或乳酸乙酯产量。由表5可知,对比诱变前菌株HJ31,诱变后菌株的乙酸乙酯产量有显著提高,从中筛选到一株乙酸乙酯产量最高的正突变菌株,编号为H-8,其乙酸乙酯产量为(1 836.81±37.24) mg/L,较出发菌株HJ31提高了28.76%。
表5 菌株HJ31及其诱变菌株的乙酸乙酯产量比较
Table 5 Comparison of ethyl acetate yield in HJ31 and its mutant strains
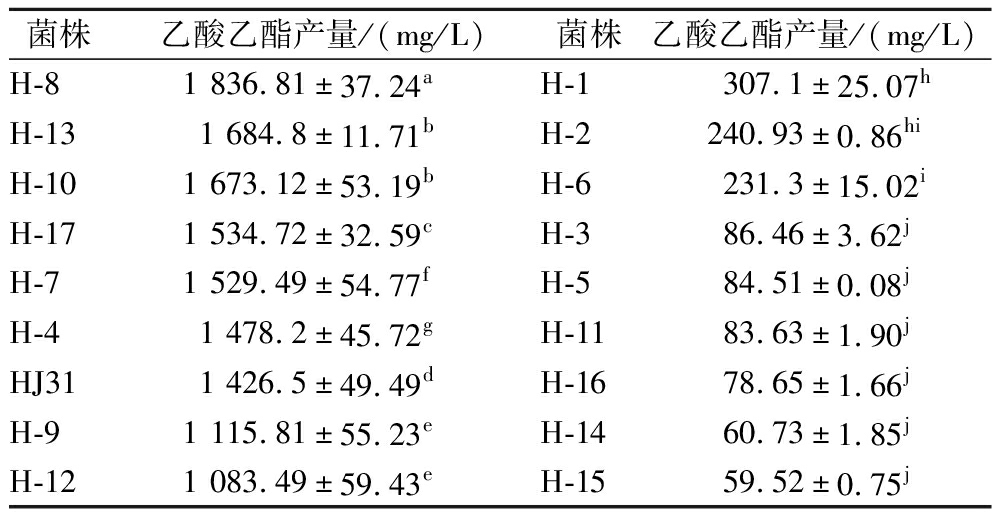
菌株乙酸乙酯产量/(mg/L)菌株乙酸乙酯产量/(mg/L)H-81 836.81±37.24aH-1307.1±25.07hH-131 684.8±11.71bH-2240.93±0.86hiH-101 673.12±53.19bH-6231.3±15.02iH-171 534.72±32.59cH-386.46±3.62jH-71 529.49±54.77fH-584.51±0.08jH-41 478.2±45.72gH-1183.63±1.90jHJ311 426.5±49.49dH-1678.65±1.66jH-91 115.81±55.23eH-1460.73±1.85jH-121 083.49±59.43eH-1559.52±0.75j
注:同一列数据中,字母不同表示差异显著(P< 0.05)(下同)。
由表6可知,对比诱变前菌株JX14,诱变后菌株的乳酸乙酯产量有显著提高,从中筛选到一株乳酸乙酯产量最高的正突变菌株,编号为J-5,其乳酸乙酯产量为(87.77±0.64) mg/L,较出发菌株JX14提高了14.64%。
表6 菌株JX14及其诱变菌株的乳酸乙酯产量比较
Table 6 Comparison of ethyl lactate production in JX14 and its mutant strains
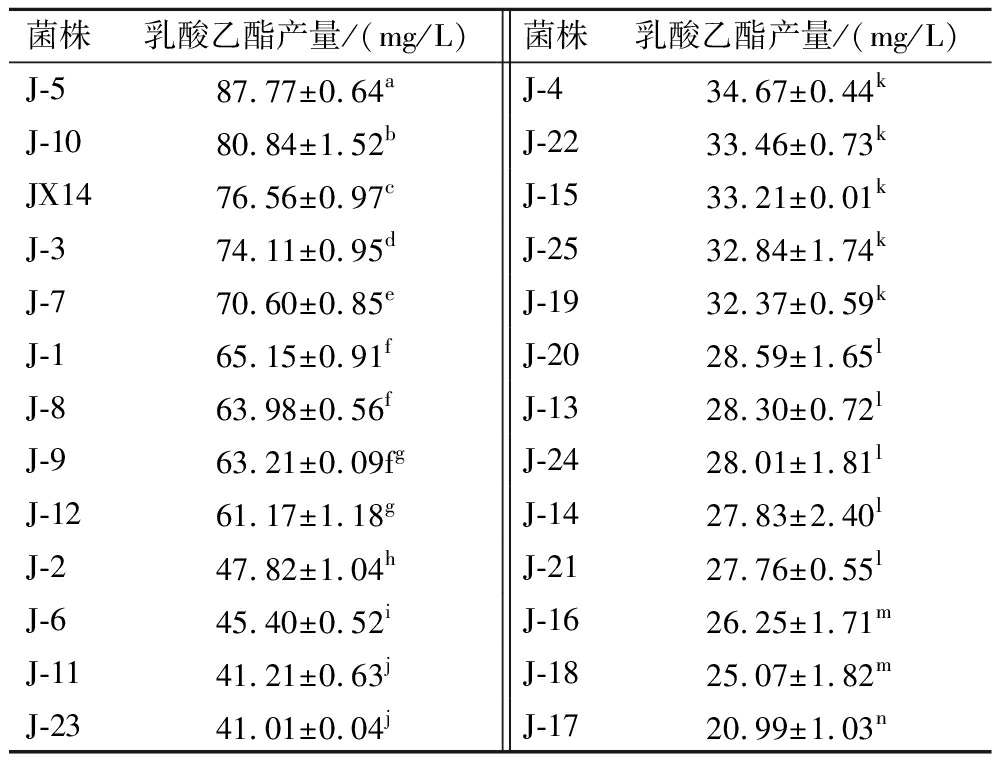
菌株乳酸乙酯产量/(mg/L)菌株乳酸乙酯产量/(mg/L)J-587.77±0.64aJ-434.67±0.44kJ-1080.84±1.52bJ-2233.46±0.73kJX1476.56±0.97cJ-1533.21±0.01kJ-374.11±0.95dJ-2532.84±1.74kJ-770.60±0.85eJ-1932.37±0.59kJ-165.15±0.91fJ-2028.59±1.65lJ-863.98±0.56fJ-1328.30±0.72lJ-963.21±0.09fgJ-2428.01±1.81lJ-1261.17±1.18gJ-1427.83±2.40lJ-247.82±1.04hJ-2127.76±0.55lJ-645.40±0.52iJ-1626.25±1.71mJ-1141.21±0.63jJ-1825.07±1.82mJ-2341.01±0.04jJ-1720.99±1.03n
2.4 诱变菌株强化发酵米香型白酒提升乙酸乙酯和乳酸乙酯的能力检测
2.4.1 不同强化发酵方式的比较
产酯酵母混合发酵对白酒风味有很大影响,米香型白酒中主要的有机酸是乙酸和乳酸,乳酸乙酯由乳酸和乙醇酯化反应生成[24];乙酸乙酯主要由乙酸和乙醇通过酯化酶酯化反应生成[25]。以不添加产酯酵母菌发酵米香型白酒作为空白组,由图5可知,对比空白组,产酯酵母的添加对米香型白酒中的特征性风味物质乳酸乙酯和乙酸乙酯大部分有显著提高。其中,所有单一产酯酵母添加对米香型白酒中乳酸乙酯的产量均有显著提高,但对乙酸乙酯的产量均显著降低。突变菌J-5单一强化发酵产生的乙酸乙酯质量浓度最低,为(39.37±0.14) mg/L,而乳酸乙酯浓度最高,为(81.18±0.23) mg/L。突变菌J-5与突变菌H-8以1∶1配比发酵时,乳酸乙酯含量有显著提升,而乙酸乙酯含量则低于空白。出发菌JX14与突变菌H-8以7∶3配比发酵时,2种酯均有显著提升,乳酸乙酯含量为(79.34±0.28) mg/L,乙酸乙酯含量为(133.58±0.94) mg/L,对比不添加产酯酵母发酵的米香型白酒,分别提高了26.66%和49.02%。从上述结果可以看出,突变菌株虽然在较为简单的培养基中能催化较多前体物合成酯,但在米香型白酒较为复杂的体系中却未能有很好的提升能力。2个突变菌株进行复配强化发酵未能有效提升2种关键酯含量,而出发菌株JX14和突变菌H-8株进行复配强化发酵则能有效提升酒中2种关键酯的含量。
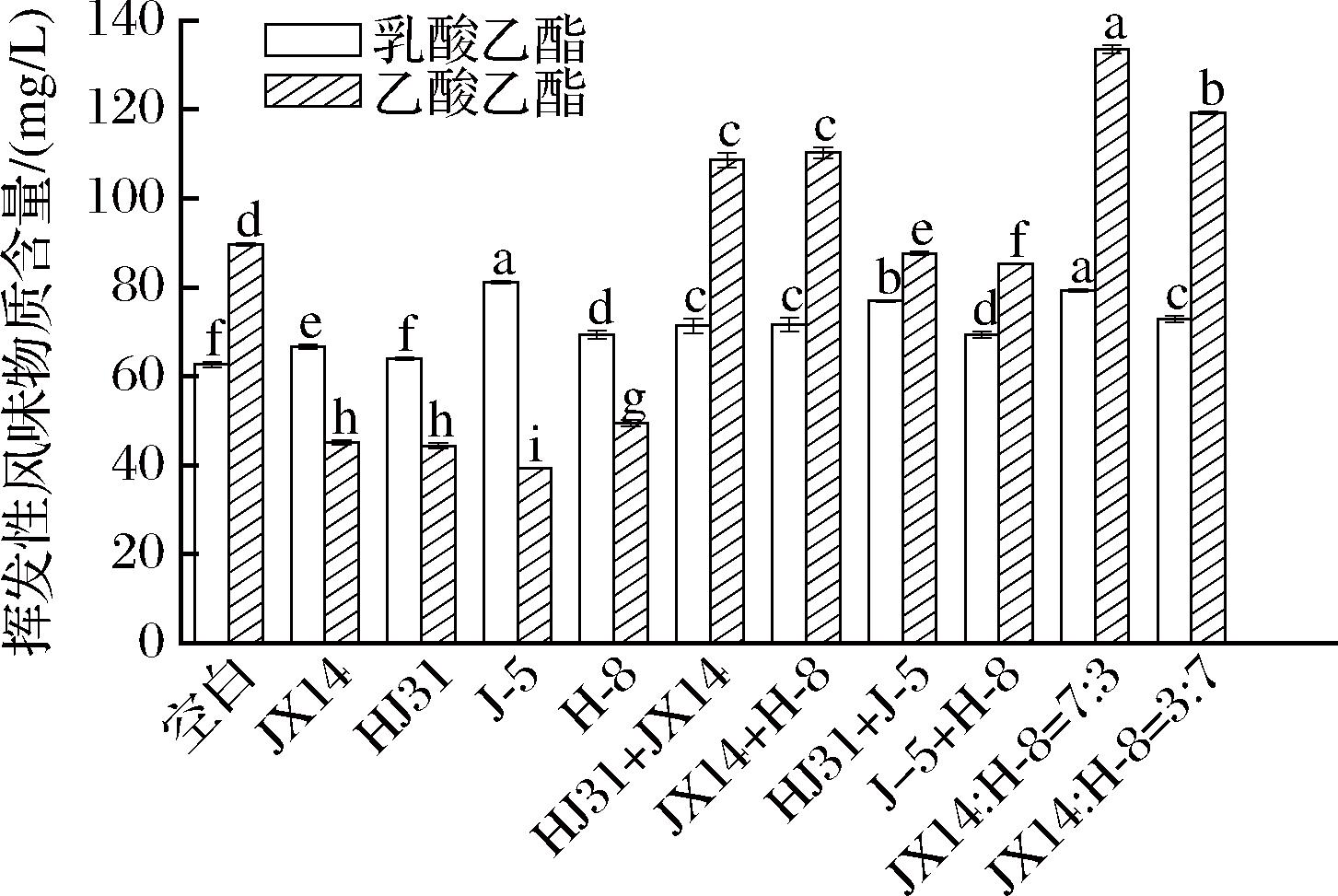
图5 产酯酵母对米香型白酒中的特征风味物质乙酸乙酯和乳酸乙酯产量的影响
Fig.5 Effect of ester producing yeast on the yield of ethyl lactate and ethyl acetate in rice-flavor Baijiu
注:如无特别标注,产酯酵母菌株混合发酵的配比均为1∶1;字母不同表示差异显著(P<0.05)。
2.4.2 强化发酵对乙酸、乳酸、乳酸乙酯和乙酸乙酯含量变化的影响
另外,对出发菌JX14与突变菌H-8以7∶3配比强化发酵过程中乙酸、乳酸、乳酸乙酯和乙酸乙酯的动态变化进行检测,以期察看菌种是否有效通过前体物的消耗合成对应的酯类物质。如图6-a、图6-b所示,发酵至第3天,实验组的乙酸消耗量显著大于空白组,而乳酸到发酵8 d时,实验组的消耗量才显著大于空白组。发酵结束后,2种酸的总体含量实验组基本都比空白组低。如图6-c、图6-d所示,实验组中的乙酸乙酯和乳酸乙酯在第发酵到达第11天时才显著高于空白组,并在随后4 d发酵中含量未有进一步的提升。从上述结果可以看出,底物消耗与产物合成并非在同一时间段发生,菌株的添加时间可能对关键酯提升程度有较大影响。还有,菌株添加后其生长情况以及对其他微生物有何影响等内容仍需要进一步研究和探讨。
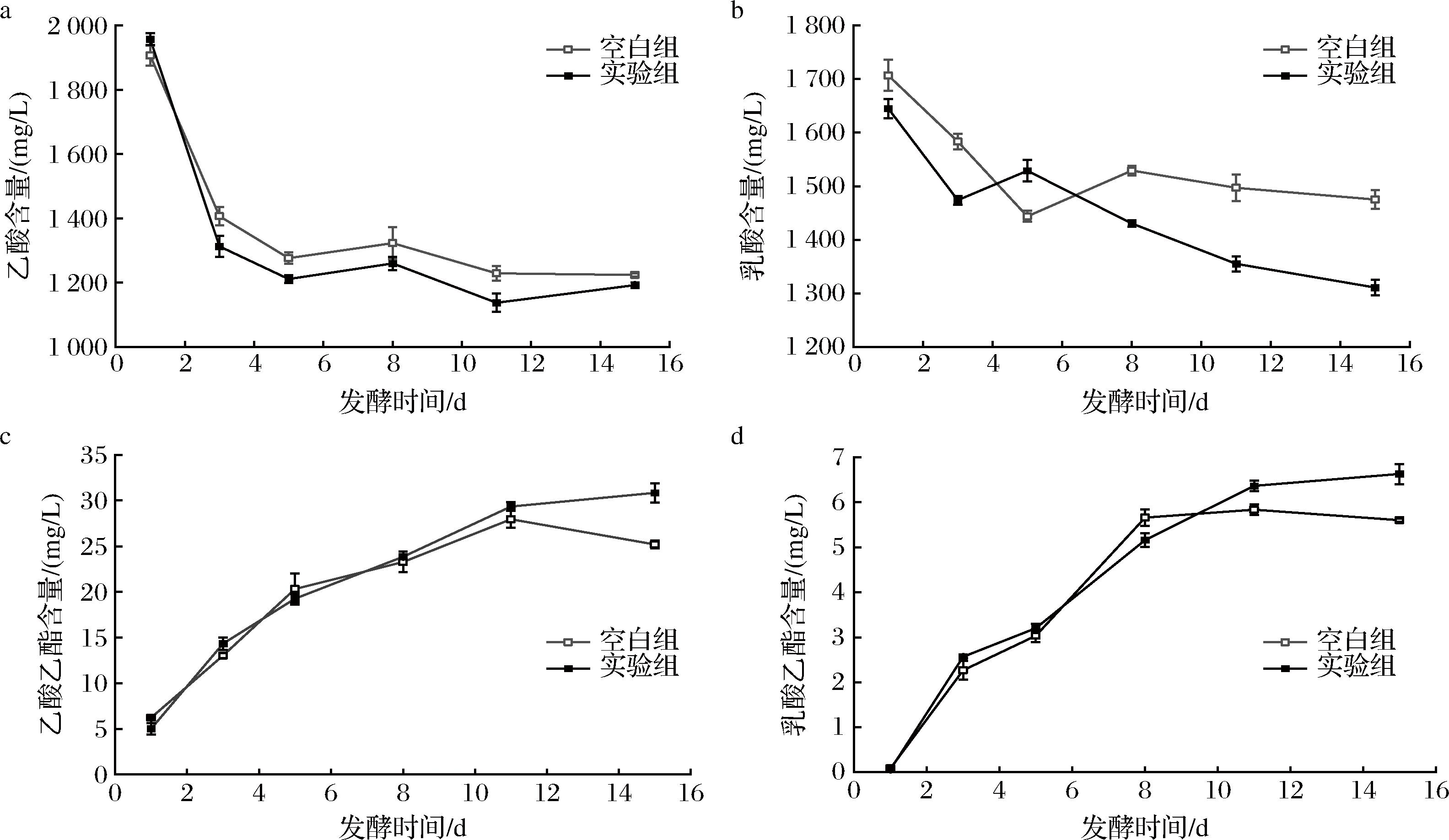
a-乙酸;b-乳酸;c-乙酸乙酯;d-乳酸乙酯
图6 发酵醪液中乙酸、乳酸、乙酸乙酯和乳酸乙酯的含量变化
Fig.6 Changes in the content of acetic acid, lactic acid, ethyl acetate, and ethyl lactate during fermentation
3 结论
本研究利用突变方式提高酵母产酯能力,以一株产乙酸乙酯能力较强的费比恩塞伯林德纳氏酵母(Cyberlindnera fabianii)HJ31和一株产乳酸乙酯能力较高的酿酒酵母(Saccharomyces cerevisiae)JX14确定为出发菌株,通过对其进行紫外诱变,通过高浓度乙酸或L-乳酸进行初选和摇瓶发酵产物测定复筛,筛选出一株产乙酸乙酯的突变菌株H-8和一株产乳酸乙酯的突变菌株J-5,其在普通培养基中合成乙酸乙酯和乳酸乙酯的能力分别提高了28.76%和14.64%。单一添加突变菌株强化发酵米香型白酒未能有效提高关键酯含量,而采用出发菌和突变菌混合添加则有显著提升效果。当菌株JX14和H-8以混菌比例为7∶3添加时,酒体的乳酸乙酯和乙酸乙酯含量分别提高了26.66%和49.02%。选育得到的产酯酵母对改善米香型白酒品质有一定的应用潜力,但菌种性能及强化发酵工艺仍需进一步研究。
[1] TU W Y, CAO X N, CHENG J, et al.Chinese Baijiu:The perfect works of microorganisms [J].Frontiers in Microbiology, 2022, 13:919044.
[2] 张安东, 贝盏临, 张欣, 等.产香酵母在食品工业中的应用 [J].绿色科技, 2015,17(11):260-264.ZHANG A D, BEI Z L, ZHANG X, et al.Application of aroma-producing yeast in food industry [J].Journal of Green Science and Technology, 2015,17(11):260-264.
[3] 朱克永, 胡继红, 方燕.白酒挥发成分测定的研究 [J].食品研究与开发, 2015, 36(21):146-149.ZHU K Y, HU J H, FANG Y.Research progress of volatile components in white spirit [J].Food Research and Development, 2015, 36(21):146-149.
[4] 林一雄. 米香型白酒的工艺改革之路 [J].广西轻工业, 2011, 27(4):10;87.LIN Y X.Technological reform of rice-flavor liquor[J].Guangxi Journal of Light Industry, 2011, 27(4):10;87.
[5] 孙宝国, 吴继红, 黄明泉, 等.白酒风味化学研究进展 [J].中国食品学报, 2015, 15(9):1-8.SUN B G, WU J H, HUANG M Q, et al.Recent advances of flavor chemistry in Chinese liquor spirits (Baijiu) [J].Journal of Chinese Institute of Food Science and Technology, 2015, 15(9):1-8.
[6] 程伟, 吴丽华, 徐亚磊, 等.浓香型白酒酿造微生物研究进展 [J].中国酿造, 2014, 33(3):1-4.CHENG W, WU L H, XU Y L, et al.Research progress on brewing microbes in the production process of Luzhou-flavor liquor [J].China Brewing, 2014, 33(3):1-4.
[7] 叶萌祺, 袁亚宏, 岳田利, 等.产香酵母分离鉴定与苹果酒发酵中的应用 [J].农业机械学报, 2013, 44(12):187-192.YE M Q, YUAN Y H, YUE T L, et al.Isolation and identification of aroma-producing yeasts and its application in cider fermentation [J].Transactions of the Chinese Society for Agricultural Machinery, 2013, 44(12):187-192.
[8] 陈美竹, 邱树毅, 胡宝东, 等.酱香型白酒酿造体系中酵母菌研究进展 [J].中国酿造, 2015, 34(6):5-10.CHEN M Z, QIU S Y, HU B D, et al.Research progress of yeast in Moutai-flavor liquor production [J].China Brewing, 2015, 34(6):5-10.
[9] 李泽洋, 伍时华, 龙秀锋,等.米酒生香酵母的分离筛选鉴定及其性能研究 [J].食品与发酵工业, 2021,47(7):43-50.LI Z Y, WU S H, LONG X F, et al.Isolation, identification and characteristics of aroma-producing yeast for rice wine [J].Food and Fermentation Industries, 2021, 47(7):43-50.
[10] 蒲春, 胡沂淮, 贾亚伟, 等.产酯酵母的筛选及其发酵特性研究 [J].酿酒科技, 2013(3):47-49;53.PU C, HU Y H, JIA Y W, et al.Screening of ester-producing yeast strains and study on its fermenting properties [J].Liquor-Making Science &Technology, 2013(3):47-49;53.
[11] 董士伟, 吴兴泉, 王德良, 等.豉香型白酒中产酯酵母的筛选与应用 [J].中国酿造, 2012, 31(2):125-128.DONG S W, WU X Q, WANG D L, et al.Screening and application of ester-producing yeast in Douchi-flavor liquor [J].China Brewing, 2012, 31(2):125-128.
[12] 刘小改, 马美荣, 周林艳, 等.高产乙酸乙酯酵母菌筛选及固态发酵应用研究 [J].中国酿造, 2020, 39(10):79-83.LIU X G, MA M R, ZHOU L Y, et al.Screening of yeast with high-yield of ethyl acetate and its application in the solid-state fermentation [J].China Brewing, 2020, 39(10):79-83.
[13] FAN G S, TENG C, XU D, et al.Improving ethyl acetate production in Baijiu manufacture by Wickerhamomyces anomalus and Saccharomyces cerevisiae mixed culture fermentations [J].BioMed Research International, 2019, 2019(1):1470543.
[14] 吴峥,雷敏,蔡俊.产胞外谷胱甘肽酿酒酵母的诱变选育及发酵优化 [J].食品研究与开发, 2023, 44(3):201-207.WU Z, LEI M, CAI J.Breeding and fermentation optimization of Saccharomyces cerevisiae producing extracellular glutathione [J].Food Research and Development, 2023, 44(3):201-207.
[15] 李小坤, 王旺, 林影, 等.常压室温等离子体(ARTP)诱变选育高核酸酿酒酵母 [J].现代食品科技, 2018, 34(12):137-144;238.LI X K, WANG W, LIN Y, et al.Screening of high-yield nucleic acid Saccharomyces cerevisiae strain by atmospheric and room-temperature plasma (ARTP) technique [J].Modern Food Science and Technology, 2018, 34(12):137-144;238.
[16] 王栋, 梁进忠, 刘玉杰, 等.葡萄酒酿酒酵母选育与非酿酒酵母混菌发酵研究进展 [J].酿酒科技, 2023(10):89-96.WANG D, LIANG J Z, LIU Y J, et al.Research progress in breeding of Saccharomyces cerevisiae and mixed fermentation with non-Saccharomyces yeasts [J].Liquor-Making Science &Technology, 2023(10):89-96.
[17] 鲁云风, 张四普, 张征田, 等.猕猴桃果酒生香酵母的诱变选育及其发酵条件优化 [J].食品研究与开发, 2022, 43(20):141-146.LU Y F, ZHANG S P, ZHANG Z T, et al.Mutagenesis-based selection of aroma producing yeast for kiwifruit wine and optimization of the fermentation conditions [J].Food Research and Development, 2022, 43(20):141-146.
[18] 陆振群, 薛正莲.紫外诱变选育高产酯酵母 [J].中国酿造, 2012, 31(5):111-113.LU Z Q, XUE Z L.Ultraviolet mutagenesis breeding high ester produced yeast [J].China Brewing, 2012, 31(5):111-113.
[19] 张彬, 杨涛, 管桂臻, 等.酿酒微生物太空育种及在生产中的应用研究(Ⅱ)芝麻香型白酒酿造功能微生物的太空育种 [J].酿酒, 2014, 41(6):45-50.ZHANG B, YANG T, GUAN G Z, et al.Mutagting strains in space of brew microorganisms and application of them in production (Ⅱ) space mutation breeding of functional microorganisms in sesame flavor liquor [J].Liquor Making, 2014, 41(6):45-50.
[20] 张杰, 程伟, 彭兵, 等.一种多粮复合香型白酒的酿造工艺研究 [J].酿酒, 2020, 47(3):39-43.ZHANG J, CHENG W, PENG B, et al.Research on brewing techniques about a kinds of multi-grain composite flavor liquors [J].Liquor Making, 2020, 47(3):39-43.
[21] 郑莉烨. 耐高渗啤酒酵母的选育及其发酵特性的研究 [D].广州:华南理工大学, 2013.ZHENG L Y.Research on mutation breeding of osmophilic beer yeast and its fermentation performances [D].Guangzhou:South China University of Technology, 2013.
[22] 熊建春. 甘蔗威士忌酯香酵母菌的选育及发酵工艺研究 [D].广州:华南理工大学, 2010.XIONG J C.Screening of ester-producing yeast of cane whisky and study on its fermentative process [D].Guangzhou:South China University of Technology, 2010.
[23] 刘延波, 宋艳洁, 李海登, 等.复合诱变选育耐高温产乙醇酵母菌的研究 [J].中国酿造, 2022, 41(10):55-61.LIU Y B, SONG Y J, LI H D, et al.Breeding of high temperature resistant with ethanol yield yeast by compound mutagenesis [J].China Brewing, 2022, 41(10):55-61.
[24] 张龙, 梁振荣, 郝俊光, 等.乳酸菌对米香型白酒发酵过程中乳酸和乳酸乙酯产生的影响研究 [J].酿酒科技, 2022(11):29-35.ZHANG L, LIANG Z R, HAO J G, et al.Effect of lactic acid bacteria on the production of lactic acid and ethyl lactate during the fermentation of mixiang Baijiu [J].Liquor-Making Science &Technology, 2022(11):29-35.
[25] 张杰, 程伟, 巩子路, 等.一株高产乙酸乙酯酵母菌的筛选及其鉴定 [J].酿酒, 2018, 45(6):59-62.ZHANG J, CHENG W, GONG Z L, et al.Screening and identification of a strain with high yield of ethyl acetate yeast [J].Liquor Making, 2018, 45(6):59-62.