肉鸽是一种高蛋白低脂禽类肉制品,干制肉鸽蛋白含量可以达到67%,营养丰富、药用价值高[1]。鸽肉是营养丰富、适合减脂的一类肉类食品。肉鸽产品多见于餐饮业[2],其烹饪方式多样,如酱卤肉鸽、糟香肉鸽、烤乳鸽、五香油鸽与香腊油鸽等,在粤菜中脆皮乳鸽尤为出名。鸽肉作为优质肉类,研究其在人体中的消化变化是值得关注的。
鸽肉中的蛋白质含量丰富,在人体消化过程中,体内相关酶会将其降解为小分子肽和氨基酸等小分子营养物质而被人体吸收[3]。目前关于鸽肉的研究主要是在鸽肉的加工工艺,对于鸽肉在人体中消化吸收的研究较少。
本文以鸽肉为原料,进行体外模拟消化实验。采用静态模拟消化模型,模拟鸽肉在人体中的胃肠消化,主要观察鸽肉中的蛋白质随着胃肠消化的变化,对其消化产物进行分析。另外,对其消化产物进行体外DPPH自由基清除能力、羟自由基清除能力、铁离子还原能力与其在STC-1细胞中细胞胆囊收缩素(cholecystokini-n,CCK)、胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)的分泌水平进行检测,以评估鸽肉蛋白的营养价值及功能作用。
1 材料与方法
1.1 材料与试剂
鸽肉取自21日龄的白羽王鸽,梅州金绿现代农业发展有限公司;盐酸,珠海市华成达化工有限公司;氢氧化钠、氯化钠、磷酸二氢钾、四硼酸钠、十二烷基硫酸钠、无水乙醇、Tris 碱、冰乙酸、三氯乙酸、磷酸氢二钠、Na2B4O7·10H2O,广州化学试剂厂;水杨酸、硫酸亚铁、抗坏血酸、铁氰化钾、邻苯三酚、DPPH自由基标准品,于碧云天生物技术公司;邻苯二甲醛(O-phthalaldehyde method,OPA),上海源叶生物科技有限公司; 4-羟乙基哌嗪乙磺酸(4-hydroxyethyl piperazine ethanesulfonic acid ,HEPES)缓冲液、达尔伯克(氏)必需基本培养基(Dulbecco’s modified eagle medium,DMEM),Gibco公司;二硫苏糖醇、甘氨酸、乙腈、甲醇,上海麦克林生化科技公司;胃蛋白酶(1∶10 000)、丝氨酸,美国 Sigma-Aldrich 公司;胰蛋白酶(猪胰腺,1∶250),美国 Ameresco 公司。
1.2 仪器与设备
FA2204B电子天平,上海精密科学仪器有限公司;KQ超声波清洗器,仪瑞达机械厂;SPH-103B超凡型小容量恒温培养摇床,上海世平实验设备有限公司;HR/T20M台式高速冷冻离心机,赫西仪器装备有限公司;PHS-3C pH计,上海雷磁仪器厂;ESY160匀浆机,上海仪驰实业有限公司;Agilent 1260高效液相色谱仪,Agilent科技有限公司;SH1M-SN多功能微孔检测仪,BioTek仪器有限公司。
1.3 实验方法
1.3.1 样品处理
参考姚宏亮等[4]的方法稍作调整,肉鸽剔骨去皮,取鸽肉部分,料液比1∶1(g∶mL)与蒸馏水混合,打成均匀的肉浆,于-20 ℃保存。
1.3.2 体外模拟消化
1.3.2.1 体外模拟胃消化
参考BRODKORB等[5]的方法并略作调整,取15 mL肉浆,加入15 mL模拟胃液,用1 mol/L的HCl溶液和NaOH溶液调节pH值至3,置于37 ℃培养10 min,加入1.5 mL胃酶溶液摇匀,置于37 ℃中模拟消化2 h,置于沸水中10 min。
1.3.2.2 体外模拟小肠消化
取30 mL上述模拟胃消化液,加入22.38 mL模拟肠液,再加入120 μL 0.3 mol/L CaCl2溶液、4.5 mL 400 mg/mL胆汁,用1 mol/L的HCl溶液和NaOH溶液调节pH值至7,置于37 ℃中模拟消化(消化时长为0、0.5、1.0、1.5、2.0 h),置于沸水中10 min,11 190×g离心10 min,取上清液,备用。
1.3.3 蛋白水解度的测定
参考罗艳华等[6]的方法略作修改,蛋白水解度的测定采用OPA法,取0.4 mL待测液、3 mL OPA待测液置比色皿,在其反应2 min时于340 nm测定吸光度并计算其水解度。计算如公式(1)所示:
水解度![]()
(1)
式中:h0,水解反应前样品相对原始底物的水解度;h1,水解反应后样品相对原始底物的水解度;htot,总肽键数,鸽肉取7.6。
1.3.4 游离氨基酸的测定
参考李梅等[7]的方法略作修改,采用磺基水杨酸对样品进行处理:量取2 mL消化液,加入8%(体积分数)的磺基水杨酸2 mL,以4 ℃、16 099×g离心10 min,取上清液。过0.45 μm的水相滤膜,取过膜后的样品1 mL进1.5 mL进样瓶中,进行自动氨基酸分析仪进行分析。
1.3.5 肽分子质量分布
参考张杰等[8]的方法略作修改,取待测液,过0.22 μm水系滤膜,色谱柱采用TSK Gel-G2000-SWXL(7.8 mm×300 mm),流动相为0.1 mol/L磷酸盐溶液 (pH = 6.7),流速0.5 mL/min,进样量10 μL,柱温30 ℃,紫外检测波长214 nm。相对分子质量的对数值与洗脱体积拟合直线方程为y=-0.887 5x+27.793(R2=0.976 8),其中y为标准肽分子质量的对数,x为保留时间。
1.3.6 体外抗氧化性的测定
1.3.6.1 羟自由基清除率测定
参考方光荣等[9]的方法,取1.5 mL邻二氮菲(5 mmol/L)、2.0 mL PBS 磷酸盐缓冲液(pH 7.4) 1.0 mL FeS04(0.75 mmol/L),立即混匀后加入待测样品1.0 mL[对照组和空白组用60%(体积分数)乙醇代替],混匀,再加入1.0 mL H2O2(体积分数0.1%) (空白组不加H2O2溶液,以蒸馏水代替),在 37 ℃水浴中反应 30 min,测定536 nm处吸光度,每个处理3次重复,按公式(2)计算清除率:
清除率![]()
(2)
1.3.6.2 铁离子还原能力的测定
参考杨红文等[10]的方法略作调整,在 2.5 mL pH 6.6的磷酸盐缓冲液中加入1 mL 待测样品(空白组以60%乙醇代替)、2.5 mL 1 g/mL 铁氰化钾混合,50 ℃恒温水浴20 min,再加入 2.5 mL 10 g/mL三氯乙酸2 798×g 离心10 min,取上清液 2.5 mL,加2.5 mL蒸馏水、0.5 mL 0.1 g/mL FeC13混匀后静置 10 min,测定700 nm吸光度,还原力按公式(3)计算:
还原力/%=(A样品-A空白)×100
(3)
1.3.6.3 DPPH自由基清除率的测定
参考陈静等[11]的方法略作调整,取3 mL待测液,加3 mL的0.1 mg/mL DPPH-无水乙醇溶液,静置30 min使其充分反应,1 790×g离心10 min,于517 nm处测其吸光度。计算如公式(4)所示:
清除率![]()
(4)
式中:A1为上清液吸光度;A2为样品(溶解于无水乙醇)的吸光度;A3为DPPH溶液(溶解于无水乙醇)的吸光度。
1.3.7 STC-1细胞与CCK与CLP-1分泌测定
1.3.7.1 STC-1细胞培养
参考GERAEDTS[12]的方法略作调整,STC-1细胞在含有4.5 g/L葡萄糖的DMEM培养基中培养,并添加10%的胎牛血清、2 mmol/L谷氨酰胺、100 U/mL青霉素和100 g/mL链霉素。
1.3.7.2 CCK和GLP-1分泌实验
经过4 h的培养后,收集上清液,按照试剂盒测定CCK和GLP-1激素浓度。将1.25×105个细胞接种到48孔板中,培养2~3 d后达到亚融合时使用。培养细胞洗用HEPES缓冲液(140 mL NaCl、4.5 mL KCl、20 mL Hepes、1.2 mL CaCl、1.2 mL MaCl、10 mL葡萄糖,pH 7.4)洗涤细胞2次,然后加入样品(1、5、10 mg/mL)(加入无水解液的HEPES缓冲液作为阴性对照)。
1.4 数据分析
除了肽分子质量的测定外,本文实验均采用3次平行测定。使用SPSS 26.0软件分析试验数据,并使用Origin 2022软件进行作图。
2 结果与分析
2.1 消化液水解度的变化
图1为鸽肉模拟消化各阶段消化液水解度的变化,5个阶段的蛋白水解度随着时间延长呈上升趋势,在消化4 h后蛋白水解度达到(34.12±0.001)%。其中,经胃肠模拟消化后的水解度发现,消化时间对鸽肉水解度影响具有极显著差异(P<0.001),鸽肉水解度随着水解时间延长而增大,其中胃消化2 h后,蛋白水解度达到(20.24±0.001)%,随后再经小肠消化0.5 h后,蛋白水解度达到(25.85±0.03)%,蛋白水解度随着小肠消化时间的延长逐渐变大。相较于胃消化2 h较低的水解度,消化4 h(其中胃消化2 h,小肠消化2 h)的消化液水解度约是前者的1.8倍,说明胰蛋白酶对蛋白的水解相对于胃蛋白酶更加迅速,此结果与焦斐等[13]的研究相似,原因可能是胃部环境(酸性环境)使蛋白质变性、结构展开,胃蛋白酶作为一种内肽酶具有高度特异性[14],只能够裂解蛋白的内肽键,形成分子质量相对较大的肽段。
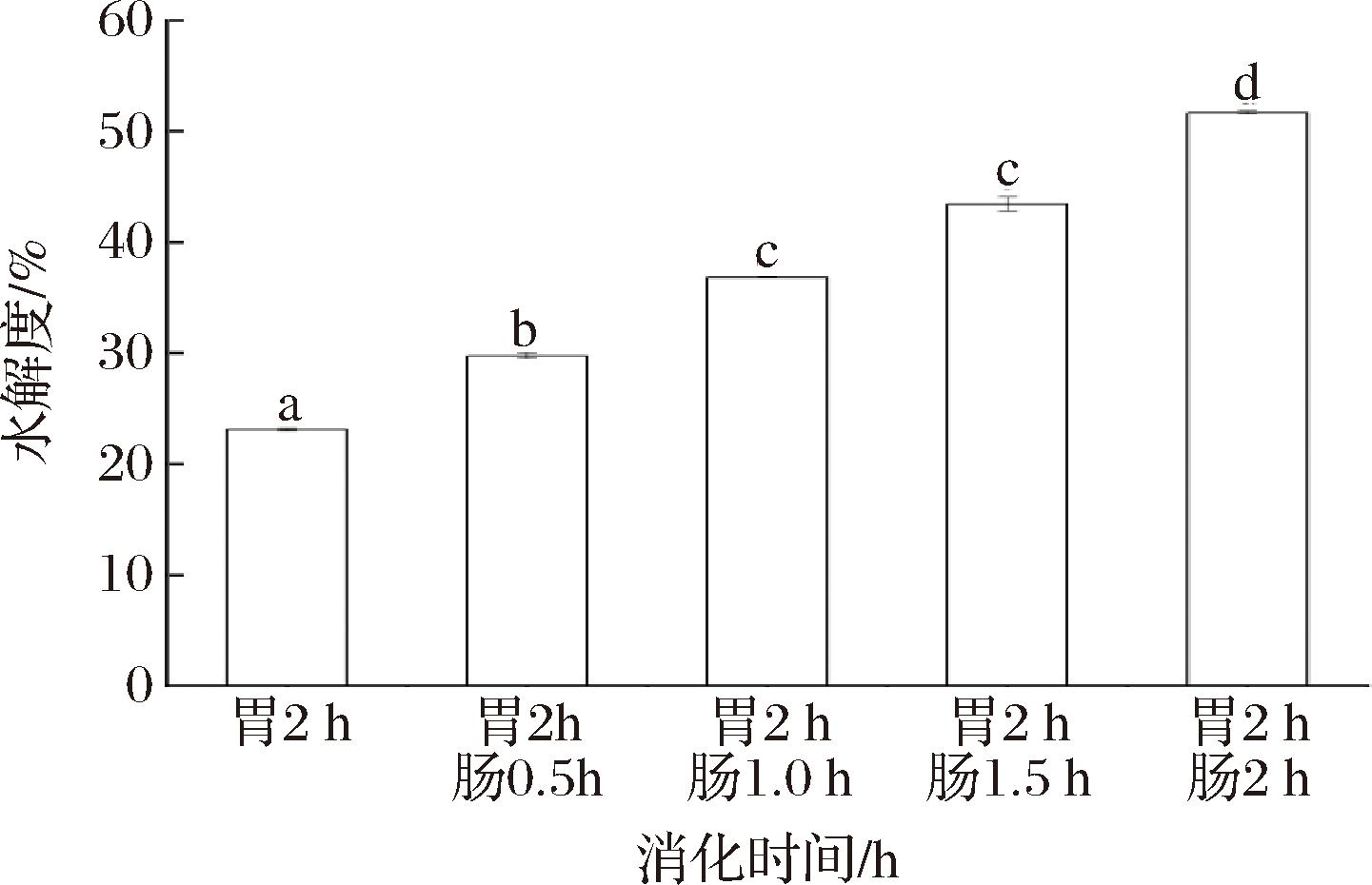
图1 鸽肉体外消化液的水解度
Fig.1 Hydrolysis degree of in vitro digestive fluid of pigeons meat
注:不同小写字母代表差异显著(P<0.05)(下同)。
2.2 消化液游离氨基酸变化情况
由2.1节可知,在鸽肉的体外模拟消化中,小肠消化阶段的程度显著大于胃消化阶段,由表1可知,胃部消化过程中分解出的游离氨基酸较少,而在肠道消化中分解出的游离氨基酸较多,两者结果具有一致性。
表1 鸽肉体外模拟消化液氨基酸组成及含量 单位:mg/g
Table 1 Amino acid composition and content of pigeon meat-simulated digestive fluid in vitro

氨基酸胃2 h胃2 h肠0.5 h胃2 h肠1 h胃2 h肠1.5 h胃2 h肠2 h天冬氨酸0.30±0.01Aa0.50±0.15Bab0.53±0.15Ba0.47±0.01Ba0.56±0.07Ba苏氨酸0.03±0.01Aa1.37±0.8Aab1.94±1.31Aa1.42±0.52Aa2.05±1.19Aa丝氨酸0.04±0.01Aa0.85±0.35Aab0.96±0.45Aa0.83±0.16Aa1.02±0.31Aa谷氨酸0.20±0.01Aa1.94±0.66Aab2.12±0.81Aa1.87±0.14Aa2.21±0.49Aa甘氨酸0.04±0.01Aa0.50±0.09Bab0.54±0.13Ba0.50±0.02Ba0.58±0.06Ba丙氨酸0.09±0.01Aa1.48±0.13Bab1.68±0.27Ba1.55±0.16Ba1.84±0.03Ba半胱氨酸0.14±0.01Aa0.4±0.09Ba0.43±0.11Ba0.42±0.01Ba0.48±0.06Ba缬氨酸0.10±0.01Aa1.55±0.45Bab1.75±0.043Ba1.71±0.16Ba1.95±0.25Ba甲硫氨酸0.13±0.01Aa1.56±0.06Bab1.78±0.21BCa1.79±0.19BCa2.10±0.06Ca异亮氨酸0.05±0.01Aa1.18±0.44ABab1.43±0.54ABab1.30±0.23ABa1.57±0.43Ba亮氨酸0.10±0.01Aa5.10±0.17Bc4.56±1.01Bb5.73±0.72Bb5.46±1.56Bb酪氨酸1.04±0.06Ab2.66±0.18Bab2.67±0.37Bab2.83±0.77Ba3.23±0.48Bab苯丙氨酸2.68±0.45Ac2.92±0.95Ab2.70±0.74Aab5.14±1.51Ab5.19±1.96Ab赖氨酸0.30±0.13A2.33±1.95A2.32±1.99A1.30±0.30A1.18±0.49A组氨酸0.20±0.01Aa0.97±0.14Bab1.04±0.23Bab1.07±0.02Ba1.20±0.10Ba精氨酸0.28±0.04Aa6.34±0.59Bc6.43±0.46Bc7.06±1.82Bb7.20±1.45Bc7种必需氨基酸3.40±0.30Ad16.01±0.97Bd16.48±1.25BCd18.39±1.22BCc19.49±1.71Cd总氨基酸5.45±0.29Ae31.66±0.22Be32.88±0.81Be34.98±1.26Cd38.17±0.9De
注:表格中A~D表示组间差异(P<0.05),a~e表示组内差异(P<0.05)。
各组消化液中总氨基酸、丙氨酸、甲硫氨酸及7种必需氨基酸的含量有极显著差异(P<0.001),对精氨酸、组氨酸、酪氨酸、亮氨酸、缬氨酸、半胱氨酸、甘氨酸及天冬氨酸有显著差异(P<0.05)。经胃部消化2 h后,消化液蛋白中氨基酸含量仅有(5.45±0.23) mg/g,而进入肠道消化0.5 h后,消化液水解度显著增加,达到(31.66±0.22) mg/g。在肠消化阶段中,随着消化时间的延长,释放出的总氨基酸含量越多,消化4 h后得到氨基酸含量达到(38.17±0.90) mg/g,是单独胃消化2 h后释放氨基酸含量的7.6倍,这也说明蛋白在消化过程中主要的消化部位是小肠,而在胃部消化的过程中只完成初步分解。
进入肠道消化后,消化液中的甘氨酸、丙氨酸、半胱氨酸、缬氨酸、甲硫氨酸、亮氨酸、酪氨酸、组氨酸与精氨酸显著增加(P<0.05)。JE等[15]研究发现,组氨酸、甲硫氨酸、半胱氨酸与酪氨酸能增强多肽的抗氧化能力,即经消化后,肉鸽消化液抗氧化性得到提升。
2.3 肽分子质量的变化情况
肽分子质量是影响生物利用率或者吸收率的一个重要因素,也是反应蛋白质水解的一个重要参数,反映了鸽肉在肠胃中的消化情况。研究表明,小分子质量肽具有更高的抗氧化活力与更强的抗菌作用。如图2所示,随着体外模拟消化时间的延长,鸽肉消化液中肽分子质量逐渐降低,体现在>10 kDa的部分肽分子质量比例逐渐减少,<10 kDa的部分肽分子质量比例均逐渐增加,与前文所述胃蛋白酶只进行初步消化,经胰蛋白酶消化水解后,才有大量蛋白质被水解的观点相符。

图2 鸽肉体外消化液的肽分子质量分布
Fig.2 Molecular weight distribution of peptides ofin vitro digestive fluid of pigeon meat
如图2所示,各组消化时间对肽分子质量的影响有极显著差异(P<0.001),未被消化的鸽肉肉浆中>10 kDa部分的肽段占总体的(97.15±0.109)%,这说明鸽肉肉浆中大多是大分子质量蛋白,进入人体后需要经过肠道的消化才能逐步被分解消化。经过2 h消化液消化后,>10 kDa部分的肽段降为(34.59±0.260)%,而经过小肠消化后,<3 kDa部分的肽段已经超过半数,消化4 h后<3 kDa部分的肽段达到(61.38±0.065)%,>10 kDa部分的肽段仅剩下(17.66±0.609)%,此结果与郭晶等[16]研究相似。
文献[17]报道显示,由于小肽暴露氨基酸残留的侧链而更容易捐赠电子或者氢原子,表现出抗氧化能力;王静等[18]发现肽的抗氧化性与其分子质量大小密切相关,具有抗氧化性的多肽片段分子质量一般 <3 kDa,即说明进入肠道消化后的消化液有更高的抗氧化能力。
2.4 鸽肉体外模拟消化液的抗氧化能力测定
以铁离子还原率、DPPH自由基清除率、羟自由基清除率3种抗氧化指标对比鸽肉胃消化液、肠消化液的抗氧化能力。发现在消化阶段,消化时间越长,其抗氧化能力提高。
各组消化液的铁离子还原率、DPPH自由基清除率、羟自由基清除率之间具有极显著差异(P<0.001),如图3所示,鸽肉体外模拟消化液的铁离子还原率、DPPH自由基清除率、羟自由基清除率均随着消化时间的延长而提高。其中羟自由基清除率最佳,DPPH自由基清除率次之,铁离子清除率较差。消化4 h后超过半数(51.67±0.016)%的羟自由基被清除,是胃消化2 h羟自由基清除率(23.09±0.007)%的2倍。消化4 h后(38.81±0.015)%的DPPH自由基被清除,且相较于胃消化2 h消化液的DPPH清除率(21.90±0.013)%,其DPPH自由基的清除率显著增加。鸽肉消化液的铁离子还原率效果一般,经过胃消化2 h的铁离子还原率仅有(4.5±0.002)%,但经过4 h消化的铁离子还原率显著增加,达到(9.5±0.001)%。HWANG等[19]研究表明,小分子肽相较于大分子肽,铁离子还原能力更强,其中<1 kDa的肽段铁离子还原能力接近100%。总体而言,消化液随着消化时间延长而抗氧化性更强,结合2.3节对消化液中肽分子质量的分析,原因可能是随着消化时间延长,鸽肉的大分子质量蛋白逐步被分解为小分子质量的肽段[20-21],而小分子质量肽段更具有抗氧化活性[22]。
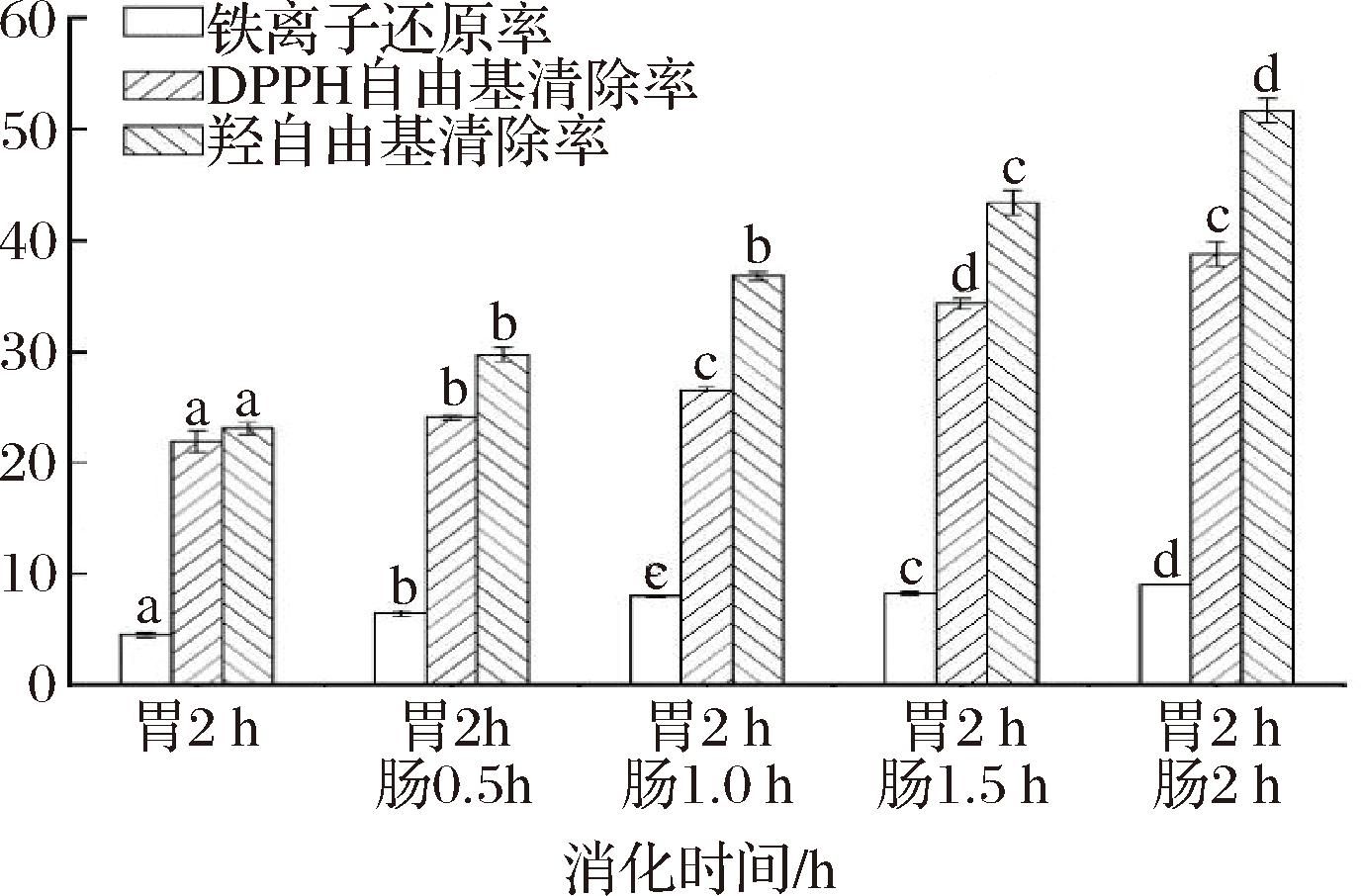
图3 鸽肉体外消化液的抗氧化能力
Fig.3 Antioxidant capacity of in vitro digestive fluid of pigeon meat
2.5 消化液对STC-1细胞CCK与CLP-1分泌影响
食物在胃肠消化时,蛋白逐步分解为肽与氨基酸,这些蛋白消化产物可以通过诱导胃肠道内分泌细胞激素来发挥生理活性[23]。已有研究表明,胰蛋白酶能够促进小肠细胞CCK与GLP-1的分泌[12],CCK和GLP-1的释放通过刺激钙敏受体实现[24]。本实验以消化4 h(配制了1、5、10 mg/mL的消化液)的胃肠消化液培养STC-1细胞,以观察消化液对CCK与CLP-1分泌影响(图4)。
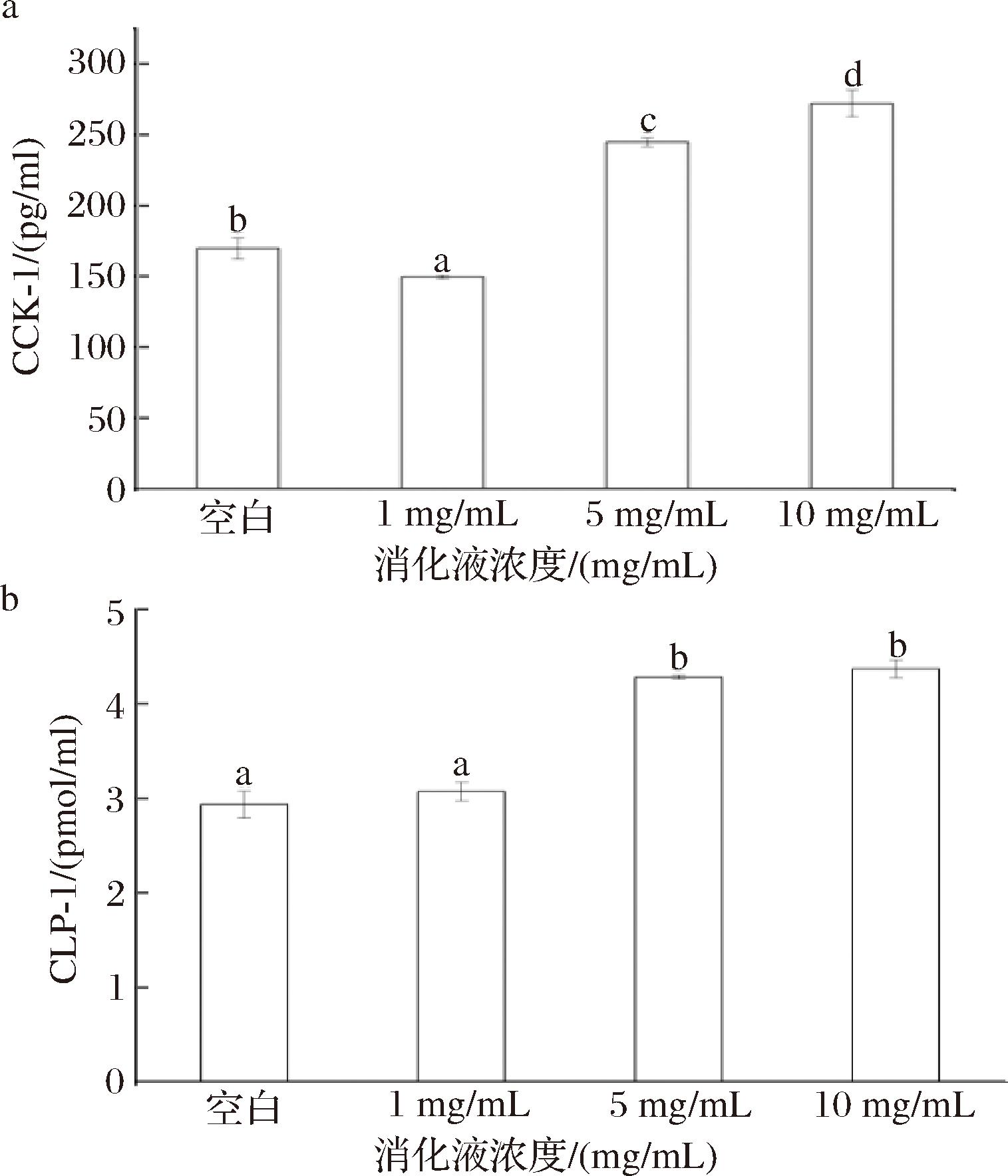
a-CCK;b-GLP-1
图4 鸽肉体外消化液对CCK与GLP-1影响
Fig.4 Effects of in vitro digestive fluid of pigeon meat on CCK and GLP-1
CCK是小肠细胞分泌的一类激素肽,主要与蛋白和脂肪作用,可以促进胰酶的合成和释放,以此参与摄食调控[25-26]。本研究表明,不同浓度消化液对CCK分泌具有极显著差异(P<0.001)。结果发现浓度越高,其CCK分泌水平越高。相较于对照组(169.633±7.445)pg/mL,1 mg/mL消化液反而比对照组低,5 mg/mL时超过对照组,达到(244.784±3.043) pg/mL,质量浓度为10 mg/mL时达到(272.028±9.409) pg/mL。这说明低浓度的消化液抑制CCK的释放,而高浓度的消化液对CCK释放有促进作用。研究表明,高浓度的活性物质可以提高细胞内钙的释放[27],而蛋白质、多肽和氨基酸是通过激活钙敏受体进而释放CCK和GLP-1[28-29],这可能是高浓度消化液促进CCK分泌能力显著提高的原因。
GLP-1是小肠中L细胞内分泌的可以帮助降血糖的物质,目前GLP-1作为2型糖尿病的治疗药物已受到广泛关注。本实验结果表明,不同浓度消化液对GLP-1分泌水平具有极显著差异(P<0.001)。其中3组浓度的消化液的GLP-1分泌水平随着浓度增加而升高,分别达到(3.071±0.100)、(4.283±0.020)、(4.371±0.092) pmol/mL,均高于对照组(2.933±0.143) pmol/mL。这表明鸽肉消化液可以诱导CLP-1的释放,这与YANG等[24]研究结果相似,即肽浓度越高,GLP分泌越多。换而言之,消化液具有降糖的作用,消化水平越高,降血糖效果越佳。
3 结论
本实验对鸽肉进行体外消化实验,对其体外模拟胃消化及肠消化的消化液分别进行了蛋白水解度的测定、游离氨基酸、肽分子质量分布、抗氧化能力以及其对STC-1细胞CCK与GLP-1分泌量的测定,以此来研究鸽肉在体外胃肠模拟消化中的消化趋势,以此评估鸽肉的营养价值。
结果表示,鸽肉在体外消化中的消化程度随着时间的延长而增大,主要表现为其蛋白水解度、游离氨基酸含量以及小分子质量物质的占比上升。通过对其DPPH自由基、羟自由基的清除率、铁离子还原率的测定发现其抗氧化性随着消化时间的增加而增强,且经过4 h消化的消化液能促进STC-1细胞CCK与GLP-1分泌测定,说明鸽肉的消化对激素分泌有一定的影响,可为日后提取抗氧化肽、降血糖的药学等研究提供理论参考。
综上所述,鸽肉是一种易于消化吸收的食物,其具有一定的抗氧化能力和营养价值,可在这个亚健康的时代为人们提供一个健康的选择。
[1] 罗辑, 陆妍妍, 刘邓美, 等.不同加工工艺对预调理乳鸽感官品质及理化特性的影响[J].中国调味品, 2023, 48(5):31-36.LUO J, LU Y Y, LIU D M, et al.Effect of different processing technologies on sensory quality and physicochemical properties of pre-prepared squab[J].China Condiment, 2023, 48(5):31-36.
[2] 张媛, 刘迥, 王艳萍, 等.鸽肉营养成分与脂肪沉积相关基因的研究[J].黑龙江畜牧兽医, 2020(4):121-124.ZHANG Y, LIU J, WANG Y P, et al.Study on the relationship between pigeon meat nutrients and fat deposition-related genes[J].Heilongjiang Animal Science and Veterinary Medicine, 2020(4):121-124.
[3] 温斯颖.不同种类动物肌肉蛋白质消化产物比较研究[D].南京:南京农业大学, 2015.WEN S Y.Comparative study on protein digestive products of different kinds of animals’ muscles[D].Nanjing:Nanjing Agricultural University, 2015.
[4] 姚宏亮, 鹿取, 韩燃, 等.鸽肉酶解液水解工艺优化及其体外抗氧化性研究[J].食品工业科技, 2018, 39(4):64-67; 87.YAO H L, LU Q, HAN R, et al.The preparation process optimization and antioxidant properties in vitro of hydrolysates from pigeon meat[J].Science and Technology of Food Industry, 2018, 39(4):64-67; 87.
[5] BRODKORB A, EGGER L, ALMINGER M, et al.INFOGEST static in vitro simulation of gastrointestinal food digestion[J].Nature Protocols, 2019, 14(4):991-1014.
[6] 罗艳华, 王全杰, 陈沛海, 等.蛋白水解物水解度测定方法的研究[J].皮革与化工, 2017, 34(2):26-31.LUO Y H, WANG Q J, CHEN P H, et al.Study on determination method for hydrolyzed de gree of protein hydrolysate[J].Leather and Chemicals, 2017, 34(2):26-31.
[7] 李梅, 刘金华, 楼兵干, 等.植物鲜样中游离氨基酸提取方法的比较[J].实验室研究与探索, 2016, 35(4):34-38; 51.LI M, LIU J H, LOU B G, et al.Comparison of methods for free amino acid extracted from fresh plant samples[J].Research and Exploration in Laboratory, 2016, 35(4):34-38; 51.
[8] 张杰, 丁琳, 白鸽, 等.超声对木瓜蛋白酶酶解产物分子量分布的影响[J].食品工业科技, 2017, 38(14):116-120.ZHANG J, DING L, BAI G, et al.Effect of ultrasonic on molecular weight distribution of papain hydrolyzate[J].Science and Technology of Food Industry, 2017, 38(14):116-120.
[9] 方光荣, 刘洁, 刘丽虹, 等.分光光度法测定中药对羟自由基的清除率[J].湖北大学学报(自然科学版), 2004, 26(2):151-154.FANG G R, LIU J, LIU L H, et al.Determination of elimination activity of Chinese traditional medicine for the hydroxyl radical by UV-Vis spectrophotometry[J].Journal of Hubei University (Natural Science Edition), 2004, 26(2):151-154.
[10] 杨红文, 彭福润.纤维素酶法提取金银花中绿原酸工艺优化及其抗氧化活性[J].食品研究与开发, 2022, 43(4):64-69.YANG H W, PENG F R.Optimization of extraction process of chlorogenic acid from Lonicera japonica with cellulase and its antioxidative activity[J].Food Research and Development, 2022, 43(4):64-69.
[11] 陈静, 陈乃东, 郑诠.四种石斛的根、茎、叶主要成分及其 DPPH自由基清除能力对比[J].北方园艺, 2020(10):128-133.CHEN J, CHEN N D, ZHENG Q.Comparative study on the main constituents and scavenging DPPH free radicals of root, stem and leaf of four Dendrobium plants[J].Northern Horticulture, 2020(10):128-133.
[12] GERAEDTS M C P, TROOST F J, FISCHER M A J G, et al.Direct induction of CCK and GLP-1 release from murine endocrine cells by intact dietary proteins[J].Molecular Nutrition &Food Research, 2011, 55(3):476-484.
[13] 焦斐, 杨倩, 杨超, 等.陇藜1号藜麦清蛋白体外消化产物抗氧化活性及结构特征分析[J].食品科学技术学报, 2023, 41(3):116-126.JIAO F, YANG Q, YANG C, et al.Antioxidant activity and structural characteristics of digestion products of Longli 1 quinoa albumin in vitro[J].Journal of Food Science and Technology, 2023, 41(3):116-126.
[14] GOODMAN B E.Insights into digestion and absorption of major nutrients in humans[J].Advances in Physiology Education, 2010, 34(2):44-53.
[15] JE J Y, PARK S Y, HWANG J Y, et al.Amino acid composition and in vitro antioxidant and cytoprotective activity of abalone viscera hydrolysate[J].Journal of Functional Foods, 2015, 16:94-103.
[16] 郭晶, 廖剑洪, 沈畅华, 等.禽蛋蛋清体外模拟消化液的营养与抗氧化性差异分析[J].中国食品学报, 2023, 23(2):121-130.GUO J, LIAO J H, SHEN C H, et al.Analysis of nutrition and antioxidant activity differences of poultry egg white in vitro simulated digestive juice[J].Journal of Chinese Institute of Food Science and Technology, 2023, 23(2):121-130.
[17] G MEZ L J, G
MEZ L J, G MEZ N A, ZAPATA J E, et al.In-vitro antioxidant capacity and cytoprotective/cytotoxic effects upon Caco-2 cells of red tilapia (Oreochromis spp.) viscera hydrolysates[J].Food Research International, 2019, 120:52-61.
MEZ N A, ZAPATA J E, et al.In-vitro antioxidant capacity and cytoprotective/cytotoxic effects upon Caco-2 cells of red tilapia (Oreochromis spp.) viscera hydrolysates[J].Food Research International, 2019, 120:52-61.
[18] 王静, 陈晨, 李楠楠, 等.米发糕胃肠水解物抗氧化性及肽段差异性分析[J].中国粮油学报, 2020, 35(7):8-14.WANG J, CHEN C, LI N N, et al.Difference analysis of antioxidant activity and hydrolyzed peptides of gastrointestinal hydrolysates of fermented rice cake[J].Journal of the Chinese Cereals and Oils Association, 2020, 35(7):8-14.
[19] HWANG C F, CHEN Y A, LUO C, et al.Antioxidant and antibacterial activities of peptide fractions from flaxseed protein hydrolysed by protease from Bacillus altitudinis HK02[J].International Journal of Food Science &Technology, 2016, 51(3):681-689.
[20] TORRES-FUENTES C, ALAIZ M, VIOQUE J.Iron-chelating activity of chickpea protein hydrolysate peptides[J].Food Chemistry, 2012, 134(3):1585-1588.
[21] DONG S Y, ZENG M Y, WANG D F, et al.Antioxidant and biochemical properties of protein hydrolysates prepared from Silver carp (Hypophthalmichthys molitrix)[J].Food Chemistry, 2008, 107(4):1485-1493.
[22] SONG H D, FU Q Y, HUANG K, et al.Digestion characteristics of quinoa, barley and mungbean proteins and the effects of their simulated gastrointestinal digests on CCK secretion in enteroendocrine STC-1 cells[J].Food &Function, 2022, 13(11):6233-6243.
[23] 傅秋云, 方子韵, 宋洪东, 等.燕麦分离蛋白消化特性和消化产物对STC-1细胞分泌胆囊收缩素的影响[J].食品科学技术学报, 2021, 39(6):35-44.FU Q Y, FANG Z Y, SONG H D, et al.Digestion characteristics of oat protein isolate and effect of its digesta on cholecystokinin secretion of STC- 1 cells[J].Journal of Food Science and Technology, 2021, 39(6):35-44.
[24] YANG J, BAI W D, ZENG X F, et al.γ-[Glu] (n=1, 2)-Phe /-Met /-Val stimulates gastrointestinal hormone (CCK and GLP-1) secretion by activating the calcium-sensing receptor[J].Food &Function, 2019, 10(7):4071-4080.
[25] 欧阳冬冬, 骆剑, 严耿杰, 等.布氏鲳鲹CCK基因的克隆及表达分析[J].基因组学与应用生物学, 2019, 38(1):7-13.OUYANG D D, LUO J, YAN G J, et al.Cloning and expression analysis of the cholecystokinin gene from snubnose pompano(Trachinotus blochii)[J].Genomics and Applied Biology, 2019, 38(1):7-13.
[26] 欧阳冬冬. 布氏鲳鲹Leptin和CCK的基因克隆及其对摄食的调控[D].海口:海南大学, 2017.OUYANG D D.Cloning of leptin and CCK genes from pomfret bubali and their regulation on feeding[D].Haikou:Hainan University, 2017.
[27] YANG J, LIAO J H, DONG H, et al.Synergistic effect of kokumi-active γ-glutamyl peptides and l-glutamate on enhancing umami sensation and stimulating cholecystokinin secretion via T1R1/T1R3 activation in STC-1 cells[J].Journal of Agricultural and Food Chemistry, 2022, 70(45):14395-14402.
[28] LIOU A P, SEI Y, ZHAO X L, et al.The extracellular calcium-sensing receptor is required for cholecystokinin secretion in response to L-phenylalanine in acutely isolated intestinal I cells[J].American Journal of Physiology.Gastrointestinal and Liver Physiology, 2011, 300(4):G538-G546.
[29] ZHAO X Y, XIAN Y H, WANG C, et al.Calcium-sensing receptor-mediated L-tryptophan-induced secretion of cholecystokinin and glucose-dependent insulinotropic peptide in swine duodenum[J].Journal of Veterinary Science, 2018, 19(2):179-187.