沙棘(Hippophae rhamnoides Linn.)是胡颓子科沙棘属落叶性灌木,其果实为球形或近卵形橘色浆果,是珍贵的药食同源植物。其特性是耐旱、抗风沙,可以在盐碱化土地上生存[1-3]。国内分布地区主要集中于西北、华北等地带,其中西北部区种植沙棘面积较广,多用于防风固沙。沙棘果实中含有黄酮类、多酚类、有机酸、多糖类、维生素类、不饱和脂肪酸、氨基酸、超氧化物歧化酶、5-羟色胺等生物活性物质[5-8],具有止咳化痰、健胃消食、活血散瘀、抗肿瘤、预防心脑血管疾病等功效,广泛应用于食品、航天、医药、农牧鱼业等领域[9-11]。
随着信息技术跨领域的飞速发展,全基因组、转录组、蛋白质组、代谢组等跨组学成为目前研究的热点[12]。代谢组学是一门在特定条件下系统研究生物体内代谢物质组成和变化规律的高通量技术学科,用于代谢物在生物体内的定性定量分析[13-14]。代谢组学分为靶向和非靶向分析策略[15]。靶向代谢组学主要针对已知代谢物进行分析,具有灵敏度高、特异性强、定量准确等特点;非靶向代谢组学通过色谱、质谱等仪器系统、全面地分析生物体代谢物种类和数量,反映一种或一组样本间差异代谢物[16],解析生物样本中代谢物的重要信息[17],发现新的代谢产物和代谢路径[18-20]。
近年来,基于非靶向代谢组学探究沙棘酵素不同发酵时期代谢物差异性分析的研究报道相对较少。本研究以新疆天然生长的沙棘鲜果为导向,采用超高效液相色谱-质谱联用(ultra-performance liquid chromatography-mass spectrometry,UPLC-MS)非靶向代谢组学技术,分析比较不同发酵时期沙棘代谢差异化合物,针对不同发酵时期代谢物质含量变化,探索其过程中的活性物质成分,旨在为沙棘酵素功能成分及代谢调控机制提供科学依据,为后期沙棘资源的开发利用奠定理论基础,助力沙棘产业纵深发展。
1 材料与方法
1.1 材料与试剂
沙棘鲜果(中亚沙棘H. rhamnoides subsp. Turkestanica),产自中国新疆,生长于海拔800~3 000 m的河谷阶地、山坡,常见于河漫滩;乙腈(色谱纯)、甲醇(色谱纯)、甲酸(色谱纯),赛默飞世尔科技有限公司;2-丙醇(色谱纯),德国默克公司;2-氯-l-苯丙氨酸(≥98%),阿达玛斯公司。
1.2 仪器与设备
Q-Exactive HF-X质谱仪、超高液相色谱系统UPLC,赛默飞世尔科技有限公司;Centrifuge 5424 R冷冻离心机,德国艾本德公司;NewClassic MF MS105DU电子天平,梅特勒托利多公司;Wonbio-96c多样品冷冻研磨仪,上海万柏生物科技有限公司;JXDC-20氮气吹扫仪,上海净信实业发展有限公司;LNG-T88台式快速离心浓缩干燥器,太仓市华美生化仪器厂;SBL-10TD控温超声波清洗机-10L,宁波新芝生物科技股份有限公司。
1.3 实验方法
1.3.1 样品处理
将采摘的沙棘鲜果用灭菌蒸馏水清洗干净沥干,挑选果粒新鲜完整、无霉变的浆果放入榨汁机打浆,无菌医用纱布过滤,采取无菌操作将汁液滤入灭菌锥形瓶中,加入2%(质量分数)的白砂糖(不加入其他发酵菌种),混匀,封口,置于25 ℃培养箱中自然发酵60 d,发酵过程中未产生腐败现象。在超净工作台中分别取发酵 10、20、30、40、50、60 d的样品汁液2 mL于灭菌冻存管中,置于-80 ℃冰箱保存。将样本送至上海美吉生物有限公司进行测试,每个样本6个重复。
1.3.2 超高效液相色谱串联傅里叶变换质谱条件
本研究仪器平台为UHPLC-QExactiveHF-X系统。
样本前处理:移取200 μL样品至1.5 mL离心管;加入800 μL提取液[V(甲醇)∶V(乙腈)=1∶1],含4种内标物[(L-2-氯苯丙氨酸(0.02 mg/mL)等],涡旋混匀 30 s,低温超声提取 30 min(5 ℃,40 kHz);将样品静置于-20 ℃,30 min;离心15 min(13 000×g,4 ℃),移取上清液,氮气吹干;加入120 μL复溶液[V(乙腈)∶V(水)=1∶1]复溶;涡旋混匀30 s,低温超声萃取5 min(5 ℃,40 kHz);离心10 min(13 000×g,4 ℃),移取上清液至带内插管的进样小瓶中上机分析;另外,每个样本分别移取20 μL 上清液混合后作为质控样本。质控样本(quality control, QC)由所有样本的提取液等体积混合制备而成,每个QC的体积与样本相同,用与分析样本相同的方法处理和检测,在仪器分析的过程中,每5~15个分析样本中插入一个QC样本,以考察整个检测过程的稳定性。
色谱条件:色谱柱为ACQUITY UPLC HSS T3(100 mm×2.1 mm, 1.8 μm)流动相A为95%水+5%乙腈(含0.1%甲酸),流动相 B 为 47.5%乙腈+47.5% 异丙醇+5%水(含 0.1%甲酸,均为体积分数)进样量为3 μL,柱温为 40 ℃。
质谱条件:样品经电喷雾电离,分别采用正、负离子扫描模式采集质谱信号。扫描范围(m/z)70~1 050;鞘气流速50arb;辅助气流速13arb,离子源加热温度 425 ℃, 毛细管温度325 ℃,离子喷雾电压+3 500/-3 500 V;S-Lens 电压50V;循环碰撞能20-40-60 eV, 分辨率(Full MS)、分辨率(MS 2)分别为60 000、7 500。
1.4 数据分析
将UPLC-MS检测分析的原始数据整理后,代入代谢组学相关软件Progenesis QI v3.0(Waters Corporation,Milford, USA)分析,包括对峰识别、基线过滤、峰对齐、积分、保留时间校正等分析,并将MS和MS/MS质谱信息与代谢数据库进行匹配,设置MS质量误差<10 ppm,根据质谱匹配得分搜索出代谢化合物。利用主成分分析(principal component analysis, PCA)、偏最小二乘判别分析(partial least squares discriminant analysis,PLS-DA)、人类代谢数据库(Human Metabolome Database,HMDB)化合物分类、KEGG通路富集、韦恩(Venn)图及火山图等对代谢组数据进行差异分析。以PLS-DA模型变量投影重要性(variable importance in the projection, VIP)值≥ 1、P值<0.05、FC>2和FC<1/2为标准筛选显著差异代谢物。
2 结果与分析
2.1 样本信息及鉴定统计
样本共分为6组,每组6个重复,A_1~A_6为Control 1组,B_1~B_6为Control 2组,C_1~C_6为Control 3组,D_1~D_6为Control 4组,E_1~E_6为Control 5组,F_1~F_6为Control 6组;质控组3个重复,分别为QC01、QC02、QC03。
经过数据预处理,如表1所示,数据预处理后在正离子模式下鉴定出代谢化合物1 325种,在负离子模式下鉴定出代谢物化合物875种。
表1 有效峰及鉴定统计
Table 1 Effective peak and identification statistics
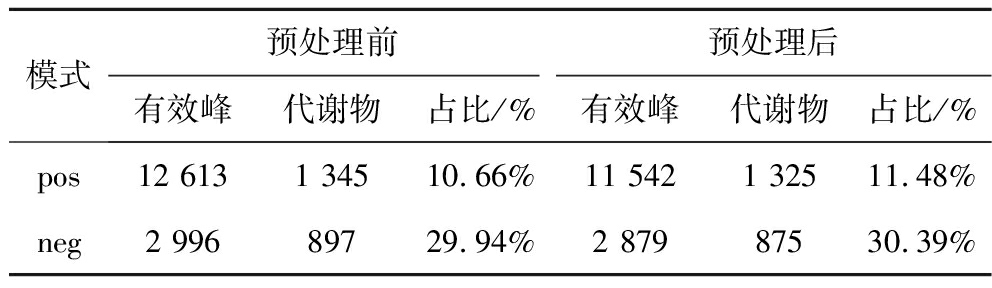
模式预处理前预处理后有效峰代谢物占比/%有效峰代谢物占比/%pos12 6131 34510.66%11 5421 32511.48%neg2 99689729.94%2 87987530.39%
2.2 PCA
通过对样本及QC样本进行PCA,可初步掌握各样本间的总体代谢差异水平及变异度大小。本研究PCA主成分分析情况如图1、图2所示。
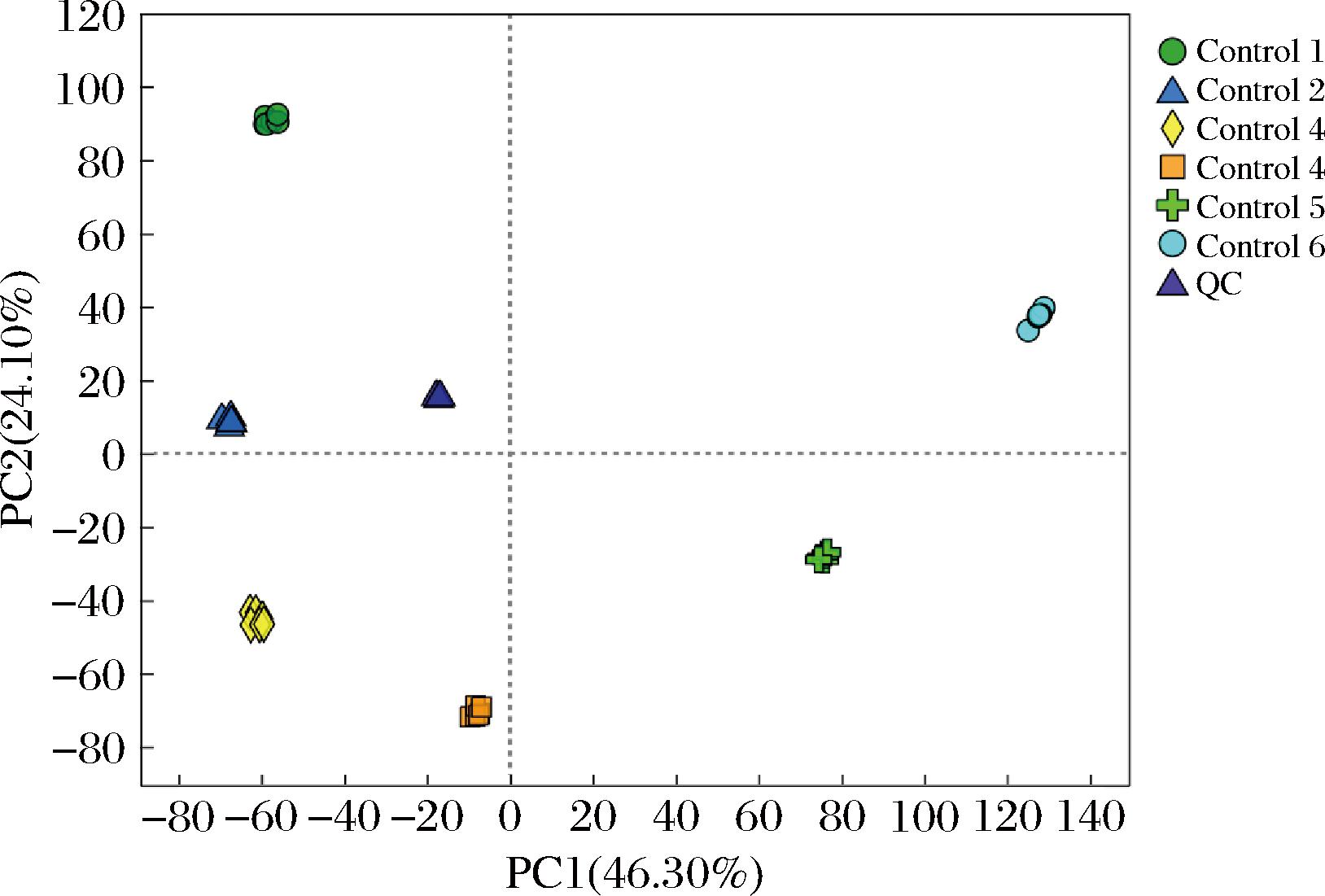
图1 正离子模式下沙棘酵素不同发酵时期代谢组学PCA结果
Fig.1 Metabolomic PCA analysis of seabuckthorn enzyme in different fermentation stages under positive ion mode
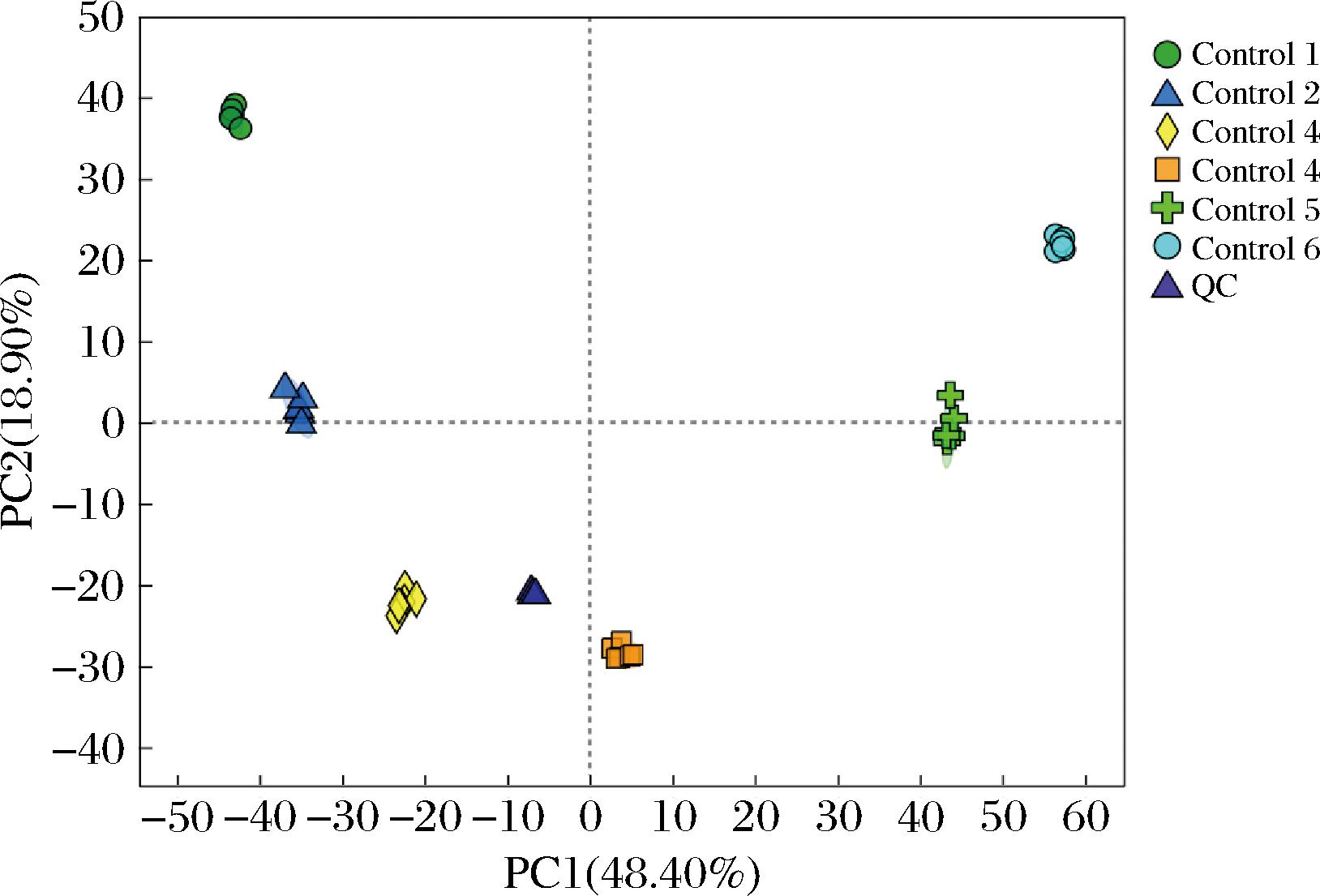
图2 负离子模式下沙棘酵素不同发酵时期代谢组学PCA结果
Fig.2 Metabolomic PCA analysis of seabuckthorn enzyme in different fermentation stages under negative ion mode
图1、图2 结果表明,在正离子模式下,PC1贡献率为46.30%,PC2贡献率为24.10%;在负离子模式下,PC1贡献率为48.40%,PC2贡献率为18.90%。所有点分布在95%置信区间范围,表明不同发酵时期沙棘代谢物具有显著差异;QC样本聚集在 PCA 图中心,表明各样本代谢组数据稳定、未出现明显偏差,该PCA 模型稳定可靠,可用于后续分析。
2.3 PLS-DA
PLS-DA可用于不同样品之间相似度及差异性的分析。建立各比较组的PLS-DA模型,经交叉验证得到模型评价参数R2(模型可解释度)和Q2(模型可预测度),如果R2和Q2越接近1,表明模型越稳定可靠。本研究PLS-DA情况如图3~图6所示。
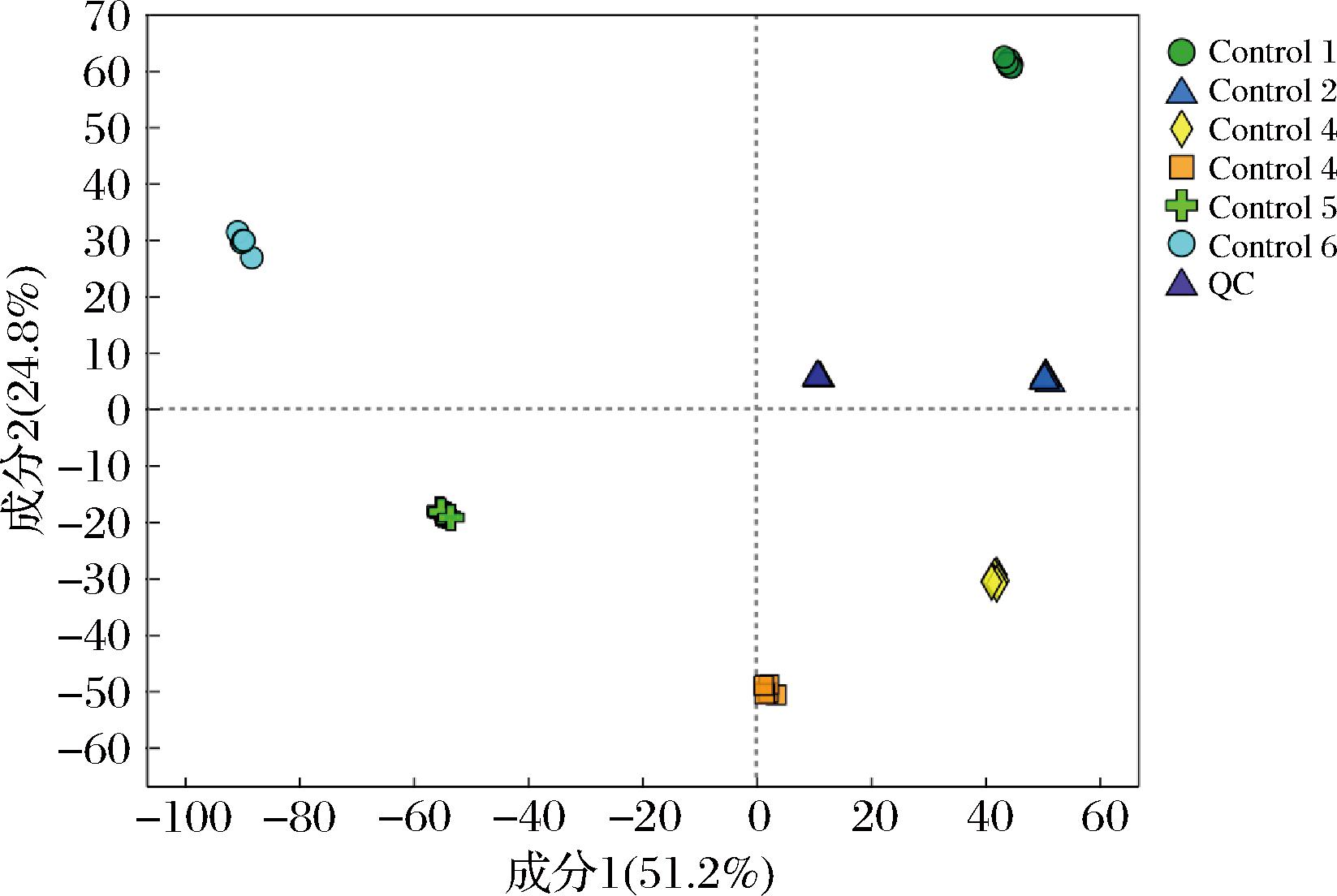
图3 正离子模式下沙棘酵素不同发酵时期代谢物PLS-DA得分图
Fig.3 PLS-DA analysis of seabuckthorn enzymes in different fermentation periods under positive ion mode
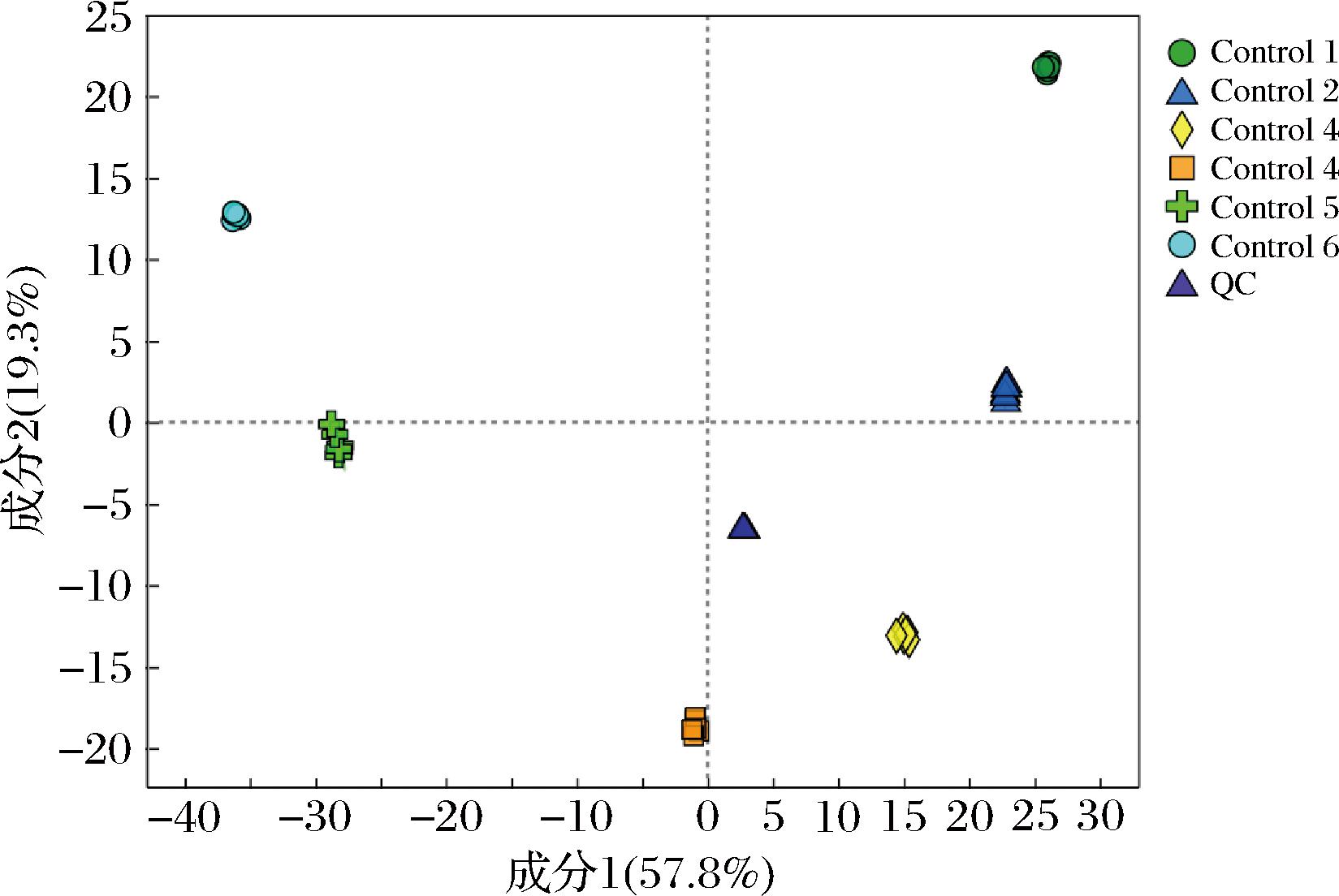
图4 负离子模式下沙棘酵素不同发酵时期代谢物PLS-DA得分图
Fig.4 PLS-DA analysis of seabuckthorn enzymes in different fermentation periods under negative ion mode
如图3~图6所示,各样本均位于置信区内,R2和Q2>0.9,可将其VIP值作为差异代谢物的筛选标准。采用置换检验来验证模型在建模过程中未发生拟合,如图5、图6所示,随着R2、Q2下降,正负离子模式下所产生的截距Q2<0.5,说明各样本间区分效果显著,建立的模型数据稳定可靠。
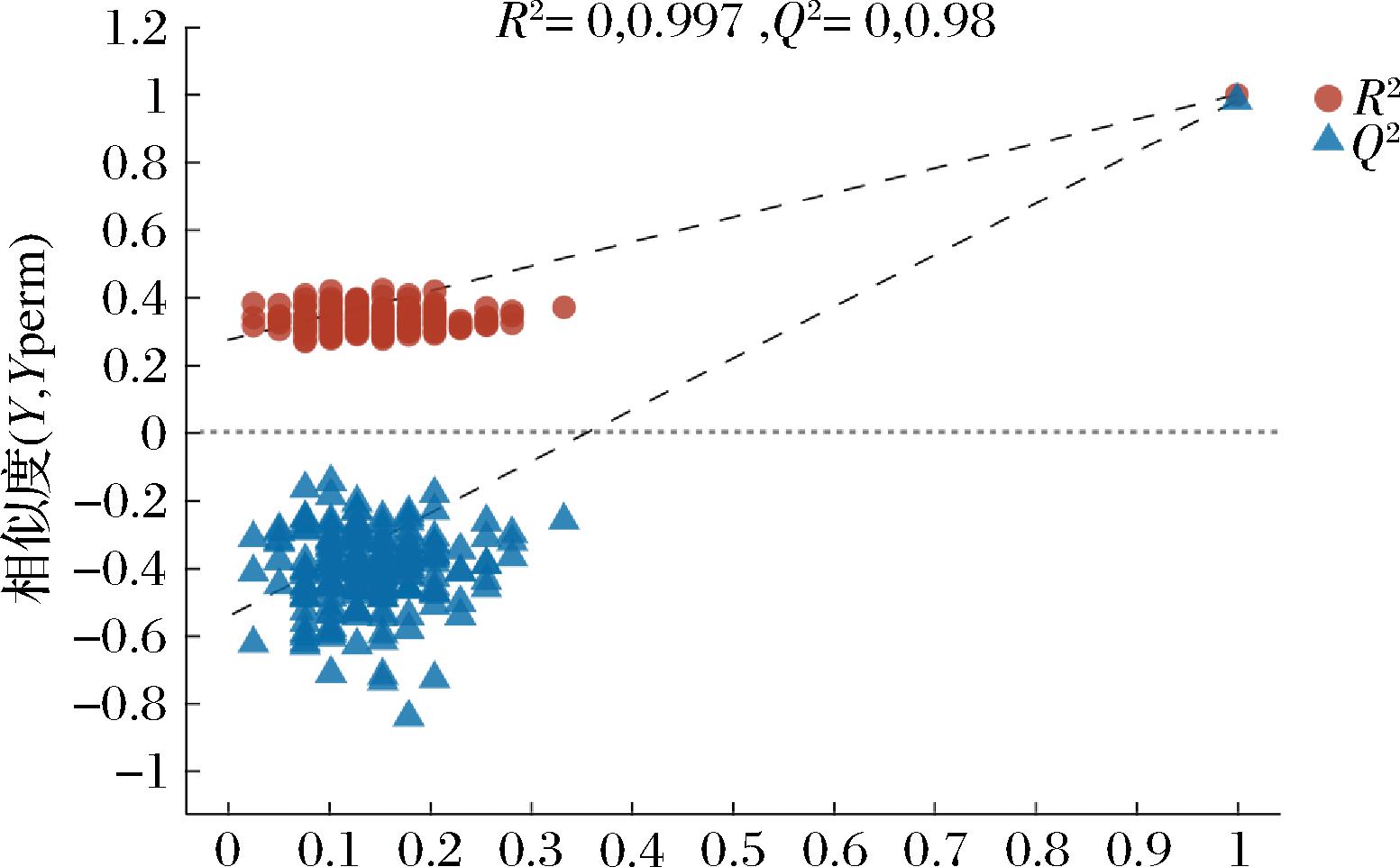
图5 正离子模式下沙棘酵素不同发酵时期代谢物PLS-DA置换检验
Fig.5 PLS-DA permutation test of seabuckthorn enzyme metabolites in different fermentation periods under positive ion mode
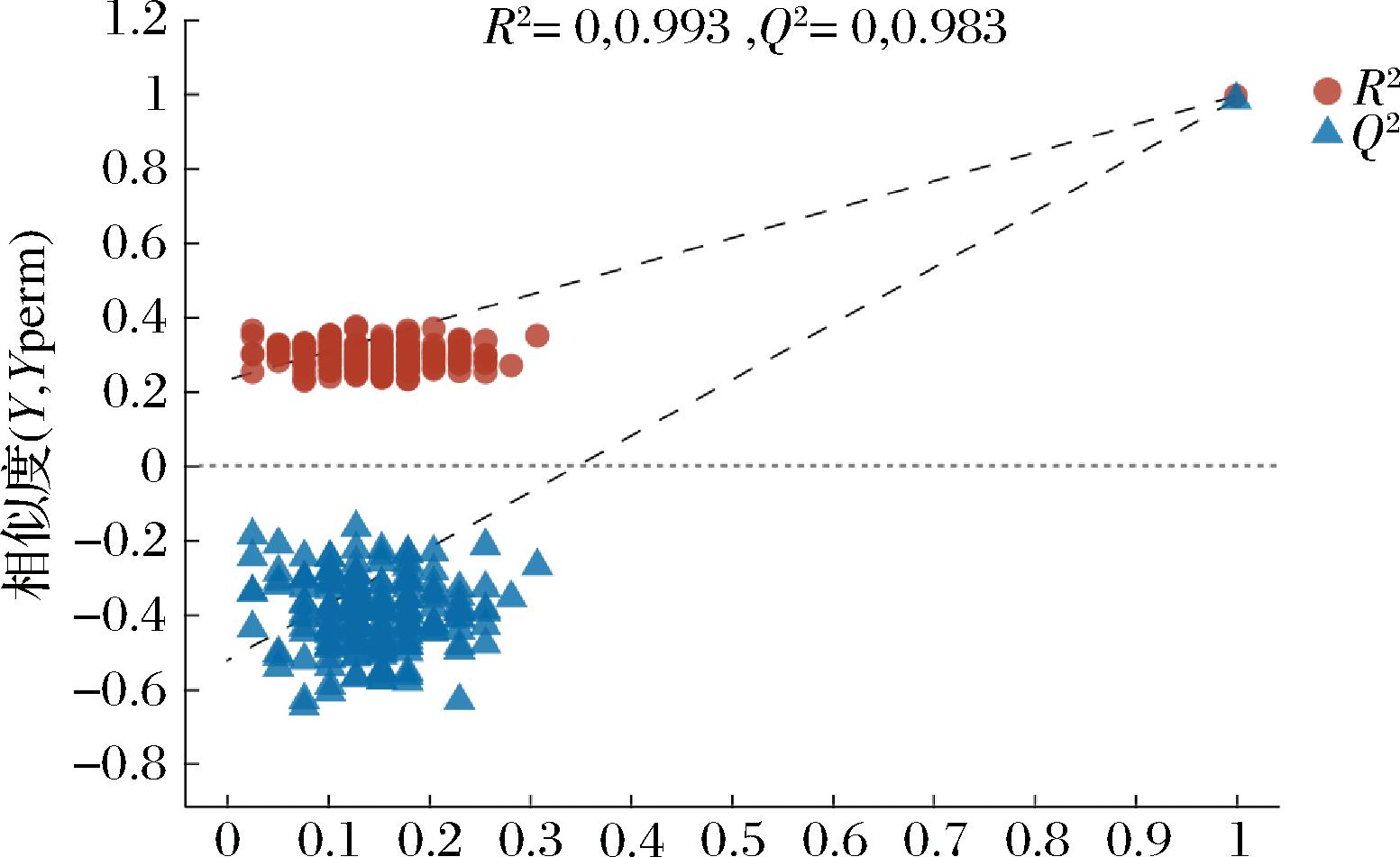
图6 负离子模式下沙棘酵素不同发酵时期代谢物PLS-DA置换检验
Fig.6 PLS-DA permutation test of seabuckthorn enzyme metabolites in different fermentation periods under negative ion mode
2.4 差异代谢物HMDB化合物分类
HMDB是最大、最全面的生物体特异性代谢数据库。HMDB被认为是人类代谢研究的标准代谢组学资源,是代谢组学物质鉴定的主要公共数据库之一,也是代谢物信息查询最重要的数据库之一。
通过比对HMDB 数据库,获得代谢产物的分类信息,如图7所示,共鉴定出16类1 164种代谢物质,分别有:有机氧化合物、有机杂环化合物、苯环类化合物、有机酸及其衍生物、脂质和类脂分子、其他类、核苷、有机氮化合物、木脂素、苯丙类和聚酮类、生物碱及其衍生物、核苷酸和类似物、碳氢化合物、新木脂素及相关化合物、有机硫磺类化合物、有机聚合物、碳氢化合物的衍生物、有机卤素类化合物。其中脂质和类脂分子、有机酸及其衍生物、有机杂环化合物三类代谢产物占比最高,占总代谢物的58.85%。
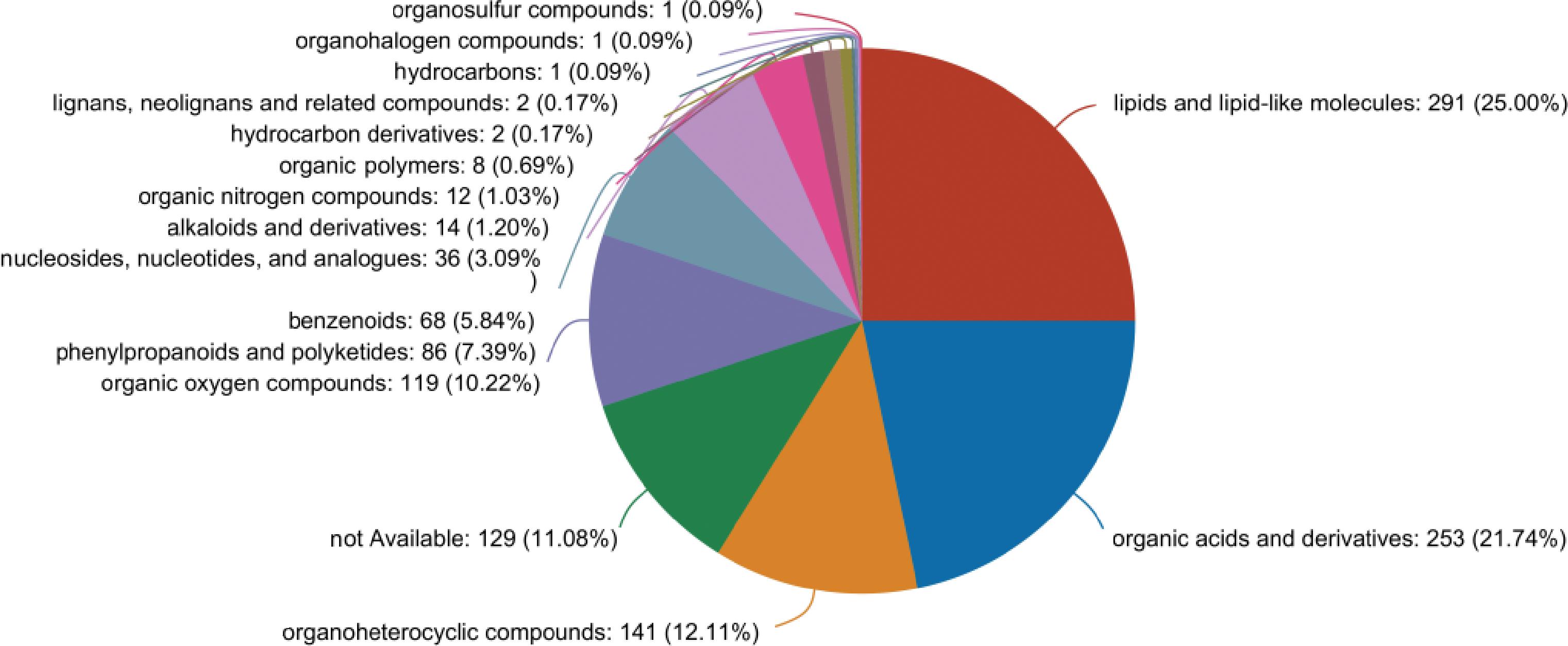
图7 沙棘酵素代谢物分类
Fig.7 Classification of metabolites in seabuckthorn enzyme
注:organcsulfur compounds:有机硫化合物;organohalogen compounds:有机卤素的化合物;hydrocarbons:碳氢化合物;lignans, nealignans and related compounds:木脂素、邻木脂素及相关化合物;hydrocarbon derivatives:碳氢化合物衍生品;lipids and lipid-like molecules:291 (25.00%),脂质和类脂分子;organic polymers:有机聚合物;organic nitragen compcunds:有机氮化合物;alkaloids and derivatives生物碱及其衍生物;nucleosides, nuclectides, and analogues:核苷、核内酯和类似物;pheny'propanoids and polyketides:苯丙素和聚酮类;organic oxygen compounds:有机氧化合物;benzenoids:苯环型化合物;not available:其他类;organic acids and derivatives:有机酸及其衍生物;organoheterocyclic compounds:有机杂环化合物。
2.5 差异代谢物KEGG通路富集分析
如图8所示,对沙棘酵素不同发酵时期差异代谢物进行KEGG通路富集分析,发现其共分布96条代谢途径,其中有20条通路具有显著差异,分别为:柠檬酸循环、丁酸代谢、色氨酸代谢、精氨酸和脯氨酸代谢、核黄素代谢、嘧啶嘌呤代谢、苯丙烷生物合成、苯丙氨酸、α-亚麻酸代谢、丙氨酸、酪氨酸和色氨酸生物合成、多种次生代谢产物的生物合成Ⅰ、辅助因子的生物合成、氨酰tRNA生物合成、玉米素生物合成、赖氨酸降解、苯丙氨酸代谢、ABC转运蛋白、D-氨基酸代谢、赖氨酸生物合成、甘油磷脂代谢、天冬氨酸和谷氨酸代谢。这些代谢途径中有217种代谢物,其中酮戊二酸、乙酰乙酸、5-羟基犬尿胺、吲哚-3-乙醛、γ-谷氨酰-L-腐胺、4-乙酰氨基丁酸、N-氨甲酰腐胺、S-腺苷甲硫氨酸、L-天门冬氨酸、S-腺苷甲硫氨酸、香豆素、胡椒酸、苯乙酸、次黄嘌呤、胞嘧啶、海藻糖、茉莉酸等代谢产物表现更为活跃。
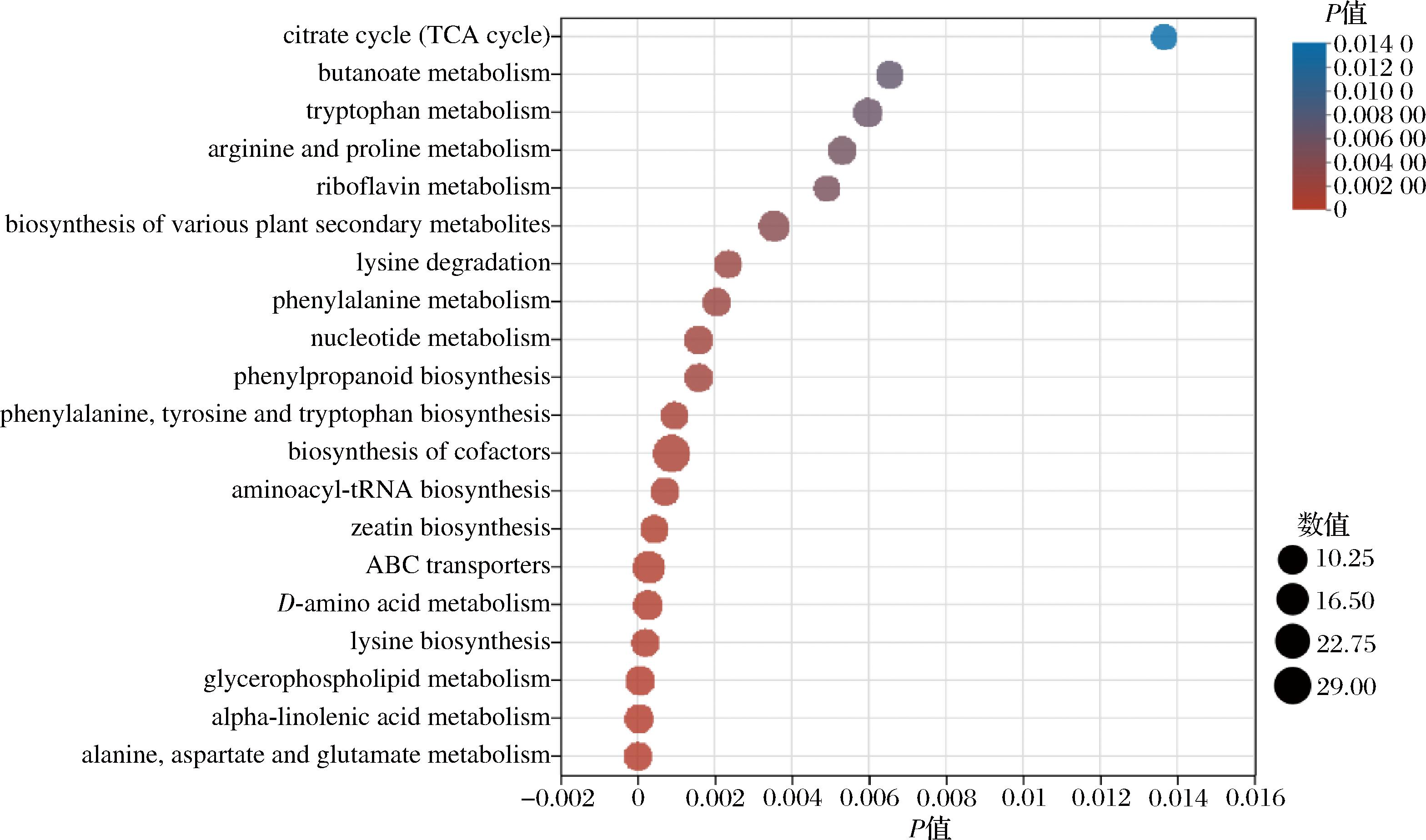
图8 沙棘酵素差异代谢物KEGG分析
Fig.8 KEGG enrichment maps of differential metabolites in seabuckthorn enzyme
注:citrate cycle:柠檬酸循环;butanoate metabolism:丁酸代谢;tryptophan metabolism:色氨酸代谢;arginine and proline metabolism:精氨酸和脯氨酸代谢;riboflavin metabolism :核黄素代谢;biosynthesis of various plant secondary metabolites:各种植物次生代谢产物的生物合成;lysine degradation:赖氨酸降解;phenylalanine metabolism :苯丙氨酸代谢;nucleotide metabolism :核苷酸代谢;phenyipropanoid biosynthesis:苯丙烷生物合成;phenylalanine, tyrosine and tryptophan biosynthesis :苯丙氨酸、酪氨酸和色氨酸的生物合成;biosynthesis of cofactors :辅助因子的生物合成;aminoacyl-trna biosynthesis:氨基酰基trna生物合成;zeatin biosynthesis :玉米素生物合成;abctransporters:abc转运蛋白;D-amino acid metabolism:D-氨基酸代谢;lysine biosynthesis:赖氨酸生物合成;glycerophosphollipid metabolism:甘油磷脂代谢;alpha-linolenic acid metabollism:α-亚麻酸代谢;alanine, aspartate and glutamate metabolism:丙氨酸、天冬氨酸和谷氨酸代谢。
在上述具有显著差异的代谢通路中,参与柠檬酸循环的差异代谢物有酮酸、琥珀酸、柠檬酸等有机酸类物质,这几种差异代谢物也参与了多条代谢通路,为机体生命活动提供能量。此外,氨基酸类物质既具有重要的呈味作用,也是风味物质形成的底物。代谢产物中的L-天门冬氨酸、L-谷氨酸属于鲜味氨基酸,其广泛存在于发酵食品中,是人体必需氨基酸,具有降血糖的功能。这类物质的存在为沙棘酵素具备更优的风味做出贡献。在丙氨酸、酪氨酸和色氨酸生物合成、天冬氨酸和谷氨酸代谢通路中,丙氨酸、天冬氨酸和谷氨酸先转化为丙酮酸、α-酮戊二酸、琥珀酸,后转变为葡萄糖等物质,可增加沙棘酵素甜度。在此代谢通路中,部分色氨酸经氧化脱羧转变为5-羟色胺,它具有稳定情绪的功效,被用于抗抑郁药物的开发。在苯丙氨酸代谢通路中,苯丙氨酸可通过代谢产生苯乙酸、苯乙酮等前体物质,还可通过苯丙氨酸羟化酶氧化生成酪氨酸,参与沙棘酵素糖代谢和脂类代谢。在嘧啶嘌呤代谢通路中,产生次黄嘌呤、胞嘧啶等代谢产物,而胞嘧啶则是合成抗癌、抗艾滋病药物的重要中间体。
2.6 差异代谢物Venn分析及聚类分析
Venn图也叫温氏图、范氏图,用于显示元素集合重叠区域的图表。Venn图是关系型图表,通过图形与图形之间的层叠关系,来表示可展示各个代谢集间的共有或特有的代谢物。通过该部分分析,可以迅速锁定不同对比组中共有和特有的代谢物。本研究中各样本Venn图分析情况如图9所示。柱状图表示Control 2 vs Control 3、Control 3 vs Control 4、Control 1 vs Control 2、Control 5 vs Control 6、Control 4 vs Control 5各比较组显示的代谢物数目分别为568、573、575、564、563。各比较组共同差异代谢物数量为35,其中Control 4 vs Control 5比较组差异较小,独有的差异代谢物数量为90,而Control 1 vs Control 2比较组差异较大,独有的差异代谢物数量为99。
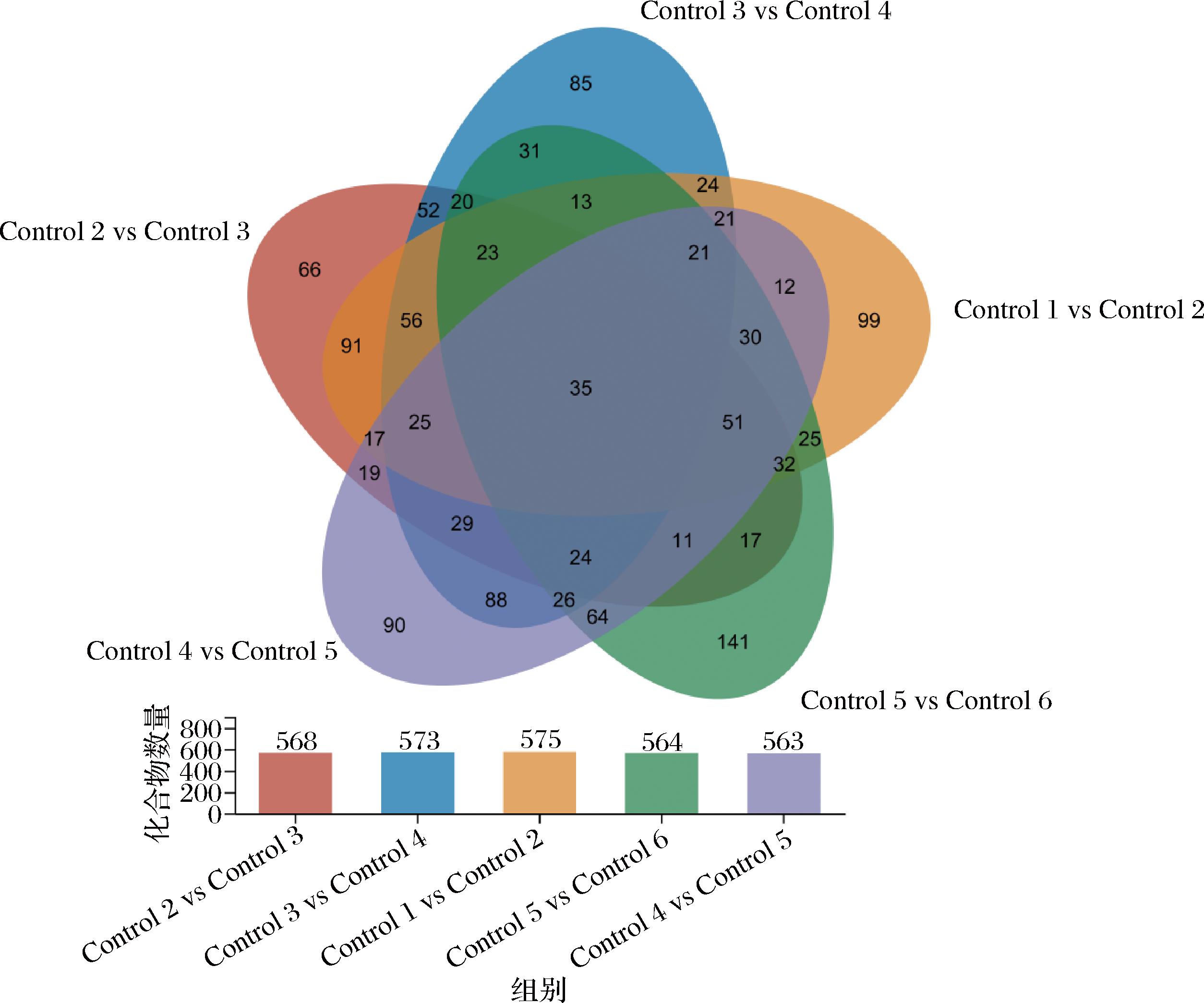
图9 沙棘酵素差异代谢化合物Venn图
Fig.9 Seabuckthorn enzyme differentially metabolized compound Venn
注:control 1 vs control 2为第10天及第20天发酵物对比;control 2 vs control 3为第20天及第30天发酵物对比;control 3 vs control 4为第30天及第40天发酵物对比;control 4 vs control 5为第40天及第50天发酵物对比;control 5 vs control 6为第50天及第60天发酵物对比。
对沙棘不同发酵时期的差异代谢物进行聚类分析,行代表一种差异代谢物,列代表一个发酵物样本。如图10所示,不同对照组中平行样本都聚在同一簇内,表明聚类热图分析结果稳定可靠[21-22]。
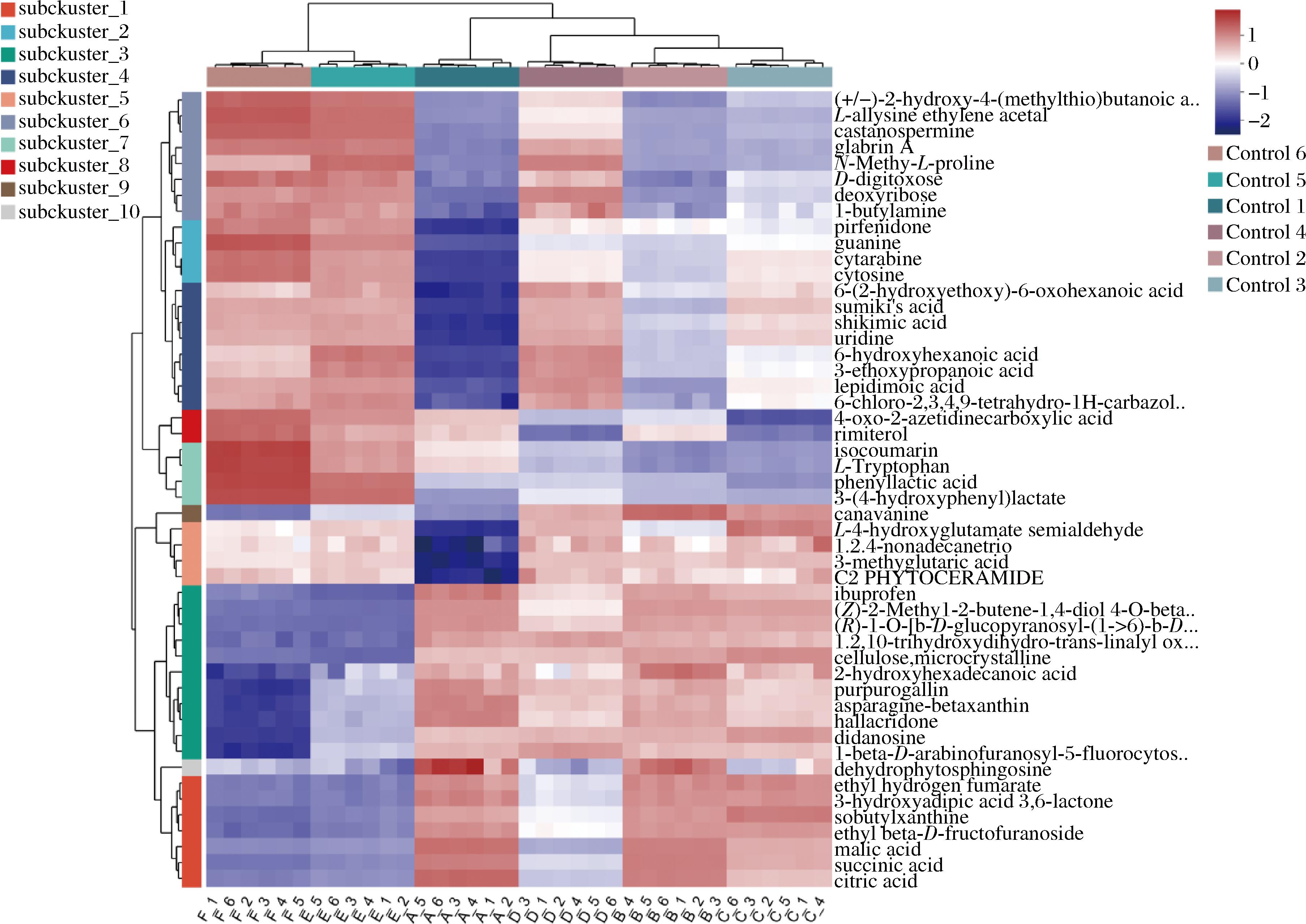
图10 沙棘酵素差异代谢化合物聚类
Fig.10 Cluster of differentially metabolizing compounds of seabuckthorn enzymes
注:subcluater_1至subcluater_10代表:样本聚类分析簇1至聚类分析簇10;control _1 至control _6代表:发酵10天的样本至发酵60天的样本;(+/-)-2-hydroxy-4-(methylthio)butanoica:(±)-2-羟基-4-(甲硫基)丁酸;L-allysine ethylene aceial: L-烯丙基甘氨酸乙缩醛;castanospermine:栗树碱;glabrin a:光甘草定a;n-methyl-l-proline:n-甲基-l-脯氨酸;d-digitoxose:d-洋地黄毒糖;deaxyribose:脱氧核糖;1-butylamine:1-丁胺;pirfenidone:吡非尼酮;guanine:鸟嘌呤;cytarabine:阿糖胞苷;cytosine:胞嘧啶;shikimic acid:莽草酸;sumil’s acid:住友酸;6-(2-hydroxyethaxy)-6-oxohexanoic acid:6-(2-羟乙氧基)-6-氧代己酸;uridine:尿苷;6-hydroxyhexanoic acid:6-羟基己酸;3-eihoxypropanoic acid:3-乙氧基丙酸;lepidimoic acid:莱普啶酸;6-chioro-2,3,4,9-1etrahydro-1 h-carbazol:6-氯-2,3,4,9-四氢-1 h-咔唑;4-oxo-2-azetidinecarboxylic acid:4-氧代-2-氮杂环丁烷羧酸;rimiterol:利米特罗;Isocoumarin:异香豆素;L-tryplophan:L-色氨酸;phenyllactic acid:苯乳酸;3-(4-hydrcxypheny)jlactate:3-(4-羟基苯基)乳酸酯;canavanine:刀豆氨酸;L-4-hydraxyglutamate semialdehyde:L-4-羟基谷氨酸半醛;1.2.4-nonadecanetrial:1,2,4-十九烷三醇;c2 phytoceramide:c2植物神经酰胺;3-methyglutaric acid:3-甲基戊二酸;lbuprafen:布洛芬;(Z)-2-methy|-2-butene- 1,4-diol 4- O -beta:(Z)-2-甲基-2-丁烯-1,4-二醇4-O-β;(R)-1-O-β-d-glucopyranosyl-(1->6)-b-d:(R)-1-O-β-d-吡喃葡萄糖基-(1→6)-β-d;1.2,10-trihydroxydihydro-trans-inalyf ax:1,2,10-三羟基二氢反式-茚基;celulose, microcrystalline:微晶纤维素;2-hydroxyhexadecanoic acid:2-羟基十六烷酸;purpurogallin:红没食子素;asparagine-betaxanthin:天冬酰胺-甜菜红素;hallacridone:2-乙酰基-5-羟基-11-甲基呋喃[2,3-c]吖啶-6-酮;didanosine:地达诺星;1-beta-d-arabinofuranasyl-5-flucrocytos:1-β-d-阿拉伯呋喃糖基-5-氟胞嘧啶;dehydrophytosphingosine:脱氢植物鞘氨醇;Isobutylxanthine:异丁基黄嘌呤;3-hydroxyadipic acid 3,6-lactone:3-羟基己二酸3,6-内酯;ethyl hydrogen fumarate:富马酸氢乙酯;ethyf beta-d-fructofuranoside:乙基 β-d-呋喃果糖苷;malic acid:苹果酸;citric acid:柠檬酸;succinic acid:琥珀酸。
2.7 差异代谢物筛选鉴定
以PLS-DA模型的VIP ≥ 1、P值<0.05、FC>2和FC<1/2为标准筛选显著差异代谢物,通过火山图显示沙棘酵素代谢物差异水平,结果如图11和表2所示。
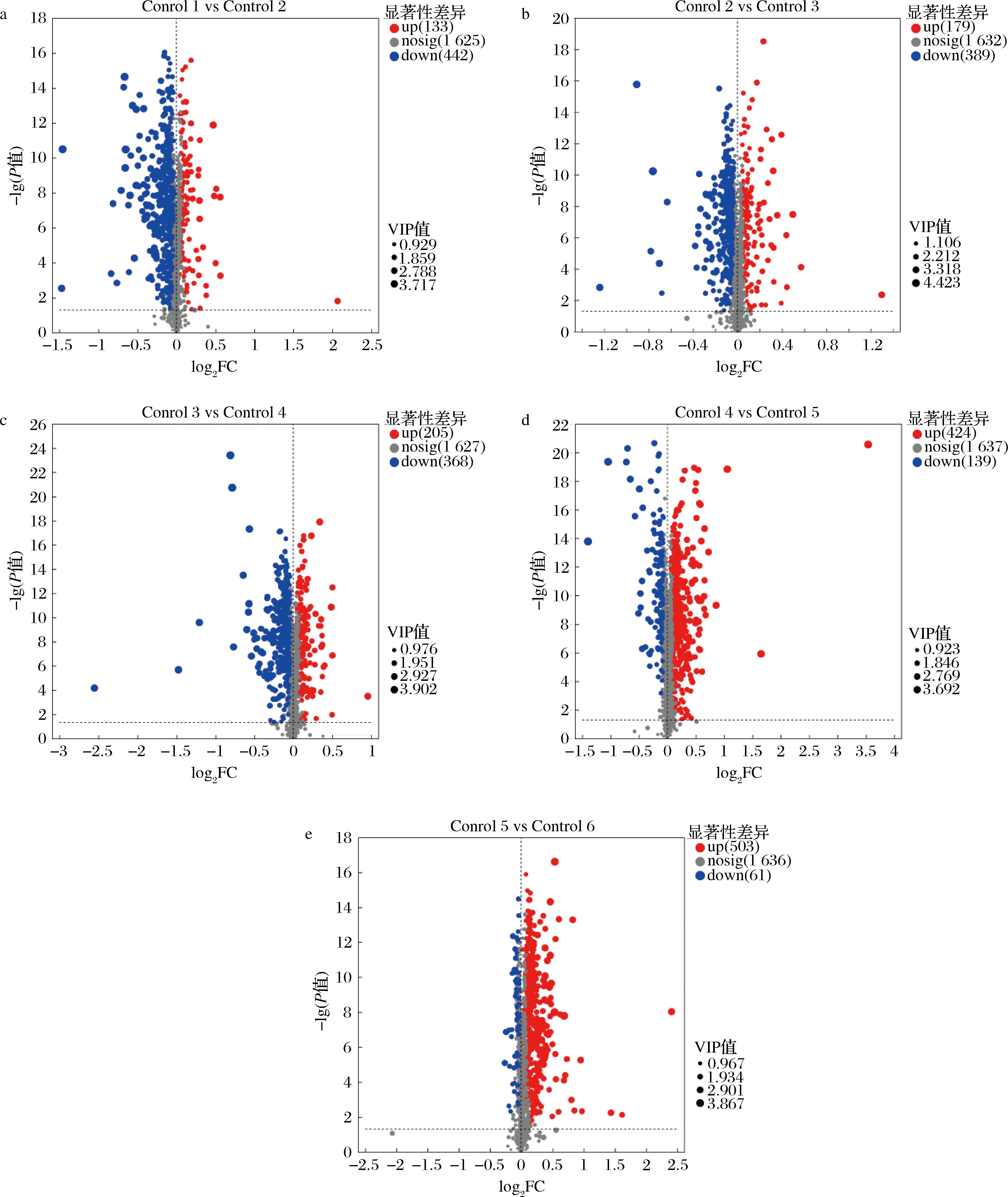
图11 沙棘酵素差异代谢物火山图
Fig.11 Volcano analysis in different metabolites of sea buckthorn enzyme
表2 沙棘酵素显著差异代谢化合物表
Table 2 Table of metabolizing compounds with significant difference in seabuckthorn enzymes

序号代谢物变化类型模式分子式HMDB 超类HMDB 类HMDB 亚类VIP值FC值P值发酵组名称12-氨基-5-膦戊酸下降negC5H12NO5P有机酸及其衍生物羧酸及其衍生物氨基酸, 肽1.011 90.360 90.002 974Control 1/Control 221-(γ-谷氨酰氨基)环丙烷羧酸下降posC9H14N2O5有机酸及其衍生物羧酸及其衍生物氨基酸, 肽1.003 40.364 10.000 000 000 032Control 1/Control 23(S)-5-氨基-3-氧代己酸盐上调posC6H11NO3有机酸及其衍生物酮酸及其衍生物中链酮酸及其衍生物3.374 72.459 20.004 494Control 2/Control 34未知化合物下降posC47H85O11P---3.284 30.433 80.000 000 000 257Control 3/Control 45芦荟醇下降negC13H14O4有机杂环化合物苯并吡喃1-苯并吡喃3.691 50.379 40.000 000 000 000 017Control 4/Control 56甲地孕酮上调posC21H28O3脂质和类脂分子类固醇和类固醇衍生物孕烷类固醇1.946 43.070 90.007 521Control 5/Control 6
注:-表示未检出。
在正负离子模式下,沙棘酵素不同发酵时期共筛选出1 164种差异代谢物,如图11所示,Control 1 vs Control 2为第10天及第20天发酵物对比,共筛选出差异代谢化合物575种,其中,上调差异代谢物133种,下调差异代谢物442种;Control 2 vs Control 3为第20天及第30天发酵物对比,共筛选出差异代谢化合物568种,其中,上调差异代谢物179种,下调差异代谢物389种;Control 3 vs Control 4为第30天及第40天发酵物对比,共筛选出差异代谢化合物573种,其中,上调差异代谢物205种,下调差异代谢物368种;Control 4 vs Control 5为第40天及第50天发酵物对比,共筛选出差异代谢化合物563种,其中,上调差异代谢物424种,下调差异代谢139种物;Control 5 vs Control 6为第50天及第60天发酵物对比,共筛选出差异代谢化合物564种,其中,上调差异代谢物503种,下调差异代谢物61种。结果表明,在沙棘酵素发酵末期,上调差异代谢化合物数量显著升高,且在发酵后期占比明显上升,而下调差异代谢物数量则随着发酵时间的延长逐步下降。
以PLS-DA模型VIP≥1、P值<0.05、FC>2和FC<1/2为标准筛选显著差异代谢物,如表2所示,共筛选出7种显著差异代谢物。在沙棘酵素发酵的前期,有机酸及其衍生物占比较多,发酵中期下调代谢物有机杂环化合物占主导地位,发酵末期则脂质和类脂分子占多数。共有2种差异代谢物上调和5种差异代谢物下调,羧酸及其衍生物多为下调,如:2-氨基-5-膦戊酸、1-(γ-谷氨酰氨基)环丙烷羧酸;有机杂环化合物为下调,如:3′-羟基丁螺环酮、芦荟醇;酮酸及其衍生物、类固醇和类固醇衍生物多为上调物质,如:(S)-5-氨基-3-氧代己酸盐、甲地孕酮。
有机酸在发酵过程中可以抑制微生物的活性,增强发酵产品的贮藏期,同时增加发酵物质的风味与口感,而有机酸主要来源于发酵过程中微生物的代谢。本实验中琥珀酸、胡椒酸、苯乙酸、茉莉酸等有机酸含量较高,琥珀酸是一类维持沙棘酵素风味的有机酸,也是重要的载体之一;苯乙酸为致香前体物质;茉莉酸亦属于芳香物质,使得沙棘酵素具有明显的的花香气味。此外,有机杂环化合物及脂质和类脂分子中的部分物质属于芳香物质,可为沙棘酵素增加风味与口感。
3 结论与讨论
本研究采用UPLC-MS非靶向代谢组学技术,对沙棘酵素不同发酵时期代谢物质进行分析。经数据预处理后,正离子模式下鉴定代谢物质1 325种,负离子模式下鉴定出代谢物质875种。PCA及PLS-DA分析结果显示,各样本间具有明显的分离趋势,表明不同发酵时期沙棘代谢物差异显著;通过对差异代谢物进行HMDB化合物分类,共鉴定出16类1 164种代谢物质,其中有机酸、有机杂环化合物、脂质和类脂分子三类化合物占比最高,占总代谢物的58.85%。通过对差异代谢物进行KEGG通路富集,沙棘酵素差异代谢物共分布96条代谢途径,其中具有显著差异的通路有20条,主要参与柠檬酸循环、丁酸代谢、色氨酸代谢、精氨酸和脯氨酸代谢、核黄素代谢等代谢途径。利用Venn图分析沙棘酵素差异代谢物,发现各比较组共同差异代谢物数量为35,其中Control 4 vs Control 5比较组差异较小,独有的差异代谢物数量为90,而 Control 1 vs Control 2比较组差异较大,独有的差异代谢物数量为99。火山图结果显示,随着发酵时间的延长,上调差异代谢物数量逐渐上升,且在发酵后期占比明显上升,而下调差异代谢物数量则随着发酵时间的延长逐步下降。以PLS-DA模型VIP≥1、P值<0.05、FC>2和FC<1/2为标准筛选显著差异代谢物,共筛选出7种显著差异代谢物,共有2种差异代谢物上调和5种差异代谢物下调,羧酸及其衍生物及有机杂环化合物多为下调,酮酸及其衍生物、类固醇和类固醇衍生物多为上调物质。
沙棘为浆果类药食同源性水果,富含多种氨基酸、维生素、多酚、总糖、类黄酮等物质,具有增强机体免疫、保护心脑血管、抗衰老、抗肿瘤等保健功能[23-24]。氨基酸和多肽类物质是浆果酵素发酵过程中的重要代谢物质,其种类和含量的增加有助于酵素在机体中发挥更大的功效[25-26]。发酵过程中的各类微生物利用有机酸类物质作为碳源快速产生能量, 维持自身代谢及增殖等生物过程, 使得发酵过程持续进行[27]。酮酸是一类在生物体内拥有重要作用的有机酸,在氨基酸代谢和维持氧化还原状态的过程中起到核心作用。其广泛存在于细菌和真菌等多类生物的次生代谢物中,具有抗病毒、抗菌、抗肿瘤等生物活性。杂环类化合物广泛存在于自然界,与生物学有关的重要化合物多数为杂环化合物,主要分为脂杂环和芳杂环两大类,一般来说,芳杂环的环系都有一定程度的稳定性和芳香性,沙棘酵素在发酵过程散发出的芳香气味可能与产生此类化合物有着紧密的联系。通过复杂的物质代谢产生新的次生代谢物及生物活性物质, 改善产品的风味及口感[28-29]。另外,沙棘酵素发酵过程中产生的脂类及类脂物质可能与沙棘油有关。沙棘浆果中沙棘籽占比23%,沙棘种子富含多种抗氧化物质、油酯、不饱和脂肪酸、β-谷甾醇等。沙棘油对心脑血管系统疾病及某些皮肤病作用显著,还具有抗菌等活性[30]。
本研究采用非靶向代谢组学技术对沙棘酵素不同发酵时期代谢物进行差异分析,筛选出显著差异代谢物。结果表明,有机酸、有机杂环化合物、脂类物质在沙棘酵素发酵前、中、后3个时期表现出不同程度的差异。沙棘酵素风味化合物、香气成分及沙棘油脂类功能探索可能是今后关注的重点。同时,在研究中发现沙棘酵素中部分物质可应用于医药领域,或成为开发药用物质重要的前体,今后将对关键核心物质进行靶向测定,为沙棘资源的开发利用提供重要的物质基础和理论依据。
[1] 张程慧, 祁玉霞, 程康蓉, 等.沙棘的综合价值研究进展[J].食品工业科技, 2017, 38(22):331-335.ZHANG C H, QI Y X, CHENG K R, et al.Advances on research and applications of Hippophea rhamnoides[J].Science and Technology of Food Industry, 2017, 38(22):331-335.
[2] 国家药典委员会. 中华人民共和国药典-一部:2020年版[M].北京:中国医药科技出版社, 2020:285-286.National Pharmacopoeia Committee.Pharmacopoeia of the People's Republic of China, Volume I:2020 Edition [M].BeiJing:China Medical Science and Technology Press,2020:285-286.
[3] ZHENG L, SHI L K, ZHAO C W, et al.Fatty acid, phytochemical, oxidative stability and in vitro antioxidant property of sea buckthorn (Hippopha⊇ rhamnoides L.) oils extracted by supercritical and subcritical technologies[J].LWT, 2017, 86:507-513.
[4] MA X Y, MOILANEN J, LAAKSONEN O, et al.Phenolic compounds and antioxidant activities of tea-type infusions processed from sea buckthorn (Hippopha⊇ rhamnoides) leaves[J].Food Chemistry, 2019, 272:1-11.
[5] OLAS B.Sea buckthorn as a source of important bioactive compounds in cardiovascular diseases[J].Food and Chemical Toxicology, 2016, 97:199-204.
[6] ZHANG W, ZHANG X H, ZOU K, et al.Seabuckthorn berry polysaccharide protects against carbon tetrachloride-induced hepatotoxicity in mice via anti-oxidative and anti-inflammatory activities[J].Food &Function, 2017, 8(9):3130-3138.
[7] WANG X, LIU J R, ZHANG X H, et al.Seabuckthorn berry polysaccharide extracts protect against acetaminophen induced hepatotoxicity in mice via activating the Nrf-2/HO-1-SOD-2 signaling pathway[J].Phytomedicine, 2018, 38:90-97.
[8] 郝娟, 方亮.沙棘各营养成分测定方法研究进展[J].现代食品, 2020, 26(13):32-35.HAO J, FANG L.Research progress on the determination methods of various nutrients in seabuckthorn[J].Modern Food, 2020, 26(13):32-35.
[9] 张琪, 朱丹, 牛广财, 等.沙棘果酒发酵动力学及其抗氧化活性[J].食品与发酵工业, 2019, 45(15):53-58.ZHANG Q, ZHU D, NIU G C, et al.Fermentation kinetics and antioxidant activity of sea buckthorn wine[J].Food and Fermentation Industries, 2019, 45(15):53-58.
[10] MA X Y, MOILANEN J, LAAKSONEN O, et al.Phenolic compounds and antioxidant activities of tea-type infusions processed from sea buckthorn (Hippopha⊇ rhamnoides) leaves[J].Food Chemistry, 2019, 272:1-11.
[11] LIU F T, WANG T, LI X X, et al.Involvement of NF-κB in the reversal of CYP3A down-regulation induced by sea buckthorn in BCG-induced rats[J].PLoS One, 2020, 15(9):e0238810.
[12] 秦双双, 韦坤华, 胡营, 等.药用植物4.0研究进展与展望[J].中国现代中药, 2023, 25(7):1383-1395.QIN S S, WEI K H, HU Y, et al.Research progress and prospect of medicinal plants 4.0[J].Modern Chinese Medicine, 2023, 25(7):1383-1395.
[13] DANZI F, PACCHIANA R, MAFFICINI A, et al.To metabolomics and beyond:A technological portfolio to investigate cancer metabolism[J].Signal Transduction and Targeted Therapy, 2023, 8(1):137.
[14] ZHANG L Y, YU Y B, YU R Z.Analysis of metabolites and metabolic pathways in three maize (Zea mays L.) varieties from the same origin using GC-MS[J].Scientific Reports, 2020, 10(1):17990.
[15] YANG M, YIN M Z, CHU S S, et al.Colour, chemical compounds, and antioxidant capacity of Astragali Radix based on untargeted metabolomics and targeted quantification[J].Phytochemical Analysis, 2022, 33(4):599-611.
[16] PENG Y, HONG J, RAFTERY D, et al.Metabolomic-based clinical studies and murine models for acute pancreatitis disease:A review[J].Biochimica et Biophysica Acta.Molecular Basis of Disease, 2021, 1867(7):166123.
[17] CHUNG H J, SIM J H, MIN T S, et al.Metabolomics and lipidomics approaches in the science of probiotics:A review[J].Journal of Medicinal Food, 2018, 21(11):1086-1095.
[18] CHEN Q, XIANG H, ZHAO Y Q, et al.Cooperative combination of non-targeted metabolomics and targeted taste analysis for elucidating the taste metabolite profile and pathways of traditional fermented golden pompano[J].Food Research International, 2023, 169:112865.
[19] PENG J K, DAI W D, LU M L, et al.New insights into the influences of baking and storage on the nonvolatile compounds in oolong tea:A nontargeted and targeted metabolomics study[J].Food Chemistry, 2022, 375:131872.
[20] WANG H J, CAO X L, YUAN Z F, et al.Untargeted metabolomics coupled with chemometrics approach for Xinyang Maojian green tea with cultivar, elevation and processing variations[J].Food Chemistry, 2021, 352:129359.
[21] LIU Y T, HUANG W M, ZHANG C Y, et al.Targeted and untargeted metabolomic analyses and biological activity of Tibetan tea[J].Food Chemistry, 2022, 384:132517.
[22] LONG P P, WEN M C, GRANATO D, et al.Untargeted and targeted metabolomics reveal the chemical characteristic of pu-erh tea (Camellia assamica) during pile-fermentation[J].Food Chemistry, 2020, 311:125895.
[23] 陈凤英. 典型浆果预处理、红外冷冻干燥及其干制品吸湿特性研究[D].无锡:江南大学, 2021:1-20.CHEN F Y.Study on pretreatment, infrared freeze-drying and moisture absorption characteristics of typical berries[D].Wuxi:Jiangnan University, 2021:1-20.
[24] 陈卫,徐阳,鲍涛,等.浆果花色苷的营养健康功效与功能食品创制[C].中国食品科学技术学会第十七届年会论文集.北京:中国食品科学技术学会,2020:115-116.CHEN W, XU Y, BAO T, et al.Nutrition and health effects of berry anthocyanins and the creation of functional food[C].Proceedings of the 17th Annual Meeting of the Chinese Society of Food Science and Technology.Beijing:Chinese Society of Food Science and Technology,2020:115-116.
[25] 陈小伟, 程勇杰, 范昊安, 等.草莓酵素发酵过程中氨基酸成分分析和蛋白质营养评价[J].食品工业科技, 2018, 39(17):64-70;78.CHEN X W, CHENG Y J, FAN H A, et al.Amino acid composition analysis and protein nutrition evaluation of strawberry jiaosu during fermentation process[J].Science and Technology of Food Industry, 2018, 39(17):64-70;78.
[26] ADESULU-DAHUNSI A T, DAHUNSI S O, OLAYANJU A.Synergistic microbial interactions between lactic acid bacteria and yeasts during production of Nigerian indigenous fermented foods and beverages[J].Food Control, 2020, 110:106963.
[27] DAI J, SHA R Y, WANG Z Z, et al.Edible plant Jiaosu:Manufacturing, bioactive compounds, potential health benefits, and safety aspects[J].Journal of the Science of Food and Agriculture, 2020, 100(15):5313-5323.
[28] 张海燕, 康三江, 袁晶, 等.苹果酵素自然发酵过程中生物活性物质的变化[J].中国酿造, 2021, 40(3):111-114.ZHANG H Y, KANG S J, YUAN J, et al.Changes of bioactive compounds of apple Jiaosu during natural fermentation[J].China Brewing, 2021, 40(3):111-114.
[29] 李静静, 唐凤仙, 赵馨馨, 等.不同预处理对发酵沙棘汁理化特性及挥发性风味化合物的影响[J].中国酿造, 2023, 42(7):196-201.LI J J, TANG F X, ZHAO X X, et al.Effects of different pretreatment on physicochemical properties and volatile flavor compounds of fermented seabuckthorn juice[J].China Brewing, 2023, 42(7):196-201.
[30] 杨旭升,张宇,张昭,等.中国沙棘果油和中亚沙棘果油的理化特性及活性成分分析[J].油脂化学,2022,45(12):44-48.YANG X S,ZHANG Y,ZHANG S,et al.Analysis of physicochemical properties and active components of Chinese and Central Asian sea buckthorn fruit oils[J].Oil chemistry,2022,45(12):44-48.