蛋清含有丰富的营养物质,约占鸡蛋总质量的66%,呈透明胶状,其中蛋白含量约为11%~13%[1],包括卵清蛋白(54%)、卵转铁蛋白(12%)、卵类黏蛋白(11%)和溶菌酶(3.4%)等。蛋清蛋白(egg white protein,EWP)因其具有高营养价值和良好的乳化性、发泡性和胶凝性[2],在食品加工领域具有广泛应用。EWP的亲水亲油特性可与水形成稳定的乳液[3],而疏水性残基被蛋清中的球状蛋白[4]包裹于分子内部,导致表面疏水性低,EWP的乳化能力低于大豆蛋白和牛奶蛋白,限制了EWP在乳液体系中的应用[5]。糖基化反应可有效促进其内部疏水基团的暴露,并修饰蛋白结构达到拓宽EWP在乳液体系中的应用。
糖基化过程是蛋白质游离氨基与还原糖的羰基之间的共价反应[6]。糖基化反应改变蛋白质侧链基团的化学活性,从而改变蛋白质的结构、静电荷和疏水性;又利用糖黏稠的优点,提高糖缀合物的界面性能,改善其乳化能力[7]。例如,AI等[8]在鸭蛋蛋清中添加D-木糖发生糖基化反应后,显著提高EWP的乳化活性和乳化稳定性;NIU等[9]发现蛋白质和多糖的组合可以提高乳液的稳定性。然而,传统的干法和湿法糖基化较为耗时,且长期加热还可能导致蛋白质聚集,糖基化反应受到限制[10],从而限制其商业应用。
pH偏移是一种简单且有效的化学处理方法,在强酸或强碱条件下诱导蛋白质亚基分离和去折叠来改善乳化性[11]。首先,将蛋白质溶液pH值调节到远低于或高于自身等电点的pH值,诱导蛋白结构展开;再将pH值调节至中性,静电斥力减弱,蛋白结构重新折叠。天然蛋白结构较紧凑,极端pH处理增加了多肽链中的分子内静电相互作用,蛋白质发生构象变化,将pH调为中性后,蛋白分子侧链之间的相互作用被削弱,蛋白分子间整体结构相对松散[12]。LI等[13]发现pH偏移处理可以破坏蛋白质分子之间的疏水相互作用和范德华力,从而改善其功能特性。WANG等[5]研究发现强酸性处理(pH 3)可以显著提高乳液体系中EWP的乳化能力,乳液具有很高的稳定性。YU等[14]将EWP经极端碱性pH偏移处理后,特别是pH值为13时,EWP的乳化活性和乳液稳定性均有所增强。
目前,糖基化和pH偏移处理方式改善蛋清蛋白乳化性已有许多研究成果,但关于pH偏移对糖基化处理改善蛋清蛋白乳化性能的影响尚未报道。本实验旨在探讨不同pH偏移处理后进行湿法糖基化对蛋清乳化性能的影响,为蛋清在乳化体系中的应用提供参考。
1 材料与方法
1.1 材料与试剂
新鲜鸡蛋,雅安市名山黄家鲜鸡蛋(蛋鸡:大五金凤);葵花籽油,金龙鱼粮油食品股份有限公司;葡聚糖T40,上海源叶生物科技有限公司;考马斯亮蓝R-250,成都市科龙化工试剂厂;8-苯胺-1-萘磺酸(8-aniline-1-naphthalene sulfonic acid,ANS探针)、PBS粉末磷酸盐缓冲液,成都浩博优科技有限公司;氢氧化钠、盐酸、甲醇、乙酸,成都市科隆化学品有限公司;三羟甲基氨基甲烷(Tris)、甘氨酸、十二烷基磺酸钠(sodium dodecyl sulfonate,SDS),北京索莱宝科技有限公司。
1.2 仪器与设备
磁力搅拌水浴锅,恩谊科技有限公司;FSH-2A可调高速均质机,常州越新仪器制造公司;PHS-25型pH计,上海今迈仪器仪表有限公司;TGL-18M型高速冷冻离心机,上海卢湘仪离心机有限公司;L1物联智能可见分光光度计,上海佑科仪表有限公司;DYCZ-240型电泳仪及电源,北京市六一仪器厂;Zetasizer Nano动态光纳米粒度点位仪,马尔文仪器公司;Thermo Scientific NicoletIS10型傅里叶变换红外光谱仪,赛默飞世尓科技有限公司;Lumina荧光分光光度计,美国赛默飞公司;LGJ-18S冷冻干燥机,新艺超声波设备有限公司。
1.3 实验方法
1.3.1 蛋清预处理
蛋清预处理的工艺流程如下所示:
拣蛋→洗蛋→消毒(0.1 mol/L的NaOH浸泡3 min)→喷淋→擦干→分离蛋清→稀释→均质(10 000 r/min、4 min)→100目过滤备用
1.3.2 pH偏移辅助糖基化改性蛋清液乳化性
取100 g蛋白质量浓度为30 mg/mL蛋清稀释液,用2 mol/L的NaOH(或HCl)将蛋清稀释液的pH值调为11、12、13(或2、3、4),在室温下搅拌1 h以诱导蛋白结构展开,最后将pH值调为7,让其重新折叠并终止反应。然后加入葡聚糖,使m(蛋清蛋白)∶m(葡聚糖)=2∶1,在80 ℃水浴锅中600 r/min反应1 h,反应完毕后立即放入冰水中。采用未改性的蛋清液作为空白组(CK),单独糖基化改性的蛋清液作为对照组。
1.4 指标测定
1.4.1 接枝度
参考SUN等[15],略作修改。邻苯二甲醛(o-phthalaldehyde,OPA)试剂的制备方法如下:将200 mg OPA溶解在5 mL甲醇中,加入12.5 mL 20%(质量分数)SDS溶液、125 mL四硼酸钠缓冲液(0.1 mol/L)和500 μL β-巯基乙醇混合均匀,用超纯水定容到250 mL。将200 μL的样品溶液与4 mL OPA试剂在35 ℃下反应2 min,以200 μL超纯水和4 mL OPA试剂的混合物作为空白。测量混合溶液在340 nm处的吸光度,以赖氨酸作为测定游离氨基含量的标准,接枝度的计算如公式(1)所示:
接枝度![]()
(1)
式中:A0为EWP的吸光度,At为糖缀合物的吸光度。
1.4.2 褐变程度
参考SETIOWATI等[16]的方法。用超纯水将样品蛋白质量浓度稀释至3 mg/mL,分别在294 nm和420 nm读取吸光度。
1.4.3 SDS-PAGE
参照PANOZZO等[17]的方法,略作修改。采用分离胶和浓缩胶的质量分数分别为12%和5%,将样品蛋白质量浓度稀释至1 mg/mL,取15 μL样品与15 μL的2倍上样缓冲液振荡混匀后沸煮5 min,冷却后取10 μL进行SDS-PAGE电泳。样品在浓缩胶和分离胶时分别采用80 V和120 V的恒压进行电泳,指示带到达分离胶最底端停止电泳。电泳完毕后用染色液于摇床上染色2 h,最后用脱色液脱色至条带清晰后进行扫描成像分析。
1.4.4 傅里叶红外光谱(Fourier transform infrared spectroscopy,FTIR)
参照CHEN等[18]的方法。将样品粉末和溴化钾以质量比1∶100完全混合,在干燥条件下压缩成透明片。并在实验条件为:光谱分辨率4 cm-1,测量范围4 000~400 cm-1,扫描信号累加32次下进行扫描。
1.4.5 粒径和Zeta电位
参照刘俊锋等[19]的方法。将样品蛋白质量浓度稀释至1 mg/mL,用马尔文粒度仪进行粒径和ζ-电位的测定,样品选择蛋白,溶剂为水相。
1.4.6 游离巯基含量
参照ZHAO等[20]的方法。配制Ellman试剂:用pH 8 Tris-甘氨酸缓冲溶液溶解0.4 g 5,5′-二硫代双(2-硝基苯甲酸),并定容到100 mL。表面巯基含量的测定:取4 mL pH 8 Tris-甘氨酸缓冲溶液,加入0.5 mL的Ellman试剂,0.5 mL样品,振荡混匀,40 ℃水浴中15 min进行显影,在412 nm处测定其吸光度值,游离巯基含量的计算如公式(2)所示:
巯基含量![]()
(2)
式中:A412为412 nm处的吸光度值;M为样品的稀释倍数;ρ为蛋白液质量浓度,mg/mL。
1.4.7 表面疏水性
参照叶钰等[21]的方法,略作修改。用0.01 mol/L的PBS(pH 7.2)缓冲液配制8 mmol/L的ANS探针溶液,取样品溶液(0.1 mg/mL)4 mL,加入20 μL ANS探针溶液,混匀后避光反应15 min,测定其荧光强度。荧光测定条件:激发波长为390 nm,发射波长470 nm,狭缝宽度为5 nm。
1.4.8 乳化性测定
乳化活性指数(emulsifying activity index,EAI)和乳化稳定性指数(emulsion stability index,ESI)采用LI等[22]的方法进行测定,略作修改。将样品蛋白质量浓度稀释至10 g/mL,将葵花籽油(10 mL)与样品溶液(30 mL)以体积比1∶3混合,用高速搅拌机10 000 r/min剪切1 min。从底部取保存0 min和10 min后的均质乳液50 μL,与5 mL 0.1% SDS溶液混合,以0.1% SDS溶液为空白,在500 nm处读取吸光度。EAI和ESI的计算如公式(3)、公式(4)所示:
(3)
(4)
式中:DF为稀释因子;C为蛋白质质量浓度,g/mL;Ψ为光路,1 cm;θ为用于形成乳液的油的比例,0.25;A0和A10为乳液在0 min和10 min下的吸光度。
1.5 数据分析
样品重复测定3次;数据采用SPSS 27显著性分析(P<0.05,显著),数据采用“平均值±标准差”的形式表示;图像采用Origin 2018绘制。
2 结果与分析
2.1 pH偏移对糖基化接枝度的影响
蛋白质与多糖之间的糖基化程度影响糖缀合物的基本结构功能特性,通常采用接枝度来表征糖基化反应初级阶段的进程。如图1所示,经pH偏移处理的接枝度较单独糖基化显著提高(P<0.05),溶液的pH值远高于蛋白质等电点,蛋白质结构变得无序和随机排列,暴露出更多的游离氨基,非质子化氨基酸的数量减少,从而提高糖基化反应程度。
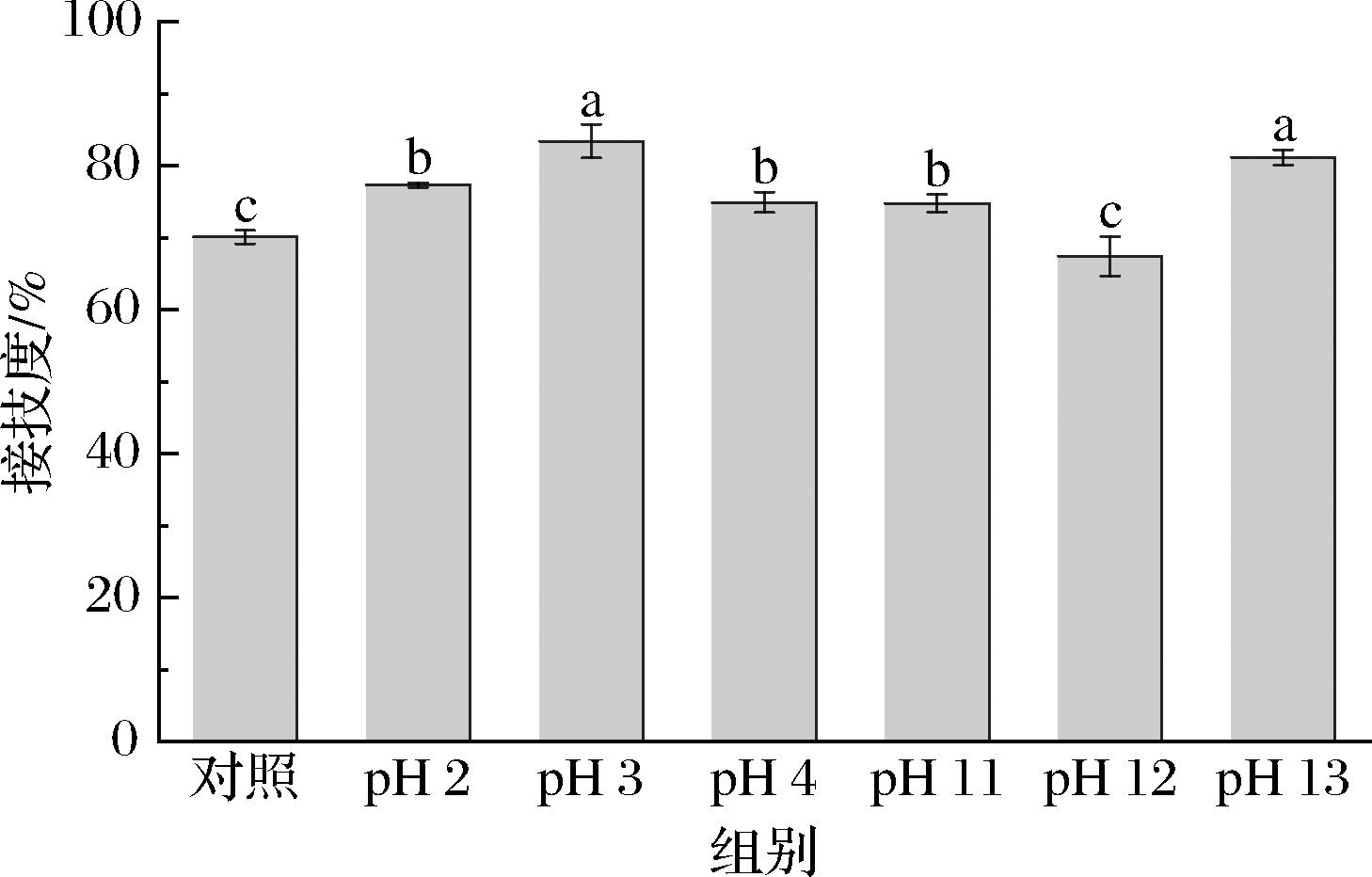
图1 不同pH值偏移处理对糖基化接枝度的影响
Fig.1 Effect of different pH shifts on glycosylation grafting
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.2 pH偏移对褐变指数的影响
糖缀合物在294 nm和420 nm处的吸光度值代表糖基化反应的中间产物和高级产物,也被广泛用作糖基化程度的指标。在图2中,对比单独糖基化处理,经pH 3、4、11、12偏移辅助处理后,A294和A420普遍得到升高(P<0.05),在pH值为11时取得最大值。但在pH 2和13偏移处理下,糖缀合物的褐变指数低于单独糖基化处理,这可能是EWP经pH 2、13处理后,去折叠程度较大,蛋白质结构伸展程度增大,反应初期与葡聚糖形成的缀合物发生聚集,限制中期反应和最终反应的进行,导致其褐变指数降低。此外,所有的糖缀合物420 nm处的吸光度值都低于在294 nm的吸光度值,这表明在糖基化反应过程中,反应中期更占优势。
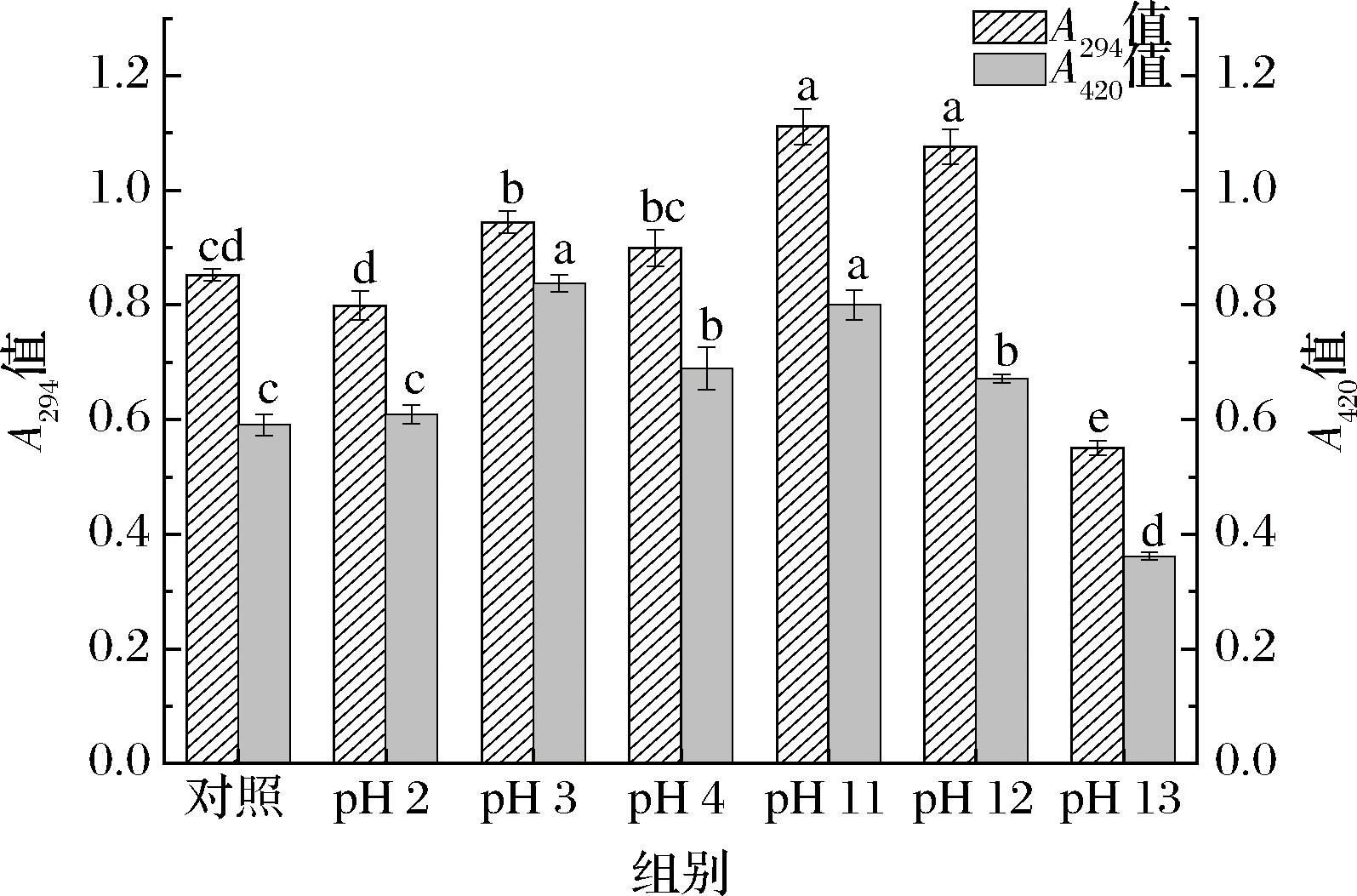
图2 不同pH值偏移处理对糖基化褐变指数的影响
Fig.2 Effect of different pH shifts on glycosylation browning index
2.3 pH偏移对糖基化产物分子质量的影响
采用SDS-PAGE分析糖基化反应过程中最终产物的分子质量变化。如图3所示,在凝胶的加载端可以观察到一些分子质量较高的条带,蛋白质分子质量的增加是糖缀合物形成的关键指示,表明蛋清蛋白与葡聚糖成功形成了糖缀合物。此外,糖缀合物的条带是高度扩散的,可能是一个蛋白质分子与多个葡聚糖的缀合物。pH 11和pH 12处理下的高分子质量条带颜色最深,说明形成了更多的糖缀合物,这与褐变指数的结果一致。同时75 kDa和45 kDa条带的变浅变窄,说明卵转铁蛋白和卵清蛋白参与了糖缀合物的形成。而14 kDa的条带消失,并且出现了更小分子质量的条带,可能是pH偏移处理使EWP的pH值远离等电点,溶菌酶发生解离生成小分子的肽。可以发现,pH偏移处理的条带与糖基化差异不大,说明pH偏移不会影响蛋清蛋白的一级结构。
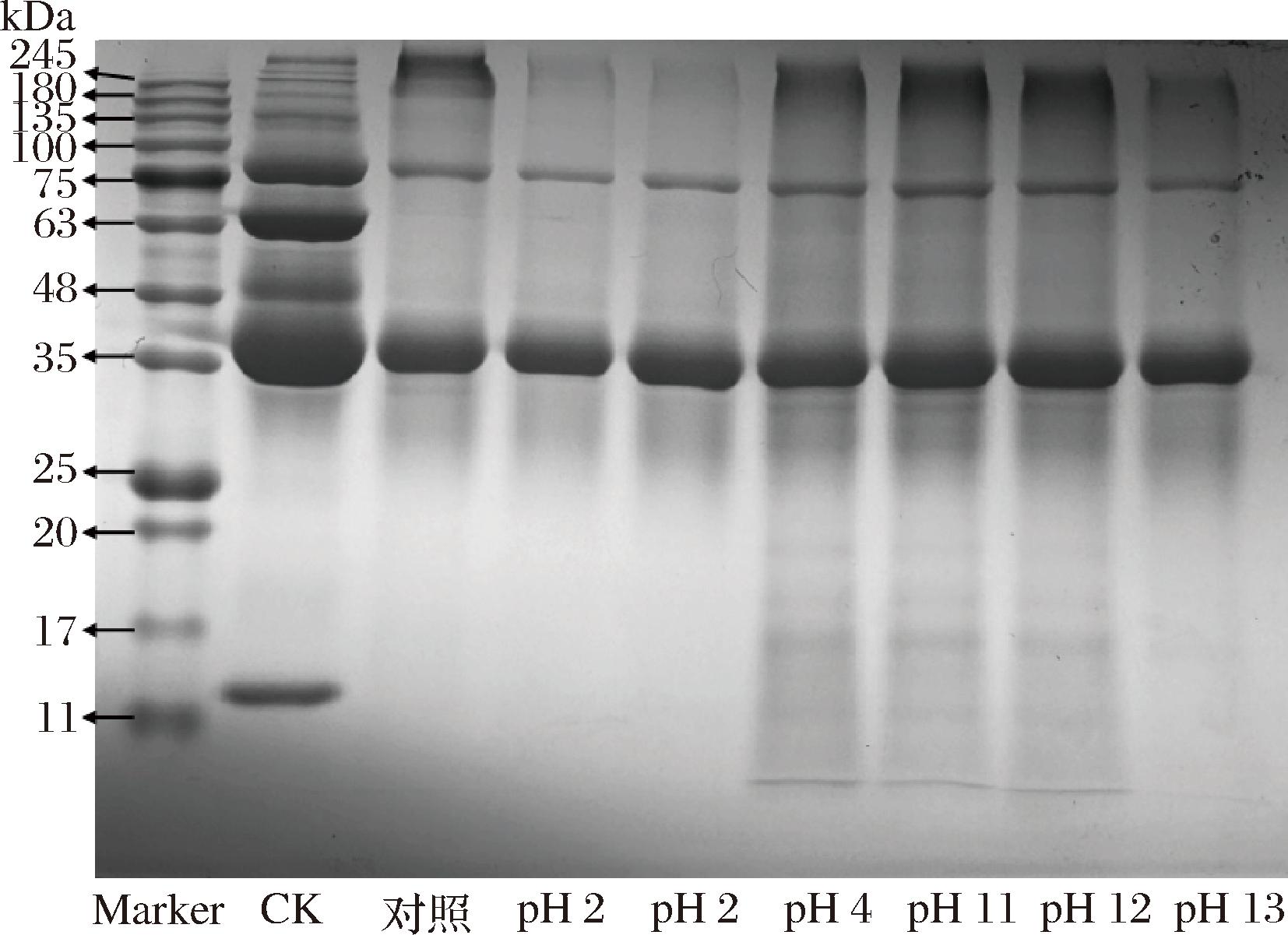
图3 不同pH值偏移后糖基化处理最终产物的分子质量变化
Fig.3 Changes in the molecular weight of the final product of glycosylation after different pH shifts
2.4 pH偏移对糖缀合物的傅里叶红外光谱的影响
FTIR光谱法是检测蛋白与多糖相互作用的有效技术,广泛用于反映糖基化蛋白的结构变化。在不同pH值偏移下获得糖缀合物的FTIR光谱如图4所示。所有糖缀合物在3 600~3 100 cm-1处的吸收峰值增加并发生红移,说明在糖基化过程中生成了O—H键。光谱图中的酰胺I带(1 600~1 700 cm-1)和酰胺Ⅱ带(1 480~1 575 cm-1)可以用于分析蛋白的二级结构,图中所有糖缀合物的酰胺I带吸收峰值(1 655 cm-1)和酰胺Ⅱ带吸收峰值(1 533 cm-1)出现蓝移和强度下降,这是糖基化反应过程中氨基的消耗导致。此外,1 200~950 cm-1代表C—N的反对称拉伸,实验组的吸收峰大于空白组,表明葡聚糖成功结合到蛋白质上;而经pH偏移处理的实验组吸收峰强度略大于对照组,并且吸收峰出现蓝移,说明产生了更多的糖缀合物,这与DG结果相对应。
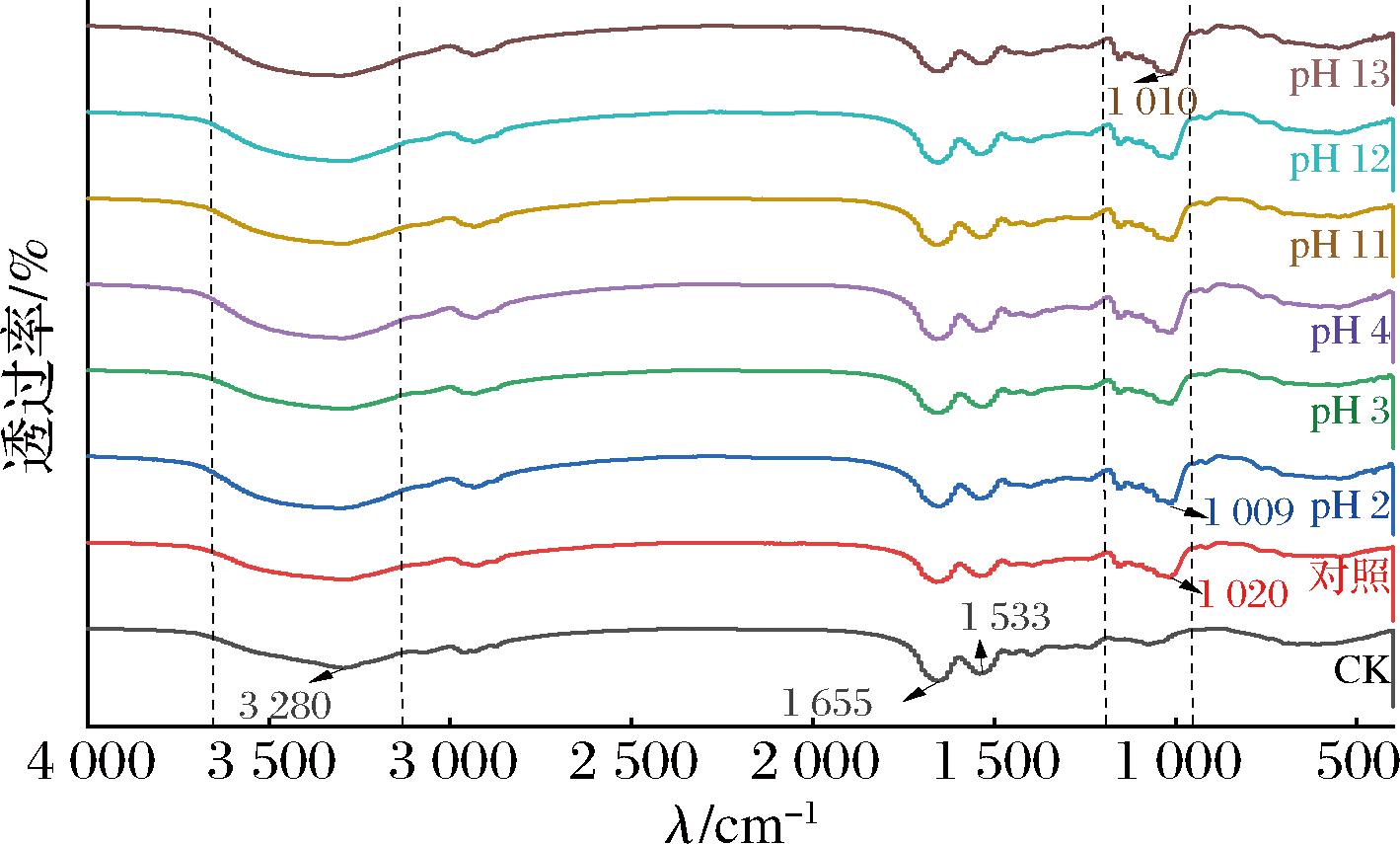
图4 不同pH偏移后糖基化处理的FTIR光谱
Fig.4 FTIR spectra of glycosylation after different pH shifts
2.5 pH偏移对糖基化产物的粒径与Zeta电位的影响
如图5-A所示,在强酸或强碱条件下蛋白质分子之间的静电排斥增加,经pH偏移后糖基化的平均粒径显著减小(P<0.05),pH 11处理下的平均粒径最小。此外,pH值为2、3、4偏移处理下的粒径逐渐降低;pH 11、12、13处理下的粒径逐渐升高,这可能是pH值越偏离等电点,蛋白质结构伸展程度逐渐增大,从而增大蛋白质表面积,在pH值调为中性过程中,易形成蛋白聚集体。
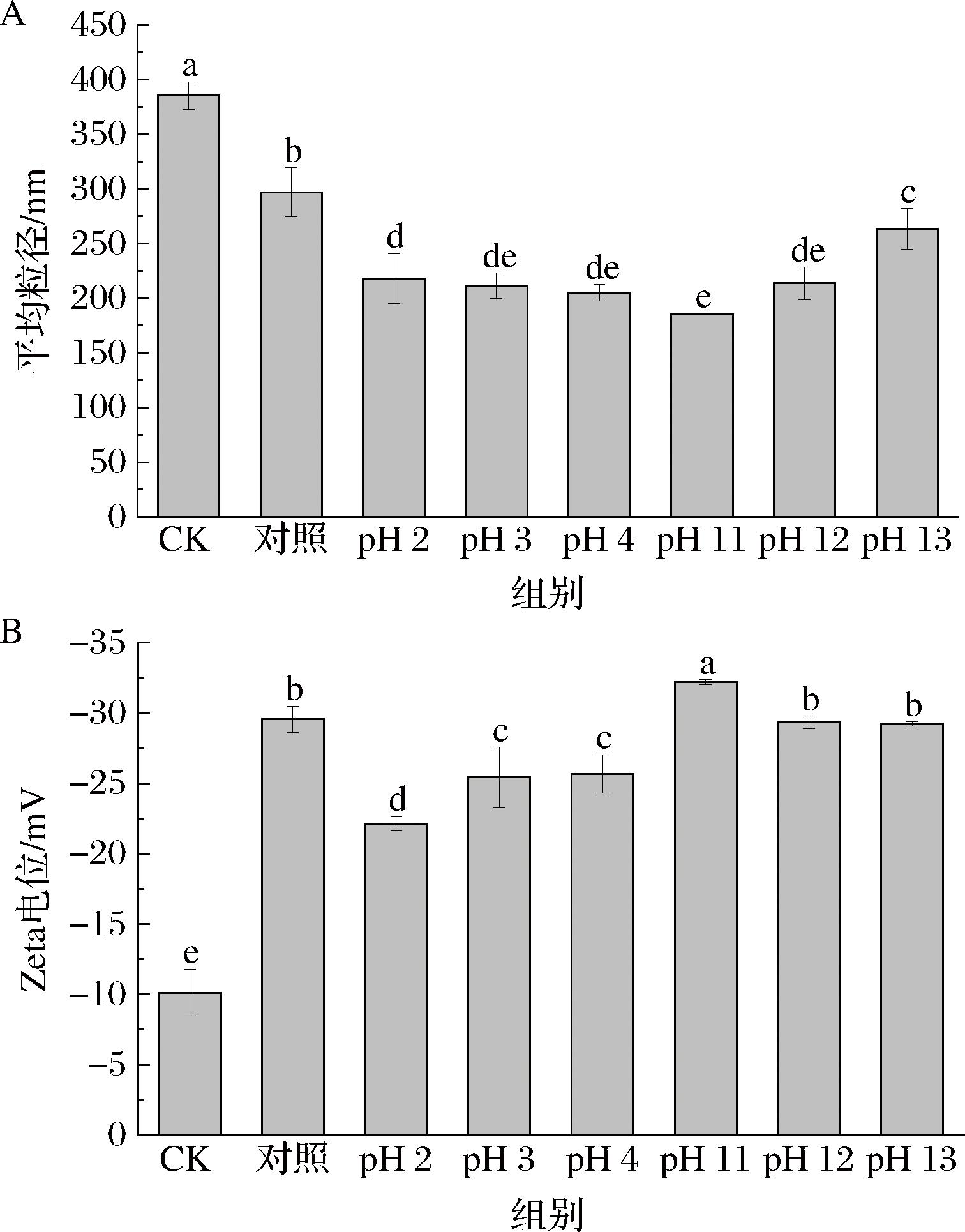
A-粒径;B-Zeta电位
图5 不同pH偏移后糖基化处理的粒径和Zeta电位变化
Fig.5 Changes in particle size and Zeta potential of glycosylation after different pH shifts
图5-B表示不同pH偏移后糖基化的Zeta电位变化。ζ-电位用于指示蛋白质表面携带的电荷,并反映蛋白质系统的稳定性,ζ-电位的变化表明蛋白质结构发生了变化,蛋白质表面暴露了不同数量的可电离基团[23]。与CK组(-10.127 mV)相比,糖基化后样品的ζ-电位显著增大(P<0.05),说明糖基化显著改变了蛋白质结构;pH偏移处理组中ζ-电位又发生显著变化(P<0.05),其中pH 11处理下的ζ-电位值最大(-32.2 mV),而酸处理下的ζ-电位值出现降低(P<0.05),这可能是氨基的质子化引起[24]。pH偏移处理中远离了蛋清蛋白的等电点(PI=4.5),负电荷的数量增加,分子间排斥力增大,增大蛋清蛋白的比表面积,电荷扩散到油水界面的速率越大,预防了分子间的聚集,这与pH偏移处理辅助糖基化形成更小的粒径结果一致。
2.6 pH偏移对游离巯基含量的影响
巯基与蛋白质的弱二级结构和三级结构的形成有关,因此游离巯基含量(free sulfhydryl,SH)可以反映蛋白质变性的程度,对蛋白质的功能特性至关重要[25]。如图6所示,发生糖基化反应后的SH含量均大于CK组(P<0.05),且在pH值为4、11、12、13的偏移处理后的SH含量比对照组显著增加(P<0.05),可能是pH偏移处理诱导了蛋白质去折叠和降解,蛋白质之间静电排斥增强,粒径减小,暴露蛋白质内部的巯基,或是破坏了蛋白质内的二硫键。pH 2、3偏移处理后比对照组的巯基含量低(P<0.05),可能是酸性pH接近蛋清蛋白的等电点,蛋白的溶解度降低,游离巯基被包埋在蛋白分子内部。此外,碱性偏移比酸性偏移处理更能有效地诱导EWP的构象变化。
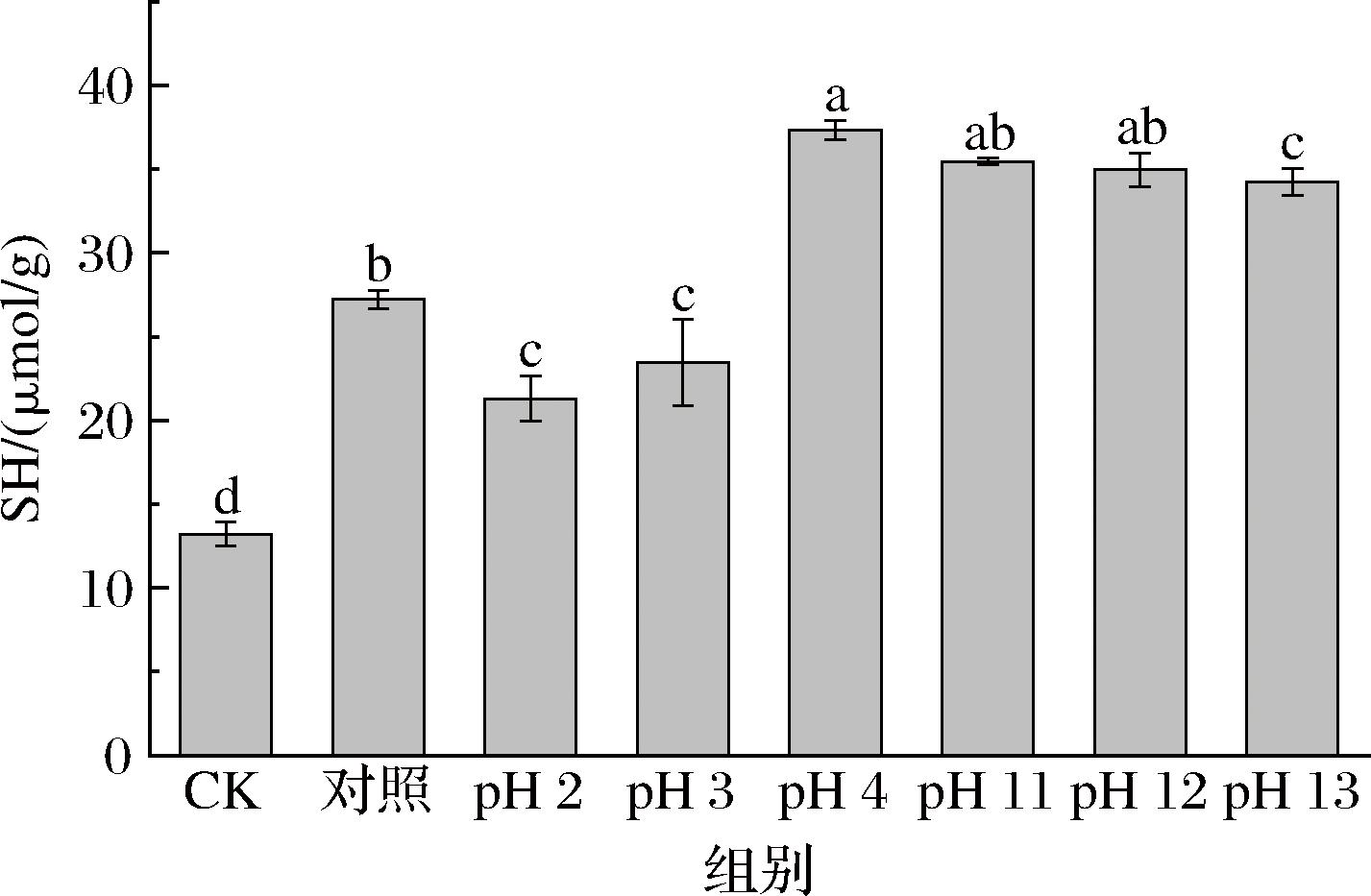
图6 不同pH偏移后糖基化处理的游离巯基含量变化
Fig.6 Changes in the content of free sulfhydryl groups in glycosylation after different pH shifts
2.7 pH偏移对表面疏水性的影响
表面疏水性(H0)是蛋白质的疏水基团与溶液中水的极性基团接触数量的指标,反映了蛋白质三级结构的变化[19]。图7中糖基化处理显著增加了EWP的表面疏水性(P<0.05),说明在糖基化过程中,蛋白质部分展开时暴露出疏水基团(包括芳香族氨基酸)。且pH 4、pH 11偏移处理后的表面疏水性明显比对照组大(P<0.05),这可能是pH偏移使蛋白质去折叠,蛋白分子侧链之间的相互作用被削弱,蛋白整体结构相对松散,疏水性氨基酸残基暴露于水溶液中,促进了与荧光探针(ANS)的结合。蛋白质的表面疏水性越高,糖缀合物更容易吸附在油滴表面,形成的乳液更加稳定。此外,经pH 2、3、12、13偏移处理后表面疏水性降低(P<0.05),可能是pH偏移程度大,形成了蛋白质聚集体。
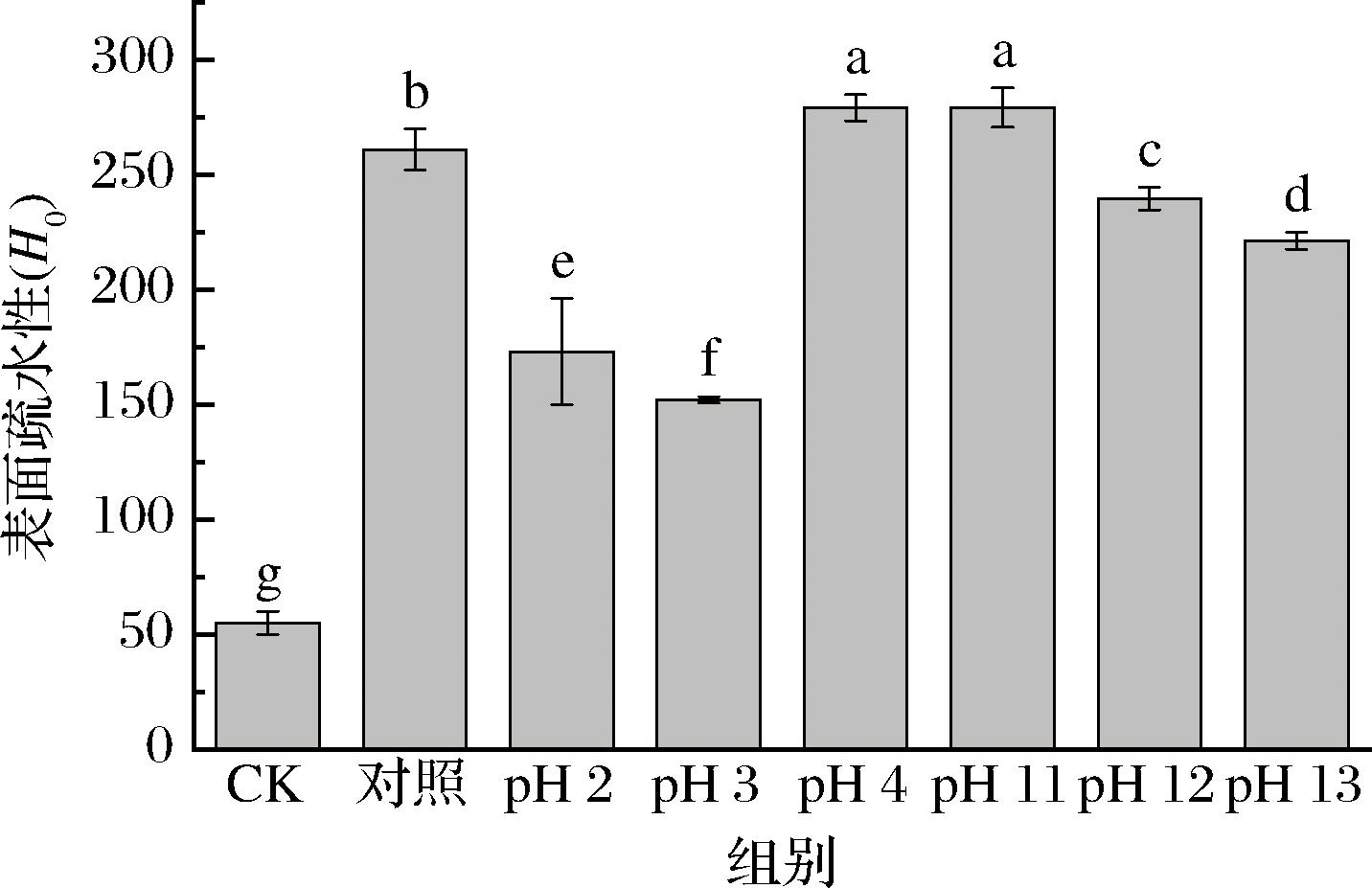
图7 不同pH偏移后糖基化处理的表面疏水性变化
Fig.7 Changes in surface hydrophobicity of glycosylation after different pH shifts
2.8 pH偏移后糖基化对蛋清液乳化性的影响
EAI和ESI是反应乳化性能的2个典型指标,EAI表示蛋白质在水-油界面吸附的能力,ESI表示蛋白质在乳液形成后保留在油-水界面的能力[24]。由图8可知,与CK组相比,单独糖基化处理和pH偏移的糖缀合物乳化性都得到了显著提高(P<0.05),这主要是糖缀合物的共价界面键合力比非共价产物更紧密,有助于糖缀合物在油滴周围形成更坚固、具有黏弹性的多层膜,防止出现絮凝和油滴合并。此外,pH 4、11、12偏移处理的EAI和ESI值比对照组显著增大(P<0.05),且pH 11偏移的ESI(38.603 min)和EAI(14.426 m2/g)最大,其ESI比空白组(12.925 min)和对照组(23.538 min)分别提升了66.52%、39.03%。因此,pH偏移的去折叠作用使蛋白质的结构变得松散且无序,更利于EWP与葡聚糖发生接枝反应,接枝度增大,形成的糖缀合物增多,界面键合力增强、ζ-电位增大、暴露出更多的疏水基团和游离巯基;粒径减小,增大比表面积,从而增强了蛋白质部分在界面处的结合能力,产生更强的界面膜和更黏稠的环境,以防止在不稳定条件下乳液发生絮凝。
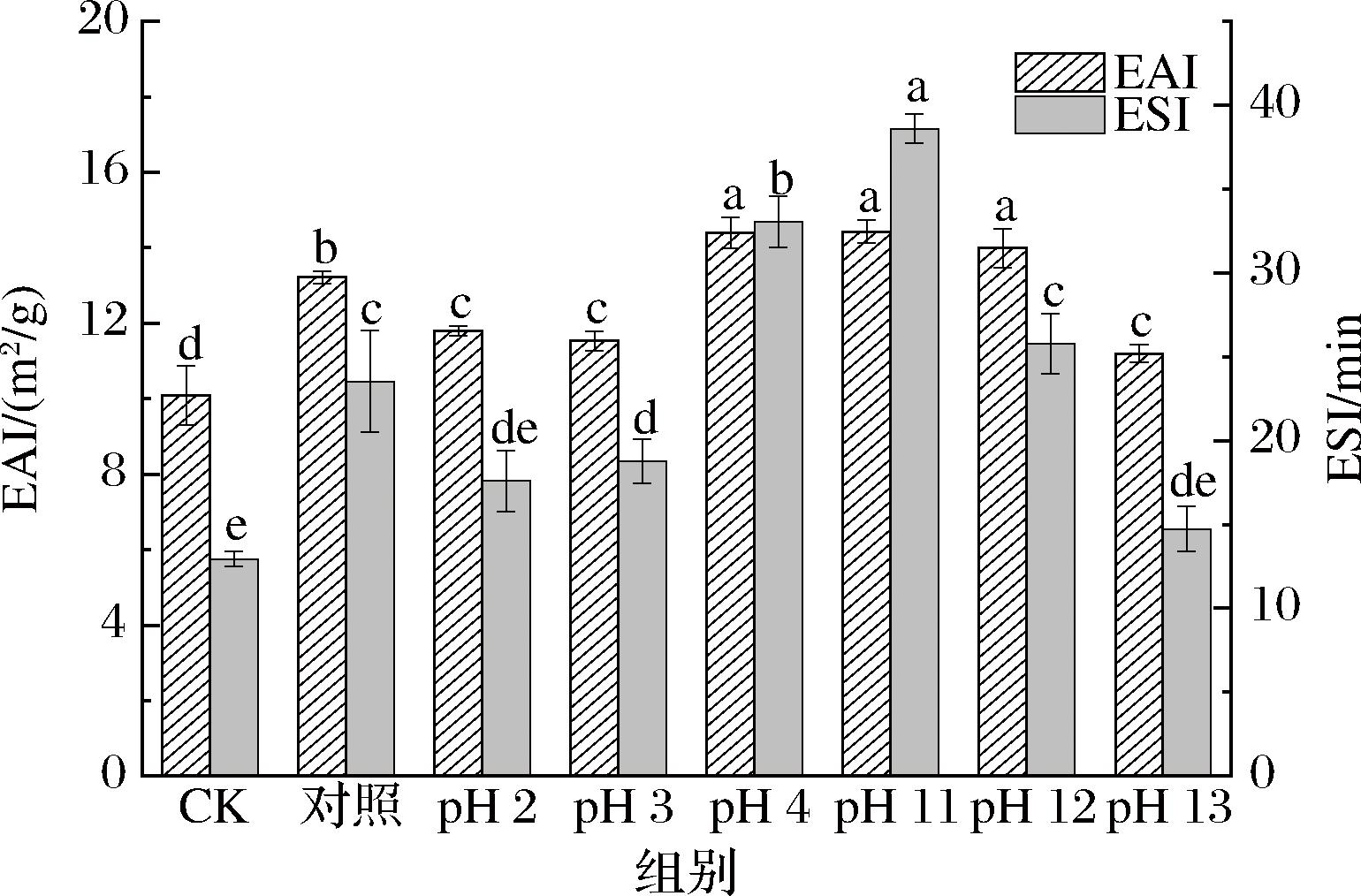
图8 不同pH偏移后糖基化处理的EAI和ESI值变化
Fig.8 Changes in EAI and ESI values of glycosylation after different pH shifts
3 结论
pH偏移可诱导蛋白分子的结构展开和构象转变,促进糖基化反应进行,提高糖基化反应程度。pH偏移的去折叠作用能暴露出更多疏水基团和巯基,减小粒径,提高糖缀合物的乳化性能。此外,强酸性pH 2、3偏移处理会降低EWP的ζ-电位,分子间静电斥力减小,蛋白易发生聚集,从而阻碍巯基和疏水基团暴露,降低乳液的乳化活性和乳化稳定性。而pH 11辅助处理下,蛋清蛋白的ζ-电位最大,粒径最小,具有较高的表面疏水性、糖缀合物在油水界面具有更强的吸附性,形成乳液的界面膜更为牢固,表现出更好的乳液稳定性。因此,通过对EWP进行适当的pH偏移处理来辅助糖基化获得的糖缀合物将在乳液液滴之间提供更高的能量势垒,更大的静电排斥力,从而显著提高EWP在食品工业应用中的乳化稳定性。
[1] 徐桂云. 鸡蛋品质及营养价值的新认识[J].中国家禽, 2012, 34(13):36-38.XU G Y.New insights into the quality and nutritional value of eggs[J].China Poultry, 2012, 34(13):36-38.
[2] ZHANG M Q, LI J H, SU Y J, et al.Preparation and characterization of hen egg proteins-soybean protein isolate composite gels[J].Food Hydrocolloids, 2019, 97:105191.
[3] WANG C Y, LI J H, LI X, et al.Molecular forces and gelling properties of heat-induced gel from egg white protein glycated with isomalto-oligosaccharide[J].Food Hydrocolloids, 2020, 99:105356.
[4] ALAVI F, CHEN L Y, EMAM-DJOMEH Z.Structuring of acidic oil-in-water emulsions by controlled aggregation of nanofibrillated egg white protein in the aqueous phase using sodium hexametaphosphate[J].Food Hydrocolloids, 2021, 112:106359.
[5] WANG C Y, LI J H, LI X, et al.Emulsifying properties of glycation or glycation-heat modified egg white protein[J].Food Research International, 2019, 119:227-235.
[6] TAGHAVI F, HABIBI-REZAEI M, AMANI M, et al.The status of glycation in protein aggregation[J].International Journal of Biological Macromolecules, 2017, 100:67-74.
[7] KUTZLI I, WEISS J, GIBIS M.Glycation of plant proteins via Maillard reaction:Reaction chemistry, technofunctional properties, and potential food application[J].Foods, 2021, 10(2):376.
[8] AI M M, XIAO N, JIANG A M.Molecular structural modification of duck egg white protein conjugates with monosaccharides for improving emulsifying capacity[J].Food Hydrocolloids, 2021, 111:106271.
[9] NIU F G, ZHOU J Z, NIU D B, et al.Synergistic effects of ovalbumin/gum arabic complexes on the stability of emulsions exposed to environmental stress[J].Food Hydrocolloids, 2015, 47:14-20.
[10] JIANG W, WANG Y Y, MA C C, et al.Pea protein isolate-inulin conjugates prepared by pH-shift treatment and ultrasonic-enhanced glycosylation:Structural and functional properties[J].Food Chemistry, 2022, 384:132511.
[11] ![]() D E, DICHANO M C, FERRARI S B, et al.Combination of pH-shifting, ultrasound, and heat treatments to enhance solubility and emulsifying stability of rice protein isolate[J].Food Chemistry, 2024, 433:137319.
D E, DICHANO M C, FERRARI S B, et al.Combination of pH-shifting, ultrasound, and heat treatments to enhance solubility and emulsifying stability of rice protein isolate[J].Food Chemistry, 2024, 433:137319.
[12] SHEN Q, DAI H M, WEN L M, et al.Effects of pH-shifting treatments on the emulsifying properties of rice protein isolates:Quantitative analysis of interfacial protein layer[J].Food Research International, 2023, 164:112306.
[13] LI J G, WU M M, WANG Y T, et al.Effect of pH-shifting treatment on structural and heat induced gel properties of peanut protein isolate[J].Food Chemistry, 2020, 325:126921.
[14] YU Y L, GUAN Y, LIU J B, et al.Molecular structural modification of egg white protein by pH-shifting for improving emulsifying capacity and stability[J].Food Hydrocolloids, 2021, 121:107071.
[15] SUN J, MU Y Y, MOHAMMED O, et al.Effects of single-mode microwave heating and dextran conjugation on the structure and functionality of ovalbumin-dextran conjugates[J].Food Research International, 2020, 137:109468.
[16] SETIOWATI A D, RWIGAMBA A, VAN DER MEEREN P.The influence of degree of methoxylation on the emulsifying and heat stabilizing activity of whey protein-pectin conjugates[J].Food Hydrocolloids, 2019, 96:54-64.
[17] PANOZZO A, MANZOCCO L, CALLIGARIS S, et al.Effect of high pressure homogenisation on microbial inactivation, protein structure and functionality of egg white[J].Food Research International, 2014, 62:718-725.
[18] CHEN X, DAI Y J, HUANG Z, et al.Effect of ultrasound on the glycosylation reaction of pea protein isolate-arabinose:Structure and emulsifying properties[J].Ultrasonics Sonochemistry, 2022, 89:106157.
[19] 刘俊锋, 樊睿, 魏海燕, 等.超声波结合磷酸化改性对蛋清凝胶特性的影响[J].食品与发酵工业, 2023, 49(9):201-206.LIU J F, FAN R, WEI H Y, et al.Effect of ultrasound combined with phosphorylation modification on properties of egg white gel[J].Food and Fermentation Industries, 2023, 49(9):201-206.
[20] ZHAO Y, CHEN Z Y, LI J K, et al.Formation mechanism of ovalbumin gel induced by alkali[J].Food Hydrocolloids, 2016, 61:390-398.
[21] 叶钰, 高金燕, 陈红兵, 等.超声波加工对蛋清蛋白质结构和凝胶特性的影响[J].食品科学, 2018, 39(21):45-52.YE Y, GAO J Y, CHEN H B, et al.Effect of ultrasonic processing on protein structure and gel properties of egg white[J].Food Science, 2018, 39(21):45-52.
[22] LI S G, HUANG Y, AN F P, et al.Hydroxyl radical-induced early stage oxidation improves the foaming and emulsifying properties of ovalbumin [J].Poultry Science, 2019, 98(2):1047-1054.
[23] ZHANG W W, LIU C Q, ZHAO J, et al.Modification of structure and functionalities of Ginkgo seed proteins by pH-shifting treatment[J].Food Chemistry, 2021, 358:129862.
[24] DONG W Y, ZHANG X Y, DING L X, et al.Enhancement of emulsification properties by modulation of egg white protein fibril structure with different heating times[J].Food Hydrocolloids, 2023, 135:108203.
[25] CAO H W, SUN R L, SHI J R, et al.Effect of ultrasonic on the structure and quality characteristics of quinoa protein oxidation aggregates[J].Ultrasonics Sonochemistry, 2021, 77:105685.