酪氨酸酶(tyrosinase)又称多酚氧化酶,广泛存在于动植物、微生物和人体中的含铜氧化还原酶[1],是黑色素生成的主限速酶[2]。黑色素的过度产生会导致审美问题以及色素沉着引发的皮肤病问题,如雀斑、黄褐斑、老年斑以及皮肤癌[3- 4],抑制酪氨酸酶活力是减少黑色素生成的主要策略之一。市面上大多数皮肤美白剂都属于天然或合成酪氨酸抑制剂,如对苯二酚、熊果苷、曲酸、视黄酸、抗坏血酸等,这些美白剂会造成一定的副作用[5-6],因此开发天然高效酪氨酸抑制剂用于化妆品美白添加剂并且明确其抑制机理有重要意义。
研究者在天然的酚类化合物中发现了大量酪氨酸酶抑制剂[5]。花色苷作为一种天然多酚类化合物,因其多种生物活性而被广泛关注,其中包括对酪氨酸酶活力的抑制作用,彭赛男[7]研究发现桑椹中花色苷类具有抑制酪氨酸酶的活性,质量浓度为0.25 mg/mL时,其抑制活性强于阳性对照曲酸,但花色苷类的单一化合物抑制酪氨酸酶的作用机制尚不明确。据报道桑椹中花色苷含量最多的单体是矢车菊素-3-O-葡萄糖苷(cyanidin-3-O-glucoside,C3G)[8],其苷元形式矢车菊素(cyanidin,Cy)也是多酚类的重要活性成分。因此本实验进一步研究了C3G和Cy对酪氨酸酶的抑制与互作机理并且比较了两者的抑制作用。主要从酶动力学、紫外光谱分析、傅立叶红外光谱(Fourier transform infrared spectroscopy,FT-IR)、荧光光谱分析、圆二色(circular dichroism,CD)光谱测量全面研究并比较了C3G和Cy对酪氨酸酶的相互作用,同时结合分子对接实验进行验证补充,从分子水平综合分析C3G和Cy对酪氨酸酶的抑制机理,为开发天然美白添加剂的化妆品提供新的研究思路。
1 材料与方法
1.1 材料与试剂
矢车菊素-3-O-葡萄糖苷(CAS:7084-24-4,HPLC≥95%)、氯化矢车菊素(CAS:528-58-5,HPLC≥98%),上海源叶生物科技有限公司;酪氨酸酶(CAS:9002-10-2,1 100 U/mg)、曲酸(CAS:501-30-4,Purity≥98%)、左旋多巴(CAS:59-92-7),索莱宝公司;PBS磷酸缓冲盐溶液(pH 6.8)、乙腈(分析纯,批号:20230801)、甲醇(分析纯,批号:20230801),天津市大茂化学试剂厂。
1.2 仪器与设备
Multiskan GO全波长酶标仪,Thermo Fisher公司;UV 2700紫外-可见分光光度计、Prestige 21红外光谱仪,日本岛津公司;RF 6000荧光分光光度计,株式会社岛津制作所;Chirascan圆二色光谱仪,英国应用光物理公司;LE104E电子天平,梅特勒-托利多仪器(上海)有限公司。
1.3 实验方法
1.3.1 酪氨酸酶活性抑制试验
参照LIU等[9]的方法,反应在96孔板中进行,依次加PBS缓冲液(pH 6.8)、不同浓度的样品溶液和50 U/mL酪氨酸酶溶液,充分混合。放置在恒温培养箱中,37 ℃孵育10 min后,加入底物0.75 mmol/L左旋多巴溶液,37 ℃孵育20 min。最后加入乙腈终止反应,同时以相同浓度的曲酸对照品溶液作为阳性对照,以相同体积PBS为阴性空白对照。用酶标仪在475 nm处测定光密度OD值。测得化合物的抑制作用以IC50值表示,IC50值表示抑制50%酶活力所对应的样品浓度。酪氨酸酶抑制率由公式(1)计算:
抑制率![]()
(1)
式中:A1,对照溶液OD值;A2,对照空白溶液OD值;A3,样品溶液OD值;A4,样品空白溶液OD值。
1.3.2 酪氨酸酶抑制动力学分析
固定底物左旋多巴浓度为0.75 mmol/L,取不同浓度的C3G和Cy(0、120、360、720 μmol/L),加入到不同浓度的酪氨酸酶溶液(5、10、20、30、40、50 U/mL)中进行反应,以酶的浓度为横坐标,反应初速度为纵坐标作图,判断C3G和Cy对酪氨酸酶的抑制作用是否可逆。固定酪氨酸酶浓度为50 U/mL,改变C3G和Cy的浓度(120、360、720 μmol/L),加入到不同浓度的左旋多巴(0.25、0.5、0.75、1.0、1.25、1.5 mmol/L)中进行反应。根据Lineweaver-Burk双倒数法,以左旋多巴浓度的倒数为横坐标,反应初速率的倒数为纵坐标作图,判断C3G、Cy对酪氨酸酶抑制类型。C3G、Cy抑制酪氨酸酶的动力学参数通过Lineweaver-Burk方程计算,如公式(2)所示:
(2)
式中:Vmax:最大反应速率,mol/(L·s);Km:米氏常数;[I]:样品的浓度,mol/L;[S]:底物浓度,mol/L;Kic:抑制剂与酶的解离常数;Kiu:抑制剂与酶和底物复合物的解离常数。
1.3.3 紫外光谱分析
参照HUANG等[10]的方法。取500 μL浓度为120 μmol/L的C3G和Cy溶液,分别加入500 μL浓度为200 U/mL的酪氨酸酶,混匀。在室温下放置30 min后,在200~600 nm波长范围扫描酪氨酸酶溶液、C3G和Cy溶液、C3G-酪氨酸酶和Cy-酪氨酸酶混合溶液的吸收光谱,分析紫外吸收光谱的差异。
1.3.4 红外光谱分析
参照HAN等[11]方法,采用红外光谱仪在室温下检测酪氨酸酶(50 U/mL)、C3G-酪氨酸酶和Cy-酪氨酸酶样品的红外光谱。C3G或Cy终浓度均为120 μmol/L。在2 500~500 cm-1扫描样品。
1.3.5 圆二色谱分析
参考LIU等[12]方法,在1 mL EP管中分别添加500 U/mL酪氨酸酶溶液200 μL,不同浓度C3G、Cy(0、120、240 μmol/L)溶液200 μL,摇匀,将混合液在37 ℃下放置30 min。使用圆二色谱光谱仪,扫描速度为60 nm/min,扫描范围为190~260 nm,进行扫描,将PBS作为空白,扫描结果扣去空白即得圆二色谱数据,在Dichroweb(http://dichroweb.cryst.bbk.ac.uk/html/home.shtml)在线分析软件中计算酪氨酸酶二级结构的含量变化。
1.3.6 荧光光谱猝灭分析
参照LI等[13]的方法。在1 mL EP管中分别添加200 μL浓度为50 U/mL酪氨酸酶溶液(pH 6.8 PBS缓冲液配制),200 μL不同浓度(0、30、60、120、180、240、300、360 μmol/L)C3G、Cy溶液,摇匀,将混合液放置在水浴锅中37 ℃下反应30 min,测定荧光强度。设定激发波长为280 nm,发射光波长290~450 nm,激发狭缝和发射狭缝均为5.0 nm,扫描速率为2 000 nm/min,记录荧光光谱。荧光猝灭率(η)用公式(3)计算:
(3)
式中:F0代表单纯酪氨酸酶的荧光强度,F代表加入不同浓度C3G/Cy后酪氨酸酶的荧光强度。
通过Stern-Volmer方程,计算和判断荧光猝灭属于静态猝灭还是动态猝灭,如公式(4)所示:
(4)
式中:F0和F分别为单纯酪氨酸酶和加入不同浓度C3G/Cy后的酪氨酸酶荧光强度;KSV:Stern-Volmer猝灭常数;Kq,分子猝灭速率常数;τ0,荧光团寿命,一般为1×10-8s;[Q],样品的浓度,mol/L。
1.3.7 同步荧光光谱分析
参照1.3.6节溶液配制方法,将混合液在水浴锅中37 ℃下反应30 min,分别设置Δλ(激发波长与发射波长的距离)=15 nm或60 nm,在激发光波长为260~400 nm进行扫描,狭缝宽度为5 nm,扫描速率为2 000 nm/min,记录同步荧光光谱。
1.3.8 三维荧光光谱分析
参照1.3.6节溶液配制方法,在激发波长和发射波长分别为200~540 nm、200~600 nm,狭缝宽度为5 nm,测定不同浓度的C3G和Cy与酪氨酸酶反应后的三维荧光光谱。
1.3.9 分子对接模拟
酪氨酸酶(PDB编号:2Y9X)的3D结构从RCSB PDB(https://www.rcsb.org)数据库中下载[14]。使用Pymol对酪氨酸酶的结构进行A链保留处理。在PubChem(https://pubchem.ncbi.nlm.nih.gov)数据库中下载C3G、Cy的3D结构(C3G编号:197081;Cy编号:128861)。用AutoDockTools(Ver 1.5.6)软件将酪氨酸酶进行去水、加氢处理,将其选为受体;同时将C3G/Cy进行加氢处理,将其选为配体,进行分子对接模拟,选择BOX覆盖所有位点,设置对接次数为50次,以最低结合能为最优对接构型。最后使用Discovery Studio和Pymol软件对分子对接结果进行分析并作图。
2 结果与分析
2.1 酪氨酸酶的抑制作用
C3G和Cy对酪氨酸酶的抑制能力可以用半数抑制浓度(IC50)来进行比较,如图2所示,C3G和Cy在一定浓度范围内均对酪氨酸酶有着明显的抑制作用,并且随着C3G和Cy浓度升高,对酪氨酸酶的抑制作用逐渐增强。C3G的IC50为(124.8±3.1) μmol/L,Cy的IC50为(278.1±2.2) μmol/L,明显强于阳性对照曲酸[IC50=(536.4±3.4) μmol/L],结果表明C3G和Cy都是有效的酪氨酸酶抑制剂,且C3G的抑制作用比Cy强2倍。
2.2 酶促反应动力学分析
C3G和Cy的酶促反应动力学如图3所示。固定底物左旋多巴的浓度,改变酪氨酸酶浓度时,分别绘制了不同浓度C3G和Cy的反应初速率与酪氨酸酶不同浓度的曲线图。所得直线均经过原点,并且随着C3G和Cy浓度的升高,酶的反应速率比酶浓度直线的斜率逐渐下降,说明C3G和Cy均能降低酪氨酸酶催化底物生成多巴色素的速率,但又不能使酪氨酸酶完全失活,因此推测C3G和Cy对酪氨酸酶均是可逆性抑制[15]。
当酪氨酸酶浓度固定,改变左旋多巴底物浓度时,C3G的Lineweaver-Burk 双倒数曲线图交叉点在Y轴处,这说明C3G对酪氨酸酶的抑制作用为竞争性抑制。Cy的Lineweaver-Burk 双倒数曲线图交叉点在第三象限,表明Cy对酪氨酸酶为反竞争性和非竞争性抑制的混合,这与陈荣达[16]研究结果一致。
2.3 紫外光谱分析
C3G和Cy与酪氨酸酶反应后紫外光谱如图4所示,曲线a为C3G和Cy与酪氨酸酶反应后的紫外吸收光谱。曲线c是单纯酪氨酸酶的光谱图,结果显示在276 nm波长处有最大吸收,该处特征峰能反映酪氨酸酶内部色氨酸和酪氨酸残基结构含量变化,同时反映酪氨酸酶结构中的荧光基团的紫外吸收[17],加入C3G和Cy后,最大吸收波长从276 nm红移到了283 nm,吸收峰的强度也明显增强,而扣除C3G/Cy为背景的光谱图(曲线d)显示酪氨酸酶在276 nm处的紫外吸收峰强度降低,且曲线d和曲线c没有重合,表明加入相同浓度的C3G和Cy与酪氨酸酶结合后形成了新的化合物,从而导致酶的构象发生了改变[16]。
2.4 红外光谱分析
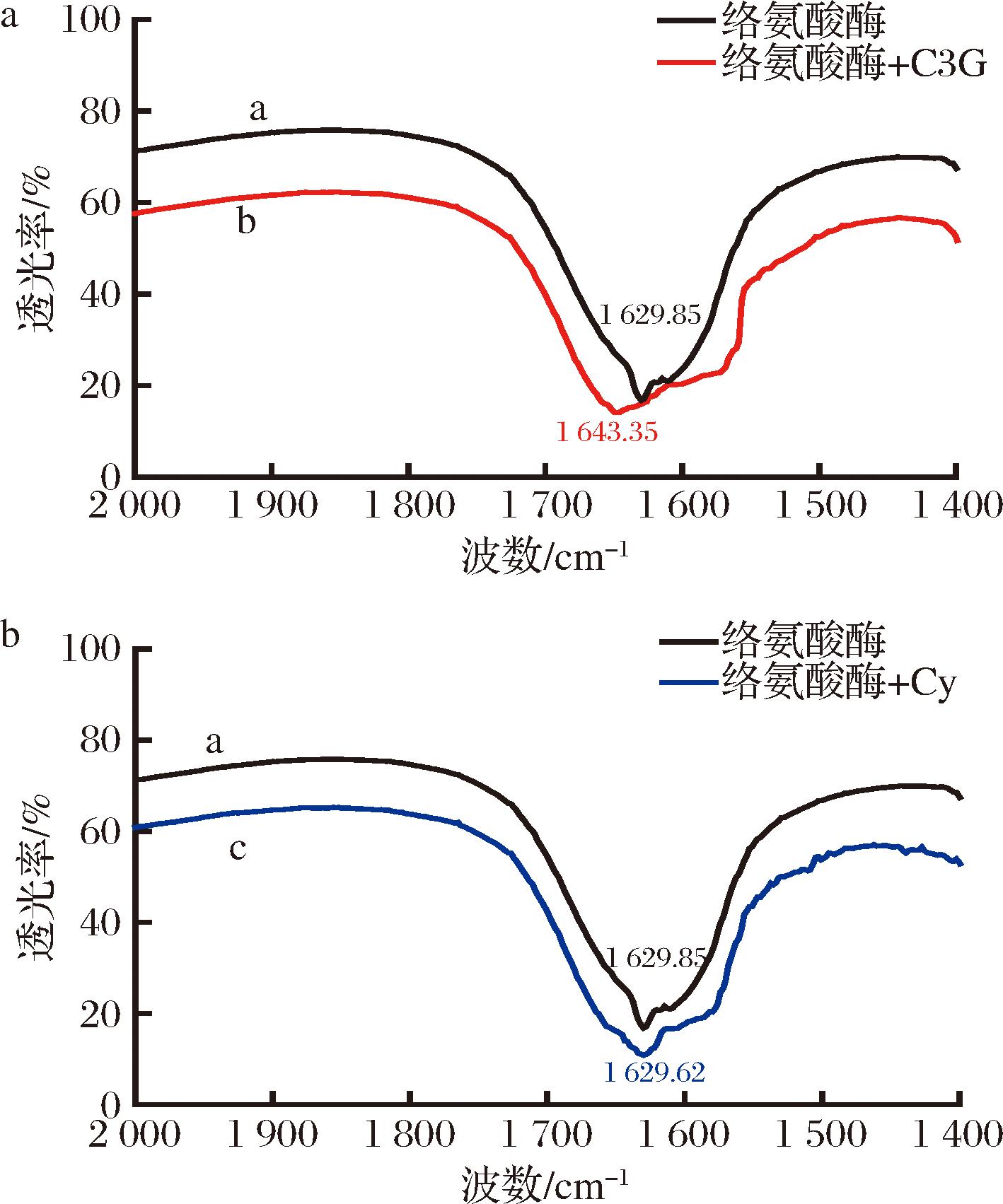
从FT-IR光谱中,可以观察到蛋白质结构中N—H拉伸振动(3 300~2 070 cm-1),酰胺Ⅰ带(1 700~1 600 cm-1),酰胺Ⅱ带(1 550 cm-1)和酰胺Ⅲ带(1 400~1 200 cm-1)的特征峰[18]。文献报道,酰胺Ⅰ带(C![]() O伸缩振动)对蛋白质二级结构的变化比其他键更敏感[19],因此,使用红外光谱仪测定了样品的酰胺 Ⅰ 带的特征峰。如图5所示,酪氨酸酶、C3G-酪氨酸酶混合物、Cy-酪氨酸酶混合物的酰胺Ⅰ带的特征峰分别出现在1 629.85 nm(酪氨酸酶)、1 643.35 nm(C3G-酪氨酸酶)和1 629.62 nm(Cy-酪氨酸酶)处。数据显示,在酪氨酸酶溶液中加入C3G后,酰胺Ⅰ带的吸收峰的波长发生了红移,表明C3G与酪氨酸酶中的酰胺Ⅰ带相互作用,导致多肽羰基氢键发生了重排[12]。然而,加入Cy后的酪氨酸酶溶液,酰胺Ⅰ带的吸收峰的波长没有发生明显偏移。结果说明,Cy对酪氨酸酶中酰胺Ⅰ带影响低于C3G。
O伸缩振动)对蛋白质二级结构的变化比其他键更敏感[19],因此,使用红外光谱仪测定了样品的酰胺 Ⅰ 带的特征峰。如图5所示,酪氨酸酶、C3G-酪氨酸酶混合物、Cy-酪氨酸酶混合物的酰胺Ⅰ带的特征峰分别出现在1 629.85 nm(酪氨酸酶)、1 643.35 nm(C3G-酪氨酸酶)和1 629.62 nm(Cy-酪氨酸酶)处。数据显示,在酪氨酸酶溶液中加入C3G后,酰胺Ⅰ带的吸收峰的波长发生了红移,表明C3G与酪氨酸酶中的酰胺Ⅰ带相互作用,导致多肽羰基氢键发生了重排[12]。然而,加入Cy后的酪氨酸酶溶液,酰胺Ⅰ带的吸收峰的波长没有发生明显偏移。结果说明,Cy对酪氨酸酶中酰胺Ⅰ带影响低于C3G。
2.5 圆二色光谱分析
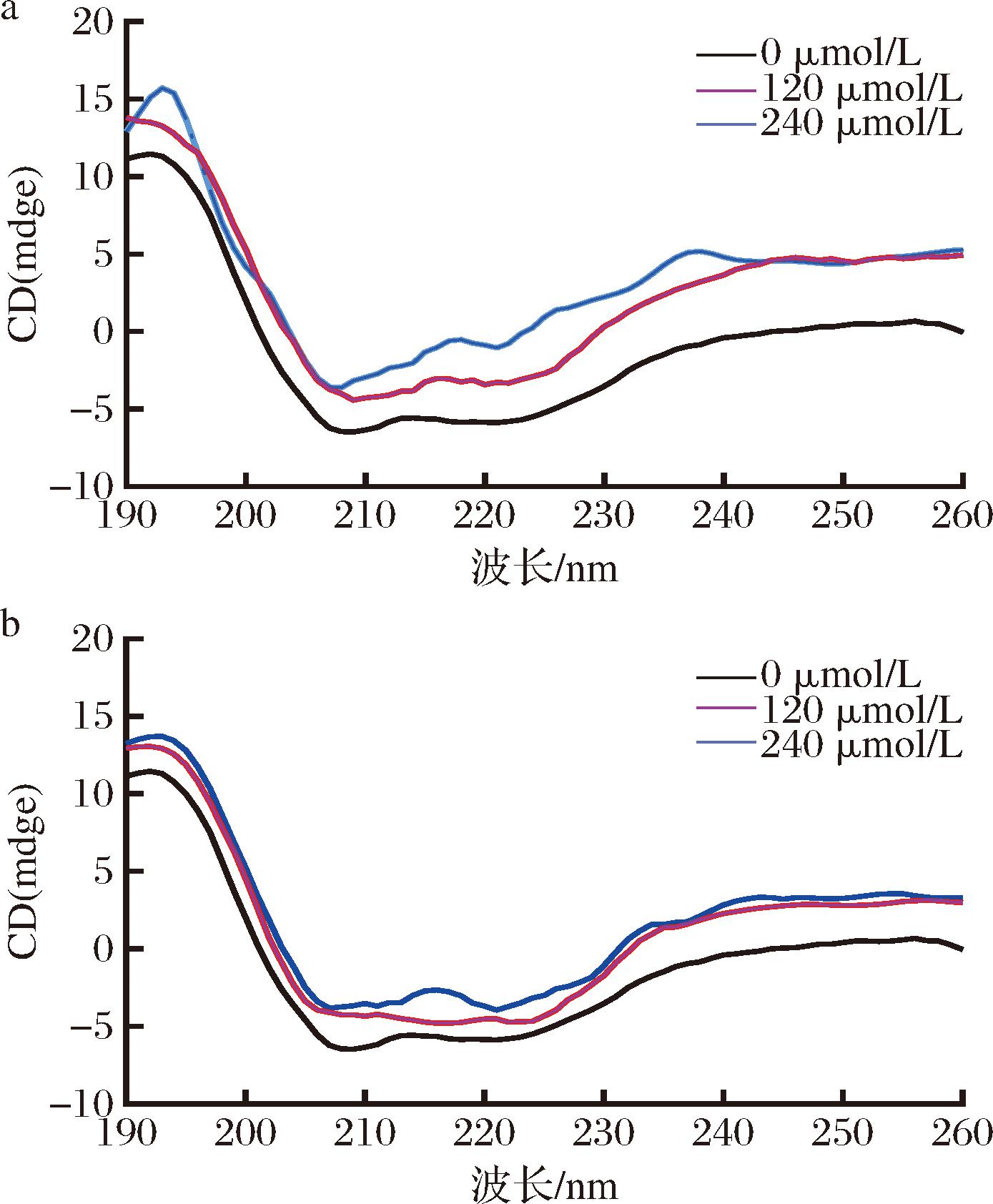
圆二色光谱可以用于检测酪氨酸酶的二级结构的变化。酪氨酸酶在208 nm和220 nm处有两条负带,是α-螺旋偏振峰,表明酪氨酸酶的α-螺旋结构来源于酰胺基团的π-π*和n-π*跃迁[20]。C3G和Cy与酪氨酸酶的圆二色光谱如图6所示。加入C3G后酪氨酸酶的α-螺旋含量降低(57.9%到30.7%),β-折叠含量增加(2.7%到17.1%),β-转角含量降低(14.4%到0%),无规则卷曲结构含量增加(25.1%到52.1%)。加入Cy后酪氨酸酶的α-螺旋含量降低(57.9%到33.8%),β-折叠含量增加(2.7%到49.3%),β-转角含量降低(14.4%到0%),无规则卷曲结构含量降低(25.1%到16.9%)(表1)。上述结果表明,C3G、Cy与酪氨酸酶的结合破坏酶原有氢键网络,导致α-螺旋结构的丢失,从而诱导酪氨酸酶构象的改变,进而抑制了酶的活力[21]。结果还显示出C3G和Cy的加入对酪氨酸酶的二级结构影响程度有明显差异,这可能是C3G比Cy化学结构中多一个葡萄糖所致。
表1 酪氨酸酶与C3G/Cy作用前后二级结构的含量 单位:%
Table 1 Contents of secondary structures before and after tyrosinase interaction with C3G and Cy
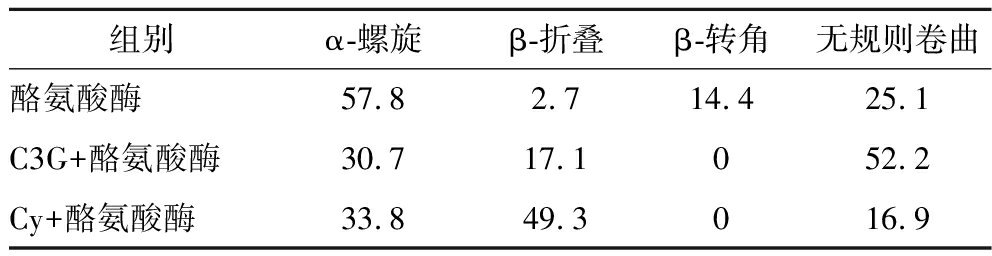
组别α-螺旋β-折叠β-转角无规则卷曲酪氨酸酶57.82.714.425.1C3G+酪氨酸酶30.717.1052.2Cy+酪氨酸酶33.849.3016.9
2.6 荧光猝灭分析
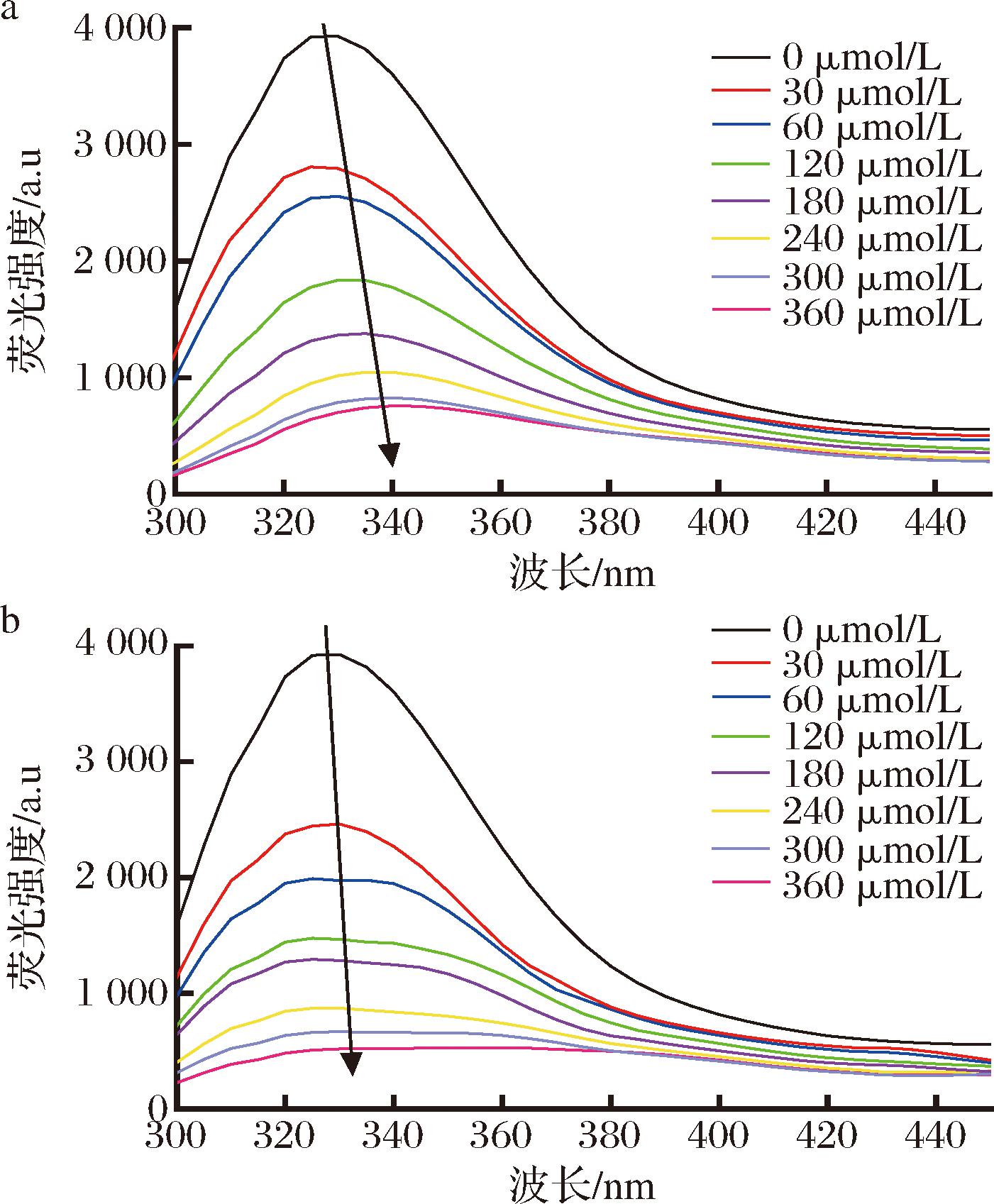
由图7可知,酪氨酸酶溶液的最大荧光峰发射波长为330 nm,C3G和Cy对酪氨酸酶的荧光具有猝灭效果。在固定酪氨酸酶浓度时,随着C3G和Cy浓度增加荧光强度规律性降低,最大吸收峰分别发生明显的红移(340 nm)和轻微红移(332 nm)。结果表明,C3G和Cy对酪氨酸酶的固有荧光有猝灭作用,且浓度越高,猝灭作用越强。Stern-Volmer方程计算可得C3G和Cy与酪氨酸酶反应猝灭常数Kq值分别为1.22×1012和1.72×1012 L/(mol·s),均大于最大散射碰撞猝灭常数 2×1010 L/(mol·s),因此C3G和Cy对酪氨酸酶的猝灭作用都是静态猝灭。
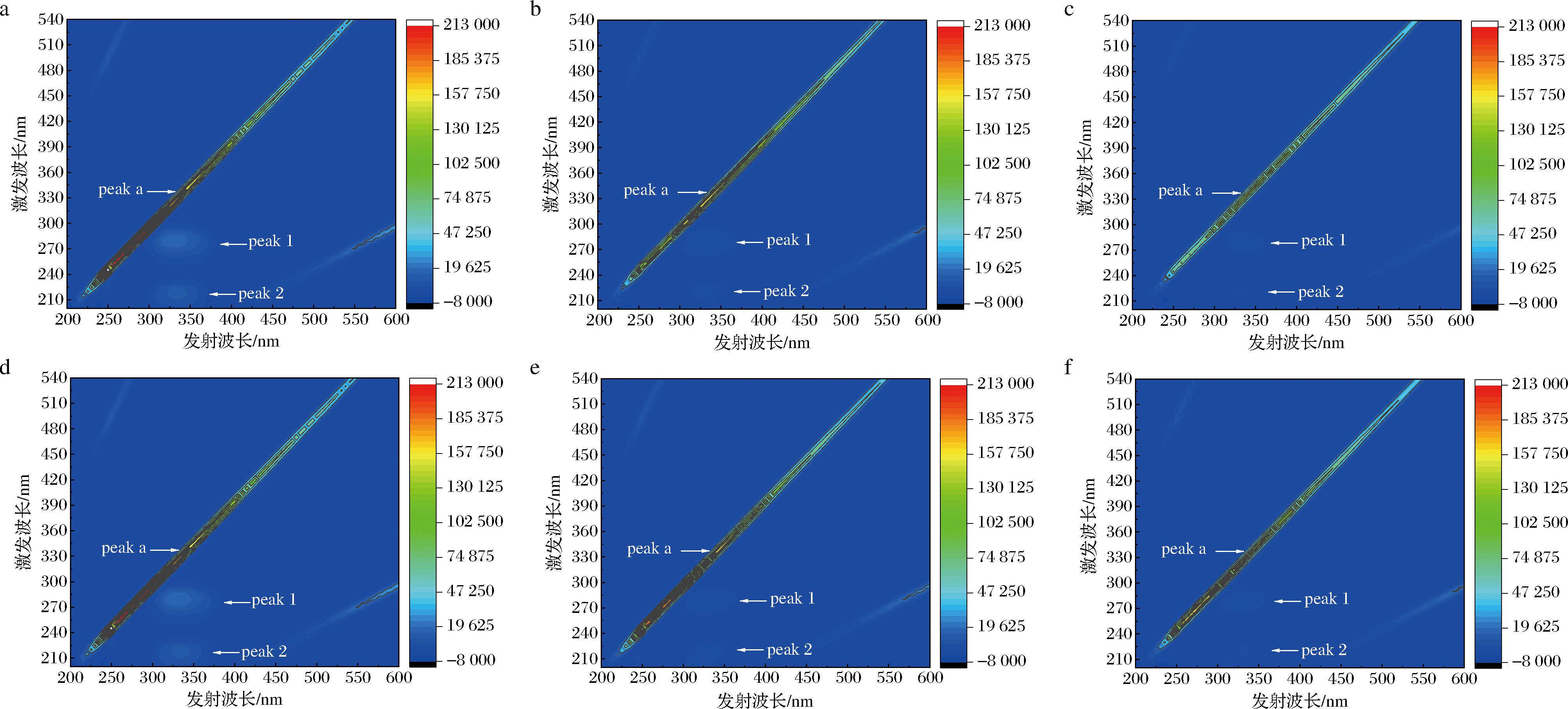
三维荧光图谱如图8所示,单纯酪氨酸酶光谱图中有3个特征峰,分别为Rayleigh散射峰(peak a)和特征光谱峰(peak 1和peak 2)。结果显示在加入了C3G和Cy以后,酪氨酸酶的peak 1峰和peak 2峰强度降低,并且随着C3G和Cy浓度的增加,特征峰强度降低更明显。经比较,加入浓度为240 μmol/L Cy后,酪氨酸酶的peak 1和peak 2峰均减弱;加入同等浓度的C3G后,酪氨酸酶的peak 1峰减弱peak 2峰消失。说明随着C3G和Cy浓度的增加,荧光猝灭效果逐渐增强,且C3G对酪氨酸酶的荧光猝灭效果比Cy强。
2.7 同步荧光光谱分析
Δλ=15 nm和60 nm时分别反映酪氨酸酶中Tyr和Trp残基的光谱特征,Tyr和Trp残基与酶的构象变化有关[22]。同时,最大吸收峰的蓝移和红移分别对应微环境疏水性和亲水性的增加[23]。结果如图9所示,随着C3G和Cy浓度增大,在Δλ=15 nm和60 nm处,酪氨酸酶的荧光强度呈现逐渐降低趋势。加入不同浓度C3G后,在Δλ=15 nm时,发射波长由305 nm红移至315 nm,当Δλ=60 nm时,发射波长由335 nm红移至340 nm;加入不同浓度Cy后,在Δλ=15 nm时,未发生偏移,在Δλ=60 nm时,发射波长分别由335 nm红移至340 nm,由此可知C3G和Cy的加入使得酪氨酸酶中Tyr和Trp残基的微环境极性增大,疏水能力降低。
2.8 分子对接结果分析
分子对接可以预测C3G和Cy分别与酪氨酸酶可能的结合位点[24]。设置分子对接次数为50后,结果如图10所示。C3G、Cy与酪氨酸酶的结合能分别为-8.1 kcal/mol和-7.5 kcal/mol,负值的结合能表示C3G和Cy均可以与酪氨酸酶形成稳定的复合物。C3G与酪氨酸酶结合时,主要被HIS178、ASN174、GLU173、GLN41、GLN44、LYS180、TYR179、HIS182、THR197、LEU177、PRO175、ALA45、LEU40、VAL42等氨基酸残基包围,与氨基酸残基HIS178、ASN174、GLN41、GLN44之间形成6个氢键,键长分别为2.33、2.25、1.78、2.01、2.16、1.76。与氨基酸残基GLU173、LYS180产生π-π相互作用,与TYR179、HIS182、THR197、LEU177、PRO175、ALA45、LEU40、VAL42等氨基酸残基之间形成范德华力。Cy与酪氨酸酶结合时,被ASN174、GLU173、GLN41、GLN44、LYS180、HIS182、TYR179、ALA45、PRO175、LEU177、LYS158、HIS178等氨基酸残基包围,并且与氨基酸残基ASN174、GLU173、GLN41、GLN44之间形成了4个氢键,键长分别为1.76、2.40、2.16、2.08。与氨基酸残基GLU173之间产生π-π相互作用,与LYS180、HJS182、TYR179、ALA45、PRO175、LEU177、LYS158、HJS178等氨基酸残基之间形成范德华力。分子对接结果表示,C3G和Cy与酪氨酸酶之间都产生了良好的结合性能,氢键、范德华力、π-π相互作用力可以使得复合物稳定,C3G/Cy与酪氨酸酶形成的复合物能有效阻止底物进入酶的活性中心,进而影响酶的活力,此外,对接结果表明,C3G(-8.1 kcal/mol)与酪氨酸酶的结合能高于Cy(-7.5 kcal/mol),表明C3G对酪氨酸酶活力的抑制作用强于Cy。进一步补充了酶促反应动力学实验和光谱学实验的结论。
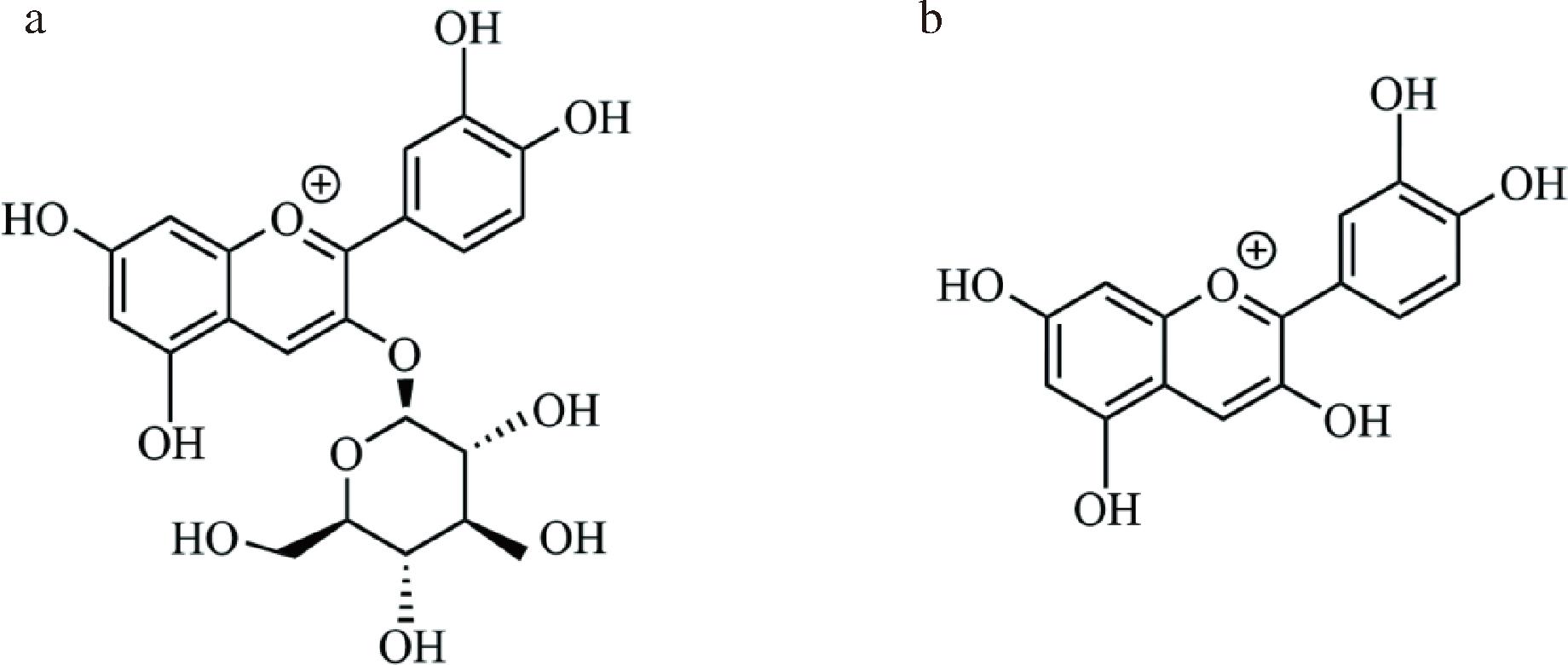
a-C3G;b-Cy
图1 C3G和Cy的化学结构式
Fig.1 Molecular structure of cyanidin-3-O-glicoside and cyanidin
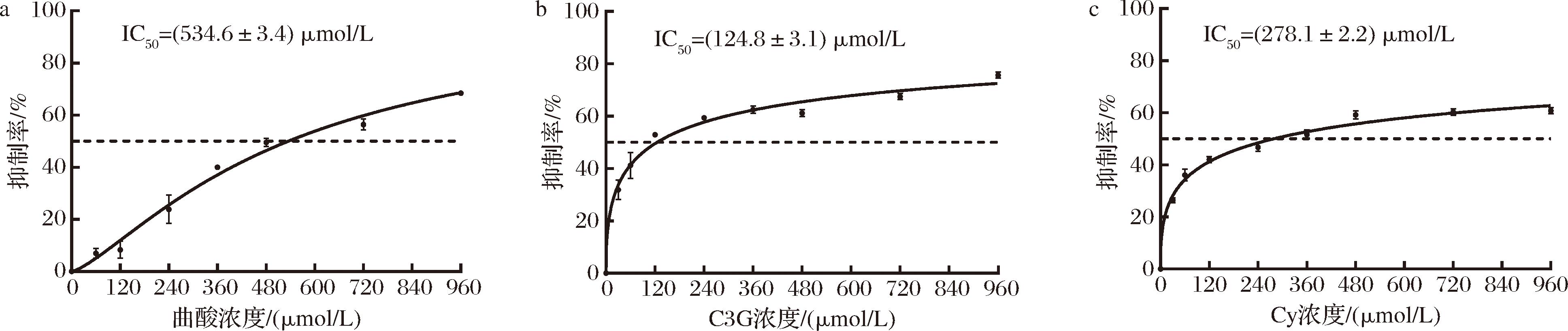
a-曲酸;b-C3G;c-Cy
图2 C3G和Cy对酪氨酸酶的抑制活性
Fig.2 Inhibitory effect of kojic acid, cyanidin-3-O-glicoside, and cyanidin on tyrosinase activity

a-C3G抑制类型曲线;b-Cy抑制类型曲线;c-C3G双倒数曲线;d-Cy双倒数曲线
图3 C3G和Cy对酪氨酸酶的酶抑制动力学
Fig.3 Enzymatic inhibition kinetics of tyrosinase by cyanidin-3-O-glicoside and cyanidin
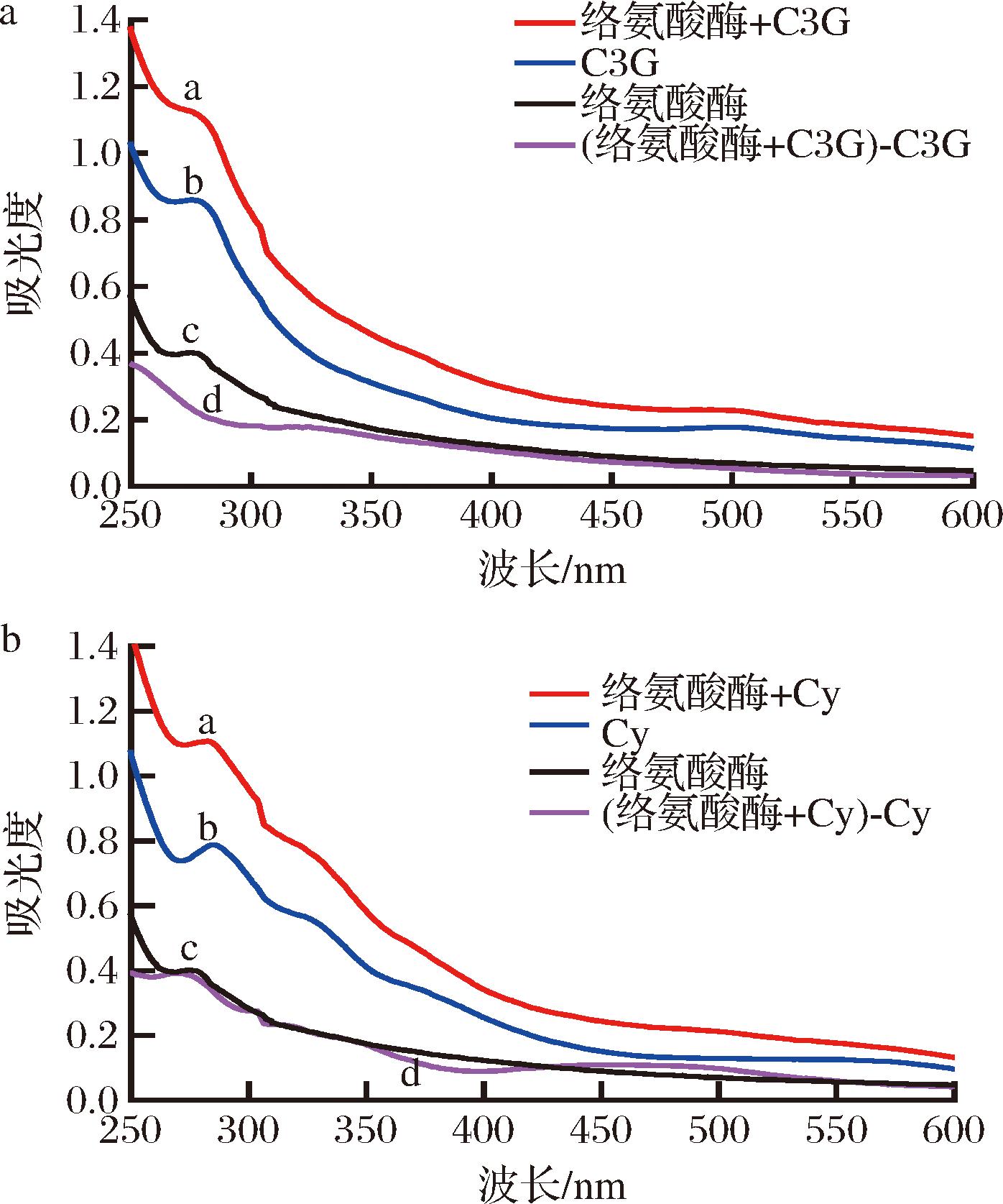
a-矢车菊素-3-O-葡萄糖苷;b-矢车菊素
图4 矢车菊素-3-O-葡萄糖苷和矢车菊素对酪氨酸酶的紫外光谱图
Fig.4 UV spectra of tyrosinase by cyanidin-3-O-glicoside and cyanidin
注:曲线a为矢车菊素-3-O-葡萄糖苷/矢车菊素与酪氨酸酶混合物紫外吸收光谱;曲线b为矢车菊素-3-O-葡萄糖苷/矢车菊素的紫外吸收光谱;电线c为酪氨酸酶的紫外吸收光谱;曲线d为扣除抑制剂为背景后矢车菊素-3-O-葡萄糖苷/矢车菊素与酪氨酸酶混合物紫外光谱。
a-C3G;b-Cy
图5 C3G和Cy对酪氨酸酶的红外光谱图
Fig.5 FT-IR spectra of tyrosinase by cyanidin-3-O-glicoside and cyanidin
注:曲线a为单纯酪氨酸酶的红外光谱曲线曲线;曲线b为矢车菊素-3-O-葡萄糖苷与酪氨酸酶混合物红外光谱曲线;曲线c为矢车菊素与酪氨酸酶混合物红外光谱。
a-C3G;b-Cy
图6 不同摩尔浓度的C3G和Cy对酪氨酸酶的圆二色光谱的影响
Fig.6 Effect of different concentrations of cyanidin-3-O-glicoside and cyanidin on CD spectrum of tyrosinase
a-C3G;b-Cy
图7 不同摩尔浓度的C3G和Cy对酪氨酸酶的荧光光谱的影响
Fig.7 Effect of different concentrations of cyanidin-3-O-glicoside and cyanidin on fluorescence spectrum of and tyrosinase
a~c-C3G浓度分别为0、120、240 μmol/L;d~f-Cy浓度分别为0、120、240 μmol/L
图8 不同摩尔浓度的C3G和Cy对酪氨酸酶的3D荧光光谱的影响
Fig.8 Effect of different concentrations of cyanidin-3-O-glicoside and cyanidin on 3D fluorescence spectrum of tyrosinase

a、b-C3G Δλ分别为15、60 nm;c、d-Cy Δλ分别为15、60 nm
图9 不同摩尔浓度的C3G和Cy对酪氨酸酶的同步荧光光谱的影响
Fig.9 Effects of cyanidin-3-O-glicoside and cyanidin on the synchronous fluorescence spectra of tyrosinase
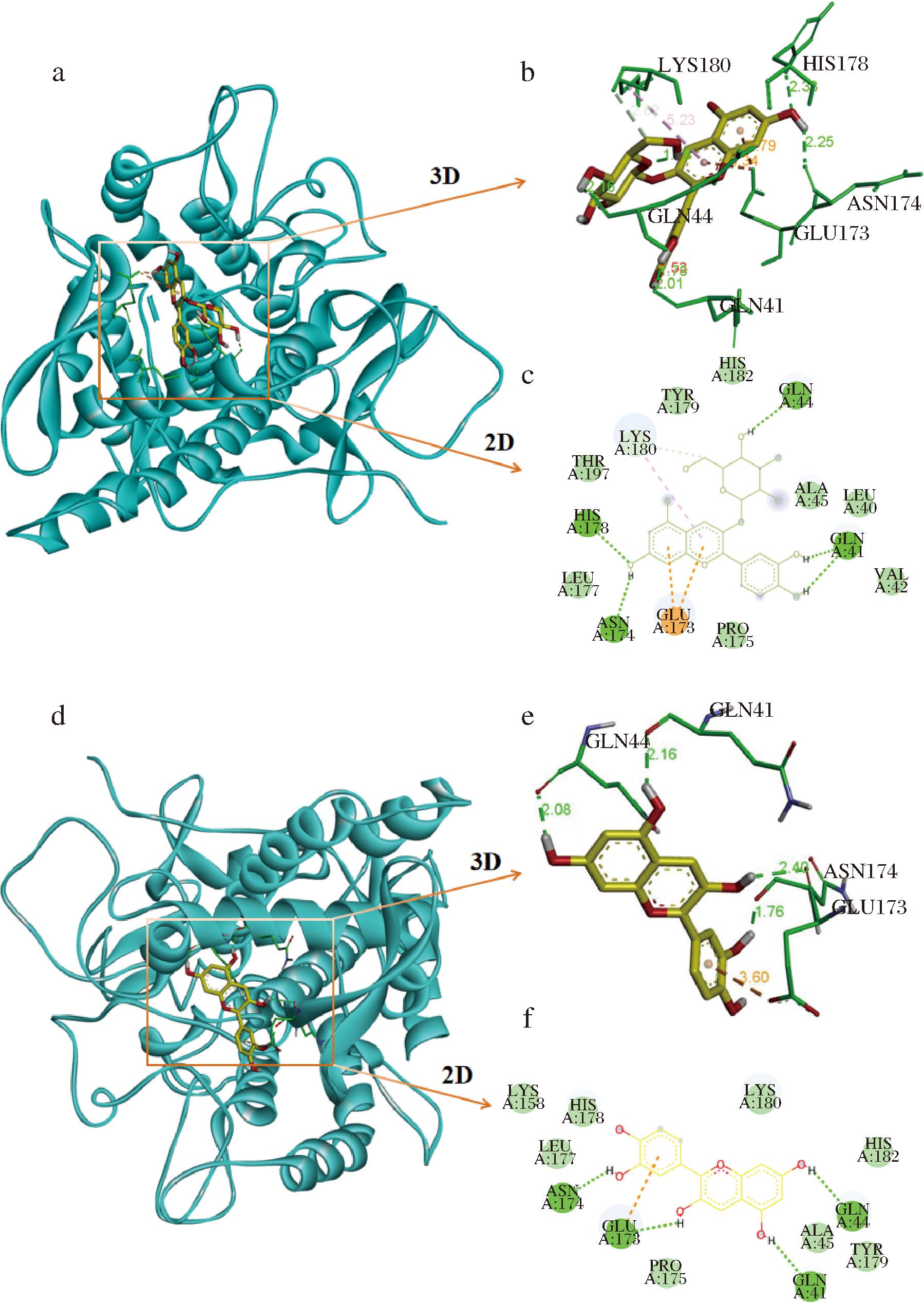
a、d-C3G、Cy与酪氨酸酶的对接模型;b、c-C3G与酪氨酸酶分子上氨基酸残基的相互作用;e、f-Cy与酪氨酸酶分子上氨基酸残基的相互作用
图10 C3G、Cy和酪氨酸酶的分子对接
Fig.10 Molecular docking of cyanidin-3-O-glicoside、cyanidin and tyrosinase
3 结论
通过酶促动力学实验表明,C3G对酪氨酸酶的抑制作用为可逆反应、竞争性抑制,Cy对酪氨酸酶的抑制作用是可逆反应、混合型抑制。荧光结果显示,C3G和Cy可以改变酪氨酸酶的Tyr和Trp残基的微环境从而对酶的内源荧光进行静态猝灭。圆二色谱、紫外和红外结果显示,C3G和Cy均能改变酪氨酸酶的二级结构,从而起到对酪氨酸酶抑制活性作用。分子对接结果显示,C3G和Cy和酪氨酸酶有多个结合位点,两者均可以有效的抑制酶的活力。并且光谱学试验和分子对接模拟实验均显示,C3G对酪氨酸酶的抑制作用强于Cy,可能是因为C3G比Cy多一个葡萄糖结构,葡萄糖结构中有多个羟基,羟基易与酪氨酸酶形成氢键,短氢键的形成促进了C3G与酪氨酸酶的结合,阻止酪氨酸酶与底物的结合,从而抑制酶的活力。分子对接结果也显示,C3G与酪氨酸酶之间形成6个氢键,而Cy与酪氨酸酶之间形成4个氢键。综上所述,C3G和Cy均可以抑制酪氨酸酶的活力,且C3G对酪氨酸酶活力的抑制作用优于Cy,两者均能减少黑色素生成,发挥美白作用。该研究为C3G和Cy这类多酚类化合物在酪氨酸酶抑制剂领域的进一步研发提供了参考,为开发天然高效酪氨酸抑制剂用于化妆品美白添加剂提供了科学支持。
[1] WEN Y T, ZHANG Y J, ZHANG X L, et al.Inhibition of albendazole and 2-(2-aminophenyl)-1H-benzimidazole against tyrosinase:Mechanism, structure-activity relationship, and anti-browning effect[J].Journal of the Science of Food and Agriculture, 2023, 103(6):2824-2837.
[2] PILLAIYAR T, NAMASIVAYAM V, MANICKAM M, et al.Inhibitors of melanogenesis:An updated review[J].Journal of Medicinal Chemistry, 2018, 61(17):7395-7418.
[3] MIYACHI K, YAMADA T, SANADA A, et al.Melanin accumulation in dermal stem cells deteriorates their exosome-mediated skin basement membrane construction in solar lentigo[J].Experimental Dermatology, 2022, 31(12):1881-1890.
[4] LOGESH R, PRASAD S R, CHIPURUPALLI S, et al.Natural tyrosinase enzyme inhibitors:A path from melanin to melanoma and its reported pharmacological activities[J].Biochimica et Biophysica Acta (BBA) - Reviews on Cancer, 2023, 1878(6):188968.
[5] ZHAO W, YANG A Q, WANG J, et al.Potential application of natural bioactive compounds as skin-whitening agents:A review[J].Journal of Cosmetic Dermatology, 2022, 21(12):6669-6687.
[6] CHANG T S.Natural melanogenesis inhibitors acting through the down-regulation of tyrosinase activity[J].Materials, 2012, 5(9):1661-1685.
[7] 彭赛男. 桑葚中主要化学成分的研究[D].西安:西北大学, 2019.PENG S N.Study on main chemical components in mulberries [D].Xi'an:Northwest University, 2019.
[8] LI Y T, HUANG T, WANG J Z, et al.Efficient acquisition of high-purity cyanidin-3-O-glucoside from mulberry fruits:An integrated process of ATPS whole-cell transformation and semi-preparative HPLC purification[J].Food Chemistry, 2023, 404:134651.
[9] LIU X, RAO J Q, WANG K, et al.Highly potent inhibition of tyrosinase by mulberrosides and the inhibitory mechanism in vitro[J].Chemistry &Biodiversity, 2022, 19(1):e202100740.
[10] HUANG X, ZHU J X, WANG L, et al.Inhibitory mechanisms and interaction of tangeretin, 5-demethyltangeretin, nobiletin, and 5-demethylnobiletin from Citrus peels on pancreatic lipase:Kinetics, spectroscopies, and molecular dynamics simulation[J].International Journal of Biological Macromolecules, 2020, 164:1927-1938.
[11] HAN L L, SONG J Q, YAN C Q, et al.Inhibitory activity and mechanism of calycosin and calycosin-7-O-β-D-glucoside on α-glucosidase:Spectroscopic and molecular docking analyses[J].Process Biochemistry, 2022, 118:227-235.
[12] LIU L L, LI J D, ZHANG L L, et al.Conformational changes of tyrosinase caused by pentagalloylglucose binding:Implications for inhibitory effect and underlying mechanism[J].Food Research International, 2022, 157:111312.
[13] LI X R, LIU H Y, YANG Z H, et al.Study on the interaction of hyaluronidase with certain flavonoids[J].Journal of Molecular Structure, 2021, 1241:130686.
[14] CARCELLI M, ROGOLINO D, BARTOLI J, et al.Hydroxyphenyl thiosemicarbazones as inhibitors of mushroom tyrosinase and antibrowning agents[J].Food Chemistry, 2020, 303:125310.
[15] 倪丹, 蒋新元, 唐玉莲, 等.鞣花酸抑制酪氨酸酶的动力学、荧光光谱分析及分子对接[J].食品科学, 2024, 45(2):104-112.NI D, JIANG X Y, TANG Y L, et al.Kinetic, fluorescence spectroscopy and molecular docking studies of tyrosinase inhibition by ellagic acid[J].Food Science, 2024, 45(2):104-112.
[16] 陈荣达. 紫娟茶花青素抑制酪氨酸酶活性及其作用机制研究[D].长春:长春师范大学, 2021.CHEN R D.Inhibitory effect of anthocyanins from Zijuan tea on tyrosinase activity and its mechanism[D].Changchun:Changchun Normal University, 2021.
[17] LI X, BAI H, WU Y Y, et al.Structural analysis and allergenicity assessment of an enzymatically cross-linked bovine α-lactalbumin polymer[J].Food &Function, 2020, 11(1):628-639.
[18] SHI J H, PAN D Q, WANG X X, et al.Characterizing the binding interaction between antimalarial artemether (AMT) and bovine serum albumin (BSA):Spectroscopic and molecular docking methods[J].Journal of Photochemistry and Photobiology B:Biology, 2016, 162:14-23.
[19] TANG H J, HUANG L, SUN C Y, et al.Exploring the structure-activity relationship and interaction mechanism of flavonoids and α-glucosidase based on experimental analysis and molecular docking studies[J].Food &Function, 2020, 11(4):3332-3350.
[20] YANG J, CHANG R R, GE S J, et al.The inhibition effect of starch nanoparticles on tyrosinase activity and its mechanism[J].Food &Function, 2016, 7(12):4804-4815.
[21] 李光辉. 没食子酸甲酯-羟丙基-β-环糊精脂质体的构建及其在双孢蘑菇保鲜中的应用初探[D].荆州:长江大学, 2023.LI G H.Construction of methyl gallate-hydroxypropyl-β-cyclodextrin liposome and its application in preservation of Agaricus bisporus[D].Jingzhou:Yangtze University, 2023.
[22] HUANG Q, CHAI W M, MA Z Y, et al.Inhibition of α-glucosidase activity and non-enzymatic glycation by tannic acid:Inhibitory activity and molecular mechanism[J].International Journal of Biological Macromolecules, 2019, 141:358-368.
[23] 韩玲玲. 毛蕊异黄酮和毛蕊异黄酮苷对α-葡萄糖苷酶的抑制作用及其机制研究[D].太原:山西医科大学, 2022.HAN L L.Inhibitory effect of calycoside and calycoside on α-glucosidase and its mechanism[D].Taiyuan:Shanxi Medical University, 2022.
[24] JIANG L L, WANG Z, WANG X Y, et al.Exploring the inhibitory mechanism of piceatannol on α-glucosidase relevant to diabetes mellitus[J].RSC Advances, 2020, 10(8):4529-4537.