单核细胞增生李斯特氏菌,简称单增李斯特菌,是一种常见的食源性致病菌,可引起严重的李斯特菌病,特别是对于免疫力低下的人群,如孕妇、婴儿和老年人,可能导致严重的侵袭性疾病,如菌血症、脑膜炎、肺炎、心内膜炎、败血症等[1]。由于单增李斯特菌广泛分布于环境中,并且对低pH、高渗透压和低温等环境胁迫具有高度抗性,因此在乳制品中难以控制其污染[2]。尽管适当的巴氏灭菌可消除乳制品中的单增李斯特菌,但仍然存在李斯特菌病与乳制品有关的报道[3]。据报道,欧洲超过一半的李斯特菌病病例与乳制品有关[4]。CHEN等[5]从中国21个城市采集了210份巴氏灭菌乳样品,共有5份样本被检出单增李斯特菌。
传统的物理方法和化学方法可有效抑制单增李斯特菌生长,但这些方法可能会对乳制品的质量产生不良影响[1]。乳酸菌在乳制品和其他发酵产品的生产中被广泛用作起始或辅助培养物,并可以通过竞争营养物质和产生有机酸、过氧化氢、细菌素等抑菌物质来抑制单增李斯特菌生长[1, 6]。KUDA等[7]报道了乳酸乳球菌(Lactococcus lactis Nagasaki-SU6)可在牛奶和豆奶中显著抑制单增李斯特菌。IVANOVIC等[8]发现乳酸乳球菌(Lactococcus lactis subsp.lactis BGBU1-4)可显著降低人工污染的超滤奶酪中的单增李斯特菌活菌数。PREZZI等[9]的研究表明,在米纳斯弗雷斯卡尔奶酪中,鼠李糖乳杆菌(Lactobacillus rhamnosus,GG)可能通过竞争营养物质来显著抑制单增李斯特菌的生长。在宿主体内,乳酸菌还可以发挥益生功能,减轻胃肠道受单增李斯特菌侵袭的影响并对单增李斯特菌感染进行免疫调节[10]。因此,本研究从新疆酸奶疙瘩中筛选出具有抑制单增李斯特菌活性的乳酸菌,并评估抑菌效果较好的乳酸菌的益生潜力和安全性。最后,评估这些乳酸菌在巴氏灭菌乳中原位抑制单增李斯特菌的效果,并通过扫描电子显微镜观察乳酸菌和单增李斯特菌共培养时的相互作用,以期为益生菌制剂和乳制品保护性发酵剂提供理论基础和菌株来源。
1 材料与方法
1.1 材料与设备
1.1.1 样品与菌株
本研究所用的酸奶疙瘩采自新疆不同地区,其中4个样品来自阿勒泰市,2个样品来自伊犁州,2个样品来自昌吉州,1个样品来自莎车县。指示菌单增李斯特菌(Listeria monocytogenes ATCC 19115)、金黄色葡萄球菌(Staphylococcus aureus ATCC 43300)均保藏于本实验室。
1.1.2 培养基和试剂
MRS培养基、TSB培养基,杭州百思生物技术有限公司;PALCAM琼脂培养基、PALCAM选择性添加剂,北京陆桥有限公司;胃蛋白酶、胰蛋白酶,西格玛奥德里奇(上海)贸易有限公司;牛胆盐,上海源叶生物科技有限公司;二甲苯,成都市科隆化学品有限公司;抗菌药物药敏纸片,湖南比克曼生物科技有限公司;全脂巴氏灭菌乳,购于当地超市。
1.2 仪器与设备
TG16 台式高速离心机,长沙英泰仪器有限公司;Synergy H1 酶标仪,美国伯腾仪器有限公司;S1000 PCR仪,伯乐生命医学产品公司;SHJ-A6 磁力搅拌水浴锅,常州市亿能实验仪器厂;MJX-450 霉菌培养箱,南京立思高仪器设备有限公司;YXQ-LS-30SII 立式压力蒸汽灭菌器,上海博讯实业有限公司医疗设备厂;SU3500 扫描电子显微镜,日立公司。
1.3 实验方法
1.3.1 新疆酸奶疙瘩中乳酸菌的筛选及鉴定
参考LI等[11]的方法筛选和鉴定新疆酸奶疙瘩中的乳酸菌并作简单地修改。取一小块酸奶疙瘩样品放入无菌试管中,加入无菌的PBS后进行均质,将均质样品在液体MRS培养基中于37 ℃富集培养24 h,然后进行10倍梯度稀释,取适宜的梯度100 μL菌液均匀涂在含有2%碳酸钙的MRS平板中,在37 ℃下培养48 h,挑选具有溶钙圈、形状为圆形、表面光滑或略粗糙且颜色为白色或乳白色的菌落在MRS平板上进一步划线纯化菌落,并进行革兰氏染色。最后,使用直接PCR扩增试剂盒(T5 Direct PCR Kit (Plus),北京擎科生物科技有限公司)扩增乳酸菌的16S rDNA基因片段。上游引物27F:5′-AGAGTTTGATCCTGGCTCAG-3′;下游引物1492R:5′- GGTTACCTTGTTACGACTT-3′。PCR反应体系:反应体系25 μL,细菌裂解产物1 μL,上游引物1 μL,下游引物1 μL,2×T5 Direct PCR Mix(Plus)12.5 μL,ddH2O 9.5 μL。反应条件:98 ℃预变性3 min;98 ℃变性10 s,58 ℃退火10 s,72 ℃延伸90 s,进行35个循环;72 ℃延伸5 min。将PCR产物送至北京擎科生物科技有限公司进行测序,测序后获得的核苷酸序列使用NCBI的BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行相似性检索,下载相似性较高的序列使用MEGA 11.0进行比对并构建系统发育树。
1.3.2 筛选抑制单增李斯特菌的乳酸菌
1.3.2.1 乳酸菌无细胞上清液的制备
活化2代后的乳酸菌接种于液体MRS培养基中,在37 ℃下培养24 h后于8 000 r/min离心10 min获得上清液,然后用0.22 μm的滤膜过滤除菌后获得无细胞上清液(cell-free supernatant,CFS)。
1.3.2.2 抑制单增李斯特菌活性评价
参考SONG等[12]的方法通过琼脂孔扩散法筛选具有抑制单增李斯特菌活性的乳酸菌并作简单地修改。制备1.5%的水琼脂平板作为下层平板,待平板凝固后将牛津杯置于平板上,再倒入含有终浓度为1.0×106 CFU/mL指示菌的半固体TSB培养基作为上层平板,待上层平板凝固后取出牛津杯,然后向孔中加入100 μL CFS。将平板在4 ℃冰箱放置4 h后,置于37 ℃培养24 h后测量抑菌圈直径。
1.3.3 乳酸菌益生潜力评估
1.3.3.1 模拟胃肠液耐受性
参照HAN等[13]的方法并作简单修改来评估乳酸菌在模拟胃肠液中的耐受性。模拟胃液:将胃蛋白酶加入到无菌PBS(0.1 mol/L,pH 2.5)中至终质量浓度为3 g/L;模拟肠液:将胰蛋白酶加入到无菌PBS(0.1 mol/L,pH 8.0)中至终质量浓度为1 g/L。
活化2代的乳酸菌过夜培养后用无菌生理盐水(8.5 g/L NaCl)洗涤2次并重悬,然后接种到模拟胃液中,使得菌液终浓度为108 CFU/mL。在37 ℃下孵育3 h,分别在0、3 h取菌液用无菌生理盐水10倍梯度稀释,取适宜的梯度100 μL稀释液涂布于MRS平板中,在37 ℃下培养48 h后计算活菌数。然后将1 mL培养物接种到9 mL模拟肠液中,在37 ℃下孵育8 h,分别在0、2、4、8 h取菌液用无菌生理盐水10倍梯度稀释,取适宜的梯度100 μL稀释液涂布于MRS平板中,在37 ℃下培养48 h后计算活菌数。根据公式(1)计算乳酸菌在模拟胃肠液中的存活率:
存活率![]()
(1)
式中:Nt,模拟胃肠液处理后不同时间的乳酸菌活菌数;N0,乳酸菌初始活菌数。
1.3.3.2 胆盐耐受性
参照DIVYASHREE等[14]的方法评估乳酸菌的胆盐耐受性。活化2代的乳酸菌过夜培养后以2%的接种量接种于3 g/L牛胆盐的MRS液体培养基中,对照组接种在不含牛胆盐的MRS液体培养基中,在37 ℃下孵育4 h。取菌液用无菌生理盐水10倍梯度稀释,选适宜的梯度取100 μL稀释液涂布于MRS平板中,在37 ℃下培养48 h后计算活菌数。根据公式(2)计算乳酸菌的胆盐耐受性:
胆盐耐受性![]()
(2)
式中:N1,接种在含有牛胆盐的MRS培养基的乳酸菌活菌数;N2,对照组的乳酸菌活菌数。
1.3.3.3 自聚集试验
参照RODR GUEZ-S
GUEZ-S NCHEZ等[15]的方法评估乳酸菌的自聚集性。活化2代的乳酸菌过夜培养后离心收集菌体,然后使用无菌PBS洗涤2次并重悬于PBS中使得终浓度为108 CFU/mL。取4 mL菌悬液涡旋10 s后在室温下静态培养,并在0、2和4 h测量上层菌悬液在600 nm处的吸光度。自聚集率采用公式(3)进行计算:
NCHEZ等[15]的方法评估乳酸菌的自聚集性。活化2代的乳酸菌过夜培养后离心收集菌体,然后使用无菌PBS洗涤2次并重悬于PBS中使得终浓度为108 CFU/mL。取4 mL菌悬液涡旋10 s后在室温下静态培养,并在0、2和4 h测量上层菌悬液在600 nm处的吸光度。自聚集率采用公式(3)进行计算:
自聚集率![]()
(3)
式中:At,不同时间的吸光度;A0,0 h的吸光度。
1.3.3.4 共聚集试验
参照RODR GUEZ-S
GUEZ-S NCHEZ等[15]的的方法评估乳酸菌与单增李斯特菌的共聚集能力。乳酸菌和单增李斯特菌分别在MRS液体培养基和TSB液体培养基中37 ℃下过夜培养,然后使用无菌PBS洗涤3次并重悬于PBS中使得终浓度为108 CFU/mL。将等体积(2 mL)的乳酸菌悬液和单增李斯特菌悬液混合并涡旋10 s。对照组分别取各菌4 mL菌悬液于离心管。测量0 h和室温下静态培养5 h后上层菌悬液在600 nm处的吸光度。按照公式(4)计算共聚集率:
NCHEZ等[15]的的方法评估乳酸菌与单增李斯特菌的共聚集能力。乳酸菌和单增李斯特菌分别在MRS液体培养基和TSB液体培养基中37 ℃下过夜培养,然后使用无菌PBS洗涤3次并重悬于PBS中使得终浓度为108 CFU/mL。将等体积(2 mL)的乳酸菌悬液和单增李斯特菌悬液混合并涡旋10 s。对照组分别取各菌4 mL菌悬液于离心管。测量0 h和室温下静态培养5 h后上层菌悬液在600 nm处的吸光度。按照公式(4)计算共聚集率:
共聚集率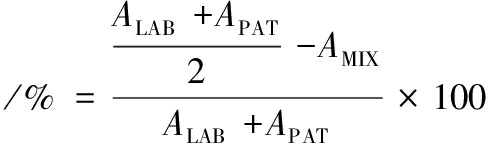
(4)
式中:ALAB,乳酸菌上层菌悬液的吸光度;APAT,单增李斯特菌上层菌悬液的吸光度;AMIX,乳酸菌和单增李斯特菌混合溶液上层菌悬液的吸光度。
1.3.3.5 细胞表面疏水性
参照RODRIGUEZ-S NCHEZ等[15]的方法评估乳酸菌的表面疏水性。如1.3.3.4节所述制备乳酸菌的菌悬液,并测量菌悬液在600 nm处的吸光度。然后将3 mL菌悬液分别与1 mL二甲苯涡旋混匀,37 ℃下孵育1 h进行相分离。测量水相在600 nm处的吸光度。根据公式(5)计算疏水性:
NCHEZ等[15]的方法评估乳酸菌的表面疏水性。如1.3.3.4节所述制备乳酸菌的菌悬液,并测量菌悬液在600 nm处的吸光度。然后将3 mL菌悬液分别与1 mL二甲苯涡旋混匀,37 ℃下孵育1 h进行相分离。测量水相在600 nm处的吸光度。根据公式(5)计算疏水性:
疏水性![]()
(5)
式中:At,孵育后水相的吸光度;A0,加入二甲苯前菌悬液的吸光度。
1.3.4 乳酸菌安全性评估
1.3.4.1 抗生素耐药性评估
采用药敏纸片琼脂扩散法评估乳酸菌的抗生素耐药性。取10种抗生素分别为青霉素(1 μg)、头孢曲松(30 μg)、红霉素(15 μg)、氯霉素(30 μg)、环丙沙星(5 μg)、复方新诺明(25 μg)、氨苄西林(20 μg)、四环素(30 μg)、林可霉素(2 μg)、庆大霉素(120 μg)。乳酸菌过夜培养后取100 μL菌液(约1×108 CFU/mL),均匀涂布在MRS平板上,再将抗生素药敏片轻轻压在并紧贴培养基表面,在37 ℃下孵育培养24 h后,测定抑菌圈直径。评价标准参照美国临床与实验室标准协会发布的CLSI M100(https://clsi.org/standards/products/microbiology/documents/m100/)。
1.3.4.2 溶血活性
将乳酸菌在含有5%的无菌脱纤维羊血的哥伦比亚培养基上划线,以金黄色葡萄球菌为阳性对照,在37 ℃下孵育48 h后,检测平板的溶血反应。
1.3.5 乳酸菌原位抑制单增李斯特菌效果评估
1.3.5.1 在巴氏灭菌乳中共培养
参考HUANG等[16]的方法评估乳酸菌在巴氏灭菌乳中与单增李斯特菌共培养的原位抑制效果,并进行简单地修改。巴氏灭菌乳同时接种单增李斯特菌(约102~103 CFU/mL)和乳酸菌(107 CFU/mL),对照组分别仅接种单增李斯特菌(约102~103 CFU/mL)和乳酸菌(107CFU/mL),在37 ℃下培养24 h。分别用PALCAM琼脂平板和MRS琼脂平板测定0、6、12、18、24 h的单增李斯特菌和乳酸菌的活菌数。
1.3.5.2 预发酵巴氏灭菌乳后共培养
参考GARC A等[3]的方法评估乳酸菌预发酵巴氏灭菌乳12 h后人工污染单增李斯特菌的原位抑制效果,并进行简单修改。将乳酸菌(107 CFU/mL)接种于巴氏灭菌乳中,在37 ℃下预发酵12 h后接种单增李斯特菌(约102~103CFU/mL),继续培养12 h,每3 h测定单增李斯特菌的活菌数。将未发酵的巴氏灭菌乳在37 ℃下静置12 h后,仅接种单增李斯特菌(约102~103 CFU/mL)作为对照。
A等[3]的方法评估乳酸菌预发酵巴氏灭菌乳12 h后人工污染单增李斯特菌的原位抑制效果,并进行简单修改。将乳酸菌(107 CFU/mL)接种于巴氏灭菌乳中,在37 ℃下预发酵12 h后接种单增李斯特菌(约102~103CFU/mL),继续培养12 h,每3 h测定单增李斯特菌的活菌数。将未发酵的巴氏灭菌乳在37 ℃下静置12 h后,仅接种单增李斯特菌(约102~103 CFU/mL)作为对照。
1.3.5.3 扫描电子显微镜观察
鉴于乳酸片球菌XJ-24在巴氏灭菌乳中表现出优异的原位抑制单增李斯特菌效果,因此进一步通过扫描电子显微镜观察乳酸片球菌XJ-24与单增李斯特菌的互作模式。参照XU等[17]的方法并作简单修改。简而言之,将活化好的乳酸片球菌XJ-24和单增李斯特菌的菌液浓度分别调至1×108 CFU/mL,然后按照1∶1的比例混合,以1%的接种量接种至10 mL TSB培养基中,在37 ℃下过夜培养。接着以8 000 r/min离心5 min,用无菌PBS洗涤菌体2次后重悬于2.5%戊二醛中,在4 ℃下固定过夜。随后,用无菌PBS洗涤菌体3次,将菌体在一系列乙醇溶液(30%、50%、70%、85%、90%,体积分数)中脱水15 min,然后用100%乙醇溶液洗脱2次,每次15 min,干燥后镀金,进行扫描电子显微镜观察。
1.4 数据处理与统计分析
所有实验重复3次,数据显示为平均值±标准偏差。单因素方差分析用于分析数据的显著性。标注不同小写字母的平均值表示组间的统计学显著差异(P<0.05)。
2 结果与分析
2.1 具有抑制单增李斯特菌活性的乳酸菌筛选和鉴定
从9个新疆酸奶疙瘩样品中共分离出26株乳酸菌。通过对乳酸菌的16S rDNA扩增产物进行测序并将测序所得的核苷酸序列通过NCBI的BLAST进行相似性检索,并结合革兰氏染色镜检初步确认这些菌株中包括10株乳酸片球菌、7株嗜酸乳杆菌、3株瑞士乳杆菌、2株植物乳植杆菌、2株罗伊斯粘液乳杆菌、1株戊糖乳杆菌以及1株鼠李糖乳酪杆菌。
随后,使用单增李斯特菌ATCC 19115作为指示菌,对这些乳酸菌进行了抑制单增李斯特菌活性的筛选。结果如图1-A所示,共有13株乳酸菌表现出抑菌效果,其中5株抑菌圈直径小于15 mm,8株抑菌圈直径为15~20 mm。抑菌效果较好的5株乳酸菌的编号分别为XJ-24、XJ-47、XJ-4、XJ-14和XJ-7,如图1-B所示。
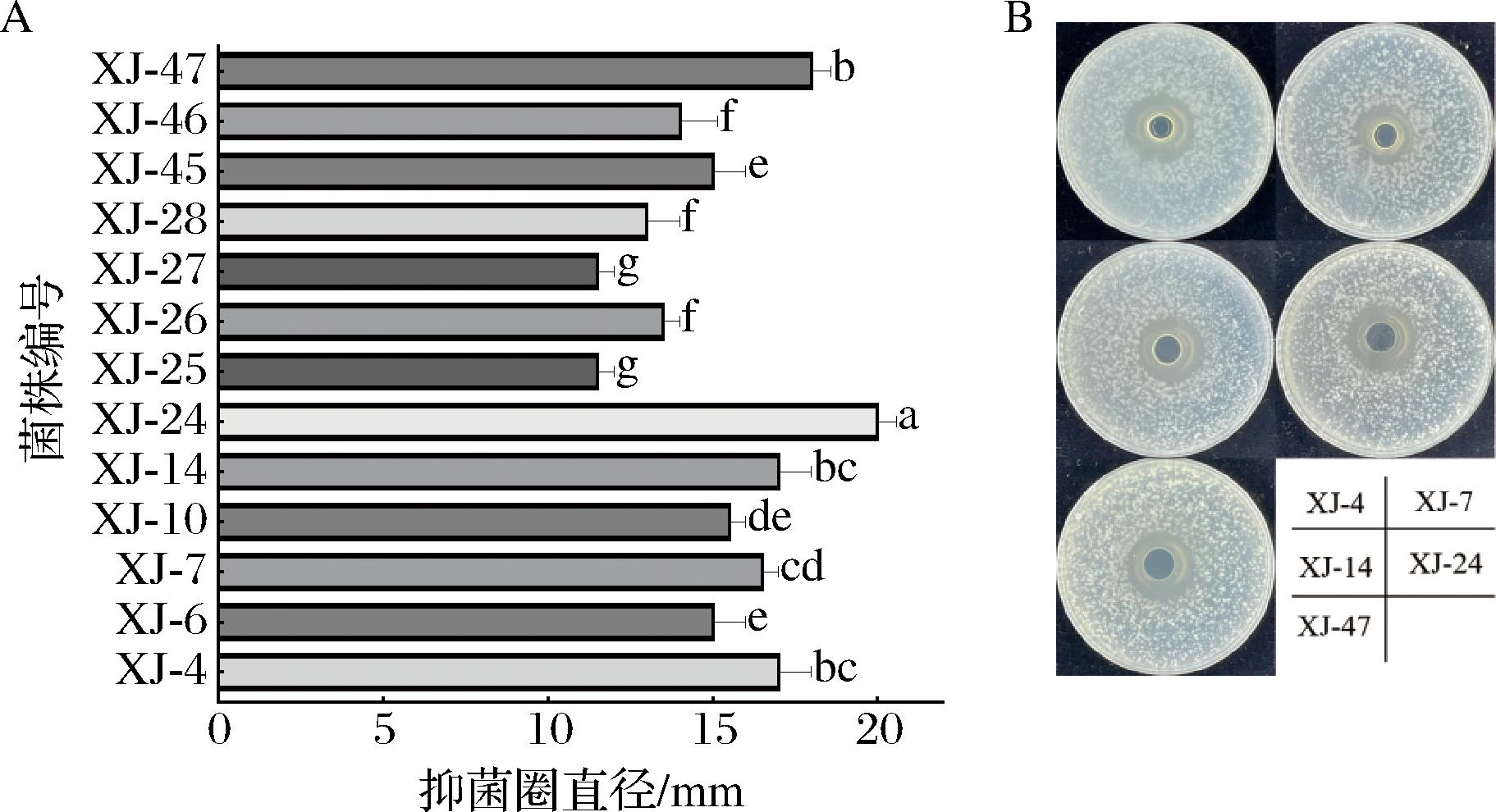
A-抑菌圈直径;B-部分菌株抑菌效果
图1 抑制单增李斯特菌的乳酸菌筛选结果
Fig.1 Screening results of lactic acid bacteria inhibiting L.monocytogenes
注:图中不同小写字母表示差异显著(P<0.05)(下同)。
针对这5株乳酸菌,进行了同源性分析和系统发育树的构建。构建的系统发育树如图2所示,菌株XJ-7和XJ-14与P.acidilactici FCP-1的亲缘关系最接近,菌株XJ-24与P.acidilactici R9亲缘关系最接近,菌株XJ-4和XJ-47则与L.reuteri LQ2亲缘关系更为接近。结合形态学观察,确认菌株XJ-7、XJ-14和XJ-24为乳酸片球菌,菌株XJ-4和XJ-47为罗伊氏粘液乳杆菌。接着进一步评估这5株菌的益生潜力、安全性以及在巴氏灭菌乳中原位抑制单增李斯特菌的效果。
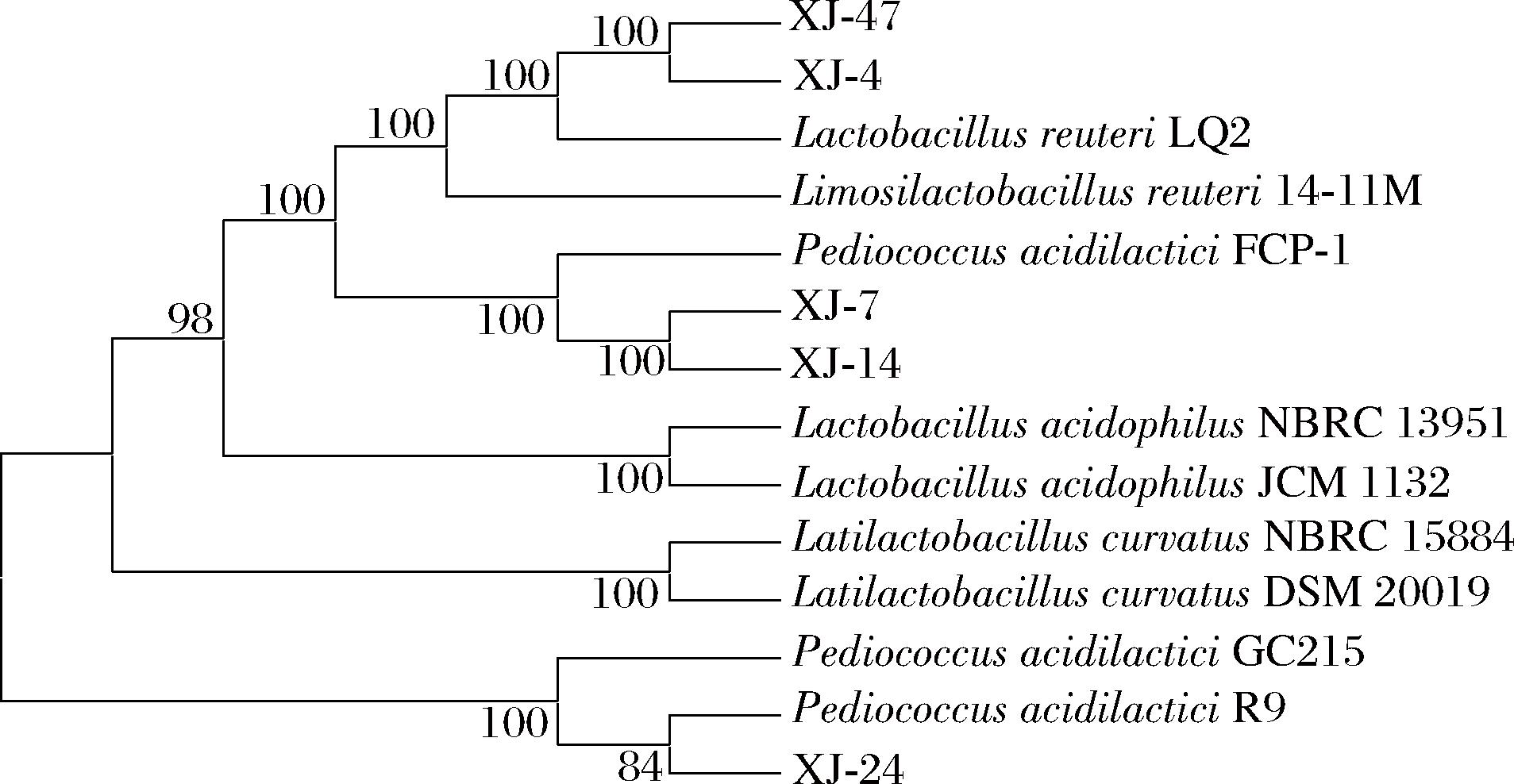
图2 五株乳酸菌的16S rDNA系统发育树
Fig.2 Phylogenetic tree based on 16S rDNA sequence of five lactic acid bacteria strains
2.2 乳酸菌益生潜力评价
2.2.1 模拟胃肠液耐受性
5株乳酸菌在模拟胃液中的存活率结果如图3-A所示。经过3 h的模拟胃液孵育后,5株乳酸菌的存活率出现了不同程度的下降。具体来说,罗伊氏粘液乳杆菌XJ-4和罗伊氏粘液乳杆菌XJ-47的存活率在90%以上,分别为96.46%和99.58%。然而乳酸片球菌XJ-7、乳酸片球菌XJ-14和乳酸片球菌XJ-24的存活率下降较为明显,为70%~80%,分别为79.13%、75.54%和73.30%。尽管如此,5株乳酸菌均能在模拟胃液中存活,其中罗伊氏粘液乳杆XJ-47的耐受能力最强。
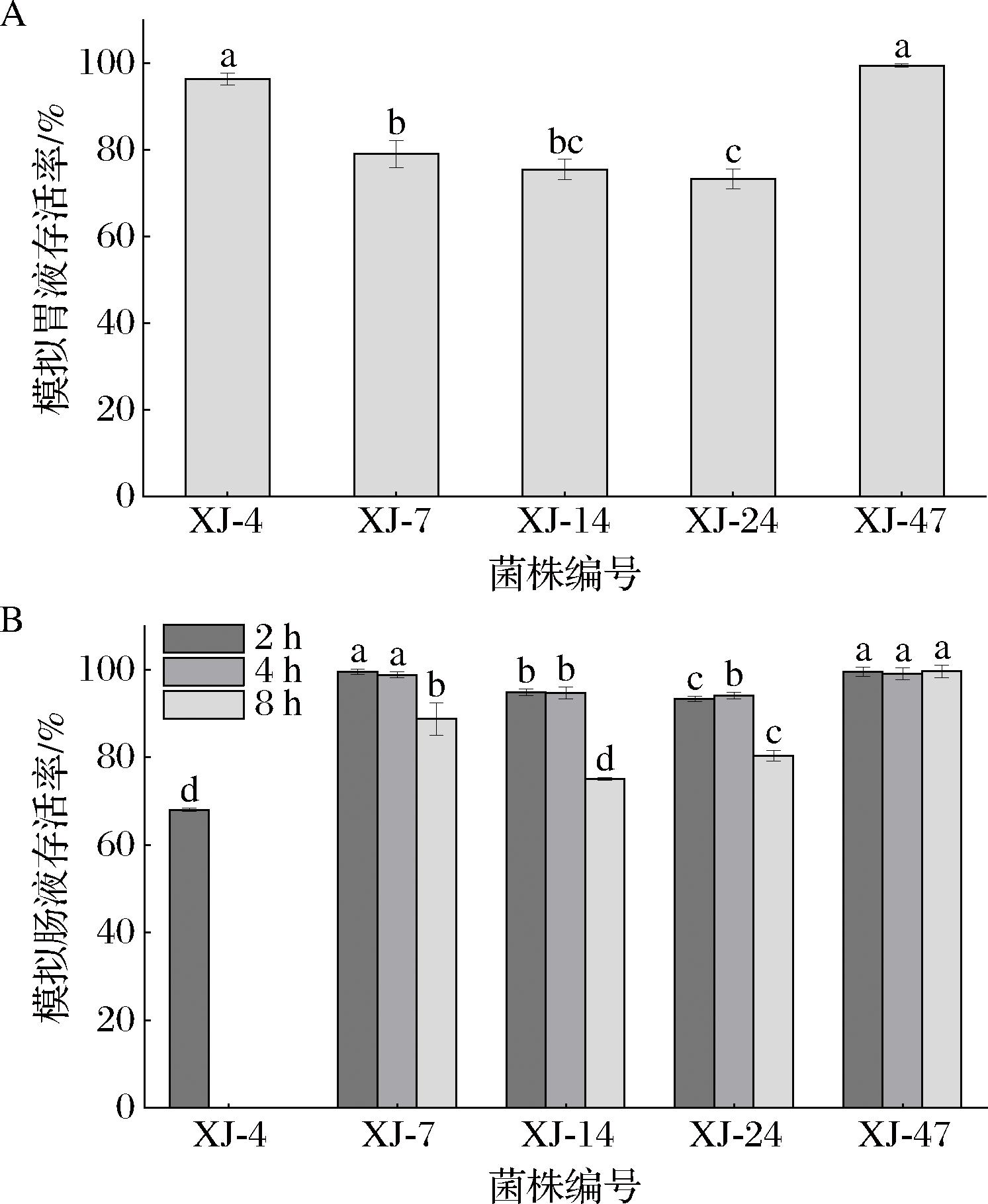
A-模拟胃液;B-模拟肠液
图3 五株乳酸菌在模拟胃肠液中的存活率
Fig.3 Survival rates of five lactic acid bacteria strains in simulated gastrointestinal fluids
在模拟胃液中孵育3 h后,将乳酸菌转移至模拟肠液中孵育8 h。试验结果如图3-B所示,5株乳酸菌中只有罗伊氏粘液乳杆XJ-4的存活率降至0,而其余4株乳酸菌的存活率随孵育时间的延长呈现出不同程度的下降。具体来说,罗伊氏粘液乳杆XJ-47在模拟肠液中表现出最强的活力,8 h存活率仍保持在90%以上。相反,乳酸片球菌XJ-7、乳酸片球菌XJ-24、乳酸片球菌XJ-14对模拟肠液较为敏感,8 h的存活率分别降至88.75%、80.43%、75.08%。除了罗伊氏粘液乳杆XJ-4,其余4株菌在模拟肠液中孵育8 h后的存活菌数均超过107 CFU/mL。
2.2.2 胆盐耐受性
在人体肠道中,胆盐的浓度随消化时间变化而变化,3 g/L是胆盐在肠道中的平均浓度[18]。因此,本文评估了5株乳酸菌在3 g/L胆盐浓度下的耐受性。结果如图4所示,经过4 h的孵育,5株乳酸菌均能耐受浓度为3 g/L的胆盐。乳酸片球菌XJ-24、乳酸片球菌XJ-7、罗伊氏粘液乳杆XJ-47的耐受性分别为89.72%、87.80%、86.81%,彼此间无显著性差异(P>0.05)。相反,罗伊氏粘液乳杆XJ-4和乳酸片球菌XJ-14的耐受性显著低于以上3株乳酸菌(P<0.05),分别为80.14%、78.45%。
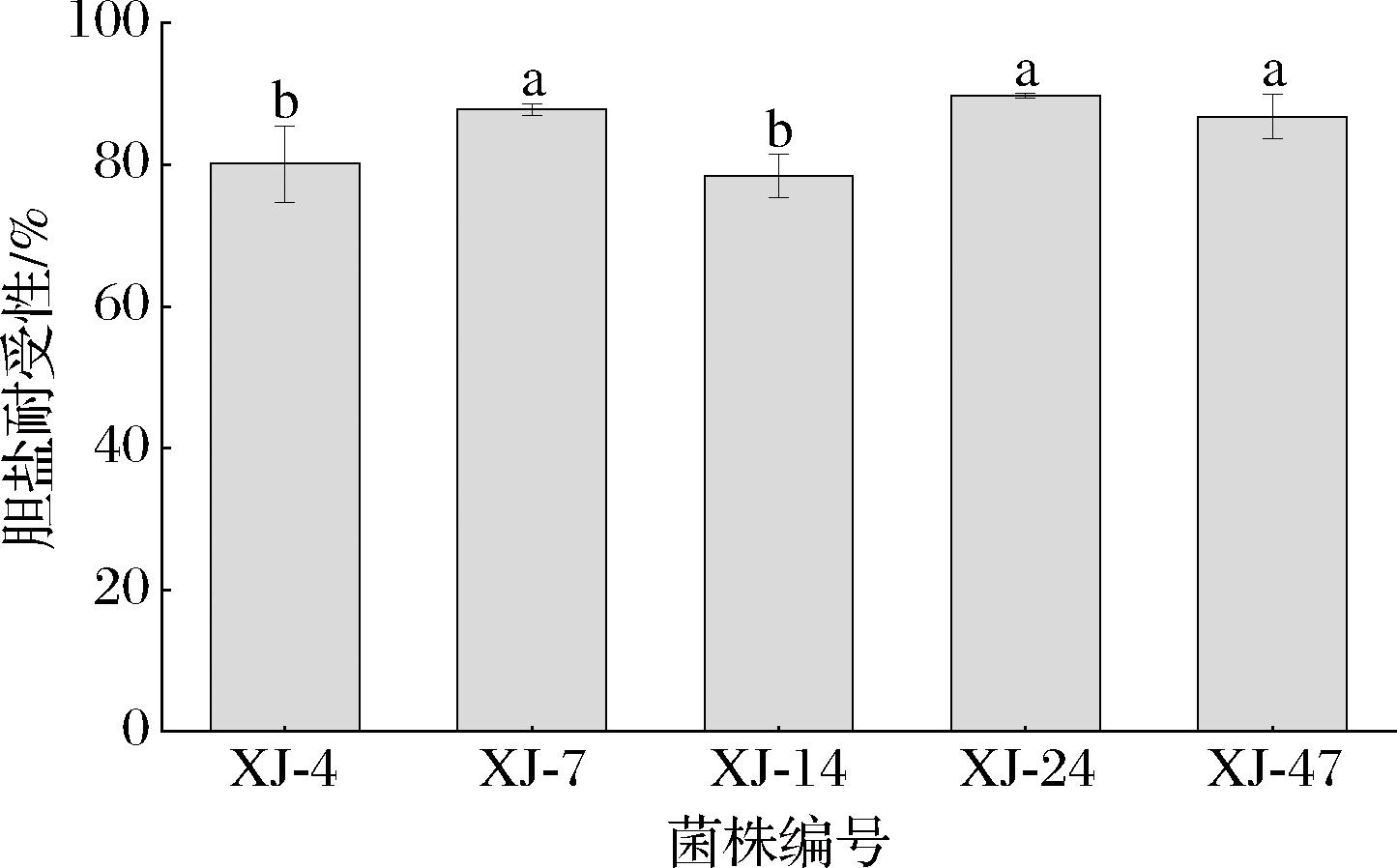
图4 五株乳酸菌在3 g/L胆盐浓度下的耐受性
Fig.4 Tolerance of five lactic acid bacteria strains at 3 g/L bile salt concentration
2.2.3 自聚集试验
菌株的自聚集是指相同的菌株结合形成细胞簇,这有助于生物被膜的形成和在宿主肠上皮细胞中黏附以阻止致病菌株的黏附和侵袭,并在一定程度上与致病菌的清除有关[19]。本文评估了5株乳酸菌在孵育2 h和4 h后的自聚集率,结果见图5-A。孵育2 h后的自聚集率3.09%~21.08%,而孵育4 h后的自聚集率显著增加(P<0.05),为34.23%~71.52%。具体而言,在孵育4 h时,罗伊氏粘液乳杆XJ-4的自聚集率最高为71.52%,罗伊氏粘液乳杆XJ-47、乳酸片球菌XJ-14、乳酸片球菌XJ-7、乳酸片球菌XJ-24的自聚集率分别为56.14%、41.24%、39.85%、34.23%。
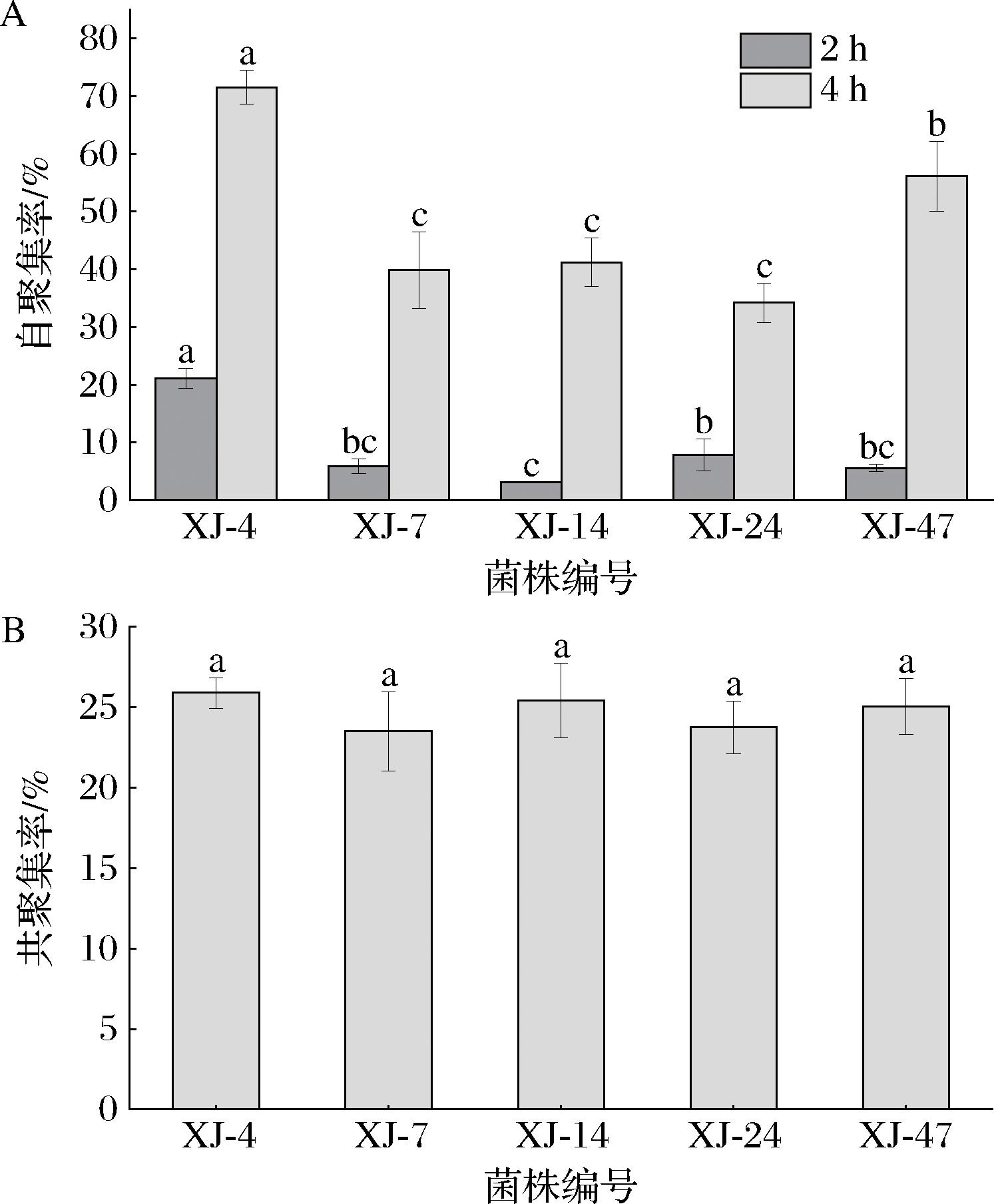
A-自聚集率;B-共聚集率
图5 五株乳酸菌的自聚集率和共聚集率
Fig.5 Auto-aggregation and co-aggregation of five lactic acid bacteria strains
2.2.4 共聚集试验
与致病菌的共聚集能力是益生菌的重要特征,有助于避免致病菌在肠道中定殖[20]。如图5-B所示,5株乳酸菌与单增李斯特菌共聚集率为23.49%~25.88%,彼此间无显著性差异(P>0.05)。SHEN等[21]的研究中,10株乳酸菌与单增李斯特菌在4 h的共聚集率仅为8.76%~15.20%。本研究中5株乳酸菌均能与单增李斯特菌共聚集,这可能使它们在宿主肠道中具有抗单增李斯特菌感染的优势。
2.2.5 细胞表面疏水性
乳酸菌的细胞表面疏水性被认为是黏附于人肠上皮细胞的关键因素[13]。本试验使用二甲苯测试了5株乳酸菌的细胞表面疏水性,以评估它们的黏附能力。结果如表1所示,5株乳酸菌对二甲苯的表面疏水性为15.51%~40.29%。其中乳酸片球菌XJ-14和乳酸片球菌XJ-7的疏水性最高,分别为40.29%、35.58%,二者之间无显著性差异(P>0.05)。相反,罗伊氏粘液乳杆XJ-47的疏水性最低,为15.51%。
表1 五株乳酸菌的细胞表面疏水性 单位:%
Table 1 Cell surface hydrophobicity of five lactic acid bacteria strains
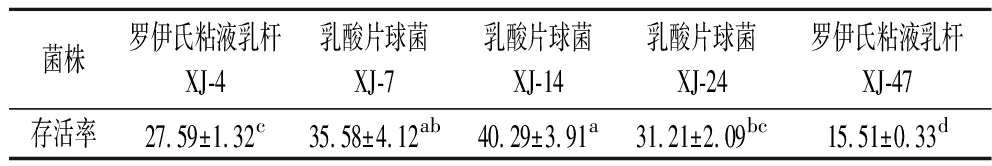
菌株罗伊氏粘液乳杆XJ-4乳酸片球菌XJ-7乳酸片球菌XJ-14乳酸片球菌XJ-24罗伊氏粘液乳杆XJ-47存活率27.59±1.32c35.58±4.12ab40.29±3.91a31.21±2.09bc15.51±0.33d
注:不同小写字母表示差异显著(P<0.05)。
2.3 安全性评价
2.3.1 抗生素耐药性
益生菌具有耐药性可能会导致与抗生素耐药性相关的基因在肠道菌群中的转移[22]。表2显示了这5株菌对10种常见的抗生素敏感性结果。结果表明,所有菌株对青霉素、头孢曲松、红霉素和氯霉素敏感,而对环丙沙星和复方新诺明产生了耐药性。另外,这5株菌对氨苄西林、四环素、林可霉素和庆大霉素的抗生素耐药性存在差异。
表2 五株乳酸菌的抗生素耐药性
Table 2 Antibiotic resistance of five lactic acid bacteria strains
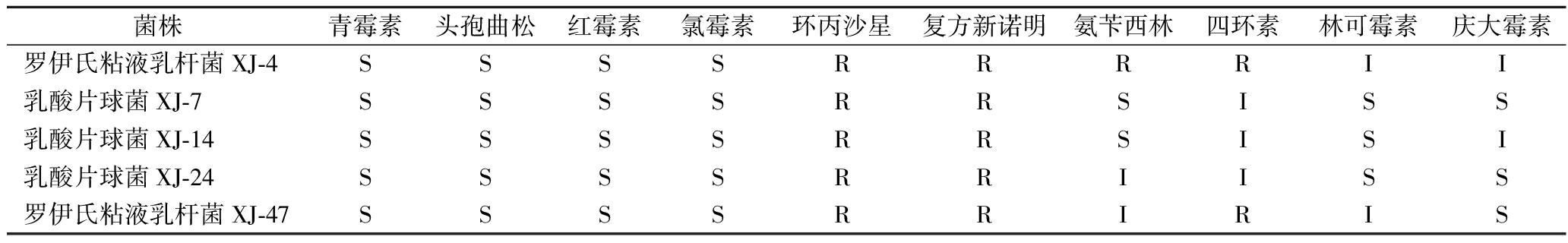
菌株青霉素头孢曲松红霉素氯霉素环丙沙星复方新诺明氨苄西林四环素林可霉素庆大霉素罗伊氏粘液乳杆菌XJ-4SSSSRRRRII乳酸片球菌XJ-7SSSSRRSISS乳酸片球菌XJ-14SSSSRRSISI乳酸片球菌XJ-24SSSSRRIISS罗伊氏粘液乳杆菌XJ-47SSSSRRIRIS
注:R为耐药;I为中度敏感;S为敏感。
2.3.2 溶血活性
在含有5%无菌脱纤维羊血的哥伦比亚琼脂平板上,菌落周围出现清晰透明圈(β-溶血)时,表示溶血活性为阳性;而出现绿色区域(α-溶血)或无清晰区域(γ-溶血)时,表示溶血活性为阴性[23]。如图6所示,这5株乳酸菌的菌落周围均未观察到清晰区域,因此属于γ-溶血,即溶血活性为阴性。相反,阳性对照金黄色葡萄球菌则呈现出明显的透明区域,为α-溶血,表明其具有溶血活性。结果表明,在溶血活性方面,这5株菌是安全的。

图6 五株乳酸菌和金黄色葡萄球菌的溶血试验
Fig.6 Hemolysis test for five lactic acid bacteria strains and S.aureus
2.4 原位抑制单增李斯特菌的效果
2.4.1 乳酸菌与单增李斯特菌同时接种巴氏灭菌乳
5株乳酸菌与单增李斯特菌分别同时接种巴氏灭菌乳的单增李斯特菌生长情况如图7-A所示。对照组中的单增李斯特菌表现出快速的生长,在24 h内活菌数达到7.31 lg CFU/mL的最高水平。然而,从12 h开始,与对照组相比,5株乳酸菌均能显著降低单增李斯特菌的活菌数(P<0.05)。在24 h与对照组相比,5个不同乳酸菌组的单增李斯特菌活菌数降低了0.99~1.71 lg CFU/mL。乳酸片球菌XJ-24组显示出最佳原位抑制效果,降低了1.71 lg CFU/mL,但是与乳酸片球菌XJ-14组、罗伊氏粘液乳杆XJ-4组、乳酸片球菌XJ-7组相比没有显著性差异(P>0.05)。而罗伊氏粘液乳杆XJ-47组的效果最差,降低了0.99 lg CFU/mL。
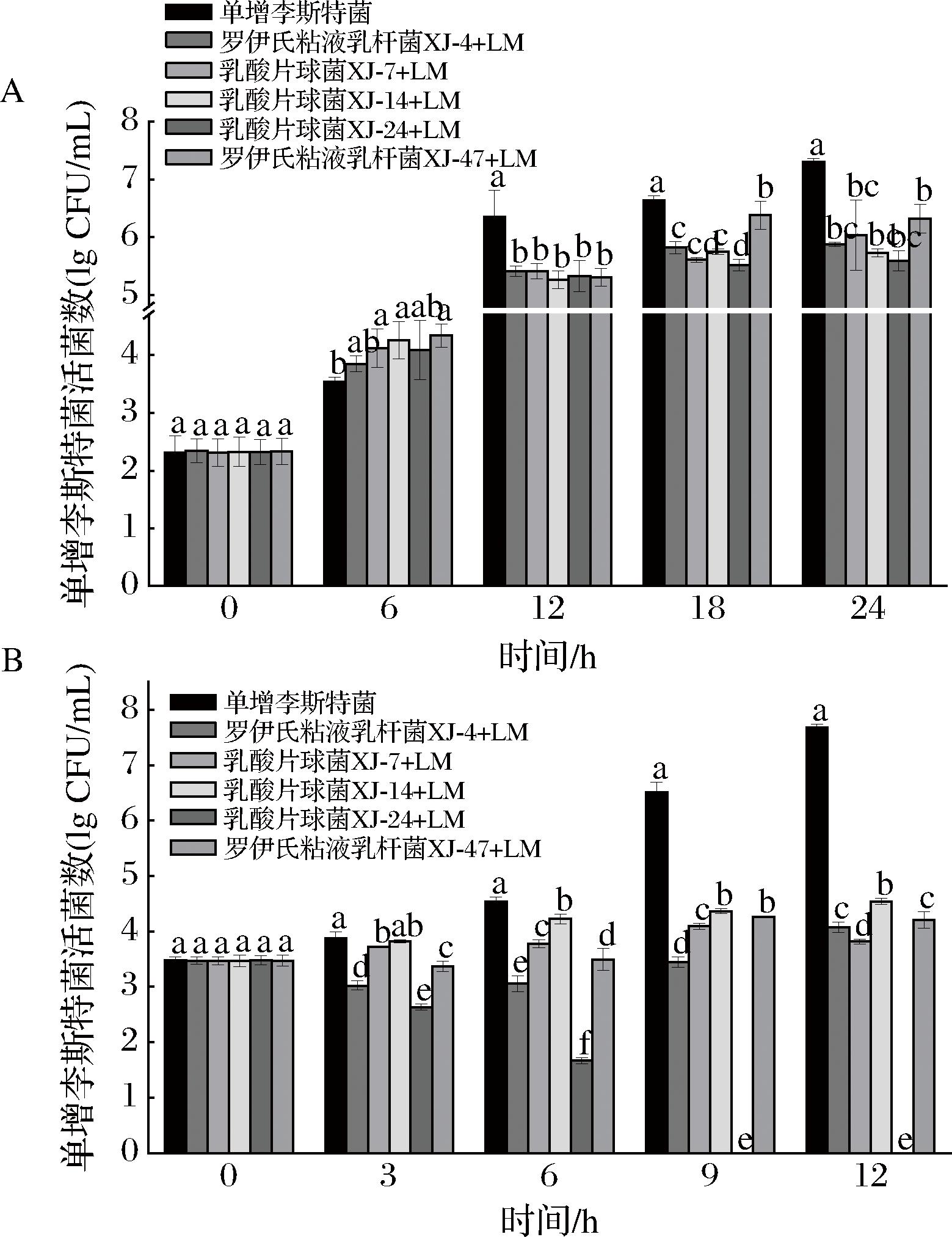
A-单增李斯特菌与乳酸菌共培养的生长情况;B-单增李斯特菌在乳酸菌预发酵巴氏灭菌乳中的生长情况
图7 五株乳酸菌分别在巴氏灭菌乳中对单增李斯特菌的原位抑制效果
Fig.7 In situ inhibition of L.monocytogenes by five individual lactic acid bacteria strains in pasteurized milk
5株乳酸菌与单增李斯特菌分别同时接种巴氏灭菌乳的生长情况如表3所示。在共培养的第24 h,与对照组相比,乳酸片球菌XJ-24的生长并未受影响,其活菌数仅降低了0.02 lg CFU/mL。然而,其余4株乳酸菌的活菌数与对照组相比出现不等程度的下降,为0.34~0.77 lg CFU/mL,这可能是与单增李斯特菌竞争营养物质所导致的。
表3 五株乳酸菌在巴氏灭菌乳中分别与单增李斯特菌共培养的生长情况
Table 3 Growth of five lactic acid bacteria strains co-cultured with L.monocytogenes in pasteurized milk
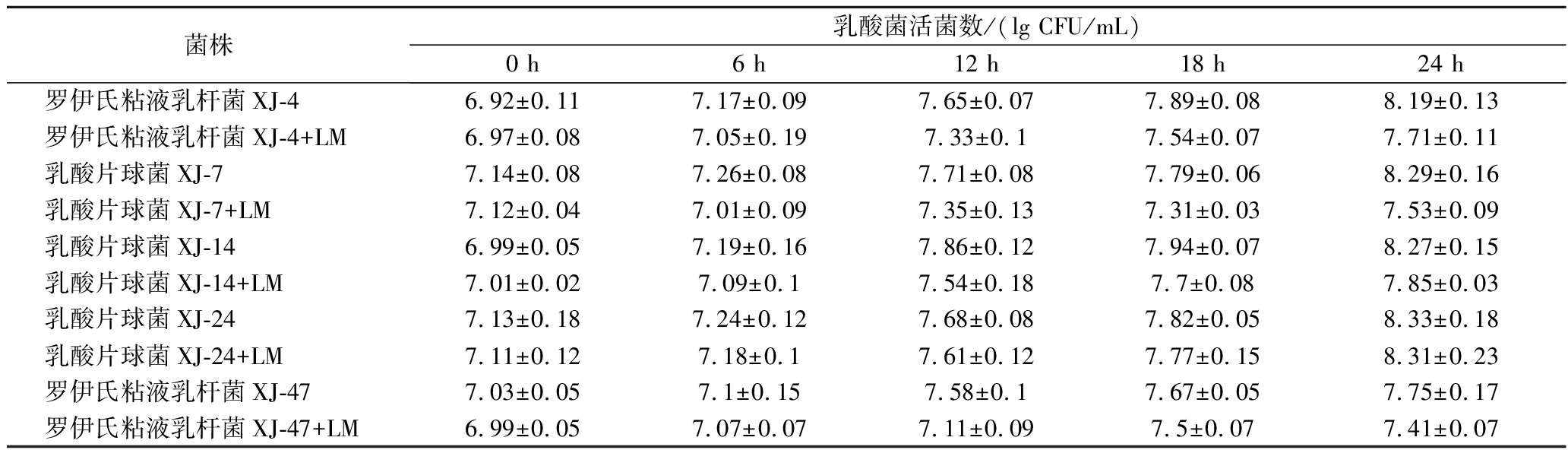
菌株乳酸菌活菌数/(lg CFU/mL)0 h6 h12 h18 h24 h罗伊氏粘液乳杆菌XJ-46.92±0.117.17±0.097.65±0.077.89±0.088.19±0.13罗伊氏粘液乳杆菌XJ-4+LM6.97±0.087.05±0.197.33±0.17.54±0.077.71±0.11乳酸片球菌XJ-77.14±0.087.26±0.087.71±0.087.79±0.068.29±0.16乳酸片球菌XJ-7+LM7.12±0.047.01±0.097.35±0.137.31±0.037.53±0.09乳酸片球菌XJ-146.99±0.057.19±0.167.86±0.127.94±0.078.27±0.15乳酸片球菌XJ-14+LM7.01±0.027.09±0.17.54±0.187.7±0.087.85±0.03乳酸片球菌XJ-247.13±0.187.24±0.127.68±0.087.82±0.058.33±0.18乳酸片球菌XJ-24+LM7.11±0.127.18±0.17.61±0.127.77±0.158.31±0.23罗伊氏粘液乳杆菌XJ-477.03±0.057.1±0.157.58±0.17.67±0.057.75±0.17罗伊氏粘液乳杆菌XJ-47+LM6.99±0.057.07±0.077.11±0.097.5±0.077.41±0.07
注:LM为单增李斯特菌。
2.4.2 乳酸菌预发酵巴氏灭菌乳后接种单增李斯特菌
本研究评估了5株乳酸菌预发酵巴氏灭菌乳12 h后对单增李斯特菌的原位抑制效果,结果如图7-B所示。在对照组中单增李斯特菌的活菌数从0 h的3.48 lg CFU/mL增加到12 h的7.68 lg CFU/mL。然而,经过不同乳酸菌预发酵巴氏灭菌乳的实验组表现出不同的原位抑菌效果。自3 h开始,5株乳酸菌均能显著抑制单增李斯特菌的生长(P<0.05)。在12 h与对照组相比,罗伊氏粘液乳杆XJ-4、乳酸片球菌XJ-7、乳酸片球菌XJ-14、罗伊氏粘液乳杆XJ-47发酵乳组的单增李斯特菌活菌数分别降低了3.61、3.86、3.14、3.48 lg CFU/mL。然而,值得注意的是,乳酸片球菌XJ-24发酵乳组表现出最强的原位抑制效果,该组的单增李斯特菌在9 h开始其活菌数降至0。
2.4.3 扫描电子显微镜观察
为了更好地了解乳酸片球菌XJ-24与单增李斯特菌共培养的状态,本文收集了共培养的菌液,并进行了扫描电子显微镜观察。结果如图8所示,乳酸片球菌XJ-24呈球状,菌体饱满且表面光滑,并可黏附在单增李斯特菌的表面。未经处理的单增李斯特菌呈杆状,表面光滑且结构完整。然而,被乳酸片球菌XJ-24粘附的单增李斯特菌细胞表面变得粗糙不平,出现凹陷和畸形,细胞形态受到严重破坏,甚至观察到细胞破裂。XU等[17]报道了一株具有抑菌活性且产胞外多糖的L.casei NA-2与蜡样芽孢杆菌共培养时可黏附并破坏蜡样芽孢杆菌表面,使其存活率降低。乳酸菌产生的次级代谢物胞外多糖,可介导细胞间的相互作用[17]。YANG等[24]报道了L.plantarum 4-10与单增李斯特菌共培养时,可通过破坏细胞膜结构来杀死单增李斯特菌,但未观察到两细胞间的黏附。ROUHI等[25]发现L.plantarum TW57-4产生的CFS可有效破坏单增李斯特菌的细胞结构,引起胞内物质泄漏,进而导致其死亡。本研究中,乳酸片球菌XJ-24的代谢产物抑菌活性最强,其在巴氏灭菌乳中预发酵12 h可增殖和积累代谢产物。因此,结合扫描电镜的结果可推测,乳酸片球菌XJ-24与单增李斯特菌黏附及其代谢产物,可能是导致单增李斯特菌在乳酸片球菌XJ-24预发酵巴氏灭菌乳中活菌数降为0的原因之一。
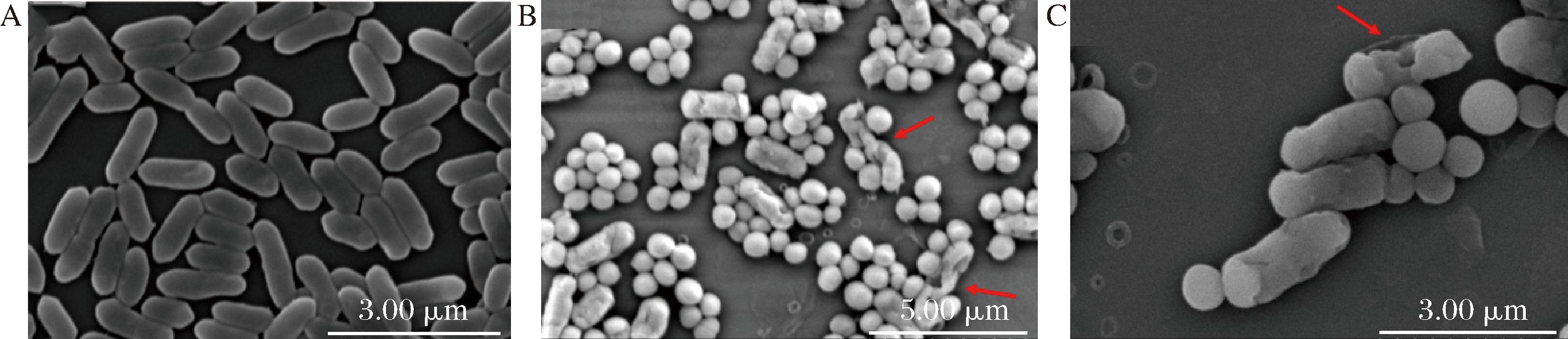
A-未处理的单增李斯特菌;B、C-单增李斯特菌与乳酸片球菌XJ-24共培养
图8 乳酸片球菌XJ-24与单增李斯特菌共培养的扫描电子显微镜图像
Fig.8 Scanning electron microscopy image of P.acidilactici XJ-24 co-cultured with L.monocytogenes
3 结论与讨论
本文从新疆酸奶疙瘩中筛选得到26株乳酸菌,其中罗伊氏粘液乳杆菌XJ-4、乳酸片球菌XJ-7、乳酸片球菌XJ-14、乳酸片球菌XJ-24和罗伊氏粘液乳杆菌XJ-47具有较强的抑制单增李斯特菌活性,随后重点评估了这5株菌的益生潜力、安全性及在巴氏灭菌乳中原位抑制单增李斯特菌的效果。
益生菌被定义为在摄入足够量时能够给宿主带来健康益处的活微生物[26]。然而,人体胃肠道中的胃酸、胆盐和消化酶对益生菌的生存极为不利[27-28]。因此,益生菌对这些因素的体外耐受性通常用于预测它们在宿主肠道内的表现[29]。除罗伊氏粘液乳杆菌XJ-4外其余4株乳酸菌均表现出良好的模拟胃肠液耐受性。在模拟肠液孵育8 h后,乳酸片球菌XJ-7、乳酸片球菌XJ-14、乳酸片球菌XJ-24和罗伊士粘液乳杆菌XJ-47存活菌数均大于107CFU/mL,WEI等[30]也报道了类似的结果。此外,罗伊士粘液乳杆菌XJ-47在模拟胃液和模拟肠液中的耐受性最高,存活率分别为99.58%和99.60%,高于之前报道的乳酸菌在相同条件下的存活率[13, 29-30]。5株乳酸菌均能耐受3 g/L的胆盐,耐受性为78.45%~89.72%,该结果与LI等[31]报道的相似。
益生菌在胃肠道内定殖的前提是其能够黏附于肠黏膜,而这种粘附能力与益生菌的自聚集能力和细胞表面疏水性密切相关 [22, 29]。本研究中,5株乳酸菌均表现出良好的自聚集率,在4 h自聚集率范围为34.23%~71.52%。FERRARI等[32]评估了58株乳酸菌在4 h内的自聚集率,其中最高的自聚集率仅为36.65%。在细胞表面疏水性方面,5株乳酸菌对二甲苯的疏水性在15.51%~40.29%。参照TYFA等[33]对细菌疏水性程度的划分标准,除了罗伊氏粘液乳杆XJ-47表现为亲水性,其余4株乳酸菌均为中度疏水性。
乳酸菌通常被认为是安全的,但由于菌株特异性,仍需评估新分离乳酸菌的安全性,如抗生素耐药性、溶血活性等[34]。本研究中,5株乳酸菌对多种抗生素表现出敏感性,但对环丙沙星和复方新诺明产生了耐药性。此前也有研究报道乳酸菌对环丙沙星、复方新诺明具有耐药性[16, 35]。此外,这5株乳酸菌无溶血活性。总体而言,这5株乳酸菌在抗生素耐药性和溶血活性方面是安全的。
单增李斯特菌易污染乳制品,因此进一步评估了上述5株乳酸菌在巴氏灭菌乳中与单增李斯特菌共培养的原位抑制效果。在巴氏灭菌乳中共培养24 h后,5株乳酸菌均可显著降低单增李斯特菌的活菌数,其中乳酸片球菌XJ-24表现最佳,降低了1.71 lg CFU/mL,但是与初始活菌数相比并不能抑制其生长,这与HUANG等[16]报道的结果相似。在预发酵巴氏灭菌乳中,乳酸片球菌XJ-24的原位抑制效果更为显著,在第9 h单增李斯特菌活菌数降为0,这与MIRHOSSEINI等[36]报道的E.faecium a2抑菌效果相似。结合扫描电镜结果推测,乳酸片球菌XJ-24与单增李斯特菌黏附及其代谢产物可能是其产生强烈的原位抑制效果的原因之一。后续研究应重点探讨乳酸片球菌XJ-24代谢产物的抑菌机制,并构建乳酸片球菌XJ-24与单增李斯特菌竞争生长模型,以深入解析其原位抑菌机制,为其应用提供理论基础。
综上所述,这5株乳酸菌表现出良好的益生特性,对多种抗生素敏感,无溶血活性,并在巴氏灭菌乳中可显著抑制单增李斯特菌,尤其是乳酸片球菌XJ-24的抑菌效果最为显著。该研究为上述5株乳酸菌作为益生菌及乳制品保护性发酵剂的应用提供了重要的理论基础。
[1] WU M J, DONG Q L, MA Y, et al.Potential antimicrobial activities of probiotics and their derivatives against Listeria monocytogenes in food field:A review [J].Food Research International, 2022, 160:111733.
[2] BUCHANAN R L, GORRIS L G M, HAYMAN M M, et al.A review of Listeria monocytogenes:An update on outbreaks, virulence, dose-response, ecology, and risk assessments [J].Food Control, 2017, 75:1-13.
[3] GARC A M J, RU
A M J, RU Z F, ASURMENDI P, et al.Searching potential candidates for development of protective cultures:Evaluation of two Lactobacillus strains to reduce Listeria monocytogenes in artificially contaminated milk [J].Journal of Food Safety, 2020, 40(1):e12723.
Z F, ASURMENDI P, et al.Searching potential candidates for development of protective cultures:Evaluation of two Lactobacillus strains to reduce Listeria monocytogenes in artificially contaminated milk [J].Journal of Food Safety, 2020, 40(1):e12723.
[4] MELO J, ANDREW P W, FALEIRO M L. Listeria monocytogenes in cheese and the dairy environment remains a food safety challenge:The role of stress responses [J].Food Research International, 2015, 67:75-90.
[5] CHEN Y T, CHEN M T, WANG J, et al.Heterogeneity, characteristics, and public health implications of Listeria monocytogenes in ready-to-eat foods and pasteurized milk in China [J].Frontiers in Microbiology, 2020, 11:642.
[6] NIETO-ARRIBAS P, POVEDA J M, SESE A S, et al.Technological characterization of Lactobacillus isolates from traditional Manchego cheese for potential use as adjunct starter cultures [J].Food Control, 2009, 20(12):1092-1098.
A S, et al.Technological characterization of Lactobacillus isolates from traditional Manchego cheese for potential use as adjunct starter cultures [J].Food Control, 2009, 20(12):1092-1098.
[7] KUDA T, FUJII A, NAKAMURA A, et al.Inhibitory effect of Lactococcus lactis Nagasaki-SU6 isolated from algal beach cast on Listeria monocytogenes during and after fermentation of cow-and soymilk [J].Food Bioscience, 2024,58:103762.
[8] IVANOVIC M, MIRKOVIC N, MIRKOVIC M, et al.Autochthonous Enterococcus durans PFMI565 and Lactococcus lactis subsp.lactis BGBU1-4 in Bio-Control of Listeria monocytogenes in Ultrafiltered Cheese [J].Foods, 2021, 10(7):1448.
[9] PREZZI L E, LEE S H I, NUNES V M R, et al.Effect of Lactobacillus rhamnosus on growth of Listeria monocytogenes and Staphylococcus aureus in a probiotic Minas Frescal cheese [J].Food Microbiology, 2020, 92:103557.
[10] YAP P C, MATRAHIM N A, ABUBAKAR S, et al.Antilisterial potential of lactic acid bacteria in eliminating Listeria monocytogenes in host and ready-to-eat food application[J].Microbiology Research, 2021, 12(1):234-257.
[11] LI L, ZHANG L X, ZHANG T T, et al.(Meta)genomics-assisted screening of novel antibacterial lactic acid bacteria strains from traditional fermented milk from Western China and their bioprotective effects on cheese [J].LWT, 2023, 175:114507.
[12] SONG J J, PENG S D, YANG J, et al.Isolation and identification of novel antibacterial peptides produced by Lactobacillus fermentum SHY10 in Chinese pickles [J].Food Chemistry, 2021, 348:129097.
[13] HAN Q, KONG B H, CHEN Q, et al.In vitro comparison of probiotic properties of lactic acid bacteria isolated from Harbin dry sausages and selected probiotics [J].Journal of Functional Foods, 2017, 32:391-400.
[14] DIVYASHREE S, RAMU R, SREENIVASA M Y.Evaluation of new candidate probiotic lactobacillus strains isolated from a traditional fermented food-multigrain-millet dosa batter [J].Food Bioscience, 2024, 57:103450.
[15] RODR GUEZ-S
GUEZ-S NCHEZ S, FERN
NCHEZ S, FERN NDEZ-PACHECO P, SESE
NDEZ-PACHECO P, SESE A S, et al.Selection of probiotic Lactobacillus strains with antimicrobial activity to be used as biocontrol agents in food industry [J].LWT, 2021, 143:111142.
A S, et al.Selection of probiotic Lactobacillus strains with antimicrobial activity to be used as biocontrol agents in food industry [J].LWT, 2021, 143:111142.
[16] HUANG X L, HE Y, ZHONG C C, et al.Screening of probiotic strains of Lactiplantibacillus plantarum from Hu sheep and its ability to inhibit Listeria monocytogenes in pasteurized milk[J].LWT, 2023, 182:114883.
[17] XU X Q, PENG Q, ZHANG Y W, et al.Antibacterial potential of a novel Lactobacillus casei strain isolated from Chinese northeast sauerkraut and the antibiofilm activity of its exopolysaccharides [J].Food &Function, 2020, 11(5):4697-4706.
[18] GUO C F, ZHANG L W, LI J Y, et al.Screening of bile salt hydrolase-active lactic acid bacteria for potential cholesterol-lowering probiotic use [J].Advanced Materials Research, 2011, 345:139-146.
[19] LI K X, GU Q Y, YANG W H, et al.In vitro screening and probiotic evaluation of anti-obesity and antioxidant lactic acid bacteria [J].Food Bioscience, 2023, 54:102844.
[20] COZZOLINO A, VERGALITO F, TREMONTE P, et al.Preliminary evaluation of the safety and probiotic potential of Akkermansia muciniphila DSM 22959 in comparison with Lactobacillus rhamnosus GG [J].Microorganisms, 2020, 8(2):189.
[21] SHEN F, ZHUANG J C, WANG Q Q, et al.Screening of novel probiotics with intestinal peristalsis-promoting potential based on in vitro and in vivo investigations [J].Food Bioscience, 2023, 53:102681.
[22] WANG H Y, LI L.Comprehensive evaluation of probiotic property, hypoglycemic ability and antioxidant activity of lactic acid bacteria[J].Foods, 2022, 11(9):1363.
[23] MARTíN I, BARBOSA J, PEREIRA S I A, et al.Study of lactic acid bacteria isolated from traditional ripened foods and partial characterization of their bacteriocins [J].LWT, 2023, 173:114300.
[24] YANG X Y, PENG Z, HE M N, et al.Screening, probiotic properties, and inhibition mechanism of a Lactobacillus antagonistic to Listeria monocytogenes [J].Science of The Total Environment, 2024, 906:167587.
[25] ROUHI A, FALAH F, AZGHANDI M, et al.Investigating the effect of Lactiplantibacillus plantarum TW57-4 in preventing biofilm formation and expression of virulence genes in Listeria monocytogenes ATCC 19115 [J].LWT, 2024, 191:115669.
[26] CREMON C, BARBARO M R, VENTURA M, et al.Pre-and probiotic overview [J].Current Opinion in Pharmacology, 2018, 43:87-92.
[27] LI S, ZHANG Y-X.Sensitive delivery systems and novel encapsulation technologies for live biotherapeutic products and probiotics [J].Critical Reviews in Microbiology, 2024, 50(3):371-384.
[28] GUO Z, WANG J C, YAN L Y, et al.In vitro comparison of probiotic properties of Lactobacillus casei Zhang, a potential new probiotic, with selected probiotic strains [J].LWT-Food Science and Technology, 2009, 42(10):1640-1646.
[29] CAI Z O, GUO Y Q, ZHENG Q, et al.Screening of a potential probiotic Lactiplantibacillus plantarum NUC08 and its synergistic effects with yogurt starter [J].Journal of Dairy Science, 2024, 107(5):2760-2773.
[30] WEI B L, PENG Z, XIAO M Y, et al.Three lactic acid bacteria with anti-obesity properties:In vitro screening and probiotic assessment [J].Food Bioscience, 2022, 47:101724.
[31] LI C, WANG S L, CHEN S, et al.Screening and characterization of Pediococcus acidilactici LC-9-1 toward selection as a potential probiotic for poultry with antibacterial and antioxidative properties [J].Antioxidants, 2023, 12(2):215.
[32] DA SILVA FERRARI I, DE SOUZA J V, RAMOS C L, et al.Selection of autochthonous lactic acid bacteria from goat dairies and their addition to evaluate the inhibition of Salmonella typhi in artisanal cheese [J].Food Microbiology, 2016, 60:29-38.
[33] TYFA A, ![]() A, ZABIELSKA J.Evaluation of hydrophobicity and quantitative analysis of biofilm formation by Alicyclobacillus sp.[J].Acta Biochimica Polonica, 2015, 62(4):785-790.
A, ZABIELSKA J.Evaluation of hydrophobicity and quantitative analysis of biofilm formation by Alicyclobacillus sp.[J].Acta Biochimica Polonica, 2015, 62(4):785-790.
[34] JIA X X, JIA M M, GAO X, et al.Demonstration of safety characteristics and effects on gut microbiota of Lactobacillus gasseri HMV18 [J].Food Science and Human Wellness, 2024, 13(2):611-620.
[35] 张媛媛, 赵梦迪, 李悦垚, 等.犬源乳酸片球菌GLP236的分离鉴定,体外益生功能及小鼠安全性评价[J].动物营养学报, 2023, 35(12):8148-8160.ZHANG Y Y, ZHAO M D, LI Y Y, et al.Isolation, Identification, in vitro probiotic function and mouse safety evaluation of canine-derived Pediococcus acidilactici GLP236[J].Chinese Journal of Animal Nutrition, 2023, 35(12):8148-8160.
[36] MIRHOSSEINI M, NAHVI I, EMTIAZI G, et al.Characterisation of anti-Listeria monocytogenes bacteriocins from Enterococcus faecium strains isolated from dairy products [J].International Journal of Dairy Technology, 2010, 63(1):55-61.