氨基葡萄糖(glucosamine, GlcN)的分子式为C6H13NO5,是一种天然的水溶性单糖,在人体关节组织中含量较高[1]。GlcN及其衍生物具有抗炎[2-3]、抗菌[4]和抗癌[5-6]等生物学功能,且在生化材料[7]、食品[8]和化妆品[9]等方面被广泛应用。生产GlcN的方法包括化学水解法[10]、微生物发酵法[11]、全细胞催化法和酶转化法[12]。然而,这些方法存在诸多限制,例如化学水解法会造成严重的环境污染[13];微生物发酵法只能生成中间产物乙酰氨基葡萄糖(N-acetylglucosamine, GlcNAc),需要进一步酸水解才能生成GlcN;另外,全细胞催化法对体系的条件要求苛刻[14]。相较之下,酶转化法制备GlcN具有反应条件温和、催化效率及产物转化率高以及环境友好等优势[12],是工业化生产GlcN的理想方案。
TANAKA等[15]在极端嗜热古菌(Thermococcus kodakararaensis KODl)中挖掘到一种新的几丁质代谢途径,并在该途径中发现了几丁二糖脱乙酰酶(diacetylchitobiose deacetylase, Dac, EC 3.5.1.136),其可以催化GlcNAc脱去乙酰基团生成GlcN[16]。刘波等[17]基于掘越氏热球菌(Pyrococcus horikoshii)的全基因组测序结果,发现其基因组中具有一段与T. kodakararaensis KOD1中几丁质代谢途径相似的基因序列,并证明来源于P.horikoshii的Dac同样能够脱去GlcNAc的乙酰基团生成GlcN。为了提高GlcN的制备效率,Dac的酶学性质和表达水平成为研究热点[18]。例如,HUANG等[19]通过定点饱和诱变筛选出的PhDac突变体M14的催化效率(kcat/Km)提高了约2.21倍,比活性提高了70.02%。而在提升Dac表达量方面,通过优化RBS序列、使用启动子Pveg过表达支架蛋白EzrA、敲除肽聚糖水解酶的编码基因lytC,最终重组枯草芽孢杆菌(Bacillus subtilis)的胞外Dac活性达到6 357.38 U/mL[20]。
B.subtilis作为典型的工业模式菌株,因其对培养基要求低和高效的蛋白分泌能力常被作为生产酶蛋白的细胞工厂[21]。在前期研究中,本文设计了一种新型的基于细菌的生物传感器,能够将GlcN转化为正相关的荧光信号,获得的突变体S60I/R157T/F168S的催化活性相较初始提高1.8倍[22]。本研究在以B.subtilis作为宿主表达突变体S60I/R157T/F168S的基础上,通过筛选内源信号肽并对信号肽功能区域进行优化以实现Dac的高水平分泌;随后使用诱导型启动子替换原始启动子并优化诱导条件,进一步提高Dac的表达水平;最后对发酵条件进行优化和放大试验进一步验证工程菌株生产Dac的能力。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
本研究中使用的菌株和质粒见表1,其中E.coli DH5α用于构建质粒,B.subtilis C6用于表达Dac,P43-NMK-T0为本研究选取的出发质粒。
表1 本实验使用菌株和质粒
Table 1 Strains and plasmids used in this study

菌株和质粒特征来源E.coli DH5α大肠杆菌感受态本实验室保藏B.subtilis C6枯草芽孢杆菌感受态本实验室保藏BS-S60I/R157T/F168S/BS-P43-NMK-T0B.subtilis C6中转化P43-NMK-T0质粒本实验室保藏BS-P43-NMK-T1B.subtilis C6中转化P43-NMK-T1质粒本研究BS-P43-NMK-T2B.subtilis C6中转化P43-NMK-T2质粒本研究BS-P43-NMK-T3B.subtilis C6中转化P43-NMK-T3质粒本研究BS-P43-NMK-T4/BS-P43-NMK-T4-N0B.subtilis C6中转化P43-NMK-T4质粒本研究BS-P43-NMK-T5B.subtilis C6中转化P43-NMK-T5质粒本研究BS-P43-NMK-T6B.subtilis C6中转化P43-NMK-T6质粒本研究BS-P43-NMK-T7B.subtilis C6中转化P43-NMK-T7质粒本研究BS-P43-NMK-T8B.subtilis C6中转化P43-NMK-T8质粒本研究BS-P43-NMK-T9B.subtilis C6中转化P43-NMK-T9质粒本研究BS-P43-NMK-T10B.subtilis C6中转化P43-NMK-T10质粒本研究BS-P43-NMK-T11B.subtilis C6中转化P43-NMK-T11质粒本研究BS-P43-NMK-T12B.subtilis C6中转化P43-NMK-T12质粒本研究BS-P43-NMK-T4-N1B.subtilis C6中转化P43-NMK-T4-N1质粒本研究BS-P43-NMK-T4-N2B.subtilis C6中转化P43-NMK-T4-N2质粒本研究BS-P43-NMK-T4-N3B.subtilis C6中转化P43-NMK-T4-N3质粒本研究BS-P43-NMK-T4-N4B.subtilis C6中转化P43-NMK-T4-N4质粒本研究BS-P43-NMK-T4-N5B.subtilis C6中转化P43-NMK-T4-N5质粒本研究BS-NMK-T4-N1-PgracB.subtilis C6中转化NMK-T4-N1-Pgrac质粒本研究BS-NMK-T4-N1-PxylAB.subtilis C6中转化NMK-T4-N1-PxylA质粒本研究BS-NMK-T4-N1-PtetB.subtilis C6中转化NMK-T4-N1-Ptet 质粒本研究P43-NMK-T0E.coli - B.subtils穿梭质粒,(包含启动子P43,包含Dac突变体S60I/R157T/F168S,未融合信号肽)本实验室保藏P43-NMK-T1P43-NMK-T0 衍生质粒,包含启动子P43,包含Dac突变体S60I/R157T/F168S,融合信号肽SPAbnA本研究P43-NMK-T2P43-NMK-T0衍生质粒,包含启动子P43,包含Dac突变体S60I/R157T/F168S,融合信号肽SPBglS本研究P43-NMK-T3P43-NMK-T0衍生质粒,包含启动子P43,包含Dac突变体S60I/R157T/F168S,融合信号肽SPDacB本研究P43-NMK-T4/P43-NMK-N0P43-NMK-T0衍生质粒,包含启动子P43,包含Dac突变体S60I/R157T/F168S,融合信号肽SPNprB本研究P43-NMK-T5P43-NMK-T0衍生质粒,包含启动子P43,包含Dac突变体S60I/R157T/F168S,融合信号肽SPMpr本研究P43-NMK-T6P43-NMK-T0衍生质粒,包含启动子P43,包含Dac突变体S60I/R157T/F168S,融合信号肽SPLytD本研究P43-NMK-T7P43-NMK-T0衍生质粒,包含启动子P43,包含Dac突变体S60I/R157T/F168S,融合信号肽SPVpr本研究P43-NMK-T8P43-NMK-T0衍生质粒,包含启动子P43,包含Dac突变体S60I/R157T/F168S,融合信号肽SPYhfM本研究P43-NMK-T9P43-NMK-T0衍生质粒,包含启动子P43,包含Dac突变体S60I/R157T/F168S,融合信号肽SPYkvT本研究P43-NMK-T10P43-NMK-T0衍生质粒,包含启动子P43,包含Dac突变体S60I/R157T/F168S,融合信号肽SPYkvV本研究P43-NMK-T11P43-NMK-T0衍生质粒,包含启动子P43,包含Dac突变体S60I/R157T/F168S,融合信号肽SPYoaW本研究P43-NMK-T12P43-NMK-T0衍生质粒,包含启动子P43,包含Dac突变体S60I/R157T/F168S,融合信号肽SPYwfM本研究P43-NMK-T4-N1P43-NMK-T4衍生质粒,包含启动子P43,包含Dac突变体S60I/R157T/F168S,融合信号肽SPN1本研究P43-NMK-T4-N2P43-NMK-T4衍生质粒,包含启动子P43,包含Dac突变体S60I/R157T/F168S,融合信号肽SPN2本研究P43-NMK-T4-N3P43-NMK-T4衍生质粒,包含启动子P43,包含Dac突变体S60I/R157T/F168S,融合信号肽SPN3本研究P43-NMK-T4-N4P43-NMK-T4衍生质粒,包含启动子P43,包含Dac突变体S60I/R157T/F168S,融合信号肽SPN4本研究P43-NMK-T4-N5P43-NMK-T4衍生质粒,包含启动子P43,包含Dac突变体S60I/R157T/F168S,融合信号肽SPN5本研究NMK-T4-N1-PgracP43-NMK-T4-N1衍生质粒,包含启动子Pgrac100,包含Dac突变体S60I/R157T/F168S,融合信号肽SPN1本研究NMK-T4-N1-PxylAP43-NMK-T4-N1衍生质粒,包含启动子PxylA,包含Dac突变体S60I/R157T/F168S,融合信号肽SPN1本研究NMK-T4-N1-PtetP43-NMK-T4-N1衍生质粒,包含启动子Ptet,包含Dac突变体S60I/R157T/F168S,融合信号肽SPN1本研究
1.1.2 培养基
LB培养基(g/L):胰蛋白胨10,酵母提取物5,NaCl 10,自然pH。固体培养基添加2.0%(质量分数)的琼脂粉;
TB培养基(g/L):胰蛋白胨12,酵母提取物24,甘油4,KH2PO4 2.31、K2HPO4 12.54,自然pH。
YN培养基(g/L):酵母提取物7,营养肉汤18,自然pH。
1.1.3 溶液配制
PB1缓冲液(200 mmol/L,pH 8.0):分别配制浓度为200 mmol/L的NaH2PO4和Na2HPO4溶液,使用配制好的Na2HPO4溶液调节NaH2PO4溶液的pH值至8.0,室温保存;
PB2缓冲液(100 mmol/L,pH 10.5):配制浓度为100 mmol/L的Na2CO3溶液和 NaHCO3溶液,使用配制好的NaHCO3溶液调节Na2CO3溶液pH值至10.5,室温保存;
GlcNAc溶液(100 g/L):称取GlcNAc 5 g于PB1中,混合均匀并用PB1定容至50 mL,密封低温保存;
二硫苏糖醇(dithiothreitol,DTT)溶液(2 mol/L):称取308.5 mg DTT于1 mL dd H2O中,混合均匀,密封低温保存;
10×邻苯二甲醛(O-phthalaldehyde,OPA)检测试剂:称取OPA 500 mg于PB2中,混合均匀并用PB2定容至100 mL,密封低温避光保存;1×OPA检测试剂:量取10×OPA 3 mL,无水乙醇300 μL,DTT 15 μL,定容至30 mL PB2 中,混合均匀,现用现配,密封低温避光保存;
HCl终止剂(0.5 mol/L):量取盐酸1.8 mL,定容至40 mL dd H2O 中,密封低温保存;
异丙基-β-D-硫代半乳糖苷(Isopropyl-beta-D-thiogalactopyranoside,IPTG)溶液(500 mmol/L):称取IPTG 4.706 g于dd H2O中,混合均匀并用dd H2O定容至40 mL,除菌后低温贮存;
木糖溶液(500 g/L):称取木糖15 g于dd H2O中,混合均匀并用dd H2O定容至30 mL,除菌后低温贮存;
抗生素溶液:称取脱水四环素0.426 4 g于1 L 50%乙醇中,低温保存;称取氨苄青霉素100 mg于1 mL dd H2O中,除菌后低温保存;称取卡那青霉素100 mg于2 mL dd H2O中,除菌后低温保存。
1.1.4 试剂
柱回收试剂盒,Thermo fisher公司;大肠杆菌感受态制备试剂盒、Prime STARMaxDNA聚合酶,大连TaKaRa公司;卡那霉素、质粒提取试剂盒、IPTG、ABTS,上海生工生物工程(上海)股份有限公司;一步克隆试剂盒,南京诺唯赞公司;酵母粉、胰蛋白胨,英国OXOID公司;蛋白 Marker,上海翊圣生物公司;蛋白电泳Loadingbuffer、Bis-Tris预制凝胶,Invitrogen公司。其他常规试剂及药品为国产或进口分装。
1.2 仪器与设备
本实验所使用设备有:超高速离心机,Beckman(德国)公司;台式离心机,Eppendorf(德国)公司;核酸定量检测仪、PCR仪、蛋白电泳仪,Bio-Rad(美国)公司;立式压力蒸汽灭菌器,上海医用核子仪器厂;超低温冷冻冰箱,ThermoFisher(美国)公司;核酸电泳仪,六一(北京)电泳仪厂;台式 pH 计,Mettler-Toledo(瑞士)公司;恒温培养箱,上海医疗器械研究所;恒温震荡培养箱,上海知楚仪器有限公司;电热恒温金属浴,上海生工有限公司;多功能酶标仪BioTek(美国)公司。
1.3 实验方法
1.3.1 枯草芽孢杆菌感受态的制备及转化
将活化的B.subtilis单菌落接种于YN培养基,在37 ℃、220 r/min的条件培养12 h后转接至添加了60 μL木糖的YN培养基中,定容至2 mL,继续培养2 h后添加250 μL甘油,混合均匀后分装贮存于-80 ℃。转化时,先将贮存在-80 ℃的B.subtilis感受态细胞置于冰上解冻45 s,加入适量质粒(根据感受态细胞转化效率做调整)后以37 ℃、220 r/min的条件培养120 min。随后,以4 500×g离心2 min,并弃除上清液,余下的100 μL菌液吹吸混匀后涂布至相应抗性的LB固体平板,37 ℃恒温培养箱中培养12 h。
1.3.2 高产几丁二糖脱乙酰酶重组菌株的构建
以P43-NMK-T0质粒为模板,将12个信号肽的DNA片段分别以引物的形式直接连接至P43-NMK-T0质粒中Dac编码基因的5′端,构建具有12条不同信号肽的质粒,引物如表2所示。以携带Dac基因的P43-NMK-T4质粒为模板,引物如表2所列,通过PCR扩增技术构建信号肽突变体。DNA片段的回收依照Thermofisher的凝胶回收剂盒使用说明书进行操作。随后,这些PCR产物转化至E.coli DH5α中,以促进DNA片段的环化。E.coli感受态细胞的制备参照Takara的感受态制备试剂盒使用说明书进行操作。质粒提取参考生工的质粒抽提剂盒使用说明书进行操作。采用Takara的2×Taq DNA聚合酶对单菌落进行验证,验证正确后提取质粒,并发送到金唯智公司进行序列验证。最后将测序正确的质粒转化至B.subtilis感受态中,得到含有不同信号肽和不同信号肽突变体的重组菌株(BS-P43-NMK-T1至BS-P43-NMK-T4-N5)。
表2 本实验使用引物
Table 2 Primers used in this study

引物序列 (5′-3′)AbnA-FAAATCACAACAAACGAACAATTTAATGAACTGATTCAAATGAAAAAAAAAAAAACATGGAAAAGATTTCTGCATTTTTCATCAGCAGCACTGGCAGCAGGCCTGATTTTTACATCAGCAGCACCGGCAGAAGCAAbnA-RGTCCTCGAACATGTTGACGACCATTGCTTCTGCCGGTGCTGCTGATGTAAAAATCAGGCCTGCTGCCAGTGCTGCTGATGAAAAATGCAGAAATCTTTTCCATGTTTTTTTTTTTTTCATBglS-FAAATCACAACAAACGAACAATTTAATGAACTGATTCAAATGCCGTATCTGAAAAGAGTTCTGCTGCTGCTGGTTACAGGCCTGTTTATGTCACTGTTTGCAGTTACAGCAACAGCATCAGCABglS-RGTCCTCGAACATGTTGACGACCATTGCTGATGCTGTTGCTGTAACTGCAAACAGTGACATAAACAGGCCTGTAACCAGCAGCAGCAGAACTCTTTTCAGATACGGCATDacB-FAAATCACAACAAACGAACAATTTAATGAACTGATTCAAATGAGAATTTTTAAAAAAGCAGTTTTTGTTATTATGATTTCATTTCTGATTGCAACAGTTAATGTTAATACAGCACATGCADacB-RGTCCTCGAACATGTTGACGACCATTGCATGTGCTGTATTAACATTAACTGTTGCAATCAGAAATGAAATCATAATAACAAAAACTGCTTTTTTAAAAATTCTCATLytD-FAAATCACAACAAACGAACAATTTAATGAACTGATTCAAATGAAAAAAAGACTGATTGCACCGATGCTGCTGTCAGCAGCATCACTGGCATTTTTTGCAATGTCAGGCTCAGCACAAGCALytD-RGTCCTCGAACATGTTGACGACCATTGCTTGTGCTGAGCCTGACATTGCAAAAAATGCCAGTGATGCTGCTGACAGCAGCATCGGTGCAATCAGTCTTTTTTTCATLytD-RGTCCTCGAACATGTTGACGACCATTGCTTGTGCTGAGCCTGACATTGCAAAAAATGCCAGTGATGCTGCTGACAGCAGCATCGGTGCAATCAGTCTTTTTTTCATMpr-FAAATCACAACAAACGAACAATTTAATGAACTGATTCAAATGAAAAAAATTGTTGCAGCAATTGTTGTTATTGGCCTGGTTTTTATTGCATTTTTTTATCTGTATTCAAGATCAGGCGATGTTTATCAATCAGTTGATGCAMpr-RGTCCTCGAACATGTTGACGACCATTGCATCAACTGATTGATAAACATCGCCTGATCTTGAATACAGATAAAAAAATGCAATAAAAACCAGGCCAATAACAACAATTGCTGCAACAATTTTTTTCATNprB-FAAATCACAACAAACGAACAATTTAATGAACTGATTCAAATGCGTAACCTTACAAAAACATCTCTTCTTCTTGCTGGCCTTTGTACAGCTGCTCAAATGGTTTTCGTTACACACGCTTCTGCTNprB-RGTCCTCGAACATGTTGACGACCATAGCAGAAGCGTGTGTAACGAAAACCATTTGAGCAGCTGTACAAAGGCCAGCAAGAAGAAGAGATGTTTTTGTAAGGTTACGCAVpr-FAAATCACAACAAACGAACAATTTAATGAACTGATTCAAATGAAAAAAGGCATCATCCGTTTCCTTCTTGTTTCTTTCGTTCTTTTCTTCGCTCTTTCTACAGGCATCACAGGCGTTCAAGCTGCTCCTGCTVpr-RGTCCTCGAACATGTTGACGACCATAGCAGGAGCAGCTTGAACGCCTGTGATGCCTGTAGAAAGAGCGAAGAAAAGAACGAAAGAAACAAGAAGGAAACGGATGATGCCTTTTTTCATYhfM-FAAATCACAACAAACGAACAATTTAATGAACTGATTCAAATGAAAAAAATCGTTGCTGCTATCGTTGTTATCGGCCTTGTTTTCATCGCTTTCTTCTACCTTTACTCTCGTTCTGGCGATGTTTACCAATCTGTTGATGCTYhfM-RGTCCTCGAACATGTTGACGACCATAGCATCAACAGATTGGTAAACATCGCCAGAACGAGAGTAAAGGTAGAAGAAAGCGATGAAAACAAGGCCGATAACAACGATAGCAGCAACGATTTTTTTCATYkvT-FAAATCACAACAAACGAACAATTTAATGAACTGATTCAAATGACAACAAAATTCACAGCTCTTGCTGTTTTCCTTCTTTGTTTCATGCCTGCTGCTAAAATCYkvT-RGTCCTCGAACATGTTGACGACCATGATTTTAGCAGCAGGCATGAAACAAAGAAGGAAAACAGCAAGAGCTGTGAATTTTGTTGTCATYkvV-FAAATCACAACAAACGAACAATTTAATGAACTGATTCAAATGCTTACAAAACGTCTTCTTACAATCTACATCATGCTTCTTGGCCTTATCGCTTGGTTCCCTGGCGCTGCTCAAGCTYkvV-RGTCCTCGAACATGTTGACGACCATAGCTTGAGCAGCGCCAGGGAACCAAGCGATAAGGCCAAGAAGCATGATGTAGATTGTAAGAAGACGTTTTGTAAGCATYoaW-FAAATCACAACAAACGAACAATTTAATGAACTGATTCAAATGAAAAAAATGCTTATGCTTGCTTTCACATTCCTTCTTGCTCTTACAATCCACGTTGGCGAAGCTTCTGCTGTTYoaW-RGTCCTCGAACATGTTGACGACCATAACAGCAGAAGCTTCGCCAACGTGGATTGTAAGAGCAAGAAGGAATGTGAAAGCAAGCATAAGCATTTTTTTCATYwfM-FAAATCACAACAAACGAACAATTTAATGAACTGATTCAAATGAAAGGCAACATCTACTCTCTTTTCGTTCTTATCGCTGCTTTCTTCTGGGGCACAACAGGCACAGTTCAAGCTYwfM-RGTCCTCGAACATGTTGACGACCATATGAAAGGCAACATCTACTCTCTTTTCGTTCTTATCGCTGCTTTCTTCTGGGGCACAACAGGCACAGTTCAAGCTN-FCTATTACTGGCCGGCTTATGCACN-R3GCCAGTAATAGAGATGTCTTGGTCAATTTGN-R5GCCAGTAATAGAGATGTCTTCTTCAAGTTGN-R35GCCAGTAATAGAGATGTCTTCTTCAATTTGC H-FCGGCTTATGCACAGCGGH-R9CATAAGCCGGCCAGTAATTGAGH-R911TGCATAAGCCGGCATCTAATTGAGATGPtet -Dac-FTAAATGTGAAAGTGGGTCCTAAGGATCCAGTTGCTCAAAAAAATCTCGGPtet -Dac-RTATCTAATCTGGACATGGAAAGGAGGAATAGAGACATGAAAAAAATCACPtet -FCCGAGATTTTTTTGAGCAACTGGATCCTAATTGCGTTGCGCTTTAGGACCPtet -RGTCCTCGAACATGTTGACGACCATATGTCCAGATTAGATAAAAGTAAAGTGATTAACAGCGPgracc100 -Dac-FATCTCCCTTCCAATGTCAAGAGATTTTTTAAAAAATTTTTCACGCTTACATCATTCTTTTCGGATCCAGTTGCTCAAAAAAATCTCGGPgracc100 -Dac-RGTGAAAAATTTTTTAAAAAATCTCTTGACATTGGAAGGGAGATATGTTATTATAAGAATTGATGGTCGTCAACATGTTCGAGGPxylA -Dac-FTTTATCTCATCATATACAAAATAAATGTTTATTTCAATGTTTTTTTTAGAAAATTTAGTTAGGATCCAGTTGCTCAAAAAAATCTCGGPxylA -Dac-RGGAAATGACAAATGGTCCAAACTAGTGATATCTAAATGGTCGTCAACATGTTCGAGGPxylA -FGATTTTTTTGAGCAACTGGATCCTAACTAAATTTTCTAAAAAAAACATTGAAATAAACATTTATTTTGTATATGATGAGATAAAGTTAGPxylA -RCCTCGAACATGTTGACGACCATTTAGATATCACTAGTTTGGACCATTTGTCATTTCC
1.3.3 诱导型重组菌株的构建
分别以本研究中构建的P43-NMK-T4-N1质粒以及实验室保藏的Pgrac100-sfGFP、PxylA-sfGFP质粒为模板,以表2所列引物通过PCR扩增技术扩增Dac表达载体骨架、启动子Pgrac100、PxylA及对应的阻遏蛋白xylR-PxylA、lacI-Pgrac100序列,将xylR-PxylA、lacI-Pgrac100片段通过一步克隆方法连至P43 NMK-T4载体骨架上。Ptet以引物的形式直接连接到P43 NMK-T0质粒上。经过转化、菌落PCR验证及测序得到重组质粒NMK-T4-N1-PxylA、NMK-T4-N1-Pgrac和NMK-T4-N1-Ptet。将这些经过验证的重组质粒转入枯草芽胞杆菌中,从而获得带有不同启动子的重组菌株(BS-NMK-T4-N1-Pgrac至BS-NMK-T4-N1-Ptet)。
1.3.4 诱导条件优化
优化诱导时机和诱导剂浓度:将B.subtilis培养至第6 h和12 h时,IPTG诱导组分别加入终浓度为0.5、1.0 mmol/L的IPTG诱导剂,37 ℃,220 r/min培养60 h,取样检测酶活力。
1.3.5 发酵方法
1.3.5.1 摇瓶发酵实验
将重组菌株在最适的条件下诱导,并对发酵条件进行优化。选取接种量、碳源和氮源3个因素。接种量分别为2%、4%,碳源分别由原始碳源甘油4 g/L替换成葡萄糖20 g/L、蔗糖20 g/L、麦芽糖20 g/L、和淀粉20 g/L。氮源分别为10 g/L的营养肉汤、蛋白胨、酵母浸膏和NH4Cl。发酵60 h后,检测重组菌株的胞外Dac活性。
摇瓶发酵方法:首先,将活化的菌株划线接种到LB固体培养基上,并将其放置于适宜条件下培养,直到观察到生长出菌落。随后,混菌接种到液体LB培养基中,在37 ℃和220 r/min的条件下培养12 h,制备发酵种子液。将4 mL的种子液接入到96 mL的TB培养基中,继续在相同的温度和转速下培养60 h。诱导型菌株在培养12 h时,根据使用的诱导型启动子的不同,需分别添加15 g/L的木糖、1 mmol/L的IPTG或200 nmol/L的脱水四环素作为诱导剂。
1.3.5.2 发酵罐实验
首先,将发酵罐灭菌30 min,配好TB培养基后,再次灭菌。待其冷却后接种。制备发酵种子液方法与摇瓶一致。发酵罐中接种量为4%,温度为37 ℃,转速为220 r/min,pH值在7.0~8.5,风量0.8 m3/h,罐压0.3 MPa,发酵60 h,每隔12 h取样测定酶活力。
1.3.6 酶活力检测方法
Dac的活性通过GlcNAc的脱乙酰作用来测定。Dac表达菌培养60 h后,将发酵液12 000×g离心2 min,收集100 μL上清液,与100 μL 100 g/L GlcNAc溶液(溶解50 mmol/L PB1,pH = 8.0),在40 ℃下预热。然后,将溶液以1 000 r/min摇动10 min;立即收集5 μL溶液并添加到95 μL PB1溶液(pH = 8.0)中。在1 000 r/min转速下搅拌10 s后,将5 μL溶液加入95 μL OPA,在1 000 r/min转速下搅拌120 s后检测试剂。OPA试剂由PB2(pH = 10.5)和500 mg/L OPA、1%(体积分数)乙醇和1 mmol/L DTT组成。使用分光光度计(Thermo Scientific,芬兰万塔)以1 000 r/min的转速摇匀溶液后,测定330 nm处的吸光度。除了GlcNAc质量浓度为0 g/L外,空白对照组也采用了相同的步骤。酶活力计算如公式(1)所示:
(1)
式中:X,粗酶液的酶活力,U/mL;A,反应液中氨基葡萄糖盐酸盐的质量浓度,g/L;B,空白液中氨基葡萄糖盐酸盐的质量浓度,g/L;M,粗酶液样品稀释倍数;V,总反应体系体积(0.3 mL);T,反应时长(10 min)。
1.3.7 蛋白SDS-PAGE分析
首先,在PCR八连管中放置30 μL粗酶液样品,再加入10 μL的4×LDS Sample Buffer,充分混合均匀后置于PCR仪上。反应温度为90 ℃,反应时间为10 min。蛋白电泳检测:倒入适量的SDS-Running Buffer缓冲液,向加样孔中点入15 μL的样品及5 μL的蛋白Marker。蛋白电泳仪前45 min使用电压80 V,后45 min使用电压120 V。结束后,取下胶板并将蛋白预制胶放入考马斯亮蓝染色液中进行染色,振荡孵育30 min后,使用脱色液脱色,最后通过凝胶成像仪在蛋白Marker指示下观察目的蛋白条带。
2 结果与分析
2.1 高效分泌几丁二糖脱乙酰酶的重组菌株构建
2.1.1 信号肽筛选实现几丁二糖脱乙酰酶的胞外表达
信号肽在引导异源蛋白在B.subtilis分泌过程中发挥着至关重要的作用,合适的信号肽可以减少细胞内蛋白的积累压力,增加目标蛋白的胞外表达量。按照B.subtilis中蛋白的主要分泌途径可将信号肽分为以下2种常见的类型:经典蛋白分泌途径(general secretory pathway, Sec)信号肽和双精氨酸分泌途径(twin-arginine translocation, Tat)信号肽[20]。在B.subtilis的Sec分泌途径中,通过信号识别因子的识别作用引导目的蛋白进行跨膜运输,而Tat转运途径信号肽主要负责折叠蛋白的转运。然而,90%的蛋白都是通过Sec途径分泌至胞外。因此,本研究选用了12条Sec途径的信号肽,包括实验室保存的4条具有较强分泌Dac能力的信号肽(AbnA、BglS、Mpr和NprB),以及近年来报道的具有较强分泌能力的B.subtilis内源信号肽(DacB、LytD、Vpr、YhfM、YkvT、YkvV、YoaW、YwfM)[23],其氨基酸序列如表3所示。分别构建了包含多种信号肽的重组质粒P43-NMK-T1至P43-NMK-T12(图1-a),并将这些质粒转化至B.subtilis中获得重组菌株BS-P43-NMK-T1至BS-P43-NMK-T12。
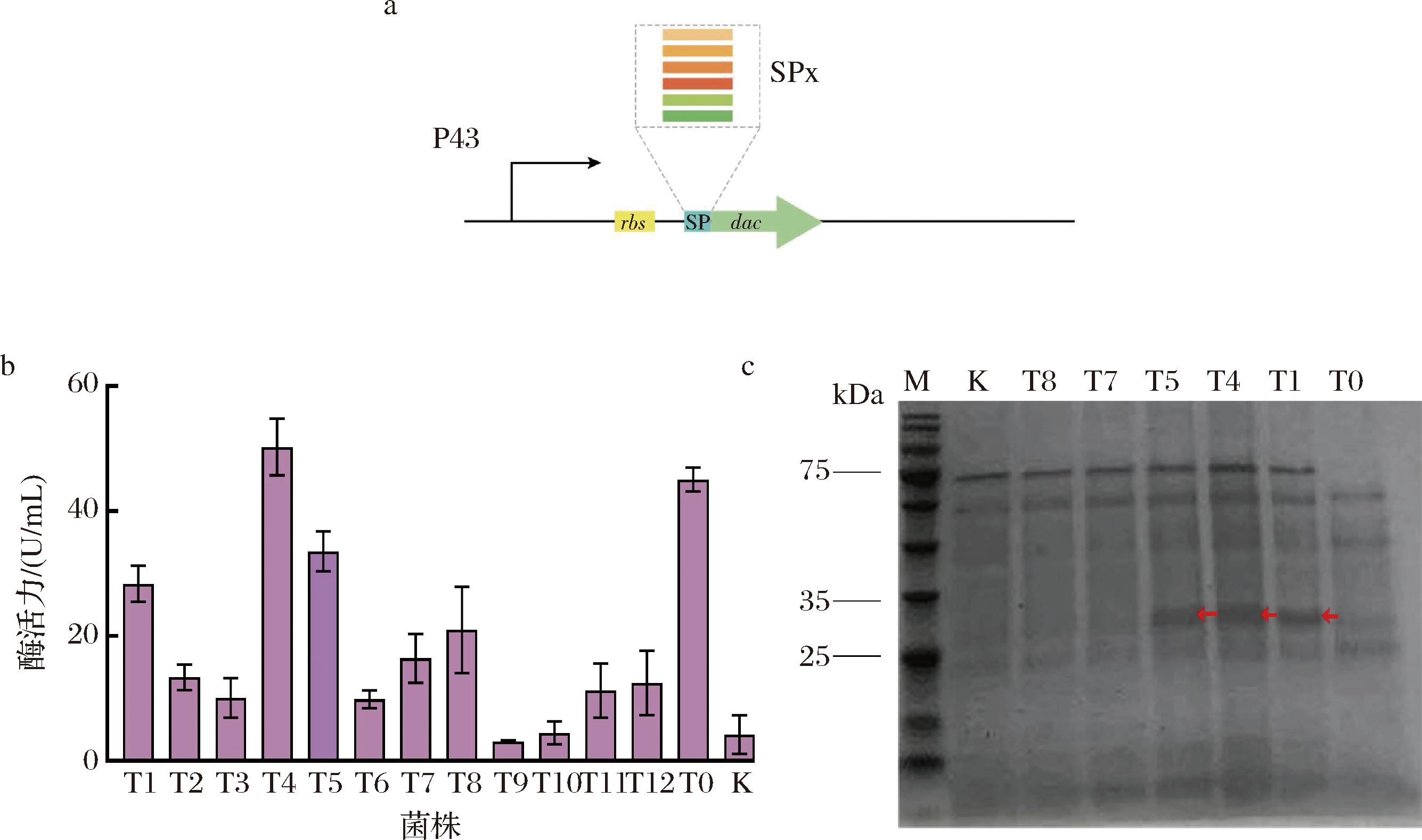
M-Marker;K-不含质粒的 B.subtilis;T0-BS-P43-NMK-T0;T1~T12-含有不同信号肽的重组菌株a-信号肽替换示意图;b-不同信号肽重组菌株酶活力;c-重组菌株的SDS-PAGE结果
图1 不同信号肽重组菌株胞外Dac酶活力的比较
Fig.1 Comparison of extracellular Dac enzyme activities in recombinant strains with different signal peptides
表3 信号肽的氨基酸序列
Table 3 Amino acid sequence of the signal peptide

名称序列AbnAMKKKKTWKRFLHFSSAALAAGLIFTSAAPAEABglSMPYLKRVLLLLVTGLFMSLFAVTATASADacBMRIFKKAVFVIMISFLIATVNVNTAHANprBMRNLTKTSLLLAGLCTAAQMVFVTHASAMprMKKGIIRFLLVSFVLFFALSTGITGVQAAPALytDMKKRLIAPMLLSAASLAFFAMSGSAQAVprMKKGIIRFLLVSFVLFFALSTGITGVQAAPAYhfMMKKIVAAIVVIGLVFIAFFYLYSRSGDVYQSVDAYkvTMTTKFTALAVFLLCFMPAAKIYkvVMLTKRLLTIYIMLLGLIAWFPGAAQAYoaWMKKMLMLAFTFLLALTIHVG EASAVYwfMMKGNIYSLFVLIAAFFWGTTGTVQA
将构建的高效分泌重组菌株进行发酵验证,结果表明原始菌株BS-S60I/R157T/F168S即T0的胞外Dac活性为45.06 U/mL,重组菌株BS-P43-NMK-T4的胞外Dac活性提升至50.29 U/mL,而其他信号肽引导的重组菌株胞外Dac活性均低于原始菌株T0(图1-b),表明最适合Dac蛋白分泌的信号肽是NprB。随后,将原始菌株和重组菌株的粗酶液进行SDS-PAGE分析。结果如图1-c所示,在对照菌株B.subtilis C6中,并未发现目的蛋白Dac(该蛋白的分子质量为32 kDa)的条带。相反,在重组菌株BS-S60I/R157T/F168S中具有较清晰的目标条带。重组菌株BS-P43-NMK-T1、BS-P43-NMK-T4和BS-P43-NMK-T5都在32 kDa位置处观察到较为明显的蛋白条带。特别地,重组菌株BS-P43-NMK-T4中Dac的条带最为明显,这与酶活检测结果一致,说明信号肽NprB提升Dac蛋白表达水平的作用最显著。
2.1.2 信号肽功能区域优化提升几丁二糖脱乙酰酶胞外产量
大多数信号肽具有3个功能区,N-端带正电荷的氨基酸可与蛋白质的转运体相互作用;H-端疏水氨基酸残基可更好地嵌入蛋白质;C-端具有信号肽酶裂解位点可促进蛋白质的正确折叠[24]。因此,为了进一步提高信号肽NprB引导Dac分泌的能力,将信号肽N端原有氨基酸突变成碱性氨基酸,并将H区域的极性氨基酸变成非极性氨基酸以降低其疏水性。因此,N端的天冬酰胺和苏氨酸突变为赖氨酸,H区域的亮氨酸突变为谷氨酰胺(图2-a)。将所得到的质粒P43-NMK-T4-N1至P43-NMK-T4-N5转化至B.subtilis中得到重组菌株BS-P43-NMK-T4-N1至BS-P43-NMK-T4-N5。
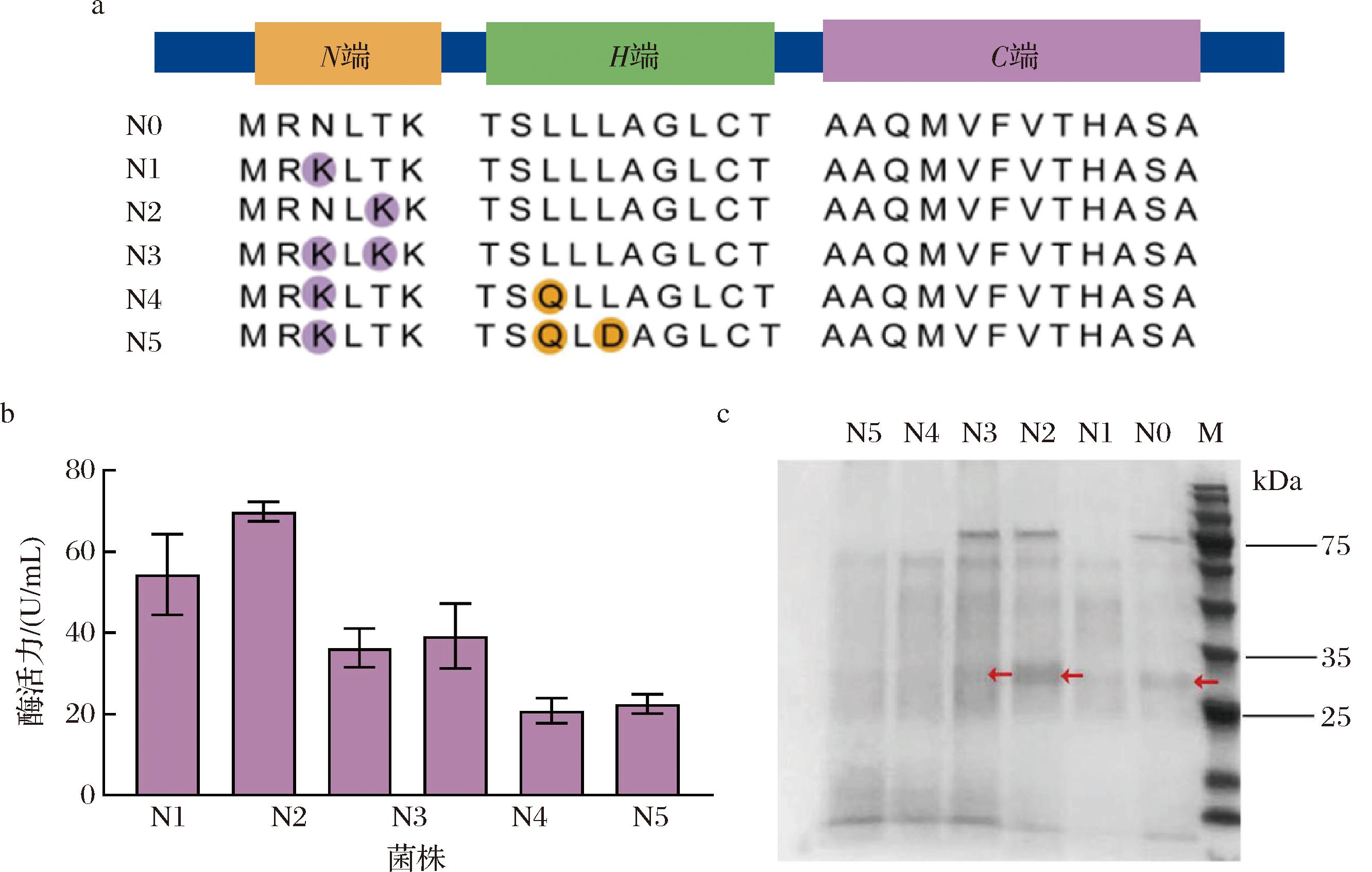
M-Marker, N0-BS-P43-NMK-T4-N0;N1-BS-P43-NMK-T4-N1;N2-BS-P43-NMK-T4-N2,N3-BS-P43-NMK-T4-N3;N4-BS-P43-NMK-T4-N4;N5-BS-P43-NMK-T4-N5a-信号肽NprB的功能结构及突变体构建;b-信号肽功能区域优化对Dac分泌的影响;c-重组菌株的SDS-PAGE结果
图2 不同信号肽功能区域优化后重组菌株胞外Dac酶活力的比较
Fig.2 Comparison of extracellular Dac enzyme activities in recombinant strains optimized for different functional regions of signal peptides
分别对上述获得的重组菌株进行摇瓶验证,在发酵至60 h后,对照组BS-P43-NMK-T4菌株胞外酶活力为54.36 U/mL,重组菌株BS-P43-NMK-T4-N1的胞外Dac活性达到69.83 U/mL(图2-b)。与原始菌株BS-S60I/R157T/F168S相比,Dac的胞外酶活力提升了54.97%,表明在信号肽NprB的N端增加一个正电荷更有利于蛋白Dac的表达与分泌。然而,其他重组菌株的胞外酶活力都有所降低,可能是因为过多带正电氨基酸的引入不利于蛋白的可溶性表达,也有可能是不合适的突变位点影响了mRNA的结构,从而降低了其翻译速率。对上述的重组菌株的发酵上清液进行SDS-PAGE分析,结果显示重组菌株 BS-P43-NMK-T4-N0、BS-P43-NMK-T4-N1、BS-P43-NMK-T4-N2 和 BS-P43-NMK-T4-N3 均在32 kDa的位置出现了较为清晰的蛋白条带,而BS-P43-NMK-T4-N4、BS-P43-NMK-T4-N5中仅观察模糊的Dac条带(图2-c),这与酶活力的测定结果一致。总之,在信号肽NprB的N端增加一个正电荷后对Dac蛋白分泌能力最强。
2.2 诱导型启动子对几丁二糖脱乙酰酶表达的影响
在本研究中,强组成型启动子P43首先被用来驱动Dac基因的表达。组成型启动子虽然可以连续不断地表达目的蛋白,但也存在基因表达强度不易控制的缺陷,而诱导型启动子则能够在特定的诱导条件下开启转录“开关”,具有精准调控外源基因转录时机、减少代谢产物等优点[20]。因此,本文使用诱导型启动子控制Dac蛋白的表达时间和水平。在重组菌株BS-P43-NMK-T4-N1的基础上,构建含有3个不同诱导型启动子Pgrac100、PxylA和Ptet的表达质粒,并将它们转入B.subtilis中得到重组菌株BS-NMK-T4-N1-Pgrac、BS-NMK-T4-N1-PxylA和BS-NMK-T4-N1-Ptet(图3-a)。发酵结果显示,以启动子P43调控Dac表达的重组菌株BS-NMK-T4-N1-Pgrac在60 h时的胞外Dac活性为65.09 U/mL,而使用启动子Pgrac100的重组菌株BS-NMK-T4-N1-Pgrac的胞外酶活力提升了24.29%(图3-b)。与组成型启动子P43相比,诱导型启动子Pgrac100可以更好平衡菌株生长,更合适诱导表达蛋白Dac。
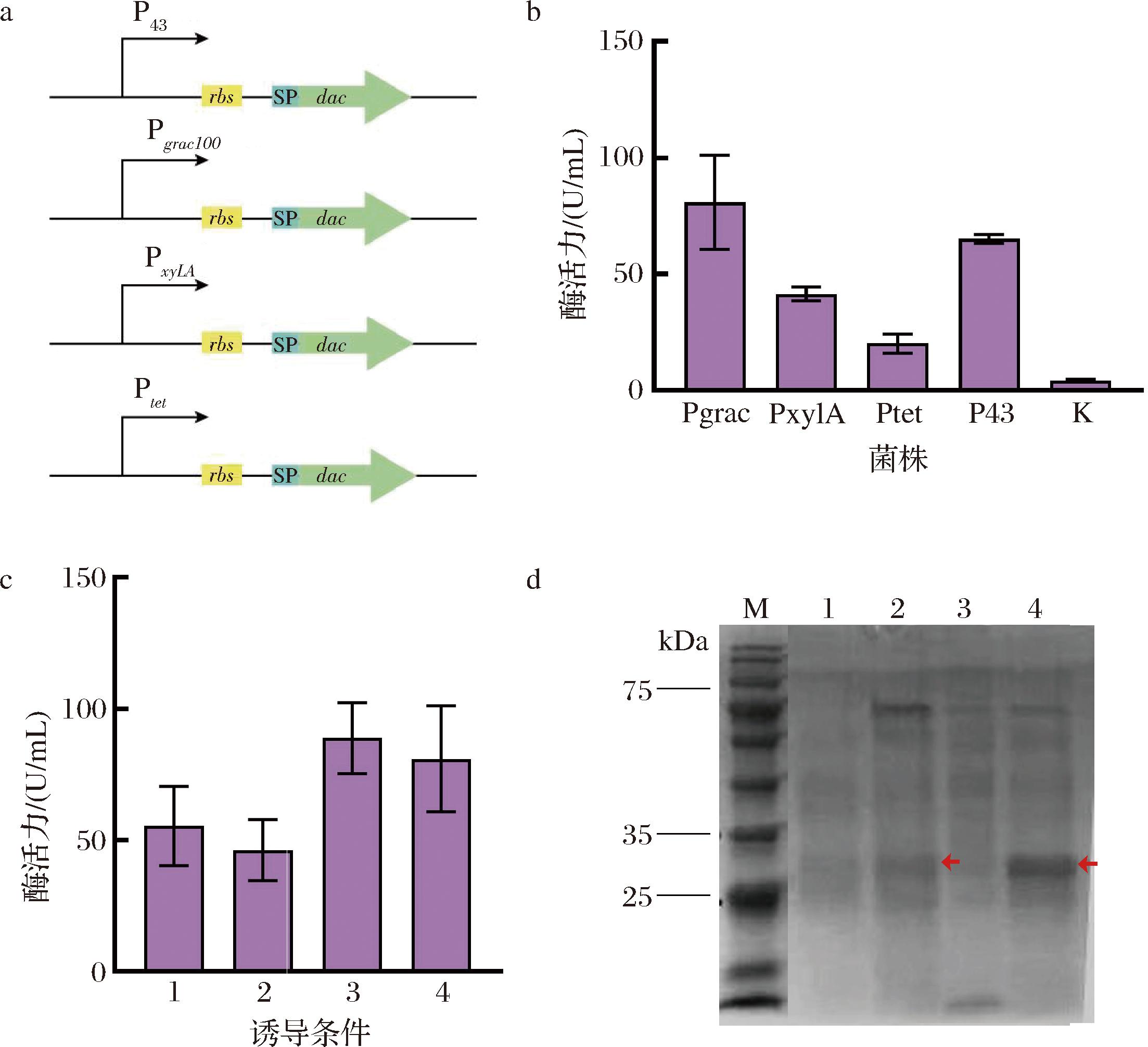
M-Marker;1-诱导时间6 h, 诱导浓度1 mmol/L;2-诱导时间6 h, 诱导浓度0.5 mmol/L;3-诱导时间12 h, 诱导浓度1 mmol/L;4-诱导时间12 h, 诱导浓度0.5 mmol/L a-启动子示意图;b-不同启动子诱导的重组菌株胞外Dac活性;c-不同诱导条件下重组菌株BS-NMK-T4-N1-Pgrac胞外酶活力;d-重组菌株的SDS-PAGE结果
图3 不同启动子重组菌株胞外 Dac 酶活力的比较
Fig.3 Comparison of extracellular Dac enzyme activities of recombinant strains with different promoters
诱导剂IPTG是乳糖类似物,虽然不易被B.subtilis分解利用,可以良好地发挥诱导基因表达的功能,但对细胞有潜在毒性[25]。因此,设置了诱导时间分别为6 h和12 h,诱导浓度分别为0.5 mmol/L和1 mmol/L。如图3-c所示,当诱导时间为12 h、IPTG的浓度为0.5 mmol/L时,该菌株BS-NMK-T4-N1-Pgrac发酵60 h胞外Dac活性达到88.92 U/mL。另外,对不同条件下获得的发酵上清液进行SDS-PAGE分析。结果显示,使用启动子Pgrac100的重组菌株BS-NMK-T4-N1-Pgrac分别在诱导时间为6 h,诱导浓度为0.5 mmol/L和诱导时间为12 h,诱导浓度为0.5 mmol/L时获得的Dac条带相较其他条件下更加明显(图3-d)。因此,IPTG的诱导时间和诱导浓度可以有效提升Dac的胞外表达水平。
2.3 接种量、碳源和氮源优化提升几丁二糖脱乙酰酶表达
分别选择葡萄糖、蔗糖、麦芽糖和淀粉为碳源替换TB培养基中的甘油,接种量分别选择2%和4%,重组菌株BS-NMK-T4-N1-Pgrac摇瓶发酵的胞外酶活力结果如图4-a所示。其中,以甘油为碳源,接种量为4%作为对照组。葡萄糖为碳源(20 g/L)、接种量4%发酵的重组菌株胞外酶活力较高,达到了106.77 U/mL,相较于对照组胞外酶活力提升了18.73%。相反,接种量为4%时使用其他碳源重组菌株胞外酶活力都有降低(图4-b)。
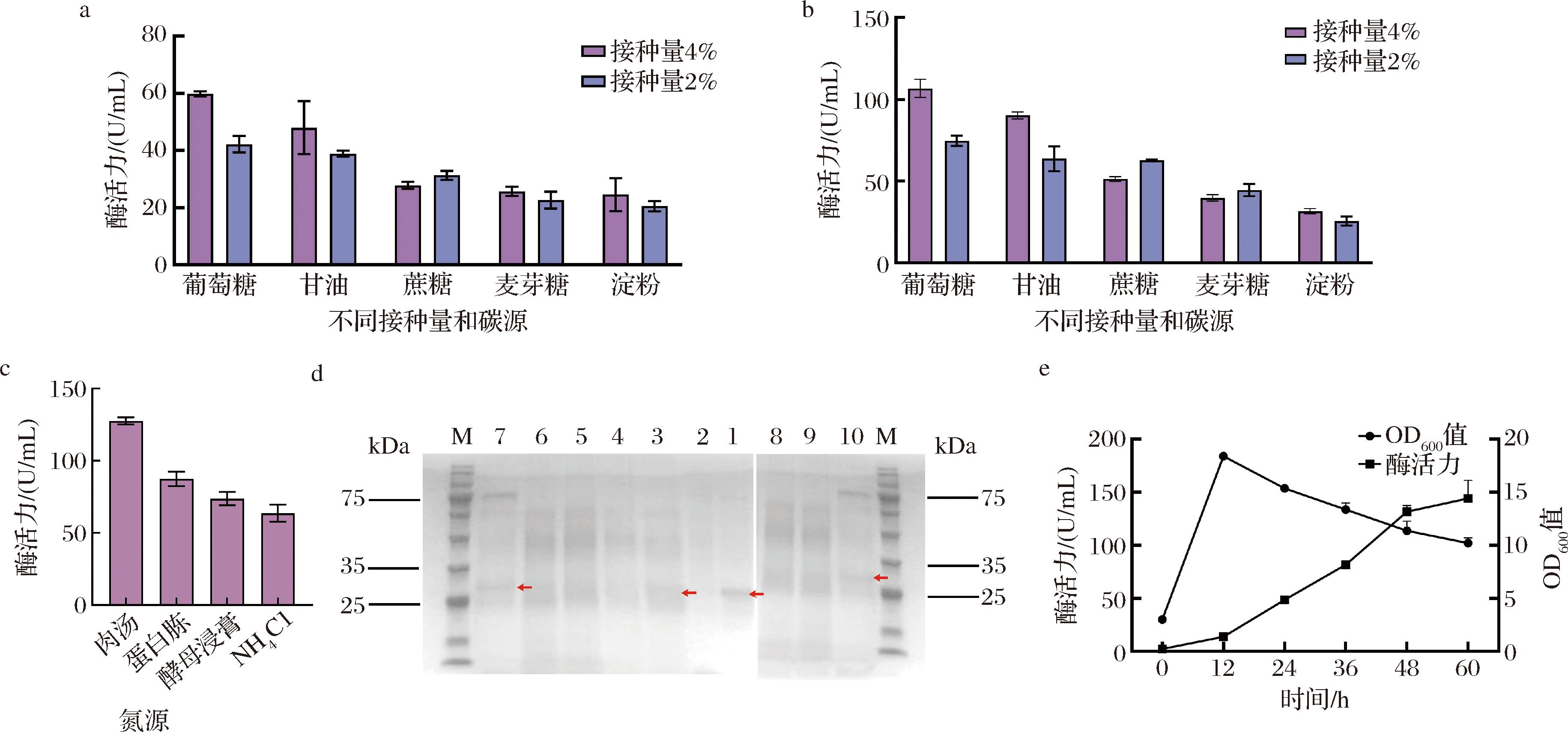
M-Marker;1~10-4%接种量-葡萄糖、2%接种量-葡萄糖、4%接种量-甘油、2%接种量-甘油、4%接种量-蔗糖、2%接种量-蔗糖油、4%接种量-麦芽糖、2%接种量-麦芽糖、4%接种量-淀粉、2%接种量-淀粉a-原始菌株BS-P43-NMK-T0不同接种量和碳源酶活力;b-重组菌株BS-NMK-T4-N1-Pgrac不同接种量和碳源酶活力;c-重组菌株BS-NMK-T4-N1-Pgrac不同氮源酶活力;d-重组菌株的SDS-PAGE结果;e-摇瓶补加葡萄糖重组菌株BS-NMK-T4-N1-Pgrac酶活力
图4 不同接种量、碳源和氮源对菌株胞外酶活的影响
Fig.4 Effect of different inoculum, carbon and nitrogen sources on the extracellular enzyme activity of strains of Bacteroides spp.
在确定最佳接种量和碳源后,探究氮源对重组菌株分泌表达Dac的影响。分别以10 g/L的营养肉汤、蛋白胨、酵母浸膏和NH4Cl作为氮源,20 g/L的葡萄糖作为碳源,在发酵60 h后测定胞外Dac的活性。以营养肉汤和蛋白胨为氮源时胞外Dac活性比以酵母浸膏和NH4Cl为氮源时的高,这可能是因为营养肉汤更能提供菌株生长所需的氮素营养物质,而以NH4Cl作为氮源时菌株生长会受到影响。具体而言,以10 g/L的营养肉汤为氮源,20 g/L的葡萄糖作为碳源时,重组菌株中Dac胞外活性达到127.59 U/mL,相较于对照组提升了19.5%(图4-c)。另外,分别对各组得到的发酵上清液进行SDS-PAGE分析。结果如图4-d所示,不同条件下重组菌株中都存在较为清晰的蛋白条带。特别地,当接种量为4%、葡萄糖质量浓度为20 g/L时重组菌株的蛋白条带最明显,这与酶活力测定结果一致。因此,将在葡萄糖作为碳源、营养肉汤作为氮源和4%接种量的基础上开展后续研究。
然而,初始葡萄糖浓度过高会引起B.subtilis渗透失水,从而对细胞生长造成影响。因此,初始添加质量浓度4 g/L的葡萄糖,并在发酵过程中每12 h补加0.4 mL 500 g/L的葡萄糖,结果如图4-e所示。发酵60 h后重组菌株胞外Dac活性提升至144.25 U/mL,相较于非补加葡萄糖发酵时Dac活性提高了13.06%。证明连续补加低浓度的葡萄糖的发酵方式可以促进Dac的分泌表达。
2.4 3-L生物反应器中的发酵优化提升几丁二糖脱乙酰酶表达
为了继续提高重组B.subtilis中Dac的胞外表达水平,进行了3-L自控发酵罐的放大试验,并从12 h开始分别补加葡萄糖和甘油。如图5-a所示,补加葡萄糖时,OD600值在0~12 h呈上升趋势,菌体量快速增加。在12~60 h呈缓慢下降趋势,说明活菌数逐渐下降;pH值从0~60 h呈缓慢逐渐上升趋势,可能是由于酶逐渐积累分泌至胞外使培养基中pH逐渐升高,由中性变为碱性。补加葡萄糖时,重组菌株BS-NMK-T4-N1-Pgrac胞外Dac酶活力在60 h最高,达到319.63 U/mL,相较于摇瓶水平提升了121.58%(图5-a)。补加甘油时,OD值在0~12 h呈上升趋势,在12~60 h呈缓慢下降趋势,与补加葡萄糖时生长趋势大致相同。发酵罐中pH值从0~60 h呈缓慢逐渐上升趋势,说明在酶逐渐积累分泌到胞外时使得发酵罐中pH逐渐由中性变为碱性。重组菌株BS-NMK-T4-N1-Pgrac胞外Dac酶活力在48 h最高,达到了242.01 U/mL,而在60 h,发酵罐中pH值较高,达到8.53,导致酶活力下降(图5-b)。对发酵上清液分别进行SDS-PAGE分析,结果显示补加葡萄糖比补加甘油获得更粗的目的蛋白条带(图5-c)。因此,在3-L自控发酵罐中,补加葡萄糖更适合Dac高效分泌与表达。
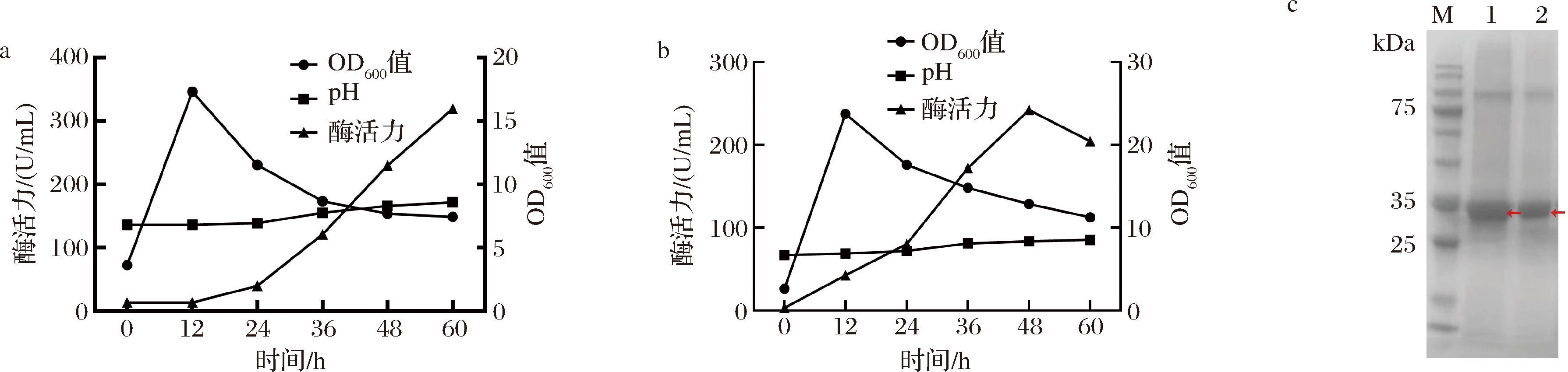
a-3-L发酵罐中补加葡萄糖发酵的OD值、pH值、酶活力;b-3-L发酵罐中补加甘油发酵的OD值、pH值、酶活力;c-BS-NMK-T4-N1-Pgrac的SDS-PAGE结果(M-Marker;1-葡萄糖;2-甘油)
图5 重组菌株在3-L发酵罐中的OD值、pH值、酶活力
Fig.5 OD, pH, and enzyme activity of group strains in a 3-L fermentor
3 结论与讨论
GlcN是一类人体中必需的功能性单糖,其应用不仅局限于食品营养和医疗保健,在化妆品等领域也受到了广泛关注,而高效表达Dac是实现GlcN工业化生产的关键[20]。虽然对信号肽的氨基酸组成及其在跨膜转运和输出蛋白质方面的作用进行了全面研究,但天然信号肽元件普适性低,进行信号肽工程改造时首要考虑的因素就是信号肽与分泌蛋白之间的适配性。本研究成功筛选12条信号肽,并通过信号肽功能区域改造来增强分泌Dac的能力。此外,强启动子P43已被用作B.subtilis表达载体工程中的常用调控元件,但这种组成型启动子无法精准控制蛋白表达水平,因此筛选了诱导型启动子并优化诱导条件提高Dac表达水平。随后对发酵条件进行优化,并在3-L发酵罐中进行放大试验来提高Dac的胞外活性,在工业化生产GlcN方面具有潜力。然而,GlcN的产量仍有较大提升空间,需要进一步在纯吸发酵罐上开展放大试验,并对发酵过程进行预测、实时在线监测与控制。
[1] LIU L, LIU Y F, SHIN H D, et al.Developing Bacillus spp.as a cell factory for production of microbial enzymes and industrially important biochemicals in the context of systems and synthetic biology[J].Applied Microbiology and Biotechnology, 2013, 97(14):6113-6127.
[2] PANGESTUTI R, KIM S K.Biological activities and health benefit effects of natural pigments derived from marine algae[J].Journal of Functional Foods, 2011, 3(4):255-266.
[3] GRZANNA M W, AU R Y, AU A Y, et al.Avocado/soybean unsaponifiables, glucosamine and chondroitin sulfate combination inhibits proinflammatory COX-2 expression and prostaglandin E2 production in tendon-derived cells[J].Journal of Medicinal Food, 2020,23(2):139-146.
[4] LIU X B, MA P S.Recent development of glucosamine-6-phosphate derivatives as potential antibacterial agents[J].Chemistry Select, 2020,5(5):1718-1727.
[5] SHEN K T, CHEN M H, CHAN H Y, et al.Inhibitory effects of chitooligosaccharides on tumor growth and metastasis[J].Food and Chemical Toxicology, 2009, 47(8):1864-1871.
[6] ZHANG H K, LU Y T, WANG Y H, et al.D-Glucosamine production from chitosan hydrolyzation over a glucose-derived solid acid catalyst[J].RSC Advances, 2018,8(10):5608-5613.
[7] LIU H Y, LI N, LIU X B, et al.Poly(N-acryloyl-glucosamine-co-methylenebisacrylamide)-based hydrophilic magnetic nanoparticles for the extraction of aminoglycosides in meat samples[J].Journal of Chromatography A, 2020,1609:460517.
[8] DHUNGEL P, BHATTACHERJEE A, HRYNETS Y, et al.The effect of amino acids on non-enzymatic browning of glucosamine:Generation of butterscotch aromatic and bioactive health compounds without detectable levels of neo-formed alkylimidazoles[J].Food Chemistry, 2020,308:125612.
[9] 陈志蓉, 常思思, 董银卯, 等.氨基葡萄糖改性阿魏酸的溶解性和美白功效研究 [J].中国药师, 2010, 13(12):1715-1718.CHEN Z R, CHANG S S, DONG Y M, et al.Research of modified solubility and whitening efficacy of ferulic acid by glucosamine[J].China Pharmacist, 2010, 13(12):1715-1718.
[10] CHEN X, LIU L, LI J H, et al.Improved glucosamine and N-acetylglucosamine production by an engineered Escherichia coli via step-wise regulation of dissolved oxygen level[J].Bioresource Technology, 2012, 110:534-538.
[11] LIU L, LIU Y F, SHIN H D, et al.Microbial production of glucosamine and N-acetylglucosamine:Advances and perspectives[J].Applied Microbiology and Biotechnology, 2013, 97(14):6149-6158.
[12] JIANG Z, LV X Q, LIU Y F, et al.Biocatalytic production of glucosamine from N-acetylglucosamine by diacetylchitobiose deacetylase[J].Journal of Microbiology and Biotechnology, 2018, 28(11):1850-1858.
[13] 乔岩, 王爱勤.N-乙酰氨基葡萄糖合成方法的改进[J].化学试剂, 2002, 24(3):162-190.QIAO Y, WANG A Q.A convenient method for the synthesis of N-acetyl-D-glucosamine[J].Chemical Reagents, 2002, 24(3):162-190.
[14] 姜竹. 几丁二糖脱乙酰酶的克隆表达与生物转化合成氨基葡萄糖的研究[D].无锡:江南大学, 2019.JIANG Z.Cloning and expression of chitosan deacetylase and its biotransformation to glucosamine[D].Wuxi:Jiangnan University, 2019.
[15] TANAKA T, FUKUI T, ATOMI H, et al.Characterization of an exo-beta-D-glucosaminidase involved in a novel chitinolytic pathway from the hyperthermophilic archaeon Thermococcus kodakaraensis KOD1[J].Journal of Bacteriology, 2003, 185(17):5175-5181.
[16] NAKAMURA T, YONEZAWA Y, TSUCHIYA Y, et al.Substrate recognition of N,N′-diacetylchitobiose deacetylase from Pyrococcus horikoshii[J].Journal of Structural Biology, 2016, 195(3):286-293.
[17] 刘波, 倪金凤, 申玉龙.极端嗜热古菌 Pyrococcus horikoshii 几丁二糖脱乙酰酶的克隆、表达及性质研究[J].微生物学报, 2006, 46(2):255-258.LIU B, NI J F, SHEN Y L.Cloning, expression and biochemical characterization of a novel diacetylchitobiose deacetylase from the hyperthermophilic archaeon Pyrococcus horikoshii[J].Acta Microbiologica Sinice, 2006, 46(2):255-258.
[18] SONI T, ZHUANG M C, KUMAR M, et al..Multifaceted production strategies and applications of glucosamine:A comprehensive review[J].Critical Reviews in Biotechnology,2023,43(1):100-120.
[19] HUANG Z Y, MAO X Z, LV X Q, et al.Engineering diacetylchitobiose deacetylase from Pyrococcus horikoshii towards an efficient glucosamine production[J].Bioresource Technology, 2021,334:125241.
[20] MAO X Z, HUANG Z Y, SUN G Y, et al.High level production of diacetylchitobiose deacetylase by refactoring genetic elements and cellular metabolism[J].Bioresource Technology,2021,341:125836.
[21] YANG S, KANG Z, CAO W L, et al.Construction of a novel, stable, food-grade expression system by engineering the endogenous toxin-antitoxin system in Bacillus subtilis[J].Journal of Biotechnology, 2016, 219:40-47.
[22] SUN G Y, WU Y K, HUANG Z Y, et al.Directed evolution of diacetylchitobiose deacetylase via high-throughput droplet sorting with a novel, bacteria-based biosensor[J].Biosensors and Bioelectronics, 2023, 219:114818.
[23] LIU Y H, SHI C S, LI D K, et al.Engineering a highly efficient expression system to produce BcaPRO protease in Bacillus subtilis by an optimized promoter and signal peptide[J].International Journal of Biological Macromolecules, 2019,138:903-911.
[24] 田荣臻, 刘延峰, 李江华, 等.典型模式微生物基因表达精细调控工具的研究进展[J].合成生物学, 2020, 1(4):454-469.TIAN R Z, LIU Y F, LI J H, et al.Progress in the regulatory tools of gene expression for model microorganisms[J].Synthetic Biology, 2020, 1(4):454-469.
[25] 周勇. 嗜麦芽糖寡养单胞菌脂肪酶 Lips 在枯草芽孢杆菌中的高效分泌表达[D] 杭州:浙江大学, 2015.ZHOU Y.High level secretion expression of a lipase from stenotrophomonas maltophilia in Bacillus subtilis[D] Hangzhou:Zhejiang University, 2015.