随着生活条件的改善,高脂血症人群大幅增加,调节血脂的保健食品越来越受到大家的欢迎,比如红曲米、水果酵素等。在红曲样品的功能性成分中,除了对于调节血脂起主要作用的洛伐他汀类化合物,还有一些活性物质具有保健功效,其中以红曲色素、γ-氨基丁酸、氨基酸、粗多糖和多酚5种成分为主。
红曲是中国传统中药,《日用本草》中“红曲酿酒”和《本草纲目》中“红曲主治消食活血,健脾燥胃。治赤白痢,下水谷,治打扑伤损,治女人血气痛及产后恶血不尽”都彰显了红曲的食用及药用价值[1]。红曲也是具有降血脂、降血压、降血糖3种功效的天然食品。红曲具有丰富的活性物质,例如红曲色素、酶类、抗菌活性物质、Monacolin K、麦角固醇、多糖、氨基酸、有机物等[2]。日本学者远藤章于1979年从产于泰国的红曲中首次分离筛选得到一种可在体内抑制胆固醇合成的功能性物质并将其命名为Monacolin K,Monacolin L、Monacolin J等其他十多种洛伐他汀类化合物紧随其后被从红曲菌发酵产物中分离得到[3-5]。研究表明,羟甲基戊二酰辅酶A还原酶是控制体内胆固醇合成的关键酶,而Monacolin类化合物是其竞争性抑制剂,其可以有效减少或阻断内源性胆固醇的合成,此类化合物以Monacolin K的效果最为显著[5-6]。同时红曲色素及其制品也具有调节血脂、降血压、抗氧化、抗炎等生理活性,其作用机理主要是通过抑制相关酶的活性[7-9]。
基于红曲潜在的多种功效,本研究拟通过利用HPLC、分光光度计、酸碱滴定等检测方法分析测定4种红曲样品(普通红曲米、功能性红曲米、水果红曲及红曲滤渣)中Monacolin K、红曲色素、粗多糖、氨基酸、多酚、γ-氨基丁酸6种功能性成分含量,并通过构建小鼠高脂血症模型,对比不同红曲样品对小鼠血清中甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,T-CHO)和超氧化物歧化酶(superoxide dismutase,T-SOD)的含量或活性的影响,评价4种红曲样品的抗氧化及辅助降血脂作用。
1 材料与方法
1.1 材料与试剂
普通红曲米,自备,大米发酵中红曲的配比质量分数为0.5%;功能红曲米,自备,大米发酵中红曲的配比质量分数为3%;水果红曲,自备,山楂粉和功能红曲米按1∶4质量比配料;红曲滤渣,自备,功能红曲米混合4倍质量70%(体积分数)乙醇,过滤甩干得滤渣;洛伐他汀标准品,中国食品药品检定研究院;γ-氨基丁酸标准品、没食子酸标准品,绿源生物;4-二甲氨基偶氮苯-4’-磺酰氯,北京百灵威科技有限公司;Folin-ciocalteu(F-C)试剂,Biotopped;其他试剂,国产分析纯(纯度均大于99.5%);红曲样品,珠海友邦医药有限公司;血脂康胶囊(国药准字Z10950029),北京北大维信生物科技有限公司;高脂饲料(质量分数配方:碳水化合物48%、蛋白质21.1%、纤维4.7%、脂肪4.2%、猪油10%、灰分8%、钙1.8%、磷1%、胆固醇1%、胆酸盐0.2%),北京科奥协力饲料有限公司;普通鼠全价颗粒饲料Ⅰ号,北京维通利华实验动物技术有限公司;T-CHO、TG、T-SOD试剂盒,南京建成生物工程有限公司;SPF级ICR雄性小鼠,合格号SCXK(京)2012-0001,北京维通利华实验动物技术有限公司。
1.2 仪器与设备
UV-2450紫外-可见分光光度计、LC-20AT高效液相色谱仪、WondaSilTM C18柱(4.6 mm×150 mm,5 μm),日本岛津公司;BSA224S分析天平(感量0.001 g),赛多利斯科学仪器(北京)有限公司;KQ-300DE超声波提取器,昆山市超声仪器有限公司;QL-901漩涡振荡器,海门市其林贝尔仪器制造有限公司;KVC通风橱,北京航天科恩;GZX-9030MBE电热鼓风干燥箱,上海博迅实业有限公司医疗设备厂;TGL-10C高速台式离心机、TGL-10C高速台式离心机,上海安亭科学仪器厂;HH-4恒温水浴锅,江苏省荣华仪器制造有限公司;Spectra Max i3多功能酶标仪,美国Molecular Devices公司。
1.3 实验方法
1.3.1 Monacolin K
标准品预处理:准确称量Monacolin K标准品溶于75%(体积分数)甲醇配制200 mg/L标准溶液,0.45 μm有机微孔滤膜过滤,进样检测[10]。
样品预处理:准确称取待测样品0.30 g,加入25 mL 75%甲醇,200 W超声波辅助萃取30 min,静置过夜后10 000 r/min离心,0.45 μm有机微孔滤膜过滤,取滤液待测。
HPLC检测条件[ 10-12]:WondaSilTM C18色谱柱(4.6 mm×150 mm,5 μm),柱温箱30 ℃,进样量10 μL,流动相为V(甲醇)∶V(1 g/L磷酸)=3∶1,流速l.0 mL/min,紫外检测器检测波长238 nm。
1.3.2 红曲色素
根据GB 1886.181—2016《食品安全国家标准 食品添加剂 红曲红》和GB 1886.66—2015《食品安全国家标准 食品添加剂 红曲黄色素》,准确称取1.00 g加入60 mL 70%的乙醇溶液,超声处理20 min,恒温水浴60 ℃浸提1 h,4 000 r/min离心10 min,取上清液稀释1 000倍,紫外-分光光度计分别测定波长为505、410 nm的吸光度[13]。505 nm波长处吸光度对应红曲红色素含量,410 nm波长处吸光度对应红曲黄色素含量[14-15]。
1.3.3 粗多糖
根据中华人民共和国出入境检验检疫行业标准SN/T 4260—2015《出口植物源食品中粗多糖的测定 苯酚-硫酸法》,称取样品1.00 g并用5 mL去离子水浸润,加入20 mL无水乙醇,混合均匀,超声提取30 min,4 000 r/min离心10 min,去上清液。不溶物用10 mL 80%乙醇溶液洗涤、离心,并用50 mL去离子水转移,120 W超声提取30 min,重复2次。滤去不溶物,将上清液定容至200 mL待测。标准曲线用烘干至恒重的葡萄糖绘制。
1.3.4 氨基酸
准确称取5.00 g样品溶解于50 mL 6 mol/L盐酸溶液中,于110 ℃恒温干燥箱中消化24 h,振荡混匀后取5 mL消化液,加入50 mL去离子水稀释,调节体系pH值为8.2,加入甲醛溶液10 mL,用标准NaOH溶液滴定至体系pH值为9.2,根据记录消耗滴定液的体积计算样品中总氨基酸的含量[16]。
1.3.5 多酚
按照TORRES等[17]报道,首先将样品配制为5 mg/mL待测,取0.1 mL待测液,加入6 mL去离子水、0.5 mL F-C试剂,混匀后再加入1.5 mL 20%(质量分数)的Na2CO3溶液,用去离子水定容至10 mL,70 ℃水浴10 min,于765 nm处测定吸光值。标准溶液用没食子酸标准品绘制[18]。
1.3.6 γ-氨基丁酸
根据中华人民共和国农业行业标准NY/T 2890—2016《稻米中γ-氨基丁酸的测定 高效液相色谱法》,准确称取样品1.000 g加入10 mL 80%乙醇溶液,超声提取30 min,振荡混匀后静置5 min,5 000 r/min离心5 min,重复2次,将上清液合并后用80%乙醇溶液定容至25 mL储备,吸取1 mL储备液,加入0.20 mL 4%(质量分数)Na2CO3溶液和0.40 mL 4-二甲氨基偶氮苯-4’-磺酰氯的乙腈溶液,混匀后70 ℃水浴20 min进行衍生化,用0.45 μm水相微孔滤膜过滤待测。
HPLC检测条件:WondaSilTMC18色谱柱(4.6 mm×250 mm,5 μm);流动相为V(乙腈):V(质量分数0.68%三水合乙酸钠溶液)=7∶13,流速l.0 mL/min,紫外检测器检测波长436 nm,柱温箱30 ℃,进样量10 μL。
1.3.7 灌胃用药的配制
阴性对照液:5 g/L羧甲基纤维素钠(carboxymethylcellulose sodium,CMC-Na)溶液,准确称取CMC-Na 4.00 g溶于800 mL去离子水,加热溶解待用。
阳性对照液:有效成分质量浓度为10 mg/mL的血脂康溶液,准确称取0.3 g血脂康胶囊内容物,溶于30 mL 5 g/L CMC-Na溶液。
样品药液:高剂量组为质量浓度为210 mg/mL的样品溶液,准确称取10.50 g红曲样品,溶于50 mL 5 g/L CMC-Na溶液。中剂量组为质量浓度为140 mg/mL的样品溶液,准确称取7.00 g红曲样品,溶于50 mL 5 g/L CMC-Na溶液。低剂量组为质量浓度为70 mg/mL的样品溶液,准确称取3.50 g红曲样品,溶于50 mL 5 g/L CMC-Na溶液。
1.3.8 小鼠分组及灌胃给药
90只雄性ICR小鼠 (18~22 g),适应环境1周,喂食普通鼠全价颗粒饲料Ⅰ号,自由饮水、觅食。适应期后,平均分成9组,分别为模型组喂食高脂饲料,灌胃阴性对照液;正常组喂食普通鼠全价颗粒饲料Ⅰ号,灌胃阴性对照液;阳性对照组喂食高脂饲料,灌胃阳性对照液;实验组全部喂食高脂饲料,高剂量组给药210 mg/(kg·d),中剂量组给药140 mg/(kg·d),低剂量组给药70 mg/(kg·d)。每天灌胃1次,连续给药6周,持续供应饮用水,灌胃期间每隔3 d给小鼠称重,根据体重调整给药剂量。
1.3.9 对血清中T-CHO、TG和T-SOD的影响
连续灌胃6周结束后,小鼠禁食(不禁水)12 h,于眼球后静脉丛采血,血浆37 ℃水浴10 min后,于4 ℃、1 000 r/min离心l0 min,分离血清测定T-CHO、TG和T-SOD值,以探索所给药品对小鼠血清中相关指标的影响,测定方法参考T-CHO、TG和T-SOD试剂盒说明书。
1.4 数据分析
数据用“平均值±标准偏差” 表示,所有处理重复3次。采用Spss进行数据分析和显著性分析,P<0.01差异极显著;P<0.05,差异显著,并用Prism 9.0进行作图。
2 结果与分析
2.1 红曲功能性成分含量
红曲样品功能性成分含量如表1所示。
表1 红曲样品功能性成分含量
Table 1 Functional ingredients of red yeast products

样品名称普通红曲米功能红曲米水果红曲红曲滤渣Monacolin K含量/(mg/g)0 2.57±0.150 0.20±0.28红曲红色素色价/(U/g)264.00±20.312 236.00±33.121 046.00±16.97966.00±13.59红曲黄色素色价/(U/g)283.00±22.111 766.00±20.211 132.00±15.771 064.00±13.54粗多糖含量/(mg/g)144.96±10.23293.32±20.11198.76±11.3638.50±1.60氨基酸含量/(mg/g)175.00±12.11224.00±10.14140.00±0.14448.00±0.42多酚含量/(mg/g)5.60±0.5513.60±0.198.00±0.033.20±0.04γ-氨基丁酸含量/(mg/g)3.18±0.163.42±0.393.55±1.843.99±0.14
2.1.1 Monacolin K
测定结果表明功能性红曲中Monacolin K的含量为2.57 mg/g;普通红曲米和水果红曲溶液中不含有Monacolin K;红曲滤渣中Monacolin K含量为0.20 mg/g,故初步推断功能性红曲在降脂方面应有不俗的表现,其余3种红曲样品的调节血脂功能不强,是否具有预防高脂血症的能力有待在动物实验中证实。
2.1.2 红曲色素
功能性红曲米样品中红曲色素含量最多;水果红曲中红曲色素含量次之;红曲滤渣中红曲色素含量与水果红曲色素含量相差较小;普通红曲米中红曲色素含量最少,与功能性红曲米差距较大。
2.1.3 粗多糖
功能红曲米中粗多糖的含量为293.32 mg/g,约为普通红曲米的2倍;水果红曲中的粗多糖含量为198.76 mg/g,而红曲滤渣中粗多糖含量仅为38.50 mg/g,可能原因为前者是将水果作为发酵底物,发酵过程中产生大量多糖的同时,水果本身也含大量的还原性糖,而以培养基、发酵液为发酵底物的后者在此方面远不及水果红曲。
2.1.4 氨基酸
功能红曲米中氨基酸的含量为224.00 mg/g,普通红曲米中氨基酸的含量为175.00 mg/g;水果红曲中氨基酸含量为140.00 mg/g;红曲滤渣中氨基酸含量为448.00 mg/g,显著高于水果红曲,推测人工配制的培养基、发酵液中的氮源更适合菌种利用,利于红曲菌丝体代谢产生各种氨基酸,而以水果作为发酵底物的水果红曲,可利用氮源较匮乏,难以代谢产生大量氨基酸,故在氨基酸的含量方面,水果红曲显著低于红曲滤渣。
2.1.5 多酚
功能红曲米中多酚含量最多,为13.60 mg/g,水果红曲中多酚的含量次之,为8.00 mg/g;普通红曲米中的多酚含量为5.60 mg/g,红曲滤渣的多酚含量为3.20 mg/g,推测可能水果本身含有大量酚类或其前体物质,发酵过程中在水果红曲中不断积累,而人工配制的培养基、发酵液中含酚类物质较少,故红曲滤渣中含有的多酚含量低于水果红曲。
2.1.6 γ-氨基丁酸
功能红曲米中氨基酸的含量为3.42 mg/g,普通红曲米中氨基酸的含量为3.18 mg/g;水果红曲中γ-氨基丁酸含量为3.55 mg/g;红曲滤渣中的γ-氨基丁酸含量为3.99 mg/g,4种样品之间相差不大。
2.2 红曲样品调节体内血脂的研究结果
2.2.1 对血清中T-CHO、TG的影响
给药5周后,各组小鼠血脂指标如图1、图2所示。与模型组相比,正常组和阳性对照组小鼠T-CHO、TG均有不同程度的降低,分别较模型组降低31.43% (P<0.01) 和39.95% (P<0.01)、2.37% (P<0.05) 和2.06% (P<0.05)。结果表明,模型组小鼠患高脂血症,血液中T-CHO、TG的含量异常。灌胃功能性红曲米高剂量、功能性红曲米中剂量、功能性红曲米低剂量组的小鼠和模型组小鼠相比,T-CHO和TG均有降低,尤其是在T-CHO上降低尤其明显,均呈现差异极显著。证明功能性红曲米样品无论浓度高低,都有比较强的降血脂效果。灌胃普通红曲米、水果红曲和红曲滤渣样品的高剂量、中剂量、低剂量组的小鼠和模型组小鼠相比,T-CHO含量有一定程度的降低,可以推断出普通红曲米、水果红曲及红曲滤渣样品也有一定的降血脂能力,但在T-CHO上降血脂能力不如功能性红曲。4种样品灌胃的小鼠血脂水平有不同程度的改善,证明此4种红曲样品确有调节血脂的效果,且效果随着剂量的增加而增强。
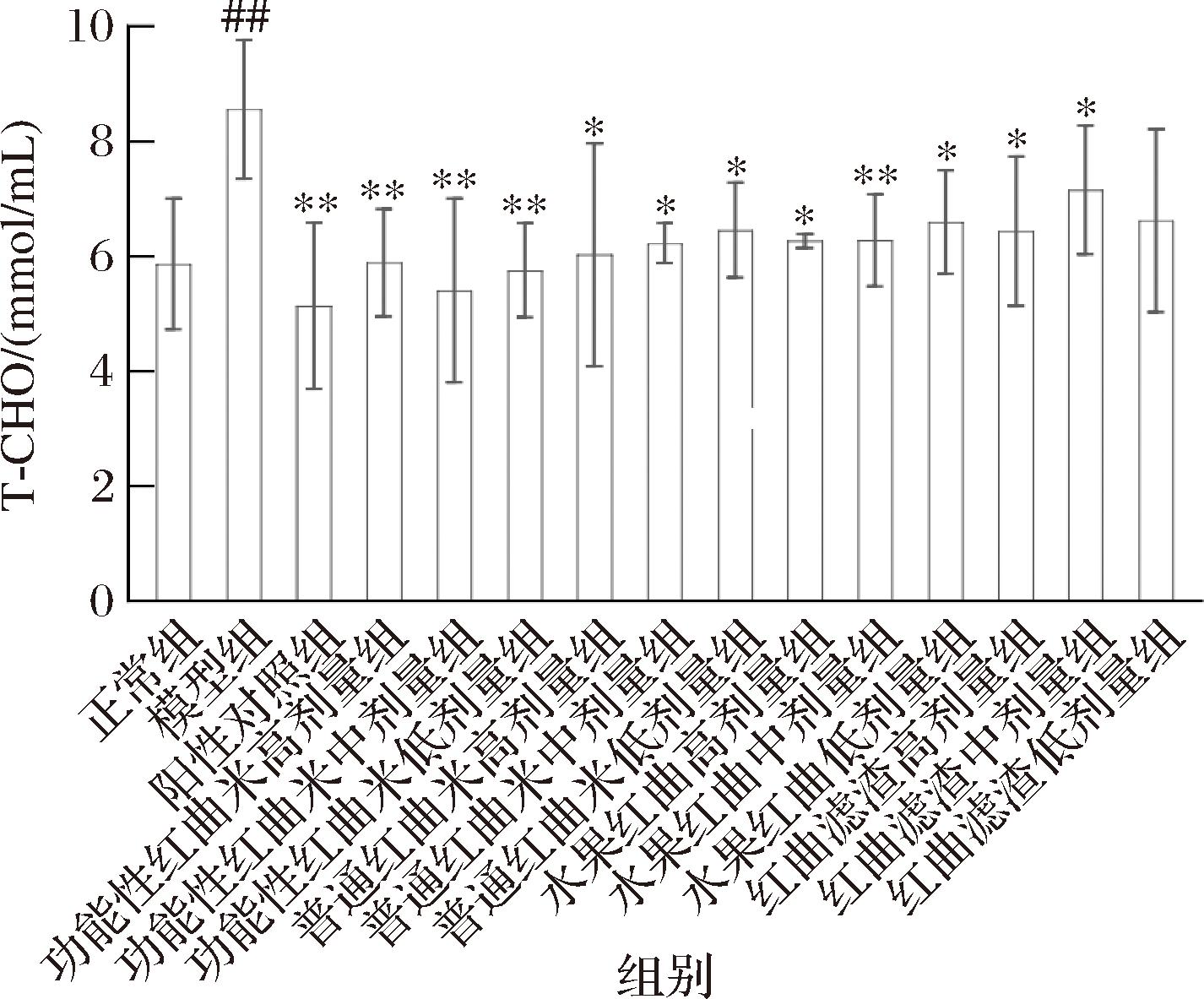
图1 各组小鼠血清中T-CHO含量的比较(±s,n=15)
Fig.1 Comparison of T-CHO content in the serum of each group (±s,n=15)
注:模型组:0.5%CMC-Na(喂食高脂饲料);正常组:0.5%CMC-Na(喂食普通鼠全价颗粒饲料Ⅰ号);阳性对照组:血脂康药物溶液[10 mg/(kg·d)];样品组:高剂量组210 mg/(kg·d)、中剂量组140 mg/(kg·d)、低剂量70 mg/(kg·d);##:与正常组比较,P<0.01差异极显著;*:与模型组比较, P<0.05差异显著;**:与模型组比较,P<0.01差异极显著(下同)。
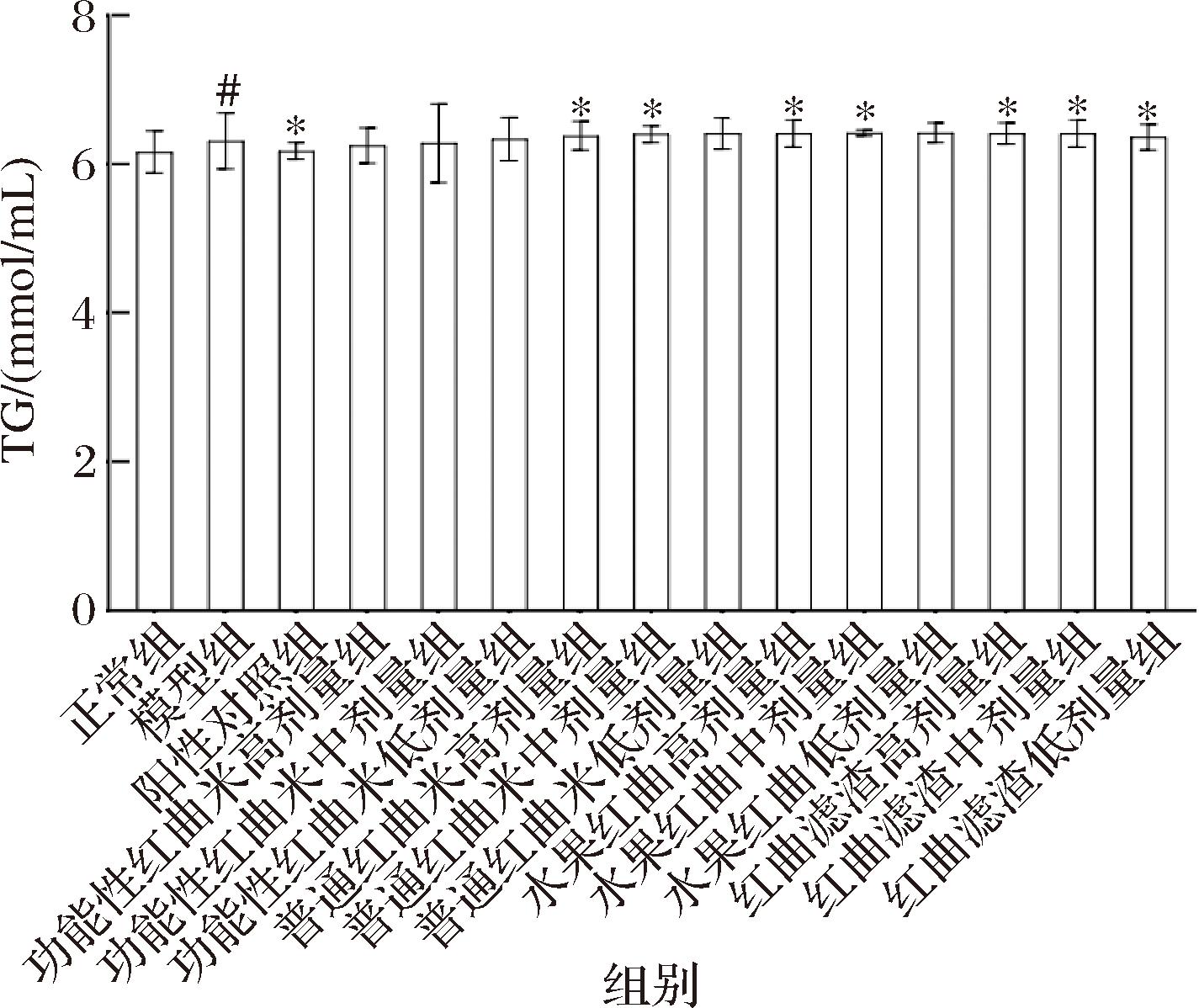
图2 各组小鼠血清中TG含量的比较(±s,n=15)
Fig.2 Comparison of TG content in the serum of each group (± s, n=15)
注:#:与正常组比较,P<0.05差异显著(下同)。
2.2.2 对血清中T-SOD的影响
给药5周后,各组小鼠氧化指标如图3所示。与模型组相比,正常组和阳性对照组小鼠T-SOD指标提高,分别较模型组提高20.34% (P<0.05)和16.93% (P<0.05)。结果表明,模型组小鼠抗氧化能力受损,超氧化物歧化酶活性降低。灌胃4种红曲米样品的实验组小鼠和模型组小鼠相比,各组抗氧化指标虽有不同程度上的增加,但无显著差异,推测可能是由于实验时间过短导致的,如延长实验时间,实验组与模型组相比可能出现显著差异。
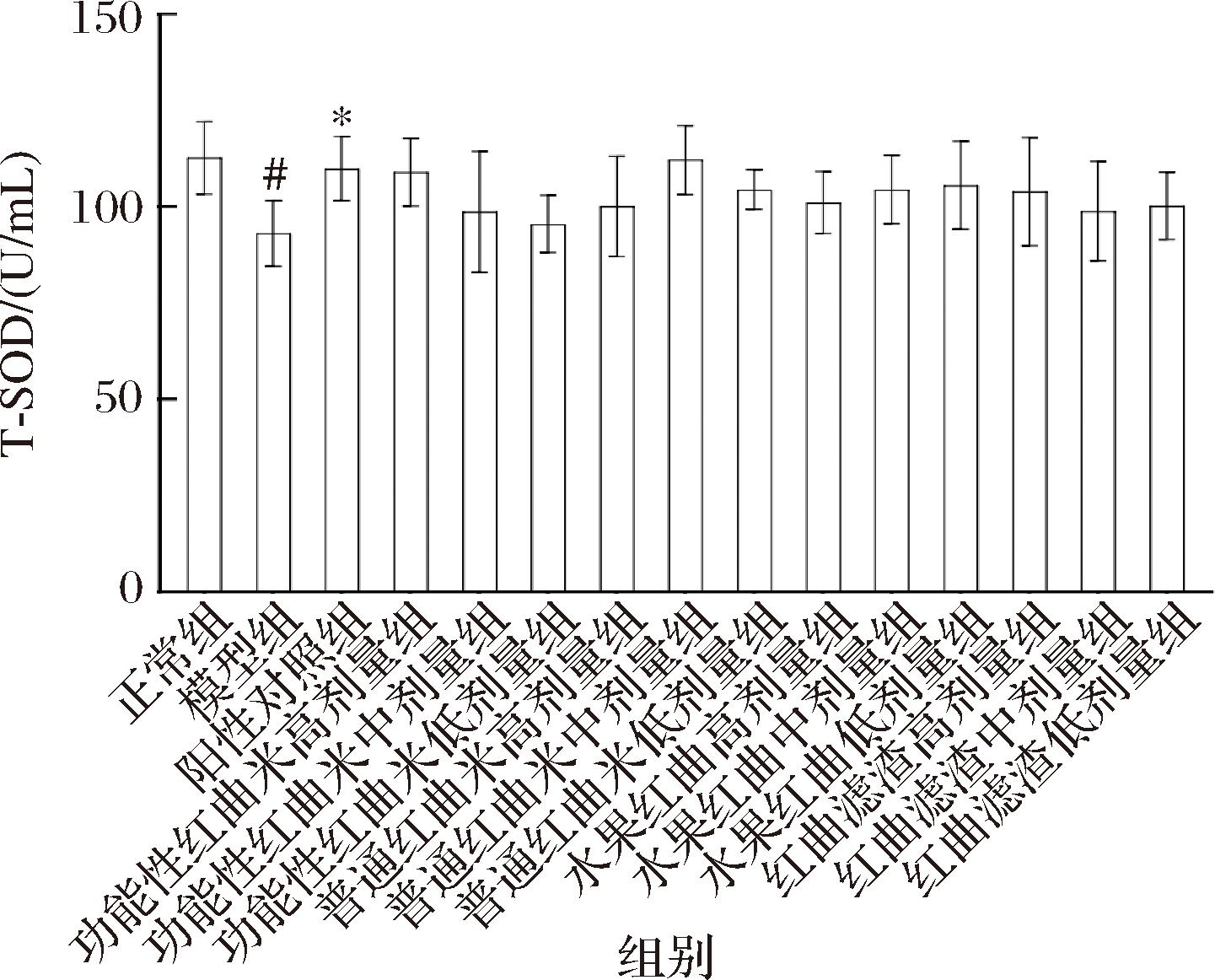
图3 各组小鼠氧化指标的比较(±s,n=15)
Fig.3 Comparison of oxidative index in different groups (± s, n = 15)
3 结论与讨论
本研究对4种红曲样品(普通红曲米、功能性红曲米、水果红曲及红曲滤渣)中Monacolin K、红曲色素、粗多糖、氨基酸、多酚、γ-氨基丁酸6种功能性成分含量的测定及体内实验证实了其调节血脂作用,同时通过对实验动物体内抗氧化指标的测定,也推测了此4种红曲样品可能具备提高机体抗氧化能力的功能。得出主要结论如下:4种样品中功能性红曲米的Monacolin K含量最高,普通红曲米和水果红曲中不含有Monacolin K;功能性红曲米中红曲色素、粗多糖以及多酚的含量最多;红曲滤渣中氨基酸和γ-氨基丁酸的含量最丰富。根据动物实验中表现出的不同降脂效果,初步推断4种样品中,功能性红曲米辅助降血脂的效果最明显,红曲滤渣的降血脂效果甚微,普通红曲米和水果滤渣可能没有降血脂的作用。出现此实验结果的原因可能为:灌胃小鼠100 mg/(kg·d)的红曲色素对所有血脂指标均有极显著的作用效果[2],本实验所用红曲产品虽只含有少量Monacolin K,但仍具有调节血脂作用。样品中功能性物质含量的差异可能导致它们在降血脂效果上的差别。且4种样品来源、制作工艺各不相同,这可能是导致它们功能性物质含量不同的原因之一。
但本研究只简单测量分析了4种红曲米样品中功能性物质的含量,并没有更进一步地研究出活性物质的差异对小鼠各项指标的具体影响,且实验只是对4种样品的降血脂能力做了粗略的定性分析没有做定量的研究。据文献报道,红曲的保健功能远不止于此[19-25]。但目前对红曲样品保健功能的探讨多以研究单一功能性成分的作用为主,缺乏对红曲样品中各功能性成分协同作用的了解和深究,红曲降血脂作用机理尚未明确,仍需进一步探究。
[1] 殷梦梅, 叶晖, 张学智.红曲单药及复方制剂治疗高脂血症的研究进展[J].医学综述, 2017, 23(2):344-347.YIN M M, YE H, ZHANG X Z.Research progress of Monascus purpureus single drug and compound preparation in the treatment of hyperlipidemia[J].Medical Recapitulate, 2017, 23(2):344-347.
[2] 陈春艳. 红曲中功能成分的分离与功能评价[D].武汉:华中农业大学, 2004.CHEN C Y.Isolation and functional evaluation of functional components in Monascus[D].Wuhan:Huazhong Agricultural University, 2004.
[3] WANG C R, ZAYAS J F.Water retention and solubility of soy proteins and corn germ proteins in a model system[J].Journal of Food Science, 1991, 56(2):455-458.
[4] 刘海荣, 沈益荣, 舒满夫.小麦面筋蛋白结构、改性及应用现状[J].粮食与饲料工业, 2021(4):5-9.LIU H R, SHEN Y R, SHU M F.Research status on the structure, modification and application of wheat gluten protein[J].Cereal &Feed Industry, 2021(4):5-9.
[5] 张文菱子, 张泽生, 刘亚萍, 等.山楂、甾醇酯及功能红曲复配物的降血脂活性[J].食品工业科技, 2019, 40(20):316-324.ZHANG W, ZHANG Z S, LIU Y P, et al.Hypolipidemic activity of hawthorn, sterol ester and functional red yeast rice compound[J].Science and Technology of Food Industry, 2019, 40(20):316-324.
[6] WU J, WARREN F J.The impact of the soluble protein fraction and kernel hardness on wheat flour starch digestibility[J].Food Chemistry, 2023, 406:135047.
[7] PATAKOVA P.Monascus secondary metabolites:Production and biological activity[J].Journal of Industrial Microbiology &Biotechnology, 2013, 40(2):169-181.
[8] RAHAYU Y Y, YOSHIZAKI Y, YAMAGUCHI K, et al.Key volatile compounds in red koji-shochu, a Monascus-fermented product, and their formation steps during fermentation[J].Food Chemistry, 2017, 224:398-406.
[9] 林瑾, 周康熙.红曲色素组分分析与功效评估研究进展[J].莆田学院学报, 2023, 30(5):11-18.LIN J, ZHOU K X.Research progress in component analysis and efficacy evaluation of Monascus pigments[J].Journal of Putian University, 2023, 30(5):11-18.
[10] 郑平, 覃先武, 张彦, 等.高产开环型monacolin K红曲霉菌株的筛选及其在红曲酒酿造中的应用[J].中国酿造, 2023, 42(3):129-134.ZHENG P, QIN X W, ZHANG Y, et al.Screening of Monascus spp.strain with high-yield open-loop monacolin K and its application in Hongqujiu brewing[J].China Brewing, 2023, 42(3):129-134.
[11] 胡文效, 魏彦锋, 蒋锡龙, 等.高产Monacolin K红曲霉菌种的诱变选育及液态发酵工艺优化[J].食品工业科技, 2013, 34(24):296-301.HU W X, WEI Y F, JIANG X L, et al.Mutagenic breeding of the high-yield Monacolin k strains of Monascus sp.and process optimization its submerged fermentation[J].Science and Technology of Food Industry, 2013, 34(24):296-301.
[12] ROBINS DAMON H, SEEWALD MEGAN E, CLEMENT BEVERLY A.Development of a rapid detection method for citrinin and monacolin K[J].Abstracts of Papers of the American Chemical Society, 2014, 247.
[13] 唐光甫, 满海乔, 赵杰宏, 等.紫色红曲霉Mrr2基因的过表达对桔霉素积累的影响[J].安徽农业科学, 2023, 51(20):1-5.TANG G F, MAN H Q, ZHAO J H, et al.Effect of overexpression of Mrr2 gene in Monascus purpureus on citrinin accumulation[J].Journal of Anhui Agricultural Sciences, 2023, 51(20):1-5.
[14] TAKAHASHI R, CHYSIRICHOTE T, ASAMI K, et al.Effect of oxygen mass transfer between the gas and liquid phases on the production of Monascus red pigments by Monascus ruber[J].Journal of Chemical Engineering of Japan, 2013, 46(8):546-549.
[15] BODAKOWSKA-BOCZNIEWICZ J, GARNCAREK Z.Naringinase biosynthesis by Aspergillus niger on an optimized medium containing red grapefruit albedo[J].Molecules, 2022, 27(24):8763.
[16] 洪炳财. 蚕蛹蛋白水解液中游离氨基酸测定方法初探[J].食品工程, 2013(1):11-14.HONG B C.Primary study on determination method of free amino acids in the Pupa protein hydrolyzate[J].Food Engineering, 2013(1):11-14.
[17] TORRES A M, MAU-LASTOVICKA T, REZAAIYAN R.Total phenolics and high-performance liquid chromatography of phenolic acids of avocado[J].Journal of Agricultural and Food Chemistry, 1987, 35(6):921-925.
[18] 吕道俊, 郭秋平, 欧慧瑜, 等.水溶性番茄浓缩物及复配红曲粉降血脂功效研究[J].现代食品, 2023, 29(21):102-106.LYU D J, GUO Q P, OU H Y, et al.Study on the assistant hypolipidemic function of water soluble tomato concentrate and compound red yeast powder[J].Modern Food, 2023, 29(21):102-106.
[19] HE T, DONG T.Research on the application of red music in the construction of curriculum civics based on the knowledge dissemination model[J].Applied Mathematics and Nonlinear Sciences, 2024, 9(1):20230762.
[20] 刘科. 功能红曲的发酵生产、品质评价及功能活性成分表征[D].福州:福州大学, 2021.LIU K.Fermentation production, quality evaluation and characterization of functional active components of functional Monascus[D].Fuzhou:Fuzhou University, 2021.
[21] QIN X L, XIE B, ZONG X L, et al.Selective production, relationship and controversy between Monascus pigments and citrinin[J].Food Bioscience, 2023, 56:103233.
[22] CHEN G, ZHAO W Q, ZHAO L, et al.Regulation of the pigment production by changing cell morphology and gene expression of Monascus ruber in high-sugar synergistic high-salt stress fermentation[J].Journal of Applied Microbiology, 2023, 134(10):lxad207.
[23] CAMPOY S, RUMBERO A, MART N J F, et al.Characterization of an hyperpigmenting mutant of Monascus purpureus IB1:Identification of two novel pigment chemical structures[J].Applied Microbiology and Biotechnology, 2006, 70(4):488-496.
N J F, et al.Characterization of an hyperpigmenting mutant of Monascus purpureus IB1:Identification of two novel pigment chemical structures[J].Applied Microbiology and Biotechnology, 2006, 70(4):488-496.
[24] 黄丹丹, 周海媚, 李谣, 等.苦荞红曲保健酒的抗氧化活性[J].中国酿造, 2014, 33(6):99-102.HUANG D D, ZHOU H M, LI Y, et al.Antioxidant activity of red kojic buckwheat health wine[J].China Brewing, 2014, 33(6):99-102.
[25] KOVALEV S, GOLOVACH A, KOVALEV V, et al.Study and determination of fructan-type polysaccharide content in Erigeron annuus L[J].Current Issues in Pharmacy and Medical Sciences, 2022, 35(2):95-98.