便秘是一种全球普遍存在的人类肠道疾病,全球患病率为10.1%~15.3%[1]。不同年龄段患病率不同,老年人发病率最高,其次是婴幼儿[2]。在就医的婴幼儿中,便秘患者所占比例达5%。便秘在临床上表现为排便周期长、粪便干硬或排除困难。便秘严重影响患者的生活质量和身体机能,给社会和患者带来长期的医疗负担[3]。因此,如何有效治疗便秘已成为人们非常关注的问题。
影响排便的主要因素包括神经系统和免疫系统[4]。胃肠道调节肽由神经系统和胃肠道内分泌细胞产生的胃肠道激素,是胃肠道蠕动和液体运输的关键调节物质。已经报道多种胃肠道调节肽与便秘密切相关[5],包括胃动素、胃泌素、P 物质(substance P,SP)和血管活性肠肽等[6-8]。同时,便秘会导致宿主肠道健康受损,比如,肠道组织结构病变,发生炎症反应,肠道屏障功能受损[9]。此外,胃肠道动力及排便能力与肠道菌群息息相关,便秘患者肠道有益微生物的丰度显著减少[10]。因此,基于调节肠道菌群来改善便秘成为研究热点。
乳糖-N-新四糖是母乳中最丰富的低聚糖之一,约占母乳中总低聚糖的6%[11]。它是一种中性低聚糖,由4个单糖分子组成,包括2个半乳糖、1个葡萄糖和1个N-乙酰葡糖胺[12]。目前,乳糖-N-新四糖已经在中国、美国、欧盟和澳大利亚等国家和地区被批准在食品中应用。一项临床喂养研究发现,乳糖-N-新四糖能够增加婴儿肠道双歧杆菌丰度[13]。此外,大量研究也报道了乳糖-N-新四糖具有调节肠道免疫和屏障功能[11, 14]。然而,尚没有关于乳糖-N-新四糖改善便秘的研究。同时,乳糖-N-新四糖对肠道菌群的调节能力能否在便秘患者中发挥积极作用仍未可知。
本研究利用洛哌丁胺诱导的便秘小鼠模型,评估了乳糖-N-新四糖对小鼠便秘表型、胃肠道调节肽含量、肠道免疫及粘蛋白分泌的影响。同时,检测了小鼠肠道菌群组成。从肠道菌群分析乳糖-N-新四糖改善便秘的可能机制。
1 材料与方法
1.1 材料与试剂
洛哌丁胺,上海源叶生物科技有限公司;乳糖-N-新四糖,一兮生物科技有限公司;胃泌素、胃动素、SP、血管活性肠肽、IL-6、IL-1β和IL-10酶联免疫吸附试剂盒,南京建成生物工程研究所;粘蛋白2(mucin 2,MUC2)抗体,武汉三鹰生物技术有限公司;原位荧光杂交固定液,武汉赛维尔生物科技有限公司。
1.2 实验动物
6周龄Balb/c小鼠购自北京维通利华有限公司,共45只,其中27只用做乳糖-N-新四糖作用验证,9只用做小肠运动实验,9只用做全肠转运实验。质量许可证号:SCXK2021-0006,本研究被哈尔滨维科生物技术有限公司实验动物管理及伦理委员会批准,批准号为JL-SD-0191-202412。
1.3 实验方法
1.3.1 动物分组及模型构建
所有小鼠生活在可控的环境中,每笼3只大鼠,可自由使用标准实验室食物和水。实验环境设置为12 h明暗循环,温度和湿度保持在(22±2)℃和(45±5)%。经过适应性喂养后,随机分为3组,分别是正常对照组(Ctrl组)、模型组(Model组)和乳糖-N-新四糖组(LNnT组)。Model组和LNnT组采用10 mg/kg洛哌丁胺进行便秘模型构建,持续14 d。Ctrl组灌胃等量的生理盐水。在每日灌胃洛哌丁胺1 h后,LNnT组灌胃450 mg/kg乳糖-N-新四糖进行治疗。Model组和Ctrl组灌胃等量的生理盐水。饲喂14 d结束后,测量小鼠体重,并取小鼠回肠、结肠、粪便和眼球血。
1.3.2 小肠转运实验与胃排空率
各组分别单独饲养3只小鼠,建模与治疗处理同1.3.1节,在实验最后一天灌胃洛哌丁胺 30 min后,按照 0.1 mL/10 g·BW灌胃墨汁,30 min 后脱臼处死,小心取出完整的小肠放在锡纸上拉直,测定墨汁距离胃最底部的距离。每只小鼠小肠运动速率以墨汁推进长度相对于小肠总长度的百分比计算。收集小鼠胃组织,称量质量后,将胃解剖去除内容物,清洗后再次称重,并计算胃排空率。
1.3.3 首粒黑便时间与粪便含水率
各组分别单独饲养3只小鼠,建模、治疗及墨汁给药处理同1.3.1节和1.3.2节,记录每只小鼠首粒黑便出现时间,即为全肠转运时间。收集接下来6 h 每只小鼠的粪便,称量质量后,使用烘箱将粪便烘干,每只小鼠小粪便含水率以烘干前后质量差相对于粪便湿重的百分比计算。
1.3.4 血清胃肠道调节肽测量
使用酶联免疫吸附法试剂盒测定小鼠血清中胃泌素、胃动素、SP和血管活性肠肽的水平。
1.3.5 苏木精-伊红染色
回肠组织保存在4%(质量分数)的多聚甲醛固定液中,使用石蜡包埋,并切成4 μm的切片。随后采用苏木精-伊红进行染色,在光学显微镜下观察回肠组织形态和病理学变化,并测量绒毛长度和隐窝深度。
1.3.6 肠道细胞因子检测
使用酶联免疫吸附法试剂盒测定小鼠回肠中IL-6、IL-1β和IL-10的水平。
1.3.7 免疫荧光检测MUC2
结肠组织保存在原位荧光杂交固定液,如1.3.5节所述制成4 μm的切片。采用MUC2抗体于4 ℃孵育过夜,置于PBS中在脱色摇床上洗涤3次,每次5 min。滴加对应的荧光素标记的二抗,室温孵育50 min。随后,滴加4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)染液,避光孵育8 min,冲洗后滴加抗荧光淬灭封片剂封片。切片于正置荧光显微镜下观察并采集图像。
1.3.8 小鼠肠道MUC2和Agr2转录水平分析
采用先前所述的方法提取RNA后进行反转录,MUC2和Agr2引物如表1所示,采用PCR仪进行扩增,采用2-ΔΔCT法分析特异性基因的相对表达。
表1 用于反转录定量 PCR 检测的引物序列
Table 1 Primer sequences for reverse transcription quantitative PCR assay

引物引物序列(5′→3′)MUC2F:ATGCCCACCTCCTCAAAGACR:GTAGTTTCCGTTGGAACAGTGAAAgr2F:GCCAAAGACACCACAGTCAAR:CCATCAAGGGTCTGTTGCTTRPL19F:GAAGGTCAAAGGGAATGTGTTCAR:CCTGTTGCTCACTTGT
1.3.9 16S rRNA测序分析小鼠肠道菌群变化
使用粪便DNA试剂盒提取小鼠肠道内容物DNA,分别使用上游引物F(341F:5′-CCTACGGGNGGCWCAG-3′)和下游引物R(806R:5′-GGACTACHVGGGTATCTAAT-3′) 扩增16S V3~V4区。16S rRNA测序由上海凌恩生物科技有限公司进行。使用该公司的在线数据处理平台(http://www.cloud.biomicroclass.com/)进行分析,包括菌群多样性、物种组成注释及线性判别分析。
1.4 统计分析
所有实验至少重复3次,数据以平均值±标准差表示。使用SPSS 22软件的配对样本方差T检验进行显著性统计。
2 结果与分析
2.1 乳糖-N-新四糖对便秘小鼠表型的影响
由图1-A可知,各组小鼠体重差异不显著(P>0.05),表明便秘和乳糖-N-新四糖没有引起小鼠生长性能的改变。针对便秘的主要临床症状,评估了乳糖-N-新四糖对便秘的缓解作用。临床症状包括小鼠粪便含水率、胃排空率、小肠转运时间和首粒黑便时间。如图1-B所示,与Ctrl组相比,Model组小鼠粪便含水率显著增加(P<0.001)。当灌胃乳糖-N-新四糖后,小鼠粪便含水率增高20.89%。由于便秘患者的胃肠道蠕动下降,胃排空率反映了小鼠胃肠道蠕动的变化。与预期一致,便秘小鼠胃排空率下降,而经过乳糖-N-新四糖处理后,小鼠胃排空率增加19.94%(图1-C)。本研究分析了小鼠小肠转运率和首粒黑便时间,结果显示,与Ctrl组相比,Model组小鼠小肠转运率显著降低(图1-D,P<0.001),且首粒黑便出现时间显著延长(图1-E,P<0.01)。与Model组相比,乳糖-N-新四糖样品增加了74.48%的小肠转运率,使得首粒黑便出现时间缩短91 min。以上结果表明乳糖-N-新四糖能够改善洛哌丁胺引起的小鼠便秘。
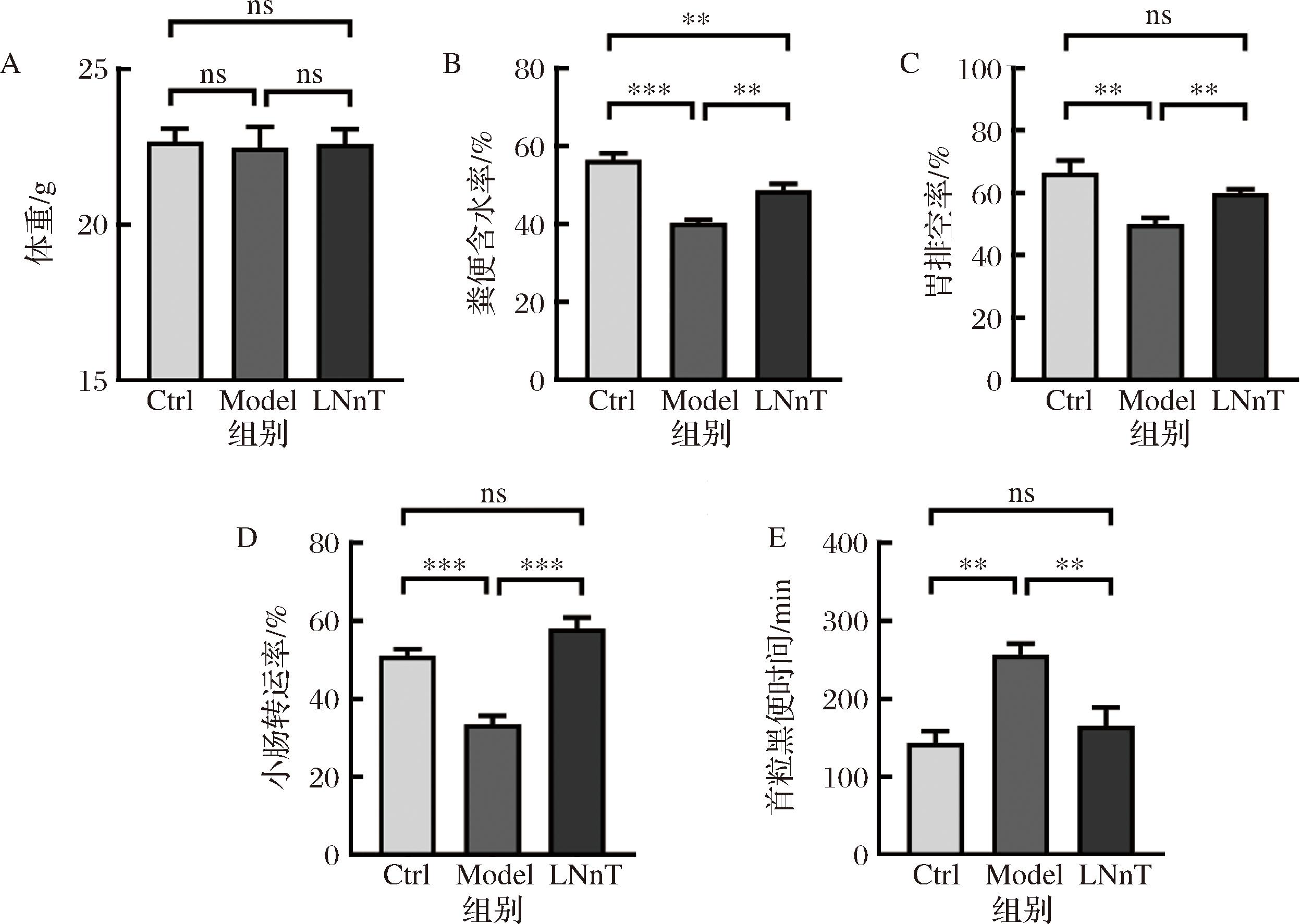
A-体重;B-粪便含水率;C-胃排空率;D-小肠转运率;E-首粒黑便时间
图1 乳糖-N-新四糖对小鼠便秘表型的改善作用
Fig.1 Improvement effect of lacto-N-neotetraose on constipation phenotype in mice
注:*代表P<0.05,**代表P<0.01,***代表P<0.001,ns代表P>0.05(下同)。
2.2 乳糖-N-新四糖对便秘小鼠血清中胃肠道调节肽的影响
宋晓妍等[15]在评估益生菌黑茶对便秘的影响时,用胃泌素、胃动素和SP反映小鼠兴奋型胃肠道调节肽水平。而马腾[16]采用血管活性肠肽分析了便秘小鼠抑制型胃肠道调节肽水平。兴奋型胃肠道调节肽和抑制型胃肠道调节肽在便秘中具有重要作用,它们能够调节胃肠道的运动,但二者作用效果相反。本研究采用胃泌素、胃动素、SP和血管活性肠肽评估了乳糖-N-新四糖对便秘小鼠胃肠道调节肽的影响。如图2-A~图2-C所示,与Ctrl组相比,Model组小鼠血清中胃泌素、胃动素和SP含量显著降低(P<0.001)。经过乳糖-N-新四糖处理后,小鼠胃泌素、胃动素和SP含量分别增加了28.76%、45.58%和17.06%。此外,便秘小鼠与Ctrl组相比血管活性肠肽显著升高(P<0.001),表明便秘宿主体内抑制肠道蠕动的调节肽含量更高。而乳糖-N-新四糖干预后,小鼠血管活性肠肽含量降低了27.60%,且与Ctrl组没有显著差异(P>0.05)。由此可见,乳糖-N-新四糖能够促进兴奋型胃肠道调节肽增加,减少抑制型胃肠道调节肽含量,从而增强便秘小鼠的胃肠道蠕动,缩短排便时间。
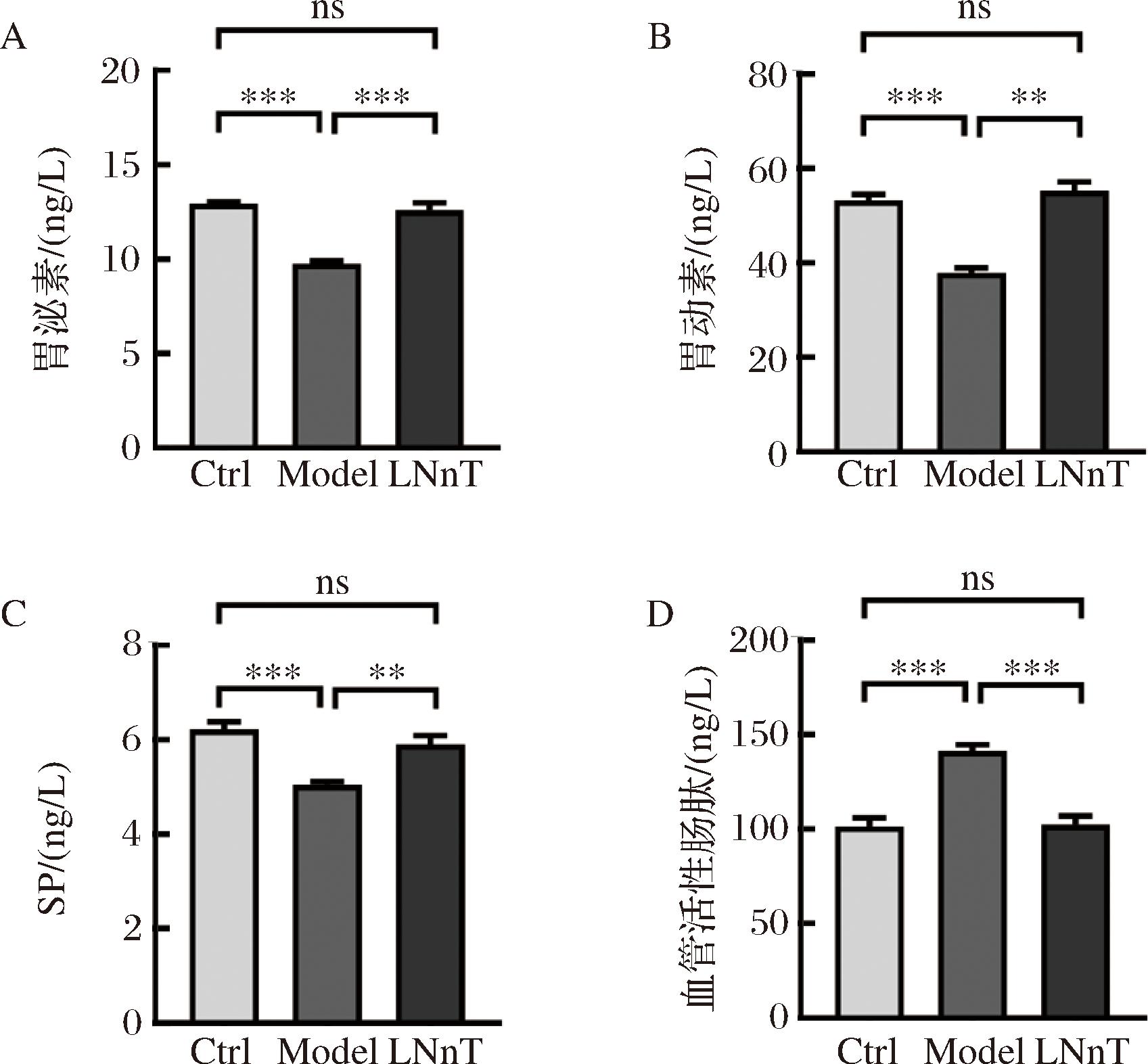
A-胃泌素;B-胃动素;C-P物质;D-血管活性肠肽
图2 乳糖-N-新四糖对小鼠胃肠道调节肽的改善作用
Fig.2 Improvement effect of lacto-N-neotetraose on gastrointestinal regulatory peptides in mice
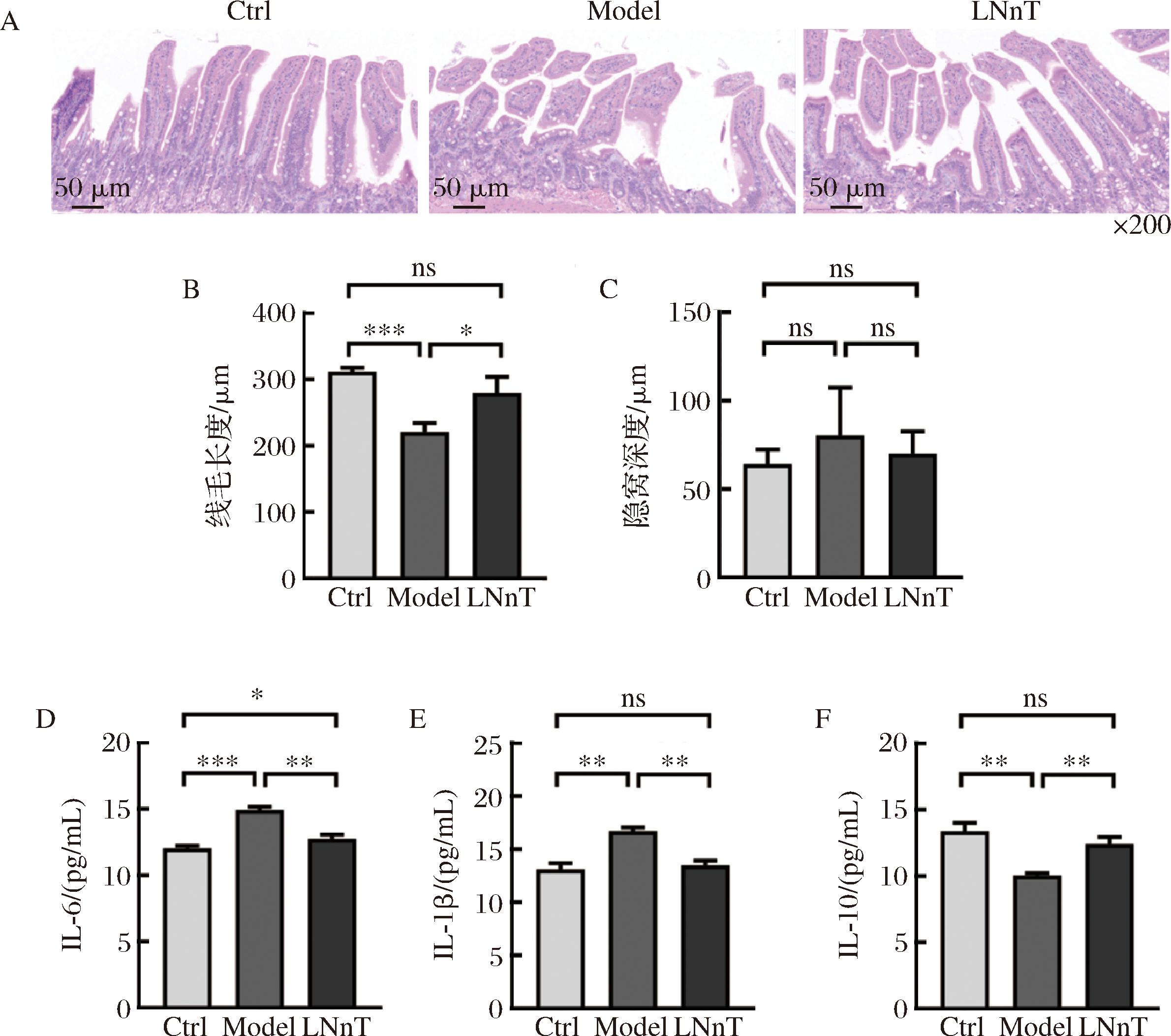
A-HE染色观察;B-绒毛长度;C-隐窝深度;D-IL-6含量;E-IL-1β含量;F-IL-10含量
图3 乳糖-N-新四糖对小鼠肠道组织结构与炎症的改善作用
Fig.3 Improvement effect lacto-N-neotetraose on intestinal tissue structure and inflammation in mice
2.3 乳糖-N-新四糖对便秘小鼠肠道损伤和炎症的影响
便秘会引起肠道组织细胞的损伤和炎症反应的发生。各组小鼠肠道组织苏木精-伊红染色分析结果如图3-A所示。Ctrl组小鼠肠道细胞排列紧密,绒毛结构完整且排列整齐。而Model组小鼠绒毛断裂,出现严重的细胞损伤和炎症。经乳糖-N-新四糖处理后,绒毛结构有所修复,上皮细胞排列整齐,炎症减轻。本研究还统计了小鼠绒毛长度和隐窝深度,如图3-B和图3-C所示。与Ctrl组相比,Model组小鼠绒毛显著变短(P<0.001),而灌胃乳糖-N-新四糖能够显著增加绒毛长度(P<0.05)。此外,各组小鼠隐窝深度没有显著差异(P>0.05)。
本研究通过分析小鼠肠道中细胞因子IL-6、IL-1β和IL-10水平,来评估乳糖-N-新四糖对炎症的调节作用。其中,IL-6和IL-1β是促炎细胞因子,IL-10则属于抗炎细胞因子,它们分别负责炎症的发生和抑制。与Ctrl组相比,Model组小鼠促炎细胞因子水平显著增加(图3-D和图3-E,P<0.01),而抗炎细胞因子水平显著降低(图3-F,P<0.01)。经乳糖-N-新四糖处理后,小鼠促炎细胞因子水平降低了14.48%~19.26%,抗炎细胞因子水平增加了23.68%。因此,乳糖-N-新四糖能够有效改善便秘小鼠肠道组织结构和炎症反应。
2.4 乳糖-N-新四糖对便秘小鼠肠道MUC2的影响
肠道黏液由杯状细胞分泌,是肠道固有免疫的组成部分[17-18]。一方面,它能够抵御肠道有害菌群的入侵,维持肠道屏障功能。另一方面,它还起到润滑作用,能促进食物在胃肠蠕动的作用下进一步消化吸收,有助于粪便的排出。肠道黏液的核心成分是黏多糖组成的糖蛋白,典型的结构是MUC2,它是黏液发挥屏障和润滑功能的有效物质[19]。本研究分析了小鼠肠道内MUC2的含量和基因表达量,来分析乳糖-N-新四糖对小鼠MUC的影响。结果如图4-A所示,Ctrl组小鼠MUC2绿色荧光强度高,MUC2填充在细胞间。而Model组小鼠MUC2绿色荧光强度降低,更分散。经乳糖-N-新四糖处理后,细胞间MUC2荧光强度增加。MUC2 mRNA的表达量与免疫荧光结果一致,灌胃乳糖-N-新四糖的小鼠肠道内MUC2 mRNA是Model组的3.84倍(图4-B)。前梯度2(AGR2)是一种蛋白质二硫键异构酶,对于MUC2翻译后的正确加工至关重要[20]。与Ctrl组相比,Model组MUC2 mRNA水平显著降低(图4-C,P<0.01),而乳糖-N-新四糖干预后,MUC2 mRNA水平增加了2.04倍。以上结果表明,乳糖-N-新四糖能够增加小鼠肠道MUC2产生来改善便秘。
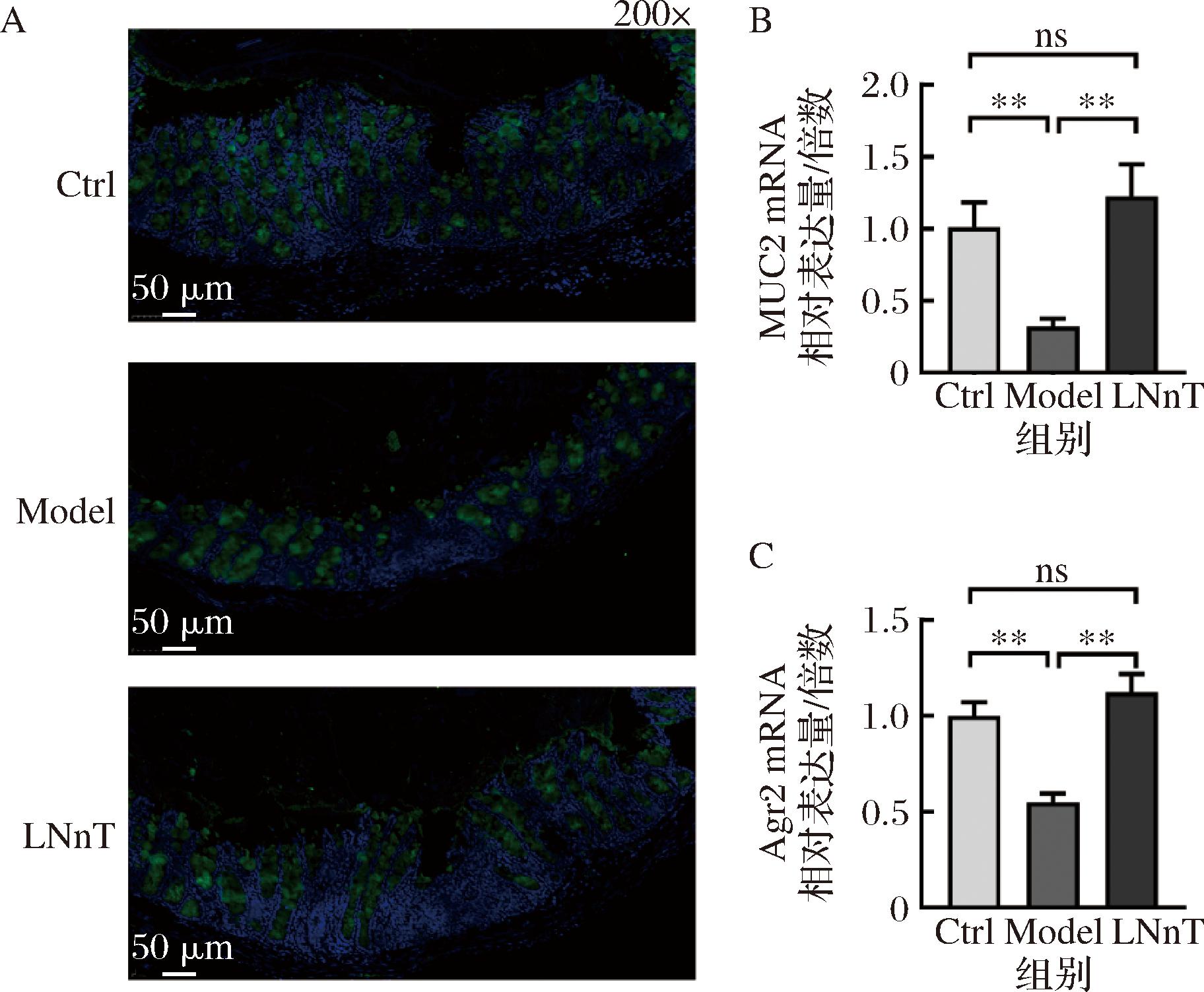
A-MUC2的免疫荧光分析;B-MUC2 mRNA相对表达量;C-Agr2 mRNA相对表达量
图4 乳糖-N-新四糖增加了小鼠肠道MUC2含量
Fig.4 Increase of intestinal MUC2 content in mice by lacto-N-neotertaose
2.5 乳糖-N-新四糖对便秘小鼠肠道菌群的影响
本研究采用16S rRNA检测了小鼠肠道菌群组成,来分析乳糖-N-新四糖对小鼠肠道菌群多样性和组成的影响。
2.5.1 肠道菌群多样性分析
由α-多样性丰富度曲线可知,3组小鼠肠道菌群丰富度相似(图5-A)。同时,代表目种数目的observed species指数在3组直接也没有显著差异(P>0.05)。值得注意的是,主成分分析(principal component analysis,PCA)显示各组小鼠肠道菌群内聚性好,组间分离明显。Model组与Ctrl组在PC2水平相距较远,而乳糖-N-新四糖组与Model组在PC1水平上距离较大(图5-C)。以上结果表明,便秘和乳糖-N-新四糖处理没有引起小鼠肠道菌群α-多样性的改变,可能对菌群组成产生了影响。
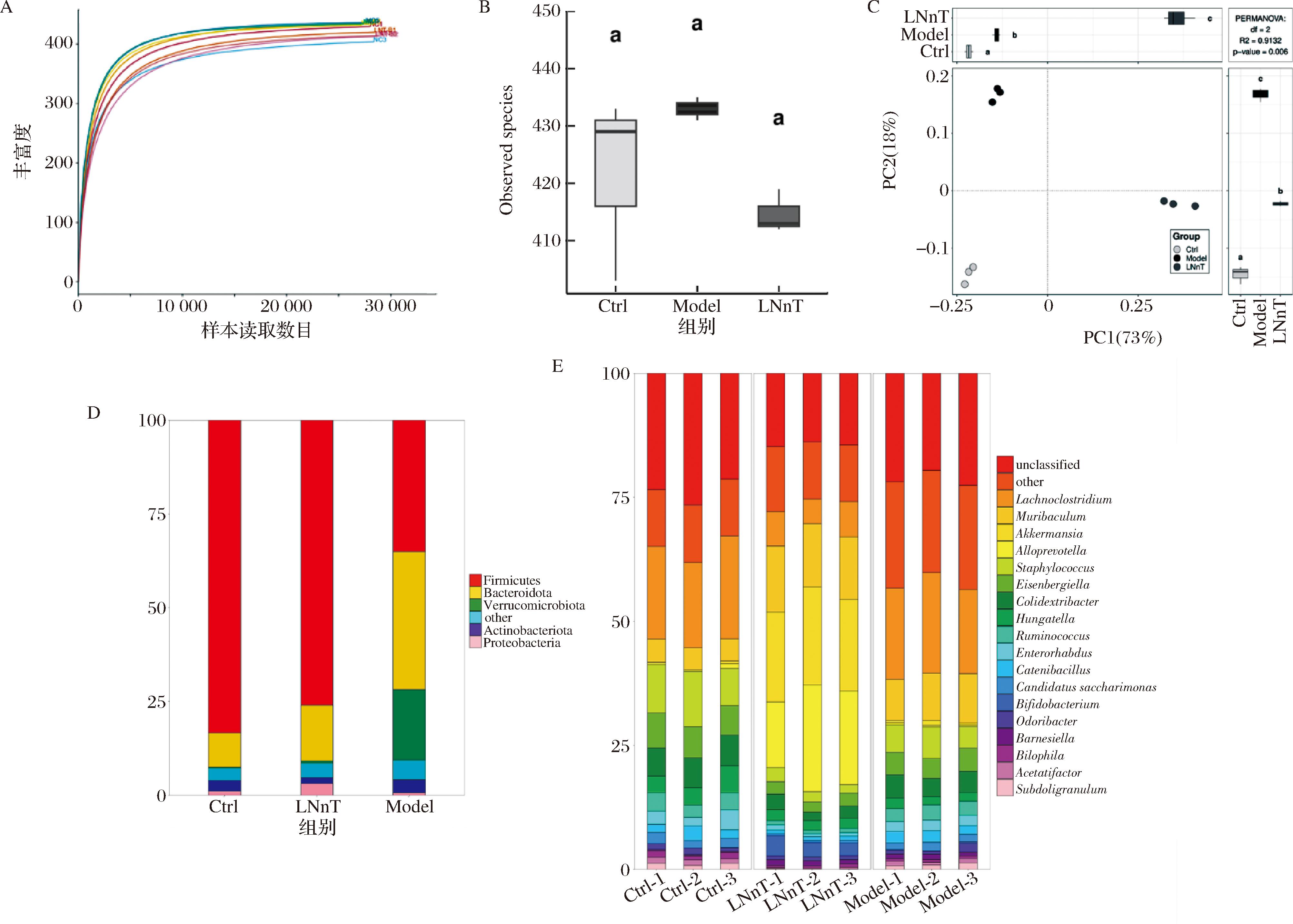
A-肠道菌群丰富度分析;B-Observed species指数;C-PCA分析;D-门水平菌群组成分析;E-属水平菌群组成分析
图5 乳糖-N-新四糖对小鼠肠道菌群的调节作用
Fig.5 Regulation effect of lacto-N-neotetraose on intestinal flora in mice
注:不同字母代表显著差异(P<0.05)。

A-分支图;B-LDA直方图
图6 肠道菌群的LEfSe分析
Fig.6 LEfSe analysis of intestinal flora
2.5.2 肠道菌群组成分析
由图5-C可知,Ctrl组和Model组以厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidota)为主,而乳糖-N-新四糖组以厚壁菌门、拟杆菌门和疣微菌门(Verrucomicrobia)为主。此外,Model组小鼠肠道放线菌门(Actinobacteriota)相对丰度显著低于Ctrl组和乳糖-N-新四糖组,而变形菌门(Proteobacteria)则显著高于Ctrl组和乳糖-N-新四糖。在属水平上,各组小鼠优势菌群如图5-D所示,主要是阿克曼氏菌(Akkermansia)、拟普雷沃氏菌属(Alloprevotella)、艾森伯格菌属(Eisenbergiella)、Lachnoclostridium和瘤胃球菌属(Ruminococcus)。与Model组相比,乳糖-N-新四糖处理增加了阿克曼氏菌、拟普雷沃氏菌属相对丰度,降低了艾森伯格菌属、Lachnoclostridium和瘤胃球菌属相对丰度。此外,本研究还观察到乳糖-N-新四糖组小鼠富集了较高丰度的双歧杆菌(Bifidobacterium,3.16%),而在Model组中,双歧杆菌仅有0.22%。
2.5.3 肠道菌群的线性判别分析
线性判别分析效应大小(linear discriminant analysis effect size,LEfSe)分析是发现和解释高纬度数据生物标识物的重要手段。本研究重点关注了Model组和乳糖-N-新四糖组肠道菌群中的标识物,结果如图6-A和图6-B所示。分支图显示了3组小鼠差异物种组成,其中双歧杆菌在乳糖-N-新四糖组显著富集。此外,直方图详细呈现了Model组和乳糖-N-新四糖组显著富集的物种。除双歧杆菌外,阿克曼氏菌和拟普雷沃氏菌属也在乳糖-N-新四糖组中显著富集。而Lachnoclostridium、葡萄球菌属(Staphylococcales)和瘤胃球菌属则在Model组中显著富集。
3 结论与讨论
研究证实益生元或益生菌能够通过调节肠道菌群、增强肠道免疫功能来改善便秘[4, 21]。目前,已经报道了乳糖-N-新四糖促进胃肠道成熟、调节肠道菌群、改善免疫及调节肠道屏障的功能[11]。然而,尚没有关于乳糖-N-新四糖改善便秘的研究。鉴于乳糖-N-新四糖对肠道菌群及宿主免疫的积极影响,因此,研究乳糖-N-新四糖对便秘的作用效果和机制,对开发天然的用于婴幼儿的功能成分具有重要意义。本研究通过排便参数相关指标确定了乳糖-N-新四糖改善便秘的作用。为了弄清该作用的内在变化和可能的机制,本研究探讨了乳糖-N-新四糖处理后,便秘小鼠胃肠道调节肽、免疫功能及肠道菌群的变化。
胃肠道调节肽能够控制胃肠道蠕动和肠内液体运输,是调控便秘的一类靶点。本研究证明,乳糖-N-新四糖能够增加小鼠胃泌素、胃动素和SP含量,从而增加胃肠道蠕动,改善便秘。胃泌素能够促进胃壁细胞分泌胃酸,并促进胃肠道平滑肌收缩,帮助消化吸收[6]。而胃动素能够促进胃蛋白酶产生,及调节胃收缩和小肠明显的分节运动[7]。SP通过直接与肠道平滑肌细胞结合,促进肠道收缩和运动[8]。胃泌素、胃动素和SP归属于兴奋型胃肠道调节肽。宋晓妍等[15]发现植物乳植杆菌协同黑茶通过增加小鼠胃泌素、胃动素和SP水平来改善便秘。此外,有研究证实益生元也具有调节便秘小鼠兴奋型胃肠道调节肽的能力[21]。总之,本研究结果表明乳糖-N-新四糖增加了小鼠肠道刺激性胃肠道调节肽的水平。此外,有研究报道了便秘动物抑制性胃肠道调节肽(血管活性肠肽)含量增加,它能够促使肠道平滑肌松弛,减少肠道蠕动,导致便秘[16]。本研究结果也证实乳糖-N-新四糖能够减少血管活性肠肽的产生。
肠道炎症往往也是便秘患者伴随的内在变化。先前的研究表明便秘会导致小鼠肠道结构受损及炎症发生[22],在本研究中,模型小鼠也出现了炎症反应。结果表明乳糖-N-新四糖能够改善便秘引起的肠道结构损伤和炎症反应,其中促炎细胞因子IL-6和IL-1β水平降低,而抗炎细胞因子IL-10水平增加。最近一项研究发现,后生元能够显著降低便秘小鼠IL-6和IL-1β水平,并增加IL-10水平,炎症减轻有效缓解了便秘[16]。另一项研究发现,膳食纤维能够降低便秘小鼠炎症程度及肠道损伤[23]。MUC2是肠道黏液的核心成分,能够保护肠道健康,增加肠道润滑度。黄梦琴等[24]发现药物润肠颗粒能够通过促进肠道黏液分泌来改善便秘。ZHANG等[25]的研究发现长双歧杆菌通过介导肠道乙酸和硬脂酸产生来调节MUC2,并进一步改善便秘。本研究证实了乳糖-N-新四糖不仅能够促进肠道MUC2含量,还能促进肠道细胞内MUC2和Agr2基因的表达。这些结果表明乳糖-N-新四糖处理,能够改善便秘小鼠肠道炎症反应,增加肠道黏液分泌,进而起到改善便秘的作用。
乳糖-N-新四糖改善了小鼠便秘症状,并调节了胃肠道调节肽和肠道炎症水平。作为典型的益生元,乳糖-N-新四糖发挥作用可能通过调节肠道菌群实现的。因此,本研究进一步关注了小鼠肠道菌群的变化。灌胃乳糖-N-新四糖的小鼠肠道内阿克曼氏菌和双歧杆菌显著富集。阿克曼氏菌是定居在肠道黏液中的菌群,能够利用粘蛋白促进自身生长[26]。研究发现,适量的阿克曼氏菌能够维持肠道黏液的动态平衡,它不仅可以利用粘蛋白,还可以刺激杯状细胞分泌粘蛋白[27]。乳糖-N-新四糖组小鼠阿克曼氏菌增加可能是MUC2大量分泌的原因。此外,已有大量研究报道了双歧杆菌改善便秘的作用,包括短双歧杆菌、长双歧杆菌和动物双歧杆菌等[28-29]。这些结果表明,乳糖-N-新四糖可能通过增加肠道有益菌阿克曼氏菌和双歧杆菌来改善便秘。
综上所述,乳糖-N-新四糖能够缓解便秘引起的粪便含水率、胃排空率、小肠转运率降低,及首粒黑便出现时间延长。同时,乳糖-N-新四糖能够调节胃肠道调节肽分泌,并改善便秘诱导的肠道炎症反应。其作用机制可能与促进肠道有益细菌增加有关。本研究探究了乳糖-N-新四糖对便秘的改善效果及机制,为开发新型便秘成分提供理论支撑。
[1] BARBERIO B, JUDGE C, SAVARINO E V, et al.Global prevalence of functional constipation according to the Rome criteria:A systematic review and meta-analysis[J].The Lancet.Gastroenterology &Hepatology, 2021, 6(8):638-648.
[2] VRIESMAN M H, KOPPEN I J N, CAMILLERI M, et al.Management of functional constipation in children and adults[J].Nature Reviews.Gastroenterology &Hepatology, 2020, 17(1):21-39.
[3] WANG L L, CHAI M, WANG J L, et al.Bifidobacterium longum relieves constipation by regulating the intestinal barrier of mice[J].Food &Function, 2022, 13(9):5037-5049.
[4] DIMIDI E, CHRISTODOULIDES S, SCOTT S M, et al.Mechanisms of action of probiotics and the gastrointestinal microbiota on gut motility and constipation[J].Advances in Nutrition, 2017, 8(3):484-494.
[5] 王佩佩, 罗雯, 禹铮, 等.慢性便秘的研究进展[J].中国全科医学, 2017, 20(3):370-374.WANG P P, LUO W, YU Z, et al.Research progress of chronic constipation[J].Chinese General Practice, 2017, 20(3):370-374.
[6] DOCKRAY G, DIMALINE R, VARRO A.Gastrin:Old hormone, new functions[J].Pflugers Archiv, 2005, 449(4):344-355.
[7] HELLSTRÖM P, JAVIDI D, WEBB D-L, et al.Differential gastric motility, gut hormone, and appetite changes following a mixed meal in people with obesity and healthy controls [J].Research Square, 2024.
[8] PLAZA-D AZ J, RUIZ-OJEDA F J, VILCHEZ-PADIAL L M, et al.Evidence of the anti-inflammatory effects of probiotics and synbiotics in intestinal chronic diseases[J].Nutrients, 2017, 9(6):555.
AZ J, RUIZ-OJEDA F J, VILCHEZ-PADIAL L M, et al.Evidence of the anti-inflammatory effects of probiotics and synbiotics in intestinal chronic diseases[J].Nutrients, 2017, 9(6):555.
[9] BHARUCHA A E, LACY B E.Mechanisms, evaluation, and management of chronic constipation[J].Gastroenterology, 2020, 158(5):1232-1249.e3.
[10] WANG J K, YAO S K.Roles of gut microbiota and metabolites in pathogenesis of functional constipation[J].Evidence-Based Complementary and Alternative Medicine, 2021, 2021(1):5560310.
[11] ZHU Y Y, LUO G C, WAN L, et al.Physiological effects, biosynthesis, and derivatization of key human milk tetrasaccharides, lacto-N-tetraose, and lacto-N-neotetraose[J].Critical Reviews in Biotechnology, 2022, 42(4):578-596.
[12] 杨宝雨, 赵军英, 乔为仓, 等.母乳低聚糖的研究进展[J].中国食品学报, 2021, 21(8):369-390.YANG B Y, ZHAO J Y, QIAO W C, et al.Research progress of human milk oligosaccharides[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(8):369-390.
[13] BERGER B, PORTA N, FOATA F, et al.Linking human milk oligosaccharides, infant fecal community types, and later risk to require antibiotics[J].mBio, 2020, 11(2):e03196-19.
[14] PULEIO F, PIRRI R, TOSCO V, et al.Assessment of 2’-fucosyllactose and lacto-N-neotetraose solution as an irrigant in E.faecalis-infected root canals:An in vitro study[J].Clinics and Practice, 2024, 14(4):1348-1356.
[15] 宋晓妍, 肖灵, 刘雅萱, 等.益生菌协同黑茶调节肠道菌群缓解盐酸洛哌丁胺诱导的小鼠便秘[J/OL].食品与发酵工业, 2024:1-11.(2024-08-23).http://kns.cnki.net/KCMS/detail/detail.aspx? filename=SPFX20240821004&dbname=CJFD&dbcode=CJFQ.SONG X Y, XIAO L, LIU Y X, et al.Probiotics synergize with dark tea to regulate intestinal flora and alleviate loperamide-induced constipation in mice.[J/OL].China Industrial Economics, 2024:1-11.(2024-08-23).http://kns.cnki.net/KCMS/detail/detail.aspx? filename=SPFX20240821004&dbname=CJFD&dbcode=CJFQ.
[16] 马腾. 后生元缓解慢性便秘的作用效果及机制研究[D].呼和浩特:内蒙古农业大学, 2024.MA T.Study on the effect and mechanism of postbiotics in relieving chronic constipation [D].Hohhot:Inner Mongolia Agricultural University, 2024.
[17] PAONE P, LATOUSAKIS D, TERRASI R, et al.Human milk oligosaccharide 2’-fucosyllactose protects against high-fat diet-induced obesity by changing intestinal mucus production, composition and degradation linked to changes in gut microbiota and faecal proteome profiles in mice[J].Gut, 2024, 73(10):1632-1649.
[18] WANG C M, FERNEZ M T, WOOLSTON B M, et al.Native gastrointestinal mucus:Critical features and techniques for studying interactions with drugs, drug carriers, and bacteria[J].Advanced Drug Delivery Reviews, 2023, 200:114966.
[19] LUIS A S, HANSSON G C.Intestinal mucus and their glycans:A habitat for thriving microbiota[J].Cell Host &Microbe, 2023, 31(7):1087-1100.
[20] PARK S W, ZHEN G H, VERHAEGHE C, et al.The protein disulfide isomerase AGR2 is essential for production of intestinal mucus[J].Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(17):6950-6955.
[21] LI Y L, YU Y, WU X L, et al.Specially designed yogurt supplemented with combination of pro- and prebiotics relieved constipation in mice and humans[J].Nutrition, 2022, 103-104:111802.
[22] WANG B, LIU C X, GUO Z, et al.Association of dietary inflammatory index with constipation:Evidence from the National Health and Nutrition Examination Survey[J].Food Science &Nutrition, 2024, 12(3):2122-2130.
[23] ZHANG H H, ZU Q X, ZHANG J C, et al.Soluble dietary fiber of hawthorn relieves constipation induced by loperamide hydrochloride by improving intestinal flora and inflammation, thereby regulating the aquaporin ion pathway in mice[J].Foods, 2024, 13(14):2220.
[24] 黄梦琴, 王雪松, 甘雨涵, 等.润肠颗粒对小鼠便秘的改善作用及机制[J].中国药房, 2024, 35(2):160-165.HUANG M Q, WANG X S, GAN Y H, et al.Improvement effects of Runchang granules on the constipation in mice and its mechanism[J].China Pharmacy, 2024, 35(2):160-165.
[25] ZHANG T, LU H M, CHENG T, et al.Bifidobacterium longum S3 alleviates loperamide-induced constipation by modulating intestinal acetic acid and stearic acid levels in mice[J].Food &Function, 2024, 15(11):6118-6133.
[26] CANI P D, DEPOMMIER C, DERRIEN M, et al.Akkermansia muciniphila:Paradigm for next-generation beneficial microorganisms[J].Nature Reviews.Gastroenterology &Hepatology, 2022, 19(10):625-637.
[27] MENG X, WANG W C, LAN T Q, et al.A purified aspartic protease from Akkermansia muciniphila plays an important role in degrading Muc2[J].International Journal of Molecular Sciences, 2019, 21(1):72.
[28] WANG R, SUN J, LI G, et al.Effect of Bifidobacterium animalis subsp.lactis MN-Gup on constipation and the composition of gut microbiota[J].Beneficial Microbes, 2021, 12(1):31-42.
[29] TABBERS M M, DE MILLIANO I, ROSEBOOM M G, et al.Is Bifidobacterium breve effective in the treatment of childhood constipation? Results from a pilot study[J].Nutrition Journal, 2011, 10:19.