乳清蛋白(whey protein,WP)是从乳清中提取出来的高营养蛋白,其主要成分为:α-乳白蛋白、β-乳球蛋白、牛血清白蛋白和免疫球蛋白[1]。然而,WP在应用方面仍面临较大的挑战[2]。例如由WP制成的食品乳化剂对环境条件较为敏感,这使得它们难以适应食品工业的需求。在复杂的食物体系中,WP可以通过共价和非共价结合与植物酚类化合物发生相互作用[3]。非共价相互作用中存在的主要作用力是疏水相互作用和氢键。然而,这些非共价蛋白-多酚相互作用是可逆的,可能容易受到pH等物理因素的影响,从而限制其在食品工业的应用[4]。共价相互作用是指酚类化合物中的苯酚被氧化形成半醌和醌类代谢物,其作为亲电试剂与WP发生共价结合[2]。在多种形成共价复合物的方法中,自由基接枝法由于其方法简单,成本较低,对环境较为友好,故被认为是一种有前景的方法[5]。且与非共价复合物相比,共价复合物表现出更高的热稳定性、抗氧化性和多酚保护性[6]。共价复合物的建立对WP结构和功能特性的影响是不可逆的,因此对于改善WP的功能特性具有重要意义。
绿原酸(chlorogenic acid,CGA)为咖啡酸和奎宁酸形成的酯,是存在许多天然植物中的代表性多酚之一,如咖啡豆、水果、蔬菜和各种草药等[7]。当口服CGA时,只有大约三分之一的CGA在胃和小肠中被吸收,剩余的CGA进入结肠被肠道菌群代谢。咖啡酸和根皮酸为CGA代谢产生的代表性酚酸。CGA含有5个羟基,咖啡酸含有2个羟基,根皮酸含有1个羟基。之前的研究显示,CGA与牛血清白蛋白结合能力最强,根皮酸最弱,咖啡酸次之,推测蛋白与多酚的相互作用强弱与多酚羟基数量有关[8]。故而选用CGA对WP进行共价改性。在结构方面,ZHANG等[9]通过多光谱分析和分子对接研究了CGA与α-乳白蛋白、β-乳球蛋白、牛血清白蛋白之间非共价分子相互作用的机制。实验结果显示,在非共价作用中,CGA与α-乳白蛋白的结合亲和力最强,结合作用最紧密。在功能特性方面,QIE等[10]探究了β-乳球蛋白的添加对CGA的抗氧化活性及其配合物在不同温度下稳定性的影响。研究结果显示,与单独的CGA相比,这种相互作用显著提高了CGA的抗氧化活性。同时,β-乳球蛋白-CGA通过形成共价和非共价复合物,增强了溶液中β-乳球蛋白的热稳定性,对于延缓β-乳球蛋白的热变性起到积极的作用。本论文在前人研究的基础上,利用自由基接枝法制备了WP-CGA共价复合物,通过多光谱法对其结构进行表征,并评价其溶解性、抗氧化性、热稳定性、起泡性及乳液稳定性。为WP和CGA在食品工业中的应用提供了基础,旨在为植物活性成分的开发和利用方面拓展思路。
1 材料与方法
1.1 材料与试剂
本实验所用WP提取方法如下:新鲜牛乳购自内蒙古呼伦贝尔牧场,化冻后经离心、脱脂、等电点调pH后收集上清液,冻干后得到WP样品。
CGA、抗坏血酸、彩虹广谱蛋白Marker(11~180 kD)、loading buffer、PBS、Tris、DPPH、β-巯基乙醇、福林酚、碳酸钠、硫酸亚铁、水杨酸、邻苯三酚、L-亮氨酸,北京solarbio科技有限公司;过氧化氢,天津江天化工技术有限公司;碳酸钠、尼罗红、考马斯亮蓝,上海Acmec科技有限公司。
1.2 仪器与设备
Sorvall LYNX4000高速落地离心机,赛默飞世尔科技(中国)有限公司;RE-301旋转蒸发仪,瑞德仪器设备有限公司;MULTISKAN GO酶标仪,美国Thermo公司;SU1510扫描电子显微镜、RF-7100C荧光分光光度计,日本Hitachi公司;PowerPacTM Basic电泳仪,美国Bio-Rad公司;迷你批次D-1高速分散机,MICCRA公司;AH-BASICI高压均质机,ATBS Engineering Inc.公司;FSX100荧光显微镜,奥林巴斯中国有限公司;BioSpectrometer basic紫外可见分光光度计,Eppendorf有限公司;DSC-600A差示扫描量热仪,日本岛津公司;Zetasizer advance纳米粒度及Zeta电位分析仪,英国马尔文帕纳科公司;BeNano 90 Zeta百特纳米粒度及电位分析仪,丹东百特仪器有限公司。
1.3 实验方法
1.3.1 WP-CGA共价复合物的制备
参考ZHENG等[11]和GU等[12]的方法,将0.5 g WP溶解于49 mL蒸馏水中,将1 mL 5 mol/L过氧化氢溶液和0.25 g抗坏血酸加入其中,于25 ℃混匀静置2 h。加入0.35 mmol/L CGA,溶解后于25 ℃混匀静置24 h。反应完后,用分子质量为3 500 Da的透析袋进行透析,每6 h换液1次,透析结束后冻干备用。
1.3.2 巯基含量的测定
Ellman试剂的配制方法如下:将5,5′-二硫代双(2-硝基苯甲酸)试剂溶解于4 mg/mL Tris-甘氨酸缓冲液(pH 8)中。并将样品加至5 mL Tris-甘氨酸缓冲液和50 μL Ellman试剂中。室温避光60 min后,记录样品在412 nm处的吸光度,巯基含量计算如公式(1)所示:
巯基含量![]()
(1)
式中:A412为样品在412 nm处的吸光度;C为样品浓度;D为样品的稀释倍数。
1.3.3 氨基含量的测定
按照邻苯二甲醛(o-phthalaldehyde,OPA)法测定氨基的含量,以L-亮氨酸作为标准品绘制标准分析曲线,计算游离氨基含量[13]。
1.3.4 总酚当量的测定
按照实验室之前的方法[14],将0.5 mL样品与1 mL福林酚试剂与黑暗中混合3 min,然后添加2 mL 7.5%(质量分数)Na2CO3溶液,振荡混匀后,暗反应2 h。表没食子儿茶素没食子酸酯被用作标准品,根据标准曲线,记录样品在760 nm下的吸光度值并计算。
1.3.5 聚丙烯酰胺凝胶电泳
按照实验室之前的方法,样品于沸水浴中变性后,进行上样(分离凝胶为12%,浓缩胶浓度为4%),施加电压为80 V(2 min)。用考马斯亮蓝G250染色30 min,于脱色溶液[V(H2O)∶V(甲醇)∶V(冰乙酸)=63∶7∶30]中脱色,直到凝胶成像仪上的蛋白质条带清晰并拍照留存。
1.3.6 荧光光谱
按照实验室之前的方法[8],样品于室温下通过荧光分光光度计进行测试。内源荧光光谱参数设置如下:激发波长为280 nm,发射波长为300~450 nm,激发和发射狭缝宽度设定为5 nm。同步荧光光谱参数设置如下:设置激发波长和发射波长之间的波长范围差分别为Δλ=60 nm和Δλ=15 nm,狭缝宽度设定为2.5 nm。
1.3.7 紫外光谱
按照实验室之前的方法,样品于室温下通过紫外可见分光光度计进行测试。测量范围为240~400 nm。
1.3.8 扫描电镜
将用于微观结构分析的样品上喷金,利用加扫描电子显微镜进行观察。所有样品的图像均以500倍放大后观察[15]。
1.3.9 粒径及Zeta电位测定
粒径使用Mastersizer 3000进行测定,Zeta电位使用BeNano 90 Zeta进行测定,所有测量均在室温(25 ℃)下进行[16]。
1.3.10 溶解性测定
按照实验室之前的方法,进行溶解性测定[17]。
1.3.11 抗氧化能力测定
DPPH自由基、羟自由基、超氧阴离子自由基清除能力均按照实验室之前的方法进行测定[18]。
1.3.12 热稳定性测定
准确称取5.0 mg样品并小心地放入坩埚中以引发反应。测量参数为:初始温度设置为30 ℃,终止温度设置为120 ℃,升温速率5 ℃/min[19]。
1.3.13 起泡性及起泡稳定性测定
按照实验室之前的方法,测定起泡性及起泡稳定性[17]。
1.3.14 乳液的微观结构
用尼罗红染液[溶于0.25%(质量分数)的无水丙酮]对所制备的乳液中的油脂进行染色,第1天和第14天用荧光显微镜倒置观察乳液的分布[20]。
1.4 数据分析
用Origin 2018软件作图。所有实验均重复3次,结果以“平均值±标准差”表示。两组间数据比较应用IBM SPSS Statistics 26进行显著性差异分析,采用比较平均值-独立样本T检验进行比较分析。
2 结果与分析
2.1 WP-CGA共价复合物的制备
2.1.1 基团含量分析
表1展示了WP-CGA自由基接枝前后游离氨基、游离巯基、CGA接枝率含量。WP中的游离氨基和游离巯基在化学反应中活跃程度高,广泛参与在食品系统中的发生的化学反应,从而影响蛋白质的功能性质,甚至改变食物结构[3]。由表1可知,随着CGA的接枝,游离氨基的含量从(15.78±0.58) nmol/mg蛋白降低为(8.37±0.39) nmol/mg蛋白。自由基接枝过程中,过氧化氢和抗坏血酸的氧化还原反应产生羟自由基,在其作用下,WP的亲核基团与CGA的苯环之间可以形成碳硫键和碳氮键,从而使体系的氨基含量降低。而OPA试剂中的SDS可以破坏体系的非共价键,合理推测WP和CGA之间是共价结合。巯基含量变化和氨基含量变化呈现一样的趋势,与未经处理的WP相比,观察到WP和CGA共价复合物中的游离巯基含量降低,证明CGA的共价结合会对WP的内部结构发生影响,以致改变了WP内部游离巯基的暴露。通过福林酚法测定体系中CGA含量为(47.28±1.90) mg/g蛋白,接枝率为(5.85±0.21)%,表明了WP-CGA共价复合物的成功制备。
表1 WP与WP-CGA共价复合物基团含量
Table 1 Group content of WP and WP-CGA covalent complexes
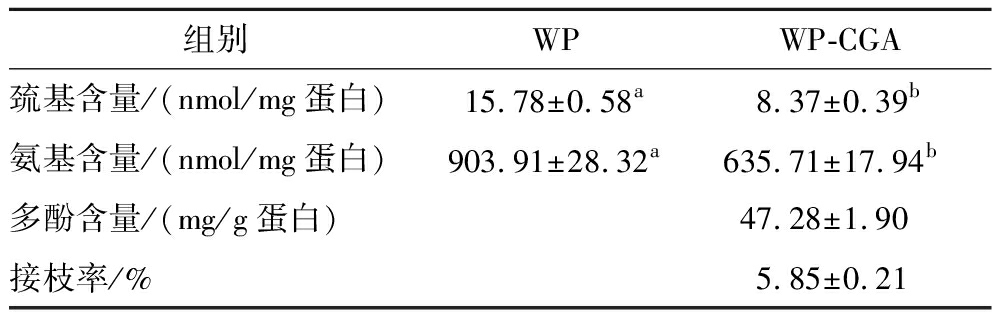
组别WPWP-CGA巯基含量/(nmol/mg蛋白)15.78±0.58a8.37±0.39b氨基含量/(nmol/mg蛋白)903.91±28.32a635.71±17.94b多酚含量/(mg/g蛋白)47.28±1.90接枝率/%5.85±0.21
注:其中不同字母代表同一指标组间具有显著性差异(P<0.05)(下同)。
2.1.2 凝胶电泳分析
为了验证WP与CGA之间是否存在共价键,利用聚丙烯酰胺凝胶电泳法来评估自由基接枝前后WP的分子量分布。实验结果如图1所示,所有样品都显示出WP的典型谱图,观察到3个强条带(分别为β-乳球蛋白、α-乳白蛋白和牛血清白蛋白)和2个弱条带(免疫球蛋白和乳铁蛋白)。作为WP中含量最丰富的2种蛋白,共价结合之后,β-乳球蛋白与α-乳白蛋白相对应的波段均略向上迁移,这表明共价复合物的相对分子质量略有增加,归因于一部分CGA与WP发生结合,略增大了体系的相对分子质量,分子质量缺乏明显变化可能是与偶联程度低且CGA分子质量较小有关。且电泳液中的β-巯基乙醇和SDS均可以破坏非共价键,而实验结果显示WP-CGA共价化合物的分子质量增加,表明其未被SDS和巯基乙醇分解,证明WP和CGA之间形成了稳定的共价键。
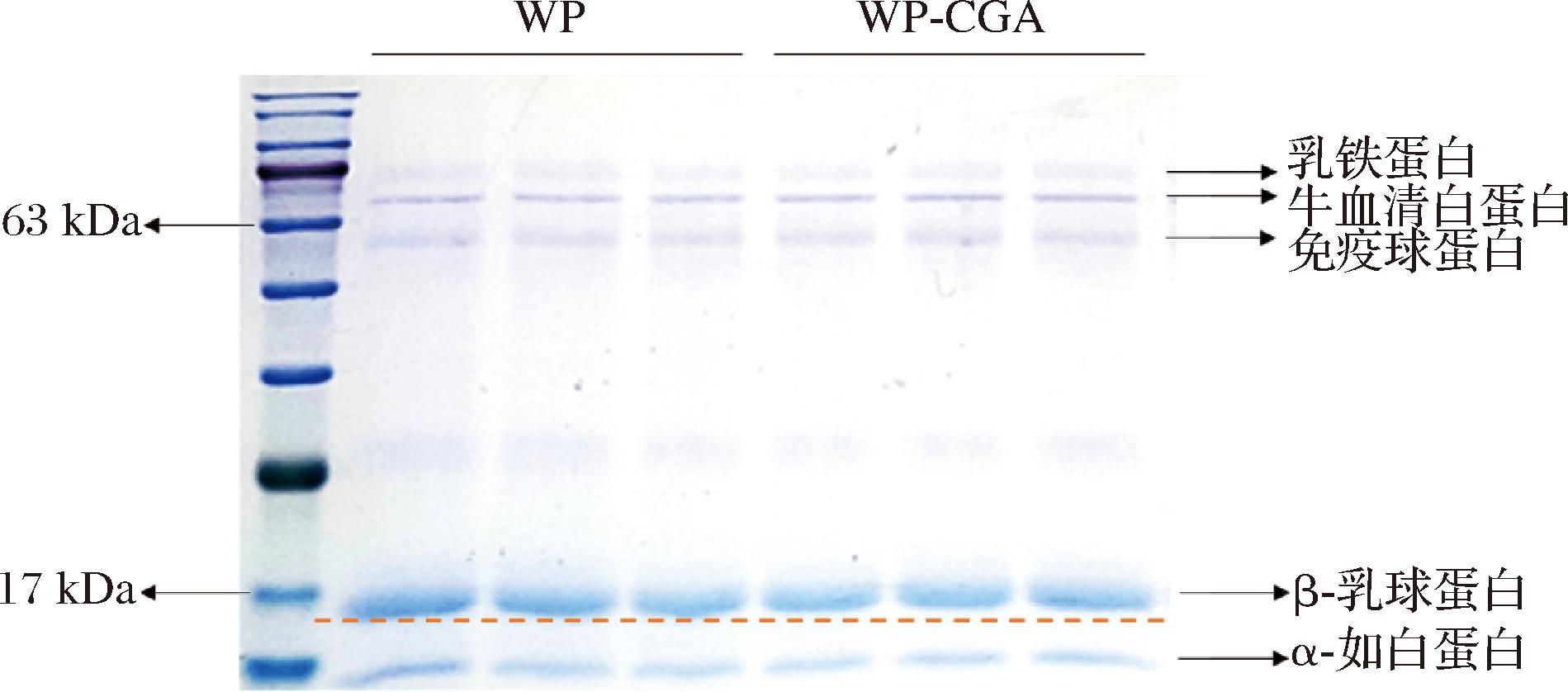
图1 WP与WP-CGA共价复合物凝胶电泳图
Fig.1 Gel electrophoresis of WP and WP-CGA covalent complexes
2.2 CGA的共价偶联对WP结构的影响
2.2.1 荧光光谱分析
在激发波长为280 nm条件下,蛋白质的内在荧光主要与色氨酸(tryptophan,Trp)的发射有关,其苯环中含有共轭双键[21]。因而本研究采用荧光光谱法研究了WP及WP-CGA共价复合物表面芳香族氨基酸的相互作用。多项实验研究证明,多酚与WP的相互作用会使WP的荧光强度降低,内源荧光光谱如图2-a所示,WP-CGA共价复合物的荧光强度降低,表明WP的Trp残基参与了体系中复合物的结合。因此,在自由基接枝的作用下,WP的结构展开,内部疏水基团暴露,从而使得荧光强度降低。酪氨酸(tyrosine,Tyr)和色氨酸残基在WP中的荧光光谱叠加不利于对其发射光谱的准确分析。因而利用同步荧光光谱来确定特定荧光基团周围微环境的相关信息[22]。同步荧光光谱如图2-b(Δλ=15 nm)和图2-c(Δλ=60 nm)所示,CGA的存在使得Tyr和Trp残基的荧光强度均下降,且对Trp残基的猝灭程度更大,这意味两者的结合位点更接近于Trp残基附近。
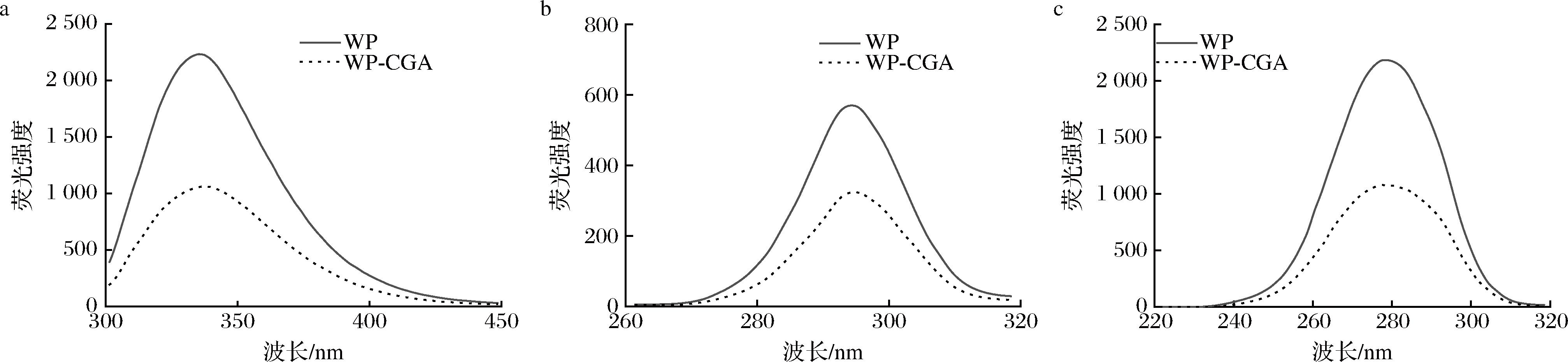
a-内源荧光光谱图;b-同步荧光光谱图;c-同步荧光光谱图
图2 WP与WP-CGA共价复合物内源荧光光谱图、酪氨酸同步荧光光谱图和色氨酸同步荧光光谱图
Fig.2 Internal fluorescence spectra of WP and WP-CGA covalent complexes, tyrosine synchronous fluorescence spectra, and tryptophan synchronous fluorescence spectra
2.2.2 紫外光谱分析
氨基酸残基的微环境受蛋白质构象的影响,因此,多酚对蛋白质构象的影响可以通过紫外光谱中吸收峰的位置和强度的变化来判断[23]。通过进行紫外吸收光谱分析以深入了解WP-CGA复合物的形成以及WP的结构变化。如图3所示,由于存在芳香族氨基酸残基,如Tyr、苯丙氨酸(phenylalanine,Phe)和Trp,WP在280 nm处表现出特征性吸收峰。一方面,WP-CGA的共价结合使得最大紫外吸收峰强度显著增加,表明与WP空间结构的扩展和有更松散的三级结构,这与荧光光谱分析一致。另一方面,共价结合后,WP的特征峰略有迁移,出现此现象的原因可能是CGA与WP的互作反应会对WP中Tyr、Trp的分布产生一定的影响,使得氨基酸残基的微环境发生了变化。
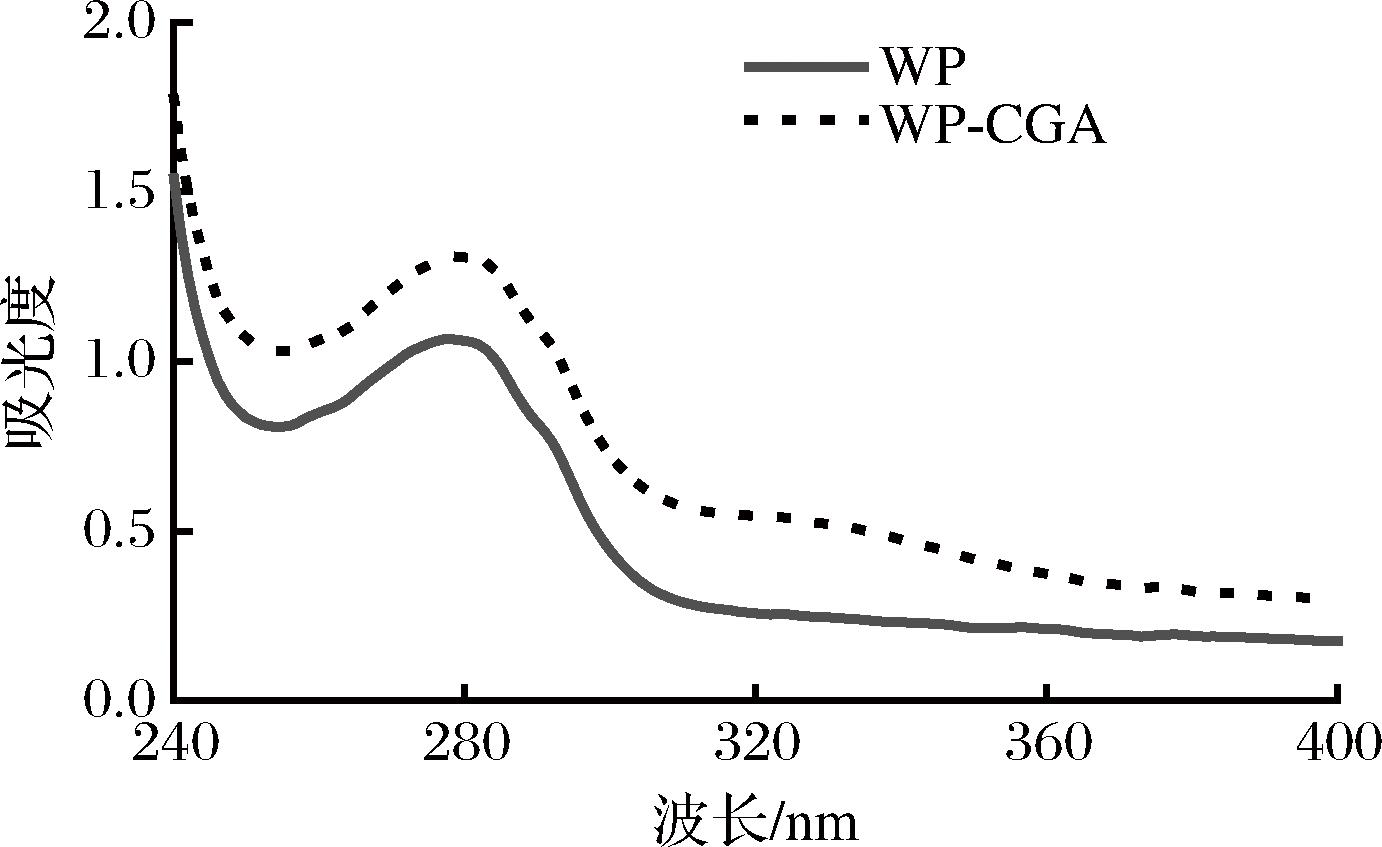
图3 WP与WP-CGA共价复合物紫外光谱图
Fig.3 Ultraviolet spectra of WP and WP-CGA covalent complexes
2.2.3 扫描电镜分析
扫描电子显微镜图像可以提供蛋白质的形态和结构特征,因而利用扫描电子显微镜观察了WP和WP-CGA共价复合物的微观形貌。如图4-a所示,WP微观结构为大的片状结构且表面较为粗糙,呈现出不规则的团聚体;图4-b为CGA的显微结构,呈现细小的棒状,与LI等[24]的研究结果一致;如图4-c所示,WP与CGA形成复合物后,其微观结构发生了较为明显的变化,大片状结构被破坏,表现出小的不规则片段。这可能与两者的相互作用破坏了分子间作用力,导致WP的结构变得松散有关。

a-WP;b-CGA;c-WP-CGA
图4 WP、CGA、WP-CGA共价复合物的扫描电镜图片
Fig.4 Scanning electron microscopy images of WP, CGA, and WP-CGA covalent complexes
2.2.4 粒径及电位分析
蛋白质的平均粒径在一定程度上可以反映蛋白质的结构,因此与蛋白质的功能特性有关。由表2可知,WP-CGA共价复合物的平均粒径比空白WP更小,这可能是由于CGA的共价结合使得WP结构变得松散,两者之间形成相对紧凑的结构,使得粒径减小。WP-CGA共价复合物与空白WP的Zeta电位分别为-11.13、-15.83 mV,表明共价复合材料的Zeta电位绝对值显著高于空白WP,电位绝对值的增加是由于WP二级结构的改变和CGA引起的蛋白质结构的扩展,导致WP负电荷的暴露增多。
表2 WP与WP-CGA共价复合物粒径和Zeta电位
Table 2 Particle size and Zeta potential of WP and WP-CGA covalent complexes

组别WPWP-CGA粒径/nm522.3±20.31a403.9±11.22bZeta电位/mV-11.13±1.03a-15.83±0.93b
2.3 CGA的共价偶联对WP功能性质的影响
2.3.1 溶解性分析
蛋白质的溶解性与其在工业生产中实现乳化性、抗氧化性等功能特性密切相关,是蛋白质实现多种功能特性的基础。图5为WP及CGA改性WP的蛋白溶解度图。实验结果显示,共价结合CGA后,WP-CGA共价复合物溶解度提高,这可能是由于CGA和WP之间的相互作用促进WP分子间的交联有关。此外,CGA具有良好的水溶性,共价结合后引入羟基,使得WP亲水性提高,进而增加WP的溶解度。
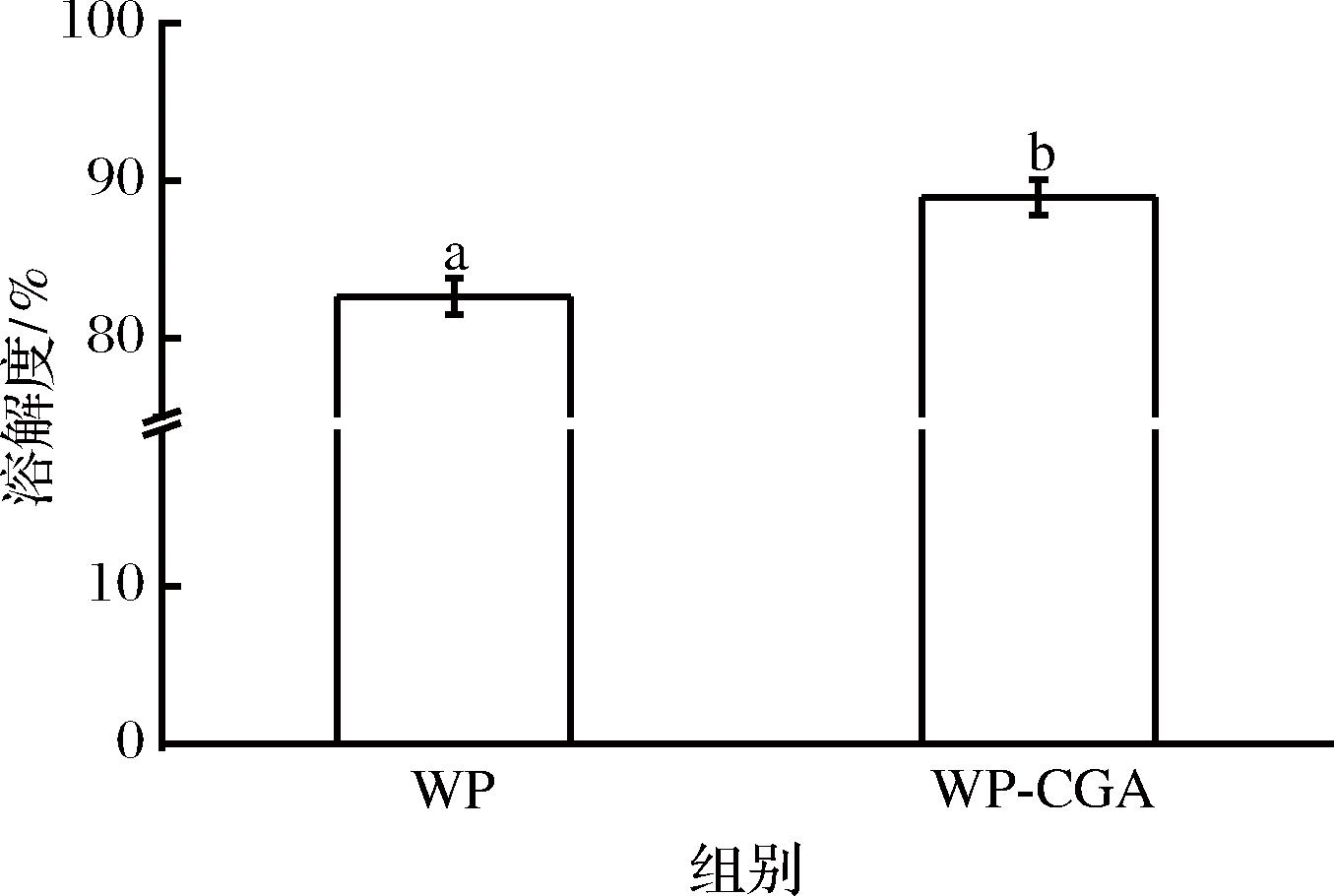
图5 WP与WP-CGA共价复合物溶解性
Fig.5 Solubility of WP and WP-CGA covalent complexes
2.3.2 抗氧化性分析
蛋白质和多酚之间相互作用可以影响蛋白质的构象变化和多酚的抗氧化活性。本实验采用了3种不同的抗氧化模型,即DPPH自由基、羟自由基和超氧阴离子自由基清除能力来评估WP在与CGA共价结合之前和之后的抗氧化特性的变化。由图6可知,CGA与WP的结合可以保护甚至增强CGA的抗氧化活性。未经处理的WP抗氧化能力较低,而经CGA自由基结合改性后,其抗氧化能力得到提高。与CGA共价修饰后,WP的DPPH自由基、羟自由基和超氧阴离子自由基清除能力分别为之前的1.72、1.42、1.02倍。酚类物质的添加被认为是抗氧化活性增加的主要原因,CGA分子中含有5个羟基,酚类结构中多羟基结构的存在可以导致抗氧化活性显著增加。SHEN等[25]同样观察到共价结合制得的多酚-蛋白偶联物显示出比原始蛋白质更好的抗氧化能力。由此可推知,WP-CGA偶联物具有作为新型抗氧化剂的应用潜力。
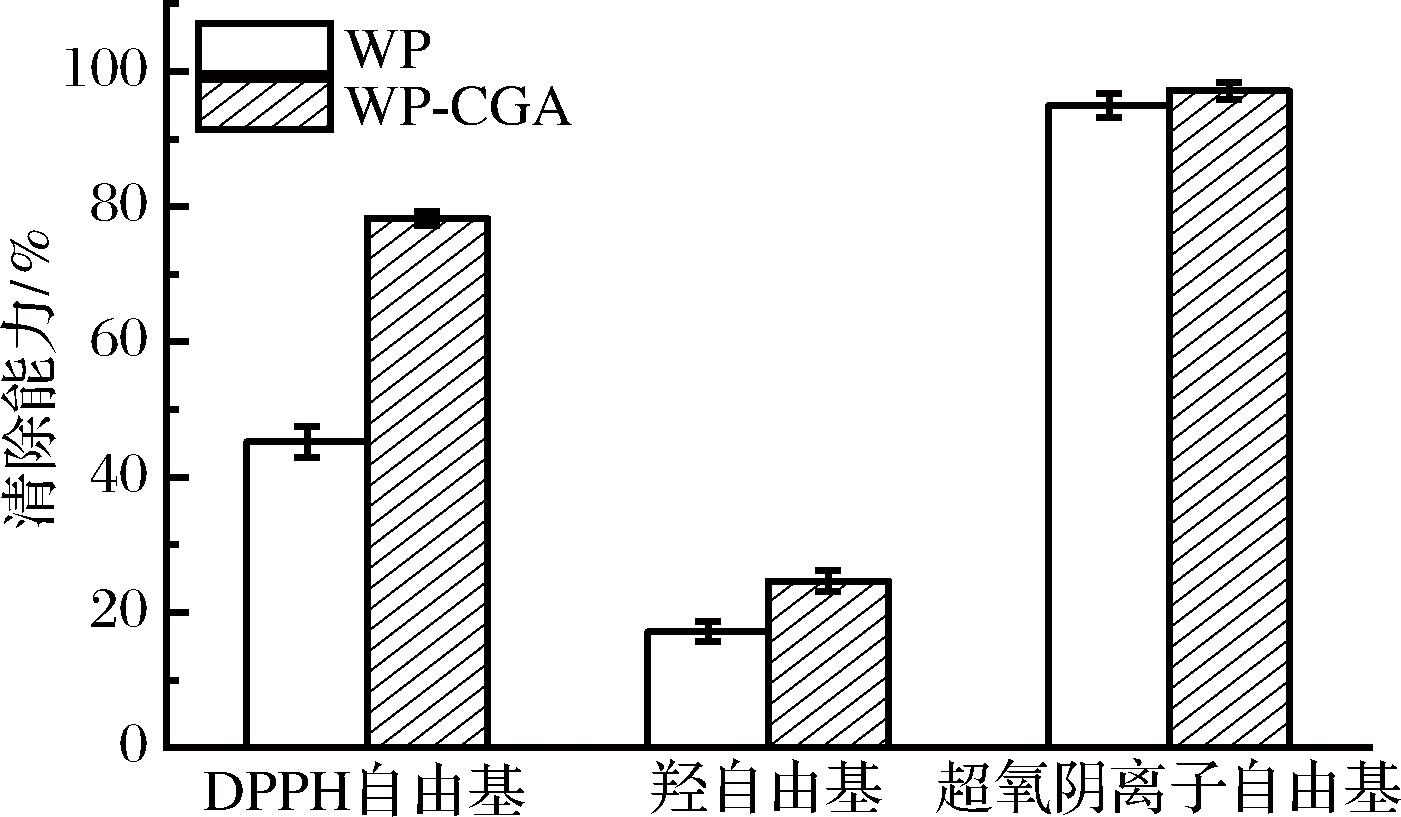
图6 WP与WP-CGA共价复合物DPPH自由基清除能力、羟自由基清除能力和超氧阴离子自由基清除能力
Fig.6 DPPH free radical scavenging ability, hydroxyl free radical scavenging ability, and superoxide anion scavenging ability of WP and WP-CGA covalent complexes
2.3.3 热稳定性分析
差示扫描量热法是一种有效的热分析方法,可以通过该方法从热稳定性的角度分析WP与CGA之间的相互作用。已有文献报道,蛋白质的热稳定性与其三级结构密切相关,而三级结构又依赖于变性温度。较高的变性温度值表蛋白质具有优越的热稳定性[26]。由图7可知,与CGA共价结合后的WP曲线与空白WP曲线基本相似,两者在60~80 ℃都有明显的主要吸热峰,WP的热变性温度为72.44 ℃,而WP-CGA共价复合物的热变性温度升至79.72 ℃,由此表明经CGA共价修饰后的WP其热稳定性有所提高。热稳定性的提高有利于WP在食品加工过程中在高温条件下仍能保持较好的物理化学性质,有利于拓宽其在食品工业的应用,与之前的研究报告结果相一致[27]。
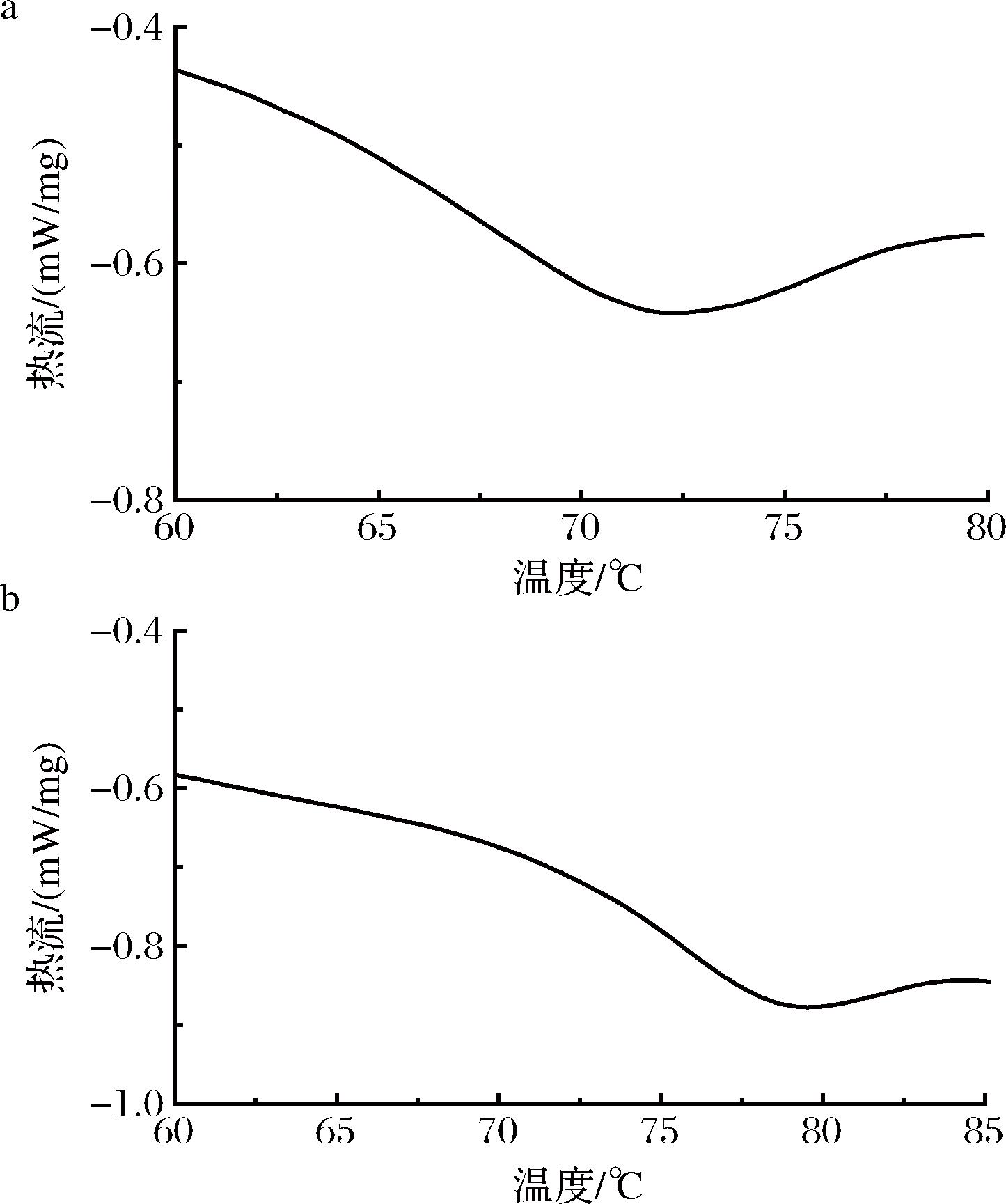
a-WP热变性温度曲线;b-WP-CGA共价复合物热变性温度曲线
图7 WP、WP-CGA共价复合物热变性温度曲线
Fig.7 Thermal denaturation temperature curves of covalent complexes WP and WP-CGA
2.3.4 起泡性及起泡稳定性分析
有研究报道,多酚有助于蛋白质泡沫结构的形成,因而WP-多酚复合物的形成会影响蛋白质的界面特性,从而在一定程度上影响其形成和稳定蛋白质泡沫的能力[28]。如图8所示,WP的起泡性为(25.4±31.40)%,经CGA共价接枝后,起泡能力明显提高[(52.38±4.66)%]。这可归因于WP分子更有效地转移到空气-水界面,使得界面层弹性增加。然而,2组样品的起泡稳定性没有显著性差异(P>0.05),说明CGA的接枝虽然使得WP起泡性增加,但形成的泡沫不够稳定,未能很好的形成结实而有弹性的蛋白质膜。这些结果表面蛋白质-多酚的互作与发泡行为之间关系的复杂性,需继续研究食品蛋白质界面稳定的新方法。
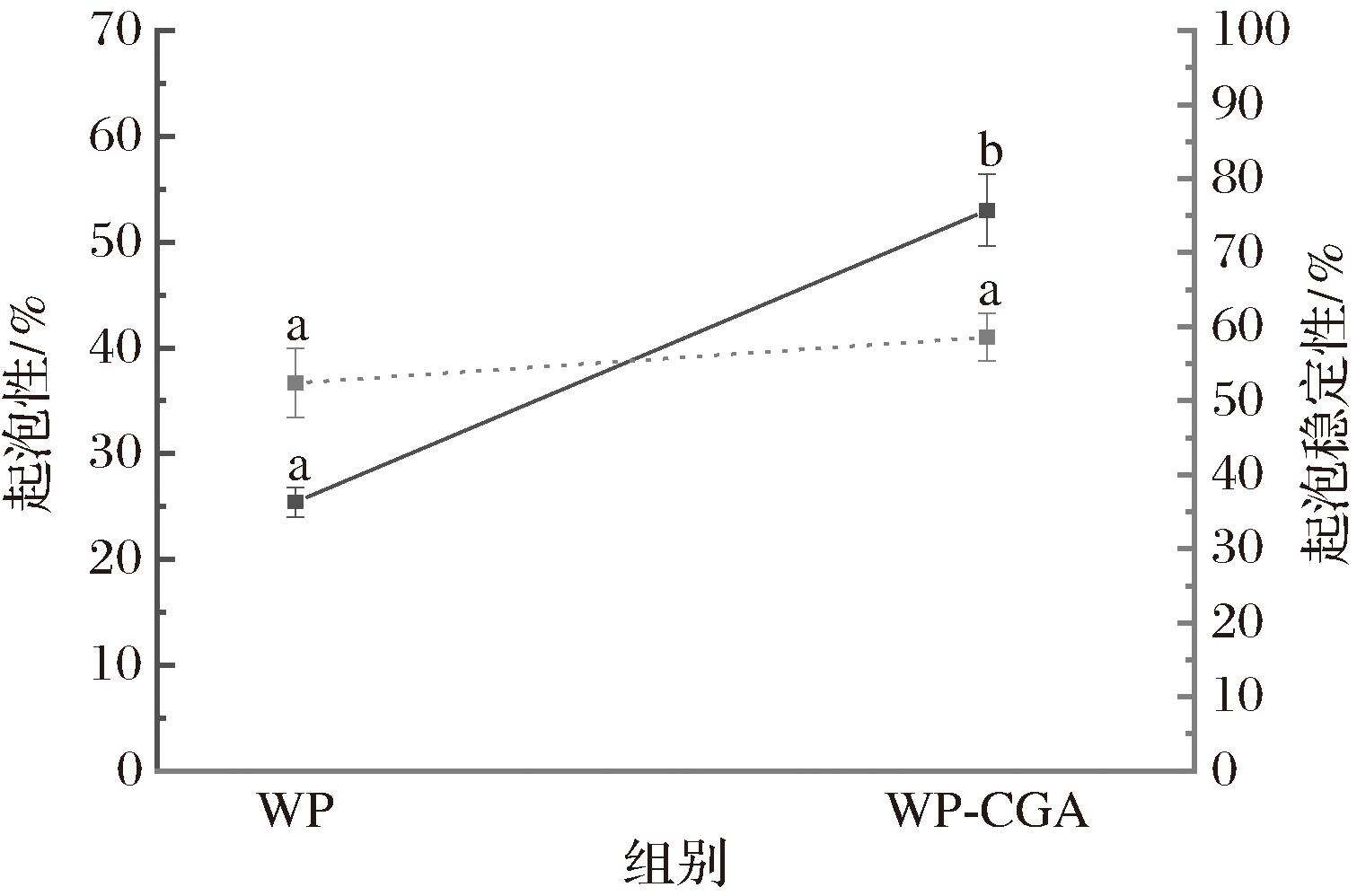
图8 WP与WP-CGA共价复合物起泡性及起泡稳定性
Fig.8 Foaming properties and stability of WP and WP-CGA covalent complexes
2.3.5 乳液稳定性分析
按照之前的方法制备乳液,并使用荧光倒置显微镜来观察乳液的微观结构,未完全乳化的油脂被尼罗红试剂染成红色。由图9可知,在第1天时,由WP和WP-CGA为乳化剂制备的乳液均一程度差异不明显,但乳液在放置14 d后,由WP-CGA为乳化剂制备的乳液乳化稳定性明显优于空白对照组,仍能保持较为均一的状态。这可能是因为蛋白与多酚之间的共价交联抑制了液滴的聚结,从而改善了蛋白质的界面性能,导致了其乳化性能的改善。这一发现与多项先前文献中的结果一致[29-30]。

图9 乳液的微观显微镜图
Fig.9 Microscopical picture of emulsion
注:乳液的质量浓度为10 g/L。
3 结论
本研究利用自由基接枝法构建WP-CGA共价体系,旨在探讨CGA的共价接枝对于WP结构以及功能特性的影响,以丰富和扩宽WP在食品工业的应用。变性电泳和基团含量测定实验表明WP-CGA共价复合物的成功构建,并利用内源荧光光谱法、同步荧光光谱法、紫外光谱法等多光谱法和扫描电镜对复合物的结构进行了表征,在功能特性评价中显示出该复合物优异的的溶解性、抗氧化性能、热稳定性、起泡性及乳化稳定性,本研究为深入探索WP和CGA的潜在应用潜力提供了参考。
4 展望
本研究所选用原料成本较为低廉,在经济上可行,适合于工业生产,可进一步优化实验方案,在能够提高应用价值的前提下尽可能节约成本。此外,自由基接枝法不会产生有毒有害的中间产物,资源消耗较小,符合可持续发展的要求。这利于促进企业提高资源利用效率、降低能耗和减少污染物排放,从而实现经济、社会和环境的协调发展。今后将深入研究与挖掘WP-CGA偶联物的多功能特性,以期为其更好地应用于食品工业提供可行的途径。
[1] CHEN L Y, XIE X N, LI Y, et al.Activation mechanism of whey protein isolate mediated by free radicals generated in the ascorbic acid/hydrogen peroxide system[J].Food Chemistry, 2022, 384:132533.
[2] CHENG J J, DUDU O E, ZHANG J, et al.Impact of binding interaction modes between whey protein concentrate and quercetin on protein structural and functional characteristics[J].Food Hydrocolloids, 2023, 142:108787.
[3] TIAN R, HAN X E, TIAN B, et al.Effects of covalent binding of different polyphenols on structure, rheology and functional properties of whey protein isolate[J].LWT, 2023, 184:114968.
[4] XU H X, ZHANG T T, LU Y Q, et al.Effect of chlorogenic acid covalent conjugation on the allergenicity, digestibility and functional properties of whey protein[J].Food Chemistry, 2019, 298:125024.
[5] ZHANG K, JIANG L, CHEN R K, et al.A versatile food packaging film fabricated by gallic acid/octanoic acid grafted chitosan:Preparation, characterization, high-efficient cells capture and photodynamic eradication of bacteria and biofilms[J].Food Hydrocolloids, 2024, 152:109914.
[6] ZHOU S D, LIN Y F, XU X, et al.Effect of non-covalent and covalent complexation of (-)-epigallocatechin gallate with soybean protein isolate on protein structure and in vitro digestion characteristics[J].Food Chemistry, 2020, 309:125718.
[7] TANG Y, FANG C, SHI J, et al.Antioxidant potential of chlorogenic acid in Age-Related eye diseases[J].Pharmacology Research &Perspectives, 2024, 12(1):e1162.
[8] CHENG D, ZHAO T T, ZHOU J P, et al.Comparative investigation on the influence of chlorogenic acid and its intestinal metabolites on the binding of cadmium to bovine serum albumin[J].Journal of Molecular Liquids, 2022, 366:120309.
[9] ZHANG Y Y, LU Y C, YANG Y, et al.Comparison of non-covalent binding interactions between three whey proteins and chlorogenic acid:Spectroscopic analysis and molecular docking[J].Food Bioscience, 2021, 41:101035.
[10] QIE X J, CHEN W P, ZENG M M, et al.Interaction between β-lactoglobulin and chlorogenic acid and its effect on antioxidant activity and thermal stability[J].Food Hydrocolloids, 2021, 121:107059.
[11] ZHENG J C, XIAO N, LI Y, et al.Free radical grafting of whey protein isolate with tea polyphenol:Synthesis and changes in structural and functional properties[J].LWT, 2022, 153:112438.
[12] GU L P, PAN C, SU Y J, et al.In vitro bioavailability, cellular antioxidant activity, and cytotoxicity of β-carotene-loaded emulsions stabilized by catechin-egg white protein conjugates[J].Journal of Agricultural and Food Chemistry, 2018, 66(7):1649-1657.
[13] LIU F G, SUN C X, YANG W, et al.Structural characterization and functional evaluation of lactoferrin-polyphenol conjugates formed by free-radical graft copolymerization[J].RSC Advances, 2015, 5(20):15641-15651.
[14] FAN Y T, ZHANG Y Z, YOKOYAMA W, et al.β-Lactoglobulin-chlorogenic acid conjugate-based nanoparticles for delivery of (-)-epigallocatechin-3-gallate[J].RSC Advances, 2017, 7(35):21366-21374.
[15] MA Z Y, ZHAO J L, ZOU Y, et al.The enhanced affinity of moderately hydrolyzed whey protein to EGCG promotes the isoelectric separation and unlocks the protective effects on polyphenols[J].Food Chemistry, 2024, 450:138833.
[16] CORFIELD R, LALOU G, DI LELLA S, et al.Experimental and modeling approaches applied to the whey proteins and vitamin B9 complexes study[J].Food Hydrocolloids, 2023, 142:108834.
[17] WANG Y J, GUO H L, ZHAO T T, et al.Ca2+-promoted free radical grafting of whey protein to EGCG:As a novel nanocarrier for the encapsulation of apigenin[J].Food Chemistry, 2024, 460:140554.
[18] HAN P Y, TIAN X N, WANG H Z, et al.Purslane (Portulacae oleracea L.) polysaccharide relieves cadmium-induced colonic impairments by restricting Cd accumulation and inhibiting inflammatory responses[J].International Journal of Biological Macromolecules, 2024, 257(Pt 1):128500.
[19] QIANG S Q, ZHOU J J, YANG T L, et al.Structure, stability and in vitro digestion of a novel zein-based oil gel delivery system loaded β-carotene[J].Journal of Food Engineering, 2024, 366:111848.
[20] ZHU X R, MENG L Y, SONG S, et al.Insight into the mechanisms of the excellent emulsification properties of whey protein isolate-arabinoxylan conjugates[J].Bioactive Carbohydrates and Dietary Fibre, 2022, 27:100312.
[21] CHEN Y, YAO M Y, PENG S, et al.Development of protein-polyphenol particles to stabilize high internal phase Pickering emulsions by polyphenols’ structure[J].Food Chemistry, 2023, 428:136773.
[22] CHENG W W, WANG M M, LI C, et al.Study of the weak interaction mechanism of ovalbumin and caffeic acid using fluorescence spectroscopy and molecular dynamics simulation[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2023, 301:122966.
[23] SONG Y Q, YAO G L, CHEN J, et al.Effect of β-cyclodextrin on whey protein-epigallocatechin gallate interaction[J].Industrial Crops and Products, 2023, 206:117626.
[24] LI H, HE W J, XU S Q, et al.Grafting chlorogenic acid enhanced the antioxidant activity of curdlan oligosaccharides and modulated gut microbiota[J].Food Chemistry:X, 2024, 21:101075.
[25] SHEN S W, YANG H G, LIU X M, et al.Insights into the effects of combined caffeic acid and glucose covalent modification on the conformational and functional properties of two milk proteins[J].LWT, 2023, 186:115199.
[26] HAN M L, SUN C N, BU Y, et al.Exploring the interaction mechanism of chlorogenic acid and myoglobin:Insights from structure and molecular dynamics simulation[J].Food Chemistry, 2024, 438:138053.
[27] ABD EL-MAKSOUD A A, ABD EL-GHANY I H, EL-BELTAGI H S, et al.Adding functionality to milk-based protein:Preparation, and physico-chemical characterization of β-lactoglobulin-phenolic conjugates[J].Food Chemistry, 2018, 241:281-289.
[28] LI C H, DAI T T, CHEN J, et al.Protein-polyphenol functional ingredients:The foaming properties of lactoferrin are enhanced by forming complexes with procyanidin[J].Food Chemistry, 2021, 339:128145.
[29] JIA Z B, ZHENG M, TAO F, et al.Effect of covalent modification by (-)-epigallocatechin-3-gallate on physicochemical and functional properties of whey protein isolate[J].LWT - Food Science and Technology, 2016, 66:305-310.
[30] WANG X Y, LIU F G, LIU L, et al.Physicochemical characterisation of β-carotene emulsion stabilised by covalent complexes of α-lactalbumin with (-)-epigallocatechin gallate or chlorogenic acid[J].Food Chemistry, 2015, 173:564-568.