非酒精性脂肪肝病(nonalcoholic fatty liver disease,NAFLD)是一种发病机制尚不明确的代谢性疾病,具有多种临床表现,其疾病谱广泛,包括非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH)、肝硬化等,并可能发展为肝癌。这种病症以甘油三酯(triglycerides,TG)在肝细胞内的沉积为主要特征,而TG的过度沉积不仅可导致肝功能和结构受损,还会增加患者患上慢性肾病、心脏血管病变或糖尿病等其他系统疾病的风险[1]。尽管通过加强锻炼、改变饮食等方式能改善NAFLD,在现实生活中大部分人难以坚持,在临床实验中使用的药物如他汀类药物及逆行测试,但作用效果不明显[2]。因此,开发一种保护肝脏、改善NAFLD的药物或功能性食品仍是当务之急。
甘油葡萄糖苷(2-O-α-D-glucopyranosyl-sn-glycerol,2-αGG)具有高保湿、抗氧化和抗衰老的能力,可以作为化妆品主要的功能成分[3]。此外,这种物质具有低甜味、益生元特性和蛋白质稳定功能[4],在保健和医药工业中具有良好的应用前景[5]。目前,2-αGG的生产主要依赖蔗糖磷酸化酶(EC2.4.1.7 sucrose phosphorylase,SPase)和生物催化,该酶是糖基水解酶13家族成员,可以催化生成具有商用价值的糖苷类化合物,如2-αGG[6]。本文利用产SPase的大肠杆菌,用κ-卡拉胶固定化后催化生产2-αGG。与游离细胞和酶相比,固定化细胞不仅提高了催化剂的稳定性和可重复使用性,还降低了酶提取纯化的成本[7]。κ-卡拉胶是一种可作为食品辅料的天然多糖[8-9],由κ-卡拉胶制成的固定化细胞凝胶有较好的机械稳定性,机械稳定性有利于保持细胞的完整性[10],且使用κ-卡拉胶与戊二醛联合固定化能有效阻止细胞泄露。与固定化酶相比,固定化细胞的优势在于可以省去繁琐的酶分离和纯化步骤[11]。此外,固定化细胞可以被重复使用多次,能进一步提高2-αGG的生产效率和降低生产成本,为2-αGG的工业化和广泛应用提供方条件,正如利用2-αGG制成的功能性食品来抑制非酒精性脂肪肝病。
HepG2细胞是从原发性肝癌中分离和建立的,其具有增殖能力强,分化程度高,易培养等特点,所生产的代谢酶具有较好的转化特性,可以在药理上维持较好的稳定性,因此被用作体外进行肝细胞的代谢和遗传毒性实验[12]。利用游离脂肪酸(free fatty acids,FFA)溶液处理HepG2细胞,以建立非酒精性脂肪肝细胞模型[13],通过测定添加2-αGG后细胞的存活率以及细胞内脂质的含量变化,在细胞水平上评价2-αGG在改善FFA诱导的肝细胞脂代谢紊乱、脂质沉积、肝细胞损伤以及HepG2细胞的脂肪变性等方面的作用,为2-αGG的进一步应用和后续的天然功能食品研发提供理论依据。
1 材料与方法
1.1 材料与试剂
重组大肠杆菌BL21(DE)/pET24a-Suc75290由本实验室构建保存,蔗糖磷酸化酶Suc75290基因的核苷酸序列已存入GenBank,登录号为PP496818;CCK-8试剂盒、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)测试盒、谷草转氨酶(glutamic oxaloacetic transaminase,GOT/AST)测试盒、谷丙转氨酶(glutamic pyruvic transaminase,GPT/ALT)测试盒,南京建成生物工程研究所;BCA蛋白浓度试剂盒,索莱宝生物科技有限公司;人肝癌细胞株HepG2为内蒙古医科大学附属医院临床研究中心实验室提供。
1.2 仪器与设备
Legend Micro 17高速冷冻离心机,日本Hitachi公司;高压蒸汽灭菌锅,上海博讯实业有限公司医疗设备厂;Infinite M200PRO酶标仪,瑞士Tecan公司;细胞培养箱,美国Thermo公司;分光光度计,美国Thermo公司。
1.3 实验方法
1.3.1 重组蔗糖磷酸化酶全细胞的固定化方法
1.3.1.1 海藻酸钠(sodium alginate,SA)包埋固定化
取1 g湿菌体,将其悬浮于5 mL生理盐水溶液中,将菌悬液与0.02 g/mL海藻酸钠等体积混合,再用注射器将混合液以一定速度滴入0.01 g/mL的CaCl2溶液中,通过Ca2+与海藻酸钠的反应,形成稳定的海藻酸钙凝胶,从而将菌体包裹在凝胶微球中。将形成的凝胶微球在4 ℃冰箱中放置12 h,除去含有CaCl2的溶液,用生理盐水洗涤凝胶微球3~4次,以去除未反应的海藻酸钠和CaCl2。洗涤后的凝胶微球存放在4 ℃的冰箱中备用。
1.3.1.2 海藻酸钠-聚乙烯醇固定化
将0.04 g/mL的海藻酸钠与0.10 g/mL的聚乙烯醇(polyvinyl alcohol,PVA)按1∶1的体积比混合,用注射器缓慢滴入0.01 g/mL的CaCl2溶液中,使得混合液在CaCl2溶液中形成凝胶微球。将形成的凝胶微球在CaCl2溶液12 h,以确保凝胶微球充分固化。制备好的固定化细胞用生理盐水冲洗3~4次,以去除未反应的固化剂和其他杂质。洗涤后的固定化细胞在4 ℃下保存备用[14]。
1.3.1.3 壳聚糖-聚乙烯醇固定化
将0.04 g/mL壳聚糖(chitosan,CS)与0.10 g/mL PVA按4∶1的体积比混合均匀制备固定化溶液;配制80 g/L的三聚磷酸钠饱和硼酸溶液,pH 7.0,制备固化液。将制备好的菌体悬浮液与固定化溶液按1∶1的体积比混合均匀,用注射器将混合溶液缓慢滴入固化液中,形成凝胶微球。在4 ℃下存放5 h后,收集固定化的细胞,并使用去离子水洗涤3~4次,洗涤后的固定化细胞在4 ℃下保存备用。
1.3.1.4 聚乙二醇-壳聚糖固定化
称取2 g聚乙二醇和2 g壳聚糖加到2%(体积分数)的乙酸溶液(100 mL)中,完全溶解后与菌悬液按体积比1∶1混合。使用注射器将混合液缓慢滴加到pH 7.0的0.02 g/mL三聚磷酸钠溶液中。在三聚磷酸钠的作用下,壳聚糖和聚乙二醇会形成微球载体,并将细胞固定在其内部或表面。将形成的微球载体静置硬化3 h,使用去离子水反复冲洗微球载体以去除残余的三聚磷酸钠和其他杂质,洗涤后的固定化细胞在4 ℃下保存备用。
1.3.1.5 κ-卡拉胶固定
将κ-卡拉胶溶解在预热的0.9% NaCl中,κ-卡拉胶的质量浓度为0.02 g/mL。将湿细胞在0.9%NaCl中重悬,并将其与κ-卡拉胶溶液以2∶3的体积比混合,将混合液放在冰上固化15 min,得到的凝胶在0.3 mol/L的KCl溶液中浸泡30 min,用刀切成小块,再用去离子水清洗,将颗粒以0.5 g/mL的比例悬浮在含有0.3 mol/L的KCl和85 mmol/L 1,6-二氨基己烷的0.5 mmol/L磷酸缓冲液中,冰上孵育10 min,再把25%(体积分数)的戊二醛加入混合液中,在冰上150 r/min振摇混匀30 min,再用0.3 mol/L的KCl洗涤颗粒,最后再用去离子水清洗,在4 ℃保存备用[15]。
1.3.2 2-αGG的HPLC检测
HPLC色谱分析条件:Waters2410示差折光检测器;色谱柱:Agilent ZORBAX NH2(5 μm 4.6×250 mm);流动相:V(乙腈)∶V(水)=80∶20;流速0.8 mL/min;进样量20 μL;柱温30 ℃,检测出峰时间和峰面积,根据峰面积计算浓度。
1.3.3 固定化的条件优化
1.3.3.1 κ-卡拉胶浓度优化
配制0.01、0.02、0.03、0.04、0.05 g/mL的κ-卡拉胶溶液,再分别将其与菌悬液混合,制成含不同浓度κ-卡拉胶的固定化细胞凝胶。将1 mol/L蔗糖和1 mol/L甘油混合后,添加相同数量的凝胶颗粒,在30 ℃,200 r/min反应48 h后,过滤出凝胶,离心后的反应液通过HPLC检测2-αGG的含量。
1.3.3.2 固定化使用的细胞浓度确定
配制0.04、0.08、0.12、0.16、0.2 mg/mL的菌悬液,再分别将其与0.02 g/mL κ-卡拉胶溶液混合,制成含不同浓度细胞的固定化细胞凝胶。200 r/min反应48 h后,过滤出凝胶,离心后的反应液通过HPLC检测2-αGG的含量。
1.3.3.3 固定化细胞催化反应温度的确定
配制0.12 mg/mL的菌悬液、0.02 g/mL的κ-卡拉胶溶液,制成固定化细胞颗粒,添加到反应液中,分别在25、30、35、40、45 ℃条件下,200 r/min反应48 h,过滤出凝胶,离心后的反应液通过HPLC检测2-αGG的含量。
1.3.3.4 固定化细胞催化反应时间的确定
配制0.12 mg/mL的菌悬液、0.02 g/mL κ-卡拉胶溶液,制成固定化细胞颗粒,添加到反应液中,在35 ℃,200 r/min反应相隔一定的时间取样,离心后的反应液通过HPLC检测2-αGG的含量。
1.3.3.5 固定化细胞重复使用性
使用50 mmol/L、pH 7.0的缓冲液配制含有1 mol/L蔗糖和1 mol/L甘油的溶液,再向其中加入一定质量的固定化细胞,35 ℃下进行反应。反应48 h后,取反应上清液,煮沸10 min以终止反应。将反应后的固定化细胞用去离子水冲洗数次,加入新鲜的转化底物,再进行下一批反应。每次反应后,测定反应液中2-αGG的含量。通过重复上述步骤多次,以评价固定化细胞的重复使用性。
1.3.4 2-αGG对HepG2细胞活性的影响的检测
CCK8法检测细胞活力[16]:取对数期生长的细胞铺96孔板,加入不同浓度的2-αGG,同时设置空白组(只含生长培养基,无细胞),6个复孔。给药24 h后,加入CCK8试剂,继续孵育24~72 h后,测定OD450的吸光值。吸光值可以反映细胞的活力水平,吸光值越高,通常表示细胞活力越强。相对细胞活力计算公式见式(1):
相对细胞活力![]()
(1)
式中:A加药组,含细胞、CCK8和药物的孔在OD450的数值;A空白,含培养基和CCK8,无细胞孔数值;A对照组,含细胞和CCK8,无药物孔数值。
1.3.5 2-αGG对细胞模型的TC、TG、LDL-C、HDL-C、ALT、AST含量的影响
收集FFA诱导后的HepG2细胞,用细胞裂解液裂解细胞,低速离心5 min,取上清液备用,BCA蛋白浓度试剂盒检测蛋白浓度。
在空白孔中添加2.5 μL蒸馏水,校准孔加如2.5 μL标准品,在样本孔中加入2.5 μL样品,最后每孔加250 μL工作液,混匀,37 ℃、10 min避光孵育后在510 nm处读取各孔OD值。细胞内TG和TC的含量计算公式见式(2):
TG/TG含量![]()
(2)
式中:C标准,标准品浓度,mmol/L。
空白孔添加2.5 μL的蒸馏水,校准孔加2.5 μL的标准品,样本孔加2.5 μL样品,随后后每孔加入180 μL试剂一,混匀,37 ℃、10 min避光孵育后在600 nm处读取各孔OD值为A1,最后每孔添加60 μL试剂二,混匀,37 ℃、10 min避光孵育后在600 nm处读取各孔OD值为A2,计算ΔA=A2-A1。再按照公式(3)分别计算出细胞内LDL-C和HDL-C的含量:
HDLC/LDLC含量![]()
(3)
在样品孔和对照孔中各加20 μL,37 ℃预热的试剂一,再加入待测样品5 μL混匀,37 ℃、30 min避光孵育;再每孔添加20 μL试剂二,对照孔另加5 μL待测样品,混匀,37 ℃、20 min避光孵育后再每孔添加200 μL,0.4 mol/L氢氧化钠,混匀,室温、15 min避光孵育后在600 nm处读取各孔OD值。再按照说明书分别计算出细胞内ALT、AST的含量。
2 结果与分析
2.1 固定化方法的选择
分别用5种方法固定化制备了蔗糖磷酸化酶Suc75290固定化细胞,利用固定化细胞催化合成2-αGG的实验结果如图1所示。其中,κ-卡拉胶固定化细胞催化得到的2-αGG产量最高,而含有海藻酸钠的海固定化凝胶微球的产量远低于κ-卡拉胶固定化细胞,可能与使用0.02 g/mL CaCl2作为固化液制备微球有关,因为在之前的实验研究中发现高浓度的Ca2+能抑制细胞中Suc75290的酶活力,而κ-卡拉胶则是以30 g/L的KCl溶液作为固化液,与用海藻酸钠相比,去除了Ca2+的影响。因此,选择κ-卡拉胶为后续制备固定化细胞。
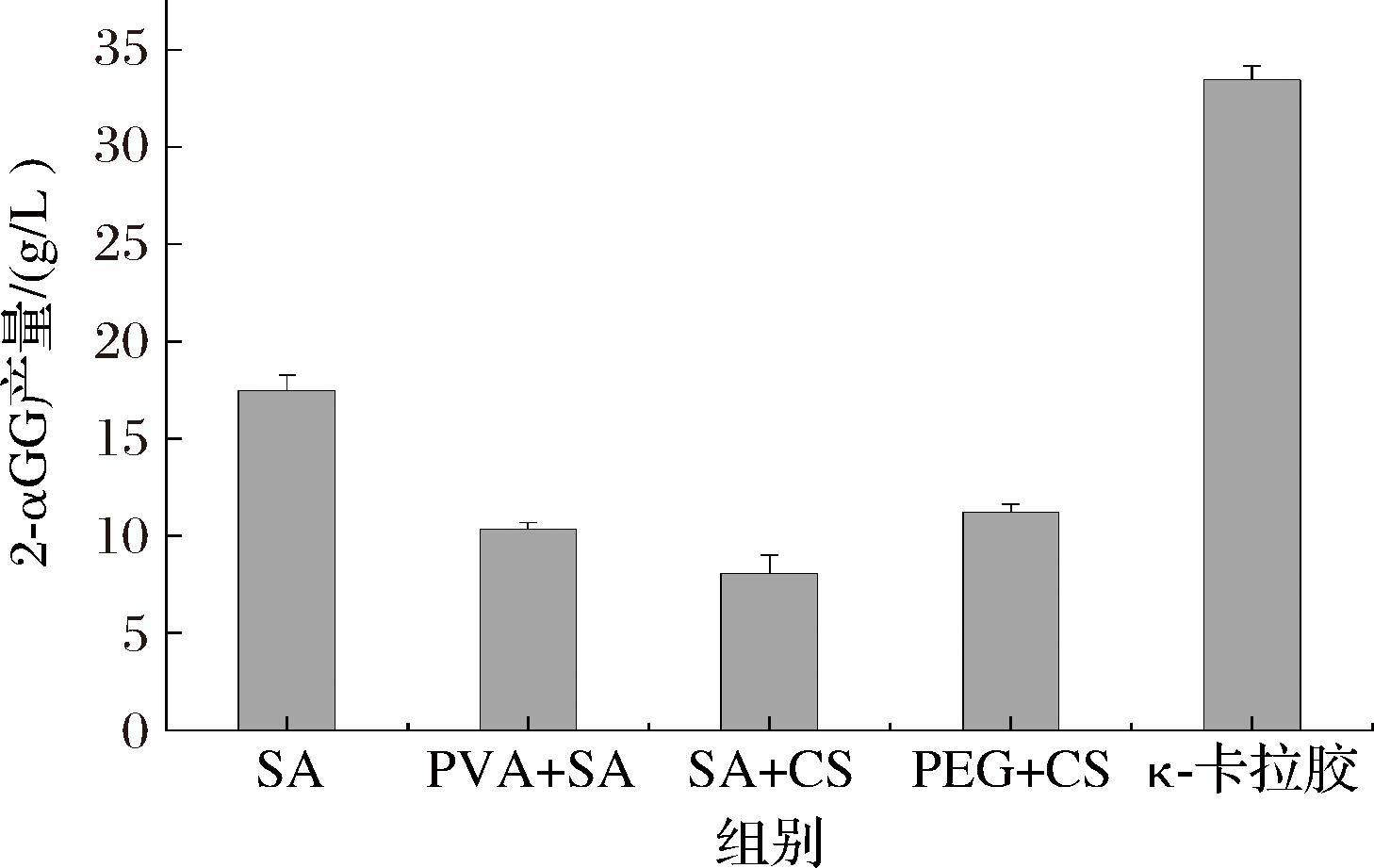
图1 细胞固定化方法
Fig.1 Methods of cell immobilization
2.2 κ-卡拉胶固定细胞的最适条件
由图2-a可知,κ-卡拉胶的质量浓度为0.02~0.03 g/mL时,制备的固定化细胞催化生成2-αGG的产量最高,但增加κ-卡拉胶的浓度,2-αGG的产量反而降低,可能是κ-卡拉胶的浓度过高,导致形成的固定化细胞与底物不能充分接触,从而降低了产量。因此,选择0.02 g/mL的κ-卡拉胶进行细胞固定化。如图2-b所示,在固定化体系中,菌体量0.12 mg/mL时,得到的凝胶在催化反应时2-αGG的产量最高。反应体系中菌体量添加不足,会降低2-αGG的产量,而如果添加过多,2-αGG的产量不再增多,就造成菌体的浪费。因此,选取添加的菌体浓度为0.12 mg/mL。
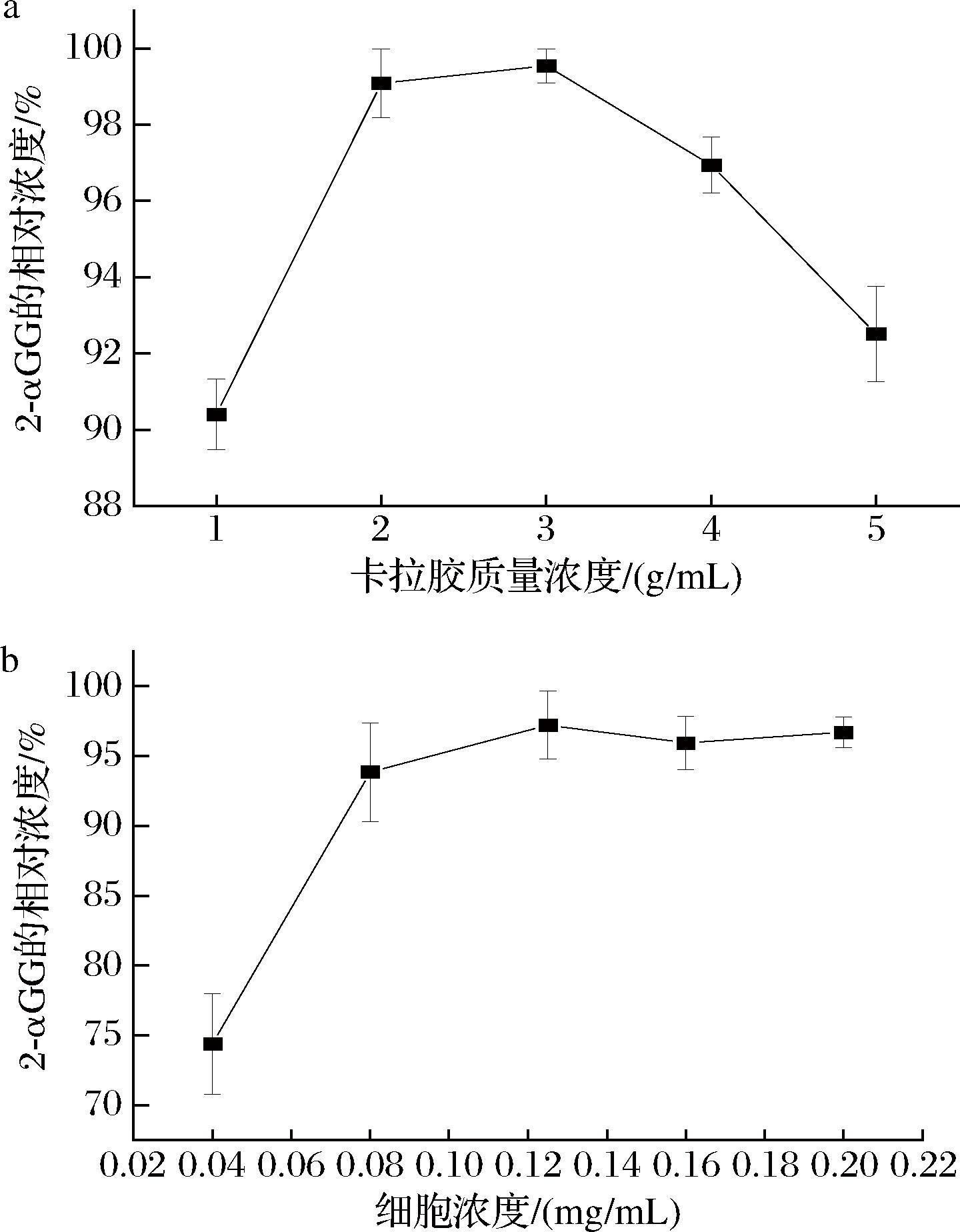
a-κ-卡拉胶质量浓度优化;b-细胞浓度优化
图2 细胞固定化条件的优化
Fig.2 Optimization of cell immobilization conditions
随着温度的升高,酶的稳定性可能会受到影响,导致活力下降,而κ-卡拉胶可能对细胞和其中的酶具有保护作用。由图3-a可知,35 ℃时,2-αGG的产量最高,但再升高温度,产量变化不大,在此温度下固定化细胞中的酶活力和稳定性可能达到了最佳平衡,从而达到了最高的产量。分别收集了8、12、24、36、48、60、72的反应液,不同反应时间2-αGG的产量如图3-b所示,反应时间为8~48 h时,2-αGG的浓度增加较快,在48 h时2-αGG的质量浓度最高,达到39 g/L,超过48 h后,2-αGG的浓度增加缓慢,逐渐达到平衡。因此,固定化细胞催化的最佳反应时间为48 h。
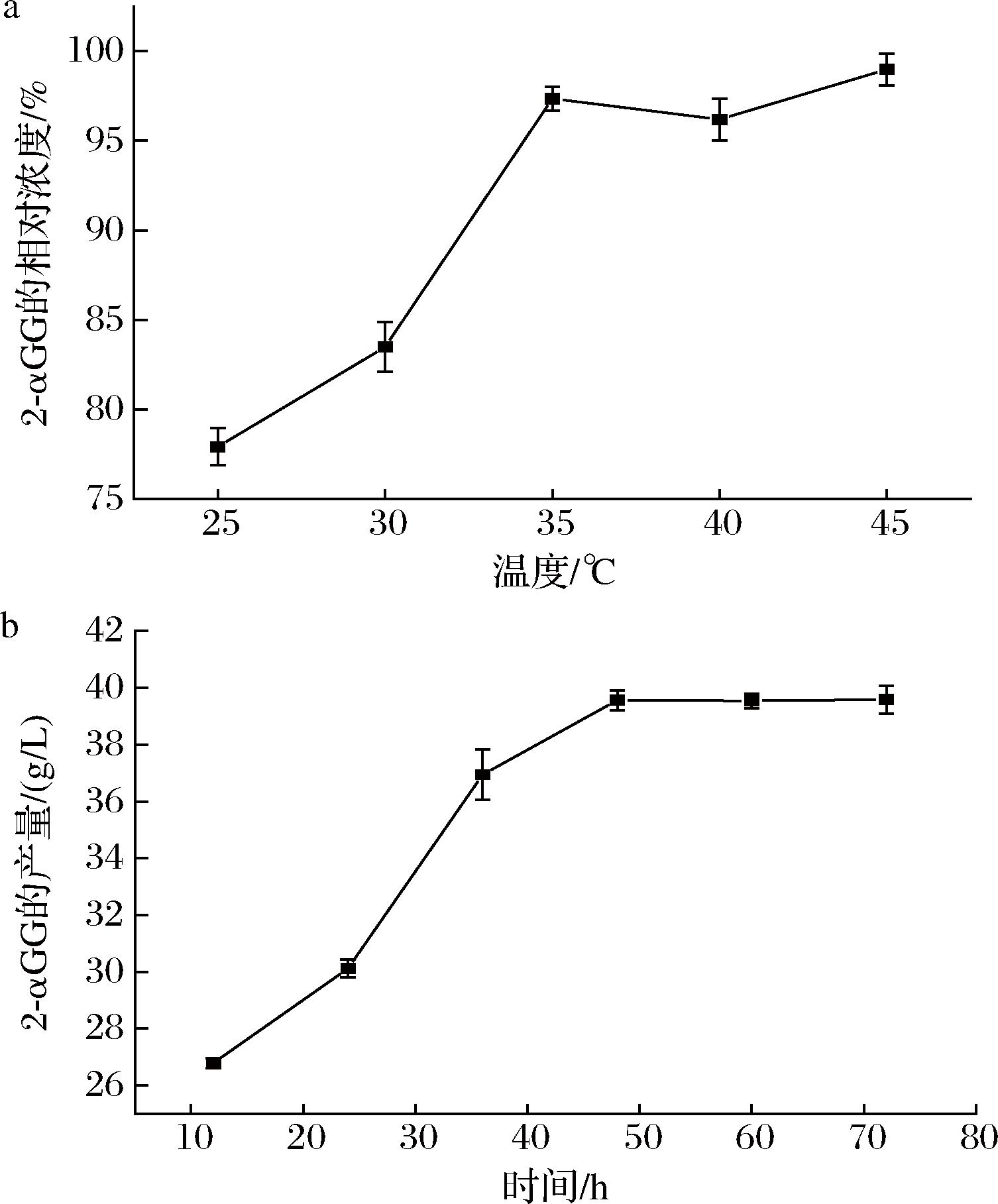
a-反应温度优化;b-反应时间优化
图3 固定化细胞生产2-αGG的条件优化
Fig.3 Optimization of conditions to produce 2-αGG by immobilized cells
2.3 固定化细胞的操作稳定性
操作稳定性(可重复使用性)是固定化细胞最重要的特性之一,为了验证κ-卡拉胶固定化细胞的重复使用性,将反应后的固定化重组细胞用缓冲液冲洗多次,再投入到新的反应体系中。重复使用7次后,固定化细胞催化生成2-αGG的产量保留了初始产量的87%,而游离细胞几乎丧失了全部催化活力(图4)。
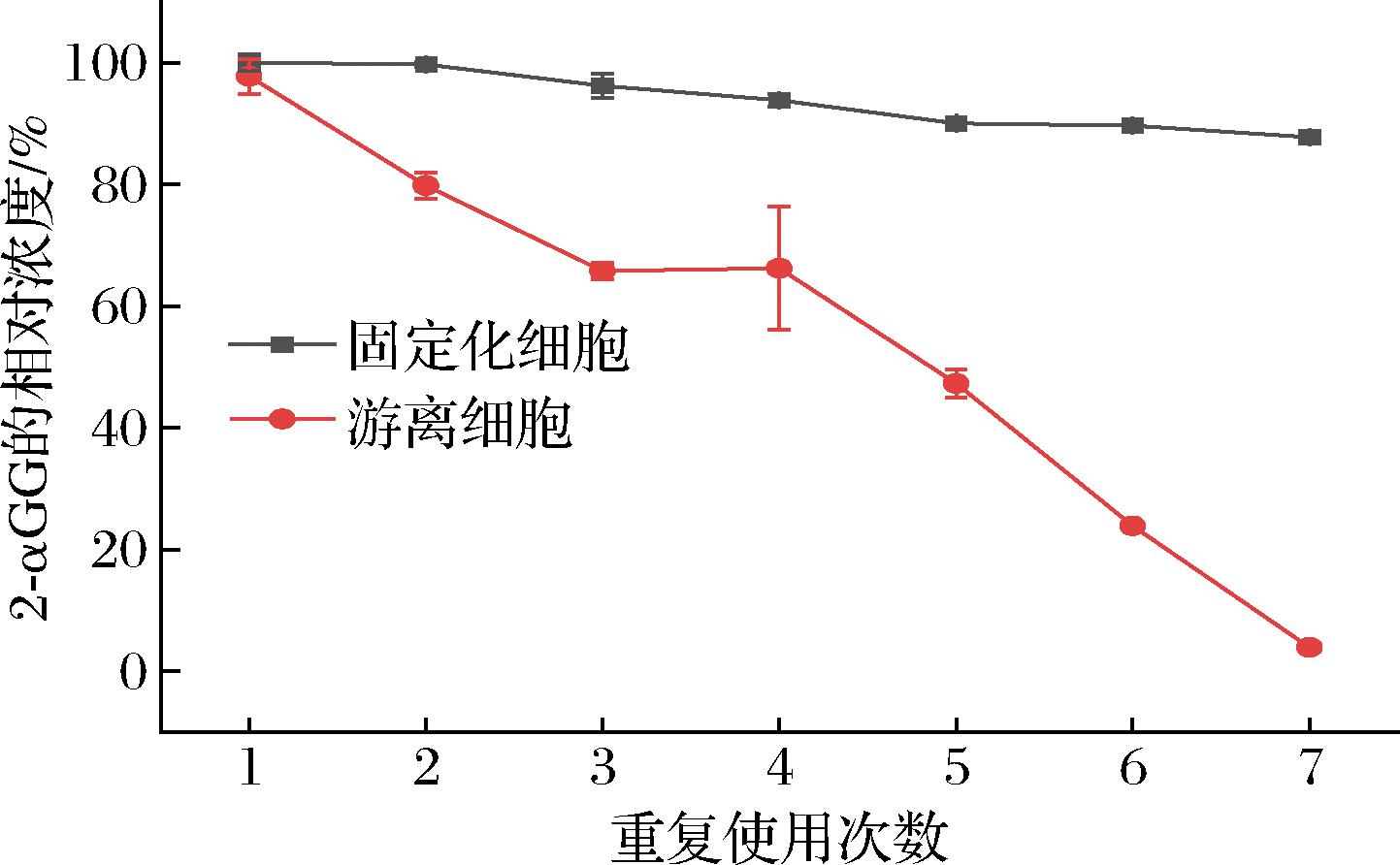
图4 固定化细胞的操作稳定性
Fig.4 Stability of immobilized cells
2.4 2-αGG对HepG2细胞活性的影响
使用4.687 5~600 μg/mL质量浓度的由固定化细胞催化得到的2-αGG分别处理HepG2细胞,监测细胞的变化,细胞活力变化数据如图5所示,2-αGG对HepG2细胞的影响呈剂量依赖,且浓度越高对细胞增殖的抑制越大,在后续实验中,选取实验周期为48 h,2-αGG质量浓度为75~600 μg/mL。
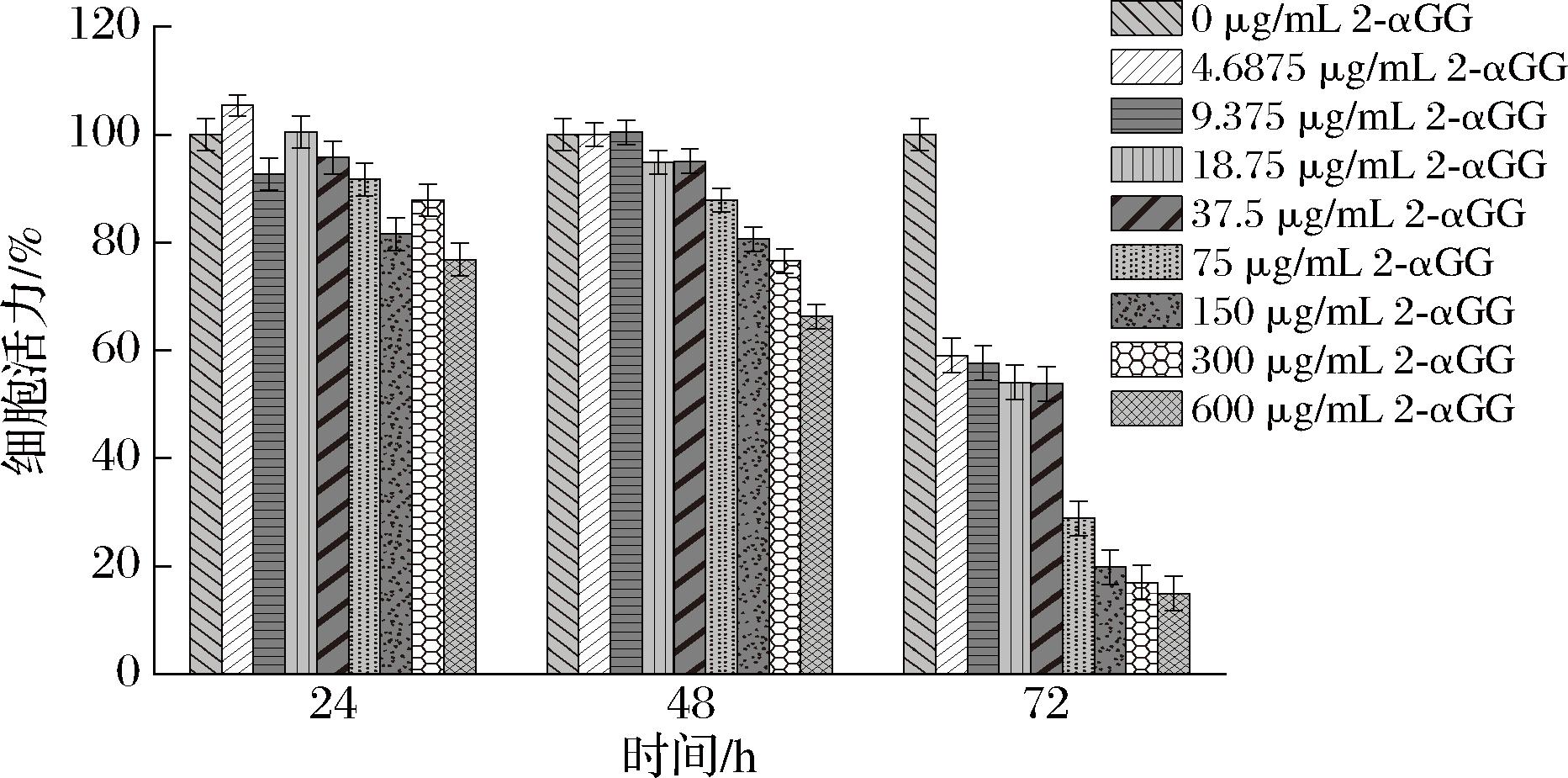
图5 2-αGG对HepG2细胞的活性和增殖的影响
Fig.5 Effect of 2-αGG on the activity and proliferation of HepG2 cells
2.5 2-αGG对细胞模型的TC、TG、LDL-C、HDL-C、ALT、AST含量的影响
通过测定用2-αGG处理后的细胞中TG和TC,LDL-C和HDL-C的浓度来分析2-αGG对细胞中各组分的变化,结果如图6所示。
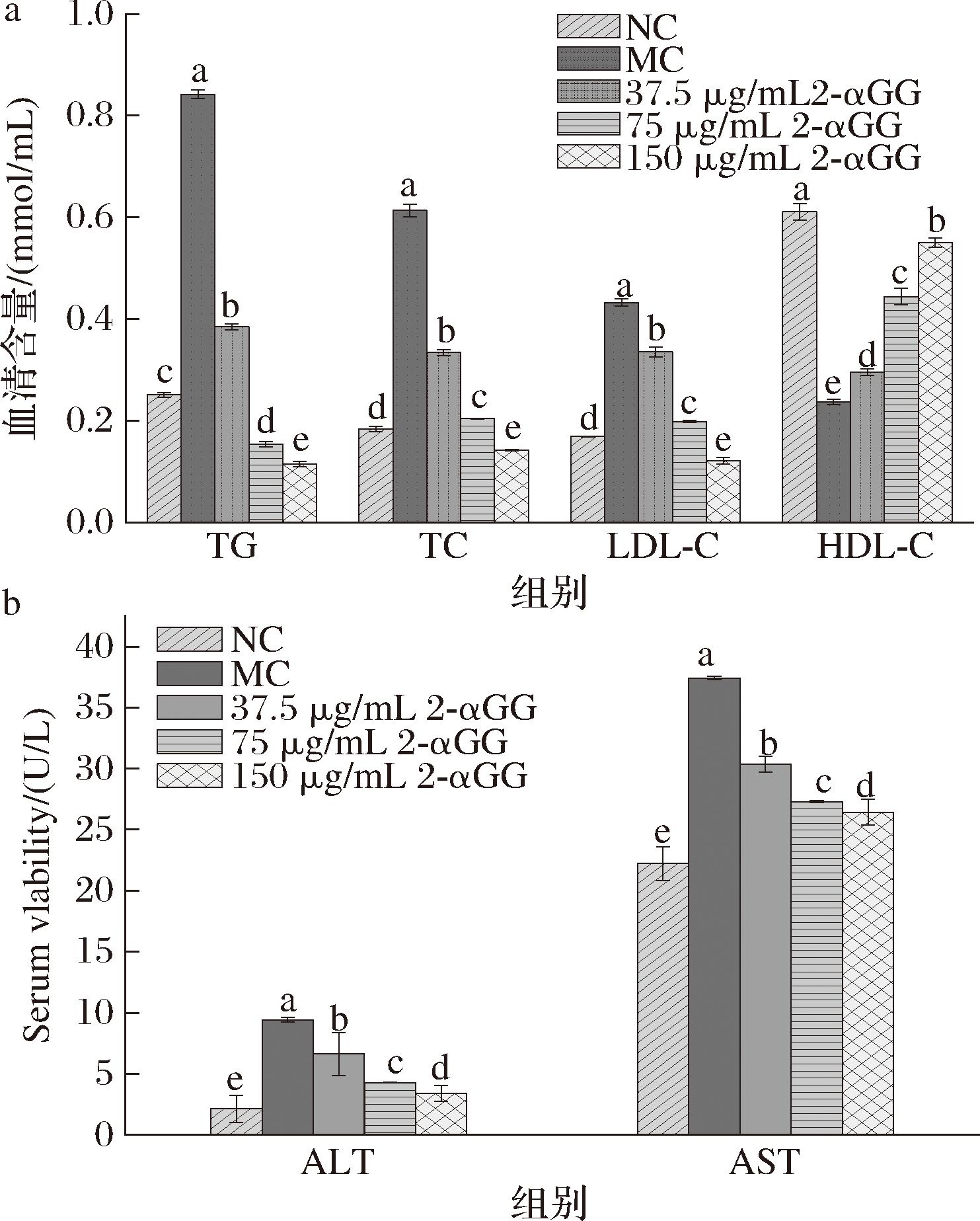
a-2-αGG对FFA诱导的HepG2细胞中TC、TG、LDL-C、HDL-C含量的影响;b-2-αGG对FFA诱导的HepG2细胞中ALT、AST含量的影响
图6 2-αGG对FFA诱导的HepG2细胞处理后血脂和肝损伤指标的影响
Fig.6 Effects of 2-αGG on lipid and liver injury indices in FFA-induced HepG2 cells after treatmen
注:同一组分下的不同字母表示在P<0.05水平上具有显著性差异。
如图6-a所示,与NC对照组相比,MO模型组中TC、TG、LDL-C、HDL-C含量均有所升高,且具有显著性差异(P<0.05),而HDL-C水平显著降低(P<0.05),表明FFA成功诱导细胞产生了脂质堆积和脂代谢紊乱现象,与模型组相比,经2-αGG处理后实验组中TC、TG以及LDL-C的含量均有明显的降低(P<0.05),而HDL-C增加(P<0.05),说明实验组的脂代谢紊乱和脂质蓄积得到了改善。从图6-b可以看出,模型组细胞中ALT、AST酶活力水平与NC组相比显著升高(P<0.05),表明FFA成功诱导了肝细胞损伤;实验组的ALT、AST水平与模型组相比均显著降低(P<0.05),且影响呈剂量依赖,浓度越高影响越大。以上结果表明,2-αGG具有改善FFA诱导的肝细胞脂代谢紊乱和脂质蓄积的功能,同时对FFA诱导的肝细胞损伤具有抵抗作用,从而改善HepG2细胞的脂肪变性。
3 讨论
NAFLD是代谢综合征,发病率在全球范围内呈上升趋势[17],随着病情的发展会对人体产生不可逆的损伤,且具有极高的致死率[18],因此,开发新的天然功能性物质改善NAFLD对人类健康具有重要意义。而从病理生理学的角度来看,非酒精性脂肪肝的特征是TG的过度沉积,而HDL-C合成与分泌减少促使LDL-C合成增多,引起TC含量升高,使TG肝转运减少,造成脂质代谢紊乱。有研究表明用有抗氧化性的功能物质可以改善非酒精性脂肪肝细胞模型脂质沉积,例如,对香豆酸具有抗氧化性、抗炎等作用,可以抑制HepG2细胞中TG的积累[19];干燥后的鸡骨草有抗氧化应激、抗炎及改善肝组织脂质代谢紊乱等功能[20]。在之前的研究报道中,2-αGG具有抗氧化的功能,因此,推测2-αGG可能具有改善非酒精性脂肪肝细胞模型脂质沉积的功能,且对HepG2细胞的影响呈剂量依赖,浓度越高对细胞增殖的抑制越大。为阐明2-αGG制剂防治脂肪肝的药效物质基础提供理论与实验依据。
由于2-αGG具有优良的生物学功能,在以后的发展应用中需要大量生产,但目前的生产方法还不足以达到需求,因此本文使用固定化产SPase的细胞来生产2-αGG。而近几年生产2-αGG的研究集中在开发利用产蔗糖磷酸化酶的菌株和纯酶催化方面,例如进行蛋白质分子改造提高酶活力进而增加生产2-αGG的产量,但是以上生产方法不稳定且步骤繁琐,而本文通过固定化产SPase的细胞来生产2-αGG,可持续生产,重复使用7次后仍保持原有的催化能力。尽管许多固定化方法得到的固定化细胞表现出良好的性能,如用聚乙二醇和聚乙烯醇,但是考虑到金属离子对酶活力的影响,使用κ-卡拉胶固定产SPase的细胞作为催化剂生产2-αGG,没有破坏基质还能维持酶活力,对关键参数进行优化后,反应体系中固定化细胞生产的2-αGG质量浓度达39 g/L,为后续的研究工作提供实践基础。
[1] KANURI G, BERGHEIM I.In vitro and in vivo models of non-alcoholic fatty liver disease (NAFLD)[J].International Journal of Molecular Sciences, 2013, 14(6):11963-11980.
[2] 于温温, 张金华, 刘云娜, 等.贻贝多糖对高脂饮食诱导的载脂蛋白E基因敲除小鼠非酒精性脂肪肝的改善作用[J].食品工业科技, 2022, 43(24):369-376.YU W W,ZHANG J H,LIU Y N, et al.Improvement effect of mussel polysaccharide α-D-glucan on non-alcoholic fatty liver apolipoprotein E knockout mice induced by high fat diet[J].Science and Technology of Food Industry 2022, 43(24):369-376.
[3] SCHWAIGER K N, CSERJAN-PUSCHMANN M, STRIEDNER G, et al.Whole cell-based catalyst for enzymatic production of the osmolyte 2-O-α-glucosylglycerol[J].Microbial Cell Factories, 2021, 20(1):79.
[4] ZHANG T, YANG J G, TIAN C Y, et al.High-yield biosynthesis of glucosylglycerol through coupling phosphorolysis and transglycosylation reactions[J].Journal of agricultural and food chemistry, 2020, 68(51):15249-15256.
[5] KRUSCHITZ A, NIDETZKY B.Biocatalytic production of 2-α-D-glucosyl-glycerol for functional ingredient use:Integrated process design and techno-economic assessment[J].ACS Sustainable Chemistry &Engineering, 2022, 10(3):1246-1255.
[6] SU R, ZHENG W, LI A, et al.Characterization of a novel sucrose phosphorylase from Paenibacillus elgii and its use in biosynthesis of α-arbutin[J].World Journal of Microbiology and Biotechnology, 2023, 40(1):24.
[7] LAPPONI M J, MÉNDEZ M B, TRELLES J A, et al.Cell immobilization strategies for biotransformations[J].Current Opinion in Green and Sustainable Chemistry, 2022, 33:100565.
[8] DELATTRE C, FENORADOSOA T A, MICHAUD P.Galactans:An overview of their most important sourcing and applications as natural polysaccharides[J].Brazilian Archives of Biology and Technology, 2011, 54(6):1075-1092.
[9] WAHBA M I.Carrageenan stabilized calcium pectinate beads and their utilization as immobilization matrices[J].Biocatalysis and Agricultural Biotechnology, 2021, 35:102078.
[10] TOSA T, SATO T, MORI T K, et al.Immobilization of enzymes and microbial cells using carrageenan as matrix[J].Biotechnology and Bioengineering, 1979, 21(10):1697-1709.
[11] BIELECKI S, BOLEK R.Immobilization of recombinant E.coli cells with phenol-lyase activity[A].:Progress in Biotechnology[J].Elsevier, 1996, 11:472-478.
[12] ANTHONY N G, BAIGET J, BERRETTA G, et al.Inhibitory kappa B kinase α (IKKα) inhibitors that recapitulate their selectivity in cells against isoform-related biomarkers[J].Journal of Medicinal Chemistry, 2017, 60(16):7043-7066.
[13] 马浩鑫, 朱桂达, 张晓霞, 等.一种非酒精性脂肪肝小鼠模型的建立方法[J].安徽农业科学, 2021, 49(14):80-84.MA H X,ZHU G D,ZHANG X X et al.An establishment method of a mouse model of non-alcoholic fatty liver disease[J].Jornal of Anhui Agricultural Sciences, 2021, 49(14):80-84.
[14] ![]() M, et al.Immobilization of Lactobacillus rhamnosus in polyvinyl alcohol/calcium alginate matrix for production of lactic acid[J].Bioprocess and Biosystems Engineering, 2020, 43(2):315-322.
M, et al.Immobilization of Lactobacillus rhamnosus in polyvinyl alcohol/calcium alginate matrix for production of lactic acid[J].Bioprocess and Biosystems Engineering, 2020, 43(2):315-322.
[15] KRUSCHITZ A, PEINSIPP L, PFEIFFER M, et al.Continuous process technology for glucoside production from sucrose using a whole cell-derived solid catalyst of sucrose phosphorylase[J].Applied Microbiology and Biotechnology, 2021, 105(13):5383-5394.
[16] 刘飞祥, 谭峰, 樊巧玲, 等.CCK-8与MTT法检测左归丸含药血清干预BMSCs增殖条件的比较[J].中国骨质疏松杂志, 2022, 28(1):6-10.LIU F X, TAN F, FAN Q L et al.Comparative study on experiment conditions between CCK-8 and MTT assay on BMSCs proliferation intervened by serum containing Zuoguiwan[J].Chinese Journal of Osteoporosis, 2022, 28(1):6-10.
[17] RINELLA M E.Nonalcoholic fatty liver disease:A systematic review[J].JAMA, 2015, 313(22):2263-2273.
[18] DRAIJER L, BENNING A M, KOOT B.Pediatric NAFLD:An overview and recent developments in diagnostics and treatment[J].Expert Review of Gastroenterology &Hepatology, 2019, 13(5):447-461.
[19] KANG S W, KANG S I, SHIN H S, et al.Sasa quelpaertensis Nakai extract and its constituent p-coumaric acid inhibit adipogenesis in 3T3-L1 cells through activation of the AMPK pathway[J].Food and Chemical Toxicology:An International Journal Published for the British Industrial Biological Research Association, 2013, 59:380-385.
[20] 谢妙金, 李阿荣, 刘若轩, 等.鸡骨草不同提取方法对非酒精性脂肪肝的改善作用[J].今日药学, 2017, 27(7):444-446.XIE M J, LI A R, LIU R X et al.Effects of Abrus mollis Hance on non-alcoholic fatty liver by different extraction methods[J].Pharmacy Today 2017, 27(7):444-446.