第二个线粒体释放的半胱天冬蛋白酶激活剂(second mitochondria-derived activator of caspase,Smac)是一种新型线粒体蛋白,最初由DU等[1]从Hela细胞中发现。当细胞受到凋亡刺激时,Smac会从线粒体释放进入到细胞质,它能够与凋亡抑制蛋白(inhibitors of apoptosis proteins,IAPs)相互作用,从而抑制IAPs与细胞凋亡酶(caspase)的结合,进一步增加caspase的活性,诱发细胞凋亡[2]。
细胞凋亡是一种细胞表现出自主、有序性死亡的方式,其通过凋亡基因控制蛋白的表达来维持细胞内环境的稳态[3]。对于众多生物个体而言,细胞凋亡在维护机体自稳态、促进生长发育以及监测和抑制肿瘤等多方面都发挥至关重要的作用[4]。细胞凋亡主要是通过外源死亡受体途径、内源线粒体途径和内质网途径得以实现,这3种途径所涉及到的中间代谢产物之间彼此存在着相互作用,从而触发复杂的凋亡级联反应[5-6]。研究发现,肿瘤细胞在内源Smac及其模拟物的调控下,可以引起线粒体损伤,激活caspase级联反应系统,从而诱导细胞凋亡[2, 7]。同时,Smac从线粒体释放后与IAPs家族中的生存素(Survivin)结合能够抑制T细胞中caspase-9的激活和释放,从而调控T细胞凋亡[8]。此外,也有研究表明细胞凋亡能够有效促进宰后畜禽肌肉的嫩化,改善生鲜肉的嫩度[9-10]。细胞凋亡具有的这一系列程序化的特性,在凋亡过程中,会导致细胞出现皱缩、骨架蛋白断裂以及细胞成分溶解等现象,这些现象都有利于宰后肌肉的嫩化[11]。近年来,随着国内外对细胞凋亡研究的不断深入,Smac调控IAPs促进细胞凋亡的研究也得到许多学者的广泛关注。因此,本文总结了近年来Smac的生物学特性、Smac调控IAPs促进细胞凋亡发生的途径、Smac调控IAPs促进肿瘤细胞、T细胞及肌细胞凋亡研究进展的相关报道,并对Smac调控IAPs促进肿瘤细胞、T细胞和肌细胞凋亡的未来研究方向进行展望,以期为肿瘤的靶向治疗和肌肉的嫩化理论提供新的见解。
1 Smac的生物学特性
1.1 Smac的分子结构及分布
Smac的基因长度约为1.49 kB,位于q12区域,由7个外显子组成,初始编码的Smac蛋白含有239个氨基酸,如图1所示[1]。Smac是一种线粒体膜间蛋白,与细胞色素c(cytochrome c,Cyt-c)相同,都被统称为线粒体促凋亡蛋白[12]。Smac的线粒体定位序列(matrix-targeting sequence,MTS)位于其氨基末端,由55个氨基酸残基组成,它的前体分子中也含有MTS[13]。MTS能够将Smac定位于线粒体,在线粒体中Smac会通过剪切作用分离MTS,形成成熟型的Smac。同时,前人报道发现含有184个氨基酸的成熟型Smac容易在细胞中形成寡聚体,其N端四肽序列为Ala-Val-Pro-Ile,这个序列经过剪切后被暴露出来,可以与X连锁凋亡抑制蛋白(X-linked inhibitor of apoptosis protein,XIAP)结合,抑制XIAP的表达,发挥Smac的促凋亡效应[13-14]。Smac通常以二聚体的形式存在于线粒体膜间隙当中,而成熟型Smac在线粒体膜间隙和胞浆中均存在,当细胞受到应激刺激时,成熟型的Smac释放进入到细胞质,并与XIAP相互作用,从而活化caspase,诱发细胞凋亡[15]。先前研究报道Smac能够与IAPs的RING结构域相互作用,从而减弱IAPs对caspase的抑制[16]。此外,研究发现Smac只有以二聚体的形式存在时,才能与IAPs结合并发挥促凋亡效应,而单体Smac不能调控IAPs介导的细胞凋亡级联反应[17]。同时,Smac在人体的睾丸、心脏、肝脏、脾脏等组织中表达水平较高;而在正常的胸腺组织中表达水平较低;在众多癌细胞中,Smac表达水平明显低于其他正常组织,Smac蛋白表达水平过低时可能会激活生物的反馈调节系统,从而抑制肿瘤细胞凋亡[18]。

图1 Smac的氨基酸序列[1]
Fig.1 Amino acid sequence of Smac[1]
1.2 Smac对IAPs的调控作用
目前,已在哺乳动物中鉴定出8种IAP,包括NIAP、CIAP1、CIAP2、XIAP、Survivin、Bruce、ML-IAP和ILP2。IAPs家族成员具有约70个氨基酸组成的特征性结构域(baculovirus inhibitior of apoptosis protein repeat, BIR),BIR结构域分为3种亚型,分别为BIR1、BIR2和BIR3,其家族成员至少要拥有1个BIR结构域,才能够具有抑制细胞凋亡的功能[19]。研究发现,在哺乳动物中的Smac能够作为IAPs的内源性抑制剂,激活caspase,从而诱导细胞凋亡;此外,也发现合成的Smac模拟物也能够限制IAPs表达,活化caspase,促进细胞凋亡[20]。IAPs家族蛋白中的BIR2和BIR3结构域能够与caspases结合从而抑制caspase的活化,进一步调节细胞凋亡,而BIR1结构域则能够在其他信号通路中起到调节者的作用[21]。IAPs家族蛋白的BIR结构域能够对caspase-3产生较强的抑制作用,其中,XIAP、CIAP1和CIAP2则是能够与活化的caspase-3和caspase-7结合,直接抑制它们的活化,而且还能与pro-caspase-9结合,抑制caspase-9的激活,但是,CIAP1和CIAP2对细胞凋亡的抑制作用要比XIAP弱的多[16, 22-24]。此外,许多研究报道Smac蛋白可以通过与XIAP的BIR3或BIR2结构域结合,使XIAP失去与caspase结合的能力,从而进一步增加caspase活性并触发细胞凋亡[2, 16, 22, 25],其相互作用机制如图2所示[2]。另一方面,IAPs具有RING结构域,因此,IAPs可以充当E3-泛素连接酶通过泛素-蛋白酶体途径,从而介导IAPs自身发生泛素化并完成降解[26]。内源Smac及其模拟物可以促进IAPs的泛素化,从而增加E3泛素连接酶活力,降解IAPs并促进细胞凋亡的发生[26-27]。尽管,大多数研究表明Smac能够调控IAPs的解降发挥促凋亡作用,但是也有学者发现XIAP会在细胞凋亡过程中削弱线粒体Smac的释放[28],对于这一机制仍需后续学者不断的探索。总之,多数研究表明Smac通过与IAPs结合抑制其表达或者促进IAPs泛素化降解来发挥促凋亡作用。
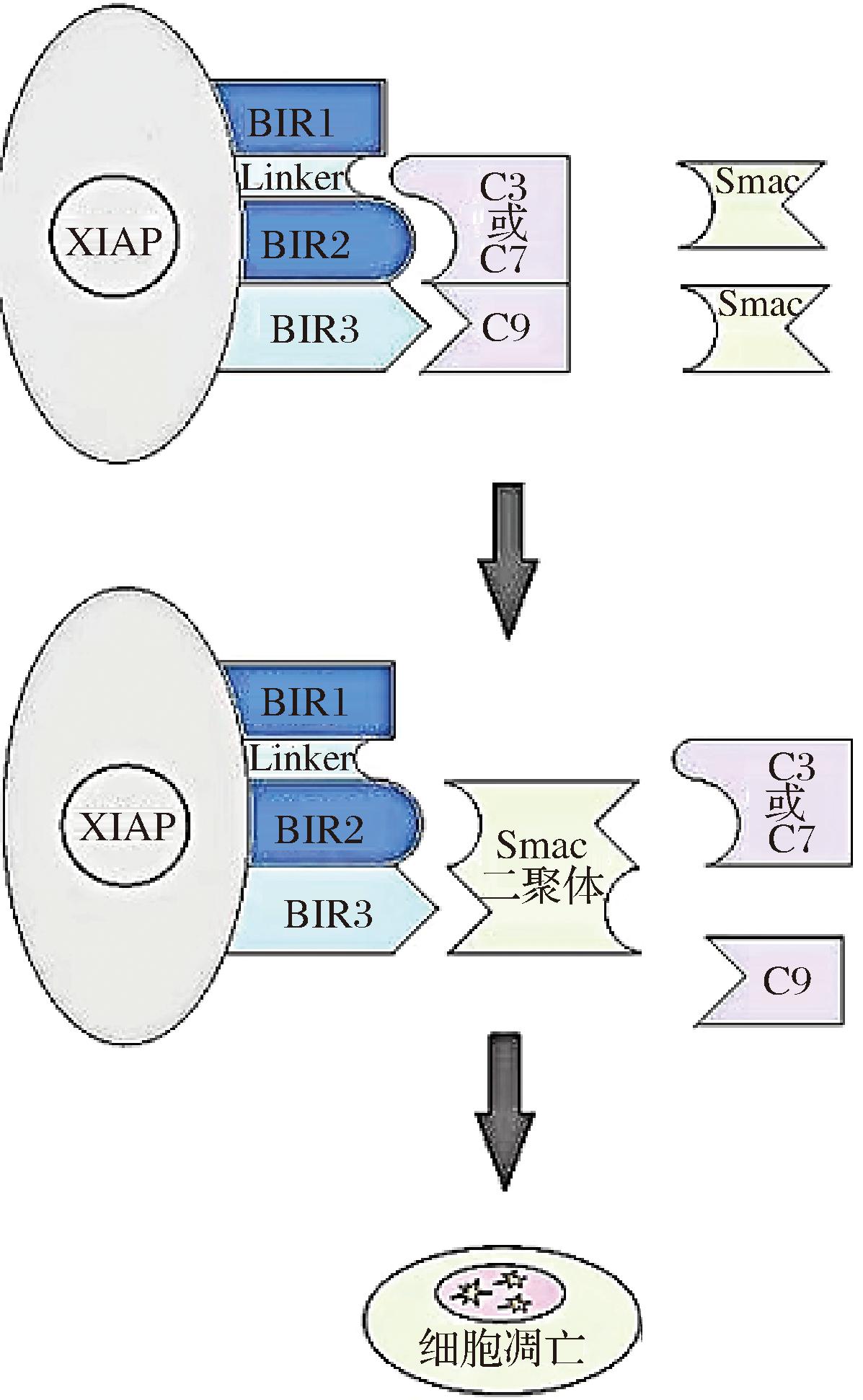
图2 Smac、XIAP与caspase的相互作用机制[2]
Fig.2 The interaction mechanism of Smac, XIAP, and caspase[2]
2 Smac调控IAPs促进细胞凋亡发生的途径
2.1 线粒体途径细胞凋亡
线粒体是提供细胞能量的重要场所,同时众多学者认为线粒体是细胞凋亡发生的核心细胞器[29]。当受到外界刺激时,如pH值和ATP开始下降时,可能会扰乱细胞内的三羧酸循环(tricarboxylic acid,TCA)造成线粒体功能障碍,线粒体膜电位下降,进一步促进线粒体膜通透性转换孔(mitochondrial permeability transition pore,MPTP)的高渗透性开放,从而导致促凋亡因子从线粒体释放到细胞质中,形成凋亡复合小体,激活caspase-9和caspase-3,然后诱导线粒体凋亡的发生[5],如图3所示。目前,多数研究表明线粒体凋亡途径主要通过B淋巴细胞瘤-2基因(B-cell lymphoma-2,Bcl-2)家族成员所调控,Bcl-2蛋白家族包括促凋亡蛋白(Bax、Bak、tBid等)和抗凋亡蛋白(Bcl-2、Bcl-xL、Mcl-1等)[31]。其中,Bcl-2和Bax是Bcl-2家族蛋白中参与细胞凋亡调控的代表性成员。前者可以通过调控抑凋亡蛋白的表达抑制线粒体促凋亡因子[Cyt-c、Smac、凋亡诱导因子(apoptosis-inducing factor,AIF)等]的表达,后者可以通过调控MPTP的高渗透性开放,从而促进Smac等凋亡因子的释放[5]。此外,有报道表明Smac可能不完全受Bcl-2家族蛋白的调控从线粒体释放到细胞质,这可能与Smac参与其他细胞凋亡途径相关[32]。至于其具体释放机制有待进一步研究。
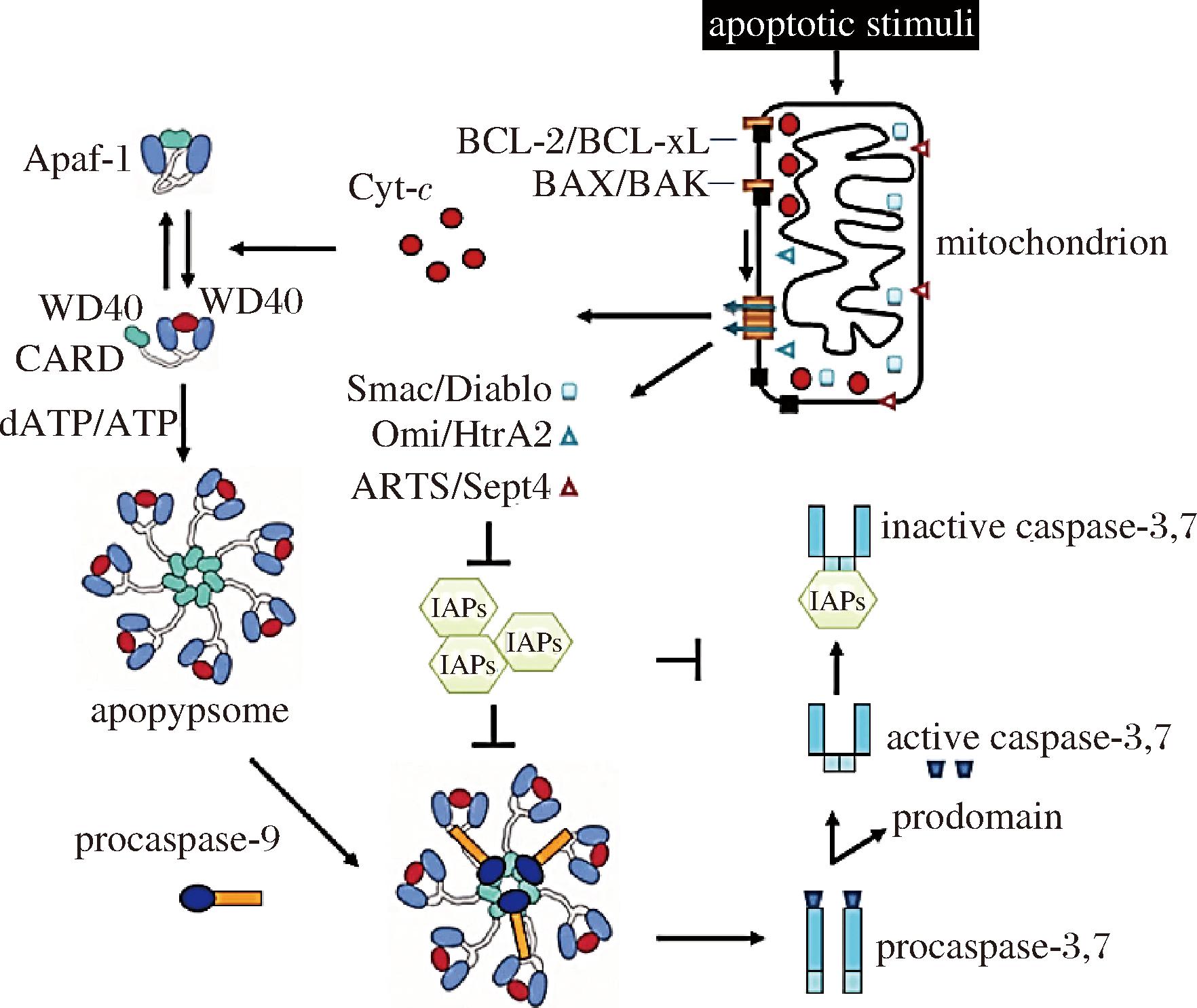
图3 Cyt-c、Smac介导线粒体途径激活caspase[30]
Fig.3 Cyt-c and Smac mediated mitochondrial pathways to activate caspase[30]
注:Apaf-1:Apoptosis protease activating factor-1,凋亡蛋白活性因子-1;mitochondrion:线粒体;apoptosome:凋亡体;Smac/Diablo:第2个线粒体衍生的半胱天冬蛋白酶激活剂/低pI的IAP直接结合蛋白;Omi/HtrA2:丝氨酸蛋白酶;IAPs:凋亡抑制蛋白;apoptotic stimuli:凋亡刺激;inactive caspase-3、7:非活性细胞凋亡酶-3、7;prodomain:原结构域;procaspase-3、procaspase-7:前体细胞凋亡酶-3、前体细胞凋亡酶-7;procaspase-9:前体细胞凋亡酶-9。
在哺乳动物细胞中Smac会同Cyt-c一起进入细胞质,触发细胞凋亡级联反应,在Cyt-c/Apaf-1/CASP-9凋亡途径中可以通过与IAPs的BIR3和BIR2结构域进行结合,减轻IAPs对caspase-9和caspase-3的抑制作用[32]。也有研究表明Cyt-c可能在Smac之前进入细胞质,而且当caspase被抑制时,Smac不能从线粒体释放进入细胞质,但对于Cyt-c的释放并未受到影响[33]。目前研究表明,Smac发挥促凋亡作用,主要通过Smac作用于IAPs,释放caspase活性,此外,IAPs还能结合caspase抑制其激活过程,从而调控细胞凋亡[16]。XIAP的BIR2结构域结合caspase-3和caspase-7,而其BIR3结构域可以结合caspase-9并抑制caspase-9的激活[16]。另外,XIAP羧基端存在的RING结构域可以充当E3泛素连接酶,从而调控XIAP发生泛素化降解反应,进而削弱对caspase的抑制作用[26]。然而,有学者认为XIAP发挥凋亡抑制作用与RING结构域并无关,这也就印证了XIAP可能通过结合caspase发挥其抑凋亡的作用[34-35]。此外,还发现CIAP1和CIAP2的C-末端也具有RING结构域,可以通过诱导CIAPs发生泛素化降解反应,介导多种凋亡信号因子的转运,最终促进caspase-3的表达[36]。Smac诱导CIAP1发生泛素化降解并介导线粒体细胞凋亡不需要CIAP2的存在,但CIAP2的降解必须要依赖CIAP1蛋白[16, 37]。CIAPs两者间相互作用的机制目前还不明确,仍需进一步研究。总之,Smac可能介导IAPs降解,从而放大caspase级联反应介导线粒体途径细胞凋亡。
2.2 死亡受体途径细胞凋亡
死亡受体途径也被称之为外源性的细胞凋亡途径,是指细胞膜表面的特定蛋白与凋亡信号相结合,形成死亡受体诱导信号复合体(death-inducing signaling complex,DISC)转运进入细胞内,激活caspase-8,从而引发死亡受体途径细胞凋亡[5, 11],如图4所示。Fas配体(Fas ligand)和Fas相关的死亡域表达增强以及caspase-8的激活,可以切割Bcl-2家族蛋白成员Bid,并导致Bax和Bak的寡聚化,从而诱导线粒体蛋白(如:Cyt-c、Smac、AIF等)释放,引起细胞凋亡[38]。前人研究发现人体中的内源Smac可促进TNF-α抑制胆囊癌细胞增殖并激活相关凋亡通路,caspase-8被激活后结合Fas相关的死亡域形成复合物并介导死亡受体途径凋亡[39]。同时,XIAP的表达对caspase-8的活化没有明显影响,但可以特异性结合半激活的p20/p12caspase-3,阻止其进一步活化为成熟型p17/p12caspase-3,从而中断凋亡受体途径的信号传导[16, 39]。另外,还有研究表明XIAP能够抑制caspase-3对caspase-8的正反馈激活,从而阻止死亡受体信号的进一步放大,这两者的相互作用可以中断死亡受体途径引起的细胞凋亡[40]。此外,Smac模拟物和阿霉素的联合使用能够通过TNF/CYLD/RIPK1/FADD/CASP-8信号途径协同触发细胞凋亡[41]。总之,Smac可能调控IAPs的表达,促进caspase-8的激活,引发死亡受体途径细胞凋亡。
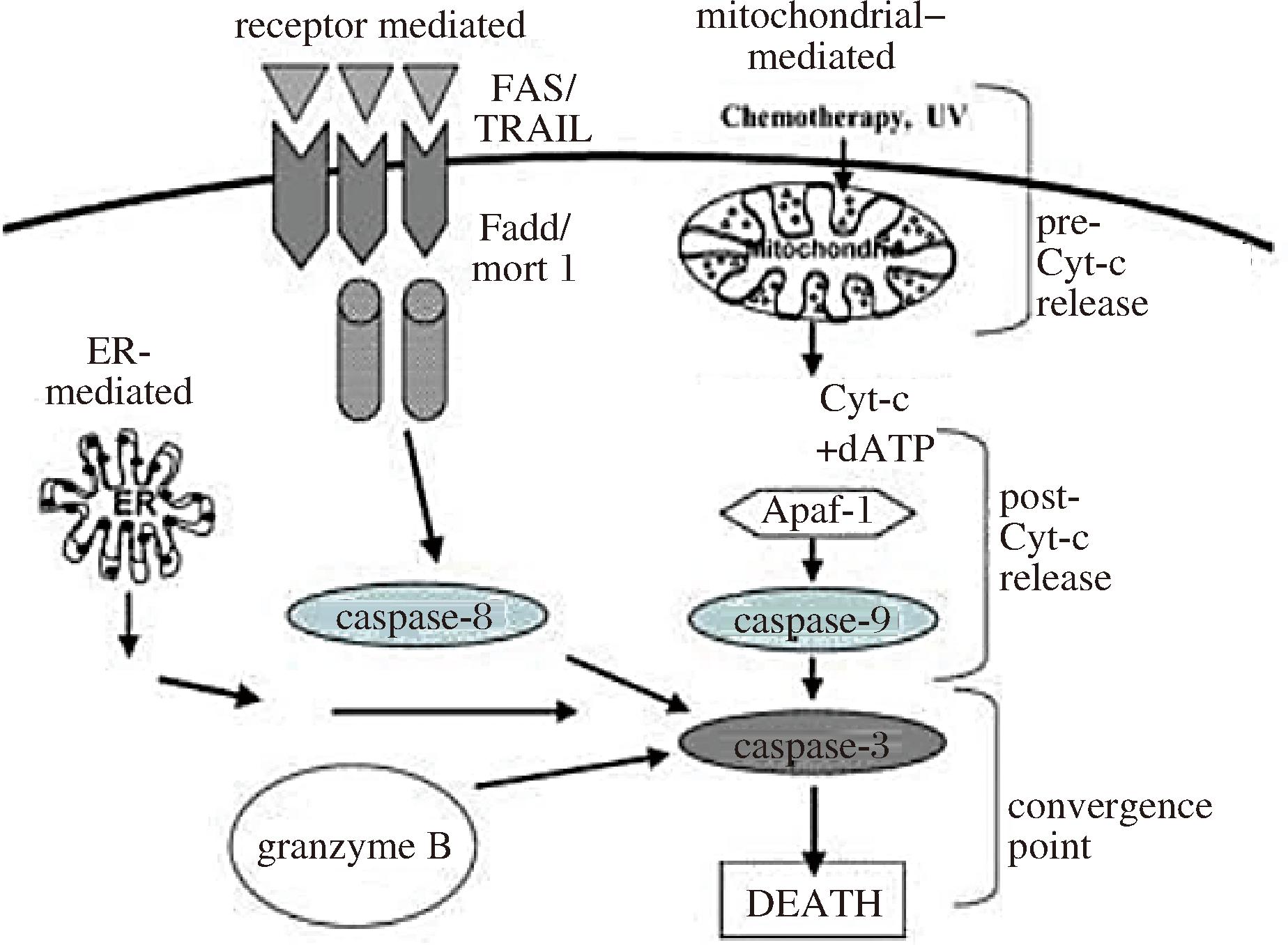
图4 细胞凋亡发生的途径[11]
Fig.4 The pathway of apoptosis[11]
注:ER-mediated:内质网介导;granzyme B:粒酶B;receptor mediated:受体介导;mitochondrial-Mediated:线粒体介导;Apaf-1:Apoptosis protease activating factor-1,凋亡蛋白活性因子-1;caspase-8:细胞凋亡酶-8;caspase-9:细胞凋亡酶-9;caspase-3:细胞凋亡酶-3;death:死亡;convergence point:聚集点。
2.3 内质网途径细胞凋亡
内质网途径是近年来最新发现的细胞凋亡途径,内质网凋亡途径受多种凋亡信号转运的影响,内质网Ca2+的超载和蛋白质的错误折叠可能会激活内质网应激凋亡,在内质网应激介导的凋亡途径中,caspase-12是重要的启动子,其在死亡受体或线粒体凋亡途径中无法被激活[42]。内质网在应激状态下可以通过促进蛋白折叠反应来保护细胞,同时,也可能通过介导凋亡级联反应来清除内部稳态失衡的细胞[43]。前人研究发现,Smac可能调控IAPs的表达激活caspase-12,诱导人体的结肠癌细胞中的内质网应激凋亡并参与了其他凋亡信号的转导,Smac和Cyt-c之间的潜在反馈信号似乎也调节了这种细胞凋亡的内在途径[44]。同时,Smac还可能通过降低内质网应激反应,减弱外源H2O2诱导的人晶状体上皮细胞凋亡[45]。此外,Smac模拟物通过未折叠蛋白反应(unfolded protein response,UPR)和内质网应激反应调控了衣霉素介导的细胞凋亡级联反应[20]。总之,Smac可能调控内质网途径细胞凋亡。
3 Smac调控IAPs促进细胞凋亡的研究进展
3.1 Smac促进肿瘤细胞凋亡的研究进展
在医学研究领域中,Smac及其模拟物被报道可以介导IAPs调控多种细胞凋亡途径诱导肿瘤细胞凋亡。IAPs在肿瘤细胞程序性死亡过程中,能够对caspase产生较强的抑制作用,从而抑制caspase的活化[17]。Smac结合IAPs使IAPs失去与caspases结合的能力或者促进IAPs的泛素化降解,从而引发细胞凋亡级联反应[16]。JIA等[46]将全长(FL)和成熟(MT)的Smac基因转染到K562和CEM白血病细胞中,发现转染Smac基因可以诱导白血病细胞的凋亡,这确证了Smac能够促进肿瘤细胞凋亡。此外,XIAP过表达时,会抑制caspase-3表达,进而阻止浸润性乳腺癌细胞凋亡,而Smac能够抑制XIAP的过表达,并促进caspase-3活化,导致乳腺癌细胞凋亡增加[47]。在研究肿瘤细胞的调控机制中发现Cyt-c和Smac等促凋亡因子的释放,进一步活化了caspase,其中Smac能够通过调控IAPs降解在抑制肿瘤增殖方面发挥重要作用,Smac过表达可以显著增加肿瘤细胞的敏感性,导致肿瘤细胞在外界刺激条件下凋亡加剧[48-50]。非小细胞肺癌组织和皮肤鳞癌细胞中的氧气供应被中断或者是受到其他外界因素刺激时,Smac能够通过渗透效应从线粒体释放进入胞浆与IAPs相互作用,导致肿瘤细胞中的Bax和Bcl-2表达量异常并促进Bax和Bak向线粒体转运,激活caspase-9,这可能有利于肿瘤细胞凋亡[51-52]。
最近有研究表明,在原发性弥漫性大B细胞淋巴瘤组织中,Smac模拟物BV6可诱导线粒体膜上蛋白Bax和Bcl-2的激活,同时伴随着线粒体膜电位的下降以及caspase-9的活化,从而诱发线粒体细胞凋亡[53]。同时,前人也发现Smac模拟物BV-6能够阻断卵巢细胞中增殖的小分子IAPs,使其表达量降低,最终诱导了肿瘤细胞凋亡[54]。BV6是目前合成的一种小分子Smac模拟类似物,能够诱导核因子κB(nuclear factor-kappa B,NF-κB)诱导激酶积累,激活非经典NF-κB途径,促使凋亡抑制蛋白家族中的CIAP1和CIAP2的显著降解[30]。SUN等[55]研究了内源Smac以及Smac模拟物介导的头颈部鳞状癌细胞化学致敏的作用和机制,结果发现Smac模拟物可以通过线粒体凋亡途径调控靶向治疗药物诱导癌细胞凋亡。另外,研究发现Smac模拟物与紫杉醇协同作用可以降解CIAP1和CIAP2,并释放激酶受体互作蛋白1(receptor-interactingprotein1, RIP1)同caspase-8和Fas相关死亡域(Fas-associating protein with a novel death domain, FADD)结合,从而形成CASP-8/RIP1/FADD复合物,该复合物激活caspase-8和caspase-3并最终导致非小细胞肺癌细胞凋亡[56]。基于上述研究发现,Smac及其模拟物可能会通过抑制肿瘤细胞中IAPs表达,促进caspase的活化,从而诱发肿瘤细胞凋亡。尽管Smac模拟物在治疗肿瘤方面具有较为广阔的应用前景,但由于Smac模拟物合成困难且在肿瘤细胞中对IAPs的靶向抑制效果较差,所以仍处于试验研究阶段,对于Smac模拟物的合成途径以及靶向调控肿瘤细胞凋亡的机制仍是未来医学领域需要攻克的难点,有待进一步研究。
3.2 Smac促进T细胞凋亡的研究进展
T细胞主要在胸腺内分化成熟,在胸腺激素的刺激下分化成熟为具有免疫活性的T细胞。活化后的T细胞具有较强的免疫活性,能够清除机体内的恶性肿瘤细胞,从而维护机体的健康运转。前人报道Smac调控T细胞凋亡可能与IAPs家族中的Survivin密切相关,Survivin作为一种抑凋亡蛋白可抑制T细胞活化诱导的细胞凋亡级联反应[57]。Smac调控Survivin的表达在T细胞发育、成熟及T细胞稳态自维持方面发挥重要作用[8]。Smac从线粒体释放同细胞质中的Survivin结合能够抑制T细胞中caspase-9的释放和激活;同时,XIAP也能够与Survivin形成复合物(XIAP-Survivin)并与caspase-3结合,导致caspase-3不能活化,从而抑制细胞凋亡级联反应[8]。Smac模拟物在T细胞中会促进XIAP和BIRC2降解,引发自噬和细胞凋亡复合物的形成,从而进一步诱导T细胞通过死亡受体途径凋亡[58]。另外,有人提出内源Smac及其模拟物可以激活T细胞,从而促进抗肿瘤免疫系统,经过不少学者的验证发现Smac可以调控IAPs并激活T细胞中的非经典NF-κB途径,从而激活T细胞靶向调控肿瘤细胞的凋亡[59]。此外,Smac可以拮抗IAPs介导的部分caspase,导致caspase-3的过早激活,然后反馈调节caspase-9的活化,从而促进T细胞中的蛋白酶体抑制所诱导的细胞凋亡,导致促凋亡蛋白的积累,引起线粒体移位,诱导线粒体膜电位下降[60]。总之,研究发现Smac可能通过调控IAPs的表达促进T细胞凋亡或通过T细胞活化靶向调控肿瘤细胞的凋亡,而关于Smac在T细胞中如何调控IAPs降解并促进T细胞活化,靶向调控肿瘤细胞凋亡的研究还鲜有报道,且作用机制也尚未阐明。
3.3 Smac促进宰后肌肉细胞凋亡的研究进展
嫩度是肉品质特性中最重要的食用品质之一。同时,嫩度也是消费者评价肉质量好坏的重要指标,并可能影响其购买肉类产品的决定。因此,研究肉嫩度的改善方法,对于改善肉品质,满足消费者需要具有十分重要的意义。宰后成熟便是改善肉嫩度的有效方法之一,该方法改善肉嫩度归因于内源酶对肌原纤维蛋白的有限降解,内源酶主要包括钙蛋白酶、蛋白酶体、组织蛋白酶和细胞凋亡酶等[61-63]。肉品科学理论最早认为宰后成熟过程中肌肉嫩度的改善主要源于钙蛋白酶和组织蛋白酶对部分肌原纤维骨架蛋白的水解,然而,上述内源酶系统并不能解释所有宰后肉嫩度变化的规律,随着研究人员不断深入探究宰后肌肉的嫩化机制,细胞凋亡理论逐渐替代传统的钙蛋白酶学说成为解释宰后成熟过程中肉嫩化的研究热点[5]。前人研究报道宰后肌肉成熟过程中细胞凋亡的发生能够促进肌肉嫩化,这与caspase级联反应的发生密不可分[9, 64]。HUANG等[9]认为caspase-3不仅是细胞凋亡的执行者,而且对降解肌原纤维蛋白骨架具有重要作用。目前研究发现caspase级联反应系统受多种凋亡信号分子的调节,其中Cyt-c和AIF等信号分子对宰后肌肉细胞凋亡及其嫩化的作用已被证实[11],但是关于Smac介导IAPs调控细胞凋亡对肉嫩度的作用机制还有待进一步探究。
在研究宰后畜禽肉类细胞凋亡调控嫩度的机制中发现,牛肉在宰后成熟早期Smac与Cyt-c的表达量明显升高,这可能是因为动物在屠宰过程当中受到了应激刺激,导致了线粒体功能障碍,MPTP开放程度变高,进一步激活了capase-9与caspase-3,诱发细胞凋亡改善宰后肌肉嫩度[65]。同时,研究表明牛肉宰后成熟过程中肌原纤维蛋白降解受多种酶系调控,其中,凋亡因子Cyt-c和Smac从线粒体释放进入细胞质可以介导肌细胞凋亡,并且线粒体Cyt-c的释放对Smac从线粒体向细胞质位移具有一定的促进作用[66],然而,关于Cyt-c和Smac之间的相互作用机制尚不清楚,仍需进一步研究。另外,ZOU等[67]也发现宰后牛肉成熟过程中12 h的XIAP基因表达明显低于1 h,且XIAP基因表达量低的牛肉caspase-3表达量相对更高,肌纤维特性更好。综上所述,Smac可能会通过与IAPs结合,或促进IAPs泛素化降解,进一步诱导肌细胞凋亡,然而在宰后肌肉成熟过程中Smac具体通过哪种方式调控IAPs降解促进细胞凋亡并影响肌肉嫩度还尚未阐明。
4 结论与展望
细胞凋亡级联反应在众多生物生命活动中具有重要作用,Smac在细胞受到刺激时,会从线粒体释放进入胞浆,与IAPs结合或者促进IAPs泛素化降解,减轻IAPs对caspase的抑制作用,从而激活caspase级联反应系统,促进细胞凋亡的发生。目前关于Smac及其模拟物促进细胞凋亡的研究报道主要还是围绕在医学领域,关于Smac模拟物的合成途径以及靶向调控肿瘤细胞凋亡的机制还尚未明确。同时,Smac在T细胞中如何调控IAPs降解并促进T细胞活化,靶向调控肿瘤细胞凋亡以及在宰后肌肉成熟过程中Smac如何调控IAPs并影响肌肉嫩化的机制尚不清楚,仍需进一步研究。总之,Smac调控IAPs对细胞凋亡的影响可以从以上角度着手深入研究,从而为肿瘤的靶向治疗和肌肉的嫩化理论提供新的思路。
[1] DU C, FANG M, LI Y, et al.Smac, a mitochondrial protein that promotes cytochrome c-dependent caspase activation by eliminating IAP inhibition[J].Cell, 2000, 102(1):33-42.
[2] QIN S D, YANG C C, LI S, et al.Smac:Its role in apoptosis induction and use in lung cancer diagnosis and treatment[J].Cancer Letters, 2012, 318(1):9-13.
[3] 王敬毅, 徐瑞荣.中药对抗再生障碍性贫血骨髓细胞凋亡研究现状[J].中国中医药信息杂志, 2007, 14(5):99-101.WANG J Y, XU R R. Research status of traditional Chinese medicine against apoptosis of bone marrow cells in aplastic Anemia[J]. Chinese Journal of Information on Traditional Chinese Medicine, 2007, 14(5):99-101.
[4] ATKIN-SMITH G K.Phagocytic clearance of apoptotic, necrotic, necroptotic and pyroptotic cells[J].Biochemical Society Transactions, 2021, 49(2):793-804.
[5] WANG L L, MA G Y, ZHANG Y B, et al.Effect of mitochondrial cytochrome c release and its redox state on the mitochondrial-dependent apoptotic cascade reaction and tenderization of yak meat during postmortem aging[J].Food Research International, 2018, 111:488-497.
[6] BECILA S, HERRERA-MENDEZ C H, COULIS G, et al.Postmortem muscle cells die through apoptosis[J].European Food Research and Technology, 2010, 231(3):485-493.
[7] SUN C, BAI J, SUN J Y, et al.OTU deubiquitinase 7B facilitates the hyperthermia-induced inhibition of lung cancer progression through enhancing Smac-mediated mitochondrial dysfunction[J].Environmental Toxicology, 2024, 39(4):1989-2005.
[8] 高照慧. Survivin调控季节性变应性鼻炎患者鼻黏膜CD4+T细胞凋亡的作用研究[D].太原:山西医科大学, 2019.GAO Z H. Effect of Survivin on regulating CD4+T cell apoptosis in nasal mucosa of patients with seasonal allergic rhinitis[D]. Taiyuan: Shanxi Medical University, 2019.
[9] HUANG F, HUANG M, ZHANG H, et al.Changes in apoptotic factors and caspase activation pathways during the postmortem aging of beef muscle[J].Food Chemistry, 2016, 190:110-114.
[10] WANG L L, YU Q L, HAN L, et al.Study on the effect of reactive oxygen species-mediated oxidative stress on the activation of mitochondrial apoptosis and the tenderness of yak meat[J].Food Chemistry, 2018, 244:394-402.
[11] ZHANG J Y, MA G Y, GUO Z B, et al.Study on the apoptosis mediated by apoptosis-inducing-factor and influencing factors of bovine muscle during postmortem aging[J].Food Chemistry, 2018, 266:359-367.
[12] 赵玉芳, 金敬顺, 赵玉玲.Smac蛋白与肺癌的研究进展[J].广西医科大学学报, 2015, 32(1):152-154.ZHAO Y F, JIN J S, ZHAO Y L.Research progress of Smac protein and lung cancer[J].Journal of Guangxi Medical University, 2015, 32(1):152-154.
[13] CHAI J, DU C, WU J W, et al.Structural and biochemical basis of apoptotic activation by Smac/DIABLO[J].Nature, 2000, 406(6798):855-862.
[14] SHI Y G.A conserved tetrapeptide motif:Potentiating apoptosis through IAP-binding[J].Cell Death and Differentiation, 2002, 9(2):93-95.
[15] 蔡增琰, 潘亚文, 尚银武, 等.XIAP、Smac的研究进展[J].中国肿瘤外科杂志, 2014, 6(1):51-53.CAI Z Y, PAN Y W, SHANG Y W, et al.Research progress of XIAP and Smac[J].Chinese Journal of Surgical Oncology, 2014, 6(1):51-53.
[16] FULDA S.Chapter four Smac mimetics to therapeutically target IAP proteins in cancer[J].International Review of Cell and Molecular Biology, 2017, 330: 157-169.
[17] WU G, CHAI J, SUBER T L, et al.Structural basis of IAP recognition by smac/DIABLO[J].Nature, 2000, 408(6815):1008-1012.
[18] 陈雷, 尚培中.Xiap、Smac与消化系肿瘤的研究进展[J].中国现代普通外科进展, 2016, 19(4):300-303.CHEN L, SHANG P Z.Research progress of Xiap, Smac and digestive system tumors[J].Chinese Journal of Current Advances in General Surgery, 2016, 19(4):300-303.
[19] CABALLERO R E, DONG S X M, GAJANAYAKA N, et al.Role of RIPK1 in SMAC mimetics-induced apoptosis in primary human HIV-infected macrophages[J].Scientific Reports, 2021, 11:22901.
[20] ABHARI B A, MCCARTHY N, LE BERRE M, et al.Smac mimetic suppresses tunicamycin-induced apoptosis via resolution of ER stress[J].Cell Death &Disease, 2019, 10(3):155.
[21] TIAN S Z, JI C G, ZHANG J Z H.Molecular basis of SMAC-XIAP binding and the effect of electrostatic polarization[J].Journal of Biomolecular Structure &Dynamics, 2021, 39(2):743-752.
[22] DIETZ L, ELLISON C J, RIECHMANN C, et al.Structural basis for SMAC-mediated antagonism of caspase inhibition by the giant ubiquitin ligase BIRC6[J].Science, 2023, 379(6637):1112-1117.
[23] ATTARAN-BANDARABADI F, ABHARI B A, NEISHABOURI S H, et al.Integrity of XIAP is essential for effective activity recovery of apoptosome and its downstream caspases by Smac/Diablo[J].International Journal of Biological Macromolecules, 2017, 101:283-289.
[24] DATTA R, OKI E, ENDO K, et al.XIAP regulates DNA damage-induced apoptosis downstream of caspase-9 cleavage[J].Journal of Biological Chemistry, 2000, 275(41):31733-31738.
[25] SRINIVASULA S M, DATTA P, FAN X J, et al. Molecular determinants of the caspase-promoting activity of Smac/DIABLO and its role in the death receptor pathway[J]. Journal of Biological Chemistry, 2000, 275(46): 36152-36157.
[26] KAMADA S.Inhibitor of apoptosis proteins as E3 ligases for ubiquitin and NEDD8[J].Biomolecular Concepts, 2013, 4(2):161-171.
[27] MACFARLANE M, MERRISON W, BRATTON S B, et al.Proteasome-mediated degradation of smac during apoptosis:XIAP promotes Smac ubiquitination in vitro[J].Journal of Biological Chemistry, 2002, 277(39):36611-36616.
[28] FLANAGAN L, SEBASTIà J, TUFFY L P, et al.XIAP impairs Smac release from the mitochondria during apoptosis[J].Cell Death &Disease, 2010, 1(6):e49.
[29] EL-MESERY M, SHAKER M E, ELGAML A.The SMAC mimetic BV6 induces cell death and sensitizes different cell lines to TNF-α and TRAIL-induced apoptosis[J].Experimental Biology and Medicine, 2016, 241(18):2015-2022.
[30] XIONG S B, MU T Y, WANG G W, et al.Mitochondria-mediated apoptosis in mammals[J].Protein &Cell, 2014, 5(10):737-749.
[31] TSUJIMOTO Y.Role of Bcl-2 family proteins in apoptosis:Apoptosomes or mitochondria?[J].Genes to Cells, 1998, 3(11):697-707.
[32] 胡文斌, 王瀚, 张少飞, 等.线粒体Smac蛋白与Bcl-2蛋白家族的相关性及其促凋亡机制研究进展[J].中国资源综合利用, 2015, 33(11):42-44.HU W B, WANG H, ZHANG S F, et al.Research progress of mitochondrial protein Smac relevance to the Bcl-2 protein family and promoting apoptosis mechanism[J].China Resources Comprehensive Utilization, 2015, 33(11):42-44.
[33] RIEDL S J, RENATUS M, SCHWARZENBACHER R, et al. Structural basis for the inhibition of caspase-3 by XIAP[J]. Cell, 2001, 104(5):791-800.
[34] JIN H L, XU J H, GUO X R, et al.XIAP RING domain mediates miR-4295 expression and subsequently inhibiting p63α protein translation and promoting transformation of bladder epithelial cells[J].Oncotarget, 2016, 7(35):56540-56557.
[35] 刘圣美, 尚凤芹, 陈亚东, 等.虾夷马粪海胆X染色体连锁凋亡抑制蛋白XIAP基因克隆及不同病原微生物刺激后的表达响应[J].大连海洋大学学报, 2022, 37(4):627-635.LIU S M, SHANG F Q, CHEN Y D, et al.Cloning of X-linked inhibitor of apoptosis protein XIAP gene and its response to stimulation in sea urchin Strongylocentrotus intermedius challenged with pathogenic microorganisms[J].Journal of Dalian Ocean University, 2022, 37(4):627-635.
[36] 汪灵, 吴至佛, 邓增艳, 等.乳腺癌组织中cIAP1、XIAP和caspase-3的表达及其临床意义[J].中国普通外科杂志, 2019, 28(5):581-589.WANG L, WU Z F, DENG Z Y, et al.Expressions of cIAP1, XIAP and caspase-3 in breast cancer tissue and their clinical significance[J].Chinese Journal of General Surgery, 2019, 28(5):581-589.
[37] DARDING M, FELTHAM R, TENEV T, et al.Molecular determinants of Smac mimetic induced degradation of cIAP1 and cIAP2[J].Cell Death and Differentiation, 2011, 18(8):1376-1386.
[38] XU F B, REN L M, SONG M, et al.Fas- and mitochondria-mediated signaling pathway involved in osteoblast apoptosis induced by AlCl3[J].Biological Trace Element Research, 2018, 184(1):173-185.
[39] CHEN M Y, HUANG M T, CHEN W H, et al.Smac mimetic promotes TNF-α to induce apoptosis of gallbladder carcinoma cells[J].Cellular Signalling, 2020, 72:109654.
[40] FERREIRA K S, KREUTZ C, MACNELLY S, et al.Caspase-3 feeds back on caspase-8, Bid and XIAP in type I Fas signaling in primary mouse hepatocytes[J].Apoptosis, 2012, 17(5):503-515.
[41] YANG C K, RAN Q, ZHOU Y F, et al.Doxorubicin sensitizes cancer cells to Smac mimetic via synergistic activation of the CYLD/RIPK1/FADD/caspase-8-dependent apoptosis[J].Apoptosis, 2020, 25(5-6):441-455.
[42] NAKAGAWA T, ZHU H, MORISHIMA N, et al.Caspase-12 mediates endoplasmic-reticulum-specific apoptosis and cytotoxicity by amyloid-beta[J].Nature, 2000, 403(6765):98-103.
[43] 王华君. Smac在人晶状体上皮细胞内质网应激及其介导的细胞凋亡中的作用及机制的研究[D].郑州:郑州大学, 2017.WANG H J.Study on the role and mechanism of Smac in endoplasmic reticulum stress and its mediated apoptosis of human lens epithelial cells[D].Zhengzhou:Zhengzhou University, 2017.
[44] HE Q, SHI J X, JONES S, et al.Smac deficiency affects endoplasmic reticulum stress-induced apoptosis in human colon cancer cells[J].Molecular and Cellular Pharmacology, 2009, 1(1):23-28.
[45] KONG D Q, LIU Y, LI L, et al.Downregulation of Smac attenuates H2O2-induced apoptosis via endoplasmic reticulum stress in human lens epithelial cells[J].Medicine, 2017, 96(27):e7419.
[46] JIA L, PATWARI Y, KELSEY S M, et al.Role of Smac in human leukaemic cell apoptosis and proliferation[J].Oncogene, 2003, 22(11):1589-1599.
[47] 王晓烨, 刘志英, 冬国友.XIAP、Smac、Caspase-3表达与浸润性乳腺癌分化程度及预后的关系[J].临床误诊误治, 2022, 35(5):55-58.WANG X Y, LIU Z Y, DONG G Y.Relationships between the expressions of XIAP,Smac,Caspase-3 and the differentiation degree and prognosis of invasive breast cancer[J].Clinical Misdiagnosis &Mistherapy, 2022, 35(5):55-58.
[48] MADI N, DANY M, ABDOUN S, et al.Moringa oleifera’s nutritious aqueous leaf extract has anticancerous effects by compromising mitochondrial viability in an ROS-dependent manner[J].Journal of the American College of Nutrition, 2016, 35(7):604-613.
[49] GIAGKOUSIKLIDIS S, KASPERCZYK H, VOGLER M, et al.Sensitization for γ-irradiation-induced apoptosis by smac[J].Blood, 2004, 104(11):3392.
[50] 兰亚东. Smac类似物LCL161对结肠癌细胞株增殖与凋亡的影响及其机制的初步探讨[D].蚌埠:蚌埠医学院, 2016.LAN Y D. Effect of Smac analog LCL161 on proliferation and apoptosis of colon cancer cell line and its mechanism[D]. Bangbu: Bengbu Medical College, 2016.
[51] 皇婷, 颜谭, 安书芬, 等.第二线粒体源性Caspases激活因子与非小细胞肺癌术后辅助化疗患者预后转归和生存期限的相关性[J].临床医学研究与实践, 2021, 6(28):9-11, 24.HUANG T, YAN T, AN S F, et al.Correlation between the second mitochondria-derived Caspases activators and the prognosis and survival time of patients with postoperative adjuvant chemotherapy for non-small cell lung cancer[J].Clinical Research and Practice, 2021, 6(28):9-11, 24.
[52] 鲁青莲, 刘林莉, 蒋亚辉, 等.红芪多糖通过线粒体途径诱导皮肤鳞状细胞癌细胞SCL-1凋亡的研究[J].河北医学, 2022, 28(2):208-213.LU Q L, LIU L L, JIANG Y H, et al.Apoptosis of cutaneous squamous cell carcinoma cell line SCL-1 induced by hedysari polysaccharide through mitochondrial pathway[J].Hebei Medicine, 2022, 28(2):208-213.
[53] DIETZ A, DALDA N, ZIELKE S, et al.Proteasome inhibitors and Smac mimetics cooperate to induce cell death in diffuse large B-cell lymphoma by stabilizing NOXA and triggering mitochondrial apoptosis[J].International Journal of Cancer, 2020, 147(5):1485-1498.
[54] BAGNJUK K, KAST V J, TIEFENBACHER A, et al.Inhibitor of apoptosis proteins are potential targets for treatment of granulosa cell tumors - implications from studies in KGN[J].Journal of Ovarian Research, 2019, 12(1):76.
[55] SUN Q H, ZHENG X N, ZHANG L, et al.Smac modulates chemosensitivity in head and neck cancer cells through the mitochondrial apoptotic pathway[J].Clinical Cancer Research, 2011, 17(8):2361-2372.
[56] YANG C C, WANG H Z, ZHANG B X, et al.LCL161 increases paclitaxel-induced apoptosis by degrading cIAP1 and cIAP2 in NSCLC[J].Journal of Experimental &Clinical Cancer Research, 2016, 35(1):158.
[57] XUE J M, ZHAO M Z, MA F, et al.Survivin facilitates T-helper 2-biased inflammation in the airway[J].International Forum of Allergy &Rhinology, 2019, 9(6):656-664.
[58] CAMPBELL G R, BRUCKMAN R S, CHU Y L, et al.SMAC mimetics induce autophagy-dependent apoptosis of HIV-1-infected resting memory CD4+ T cells[J].Cell Host &Microbe, 2018, 24(5):689-702.e7.
[59] BURTON A M, LIGMAN B R, KEARNEY C A, et al.SMAC mimetics inhibit human T cell proliferation and fail to augment type 1 cytokine responses[J].Cellular Immunology, 2023, 384:104674.
[60] BERGES C, HABERSTOCK H, FUCHS D, et al.Proteasome inhibition activates the mitochondrial pathway of apoptosis in human CD4+ T cells[J].Journal of Cellular Biochemistry, 2009, 108(4):935-946.
[61] SENTANDREU M A, COULIS G, OUALI A.Role of muscle endopeptidases and their inhibitors in meat tenderness[J].Trends in Food Science &Technology, 2002, 13(12):400-421.
[62] 刘越. 泛素—蛋白酶体在羊肉成熟中的作用[D].银川:宁夏大学, 2015.LIU Y.The role of ubiquitin-proteasome in mutton maturation[D].Yinchuang:Ningxia University, 2015.
[63] WANG J Y, HAN J H, ZHAO R N, et al.Effects of lysosomal Fe2+ on mitochondria apoptosis and muscle tenderness in postmortem Tibetan sheep meat[J].International Journal of Food Science and Technology, 2024, 59(9):6277-6288.
[64] CAO J X, OU C R, ZOU Y F, et al.Activation of caspase-3 and its correlation with shear force in bovine skeletal muscles during postmortem conditioning[J].Journal of Animal Science, 2013, 91(9):4547-4552.
[65] 魏起超. 线粒体损伤对宰后牛肉嫩化的影响[D].北京:中国农业科学院, 2021.WEI Q C. Effect of mitochondrial damage on tenderness of beef after slaughtering[D]. Beijing: Chinese Academy of Agricultural Sciences, 2021.
[66] 刘春梅. 线粒体凋亡因子释放对宰后牛肉嫩化的影响[D].北京:中国农业科学院, 2023.LIU C M. Effect of mitochondrial apoptosis factor release on tenderness of beef after slaughtering[D]. Beijing: Chinese Academy of Agricultural Sciences, 2023.
[67] ZOU B, SHAO L L, LIU Y N, et al.Muscle fiber characteristics and apoptotic factor differences in beef Longissimus lumborum and Psoas major during early postmortem[J].Meat Science, 2023, 198:109092.