酵母β-葡聚糖是来自酵母细胞壁的一种天然多糖,具有增强免疫力、抗炎、改善肠道健康、降血糖、清除胆固醇等多种生物活性[1-2]。目前,酵母β-葡聚糖已被用于医药[3]、化妆品[4]以及食品加工[5]等行业。然而,酵母β-葡聚糖分子内与分子间存在着较强的氢键作用力,使其以紧密的三螺旋构象存在,这种结构极大地限制了β-葡聚糖分子与水分子的有效接触,导致其溶解性极低,严重影响了酵母β-葡聚糖的生物活性和应用范围。酵母β-葡聚糖的生物活性可通过修饰其一级和高级结构或减少多糖的链长来改善。因此,通过适当的方法对酵母β-葡聚糖进行改性,对其功效的发挥和实际工业应用具有重要意义。目前,国内外学者已采用物理、化学和生物等单一或协作的方法对酵母β-葡聚糖的改性进行了深入研究[6-8],如通过高温、超声、酸碱、酶降解或改变β-葡聚糖骨架或支链上的基团来增强酵母β-葡聚糖的可溶性,从而提高其生物活性以满足实际生产需求。本文综合回顾了国内外对酵母β-葡聚糖改性增溶的研究进展,系统性地概述了不同改性方法的原理与效果,以及酵母β-葡聚糖的应用现状,以期为酵母β-葡聚糖的高效应用提供坚实的理论依据,进一步推动其在多个领域的广泛应用与发展。
1 酵母β-葡聚糖的来源与结构
酵母β-葡聚糖是具有多种生物活性和药理作用的多糖大分子,主要来源于细胞壁[9]。酵母细胞壁由甘露聚糖、葡聚糖和几丁质组成(图1),其中,甘露聚糖和几丁质分别占细胞壁多糖成分的45%和2%左右,而β-葡聚糖则占据主导地位,约为细胞壁干重的50%~60%。酵母β-葡聚糖不带电荷,呈中性,其结构独特:主链由大约1 500个葡萄糖残基通过β-1,3糖苷键连接,支链则由约190个葡萄糖残基通过β-1,6糖苷键形成分支,3条多糖链平行排列,缠绕形成致密的三股螺旋结构,并通过分子内多羟基作用形成的氢键网络维持结构稳定。作为细胞壁的骨架,β-1,3葡聚糖负责支撑和构建酵母细胞框架,而β-1,6葡聚糖则为连接蛋白提供结合位点,这对于维持整个细胞和细胞壁的稳定至关重要[10-12]。然而,酵母β-葡聚糖的结构受到β-1,6糖苷键连接的葡萄糖侧链的显著影响。具体而言,当这些侧链长度变短、取代度降低时,酵母β-葡聚糖的三螺旋结构将变得更为致密[11],这种致密的结构使得酵母β-葡聚糖不易溶于水、醇和酸碱等有机溶剂,因此,酵母β-葡聚糖的不溶性在很大程度上限制了其在食品、医药等领域的开发和应用潜力[13]。鉴于此,对酵母β-葡聚糖进行改性增溶显得极为关键,这将有助于克服其溶解性差的限制,进而扩宽应用范围。
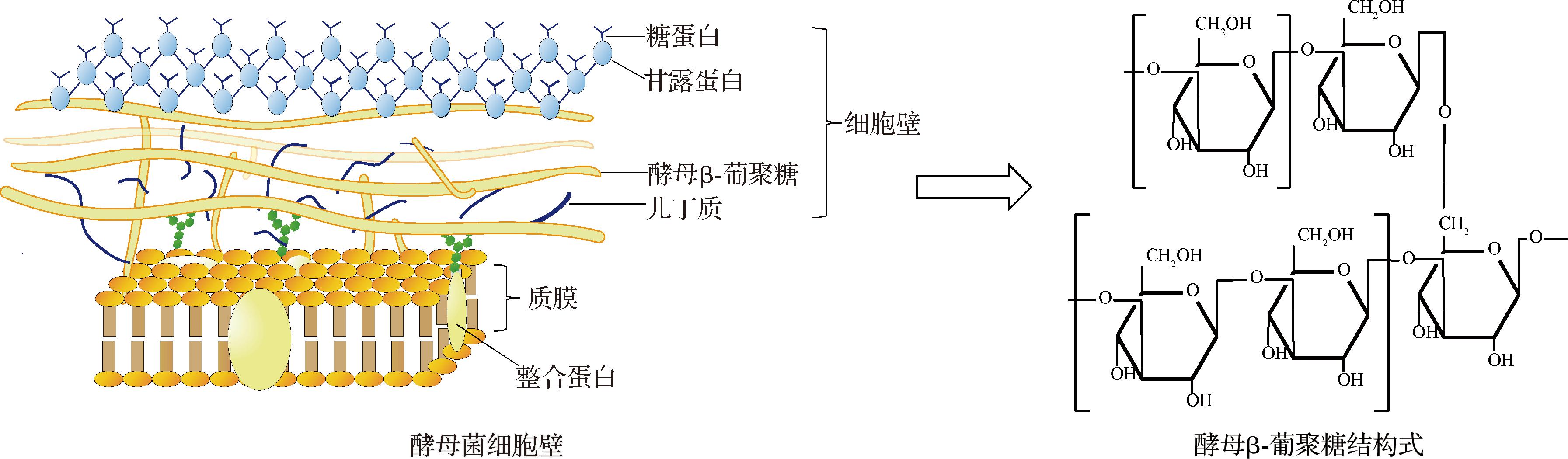
图1 酵母β-葡聚糖的来源与结构
Fig.1 Source and structure of yeast β-glucan
2 酵母β-葡聚糖的改性增溶
酵母β-葡聚糖改性是指通过一系列化学、物理或生物手段对其进行结构修饰或改变,以改善其可溶解性或生物活性。目前已发展出多种改性增溶方法,包括物理改性、化学改性和生物改性等。酵母β-葡聚糖不同改性方式的优缺点如表1所示。
表1 酵母β-葡聚糖不同改性方式的优缺点
Table 1 Advantages and disadvantages of different modification methods of yeast β-glucan

改性方法作用方式作用机制优点缺点参考文献物理法辐照电子射线在高压电场中辐照酵母β-葡聚糖,断裂β-1,3糖苷键无添加物、成本低、无污染反应条件与装置要求高、降解程度不易控制[6]热降解酵母β-葡聚糖受热大分子降解为小分子,溶解度增加方法简便所需温度高、时间长[14]高压微射流高压将酵母β-葡聚糖溶液泵入反应腔内形成微流,在多种力作用下打断酵母β-葡聚糖分子链耗时短、增溶效果强处理能力有限、操作复杂[15]超声声空化过程产生高能剪切力,瞬时高温高压破坏分子键操作简单、能耗低、绿色无污染缺乏改性后对人体健康影响的研究[16]化学法碱法羧甲基化硫酸酯化磷酸酯化强碱打断酵母-葡聚糖分子之间的氢键糖残基单元上羟基的氢被羧甲基基团取代磺化反应将亲水性的硫酸根基团引入酵母β-葡聚糖向酵母β-葡聚糖中引入磷酸基团工艺简单、改性效果优良增加溶解度、改性后酵母-葡聚糖生物活性提高降解过程难控、反应剧烈且易残留耗时长、产量低、化学试剂残留[17][18][19][20]生物法酶法酶促反应降解酵母β-葡聚糖作用手段温和无化学污染耗时长、产量低、成本高[21]
2.1 物理改性
物理改性是一种在不损害酵母β-葡聚糖基本分子结构的前提下,通过施加外界作用力提供额外能量来解聚大分子主链的精细技术。随着力的持续作用,葡聚糖大分子的化学键或分子间作用力逐渐被削弱,分子链开始断裂,这种断裂逐渐积累,最终导致葡聚糖大分子被有效地解聚成分子质量较低的片段,进而提升了葡聚糖的溶解性。物理改性解聚酵母β-葡聚糖的技术主要包括热降解、辐照以及高压微射流等方法。这些技术的优势在于能够在不破坏酵母β-葡聚糖基本结构的前提下进行改性,确保处理过程高效、环保且无化学残留。尽管物理方法具有上述优势,但在改性酵母β-葡聚糖时,常常面临水溶性酵母β-葡聚糖得率较低和改性效果不稳定等挑战。
2.1.1 热降解法
热降解法通过长时间加热提供足够能量使酵母β-葡聚糖逐步降解为小分子。因此,通过精确控制温度与热降解时间,能够获得分子质量不同的酵母β-葡聚糖,从而达到改性增溶的目的。ISHIMOTO等[22]的研究表明,在100、121、135 ℃的温度下处理酵母β-葡聚糖悬液时,135 ℃条件下的热降解对增溶效果提升最为显著,在该温度下处理1 h后,酵母β-葡聚糖出现明显溶胀现象,且随着时间的延长,可溶性酵母β-葡聚糖含量逐渐增加,经12 h后上清液中的可溶性葡聚糖含量高达89.80%。热降解法不仅操作简单且无化学残留,还提升了产品的溶解性并保留了其生物活性,为酵母β-葡聚糖在食品工业中的广泛应用提供了有力支持。
2.1.2 辐照法
辐照技术主要包括γ射线辐照和电子束辐照2种形式。β射线作用于物质时,主要产生光电效应、康谱顿效应和电子对效应,而电子束则是通过高密度电子流引发束缚电子吸收能量,进而在原子系统中触发能级跃迁,产生电磁辐射,并通过弹性碰撞和非弹性碰撞与物质进行相互作用[23]。在辐照条件下,酵母β-葡聚糖主链上的β-1,3糖苷键会发生断裂,导致分子质量下降,但这一降解过程的独特之处在于,它并不会破坏酵母β-葡聚糖分子的功能性官能团。刘媛媛[24]的研究表明,在不同辐照剂量(5~20 kGy)的60Coγ射线作用下,酵母β-葡聚糖的分子质量、粒径和黏度均呈下降趋势,而溶解度显著提高。红外光谱分析结果显示,其化学键与官能团结构保持稳定。在20 kGy辐照条件下,酵母β-葡聚糖溶解度从(5±0.34)%提高至(32.46±0.26)%,平均粒径从69.52 μm降低至55.58 μm;随着辐照剂量从5 kGy增加到10 kGy,溶液的表观黏度从5.52 Pa·s降低至1.51 Pa·s。LONG等[25]通过Co-60辐照器以3 kGy/h的剂量率对酵母β-葡聚糖进行β射线辐照,在pH值9、辐照剂量为50 kGy的条件下β-葡聚糖的分子质量降至约25 kDa,剂量为100 kGy时溶液中可溶性β-葡聚糖含量达到86.30%,动物实验进一步证实,分子质量约为25 kDa的酵母β-葡聚糖在降低胆固醇和葡萄糖水平方面效果显著,这为葡聚糖在降血脂和稳定血糖水平方面的应用提供了有力支持。此外,乜世成[26]利用高能电子直线加速器产生剂量为50~600 kGy的电子束对裸藻β-葡聚糖进行降解处理。研究发现,随着辐照吸收剂量的增加,裸藻β-葡聚糖的溶解分数也相应增加。在600 kGy辐照剂量下,裸藻β-葡聚糖的溶解度达到68.01%。LI等[27]则深入探讨了电子束辐照对葡聚糖结构的影响,发现溶解度的增加与电子束辐照引发的糖苷键的断裂和螺旋结构的解离密切相关。这些研究不仅揭示了辐照法在显著提升葡聚糖溶解度方面的卓越能力,也进一步深化了研究者对辐照诱导葡聚糖降解机制的理解,同时为葡聚糖在医药和保健领域的应用提供了新的思路。
2.1.3 高压微射流(high pressure microfluidization,HPM)技术
HPM是一种利用超高压(310 MPa)迫使高压气体或液体通过极小孔径的微型喷嘴,产生微射气流或液微射流的创新技术。在此技术的作用下,聚集的酵母β-葡聚糖得以打散,其分子链断裂,结构发生显著变化。HPM技术常与离子液体1-乙基-3-甲基咪唑乙酸盐(1-ethyl-3-methylimidazole acetate,EmimAc)结合使用,这种离子液体的阳离子环上的氢质子与酵母β-葡聚糖上的羟基形成氢键,有效破坏了酵母β-葡聚糖分子间与分子内的氢键作用力。同时,HPM技术还能破坏酵母β-葡聚糖天然的三螺旋构象,降低其分子质量,从而提高β-葡聚糖水溶性[15]。LIU等[28]采用离子液体EmimAc结合HPM对酵母β-葡聚糖进行改性增溶,经过改性的酵母β-葡聚糖溶解度达到(85.01±0.75)%。白文强[29]研究发现,经EmimAc-HPM处理的酵母β-葡聚糖解聚为无规则链状结构,但分子间仍以β-1,3糖苷键相连。因此,HPM技术为提高酵母β-葡聚糖溶解度提供了一种有效且可持续的改性方法,展现了其在生物工程和食品科学领域的巨大潜力。
2.1.4 超声波法
超声波法改性的原理是其声空化过程能够松动酵母β-葡聚糖聚集结构,导致葡聚糖苷键的断裂,进而提高溶解度。HUANG等[30]的研究进一步证实了超声波技术在改性方面的潜力。其通过超声波技术对明串珠菌中的(1→3)(1→6)-α-D-葡聚糖进行改性,以20 kHz频率、190 W功率超声处理葡聚糖溶液5~160 min。结果显示,在超声处理的前20 min内,改性后的葡聚糖溶液吸光度OD220值从2.4大幅下降至0.82,并在160 min后逐渐降至平台值0.31。与吸光度下降趋势相似,前20 min内,葡聚糖分子质量Mw从2.25×107 g/mol急剧下降至3.15×105 g/mol,符合随机断裂模型;同时,葡聚糖溶液的黏度显著下降,可溶性葡聚糖含量达到30 g/100 mL。CHEUNG等[31]使用超声波处理不溶的线性β-1,3葡聚糖,发现随着超声功率(10.6、34.3、48.4 W/cm2)的增加和时间(2~60 min)的延长,葡聚糖溶液的黏度和分子质量逐渐降低。在超声波功率48.4 W/cm2、处理时间60 min的条件下,葡聚糖的黏度降低了约90%,分子质量(Mw)从1.65×105 g/mol降低至1.65×104 g/mol。鉴于超声波技术的高效性、环保性以及操作的可控性,其在食品工业中具有极为广阔的应用前景,为多糖改性领域带来了新的可能性。
2.2 化学改性
化学改性可以通过精确调控葡聚糖的官能团来改善其生物活性,显著提升其溶解度。目前常用的化学改性方法包括硫酸酯化、磷酸酯化和羧甲基化等,这些方法不仅操作简单,而且改性效果显著。这些方法通过引入新的亲水基团,显著提升了酵母β-葡聚糖的溶解度,同时赋予其更好的生物活性。例如,磷酸化改性后的酵母β-葡聚糖,不仅水溶性显著提升,还展现出更优异的免疫活性[32]。
然而,化学改性方法虽具较大潜力,其局限性同样不容忽视。一方面,剧烈的处理过程可能对葡聚糖的原始结构造成较大影响,并容易造成化学残留;另一方面,部分改性技术伴随着高昂的成本投入与对特殊设备的依赖,为实际应用带来了一定挑战。
2.2.1 羧甲基化
羧甲基酵母β-葡聚糖的制备通常以氯乙酸为底物,在碱性环境中糖残基单元上羟基的H原子被-CH2COOH基团取代从而得到羧甲基葡聚糖,羧甲基化修饰使酵母β-葡聚糖在溶液中的构象由最初的稠密无规则线团链转变为伸展的柔顺链构象。ZHOU等[18]在碱性条件下对酵母β-葡聚糖进行羧甲基化改性,以50 mL异丙醇为溶剂溶解酵母β-葡聚糖,向反应体系中加入5 mL 30%氢氧化钠溶液和氯乙酸,使酵母β-葡聚糖和氯乙酸的摩尔比为4∶3。在60 ℃下搅拌5 h后,将所得粗产物进行洗涤透析,冷冻干燥后制得羧甲基化酵母β-葡聚糖。改性后的羧甲基化酵母β-葡聚糖易溶于水,展现出良好的吸附与吸湿能力,其孔隙率高达90%。吸水后,葡聚糖海绵能够在20 s内迅速膨胀至280%。这使其在促进创口愈合功能的药物中具有潜在应用价值。MEILING等[33]通过表没食子儿茶素没食子酸酯与二甲基亚砜中的葡聚糖溶液偶联,制得钠羧甲基化酵母β-葡聚糖。改性后的酵母β-葡聚糖衍生物接枝率达到100.25 mg/g,该衍生物易溶于水,且具有更高的自由基清除能力和稳定的颜色。这些特性为葡聚糖在药物和保健品领域的应用提供了可能性。
2.2.2 硫酸酯化
硫酸酯化是指使硫酸等含硫试剂与酵母β-葡聚糖在特定的反应体系中进行磺化反应,从而将亲水性的硫酸根基团引入酵母β-葡聚糖中。ZHANG等[34]选取氯磺酸与二甲基乙酰胺为酯化剂制备硫酸化改性酵母β-葡聚糖,研究结果表明,在氯磺酸与二甲基乙酰胺配比为1∶5.9,49.5 ℃搅拌2.4 h的条件下,酯化后的酵母β-葡聚糖不仅溶解度显著提高到2.15 g/100 g,平均分子质量从8.51×106 Da降低到1.29×106 Da。此外,胃内注射硫酸化酵母β-葡聚糖后,小鼠脾脏中的过氧化氢酶活力从(17±3) U/mL增加到(26±1) U/mL,超氧化物歧化酶活力从(84±4) U/mL增加到(117±6) U/mL,这些结果均表明硫酸化酵母β-葡聚糖能够有效预防辐射引起的氧化损伤。
2.2.3 磷酸酯化
磷酸酯化是指向酵母β-葡聚糖引入磷酸基团的改性方法,常见的磷酸酯化试剂包括磷酰氯、磷酸酐、磷酸及磷酸盐等。DU等[35]以含尿素的二甲基亚砜为溶剂对酵母β-葡聚糖进行磷酸化改性,在H3PO4与DMSO添加量为1∶4,100 ℃反应5 h的条件下,制得的磷酸化酵母β-葡聚糖溶解度达到85%以上。将200 mg/kg的磷酸酯化产物注射到小鼠前腹腔中,24 h后注射大肠埃希氏菌进行攻毒。与空白对照组相比,小鼠的存活率由0%提高至80%,表明磷酸化的酵母β-葡聚糖具有更优异的免疫活性。
2.3 生物改性
生物改性法是一种利用特定酶降解酵母β-葡聚糖的技术,又称酶法改性。这种方法通过调控酶的作用条件,如温度、pH值和酶浓度,来实现对酵母β-葡聚糖分子结构的改变。在对酵母β-葡聚糖进行酶解改性时,通常使用β-1,3葡聚糖内切酶来断裂酵母β-葡聚糖的糖苷键,从而降低其聚合度,同时不改变分子结构[36]。生物改性法作用条件温和,避免了极端物理或化学处理可能带来的不良影响。通过使用单一酶或复合酶,可以实现不同的改性效果,满足不同应用场景的需求。相较于物理和化学改性方法,生物改性具有更强的特异性,反应条件也更为温和。但生物改性中的酶催化过程常常面临稳定性差的问题,原因在于酶的空间结构相对柔性,容易因环境条件变化而失活,这在一定程度上影响了酶水解酵母β-葡聚糖的效果。
2.3.1 单一酶改性
单一酶改性是利用特定酶类对酵母β-葡聚糖进行精确调控的方法。ZHEN等[37]的研究表明β-1,3-葡聚糖酶能够随机切断酵母β-葡聚糖使其降解为糊精或者寡聚糖。KATSUKI等[38]的研究报道了哈茨木霉来源的溶壁酶可将酵母β-葡聚糖彻底水解为可溶的葡萄糖。段会轲等[39]利用木霉菌株LE02产的β-1,3-葡聚糖酶对酵母β-1,3-葡聚糖进行酶解增溶,发现在最佳酶解条件下多糖得率为57.08%,这与范红梅[40]报道的酶解酵母β-葡聚糖后葡聚糖溶解度达40%以及张学况等[41]使用专一性β-1,3-葡聚糖酶得到的可溶性葡聚糖得率为51.9%的结论相近,体现了酶解技术在提高酵母β-葡聚糖溶解度方面的潜力。然而,目前通过单一酶改性生产水溶性酵母β-葡聚糖的得率较低,这严重限制了酵母β-葡聚糖的工业化生产和商业化应用,因此,开发具有热稳定性、高pH耐受性以及高酶活力的β-葡聚糖酶是单一酶改性技术的关键突破点。
2.3.2 复合酶改性
除了使用单一酶改性外,复合酶协同改性也成为研究的热点。蜗牛酶是由纤维素酶、半纤维酶、果胶酶等40多种酶组成的混合酶[42],在酵母β-葡聚糖改性中展现出显著效果。张漫莉等[43]使用蜗牛酶降解酵母β-葡聚糖,在酶添加量4.3%、温度45 ℃、时间83 min、β-葡聚糖质量浓度15 mg/mL的条件下,酵母β-葡聚糖的溶解度从不溶增加至89.74%,且改性后的酵母β-葡聚糖分子质量降低,热稳定性显著增加。王国军[44]的研究显示,在pH值5.5、温度50 ℃的条件下,添加量为5%的葡聚糖酶和碱性蛋白酶先后酶解酵母β-葡聚糖12 h,收集到的酶解上清液经过喷雾干燥后所得酵母β-葡聚糖可100%溶于水。由此可知,复合酶降解酵母β-葡聚糖是提高酵母β-葡聚糖溶解性较为理想的方法。然而,目前国内外对酵母β-葡聚糖生物改性研究主要集中于单一的酶解工艺,对酶解机制和酶解程度精确可控技术鲜有研究。因此,可控酶解技术以及复合酶解技术将成为酵母β-葡聚糖生物改性领域的新趋势。
2.4 协同改性
除了使用单一改性策略外,研究人员正在积极钻研多种改性手段的综合效应在酵母β-葡聚糖改性中的应用。研究表明,相较于单一作用方式,协同改性技术能够更显著地提升葡聚糖的溶解性能[45]。目前广泛应用的协同改性技术涵盖了物理-生物法、物理-化学法、生物-化学法等多样化的组合,如超声协同酶解、超声协同过氧化氢、碱法辅助酶解等已普遍用于各类多糖改性中。尽管这些协同方法已初见成效,然而,如何确定最优化的改性组合方案,以实现改性效果的最大化协同增效,依然是该领域未来探究的核心议题。
2.4.1 超声协同酶法
超声协同酶法可将复杂的聚合物结构转变为更简化的分支和更短链的单元。超声波可使聚合物解聚,所得的分散结构更易与酶结合。因此,超声-酶解联用可显著提升酶与底物的亲和力,从而加速聚合物的酶解进程。当前文献广泛报道了超声-酶解联合技术在提取多糖[46]、蛋白[47]、多酚[48]等领域的应用。这些研究为超声协同酶解改性酵母β-葡聚糖开辟了新路径。袁洪洁[49]利用超声波协同葡聚糖酶改性产朊假丝酵母β-葡聚糖,该研究采用2%的木瓜蛋白酶和2%的中性蛋白酶进行复合酶解,随后在超声功率18 W/mL,温度30 ℃,时间20 min的条件下处理酶解产物。结果显示,得到的改性产物溶解度高达75.35%,改性后的酵母β-葡聚糖的三螺旋结构遭到破坏,分子质量减小,颗粒形态更为分散稀疏,其结构变化和降解程度直接受超声功率和酶浓度等因素调控。郑赵敏[50]的研究同样证实,超声与酶的双重干预能有效疏松酵母β-葡聚糖的聚集结构,表面积增加,粒径缩小,协同处理下的产物溶解性显著优于单一处理方式。物理与生物法的作用并不是独立的,这2种方式的有效结合在酵母β-葡聚糖的绿色改性增溶技术发展中展现出广阔前景。
2.4.2 超声协同过氧化氢法
超声协同过氧化氢法改性增溶的机理在于超声波加剧了H2O2的氧化分解,产生大量的羟自由基,有效裂解多糖的糖苷键。XIU等[51]通过此法降解甜玉米芯多糖,成功制备了高溶解性、低分子质量的多糖,且改性后的多糖通过显著调节脂质代谢和增加肝糖原储备促进胰岛素分泌,降低血糖水平,该改性产物表现出较好的对抗Ⅱ型糖尿病的生物活性。董琳[52]以产朊假丝酵母β-葡聚糖为原料,采用超声波辅助过氧化氢法进行增溶改性,在超声功率为3 W/mL、H2O2浓度为24%、反应时间为4 h的条件下,酵母β-葡聚糖的溶解度达到70%,相比改性前的葡聚糖溶解度提高了56.40%,并观察到改性后酵母β-葡聚糖颗粒尺寸变小而一级结构保持完整,同时其体外抗氧化活性、降血糖活性均显著增强。这些研究揭示了超声协同过氧化氢法在提升多糖溶解性与生物活性方面的巨大潜力,为进一步开发高效、多功能的多糖衍生物提供了科学依据与技术支撑。
2.4.3 碱协同酶法
碱协同酶法的作用机理是碱可渗透到酵母β-葡聚糖颗粒深处,通过切割酵母β-葡聚糖链内部的键,从而使聚合体分解成小分子片段。此过程与超声协同酶法的作用机制相似,均通过疏松酵母β-葡聚糖的紧密结构、增加表面积来促进酶解作用。ZHENG等[53]使用碱协同酶法处理酵母β-葡聚糖,通过2 mol/L NaOH溶液在4 ℃下处理不溶的葡聚糖12 h后,以最佳工艺条件:底物质量浓度0.25 mg/mL,温度50 ℃,pH值5.0,酶添加量60.5 FBG/g,时间1.5 h处理后,葡聚糖粒径从8.80 μm减小到7.19 μm,可溶性酵母β-葡聚糖的得率达到(36.2±0.3)%。酶解效率的提升归因于碱预处理后所得的分散片状结构优化了酶与底物的接触界面。HORAGUCHI等[54]采用相同策略处理不溶的葡聚糖,成功制备出粒径小、分子质量较低的水溶性产物。尽管碱辅助酶解在提升改性效率方面展现出显著成效,但其可能残留的有机化学试剂问题限制了该技术在工业化生产改性酵母β-葡聚糖上的广泛应用。鉴于此,超声辅助酶解作为一种更清洁环保的替代方案,可能是改性酵母β-葡聚糖工业化生产的更优选择。
3 酵母β-葡聚糖的应用进展
3.1 酵母β-葡聚糖在医药领域的应用
大量的实验室研究和临床试验已证明酵母β-葡聚糖具有多种促进健康的生物活性,如增强免疫调节、减轻炎症反应、促进肠道健康等。从增强人体自然防御机制到辅助治疗慢性疾病,酵母β-葡聚糖正逐步成为提升人类健康的重要天然资源,其在药物研发、免疫疗法等方面的应用前景备受瞩目。
3.1.1 调节免疫与抗肿瘤活性
酵母β-葡聚糖已被证实能够显著增强巨噬细胞的吞噬能力,增加细胞因子的分泌,从而调节全身细胞免疫。VUSCAN等[55]发现,酵母β-葡聚糖能在人单核细胞中诱发一种称为“训练免疫”的状态,使机体在受到继发性非特异性攻击后,能够产生有效的先天性防御反应。酵母β-葡聚糖的这种生物学效应得益于它可与Dectin-1、CR3等关键受体特异性结合,共同激活多条信号通路,最终实现机体免疫应答的全局调控。HORNECK JOHNSTON等[11]的动物模型研究进一步证实了酵母β-葡聚糖作为免疫激活剂的角色,其发现酵母β-葡聚糖不仅能促进骨髓中免疫细胞的生成,还能有效激活巨噬细胞。近期的研究发现改性增溶后的酵母β-葡聚糖具有独特的结构特征,不仅可以激活先天免疫,还有望作为药物/抗原递送载体和免疫佐剂[56]。酵母β-葡聚糖的潜在抗癌机制则可能是通过免疫应答促进免疫细胞积聚于肿瘤细胞,利用体内P53信号传导途径抑制或控制癌细胞的增殖。β-葡聚糖的分子质量、溶解度、结构构象等都会影响其对机体的免疫调节和抗肿瘤功效。YOON等[57]研究发现,来自突变酿酒酵母的β-葡聚糖IS-2可通过免疫刺激作用显著抑制黑色素瘤B16-BL6细胞和结肠癌26-M3.1细胞的增殖与转移。同时,酵母β-葡聚糖还可使机体产生大量活性氧诱导宫颈癌细胞DNA断裂,并对线粒体膜电位进行破坏,从而促进宫颈癌细胞凋亡[58]。
3.1.2 抗炎
持续的炎症反应会引起多种疾病,减少炎症介质对于控制机体炎症至关重要,酵母β-葡聚糖可抑制炎症介质的表达。NO等[59]发现球磨法制备的低分子质量酵母β-葡聚糖具有显著的抗炎效果。QIAO等[60]也证实酵母β-葡聚糖通过抑制氧化应激和炎症介质的分泌来改善结肠炎小鼠的炎症症状。XU等[61]使用酵母β-葡聚糖处理阿尔茨海默病小鼠,发现其可以抑制神经炎症和改善脑胰岛素抵抗,从而干预阿尔茨海默病的发展。
3.1.3 促进肠道健康
酵母β-葡聚糖无法在口腔、胃部和小肠中消化,但可以在大肠中被人体肠道微生物群代谢,产生短链脂肪酸从而调节肠道健康。GOLISCH等[62]发现酵母β-葡聚糖代谢可产生丙酸、丁酸等短链脂肪酸,这些短链脂肪酸对于维持肠道屏障的健康至关重要。WANG等[63]也报道称酵母β-葡聚糖可通过抑制肠道有害菌群的增殖,促进有益菌群的生长来调节菌群结构和组成。MO等[64]的研究揭示了酵母β-葡聚糖具有恢复肠道菌群失调的功能,其通过促进短链脂肪酸与脂多糖生成,减少氧化应激,从而降低结肠炎风险并预防肥胖。
3.2 酵母β-葡聚糖在食品领域的应用
酵母β-葡聚糖在食品领域具有积极的发展应用潜力,如用作增稠剂、乳化剂、食品营养强化剂等。酵母β-葡聚糖的添加会影响食品的质构特性、感官特性和保质期,如何赋予酵母β-葡聚糖与食品基质的高相容性从而有效提升其生物利用度,已成为酵母β-葡聚糖应用于食品领域所面临的重大挑战。
3.2.1 在功能性食品中的应用
酵母β-葡聚糖具有与菊粉相似的益生元活性,可作为膳食补充剂应用于食品中。摄入添加酵母β-葡聚糖的食品后,胃排空的速度会减慢,从而起到减少人体能量摄入降低胆固醇的作用。CARUSO等[5]通过在早餐麦片和蛋白棒中创新性地加入酵母β-葡聚糖,成功地为其增添了功能性食品的属性,丰富了产品的健康效益。VIOLA等[65]的研究揭示了在面包、酸奶及肉制品制造过程中加入酵母β-葡聚糖的多方面益处,不仅显著增加了食品的总膳食纤维含量,优化了乳化特性和保水性能,还有效维护了产品的结构稳定性,提升了其抗氧化能力,展现出酵母β-葡聚糖作为功能性配料在提升食品品质与健康价值方面的广阔应用前景。
3.2.2 在烘焙食品中的应用
在烘焙食品中,添加酵母β-葡聚糖不仅能丰富产品的营养成分,还有延长保质期等作用。ZBIKOWSKA等[66]的研究表明,酥饼中加入酵母β-葡聚糖可以增加膳食纤维含量、减少热量及饱和脂肪酸含量。BACHA等[67]发现2%添加量的酵母β-葡聚糖对小麦饼干理化与感官特性无显著影响,但酵母β-葡聚糖的添加增强了产品的抗氧化性,从而延长了保质期。
3.2.3 在乳制品中的应用
酵母β-葡聚糖在酸性条件下稳定,具有增稠、乳化等功能。AL-SAHLANY等[68]在酸奶中加入酵母β-葡聚糖,制备的乳制品酸度增加,乳清分离度降低,具有良好的感官特性。RAIKOS等[69]发现含酵母β-葡聚糖的酸奶比不含酵母β-葡聚糖的酸奶具有更短的发酵时间,能够显著降低酸奶工业化成本。
3.2.4 在肉制品中的应用
酵母β-葡聚糖具有较好的持水性,添加在肉制品中可改善感官风味。APOSTU等[70]在肉糜中添加酵母β-葡聚糖,该研究表明在1.5%的添加量下酵母β-葡聚糖束水能力和乳化能力较强,且葡聚糖的添加降低了肉制品中的氯化钠和多磷酸盐含量,该实验为酵母β-葡聚糖作为食盐替代物的应用奠定理论基础。
3.3 酵母β-葡聚糖在化妆品领域的运用
酵母β-葡聚糖因其显著的保湿和抗氧化等作用而成为化妆品领域的研究热点。人体皮肤除了内源性老化外,还易遭受外界紫外线带来的氧化应激伤害,经过羧甲基化修饰后具有抗氧化能力。酵母β-葡聚糖可用于预防和缓解氧化应激引起的皮肤老化和色素沉着等皮肤问题[71],同时还具有保湿、舒缓抗皱等功效,能够有效缓解皮肤干燥问题,可作为保湿功效成分添加在化妆品中。酵母β-葡聚糖可以深入真皮层和表皮,与皮肤细胞相互作用,从而减少皱纹的产生,提高皮肤弹性。SOUSA等[72]发现添加量为20 μg/mL的酵母β-葡聚糖可使细胞迁移和皮肤收缩,从而促进皮肤修复。ZHU等[73]通过动物实验对一款添加酵母β-葡聚糖的保湿喷雾进行评价,发现使用该喷雾可有效降低小鼠的抓挠次数,表明酵母β-葡聚糖可以缓解皮肤干燥引起的瘙痒,改善受损皮肤的屏障功能,减轻局部皮肤的炎症状态。在化妆品实际生产中,通过改性增溶使酵母β-葡聚糖发挥更加稳定有效的作用是酵母β-葡聚糖化妆品应用的发展方向。
4 总结与展望
综上,本文分析了酵母β-葡聚糖因独特结构而导致的低溶解性问题,并详尽探讨了国内外在酵母β-葡聚糖改性增溶方面的多种策略及其在各领域的应用进展。我国酵母资源十分丰富,基于现有的提取纯化工艺,通过改性增溶技术制备的酵母β-葡聚糖展现出极大的应用潜力和市场价值。然而,当前酵母β-葡聚糖的改性增溶研究与应用仍面临着对其结构与功能之间的构效关系不清晰、高效改性技术缺失以及技术规模化应用滞后等瓶颈问题。此外,制定酵母β-葡聚糖在不同领域的应用标准及功效评估体系也是未来亟需解决的重要课题。随着新技术的不断涌现以及人们对新方法的持续探索,深入剖析酵母β-葡聚糖低溶解性的机理,开发更加多样化、高效的改性增溶技术,特别是通过多技术协同的方式对酵母β-葡聚糖进行深度改性,将成为推动该领域发展的关键路径。开发酵母β-葡聚糖高效改性工艺不仅能拓宽其应用边界,也将为其在医药、食品、化妆品等行业的高效利用提供坚实的科学基础与技术支撑。
[1] YUAN H J, LAN P, HE Y, et al.Effect of the modifications on the physicochemical and biological properties of β-glucan-a critical review[J].Molecules, 2019, 25(1):57.
[2] ROSS P, FARRELL M P.The road to structurally defined β-glucans[J].Chemical Record, 2021, 21(11):3178-3193.
[3] WOUK J, DEKKER R F H, QUEIROZ E A I F, et al.β-Glucans as a Panacea for a healthy heart? Their roles in preventing and treating cardiovascular diseases[J].International Journal of Biological Macromolecules, 2021, 177:176-203.
[4] BAI J Y, REN Y K, LI Y, et al.Physiological functionalities and mechanisms of β-glucans[J].Trends in Food Science &Technology, 2019, 88:57-66.
[5] CARUSO M A, PIERMARIA J A, ABRAHAM A G, et al.β-glucans obtained from beer spent yeasts as functional food grade additive:Focus on biological activity[J].Food Hydrocolloids, 2022, 133:107963.
[6] ZHENG Z M, HUANG Q L.New insight into the structure-dependent two-way immunomodulatory effects of water-soluble yeast β-glucan in macrophages[J].Carbohydrate Polymers, 2022, 291:119569.
[7] ZHENG Z M, HUANG Q L, KANG Y, et al.Different molecular sizes and chain conformations of water-soluble yeast β-glucan fractions and their interactions with receptor Dectin-1[J].Carbohydrate Polymers, 2021, 273:118568.
[8] XIN Y J, JI H, CHO E, et al.Immune-enhancing effect of water-soluble beta-glucan derived from enzymatic hydrolysis of yeast glucan[J].Biochemistry and Biophysics Reports, 2022, 30:101256.
[9] LIU J J, HOU Y K, WANG X, et al.Recent advances in the biosynthesis of fungal glucan structural diversity[J].Carbohydrate Polymers, 2024, 329:121782.
[10] MAGNELLI P, CIPOLLO J F, ABEIJON C.A refined method for the determination of Saccharomyces cerevisiae cell wall composition and β-1, 6-glucan fine structure[J].Analytical Biochemistry, 2002, 301(1):136-150.
[11] HORNECK JOHNSTON C J H, LEDWITH A E, LUNDAHL M L E, et al.Recognition of yeast β-glucan particles triggers immunometabolic signaling required for trained immunity[J].iScience, 2024, 27(3):109030.
[12] 骆莹. 酵母细胞去除猕猴桃果汁中展青霉素的机理研究及磁性吸附剂的制备[D].杨凌:西北农林科技大学, 2016.LUO Y.Patulin absorption mechanism study on yeast cells from kiwi fruit juice and magnetic adsorbents preparation[D].Yangling:Northwest A &F University, 2016.
[13] 韩瑨, 吴正钧, 高彩霞, 等.功能性多糖饮料的研究进展[J].食品研究与开发, 2015, 36(8):115-119.HAN J, WU Z J, GAO C X, et al.Progress in the research and development of functional polysaccharide beverages[J].Food Research and Development, 2015, 36(8):115-119.
[14] WANG D M, KIM D H, YOON J J, et al.Production of high-value β-1, 3-glucooligosaccharides by microwave-assisted hydrothermal hydrolysis of curdlan[J].Process Biochemistry, 2017, 52:233-237.
[15] HUANG X Y, LI C Y, XI J.Dynamic high pressure microfluidization-assisted extraction of plant active ingredients:A novel approach[J].Critical reviews in food science and nutrition, 2022, 63(33):12413-12421.
[16] WANG Y J, XIONG X, HUANG G L.Ultrasound-assisted extraction and analysis of maidenhairtree polysaccharides[J].Ultrasonics Sonochemistry, 2023, 95:106395.
[17] LEE H N, LIM H J, PARK J Y, et al.Effect of modification methods on the physical properties and immunomodulatory activity of particulate β-glucan[J].Food Science and Biotechnology, 2024, 33(7):1615-1621.
[18] ZHOU Z B, XIAO J W, HUANG S, et al.A wet-adhesive carboxymethylated yeast β-glucan sponge with radical scavenging, bacteriostasis and anti-inflammatory functions for rapid hemostasis[J].International Journal of Biological Macromolecules, 2023, 230:123158.
[19] ZHANG Q Y, XIE J, XUE B, et al.Effect of sulfated modification on rheological and physiological properties of oat β-glucan oligosaccharides prepared by acid or oxidative degradation[J].Journal of Cereal Science, 2021, 99:103209.
[20] 郭欢. 青稞β-葡聚糖的提取分离、结构表征、化学修饰及其生物活性研究[D].雅安:四川农业大学, 2020.GUO H.Extraction, isolation, structural characterization chemical modification, and biological activities of Qingke (Hordeum vulgare L.) β-glucans[D].Ya′an:Sichuan Agricultural University, 2020.
[21] 王亚静. 酵母β-葡聚糖改性及其定量检测方法研究[D].北京:北京化工大学, 2020.WANG Y J.Study on modification of yeast β-glucan and its quantitative detection method[D].Beijing:Beijing University of Chemical Technology, 2020.
[22] ISHIMOTO Y, ISHIBASHI K I, YAMANAKA D, et al.Modulation of an innate immune response by soluble yeast β-glucan prepared by a heat degradation method[J].International Journal of Biological Macromolecules, 2017, 104:367-376.
[23] 陈亮, 武小芬, 齐慧, 等.电子束辐照对不同含水量芦苇木质纤维素结构及酶解性能的影响[J].辐射研究与辐射工艺学报, 2023, 41(2):76-85.CHEN L, WU X F, QI H, et al.Effects of electron beam irradiation pretreatment on the structure and enzymatic efficiency of Phragmites australis lignocelluloses with different moisture contents[J].Journal of Radiation Research and Radiation Processing, 2023, 41(2):76-85.
[24] 刘媛媛. 酵母细胞壁多糖制备及流变学性质研究[D].北京:中国农业科学院, 2010.LIU Y Y.Study on preparation of cell wall polysaccharide from Saccharomyces cerevisiae and its rheological properties[D].Beijing:Chinese Academy of Agricultural Sciences, 2010.
[25] LONG N T, ANH N T N, GIANG B L, et al.Radiation degradation of β-glucan with a potential for reduction of lipids and glucose in the blood of mice[J].Polymers, 2019, 11(6):955.
[26] 乜世成. 辐照降解裸藻β-葡聚糖及其产物的抗氧化活性研究[D].西宁:青海师范大学, 2022.MEI S C.Degradation of euglena β-glucan by electron beam irradiation and antioxidant activity[D].Xining:Qinghai Normal University, 2022.
[27] LI H T, ZHANG W Y, CHEN Y Y, et al.Physical modification of high amylose starch using electron beam irradiation and heat moisture treatment:The effect on multi-scale structure and in vitro digestibility[J].Food Chemistry, 2023, 424:136344.
[28] LIU H Z, BAI W Q, HE L, et al.Degradation mechanism of Saccharomyces cerevisiae β-D-glucan by ionic liquid and dynamic high pressure microfluidization[J].Carbohydrate Polymers, 2020, 241:116123.
[29] 白文强. 基于离子液体与微射流协同作用的酵母β-葡聚糖增溶机制研究[D].北京:中国农业科学院, 2019.BAI W Q.Dissolution mechanisms of yeast β-glucan modified by the ionic liquid combined with high pressure microfluidization[D].Beijing:Chinese Academy of Agricultural Sciences, 2019.
[30] HUANG C, MIAO M, JIANG B, et al.Polysaccharides modification through green technology:Role of ultrasonication towards improving physicochemical properties of (1-3)(1-6)-α-D-glucans[J].Food Hydrocolloids, 2015, 50:166-173.
[31] CHEUNG Y C, YIN J Y, WU J Y.Effect of polysaccharide chain conformation on ultrasonic degradation of curdlan in alkaline solution[J].Carbohydrate Polymers, 2018, 195:298-302.
[32] HUANG S Y, CHEN F, CHENG H, et al.Modification and application of polysaccharide from traditional Chinese medicine such as Dendrobium officinale[J].International Journal of Biological Macromolecules, 2020, 157:385-393.
[33] MEILING C, TIANCHEN J, JIANQUAN H, et al.Functionalization of sodium carboxymethylated yeast β-glucan by epigallocatechin gallate:Antioxidant activity and color stability[J].Journal of the Chinese Chemical Society, 2021,68(8):1413-1422.
[34] ZHANG H, ZHANG J, FAN Z L, et al.Chemical synthesis of sulfated yeast (Saccharomyces cerevisiae) glucans and their in vivo antioxidant activity[J].Molecules, 2017, 22(8):1266.
[35] DU L P, ZHANG X K, WANG C, et al.Preparation of water soluble yeast glucan by four kinds of solubilizing processes[J].Engineering, 2012, 4(10):184-188.
[36] CARVALHO V S D, LAURA G D, áNGELES C M, et al.Analysis and application of a suite of recombinant endo-β (1,3)-D-glucanases for studying fungal cell walls[J].Microbial Cell Factories, 2021, 20(1):126.
[37] ZHEN Q, DONG Y, XIN Y, et al.The recognition mechanism of triple-helical β-1,3-glucan by a β-1,3-glucanase[J].Chemical Communications (Cambridge, England), 2017,53(67):9368-9371.
[38] KATSUKI H, NOBUHIRO K, SACHIO H.Characterization and enzymatic hydrolysis of hydrothermally treated β-1,3-1,6-glucan from Aureobasidium pullulans[J].World journal of Microbiology &Biotechnology, 2016,32(12):206.
[39] 段会轲, 熊善柏, 刘海梅.酵母β-1,3-葡聚糖的酶法增溶及产物分析[J].食品科学, 2008, 29(1):185-189.DUAN H K, XIONG S B, LIU H M.Study on solubility and properties enzymolysates of yeast β-1, 3-glucan[J].Food Science, 2008, 29(1):185-189.
[40] 范红梅. 酵母β-葡聚糖酶解改性及其应用[D].天津:天津科技大学, 2018.FAN H M.Enzyme modification of yeast β-glucan and its application[D].Tianjin:Tianjin University of Science and Technology, 2018.
[41] 张学况, 杜丽平, 王超, 等.酶解法增溶酵母(1→3)-β-D-葡聚糖的研究[J].食品与发酵工业, 2012, 38(7):48-52.ZHANG X K, DU L P, WANG C, et al.An enzymolysis method for the solubilization of yeast(1→3)-β-D-glucan[J].Food and Fermentation Industries, 2012, 38(7):48-52.
[42] 杜昱光, 白雪芳, 曲天明, 等.利用蜗牛酶降解天然产物及多糖的方法:中国, CN01136891.8[P].2003-05-14.DU Y G, BAI X F, QU T M, et al.Method of using snail enzyme to degrade natural products and polysaccharides:China, CN01136891.8[P].2003-05-14.
[43] 张漫莉, 王强, 刘丽, 等.酵母β-葡聚糖增溶改性与构效关系[J].中国食品学报, 2022, 22(5):147-156.ZHANG M L, WANG Q, LIU L, et al.The solubilization modification and structure-activity relationship of yeast β-glucan[J].Journal of Chinese Institute of Food Science and Technology, 2022, 22(5):147-156.
[44] 王国军.一种水溶酵母β-葡聚糖及其制备方法:中国, CN202210982808.9[P].2022-12-16.WANG G J.A water-soluble yeast β-glucan and its preparation method:China, CN202210982808.9[P].2022-12-16.
[45] YUAN H J, HE Y, ZHANG H, et al.Ultrasound-assisted enzymatic hydrolysis of yeast β-glucan catalyzed by β-glucanase:Chemical and microstructural analysis[J].Ultrasonics Sonochemistry, 2022, 86:106012.
[46] HU H G, ZHAO Q L, XIE J H, et al.Polysaccharides from pineapple pomace:New insight into ultrasonic-cellulase synergistic extraction and hypoglycemic activities[J].International Journal of Biological Macromolecules, 2019, 121:1213-1226.
[47] WANG Q, WANG Y, HUANG M G, et al.Ultrasound-assisted alkaline proteinase extraction enhances the yield of pecan protein and modifies its functional properties[J].Ultrasonics Sonochemistry, 2021, 80:105789.
[48] YAN S Z, WANG Q, YU J Y, et al.Ultrasound-assisted preparation of protein-polyphenol conjugates and their structural and functional characteristics[J].Ultrasonics Sonochemistry, 2023, 100:106645.
[49] 袁洪洁. 产朊假丝酵母β-葡聚糖的增溶改性及其活性评价研究[D].上海:上海应用技术大学, 2021.YUAN H J.Study on solubilization of Candida utilis β-glucan and evaluation of of its activity [D].Shanghai:Shanghai Institute of Technology, 2021.
[50] 郑赵敏. 酵母葡聚糖改性增溶及链结构与免疫调节活性间构效关系的研究[D].武汉:华中农业大学, 2019.ZHENG Z M.Modification from yeast glucan solubility and the structure-function relationship between chain structure and immunomodulatory activity[D].Wuhan:Huazhong Agricultural University, 2019.
[51] XIU W Y, WANG X, NA Z G, et al.Ultrasound-assisted hydrogen peroxide-ascorbic acid method to degrade sweet corncob polysaccharides can help treat type 2 diabetes via multiple pathways in vivo[J].Ultrasonics Sonochemistry, 2023, 101:106683.
[52] 董琳. 超声波辅助过氧化氢法增溶酵母β-葡聚糖及其对马铃薯淀粉特性影响的研究[D].上海:上海应用技术大学, 2023.DONG L.Solubiliztion of yeast β-glucan by ultrasonic-assisted H2O2 and its effect on potato starch properties[D].Shanghai:Shanghai Institute of Technology, 2023.
[53] ZHENG Z M, HUANG Q L, LUO X G, et al.Effects and mechanisms of ultrasound- and alkali-assisted enzymolysis on production of water-soluble yeast β-glucan[J].Bioresource Technology, 2019, 273:394-403.
[54] HORAGUCHI Y, TAKAHASHI M, TAKAMATSU K, et al.Heterologous expression of α-1, 3-glucanase Agn1p from Schizosaccharomyces pombe, and efficient production of nigero-oligosaccharides by enzymatic hydrolysis from solubilized α-1, 3;1, 6-glucan[J].Bioscience, Biotechnology, and Biochemistry, 2023, 87(10):1219-1228.
[55] VUSCAN P, KISCHKEL B, HATZIOANNOU A, et al.Potent induction of trained immunity by Saccharomyces cerevisiae β-glucans[J].Frontiers in Immunology, 2024, 15:1323333.
[56] HAN B, BARUAH K, COX E, et al.Structure-functional activity relationship of β-glucans from the perspective of immunomodulation:A mini-review[J].Frontiers in Immunology, 2020, 11:658.
[57] YOON T J, KIM T J, LEE H, et al.Anti-tumor metastatic activity of β-glucan purified from mutated Saccharomyces cerevisiae[J].International Immunopharmacology, 2008, 8(1):36-42.
[58] UPADHYAY T K, TRIVEDI R, KHAN F, et al.In vitro elucidation of antioxidant, antiproliferative, and apoptotic potential of yeast-derived β-1, 3-glucan particles against cervical cancer cells[J].Frontiers in Oncology, 2022, 12:942075.
[59] NO H, KIM J, SEO C R, et al.Anti-inflammatory effects of β-1, 3-1, 6-glucan derived from black yeast Aureobasidium pullulans in RAW264.7 cells[J].International Journal of Biological Macromolecules, 2021, 193:592-600.
[60] QIAO Y, YE X F, ZHONG L L, et al.Yeast β-1, 3-glucan production by an outer membrane β-1, 6-glucanase:Process optimization, structural characterization and immunomodulatory activity[J].Food &Function, 2022, 13(7):3917-3930.
[61] XU M D, MO X X, HUANG H, et al.Yeast β-glucan alleviates cognitive deficit by regulating gut microbiota and metabolites in Aβ1-42-induced AD-like mice[J].International Journal of Biological Macromolecules, 2020, 161:258-270.
[62] GOLISCH B, LEI Z H, TAMURA K, et al.Configured for the human gut microbiota:Molecular mechanisms of dietary β-glucan utilization[J].ACS Chemical Biology, 2021, 16(11):2087-2102.
[63] WANG H L, CHEN G J, LI X, et al.Yeast β-glucan, a potential prebiotic, showed a similar probiotic activity to inulin[J].Food &Function, 2020, 11(12):10386-10396.
[64] MO X X, SUN Y H, LIANG X L, et al.Insoluble yeast β-glucan attenuates high-fat diet-induced obesity by regulating gut microbiota and its metabolites[J].Carbohydrate Polymers, 2022, 281:119046.
[65] VIOLA C, CHRISTOS E, GIORGOS M, et al.Biotechnological addition of β-glucans from cereals, mushrooms and yeasts in foods and animal feed[J].Processes, 2021,9(11):1889.
[66] ZBIKOWSKA A, KOWALSKA M, ZBIKOWSKA K, et al.Study on the incorporation of oat and yeast β-glucan into shortbread biscuits as a basis for designing healthier and high quality food products[J].Molecules, 2022, 27(4):1393.
[67] BACHA U, NASIR M, IQBAL S, et al.Influence of yeast β-glucan on cookies sensory characteristics and bioactivities[J].Journal of Chemistry, 2018, 2018:1295184.
[68] AL-SAHLANY S T G, AL-KAABI W J, AL-MANHEL A J A, et al.Effects of β-glucan extracted from Saccharomyces cerevisiae on the quality of bio-yoghurts:in vitro and in vivo evaluation[J].Journal of Food Measurement and Characterization, 2022, 16(5):3607-3617.
[69] RAIKOS V, GRANT S B, HAYES H, et al.Use of β-glucan from spent brewer’s yeast as a thickener in skimmed yogurt:Physicochemical, textural, and structural properties related to sensory perception[J].Journal of Dairy Science, 2018, 101(7):5821-5831.
[70] APOSTU P M, MIHOCIU T E, NICOLAU A I.Technological and sensorial role of yeast β-glucan in meat batter reformulations[J].Journal of Food Science and Technology, 2017, 54(9):2653-2660.
[71] HERGESELL K, VALENTOV K, VELEBNY V, et al.Common cosmetic compounds can reduce air pollution-induced oxidative stress and pro-inflammatory response in the skin[J].Skin Pharmacology and Physiology, 2022, 35(3):156-165.
K, VELEBNY V, et al.Common cosmetic compounds can reduce air pollution-induced oxidative stress and pro-inflammatory response in the skin[J].Skin Pharmacology and Physiology, 2022, 35(3):156-165.
[72] SOUSA P, TAVARES-VALENTE D, AMORIM M, et al.β-Glucan extracts as high-value multifunctional ingredients for skin health:A review[J].Carbohydrate Polymers, 2023, 322:121329.
[73] ZHU J, WANG F Y, SONG S S, et al.Alleviating skin barrier disruption, skin inflammation and pruritus:a moisturizing spray containing β-glucan and panthenol[J].International Journal of Dermatology and Venereology, 2022, 6(1):1-8.