罗非鱼(Oreochromis mossambicus)别名“非洲鲫鱼”,具有生长快、繁殖力强、抗病力强等特点,且肉质厚、骨刺少,富含多种不饱和脂肪酸,被公认为健康食品[1]。根据《中国渔业统计年鉴》显示,2022年我国罗非鱼(淡水)养殖产量173.89万t,较2021年增长7.63万t,同比增长4.59%,是主要的淡水养殖鱼类之一[2]。我国罗非鱼在捕获后,一部分直接流入市场鲜售;另一部分经生产商加工后流入市场,目前主要是冻罗非鱼片和冻全鱼为主的初加工产品,缺少具有更高经济效益的深加工产品[3]。
为了顺应现代食品产业方便化、营养化和健康化的发展趋势,罗非鱼产业开始向精深加工方向转型,预制食品逐渐成为发展热点[1]。预制食品是以农、畜、禽、水产品为原料,经预加工后于常温、冷藏、冻藏条件下贮存的半成品或成品[4]。随着预制食品的发展,水产品的加工方式也越来越多样化。真空低温蒸煮是将食物原材料密封在耐热的食品级真空袋中,以可控的温度和时间进行水浴加热的过程,温度一般为50~90 ℃,时间在几分钟到数小时不等[5]。真空低温蒸煮过去常应用于牛肉、鸭肉等禽肉类食品,用于保护肉品的纤维结构,优化肉品的质构特性,改善肉品的适口性[5]。近年来,真空低温蒸煮技术关于鱼类的研究不断增加。研究发现,相比于传统高温蒸煮处理的鱼片,真空低温蒸煮处理的鱼片表现出了更紧凑的纤维排列[6],更高的水分含量和产品得率[7],更少的脂肪氧化、蛋白质变性以及更丰富的风味物质[8]。可见真空低温蒸煮技术可以改善水产品品质特性,在预制水产品加工领域有广阔的应用前景。
水产品含水量高、营养价值丰富等特点,使其极易在内源酶和微生物的作用下腐坏变质,从而降低食用品质与商业价值,影响预制水产品的发展[4]。因此,贮藏过程中品质变化的研究对预制水产品行业有重要意义。冻藏保鲜技术是将水产品贮存在低温(≤-18 ℃)的环境中,使水产品中的水分基本处于冻结状态,从而抑制微生物的生长繁殖和内源酶的活性作用,达到长期保存水产品的效果,是一种实用且常见的延长保质期的方法[9]。目前,关于真空低温蒸煮鱼类在冻藏过程中品质变化的研究鲜有报道。本研究以真空低温蒸煮技术处理的罗非鱼片为研究对象,以常压高温蒸煮处理的罗非鱼片为对照,探究真空低温蒸煮罗非鱼片在冻藏过程中品质特性和肌原纤维蛋白结构的变化,旨在促进罗非鱼资源的利用,为预制水产品行业的发展提供科学基础。
1 材料与方法
1.1 材料与试剂
罗非鱼,广东省湛江市麻章区湖光镇湖光市场;食品级耐高温蒸煮袋,深圳平达利实业有限公司。
三氯乙酸、2-硫代巴比妥酸、溴酚蓝、硼酸等均为分析纯,上海源叶生物科技有限公司。
1.2 仪器与设备
VAP450全自动凯氏定氮仪,德国格哈特分析仪器有限公司;SLI-700埃朗生化培养箱,东京理化器株式会社;ChirascanV10圆二色谱仪,英国应用光物理公司;RF-5301PC荧光光谱仪,德国BRUKER光谱仪器公司;TA.XTplusC质构仪,英国SMS有限公司;Varioskan Flash多功能读数酶标仪,赛默飞世尔科技(中国)有限公司。
1.3 实验方法
1.3.1 材料制备
将新鲜罗非鱼致死取背部肌肉,切成相同大小的罗非鱼片,每片长(80±5) mm、高(30±5) mm、厚(3±1) mm,洗净后沥干水分,分成2组。真空低温蒸煮(SV)组[10]:称取50 g试样放入食品级耐高温真空包装袋中,用真空包装机(-0.1 MPa,30 s)进行包装,将包装好的罗非鱼片置于60 ℃水浴锅中煮制45 min;常压高温蒸煮(TH)组[11]:称取50 g罗非鱼片,置于蒸锅中沸水蒸制5 min,待样品冷却至室温后进行真空包装(-0.1 MPa,30 s)。将煮制好的2组样品部分放于4 ℃冰箱,待样品冷却至中心温度4 ℃后进行0 d的相关指标测定,其余样品冷却至室温后放入-18 ℃冰箱冻藏,冻藏时间为120 d,每隔30 d取出冻藏样品,放于4 ℃冰箱解冻后测定相关指标。
1.3.2 水分含量的测定
参考国家标准GB 5009.3—2016《食品安全国家标准 食品中水分的测定》中的直接干燥法。
1.3.3 质构的测定
参考LIU等[9]的方法并略加修改。采用质构仪的全质构分析(texture profile analysis,TPA)模式,选用P/36R探头,仪器条件为:测前5 mm/s、测中0.5 mm/s、测后1 mm/s、时间间隔5 s、触发力5 g、形变50%。
1.3.4 菌落总数的测定
参照国家标准GB 4789.2—2022《食品安全国家标准 食品微生物学检验 菌落总数测定》。
1.3.5 挥发性盐基氮(total volatile base nitrogen,TVB-N)的测定
参考国家标准GB 5009.228—2016《食品安全国家标准 食品中挥发性盐基氮的测定》中的全自动凯氏定氮仪法。
1.3.6 pH的测定
参考国家标准GB 5009.237—2016《食品安全国家标准 食品pH值的测定》。
1.3.7 硫代巴比妥酸(thiobarbituric acid,TBA)值的测定
参考SUN等[12]的方法,准确称取5 g绞碎的罗非鱼肉,放入50 mL具塞离心管中,与25 mL质量分数为7.5%的三氯乙酸溶液混合,将混合物在50 ℃下振荡30 min,然后在4 ℃下5 000×g离心15 min,离心完毕后取5 mL上清液与5 mL 0.02 mol/L硫代巴比妥酸溶液混合,将混合物在100 ℃水浴中加热30 min,冷却至室温,在532 nm处测定吸光度。TBA的值表示1 kg罗非鱼肉中丙二醛(malondialdehyde,MDA)的含量,通过公式(1)计算:
(1)
式中:A532是样品的吸光度;Ws是样品的质量,g;9.48是从红色TBA反应产物的稀释因子和摩尔消光系数[152 000 L/(mol·cm)]导出的常数。
1.3.8 肌原纤维蛋白的提取
参考李学鹏等[13]的方法,取绞碎的罗非鱼肉5 g,加入25 mL 10 mmol/L的Tris-HCl溶液(pH 7.2),高速均质3次,每次30 s,在4 800×g,4 ℃条件下离心10 min,取沉淀备用,上述过程重复3次。在最后1次取得的沉淀中加入25 mL 10 mmol/L Tris-HCl缓冲液(含0.6 mol/L NaCl,pH 7.2),高速均质3次,每次30 s,在4 500×g,4 ℃条件下离心10 min,最后用双层纱布过滤,提取的肌原纤维蛋白在2 d内使用。
1.3.9 总巯基含量的测定
总巯基的测定参考了ZHANG等[14]的方法,并稍作修改。将0.5 mL 2 mg/mL肌原纤维蛋白溶液与4.5 mL缓冲液A[10 mmol/L EDTA,1%(质量分数)SDS,8 mol/L尿素,0.2 mol/L Tris-HCl,pH 8.0]混合。取4 mL的混合物,加入0.5 mL的缓冲液B(1 g/L 5,5′-二硫代双(2-硝基苯甲酸),0.2 mol/L Tris-HCl,pH 8.0),将上述溶液完全混合,在40 ℃下反应30 min后冷却至室温。在412 nm处测定吸光度,计算总巯基含量,摩尔消光系数为13 600 L/(mol·cm)。
1.3.10 表面疏水性的测定
参考吴佳[15]的方法,用10 mmol/L Tris-HCl缓冲液(含0.6 mol/L NaCl,pH 7.2)将肌原纤维蛋白浓度调至1 mg/mL。取1 mL试样中加入200 μL 1 mg/mL溴酚蓝,涡旋10 min,在4 ℃、8 000×g条件下离心10 min。取上清液稀释10倍后在波长595 nm处测定吸光值,空白组用未添加肌原纤维蛋白的磷酸盐缓冲液替代。肌原纤维蛋白表面疏水性的计算如公式(2)所示:
表面疏水性![]()
(2)
式中:A空白为空白组的吸光度;A样品为样品组的吸光度。
1.3.11 二级结构的测定
参考DU等[16]的方法,并稍作修改。将肌原纤维蛋白浓度用超纯水调至0.2 mg/mL,圆二色谱仪条件为:扫描波长190~260 nm,扫描速率为50 nm/min,带宽为1 nm。
1.3.12 三级结构的测定
参考JIN等[17]的方法,并稍作修改。用10 mmol/L Tris-HCl缓冲液(含0.6 mol/L NaCl,pH 7.2)将肌原纤维蛋白质量浓度调至0.2 mg/mL。使用RF-5301PC荧光光谱仪测定肌原纤维蛋白的内源荧光强度。设定仪器参数为:激发波长290 nm,发射光谱波长范围300~400 nm,狭缝宽度为10 nm。
1.4 数据处理
每组试验重复3次以上,数据用SPSS 27软件进行分析处理,利用Origin 2022进行绘图,结果以“平均值±标准差”表示。显著性差异检验用单因素ANOVA检验和Duncan多重比较,P<0.05表示差异性显著。本文用不同大写字母表示不同处理组的差异性显著(P<0.05);不同小写字母表示不同冻藏时间的差异性显著(P<0.05)。
2 结果与分析
2.1 不同处理对罗非鱼片冻藏过程中水分含量的影响
水分含量可以对水产品的质构、外观以及微生物的生长繁殖造成影响,是评价食品品质的重要指标[18]。如图1所示,随着冻藏时间的延长,2个处理组的水分含量呈现下降趋势,SV组由0 d的75.69%下降至120 d的73.75%,TH组从0 d的74.09%减少到120 d的71.41%,可能是冻藏过程中,产品与周围环境之间发生了水的转移,造成产品的脱水作用,使样品水分含量降低,与MALIK等[18]研究结果一致。冻藏120 d后,SV组样品的水分含量较0 d下降了2.26%,TH组的水分含量总体下降了3.61%,SV组的整体水分损失少于TH组,且SV组罗非鱼片的水分含量在整个冻藏期间都显著高于TH组(P<0.05),说明相比传统的TH,SV不仅能保留水产品加工中的水分,而且能减少水产品冻藏过程中的水分损失,减缓罗非鱼片的水分含量和感官品质的劣变[7]。
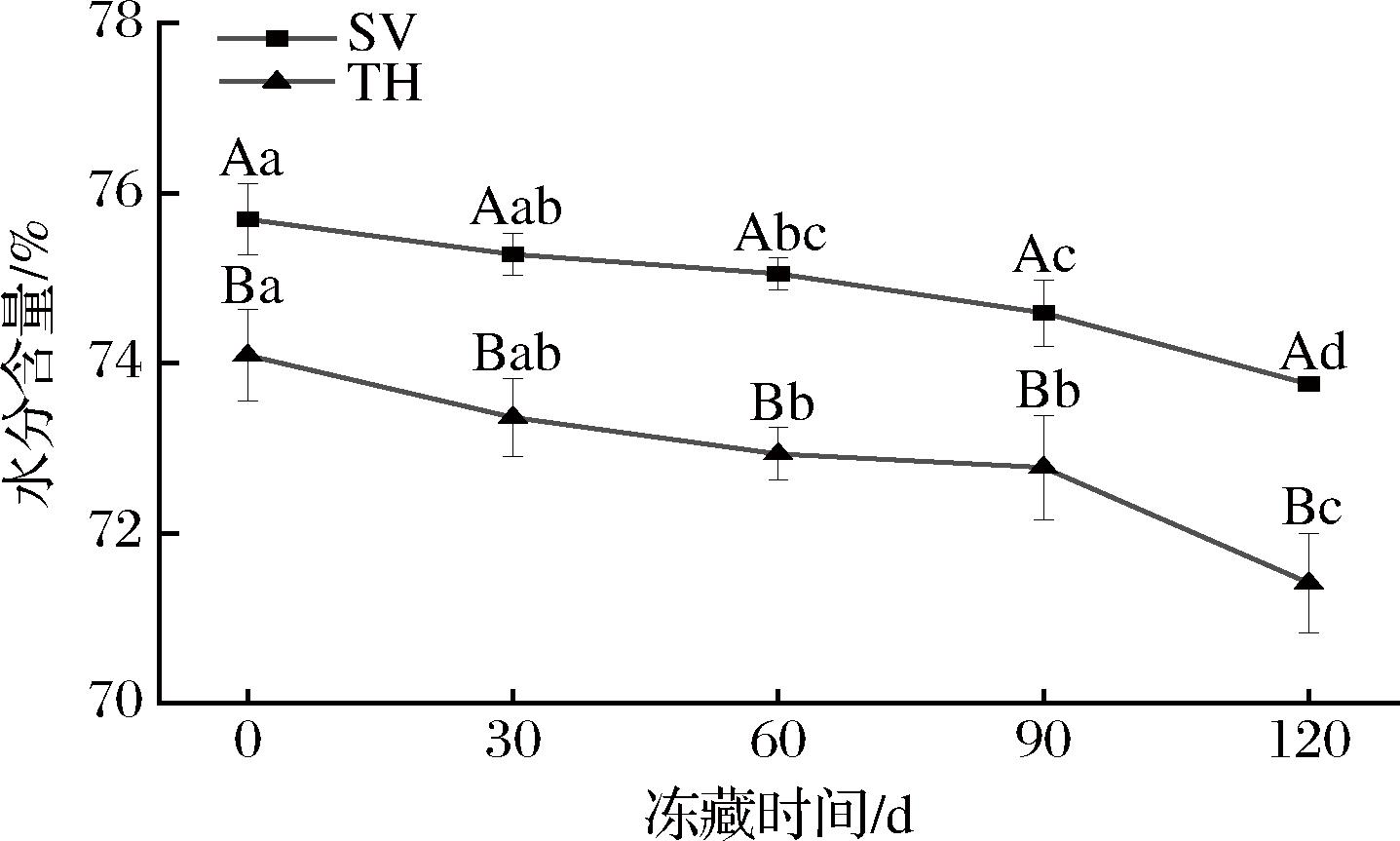
图1 不同处理对罗非鱼片冻藏过程中水分含量的影响
Fig.1 Effects of different treatments on moisture content of tilapia fillets during frozen storage
2.2 不同处理对罗非鱼片冻藏过程中质构的影响
质构与水产品肌肉组织、保水能力、蛋白质结构等状态密切相关,是水产品品质变化的重要体现,影响着消费者对产品的选择和偏好[9]。TPA主要通过模拟人口的咬合行为,对产品进行双循环压缩测试,以研究产品在口中咀嚼时的变化[7]。由表1可知,冻藏时间的延长,2组样品的硬度、弹性和咀嚼性都呈下降趋势。冻藏至120 d时,SV组的硬度、弹性和咀嚼性分别下降为394.2 g、0.36 mm和60.14 mJ,TH组降低为366.13 g、0.34 mm和55.55 mJ,都较0 d发生了显著性变化(P<0.05)。马新悦等[19]研究了小黄鱼在不同温度下贮藏的品质变化,研究发现由于外界微生物的作用和肌肉中的酶解作用,导致小黄鱼的蛋白质降解,肌肉溶解,硬度、咀嚼性和弹性都逐渐下降,与本研究结果相似。在整个冻藏期间,SV组的硬度显著高于TH组(P<0.05),弹性略高于TH组,咀嚼性除60 d外均显著高于TH组(P<0.05)。可能归因于TH鱼片持续高温处理导致肌原纤维蛋白和胶原蛋白的水解,造成了鱼肉质构的迅速恶化[8]。相较而言,SV的温度较低,条件较温和,因此肌原纤维蛋白的变性程度降低,促进了硬度、弹性和咀嚼性的保留,使罗非鱼片得到了更好的食用品质[6]。由此可见,SV可以为罗非鱼片的冻藏提供更有利的质构品质,更适合罗非鱼片的加工。
表1 不同处理对罗非鱼片冻藏过程中质构的影响
Table 1 Effects of different treatments on texture of tilapia fillets during frozen storage
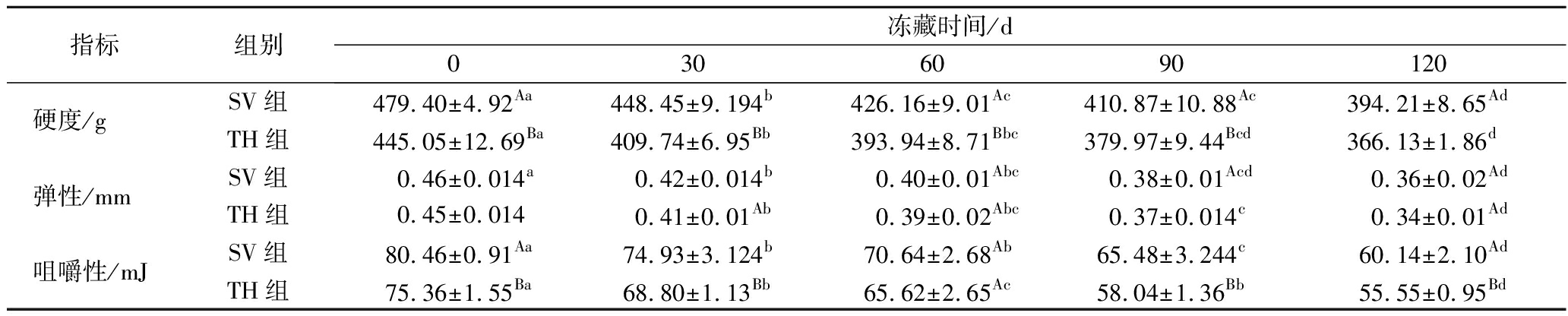
指标组别冻藏时间/d0306090120硬度/gSV组479.40±4.92Aa448.45±9.194b426.16±9.01Ac410.87±10.88Ac394.21±8.65AdTH组445.05±12.69Ba409.74±6.95Bb393.94±8.71Bbc379.97±9.44Bcd366.13±1.86d弹性/mmSV组0.46±0.014a0.42±0.014b0.40±0.01Abc0.38±0.01Acd0.36±0.02AdTH组0.45±0.0140.41±0.01Ab0.39±0.02Abc0.37±0.014c0.34±0.01Ad咀嚼性/mJSV组80.46±0.91Aa74.93±3.124b70.64±2.68Ab65.48±3.244c60.14±2.10AdTH组75.36±1.55Ba68.80±1.13Bb65.62±2.65Ac58.04±1.36Bb55.55±0.95Bd
2.3 不同处理对罗非鱼片冻藏过程中菌落总数的影响
微生物生长是影响水产品品质的重要原因,菌落总数可以反映冻藏过程中微生物的生长情况和水产品的腐败变质程度[6],根据GB 10136—2015《食品安全国家标准 动物性水产制品》规定,即食性动物性水产制品的菌落总数应≤4.70 lg CFU/g。由图2可知,2组产品在整个冻藏期内的菌落总数均符合GB 10136—2015《食品安全国家标准 动物性水产制品》的规定。其中,SV组第0~90天期间均无菌落生长,在120 d时有1.15 lg CFU/g菌落;TH组除0 d无菌落生长外,菌落总数随冻藏时间的延长而增加,至120 d生长了1.74 lg CFU/g菌落。由此可见,SV组在冻藏过程中相对稳定且微生物生长繁殖较少,可能是SV在一定程度下改变了包装袋内食材的压强,破坏了微生物细胞膜结构,造成细胞内容物外泄和细菌细胞关键代谢酶结构改变,影响其新陈代谢,达到抑制微生物繁殖的作用,提升样品在冻藏过程中的稳定性[20]。
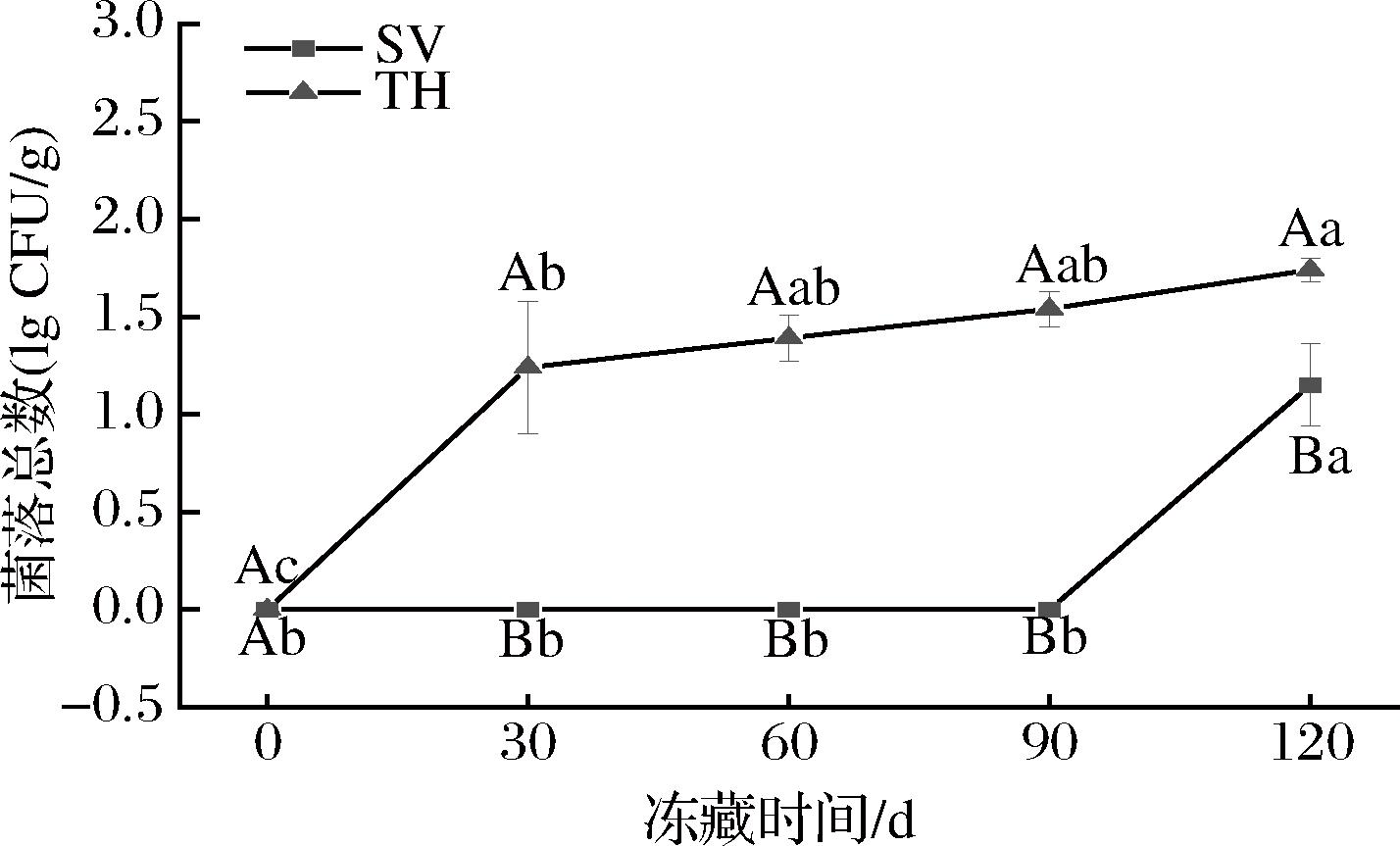
图2 不同处理对罗非鱼片冻藏过程中菌落总数的影响
Fig.2 Effects of different treatments on total number of colonies of tilapia fillets during frozen storage
2.4 不同处理对罗非鱼片冻藏过程中TVB-N的影响
TVB-N来源于受微生物和酶作用而被分解的蛋白质和非蛋白质含氮化合物,一般由伯胺、仲胺、叔胺和氨等碱性物质组成,常用于监测水产品的新鲜度和安全性,其含量变化可以表征水产品的腐败情况[21]。由图3可知,2组产品的TVB-N随着冻藏时间延长呈上升趋势。依据GB 10136—2015《食品安全国家标准 动物性水产制品》规定预制动物性水产制品挥发性盐基氮含量不得超过30 mg/100 g,在冻藏末期,SV组的TVB-N含量为15.24 mg/100 g,TH组的TVB-N含量为15.91 mg/100 g,仍低于限量值,符合限量规定。在整个冻藏期间,2组TVB-N含量总体显著上升(P<0.05),说明样品发生了不可逆的腐败变质。在相同冻藏时间时,TH组的TVB-N含量均显著高于SV组(P<0.05),可能是因为SV在很大程度上简化了程序,减少样品与外界环境和微生物的直接接触时间,避免了微生物对罗非鱼片含氮化合物的分解作用,延缓了产品的腐败变质[22]。
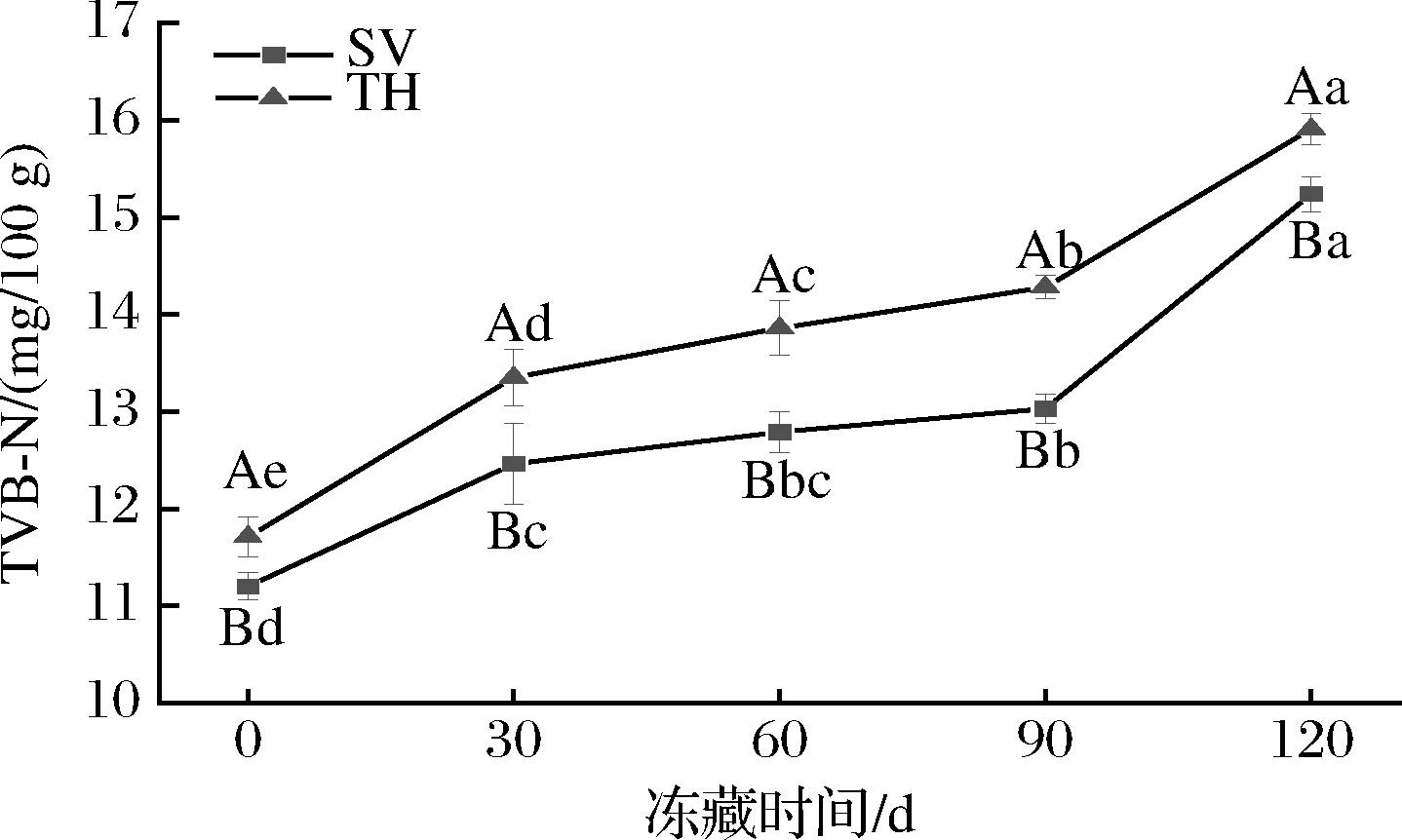
图3 不同处理对罗非鱼片冻藏过程中TVB-N的影响
Fig.3 Effects of different treatments on TVB-N of tilapia fillets during frozen storage
2.5 不同处理对罗非鱼片冻藏过程中pH的影响
pH值可用于表征冻藏过程中由腐败菌引起的蛋白质水解和氨基酸脱羧等作用的程度[23]。如图4所示,2组产品的pH值随着冻藏时间的延长而呈上升趋势,SV组从0 d的6.89增加至120 d的7.11,TH组由6.93显著升高(P<0.05)至7.21。ZHOU等[24]研究了不同冻藏方式对金鲳鱼品质的影响,pH值与冻藏时间呈正相关,冻藏初期上升缓慢,冻藏后期上升速率增加,与本研究结果相似。初期上升速率较慢,可能归因于冻藏前期,肌肉组织发生糖酵解反应而产生大量乳酸,缓解了由于蛋白质降解和含氮物质分解产生的碱性物质引发的pH值的上升[22]。在整个冻藏期内,TH组的pH值都高于SV组,特别是在冻藏0、60、90、120 d,TH组的pH值均显著高于SV组(P<0.05),可见SV组的腐败程度弱于TH组。与TVB-N趋势相似,说明真空低温蒸煮技术可以延缓腐败物质的生成,提高罗非鱼片的安全性,使产品有更好的冻藏效果。
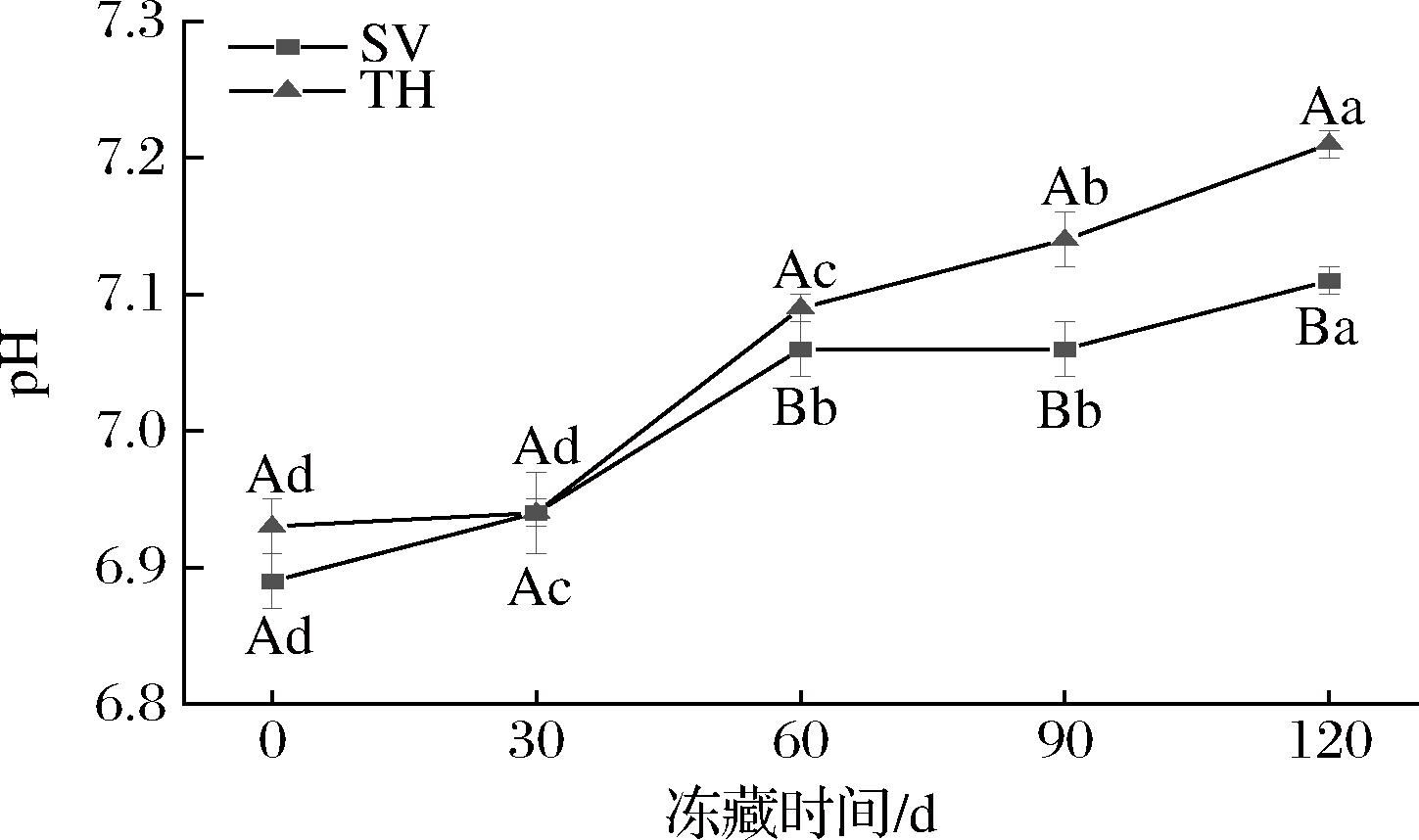
图4 不同处理对罗非鱼片冻藏过程中pH的影响
Fig.4 Effects of different treatments on pH of tilapia fillets during frozen storage
2.6 不同处理对罗非鱼片冻藏过程中TBA的影响
由于罗非鱼富含多不饱和脂肪酸,因此脂质氧化是导致罗非鱼产品质量恶化的重要原因,TBA含量体现了脂质氧化中间产物的含量,是水产品中脂质氧化的主要指标之一[24]。由图5可知出,罗非鱼片的TBA值在冻藏期间逐渐增加,可能是因为冰晶的生成、促氧化分子和脂解酶的作用促进了罗非鱼片的脂质氧化,与CROPOTOVA等[25]的结果相似。在冻藏120 d后,SV组的TBA增加了94.44%,TH组增加了131.58%,TH组的增长比例大于SV组,且0、90、120 d,TH组的TBA值显著高于SV组(P<0.05),可见TH组的罗非鱼片脂肪氧化更加严重。这是因为高温蒸煮会促进罗非鱼片的脂质氧化,而SV在加工过程中保持恒定的低温,这避免了产品受热过度,减少了热处理引发的罗非鱼片的脂质氧化,从而保护罗非鱼片的营养物质,更利于产品冻藏[20]。CHANG等[26]比较了真空低温蒸煮技术与传统蒸煮技术的差别,发现SV组的TBA值最低(P<0.05),与其他产品相比平均降低约38%,与本研究结果相似。
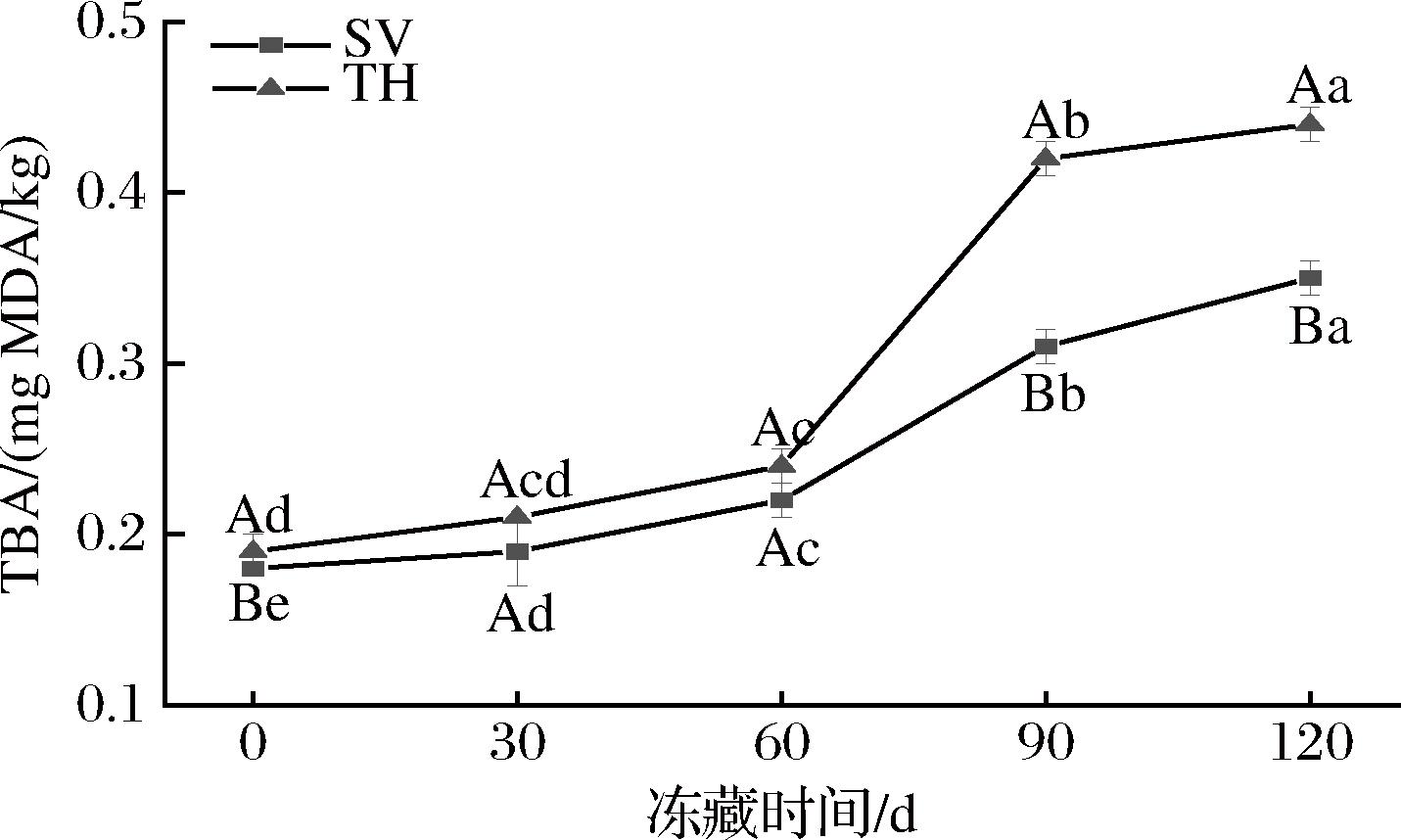
图5 不同处理对罗非鱼片冻藏过程中TBA的影响
Fig.5 Effect of different treatments on TBA of tilapia fillets during frozen storage
2.7 不同处理对罗非鱼片冻藏过程中总巯基含量的影响
巯基是肌原纤维蛋白中最活跃、反应活性最高的功能基团,影响着蛋白质结构的稳定性,故总巯基含量是衡量蛋白质变性的重要指标,可以在一定程度上反映蛋白质的变性程度[14]。由图6可知,随着冻藏时间的延长,2组的总巯基含量呈下降趋势,可能是冻藏过程中,冰晶持续生长使细胞受到的机械压力不断增大,引发肌原纤维蛋白结构的变化,从而导致巯基暴露并被氧化形成二硫化物等氧化产物,造成总巯基含量下降[27]。在整个冻藏期间,2组总巯基含量不断降低,至冻藏120 d,SV组的总巯基含量降低至63.15 μmol/g,TH组的总巯基含量下降至61.42 μmol/g。ABDELNABY等[23]的研究结果与本研究趋势一致,该研究分析了熟小龙虾在冷冻贮藏中质量参数的变化,发现与原始样品相比,冷冻贮藏后小龙虾的总巯基含量显著降低(P<0.05),这种降低归因于冻结导致的肌肉结构损伤和蛋白质降解。冻藏的120 d中,SV组的巯基含量显著高于TH组(P<0.05),可能是SV加工过程中条件稳定,减少了蛋白质构象的变化,抑制了蛋白质氧化变性,维持了罗非鱼片的品质,使罗非鱼片有更好的冻藏效果[8]。
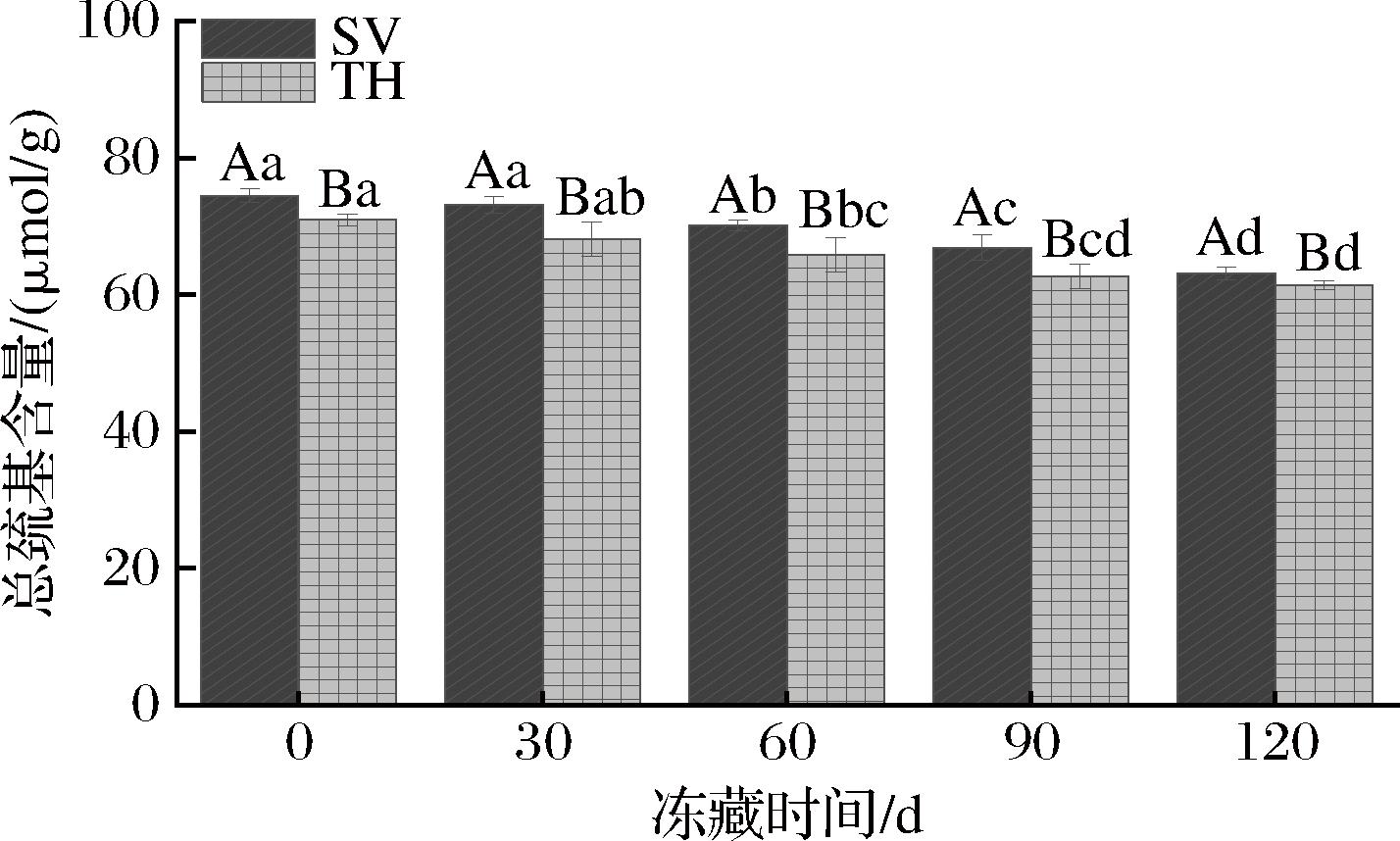
图6 不同处理对罗非鱼片冻藏过程中肌原纤维蛋白总巯基含量的影响
Fig.6 Effect of different treatments on total sulfhydryl content of myofibrillar protein of tilapia fillets during frozen storage
2.8 不同处理对罗非鱼片冻藏过程中表面疏水性的影响
蛋白质的表面疏水性是指蛋白质分子表面疏水残基的相对含量,可以用于表征蛋白质疏水基团的暴露情况,得到蛋白质内核结构的变化,蛋白质的疏水基团暴露越多,表面疏水性越高,蛋白质变性越严重[14]。如图7所示,冻藏前SV组溴酚蓝的结合量为23.41 μg,TH组的溴酚蓝结合量为25.16 μg,2组样品的表面疏水性都随着冻藏时间的延长而上升。这可能归因于冻藏过程中冰晶的形成破坏了蛋白质结构,促进了疏水基团的暴露,导致了表面疏水性的上升[28]。此外,TH组的表面疏水性整体高于SV组,在0、90、120 d均显著高于SV组(P<0.05),至120 d时SV组升至32.35 μg,较初始增长38.19%;TH组上升至37.11 μg,较初始增长47.5%。由此可见,SV组的罗非鱼片蛋白质变性程度低于TH组,说明SV能够有效缓解样品冻藏过程中的蛋白质氧化情况,维持样品的营养品质。
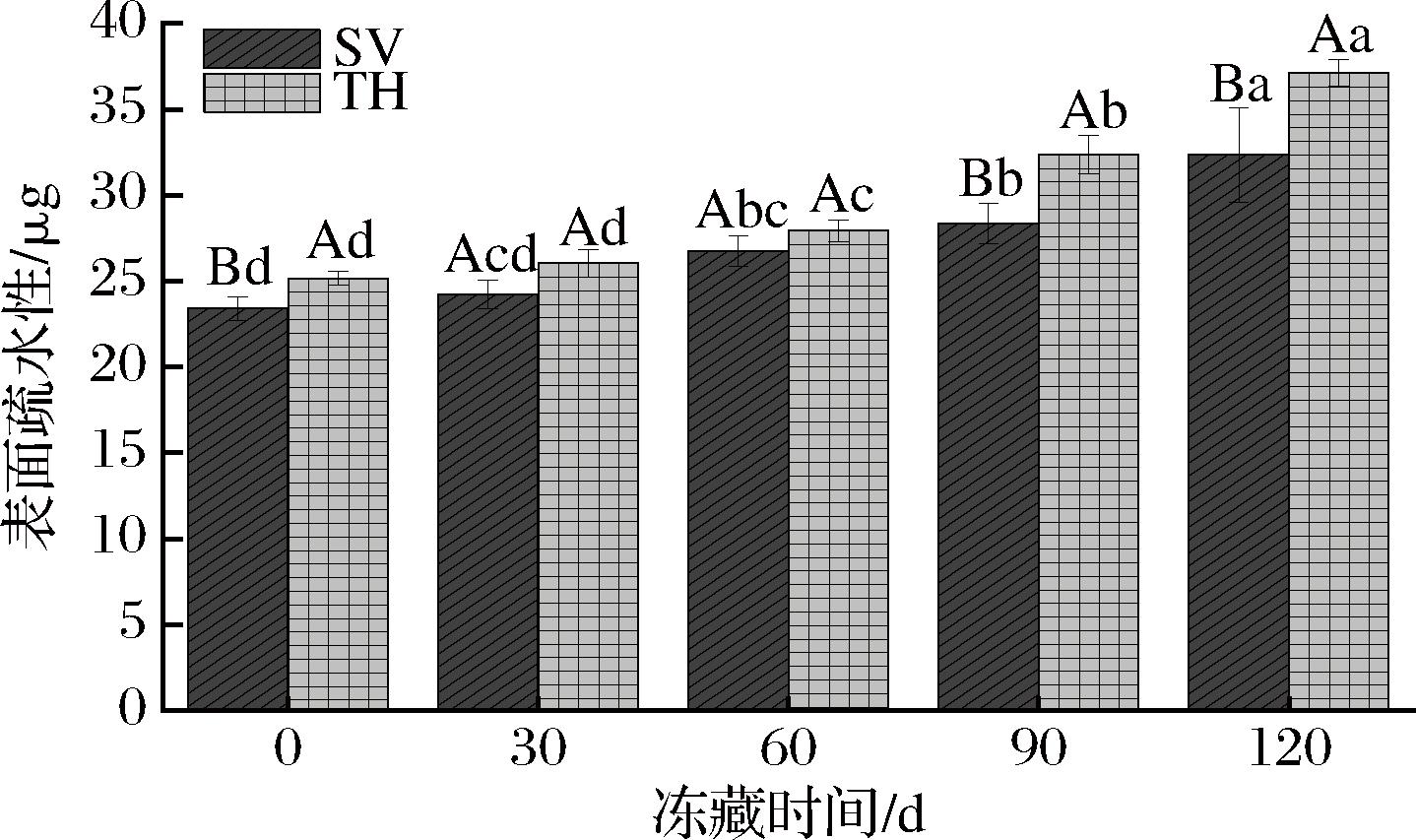
图7 不同处理对罗非鱼片冻藏过程中肌原纤维蛋白表面疏水性的影响
Fig.7 Effect of different treatments on surface hydrophobicity of myofibrillar protein of tilapia fillets during frozen storage
2.9 不同处理对罗非鱼片冻藏过程中二级结构的影响
圆二色谱可以定量分析肌原纤维蛋白的变性程度,主要测定二级结构的含量和比例,包括α-螺旋、β-折叠、β转角和无规卷曲,常用α-螺旋的比例来评估蛋白质二级结构稳定性[16]。由图8可知,随着冻藏时间的推移,SV组的α-螺旋比例由0 d的23.18%减少至120 d的16.07%,TH组从22.36%降低至14.67%,均呈现下降趋势,可能是因为冻结引起的氧化加重并破坏氢键,扰乱肌原纤维蛋白结构,从而将螺旋结构转变为随机结构,造成α-螺旋构象的百分比降低[5]。LI等[29]研究了冷冻保存过程中肌原纤维蛋白的结构稳定性变化情况,发现随着冷冻贮存时间的延长,所有样品α-螺旋比例都逐渐降低,与本研究结果相似。当贮存时间相同时,SV组二级结构的α-螺旋比例均高于TH组,且冻藏120 d后,SV组较初始降低30.67%,而TH组下降了34.39%,可见SV组的蛋白质结构劣变程度弱于TH组,说明SV处理的罗非鱼肌原纤维蛋白有更加稳定的蛋白质二级结构。
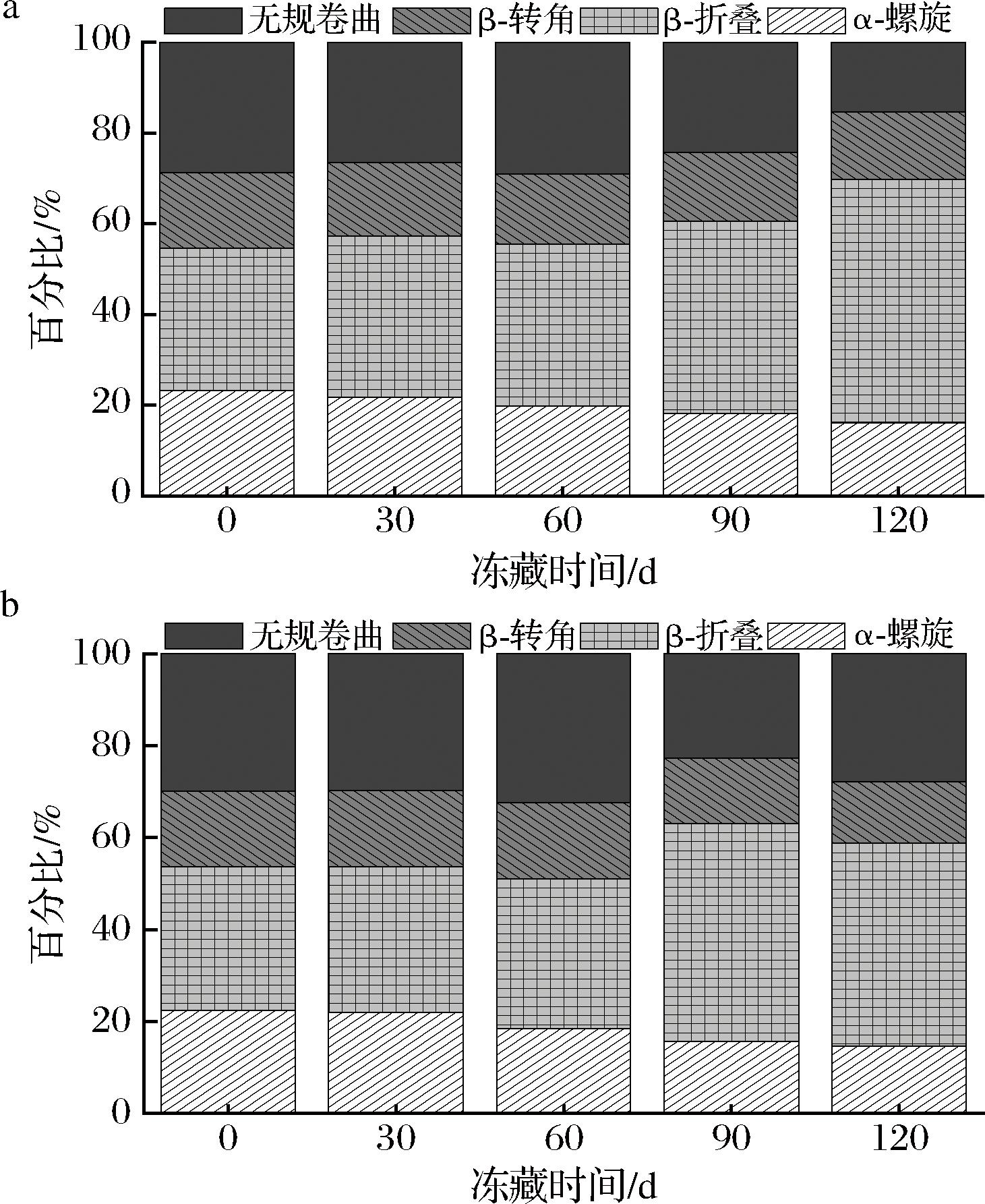
a-SV对罗非鱼片肌原纤维蛋白二级结构含量的影响;b-TH对罗非鱼片肌原纤维蛋白二级结构含量的影响
图8 不同处理对罗非鱼片冻藏过程中肌原纤维蛋白二级结构含量的影响
Fig.8 Effect of different treatments on the secondary structure content of myofibrillar protein of tilapia fillets during frozen storage
2.10 不同处理对罗非鱼片冻藏过程中三级结构的影响
芳香族氨基酸残基,如色氨酸、酪氨酸和苯丙氨酸,是蛋白质固有荧光的主要贡献者[29]。由于色氨酸残基的固有荧光对微环境的极性特别敏感,因此经常通过检测色氨酸残基的荧光强度来表征蛋白质疏水结构的完整性,从而分析蛋白质三级结构的变化[16]。由图9可知,SV组和TH组肌原纤维蛋白的内源荧光强度随着冻藏时间的延长而呈下降趋势,这表明受冻藏环境的影响,位于肌原纤维蛋白的色氨酸残基暴露,导致蛋白质聚集的形成和蛋白质构象的减弱,从而引发了荧光强度的下降[29]。CHEN等[30]研究了不同冷冻方式对鲈鱼片理化性质和蛋白质结构的影响,发现所有样品组的内源荧光强度都随着贮存时间的延长而逐渐下降,表明芳香族氨基酸残基在从中等疏水环境向极性环境移动时暴露在外,造成了荧光强度的降低,与本研究结果相似。此外,在相同的冻藏时间,SV组的内源荧光强度均高于TH组,说明真空低温蒸煮技术有助于减缓蛋白质三级结构的变化,维持肌原纤维蛋白结构的稳定。
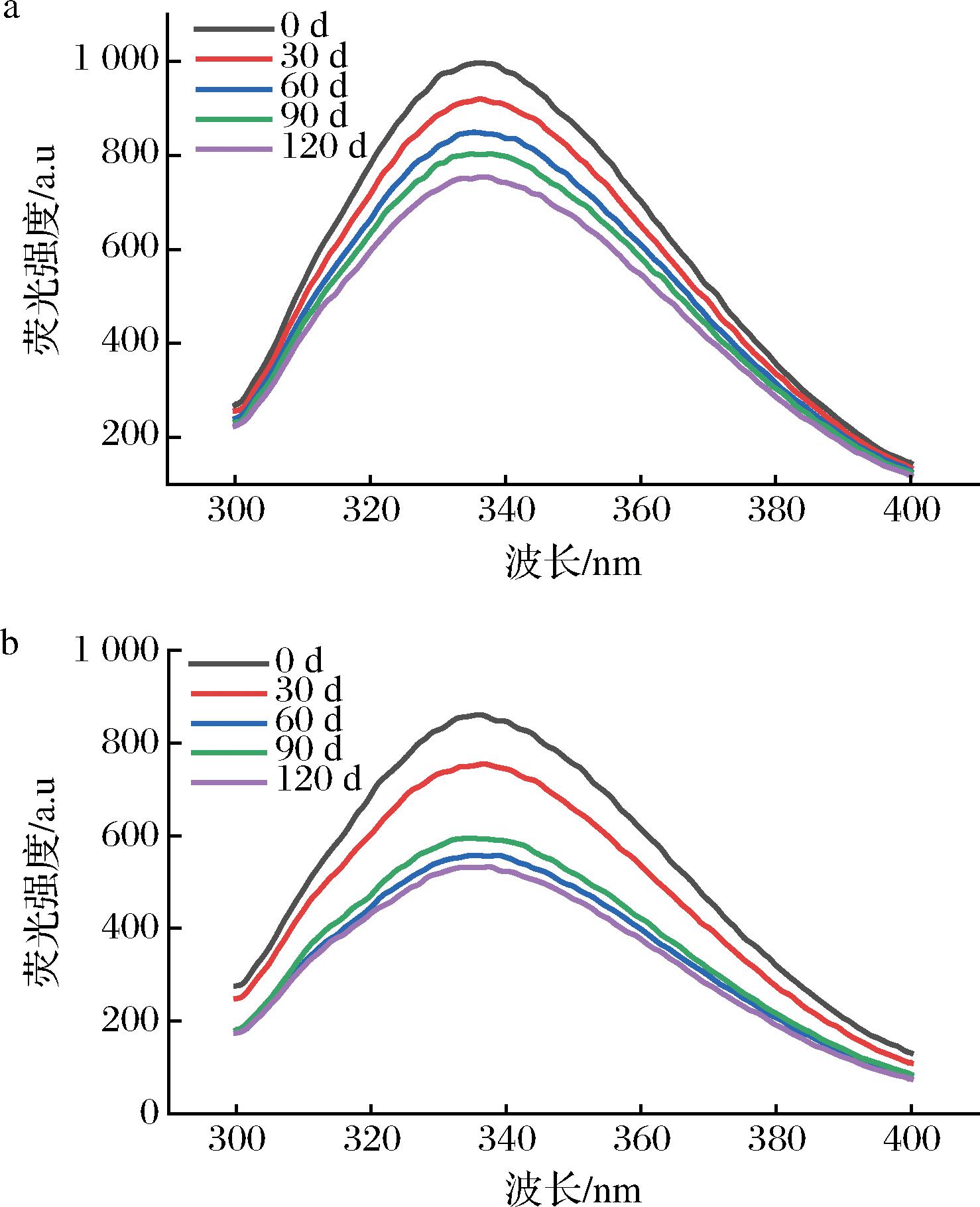
a-SV对罗非鱼片肌原纤维蛋白三级结构的影响;b-TH对罗非鱼片肌原纤维蛋白三级结构的影响
图9 不同处理对罗非鱼片冻藏过程中肌原纤维蛋白三级结构的影响
Fig.9 Effect of different treatments on the tertiary structure of myofibrillar protein of tilapia fillets during frozen storage
3 结论
本文以常压高温蒸煮技术处理的罗非鱼片为对照,主要研究了真空低温蒸煮处理的罗非鱼片在-18 ℃下冻藏120 d的水分含量、质构、菌落总数、TVB-N和pH等指标的变化。研究发现,随着冻藏时间的延长,2组罗非鱼片的品质都出现了明显劣变。冻藏120 d后,TH组水分含量下降至96.37%,较SV组多损失了1.07%;SV组的硬度、弹性和咀嚼性分别下降为394.2 g、0.36 mm和60.14 mJ,整体优于TH组的366.13 g、0.34 mm和55.55 mJ;SV组的TVB-N、pH、TBA上升至15.24 mg/100 g、7.11、0.35 mg MDA/kg,总体显著低于TH组的15.91 mg/100 g、7.21、0.44 mg MDA/kg(P<0.05)。对肌原纤维蛋白的研究表明,冻藏120 d后,SV组总巯基含量降低至63.15 μmol/g,表面疏水性增加38.19%,二级结构的α-螺旋比例下降至16.07%;TH组的总巯基含量下降至61.42 μmol/g,表面疏水性增加47.50%,二级结构的α-螺旋比例下降至14.67%。2组内源荧光强度都随着冻藏时间的延长逐渐下降,相同冻藏时间时,SV组高于TH组。综上所述,2组罗非鱼片的品质都随着冻藏时间的延长而逐渐劣变,其中,真空低温蒸煮处理的罗非鱼片品质特性和肌原纤维蛋白的结构都明显优于常压高温蒸煮处理的罗非鱼片,说明真空低温蒸煮技术能够缓解冻藏过程中罗非鱼片的不良品质变化。本研究结果将为罗非鱼预制食品开发和冻藏提供理论基础。
[1] CHENG H, MEI J, XIE J.Analysis of key volatile compounds and quality properties of Tilapia (Oreochromis mossambicus) fillets during cold storage:Based on thermal desorption coupled with gas chromatography-mass spectrometry (TD-GC-MS)[J].LWT, 2023, 184:115051.
[2] 农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会编.2023中国渔业统计年鉴[M].北京:中国农业出版社, 2023.Ministry of Agriculture and Rural Affairs of the People’s Republic of China, National Fisheries Technology Extension Center, China Society of Fisheries, et al.Fishery Statistical Yearbook of China[M].Beijing:China Agriculture Press, 2023.
[3] 赵志霞, 吴燕燕, 李来好, 等.我国罗非鱼加工研究现状[J].食品工业科技, 2017, 38(9):363-367;373.ZHAO Z X, WU Y Y, LI L H, et al.Current research situation of Tilapia processing in China[J].Science and Technology of Food Industry, 2017, 38(9):363-367; 373.
[4] 赵茜, 陈剑, 李欢, 等.水产预制食品品质控制及智能监测技术研究进展[J].现代食品科技, 2024, 40(1):312-318.ZHAO X, CHEN J, LI H, et al.Research advances in quality control and intelligent monitoring technologies for aquatic prepared products[J].Modern Food Science &Technology, 2024, 40(1):312-318.
[5] 陈美玉. 基于水分迁移及肌原纤维蛋白特性研究真空低温加热对牛肉品质的影响[D].杭州:浙江大学, 2021.CHEN M Y.Effect of water migration and the structural change of myofibril protein on beef quality during sous-vide cooking[D].Hangzhou:Zhejiang University, 2021.
[6] SHEN S K, CHEN Y W, DONG X P, et al.Changes in food quality and microbial composition of Russian sturgeon (Acipenser gueldenstaedti) fillets treated with low temperature vacuum heating method during storage at 4 ℃[J].Food Research International, 2020, 138:109665.
[7] G UCHOWSKI A, CZARNIECKA-SKUBINA E, WASIAK-ZYS G, et al.Effect of various cooking methods on technological and sensory quality of Atlantic salmon (Salmo salar)[J].Foods, 2019, 8(8):323.
UCHOWSKI A, CZARNIECKA-SKUBINA E, WASIAK-ZYS G, et al.Effect of various cooking methods on technological and sensory quality of Atlantic salmon (Salmo salar)[J].Foods, 2019, 8(8):323.
[8] YANG L Q, LI Z Y, XIE T X, et al.Effects of sous-vide on quality, structure and flavor characteristics of Tilapia fillets[J].Molecules, 2023, 28(24):8075.
[9] LIU L, JIAO W J, XU H, et al.Effect of rapid freezing technology on quality changes of freshwater fish during frozen storage[J].LWT, 2023, 189:115520.
[10] PONGSETKUL J, YONGSAWATDIGUL J, BOONANUNTANASARN S, et al.Development of flavor and taste components of sous-vide-cooked Nile Tilapia (Oreochromis niloticus) fillet as affected by various conditions[J].Foods, 2022, 11(22):3681.
[11] 李锐. 不同热加工方式对罗非鱼片品质变化影响作用研究[D].烟台:烟台大学, 2021.LI R.Study on the effects of different thermal processing methods influence on the quality changes of Tilapia fillets[D].Yantai:Yantai University, 2021.
[12] SUN Q X, SUN F D, XIA X F, et al.The comparison of ultrasound-assisted immersion freezing, air freezing and immersion freezing on the muscle quality and physicochemical properties of common carp (Cyprinus carpio) during freezing storage[J].Ultrasonics Sonochemistry, 2019, 51:281-291.
[13] 李学鹏, 周明言, 周凯, 等.大黄鱼冻藏过程中肌原纤维蛋白氧化及其功能性质的变化[J].中国食品学报, 2018, 18(7):171-179.LI X P, ZHOU M Y, ZHOU K, et al.Changes of myofibrillar protein oxidation and functional properties in large yellow croaker (Pseudosciaena crocea) during frozen storage[J].Journal of Chinese Institute of Food Science and Technology, 2018, 18(7):171-179.
[14] ZHANG X D, ZHANG Y Q, DONG Y, et al.Study on the mechanism of protein hydrolysate delaying quality deterioration of frozen surimi[J].LWT, 2022, 167:113767.
[15] 吴佳. DHPM处理和Salecan添加量对低盐条件下肌原纤维蛋白理化特性和结构的影响[D].重庆:西南大学, 2021.WU J.Effects of DHPM treatment and Salecan addition on the physical and chemical properties and structure of myofibrils protein under low-salt condition[D].Chongqing:Southwest University, 2021.
[16] DU X, LI H J, DONG C H, et al.Effect of ice structuring protein on the microstructure and myofibrillar protein structure of mirror carp (Cyprinus carpio L.) induced by freeze-thaw processes[J].LWT, 2021, 139:110570.
[17] JIN D L, WEI J L, HE F Y, et al.Effect of tea polyphenols on sturgeon myofibrillar protein structure in the in vitro anti-glycation model mediated by low temperature vacuum heating[J].Food Chemistry, 2023, 407:135133.
[18] MALIK I A, ELGASIM E A, ADIAMO O Q, et al.Effect of frozen storage on the biochemical composition of five commercial freshwater fish species from River Nile, Sudan[J].Food Science &Nutrition, 2021, 9(7):3758-3767.
[19] 马新悦, 韩悦, 邓尚贵, 等.小黄鱼低温贮藏过程中内源性蛋白酶活性及其水分变化[J].食品与发酵工业, 2023, 49(9):252-258.MA X Y, HAN Y, DENG S G, et al.Changes of endogenous protease activity and water content in Larimichthys polyactis during low temperature storage[J].Food and Fermentation Industries, 2023, 49(9):252-258.
[20] 杨东松. 真空低温烹饪技术在烹饪中的应用进展[J].食品工程, 2021(1):1-4;10.YANG D S.Study on the application status of sous-vide cooking in cooking[J].Food Engineering, 2021(1):1-4;10.
[21] 张泽伟, 吉宏武, 段伟文, 等.两种灭菌方式对熟制小龙虾冷藏期间品质的影响[J].广东海洋大学学报, 2019, 39(6):93-100.ZHANG Z W, JI H W, DUAN W W, et al.Effect of two sterilization treatment on the quality of cooked crayfish (Procambarus clarkii)product during refrigerated storage[J].Journal of Guangdong Ocean University, 2019, 39(6):93-100.
[22] 司徒慧媛, 李玉梅, 高加龙, 等.模拟冷链流通中温度波动对养殖金鲳鱼鱼肉品质及微生物多样性的影响[J].食品科学技术学报, 2022, 40(5):148-159.SITU H Y, LI Y M, GAO J L, et al.Effect of temperature fluctuation during simulated cold chain circulation on meat quality and microbial diversity of cultured Trachinotus ovatus[J].Journal of Food Science and Technology, 2022, 40(5):148-159.
[23] ABDELNABY T, FENG T Y, ZHANG T T, et al.Impact of frozen storage on physicochemical parameters and quality changes in cooked crayfish[J].Heliyon, 2024, 10(11):e31649.
[24] ZHOU J Q, SUN Q X, WEI S, et al.Changes in microstructure, quality and water distribution of golden pompano (Trachinotus ovatus) muscles subjected to magnetic field-assisted immersion freezing during long-term frozen storage[J].Journal of Food Engineering, 2023, 354:111566.
[25] CROPOTOVA J, MOZURAITYTE R, STANDAL I B, et al.The influence of cooking parameters and chilled storage time on quality of sous-vide atlantic mackerel (Scomber scombrus)[J].Journal of Aquatic Food Product Technology.2019, 28(5):505-518.
[26] CHANG Y S, CHEN J W, WU Y H S, et al.A possible systematic culinary approach for spent duck meat:Sous-vide cuisine and its optimal cooking condition[J].Poultry Science, 2023, 102(6):102636.
[27] WU D, CAO Y, YIN T, et al.Inhibitive effect of trehalose and sodium pyrophosphate on oxidation and structural changes of myofibrillar proteins in silver carp surimi during frozen storage[J].Food Research International, 2024, 187:114361.
[28] 季文娜. 基围虾冻藏过程中品质变化规律及黑变影响因素的研究[D].无锡:江南大学, 2021.JI W N.The changes of quality and the influencing factors of melanosis during frozen storage of shrimp (Metapenaeus ensis)[D].Wuxi:Jiangnan University, 2021.
[29] LI F F, DU X, REN Y M, et al.Impact of ice structuring protein on myofibrillar protein aggregation behaviour and structural property of quick-frozen patty during frozen storage[J].International Journal of Biological Macromolecules, 2021, 178:136-142.
[30] CHEN X Q, LIU H Y, LI X X, et al.Effect of ultrasonic-assisted immersion freezing and quick-freezing on quality of sea bass during frozen storage[J].LWT, 2022, 154:112737.