细菌素是某些细菌分泌的一类具有抑菌活性的多肽或前体多肽物质[1]。因其高效、安全、无毒,易被人体消化无耐药性等优点,已成为开发生物保鲜剂的热点[2-4]。目前已被发现的细菌素有数百余种,但已商业化的仅有乳酸链球菌素(Nisin)和片球菌素Pediocin PA-1,其余仅限于实验研究,究其原因主要是由于细菌素产物合成量过低,提取复杂、生产成本高等因素导致其无法被大规模生产及应用[5-6]。
诱变育种是提高菌种产量的重要手段。理化诱变往往具有操作简单、诱变效率高等优点。陈瑞龙等[7]对植物乳杆菌JL-A65分别采用ARTP和甲基硝基亚硝基胍(methyl nitrate nitrosoguanidine,MNNG)诱变得到突变株A8-110和M2-58,细菌素产量分别提高了48.9%和46.6%。王芳[8]通过紫外线(ultraviolet,UV)、亚硝基胍(nitrosoguamidine,NTG)、60Coγ射线及常压室温等离子体(atmospheric room temperature plasma,ARTP)诱变处理植物乳杆菌JLA-9,分别获得了突变株UV90-115、N4-27、60Coγ600-67、ARTP10-61,相对原始菌株其抑菌效价分别提高了35.64%、38.79%、37.30%、48.06%。洪伟等[9]采用紫外-常压室温等离子体-亚硝基胍对植物乳杆菌复合诱变获得突变株并经发酵条件优化后抑菌性能比初始出发菌株提高50%以上。何艳艳等[10]利用亚硝基胍对嗜热链球菌IMAU80846诱变处理得到一株可代谢半乳糖的突变株。NYABAKO等[11]对嗜酸乳杆菌通过大气和ARTP处理,获得突变菌株LAartp-ale2乳酸产量及耐受性得到提高。刘晨等[12]对植物乳杆菌(Lactobacillus plantarum)LY-78通过亚硝基胍-紫外复合诱变结合双层平板拮抗法和牛津杯琼脂扩散法筛选获得变异株UN-30,苯乳酸提高2.89倍。可见,传统理化诱变方法可有效提高菌株代谢物的产量,且具有操作简单、诱变效率高等优点。
课题组此前从新鲜牛粪中分离鉴定出L.plantarum C010,在液体发酵工艺优化及外源添加诱导调控作用提高细菌素产量研究基础上,通过分离纯化鉴定出细菌素Plantarum C010[13-15]。本研究进一步采用紫外线、亚硝酸、吖啶橙、激光等诱种方式,进一步对菌株进行改造,以期了解紫外线等育种方式对该菌株诱变的基本规律和筛选高产菌株,为其进一步生产应用研究提供理论基础和实验材料。
1 材料与方法
1.1 菌株与试剂
试验菌株:L.plantarum C010由课题组从新鲜牛粪中自行分离鉴定保存[13]。
指示菌:嗜水气单胞菌PS1(Aeromonas hydrophila PS1)为冷却猪肉优势致腐菌,此前鉴定为韩国假单胞菌PS1(Pseudomonas koreensis PS1)[16],后经全基因组测序分析重新鉴定为该菌株。
液体发酵培养基:优化MRS培养基[14]。
1.2 仪器与设备
1260型高效液相色谱仪,美国安捷伦科技有限公司;Nimma-200型激光器,北京镭宝光电技术有限公司;LDZX-50KBS型高压灭菌锅,上海申安医疗器械厂;SpectraMax 190型多功能酶标仪,美国Molecular Devices公司;SPX-500型生化培养箱,杭州硕联仪器有限公司;SW-CJ-2D型超净工作台,苏州净化设备有限公司。
1.3 实验方法
1.3.1 菌种活化和菌悬液的准备
将甘油管中保存菌株C010划线接种至MRS固体培养基中,37 ℃培养24~48 h,取单菌落接入MRS液体培养基37 ℃静置培养至生长指数期并离心(8 000 r/min,5 min),收集菌体用无菌生理盐水洗涤离心2次,重悬得菌悬液(108 CFU/mL)。
1.3.2 诱变处理
1.3.2.1 紫外诱变处理
参考陈亚兰等[17]的方法,取5 mL上述菌悬液于无菌培养皿中,在低速磁力搅拌下进行0~9 min的紫外诱变,所得菌液适当稀释涂布MRS平板,37 ℃避光培养24~48 h进行单菌落筛选并统计致死率和正突变率。
1.3.2.2 亚硝酸诱变处理
参考刘阳等[18]的方法,选用0~0.14 mol/L亚硝酸对上述菌液进行诱变处理稀释培养进行单菌落筛选并统计致死率和正突变率。
1.3.2.3 吖啶橙诱变处理
参考莫红丽[19]的方法,将紫外线或亚硝酸诱变所得优势突变株制成菌悬液,取适当稀释倍数菌悬液0.2 mL涂布在分别加有0~35 mol/L吖啶橙的MRS固体平板中,进行单菌落筛选并统计致死率和正突变率。
1.3.2.4 激光诱变处理
参考孙莹等[20]的方法略作改变,采用100 mJ激光能量对上述诱变所获优势突变株菌悬液分别照射0~50 min稀释培养进行单菌落筛选并统计致死率和正突变率。
1.3.2.5 致死率和正突变率的测定
按洪伟等[9]的方法统计致死率和正突变率,其中正突变菌落定义为抑菌圈直径大于出发菌株抑菌圈直径的10%,计算如公式(1)、公式(2)所示:
致死率![]()
(1)
正突变率![]()
(2)
1.3.3 高产突变株的筛选
初筛:在各次诱变处理条件下,随机挑选共约500个单菌落保存至试管斜面并进行摇瓶培养,取上清液采用双层琼脂牛津杯扩散法测定其对特定优势致腐菌A.hydrophila PS1的抑菌活性[21],采用十字交叉法测定抑菌圈直径,每个菌液重复3次,取平均值,以该抑菌圈直径初筛抑菌能力较强的突变株。
复筛:将初筛突变株进行液体摇瓶发酵,每个菌株做2个重复,取上清液按1∶1加入乙酸乙酯萃取,将有机相浓缩后经0.22 μm有机滤膜过滤,收集滤液(参考PENG等[22]的方法略作改变)采用反向高效液相色谱法(RF-HPLC)测定细菌素含量,检测条件为:C18柱(ZORBX Eclipse Plus C18, 4.6 mm 250 mm,5 μm, Agilent, 美国),流动相A含有85%的水和15%的水乙腈(含0.07%三氟乙酸),梯度:100% A在35 min内,流速为1 mL/min,进样量0.5 mL,检测波长为 215 nm。
测样前将课题组纯化鉴定的细菌素样品采用二倍稀释法制成标准液浓度分别为3.000、1.500、0.750、0.375、0.187 5、0.093 8 mg/mL在RF-HPLC条件下测得色谱峰面积,并得到回归方程为y=5 753.6x+514.06,R2=0.995 2,以此进行各菌株发酵液细菌素含量的计算。
1.3.4 突变株遗传稳定性分析
将复筛所得突变株与初始出发菌株接种至培养基培养至对数生长期,将种子接种于液体培养基,37 ℃静止连续培养10代,每隔1代测定培养液中细菌素含量,分析其遗传稳定性。
1.3.5 动力学模型的构建
前期实验结果表明,突变株JG-2较原始菌株C010对细菌素产量有显著提升,由于细菌素合成和菌体生长存在密切联系,故进一步对菌体液体发酵过程中菌体生长、细菌素合成以及总糖消耗的实验数据进行拟合,分别构建菌体生长、细菌素合成及总糖消耗模型以探讨分析它们的差异。
1.3.5.1 生长动力学模型
Logistic模型是一条典型的“S”型曲线,且能较好地表征分批液体发酵过程中的活菌数变化[23],前期研究表明L.plantarum C010生长曲线为S型,从前期固定时间点产物含量测定结果来看,突变株的生长亦未发生显著变化,故本试验采用Logistic模型模拟菌体的生长情况,通过对公式(3)积分可以得到菌体生长与时间的关系如公式(4)所示:
(3)
(4)
式中:X为活菌体浓度;X0为初始活菌体浓度;μm为最大比生长速率,h-1;Xm为最大菌体浓度。
1.3.5.2 细菌素合成动力学模型
在分批发酵过程中,细菌素合成与菌体生长的关系分为3种模式,即:生长耦合型、非生长耦合型及部分生长耦合型。细菌素于对数生长期合成,但与自身生长并非完全同步,存在一定滞后性,说明细菌的生长一定程度上能够影响细菌素合成,符合部分生长偶联型,因此选择Leudeking-piret方程来探究描述细菌素的合成,如公式(5)所示:
(5)
式中:P为产物浓度; α为与菌体生长相关的产物合成系数;β为与菌体量相关的产物合成系数。把公式(3)代入公式(5)中,经积分可以得到细菌素生成与时间的公式 (6):
![]()
(6)
式中:P为产物浓度;P0为初始产物浓度;α为与菌体生长相关的产物合成系数;β为与菌体量相关的产物合成系数。
1.3.5.6 总糖消耗动力学模型
碳源为细胞生长和代谢产物累积提供重要的能量,在液体发酵过程中,对碳源的利用分为3部分,即:用于菌体生长、细菌素合成、维持细胞生命。因此,试验中MRS培养基所含总糖的消耗情况可以用改良的Leudeking-piret方程(7)来表征培养基中总糖的消耗情况。将公式(3)代入公式(7)后积分,得到总糖浓度与时间的关系函数公式(8):
(7)
![]()
(8)
式中:S为总糖质量浓度,mg/mL;S0为初始总糖质量浓度,mg/mL;m为生长偶联的底物消耗速率;n诶非生长偶联的底物消耗速率;Ke为细胞维持系数;Yx为菌体生长得率系数;Yp为产物生成得率系数。
2 结果与分析
2.1 最佳诱变剂量的确定
课题组前期研究表明,L.plantarum C010的生长呈S形曲线,该菌株培养2 h后进入对数生长期,发酵至第12 h时,菌体浓度达到最大并趋于稳定,同时细菌素含量随时间逐步增加,至20 h时抑菌活性效果最佳[15]。因此后续试验将菌种细胞培养6~8 h进行诱变处理,并选择培养20 h菌液进行抑菌活性测定。如图1所示。
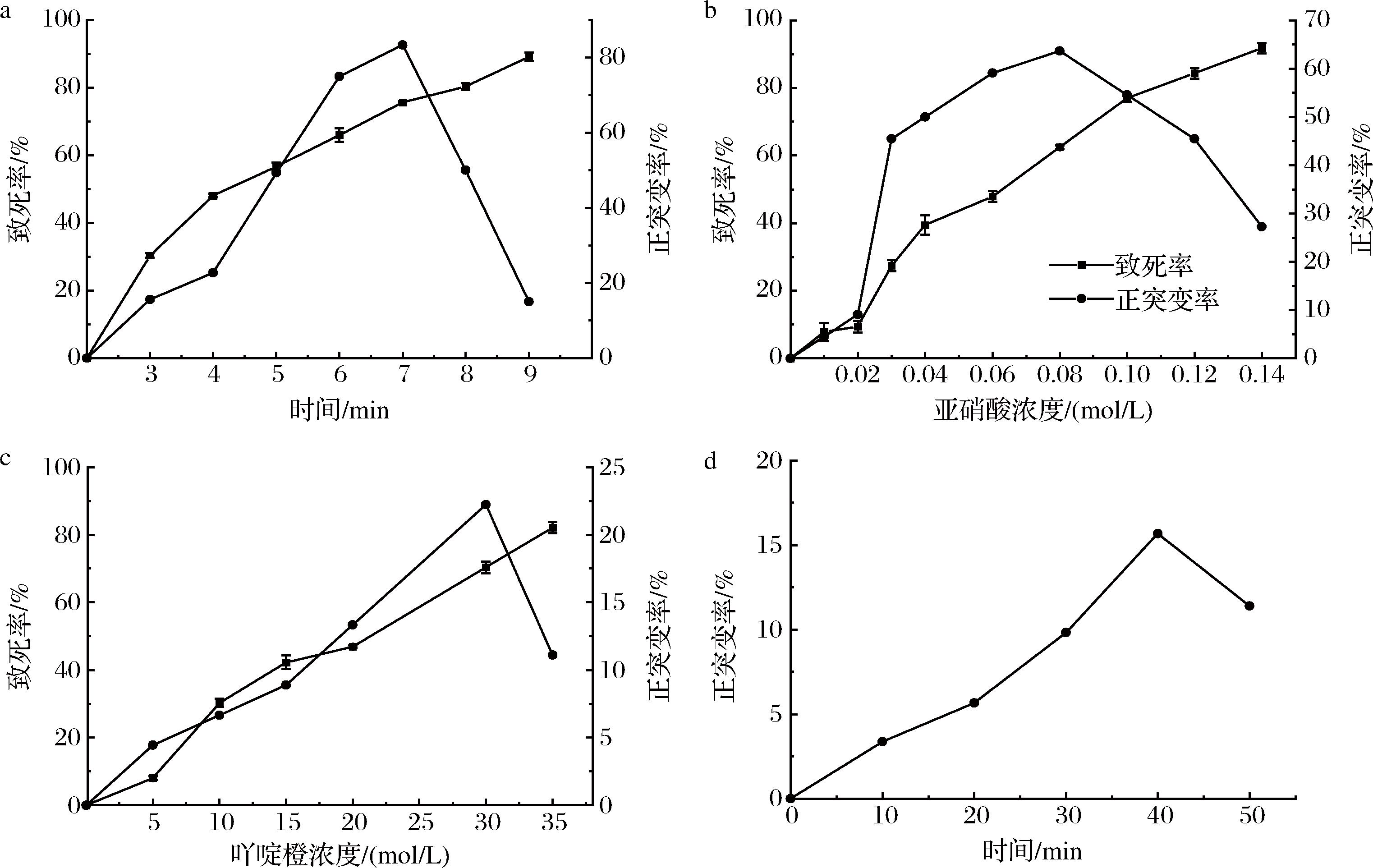
a-紫外诱变;b-亚硝酸诱变;c-吖啶橙诱变;d-激光诱变
图1 不同诱变处理致死率和正突变率随时间/浓度的变化
Fig.1 Changes of lethal rate and positive mutation rate with time/concentration in different mutation treatments
据报道[24],一般诱变致死率为60%~80%时,容易筛选到变异幅度较大的突变株。由图1-a可知,随着紫外线照射时间的延长,致死率逐渐升高,在7 min时,致死率达到75.63%,此时正突变率最高达83.33%;图1-b表明,当亚硝酸0.08 mol/L时,致死率达到62.47%,此时正突变率最高达63.64%。因此本试验确定最佳紫外照射时间为7 min,亚硝酸最佳诱变浓度为0.08 mol/L。
将亚硝酸诱变所获得的优势突变株ysx9-13,进一步采用吖啶橙处理所得突变株I9进行激光照射处理,如图1-c所示,在吖啶橙30 μg/L时,致死率达到70.37%,此时正突变率最高达22.22%。在100 mJ激光能量诱变不同时间下未见菌株致死,但照射时间对菌株正突变率存在明显影响,在激光能量为100 mJ照射40 min时,正突变率最高可达15.67%,因此本试验确定激光能量100 mJ照射40 min为最佳剂量。
由图1可知,致死率随各处理时间延长或浓度的增加逐渐升高,在较高剂量下(紫外照射7 min或0.08 mol/L亚硝酸或30 μg/L吖啶橙)会破坏细胞内的核酸、蛋白质等重要生物大分子的结构,导致发生正突变的菌体过高死亡,该结果与GAO等[25]对诱变致死率和正突变率的报道一致。
2.2 高产突变株筛选结果
试验从每种诱变处理的MRS固体平板中随机挑取约500个单菌落,进行液体培养后采过管碟法测定各菌20 h发酵上清液的抑菌活性,初步筛选得到对指示菌A.hydrophila PS1抑菌圈较大的菌株50个,进一步采用HPLC测定细菌素含量进行复筛。由表1可知,出发菌株L.plantarum C010(CK)经紫外线诱变和亚硝酸诱变处理后,复筛所得多个菌株细菌素含量比出发菌株(CK)分别有不同程度的提升,其中亚硝酸诱变所得突变株yxs9-13效果最佳,相较于出发菌株(CK)提高了25.73%。以此选取突变株yxs9-13进行吖啶橙处理,获得细菌素产量有所提升的突变株I9再次激光诱变处理,最后筛选所得突变株JG-2细菌素含量高达17.79 mg/mL,较原始菌株C010提高了85.31%。综上所述,不同诱变均能一定程度提高植物乳杆菌C010细菌素产量,且激光诱变所得突变株JG-2效果最佳。
表1 不同诱变处理筛得突变株细菌素测定结果
Table 1 Determination result of bacteriocin of mutant strains obtained by different mutagenesis
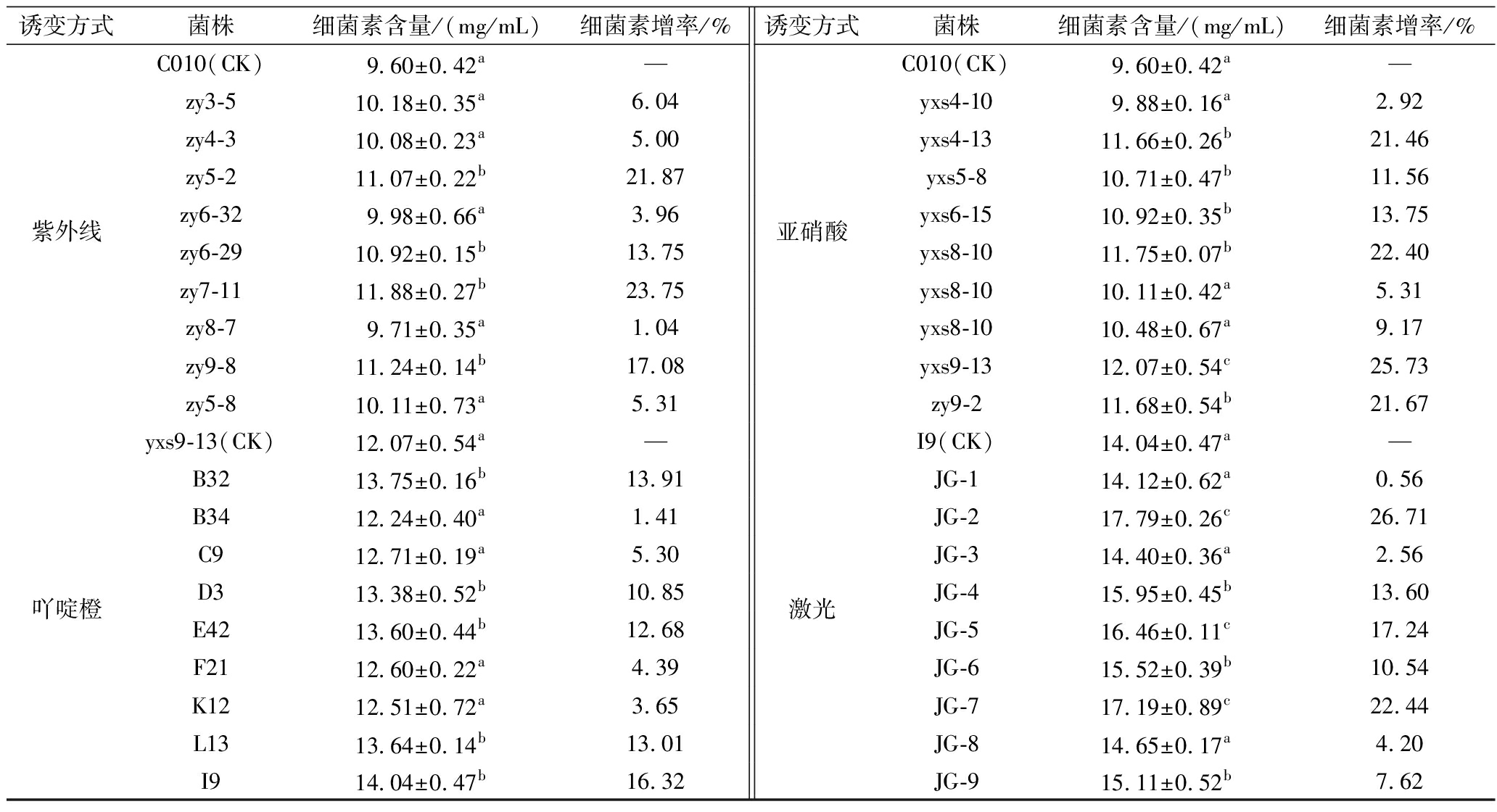
诱变方式菌株细菌素含量/(mg/mL)细菌素增率/%诱变方式菌株细菌素含量/(mg/mL)细菌素增率/%C010(CK)9.60±0.42a—C010(CK)9.60±0.42a—zy3-510.18±0.35a6.04yxs4-109.88±0.16a2.92zy4-310.08±0.23a5.00yxs4-1311.66±0.26b21.46zy5-211.07±0.22b21.87yxs5-810.71±0.47b11.56紫外线zy6-329.98±0.66a3.96亚硝酸yxs6-1510.92±0.35b13.75zy6-2910.92±0.15b13.75yxs8-1011.75±0.07b22.40zy7-1111.88±0.27b23.75yxs8-1010.11±0.42a5.31zy8-79.71±0.35a1.04yxs8-1010.48±0.67a9.17zy9-811.24±0.14b17.08yxs9-1312.07±0.54c25.73zy5-810.11±0.73a5.31zy9-211.68±0.54b21.67yxs9-13(CK)12.07±0.54a—I9(CK)14.04±0.47a—B3213.75±0.16b13.91JG-114.12±0.62a0.56B3412.24±0.40a1.41JG-217.79±0.26c26.71C912.71±0.19a5.30JG-314.40±0.36a2.56吖啶橙D313.38±0.52b10.85激光JG-415.95±0.45b13.60E4213.60±0.44b12.68JG-516.46±0.11c17.24F2112.60±0.22a4.39JG-615.52±0.39b10.54K1212.51±0.72a3.65JG-717.19±0.89c22.44L1313.64±0.14b13.01JG-814.65±0.17a4.20I914.04±0.47b16.32JG-915.11±0.52b7.62
注:以4种诱变处理所用菌株(CK)为对照进行两样本t检验时P<0.01,差异极显著用c表示;P<0.05,差异显著用b表示,差异不显著用a表示(下同);“—”表示无数据。
2.3 突变株JG-2的遗传稳定性分析
菌株在传代培养过程中易引发衰退导致产量下降。试验对菌株C010和JG-2分别进行10次传代分析其产细菌素的稳定性。表2结果显示,原始菌株C010和突变株JG-2的F0~F10代各产细菌素均无显著性差异,表明该菌株所产细菌素较为稳定,有利于工业化生产。
表2 传代次数对菌株所产细菌素稳定性的影响
Table 2 The effect of passage number on the stability of bacteriocin produced by strains

菌株细菌素含量/(mg/L)F0F2F4F6F8F10C0109.33±0.46a10.15±0.04b9.81±0.07a9.70±0.24a9.86±0.82a9.44±0.16aJG-217.23±0.23a17.89±0.69a17.33±0.06a17.03±0.52a17.13±0.25a17.62±0.36a
2.4 菌株液体发酵动力学分析
液体发酵动力学分析是研究环境因素与微生物生长代谢活动之间的相互作用随时间动态变化规律的科学,液体发酵动力学模型的建立有助于更加深入地认识和掌握微生物的发酵过程,为其工业发酵的模拟、优化和过程控制奠定理论基础。
2.4.1 动力学参数评估
根据1.3.5节中公式(4)、公式(6)、公式(8)能够分别评估求解发酵动力学三大模型,经非线性拟合可以得到各参数值及相关系数R2,具体参数值如表3所示。L.plantarum C010分批发酵后,经非线性拟合,可以得出菌株C010和JG-2生长速率分别为0.760 4 h-1、0.694 9 h-1,同时预测初始菌液吸光度和最大吸光度分别为 0.020 8、0.027 4和1.496 3、1.452 5,这与实际发酵无显著性差异,可见原始菌株C010和突变株JG-2比较生长动力学参数无显著差异。经Leudeking-piret方程拟合后,菌株C010和JG-2所得α和β均不为0,可见细菌素与菌体的生长呈部分生长偶联型关系。此外,在总糖消耗模型中,突变株JG-2菌体对总糖得率接近于零,说明突变株菌体生长受总糖消耗影响远小于原始菌株,C010和JG-2所得拟合值Yp/s分别为1.471 5、1.755 8,该结果显示突变株JG-2细菌素产量有显著提升。而预测所得初始总糖含量(S0)仅为18.65 g/L和18.50 g/L,相较于初始添加葡萄糖(20 g/L)含量有所下降,可能原因是在灭菌过程中葡萄糖发生反应进而产生了损失。
表3 菌株液体发酵动力学模型参数
Fig.3 Parameters of liquid fermentation kinetic models of strains
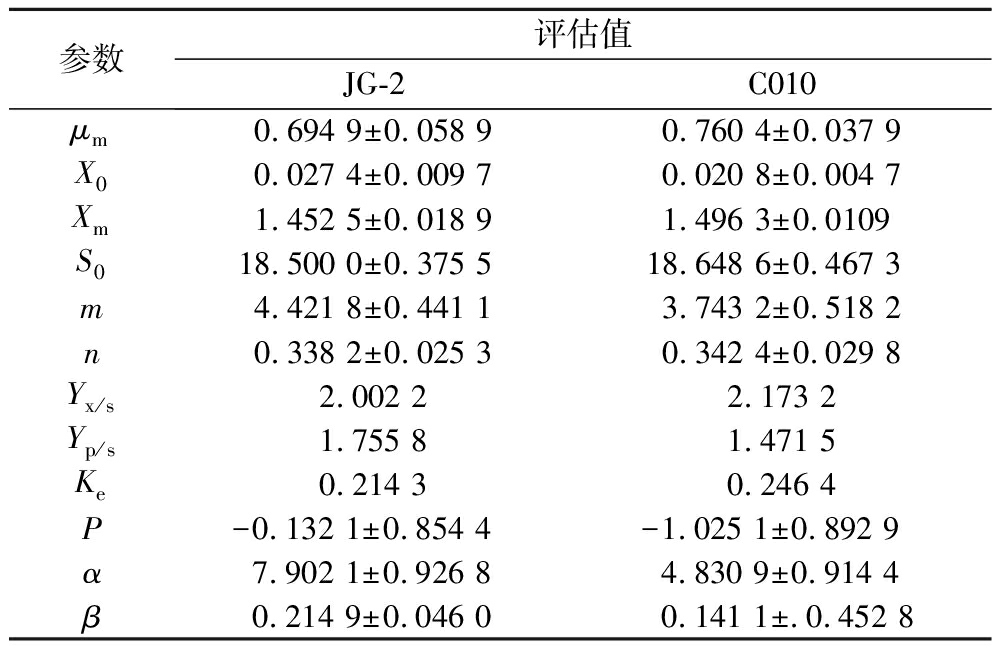
参数评估值JG-2C010μm0.694 9±0.058 90.760 4±0.037 9X00.027 4±0.009 70.020 8±0.004 7Xm1.452 5±0.018 91.496 3±0.0109S018.500 0±0.375 518.648 6±0.467 3m4.421 8±0.441 13.743 2±0.518 2n0.338 2±0.025 30.342 4±0.029 8Yx/s2.002 22.173 2Yp/s1.755 81.471 5Ke0.214 30.246 4P-0.132 1±0.854 4 -1.025 1±0.892 9 α7.902 1±0.926 84.830 9±0.914 4β0.214 9±0.046 00.141 1±.0.452 8
2.4.2 动力学非线性拟合模型方程求解
将2.4.1节中的参数评估值带入公式(4)、公式(6)、公式(8)中,可以求解得到原始菌株C010和突变株JG-2的生长动力学模型[公式(9)]、还原糖消耗动力学模型[公式(10)]、细菌素合成动力学模型[公式(11)]的模型方程如下所示:
(9)
0.673 7×ln(0.986+0.013 9e0.760 38t),
0.706 9×ln(0.981+0.018 8e0.694 9t)
(10)
![]()
0.277 7×ln(0.986+0.013 9e0.760 38t),
0.580 2×ln(0.981+0.018 8e0.694 9t)
(11)
经动力学方程非线性拟合可以得到菌株C010和JG-2分批液体发酵三大动力学模型如图2-a, 图2-b, 图2-c所示,其菌体生长、总糖消耗及细菌素合成动力学模型相关系数R2分别为0.996 0、0.987 9,0.976 4、0.985 6和0.891 7、0.956 4,说明实验值与模型拟合较好,这为细菌素后续液体发酵工艺优化以及进一步工业生产提供技术支持与理论指导。
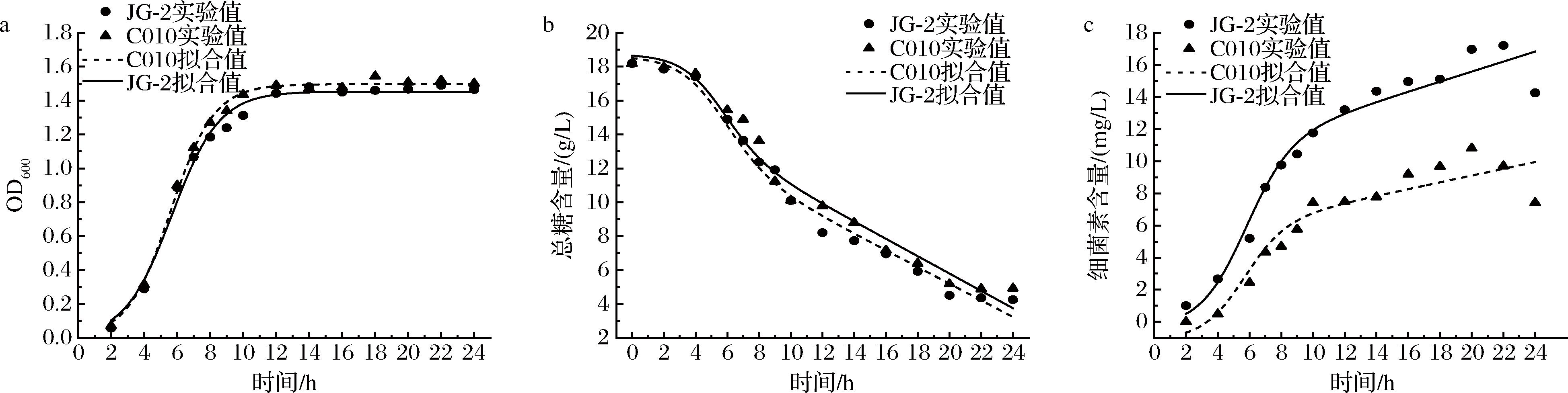
a-菌体生长;b-总糖消耗;c-细菌素合成
图2 菌株C010和JG-2在分批液体发酵过程中的菌体生长,总糖消耗,细菌素合成动力学拟合模型
Fig.2 Kinetic fitting model for cell growth, total sugar consumption and bacteriocin synthesis of the strains C010 and JG-2 during batch liquid fermentation
3 结论
本研究分别采用了紫外线、亚硝酸、吖啶橙、激光4种方式对试验菌株进行处理,采用双层平板拮抗抑菌圈法初筛结合反向高效液相色谱法定量检测细菌素含量复筛高产突变株。最终经亚硝酸、吖啶橙和激光诱变后获得高产突变株JG-2,其细菌素产量与原始菌株C010相比提高了85.31%。进一步对原始菌株C010和高产突变株JG-2液体发酵规律进行研究,建立了菌体生长、总糖消耗、细菌素合成动力学模型,摸索了其菌体生长与代谢的基本规律。该结果为后续工艺改进、细菌素累积及其工业化生产提供数据基础和研究思路。
[1] CASCALE S E, BUCHANAN S K, DUCHE D, et al.Colicin biology[J].Microbiology and Molecular Biology Reviews, 2007, 71(1):158-229.
[2] REUBEN R C, TORRES C.Bacteriocins:Potentials and prospects in health and agrifood systems[J].Archives of Microbiology, 2024, 206(5):233.
[3] CIRAT R, CAPOZZI V, BENMECHERNENE Z, et al.LAB antagonistic activities and their significance in food biotechnology:molecular mechanisms food targets and other related traits of interest[J].Fermentation, 2024, 10(4):222.
[4] BUKVICKI D, D′ALESSANDRO M, ROSSI S, et al.Essential oils and their combination with lactic acid bacteria and bacteriocins to improve the safety and shelf life of foods:A review[J].Foods, 2023, 12(17):3288.
[5] SIDOOSKI T,BRANDELLI A, BERTOLI S L, et al.Physical and nutritional conditions for optimized production of bacteriocins by lactic acid bacteria:A review[J].Critical Reviews in Food Science and Nutrition, 2019, 59(17):2839-2849.
[6] 顾雅昕, 乔柱, 郭行, 等.发酵乳杆菌LBM97所产细菌素提取方法的优化及比较[J].食品与发酵工业, 2020, 46(19):111-116.GU Y X, QIAO Z, GUO X, et al.Optimization and comparison of extraction methods of bacteriocin produced by Lactobacillus fermentum LBM97[J].Food and Fermentation Industries, 2020, 46(19):111-116.
[7] 陈瑞龙, 庄莹, 贺彬彬, 等.植物乳杆菌细菌素高产菌株的诱变选育及其对肉丸的防腐保鲜作用[J].食品工业科技, 2018, 39(22):121-127.CHEN R L, ZHUANG Y, HE B B, et al.Screeging of high-yield plantaricin producing stains induced by mutations and the fresh-keeping effect of plantaricin on the preservation of meatballs[J].Science and Technology of Food Industry, 2018, 39(22):121-127.
[8] 王芳. 植物乳杆菌高产细菌素菌株诱变选育及其应用研究[D].南京:南京农业大学, 2017.WANG F.Mutation breeding and application of with high bacteriocin production Lactobacillus plantarum strain[D].Nanjing:Nanjing Agricultural University, 2017.
[9] 洪伟, 李鑫, 孙浩浩, 等.诱变选育高抑菌活性植物乳杆菌及发酵条件优化[J].池州学院学报, 2023, 37(6):45-50.HONG W, LI X, SUN H H, et al.Selecting Lactobacillus plantarum for high antibacterial actitvity by mutagenesis and optimization of fermentation conditions[J].Journal of Chizhou University, 2023, 37(6):45-50.
[10] 何艳艳, 邰佳慧, 卢纹慧, 等.可代谢半乳糖嗜热链球菌的诱变选育及其在发酵乳生产中的应用[J].微生物学报, 2024, 64(5):1436-1454.HE Y Y, TAI J H, LU W H, et al.Streptococcus thermophilus capable of metabolizing galactose:Mutagenesis and application in production of fermented milk[J].Acta Microbiologica Sinica, 2024, 64(5):1436-1454.
[11] NYABAKO B A, FANG H, CUI F J, et al.Enhanced acid tolerance in Lactobacillus acidophilus by atmospheric and room temperature plasma (ARTP) coupled with adaptive laboratory evolution (ALE)[J].Applied Biochemistry and Biotechnology, 2020, 191(4):1499-1514.
[12] 刘晨, 张丽萍.亚硝基胍-紫外复合诱变筛选高产苯乳酸菌株[J].中国食品学报, 2015, 15(9):41-46.LIU C, ZHANG L P.Breeding of a high phenyllactic acid strain by composite mutation with UV and NTG[J].Journal of Chinese Institute of Food Science and Technology, 2015, 15(9):41-46.
[13] DAI J Y, FANG L M, ZHANG M M, et al.Isolation and identification of new source of bacteriocin-producing Lactobacillus plantarum C010 and growth kinetics of its batch fermentation[J].World Journal of Microbiology and Biotechnology, 2022, 38(4):67.
[14] 方利敏. 产细菌素乳酸菌的筛选鉴定及其细菌素合成的培养优化及诱导作用研究[D].南昌:江西农业大学, 2021.FANG L M.Screening and identification of bacteriocin-producing lactic acid bacteria and study on their culture optimization and induction of bacteriocin synthesis[D].Nanchang:Jiangxi Agricultural University, 2021.
[15] 张漫敏, 曾祥益, 方利敏, 等.植物乳杆菌C010产细菌素的分离纯化及理化稳定性分析[J].食品与发酵工业, 2023, 49(3):31-37.ZHANG M M, ZENG X Y, FANG L M, et al.Purification and physicochemical stability analysis of bacteriocin produced by Lactobacillus plantarum C010[J].Food and Fermentation Industries, 2023, 49(3):31-37.
[16] 黄林, 陈全胜, 张燕华, 等.冷却猪肉优势腐败菌分离鉴定及致腐能力测定[J].食品科学, 2013, 34(1):205-209.HUANG L, CHEN Q S, ZHANG Y H, et al.Isolation, identification and spoilage capability of dominant spoilage bacteria in chilled pork[J].Food Science, 2013, 34(1):205-209.
[17] 陈亚兰, 陈德刚, 张冰莹, 等.泰妙菌素高产菌的紫外诱变选育[J].农业与技术, 2020, 40(18):50-52.CHEN Y L, CHEN D G, ZHANG B Y, et al.Breeding of high-yield tamuiflu strain by UV mutation[J].Agriculture and Technology, 2020, 40(18):50-52.
[18] 刘阳, 梁政武, 程嘉瑞, 等. 利用循环复合诱变的方法提高米曲霉的L-苹果酸产量[J]. 轻工科技,2016, 32(1): 13-14.LIU Y, LIANG Z W, CHENG J R, et al. Using the method of cyclic compound mutagenesis to increase the L-malic acid production of Aspergillus oryzae[J]. Light Industry Science and Technology, 2016, 32(1): 13-14.
[19] 莫红丽. 吖啶橙诱变提高蛹虫草虫草素含量的研究[J].广东蚕业, 2011, 45(2):23-26.MO H L.Study on the mutation of acridine orange to improve the content of cordycepin in pupa Cordyceps militaris.[J].Guangdong Sericulture, 2011, 45(2):23-26.
[20] 孙莹, 王海曼, 宋刚, 等.利用氦氖激光诱变提高枯草芽孢杆菌纤溶酶活力的研究[J].中国农学通报, 2020, 36(35):28-36.SUN Y, WANG H M, SONG G, et al.He-Ne laser mutagenesis increasing the fibrinolytic enzyme activity of Bacillus subtilis[J].Chinese Agricultural Science Bulletin, 2020, 36(35):28-36.
[21] SUN Q, LI C, XU X, et al.Novel application of agarose in cultivating microorganisms in the stomach and rapid drug susceptibility testing of Helicobacter pylori[J].Materials Express, 2021, 11(6):880-887.
[22] PENG J J, JIN W G, ABD EL-ATY A M, et al.Isolation, purification, and structural identification of a new bacteriocin made by Lactobacillus plantarum found in conventional kombucha[J].Food Control, 2020, 110:106923.
[23] SARI A M, BUDIANTO F A, NURSIWI A, et al.Study of Acetobacter xylinum FNCC 0001 fermentation kinetics using artificial media containing various carbon and nitrogen concentrations[J].IOP Conference Series:Earth and Environmental Science, 2021, 828(1):012004.
[24] GE S Y, ZHANG B Q.Analysis of the effect of pulsed light on the protein of Lactobacillus plantarum based on liquid mass spectrometry[J].Food Science and Biotechnology, 2023, 33(3):617-624.
[25] GAO X L, LIU E M, YIN Y Y, et al.Enhancing activities of salt-tolerant proteases secreted by Aspergillus oryzae using atmospheric and room-temperature plasma mutagenesis[J].Journal of Agricultural and Food Chemistry, 2020, 68(9):2757-2764.